Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Роботизированная тотальная гастрэктомия с сохранением блуждающего нерва для лечения мутации гена CDH1
В этой статье
Резюме
Эта статья посвящена роботизированной тотальной гастрэктомии с сохранением блуждающего нерва. Обсуждаются методы и подводные камни сохранения блуждающего нерва, сшивания эзофагоеюностомии, формирования тощего мешка, а также реконструкции по методу Ру с помощью степлерной еюноюностомии.
Аннотация
Наследственный диффузный рак желудка (HDGC), вызванный мутацией гена CDH1, является наследственным онкологическим синдромом, который увеличивает риск диффузного рака желудка и практически невозможно обнаружить с помощью скрининговой гастроскопии. Рекомендуемым профилактическим лечением является тотальная гастрэктомия. Роботизированная хирургия способствует использованию минимально инвазивных хирургических методов (MIS) для анастомозов и сохранения заднего блуждающего нерва для потенциального снижения неблагоприятных функциональных исходов. Бессимптомный 24-летний мужчина с мутацией гена CDH1, подтвержденной генетическим тестированием, и семейным анамнезом брата, перенесшего тотальную гастрэктомию по поводу HDGC, лечился с помощью этой техники. В этом видеорепортаже демонстрируются методы и подводные камни роботизированной хирургии с точки зрения позиционирования пациента и установки порта, задней диссекции с сохранением блуждающего нерва, ушитной эзофагогееностомии, формирования тощего мешка и реконструкции Roux-en-Y с помощью степлерной еюноюностомии. Хотя эти методы продемонстрированы в случае профилактической гастрэктомии, многие из них могут быть применены к другим доброкачественным и бариатрическим типам передней кишки и общей хирургии. Роботизированная хирургия может облегчить технику MIS передней кишки, как описано в этом случае тотальной гастрэктомии с сохранением блуждающего нерва.
Введение
Наследственный диффузный рак желудка (HDGC) характеризуется генетической мутацией в гене-супрессоре опухолей E-cadherin (CDH1), который имеет аутосомно-доминантный тип наследования1. Этот наследственный онкологический синдром увеличивает риск развития диффузного рака желудка и долькового рака молочной железы (LBC). В современных рекомендациях рекомендуется тестирование на мутации CDH1 у пациентов с семейными кластерами HDGC и LBC, особенно у пациентов с ранним началом (до 40 лет)2. Согласно крупнейшему сообщенному ряду носителей мутации CDH1, кумулятивная заболеваемость раком желудка в течение жизни составляет 70% (95% ДИ, 59%-80%) для мужчин и 56% (95% ДИ, 44%-69%) для женщин с этоймутацией3. Тем не менее, недавние исследования показали, что пенетрантность рака желудка с этой мутацией находится в диапазоне 37%-42% для мужчин и 25%-33% дляженщин1.
Эндоскопическое наблюдение с биопсией является рекомендуемым типом наблюдения для тех, кто решил отложить профилактическую гастрэктомию; Тем не менее, практически невозможно обнаружить ранний рак желудка в этой когорте с помощью скрининговой гастроскопии2. За обширным эндоскопическим исследованием в белом свете следует не менее 30 нецелевых биопсий желудка из пяти отдельных областей желудка. Тем не менее, этот метод наблюдения имеет высокий процент ложноотрицательных результатов и обнаруживает только 20%-63% очагов скрытых клеток кольца печати 4,5.
Профилактическая тотальная гастрэктомия (ОЩЖ) является рекомендуемым профилактическим лечением любого патогенного или вероятно патогенного носителя варианта CDH1, начиная с возраста 20 лет, но не рекомендуется после 70лет. Метастазирование в перигастральные лимфатические узлы является редким явлением у бессимптомных пациентов, у которых обычно есть Т1a или кольцевые клетки in situ. Периоперационная заболеваемость в целом низкая, а удовлетворенность пациентов высока6. Несмотря на то, что общее качество жизни после операции высокое, при тотальной гастрэктомии обычно выполняется стволовая ваготомия 7,8. Резекция блуждающего нерва выше уровня чревной и печеночной ветвей приводит к парасимпатической денервации гепатобилиарного дерева и тонкой и толстой кишки. Диарея после ваготомии и демпинг-синдром являются хорошо известными долгосрочными осложнениями после ОЩЖ8.
Роботизированная хирургия предоставляет хирургу трехмерное изображение операционного поля в 10 раз с увеличенным в 10 раз и предлагает высокую степень свободы при использовании шарнирных хирургических инструментов9. Целью преформирования этого метода является потенциальное снижение неблагоприятных функциональных исходов за счет сохранения заднего блуждающего нерва, чему способствуют минимально инвазивные хирургические методы (MIS).
протокол
Пациент предоставил информированное согласие на публикацию обезличенной информации, изображений и видеодокументации. Доцент доктор Майкл Талбот (соавтор) является хирургом верхних отделов желудочно-кишечного тракта, аккредитованным для проведения гастрэктомии в своем учреждении. Из-за незначительного риска, связанного с этим клиническим случаем и протоколом, он был освобожден от этической экспертизы в соответствии с руководящими принципами местного институционального наблюдательного совета. Заявления по этическим нормам для отчетов о случаях заболевания освобождаются от ответственности в соответствии с руководящими принципами местного институционального наблюдательного совета.
1. Позиционирование пациента
- Поместите пациента в обратное положение Тренделенбурга после проведения общей анестезии.
- Закрепите пациента в нужном положении с помощью подножной пластины, ремня для тела, расположенного выше колен, и ремней для лодыжек. Отведите (<90°) руки и наложите на них креповую повязку. Поместите кронштейн для ретрактора печени Натансона на операционный стол краниально к левой доске.
2. Размещение порта (Рисунок 1)
- Сделайте разрез кожи диаметром 12 мм по желанию хирурга в правом среднеключичном положении на уровне пупка или ниже. Выполните оптический вход с помощью лапароскопа 8 мм, 0° и порта 12 мм через этот разрез. Обратите внимание, порт камеры должен находиться на расстоянии 10-20 см от анатомии мишени.
- Замените порт на роботизированный порт 12 мм с редуктором 12-8 мм, а лапароскоп поменяйте местами на лапароскоп 8 мм, 30°. Установите пневмоперитонеумCO2 с концентрацией 15 мм рт.ст. с потоком 45 мм рт.ст.
- Сделайте еще три разреза кожи по 8 мм в транспупбильной плоскости и установите три роботизированных порта по 8 мм. Поместите один из роботизированных портов в пупок, а два других роботизированных порта латерально к нему с левой стороны. Убедитесь, что расстояние между портами составляет >8 см, а между портами и целевой анатомией — 10-20 см.
- Поместите еще один вспомогательный порт 12 мм (порт A) в правом верхнем квадранте. Вставьте ретрактор Натансона в эпигастрий через разрез 5 мм и втяните левую долю печени.
- Поместите роботизированную тележку для пациента над пациентом с правой стороны пациента, стараясь избежать столкновения с ретрактором печени. Сначала установите кронштейн камеры на док-станцию с помощью расположения порта с лазерным наведением. Выполните инцизуру, нацеленную на желудок, с помощью роботизированного прицела 8 мм, угол поворота 30°, используя порт 3.
- Пристыкуйте и отрыжьте оставшиеся отверстия робототехники к манипуляторам приборов, а затем вставьте силовой биполярный прибор 8 мм (порт 1), уплотнитель для судна (порт 2) и опрокидывающийся фенестрированный захват (горшок 4). Установите монополярную и биполярную автоматическую обрезку и принудительную коагуляцию на эффект 3 и проверьте настройку системы.
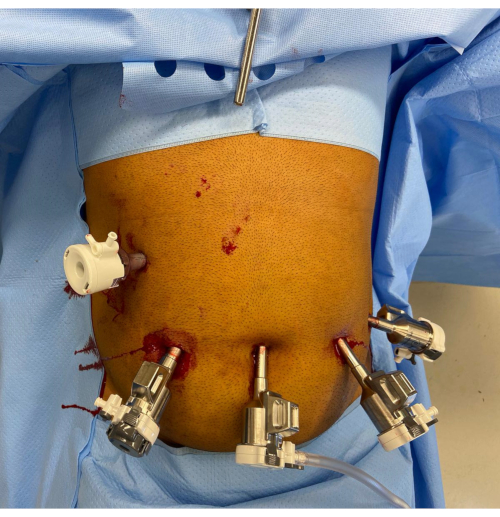
Рисунок 1: Размещение роботизированного порта. Ручка ретрактора Натансона видна в эпигастрии. В правом верхнем квадранте есть вспомогательный порт 12 мм. Остальные порты слева направо на изображении — это 12-мм роботизированный порт с редуктором, 8-мм порт камеры и два дополнительных 8-мм роботизированных порта. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Диссекция, сохраняющая вагусный нерв
- Мобилизуйте большой изгиб желудка через желудочно-кишечную связку от антрального отдела к кардии и разделите на пять-семь коротких желудочных сосудов, расположенных латерально к аркадному сосуду, чтобы включить узлы N1. Затем мобилизуйте левую сторону пищеводного отверстия диафрагмы.
- Войдите в связку пищевода и мобилизуйте левую сторону дистального отдела пищевода. Выполните дистальную диссекцию с помощью герметика для сосудов и продолжайте вплоть до мобилизации первой части двенадцатиперстной кишки. Проследите за наддуоденальным окном через pars flaccida, чтобы завершить правостороннюю мобилизацию пищевода, при этом плоскость расслоения примыкает к пищеводу.
- Пересеките первую часть двенадцатиперстной кишки с помощью роботизированного степлера с использованием зеленого перезаряда размером 60 мм x 4,3 мм с контрфорсным усилением. Разделите сосуды левого желудка вплотную к стенке желудка с помощью герметика для сосудов. Это необходимо для того, чтобы задний блуждающий нерв оставался неразделенным в брыжейке вокруг ножки левого желудка.
- Втяните пищевод и желудок в надолатеральном направлении и определите задний блуждающий нерв. Протяните нерв кзади и сохраните его.
4. Наложение швов на пищевод с помощью тощадного мешочка
- Реконструкция связок пищевода
- Выполните реконструкцию связок пищевода в непрерывном направлении против часовой стрелки из положения «5 часов» до «9 часов» с помощью нерассасывающегося шовного материала с заусеницами 2-0 на игле с коническим концом диаметром 26 мм 1/2 круга. Пересеките внутрибрюшной пищевод с помощью роботизированного степлера с помощью зеленого перезаряда размером 60 мм x 4,3 мм. Переместите отделенный живот в правый верхний квадрант.
- Пищеводный юный анастомоз
- Поднимите большой сальник краниально, чтобы определить дуоденоеюнальный изгиб, и подведите петлю тощей кишки длиной 50 см (создавая 40-60 см билиопанкреатическую конечность после формирования тощего мешка) к пищеводу.
- Шовная нить длиной 23 см 3-0 рассасывающаяся заусеница на игле 26 мм 1/2 круга с коническим коническим концом в виде 3-часовой боковой пищеводной пексии. Втяните неразрезанный шов сбоку. Создайте эзофагостомию перед скобой с помощью монополярного диатермического крючка с направляющим для назогастрального зонда 18Fr. Создайте еюностомию такого же или чуть меньшего размера, как это делается при эзофагостоме.
- Сшить заднюю стенку пищевода с помощью шва с заусеницами непрерывно, по часовой стрелке от положения «3 часа» до «9 часов», включая линию скоб. Сшить переднюю часть с помощью другого такого же шва, чтобы завершить полнослойный однослойный шов для пищеводного анастомоза. Наложите несколько медиальных швов за пределами анастомоза в качестве медиальной пексии.
- Чехол для тощей кишки
- Пересеките проксимальную петлю тощей кишки на расстоянии 10 см от анастомоза с помощью роботизированного степлера с использованием белого перезаряда размером 60 мм x 2,5 мм. Создают антиментерийные энтеростомии на 10 см проксимальнее и дистальнее пищеводно-юнального анастомоза.
- Выполните два обжига роботизированного степлера, используя белые перезарядки размером 60 мм x 2,5 мм, чтобы создать подсумок для тощей кишки. Убедитесь, что второй обжиг не проходит весь путь до встречи с пищеводным анастомозом, чтобы сохранить кровоснабжение анастомозов. Закройте энтеротомию тощей кишки непрерывно с помощью рассасывающегося шва с заусеницами 3-0.
5. Сшиваемая еюноеюностомия
- Измерьте пищевую конечность длиной 70 см и наложите шелковый прерывистый шов 2-0 в этой точке и дистальный отдел билиопанкреатической конечности для маркировки и втягивания.
- Формируйте еюноеюностомию с использованием только скобной техники, как описано в технике тройного сшивания для лапароскопического шунтирования желудка10,11. Используйте белую перезарядку размером 60 мм x 2,5 мм, чтобы сформировать анастомоз и закрыть энтеротомию.
- Закройте как тощие, так и ретро-Ру брыжеечные дефекты с помощью нерассасывающихся швов с заусеницами 2-0, чтобы снизить риск осложнений из-за внутренней грыжи.
6. Отбор и укупорка образцов
- Снимите приборы, втягивающее устройство Натансона и порты в режиме роботизированного обзора. Отстыкуйте роботизированную тележку пациента от пациента.
- Создать мини-лапаротомию 5 см через расширение пупочного порта. Подайте образец через небольшой защитный ограничитель для раны с уплотнительным кольцом. Закройте лапаротомию обычным способом, используя мышечные щадящие швы с непрерывным закрытием фасции и соотношением швов к длине раны 1:4.
Результаты
Общее время операции составило 2 часа 50 минут, и у пациента было ничем не примечательное послеоперационное течение. Пациент был переведен на бесплатную водную диету в 1-й день после операции и выписан из больницы на 4-й день. Через 1 месяц и 3 месяца наблюдения пациент чув...
Обсуждение
Был выбран бессимптомный 24-летний мужчина с мутацией гена CDH1, подтвержденной генетическим тестированием и семейным анамнезом брата, перенесшего тотальную гастрэктомию по поводу HDGC. Предоперационная эндоскопия была ничем не примечательна. Кейс используется в качест...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы выражают благодарность Фонду исследований верхних отделов желудочно-кишечного тракта и метаболизма за финансирование издательских сборов журнала. Авторы также выражают признательность пациенту в данном случае за его согласие на публикацию его обезличенной информации и изображений.
Материалы
| Name | Company | Catalog Number | Comments |
| Laparoscopic instruments | |||
| 5 mm optical entry port | Applied Medical | CFF03 | Kii Fios First entry access system. |
| Laparoscopic 5mm 0° camera | Olympus | ENDOEYE HD II | 5 mm, 0° |
| Laparoscopic needle holder | KARL STORZ | Laparoscopic needle holder | |
| Nasogastric tube | Cardinal Health | 8888264960E | 16Fr |
| Nathanson liver retractor | COOK Medical | NLRS-1001/ NLRS-1002 | Large/ Extra-large |
| Robotic instruments | |||
| 12 mm port | Intuitive Surgical | 470375 | |
| 8 mm port | Intuitive Surgical | 470380 | |
| 8 mm reducer | Intuitive Surgical | 470381 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 0° | Intuitive Surgical | 470026 | |
| Da Vinci Xi/X Endoscope with Camera, 8 mm, 30° | Intuitive Surgical | 470027 | |
| Force Bipolar 8 mm | Intuitive Surgical | 470405 | |
| Mega SutureCut Needle Driver | Intuitive Surgical | 470309 | |
| Monopolar hook diathermy | Intuitive Surgical | 470183 | |
| SureForm 60mm stapler | Intuitive Surgical | 480460 | |
| Tip-up fenetrated grasper 8 mm | Intuitive Surgical | 470347 | |
| Vessel Sealer Extend 8 mm | Intuitive Surgical | 480422 | |
| Stapler reloads | |||
| Seamguard buttress 60 mm | GORE | 1BSGXI60GB/12BSGXI60GB | |
| SureForm 60 mm green reload | Intuitive Surgical | 48360G | |
| SureForm 60 mm white reload | Intuitive Surgical | 48360W | |
| Sutures | |||
| 2-0 nonabsorbable barbed suture | Medtronic | VLOCN0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle |
| 3-0 absorbable barbed suture | Medtronic/ Ethicon (J&J) | VLOCM0644 | 23 cm V-Loc on a 26 mm ½ circle taper point needle (preferred), STRATAFIX (alternate). Catalogue number |
| 2-0 monocryl suture | Ethicon (J&J) | JJW3463 | Cut to 15 cm, taper point needle |
| 2-0 silk suture | Ethicon (J&J) | JJ423H | Cut to 15 cm, taper point needle |
| 1 PDS suture | Ethicon (J&J) | JJ75414 | Fascial closure |
| 3-0 monocryl suture | Ethicon (J&J) | JJY227H | Skin closure |
| Topical Skin Adhesive | Ethicon (J&J) | JJ79025 | Skin closure/ wound dressing |
| Specimen extraction | |||
| Alexis O-ring wound retractor | Applied Medical | C8402 | Medium. For specimen extraction |
| Handheld diathermy | Covidien/ Valleylab | VLE2515 | For specimen extraction |
Ссылки
- Gamble, L. A., Heller, T., Davis, J. L. Hereditary diffuse gastric cancer syndrome and the role of CDH1: A review. JAMA Surgery. 156 (4), 387-392 (2021).
- Shenoy, S. CDH1 (E-cadherin) mutation and gastric cancer: Genetics, molecular mechanisms and guidelines for management. Cancer Management and Research. 11, 10477-10486 (2019).
- Hansford, S., et al. Hereditary diffuse gastric cancer syndrome: CDH1 mutations and beyond. JAMA Oncology. 1 (1), 23-32 (2015).
- Friedman, M., et al. Surveillance endoscopy in the management of hereditary diffuse gastric cancer syndrome. Clincal Gastroenterology and Hepatology. 19 (1), 189-191 (2021).
- van der Post, R. S., et al. Hereditary diffuse gastric cancer: updated clinical guidelines with an emphasis on germline CDH1 mutation carriers. Journal of Medical Genetics. 52 (6), 361-374 (2015).
- Kaurah, P., et al. Hereditary diffuse gastric cancer: Cancer risk and the personal cost of preventive surgery. Familal Cancer. 18 (4), 429-438 (2019).
- Hejazi, R. A., Patil, H., McCallum, R. W. Dumping syndrome: Establishing criteria for diagnosis and identifying new etiolo gies. Digestive Diseases and Sciences. 55 (1), 117-123 (2010).
- Johnston, D. Operative mortality and postoperative morbidity of highly selective vagotomy. British Medical Journal. 4 (5996), 545-547 (1975).
- Nakauchi, M., et al. Robotic surgery for the upper gastrointestinal tract: Current status and future perspectives. Asian Journal of Endoscopic Surgery. 10 (4), 354-363 (2017).
- Frantzides, C. T., et al. Laparoscopic Roux-en-Y gastric bypass utilizing the triple stapling technique. Journal of the Society of Laparoendoscopic Surgeons. 10 (2), 176-179 (2006).
- Madan, A. K., Frantzides, C. T. Triple-stapling technique for jejunojejunostomy in laparoscopic gastric bypass. Archives of Surgery. 138 (9), 1029-1032 (2003).
- Forrester, J. D., et al. Surgery for hereditary diffuse gastric cancer: Long-term outcomes. Cancers. 14 (3), 728 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены