Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Нефракционированная объемная культура скелетных мышц мышей для повторения нишевого покоя и покоя стволовых клеток
* Эти авторы внесли равный вклад
В этой статье
Резюме
Скелетные мышцы состоят из нескольких типов клеток, включая резидентные стволовые клетки, каждый из которых вносит особый вклад в гомеостаз и регенерацию мышц. Здесь описывается 2D-культура мышечных стволовых клеток и ниша мышечных клеток в условиях ex vivo, которая сохраняет многие физиологические, in vivo и экологические характеристики.
Аннотация
Скелетные мышцы являются самой большой тканью тела и выполняют множество функций, от передвижения до контроля температуры тела. Его функциональность и восстановление после травм зависят от множества типов клеток и от молекулярных сигналов между основными мышечными клетками (миоволокнами, мышечными стволовыми клетками) и их нишей. Большинство экспериментальных установок не сохраняют это сложное физиологическое микроокружение, а также не позволяют исследовать ex vivo мышечные стволовые клетки в состоянии покоя, которое имеет для них решающее значение. Здесь изложен протокол культивирования ex vivo мышечных стволовых клеток с клеточными компонентами их ниши. Путем механического и ферментативного расщепления мышц получается смесь типов клеток, которая помещается в 2D-культуру. Иммуноокрашивание показывает, что в течение 1 недели в культуре присутствуют несколько нишевых клеток наряду с миоволокнами и, что важно, Pax7-положительными клетками, которые проявляют характеристики спящих мышечных стволовых клеток. Эти уникальные свойства делают этот протокол мощным инструментом для клеточной амплификации и получения покоящихся стволовых клеток, которые могут быть использованы для решения фундаментальных и трансляционных вопросов.
Введение
Движение, дыхание, обмен веществ, положение тела и поддержание температуры тела зависят от скелетной мускулатуры, и сбои в работе скелетных мышц могут, таким образом, вызывать изнурительные патологии (например, миопатии, мышечные дистрофии и т. д.). 1. Благодаря своим основным функциям и изобилию, скелетные мышцы привлекли внимание исследовательских лабораторий по всему миру, которые стремятся понять ключевые аспекты, поддерживающие нормальную работу мышц и служащие терапевтическими мишенями. Кроме того, скелетные мышцы являются широко используемой моделью для изучения регенерации и функции стволовых клеток, поскольку здоровые мышцы могут полностью самовосстанавливаться после полной травмы и дегенерации, в основном благодаря своим резидентным стволовым клеткам2; Они также называются сателлитными клетками и локализуются под базальной пластинкой на периферии мышечных волокон3.
Основными клетками скелетной мускулатуры взрослого человека являются миоволокна (длинные синцитиальные многоядерные клетки) и клетки-сателлиты (стволовые клетки с миогенным потенциалом, которые находятся в состоянии покоя до тех пор, пока травма не активирует их). Последние клетки являются центральными клетками мышечной регенерации, и этот процесс не может происходить при их отсутствии 4,5,6,7. В их непосредственном микроокружении есть несколько типов клеток и молекулярных факторов, которые сигнализируют о них. Эта ниша постепенно закрепляется на протяжении всего развития и до совершеннолетия8. Мышцы взрослого человека содержат несколько типов клеток (эндотелиальные клетки, перициты, макрофаги, фибро-адипогенные предшественники-FAP, регуляторные Т-клетки и т.д.). 9,10 и компоненты внеклеточного матрикса (ламинины, коллагены, фибронектин, фибриллины, периостин и др.) 11, которые взаимодействуют друг с другом и с клетками-сателлитами в контексте здоровья, болезни и регенерации.
Сохранение этой сложной ниши в экспериментальных условиях является фундаментальным, но сложным делом. Не менее трудно поддерживать или возвращаться в состояние покоя, которое имеет решающее значение для клеток-сателлитов9. Для частичного решения этих проблем было введено несколько методов, каждый из которых имеет свои преимущества и недостатки (подробно описаны в разделе обсуждения). Здесь представлен метод, позволяющий частично преодолеть эти два барьера. Мышцы сначала собираются, а затем разрушаются механически и ферментативно, прежде чем гетерогенная клеточная смесь будет помещена в культуру. В ходе культивирования обнаруживаются многие типы клеток ниши, а также наблюдаются клетки-сателлиты, вернувшиеся в состояние покоя. В качестве последнего шага протокола представлены этапы иммунофлюоресценции, которые позволяют обнаружить каждый тип клеток с помощью общепринятых маркеров.
Access restricted. Please log in or start a trial to view this content.
протокол
Все эксперименты проводились в соответствии с французскими и европейскими нормами в отношении животных в Институте биологических исследований (INSERM U955), в частности, директивой 2010/63/UE. Животные содержались в контролируемой и обогащенной среде на животноводческих объектах с номерами сертификатов А94 028 379 и Д94-028-028; С ними работали только уполномоченные исследователи и смотрители за животными, и они визуально осматривались персоналом содержания животных на предмет признаков дискомфорта в течение их жизни. Они были усыплены вывихом шейки матки перед вскрытием. В течение жизни животных не проводилось никаких интервенционных процедур; Таким образом, не было необходимости получать одобрение на эту процедуру от Комитета по этике и Министерства высшего образования, исследований и инноваций Франции. Действительно, в соответствии с директивой 2010/63/UE, для эвтаназии и вскрытия не требуется никакого этического разрешения. Результаты, представленные в этой рукописи, относятся к линии C57BL/6NRj дикого типа (см. таблицу материалов) и трансгенной линии Tg:Pax7-nGFP 12 (выведенной нашей командой). Протокол применялся к самцам и самкам мышей в возрасте 8-12 недель.
1. Подготовка реагентов и оборудования к предварительному сбраживанию
- Опрыскайте инструменты для вскрытия (прямые и изогнутые ножницы, щипцы, см. таблицу материалов) 70%-ным этиловым спиртом и высушите их бумагой. Покройте пробковую тарелку алюминиевой фольгой и держите поблизости 10-сантиметровые чашки Петри (по одной на животное). Имейте под рукой бумагу и 70% этанола.
ПРИМЕЧАНИЕ: По окончании вскрытия промойте инструменты для вскрытия водой, затем сбрызните их 70% этиловым спиртом и высушите бумагой. - Установите вращающуюся водяную баню на 37 °C и приготовьте смесь для пищеварения (20 мл/животное), соединив DMEM с 1% пенициллин-стрептомицином, 0,5 ЕД/мл коллагеназы, 3 ЕД/мл диспазы (см. таблицу материалов) и 0,2% БСА в пробирке (пробирках) 50 мл.
- Пропустите смесь для разложения через фильтр 0,22 мкм в колпаке для клеточных культур.
ПРИМЕЧАНИЕ: Рекомендуется каждый раз готовить смесь для сбраживания свежей.
2. Подготовка реагентов и оборудования после разложения
- После разложения смесь можно замораживать или культивировать. Для замораживания приготовьте 10% ДМСО:90% фетальную бычью сыворотку (FBS), а также набор криопробирок (1 мл клеточной суспензии на 2 мл криопробирки). Для посева подготавливают питательную среду (ДМЕМ с добавлением 1% пенициллина-стрептомицина, 4 нг/мл bFGF и 20% FBS) и набор из 8-луночных планшетов. Пластины должны быть покрыты перед нанесением покрытия на ячейки (подробная информация приведена в шаге 7.1).
- Для окрашивания готовят 4% параформальдегид (PFA) в буфере фосфатного раствора (PBS) (0,15 мл/лунку 8-луночного планшета) и блокирующий раствор (5% бычий сывороточный альбумин без IgG [BSA] в PBS; 0,15 мл/лунку 8-луночного планшета).
ВНИМАНИЕ: Не вдыхайте порошок PFA; Приготовьте и обработайте его под химическим колпаком.
3. Вскрытие
- Опрыскайте усыпленное животное 70% этиловым спиртом. Сделайте горизонтальный разрез (от левой стороны тела к правой стороне) большими ножницами на уровне живота и разрежьте вокруг талии. Стяните кожу с задних конечностей, чтобы обнажить мышцы (рис. 1А).
- Поместите животное на пробковую пластину, покрытую алюминиевой фольгой, и приколите противоположные переднюю и заднюю конечности. Быстро удалите все мышцы задних конечностей (переднюю и заднюю) в чашку Петри диаметром 10 см, помещенную на лед (рис. 1B, C). Позаботьтесь об удалении жировой ткани из областей вокруг квадрицепсов и задних мышц. Фасции, нервы и сухожилия также могут быть удалены на этом этапе, если это не повлияет на общее время, затрачиваемое на рассечение.
ПРИМЕЧАНИЕ: Оптимальное время рассечения обеих задних конечностей должно составлять около 15-20 минут. Рекомендуется, чтобы время вскрытия не превышало 30 минут. - Время от времени добавляйте капли DMEM в мышцы, чтобы они оставались влажными, но не слишком много, так как это затруднит измельчение. Повторите то же самое для другой задней конечности. После того, как все мышцы одного животного окажутся в чашке Петри (рис. 1D), мелко нарежьте их ножницами в течение 7-10 мин до получения гладкого гомогената (рис. 1E).
ПРИМЕЧАНИЕ: В этом протоколе используется DMEM с добавлением L-глютамина, пирувата и 4,5 г/л D-глюкозы.
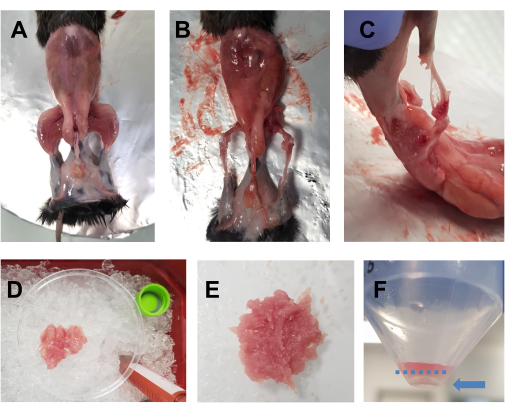
Рисунок 1: Подготовка мышц перед культурой. (А) Кожа снимается, чтобы обнажить мышцы задних конечностей, как описано в шаге 3.1. (В,В) Все мышцы задних конечностей собираются (В) вокруг костей и (С) между костями, как описано в шаге 3.2. (D) Собранные мышцы помещают в 10-сантиметровую чашку Петри на лед с каплями DMEM, чтобы они оставались влажными, как описано в шаге 3.3. (E) Мышцы мелко нарезаются ножницами до получения однородной пасты с консистенцией, изображенной на этом изображении. (F) Изображение гранулы после окончательного центрифугирования; Синяя стрелка выделяет дробинку, которая находится напротив трубки, под пунктирной синей линией. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Пищеварение
ПРИМЕЧАНИЕ: В конце сбраживания для секции 5 необходима центрифуга при температуре 4 °C, ведро льда, три ситечка для клеток (100 мкм, 70 мкм, 40 мкм) и три пробирки по 50 мл (на животное).
- Приготовьте и отфильтруйте смесь для разложения, как описано в шаге 1.2. Держите смесь на льду.
- После того, как все мышцы будут измельчены, поместите гомогенат в пробирку объемом 50 мл с 20 мл смеси для пищеварения. Оберните края крышки гибкой пленкой, чтобы предотвратить протекание, и поместите трубку на водяную баню для встряхивания при температуре 37 °C на низкой или средней скорости (50 об/мин).
- Через 1 ч при температуре 37 °C откройте крышку и перемешайте, осторожно пипетируя семь раз вверх и вниз пипеткой объемом 10 мл, чтобы получить однородную смесь. Наклейте новую пленку на крышку и снова поместите ее на водяную баню для встряхивания. Через 1 ч выньте трубку, и выключите ванну.
ПРИМЕЧАНИЕ: Для культуры используйте это время инкубации, чтобы покрыть пластины, как описано в шаге 7.1, прежде чем переходить к разделу 5.
5. Фильтрация
- Наполните пищеварительную трубку холодным ДМЕМ (с добавлением 1% пенициллина-стрептомицина) до 50 мл. Перемешайте, перевернув трубку три раза. Храните DMEM в ведре со льдом для следующих шагов.
- Поместите ситечко со 100 мкм на новую пробирку объемом 50 мл. Пропустите переваренную смесь через ситечко в новую пробирку. Центрифуга при 600 x g в течение 5 мин при 4 °C. Вылейте надосадочную жидкость в емкость для жидких отходов.
- Ресуспендируйте гранулу в 1 мл холодного ДМЕМ (с добавлением 1% пенициллина-стрептомицина). Наполните пробирку объемом до 50 мл тем же DMEM. ПРИМЕЧАНИЕ: Если центрифугирование пропустить, следующую гранулу будет труднее идентифицировать и обслуживать.
- Поместите ситечко с ячейками 70 мкм на новую пробирку объемом 50 мл. Пропустите центрифугированную/ресуспендированную смесь через сетчатый фильтр в новую пробирку. Центрифуга при 80 x g в течение 5 мин при 4 °C.
ПРИМЕЧАНИЕ: Этот шаг не является обязательным, но рекомендуется для удаления клеточного мусора. - Поместите ситечко с ячейками 40 мкм на новую пробирку объемом 50 мл. Пропустите надосадочную жидкость через ситечко в новую пробирку. Центрифугу при 600 x g в течение 5 мин при 4 °C, вылейте надосадочную жидкость в контейнер для жидких отходов и повторно суспендируйте гранулы в FBS под колпаком для культивирования. Гранула на этом этапе очень маленькая (Рисунок 1F).
ПРИМЕЧАНИЕ: Фильтрация через сетчатый фильтр 40 мкм удаляет мусор, который дал бы неспецифический сигнал при последующем окрашивании культур.
6. (Необязательно) Замораживание
ПРИМЕЧАНИЕ: Раздел 6 не является обязательным. Протокол может быть приостановлен после фильтрации, но это может снизить выживаемость клеток и успешность культивирования.
- Добавьте ДМСО для получения соотношения 10% ДМСО:90% FBS и перелейте в криопробирки (1 мл ресуспендированной гранулы на 2 мл криопробирки).
- Поместите криопробирку при температуре −80 °C в полистирольную коробку на ночь. На следующий день переместите температуру до −150 °C для длительного хранения.
ПРИМЕЧАНИЕ: Также возможно кратковременное хранение при температуре −80 °C. - При запуске культуры быстро разморозьте криопробирку на водяной бане с температурой 37 °C, пока клеточная суспензия не оттает. Смешайте с 4 мл ДМЕМ под колпаком культуры. Отжим при 600 x g в течение 5 мин при 4 °C. Пипеткой выдавите надосадочную жидкость и продолжайте, как описано в шаге 7.2.
7. Культивирование
ПРИМЕЧАНИЕ: Можно ожидать, что замороженные или свежие клеточные суспензии заполнят 24-32 лунки из трех-четырех 8-луночных планшетов.
- Покройте 8-луночные пластины раствором для покрытия, который следует размораживать при 4 °C или на льду (исходный раствор для покрытия обычно выдерживается при температуре −20 °C). Добавьте 0,4 мл раствора для покрытия в одну лунку и пипетируйте его от лунки к лунке. После переноса обмазочного раствора через все лунки его можно собрать и повторно заморозить для будущих культур. Пластины с покрытием выдерживают при температуре 37 °C в течение 30 минут перед нанесением покрытия на ячейки.
- Добавляют DMEM (с добавлением 1% пенициллина-стрептомицина) с добавлением 4 нг/мл bFGF (см. таблицу материалов) к суспензии FBS-клеток для получения соотношения 20% FBS:80% DMEM.
ПРИМЕЧАНИЕ: Несмотря на то, что добавление bFGF может быть полезным в первичных культурах миобластов и в производстве сателлитных клеток в массовых культурах, его добавление не является обязательным, так как его отсутствие в массовых культурах продолжительностью ~7 дней не ставит под серьезную угрозу выход клеток. - Планшет 0,4 мл суспензии на лунку (с шага 7.2) в покрытых 8-луночных планшетах.
ПРИМЕЧАНИЕ: Рассчитайте 30 см2 культуры на животное для замороженных и свежих препаратов. - Инкубируют культуры при 37 °C с 5%СО2 до 10 дней, меняя среду каждый день после того, как культура начнет менять цвет на желтоватый (обычно 5-7 дней).
ПРИМЕЧАНИЕ: Для количественного определения клеток в S-фазе клеточного цикла13 добавьте 10 мкМ EdU за 2 ч до фиксации. Чтобы захватить первую S-фазу, добавьте 10 мкМ EdU из покрытия и зафиксируйте через 40 ч культуры.
8. Фиксация
ПРИМЕЧАНИЕ: Разделы 8-10 следует проводить при комнатной температуре, если не указано иное.
- Пипетку выньте питательную среду и зафиксируйте клетки 4% PFA (0,15 мл/лунка).
ВНИМАНИЕ: Добавьте PFA под химический колпак.
ПРИМЕЧАНИЕ: Если все лунки закреплены одновременно, инкубируйте с PFA при комнатной температуре в течение 10 минут. Если лунки закреплены в разные моменты времени, добавьте PFA в лунки, которые нужно зафиксировать, и держите планшет в инкубаторе при температуре 37 °C в течение 5 минут. - Пипеткой извлеките PFA и добавьте PBS в течение 10 с (0,15 мл/лунку). Выньте пипетку из PBS и добавьте свежий PBS в течение 5 минут (0,15 мл/лунка).
ПРИМЕЧАНИЕ: Если все лунки закреплены одновременно, инкубируйте с PBS при комнатной температуре. Если лунки зафиксированы в разные моменты времени, добавьте PBS к фиксированным лункам и держите планшет в инкубаторе при температуре 37 °C в течение 5 минут. Затем добавьте 0,4 мл PBS и держите планшет в инкубаторе до 1 недели.
9. Проницаемость и блокировка
- Когда все будет готово к окрашиванию, пипеткой извлеките PBS и промеабилизируйте 0,5% TritonX 100 в PBS (0,15 мл/лунка) в течение 8 минут. Выньте пипетку TritonX 100, промойте PBS в течение 10 с (0,15 мл/лунка), выньте пипетку PBS и промойте PBS в течение 5 минут (0,15 мл/лунка).
- Блок с 5% IgG-свободным BSA в PBS в течение 30-60 мин (0,15 мл/лунка).
10. Окрашивание
- Пипетку из BSA и добавьте смесь первичных антител, разведенную в PBS (0,15 мл/лунку) (см. таблицу материалов; разведения: анти-CD31 1:100, анти-FOSB 1:200, анти-GFP 1:1,000, анти-KI67 1:1,000, анти-MyHC 1:400, анти-MYOD 1:200, анти-MYOG 1:150, анти-PAX7 1:100, анти-PDGFRa 1:50) для ночной инкубации при 4 °C.
ПРИМЕЧАНИЕ: После инкубации антител соберите смесь антител, добавьте азид натрия и храните при температуре 4 °C или −20 °C (в соответствии с инструкциями производителя антител) для повторного использования в будущем. - Пипетку вынимают смесь антител, промывают PBS в течение 10 с (0,15 мл/лунка), пипеткой вынимают PBS и промывают PBS в течение 5 мин (0,15 мл/лунка).
- Пипетку из промывочного ПБС выпипетку, добавьте смесь вторичных антител (козий антимышиный Alexa Fluor 488, козий антикроличий Alexa Fluor 555, козий антикрысиный Alexa Fluor 647, козий антимышиный Alexa Fluor 555, козий антикуриный Alexa Fluor 488, все используемые в разведении 1:500-1,000) и маркер ядра (например, DAPI), разбавленный в PBS (0,15 мл/лунка) (см. таблицу материалов), и выдерживают в течение 1 ч при комнатной температуре, защищая от света.
- Пипетку вынимают смесь вторичных антител, промывают PBS в течение 10 с (0,15 мл/лунка), пипеткой вынимают PBS, промывают PBS в течение 5 мин (0,15 мл/лунка), пипеткой вынимают PBS и монтируют.
ПРИМЕЧАНИЕ: Если используются 8-луночные планшеты со съемными сепараторами, перед монтажом снимите сепараторы.
Access restricted. Please log in or start a trial to view this content.
Результаты
Этот протокол позволяет культивировать мышечные клетки, сохраняя при этом клетки-сателлиты и большинство клеток из их эндогенной ниши. На рисунке 2 обобщены основные этапы протокола, в то время как основные части вскрытия и пищеварения представлены на рисунке 1.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Функция скелетных мышц взрослого человека подкрепляется тонко организованным набором клеточных взаимодействий и молекулярных сигналов. Здесь представлен метод, позволяющий изучать эти параметры в условиях ex vivo , близком к физиологическому микроокружению.
Нескол?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Для рисунка 2 были использованы шаблоны Servier Medical Art (https://smart.servier.com/). Лаборатория FR поддерживается Французской ассоциацией по борьбе с миопатиями - AFM через TRANSLAMUSCLE (гранты 19507 и 22946), Фондом медицинских исследований - FRM (EQU202003010217, ENV202004011730, ECO201806006793), Национальным агентством исследований - ANR (ANR-21-CE13-0006-02, ANR-19-CE13-0010, ANR-10-LABX-73) и Высшей лигой по борьбе с раком (IP/SC-17130). Вышеупомянутые спонсоры не играли никакой роли в разработке, сборе, анализе, интерпретации или представлении информации об этом исследовании или написании этой рукописи.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| anti-CD31 | BD | 550274 | dilution 1:100 |
| anti-FOSB | Santa Cruz | sc-7203 | dilution 1:200 |
| anti-GFP | Abcam | ab13970 | dilution 1:1000 |
| anti-Ki67 | Abcam | ab16667 | dilution 1:1000 |
| anti-MyHC | DSHB | MF20-c | dilution 1:400 |
| anti-MYOD | Active Motif | 39991 | dilution 1:200 |
| anti-MYOG | Santa Cruz | sc-576 | dilution 1:150 |
| anti-Pax7 | Santa Cruz | sc-81648 | dilution 1:100 |
| anti-PDGFRα | Invitrogen | PA5-16571 | dilution 1:50 |
| b-FGF | Peprotech | 450-33 | concentration 4 ng/mL |
| Bovine serum albumin (BSA) – used for digestion | Sigma Aldrich | A7906-1006 | concentration 0.2% |
| BSA IgG-free, protease-free – used for staining | Jackson ImmunoResearch | 001-000-162 | concentration 5% |
| Cell strainer 40 um | Dominique Dutscher | 352340 | |
| Cell strainer 70 um | Dominique Dutscher | 352350 | |
| Cell strainer 100 um | Dominique Dutscher | 352360 | |
| Collagenase | Roche | 10103586001 | concentration 0.5 U/mL |
| Culture plate | Sarstedt | 94.6140.802 | |
| Dimethyl sulfoxide (DMSO) | Euromedex | UD8050-05-A | |
| Dispase | Roche | 4942078001 | concentration 3 U/mL |
| Dissection forceps size 5 | Fine Science Tools | 91150-20 | |
| Dissection forceps size 55 | Fine Science Tools | 11295-51 | |
| Dissection scissors (big, straight) | Fine Science Tools | 9146-11 | ideal for chopping |
| Dissection scissors (small, curved) | Fine Science Tools | 15017-10 | |
| Dissection scissors (small, straight) | Fine Science Tools | 14084-08 | |
| Dulbecco's Modified Eagle's Medium (DMEM) | ThermoFisher | 41966-029 | |
| EdU Click-iT kit | ThermoFisher | C10340 | |
| Fetal bovine serum – option 1 | Eurobio | CVF00-01 | |
| Fetal bovine serum – option 2 | Gibco | 10270-106 | |
| Matrigel | Corning Life Sciences | 354234 | coating solution |
| Parafilm | Dominique Dutscher | 090261 | flexible film |
| Paraformaldehyde – option 1 | PanReac AppliChem ITW Reagents | 211511.1209 | concentration 4% |
| Paraformaldeyde – option 2 | ThermoFisher | 28908 | concentration 4% |
| Penicillin streptomycin | Gibco | 15140-122 | |
| Shaking water bath | ThermoFisher | TSSWB27 | |
| TritonX100 | Sigma Aldrich | T8532-500 ML | concentration 0.5% |
| Wild-type mice | Janvier | C57BL/6NRj |
Ссылки
- Frontera, W. R., Ochala, J. Skeletal muscle: A brief review of structure and function. Calcified Tissue International. 96 (3), 183-195 (2015).
- Forcina, L., Cosentino, M., Musarò, A. Mechanisms regulating muscle regeneration: Insights into the interrelated and time-dependent phases of tissue healing. Cells. 9 (5), 1297(2020).
- Mauro, A. Satellite cell of skeletal muscle fibers. Journal of Biophysical and Biochemical Cytology. 9 (2), 493-495 (1961).
- Lepper, C., Partridge, T. A., Fan, C. -M. An absolute requirement for Pax7-positive satellite cells in acute injury-induced skeletal muscle regeneration. Development. 138 (17), 3639-3646 (2011).
- McCarthy, J. J., et al. Effective fiber hypertrophy in satellite cell-depleted skeletal muscle. Development. 138 (17), 3657-3666 (2011).
- Murphy, M. M., Lawson, J. A., Mathew, S. J., Hutcheson, D. A., Kardon, G. Satellite cells, connective tissue fibroblasts and their interactions are crucial for muscle regeneration. Development. 138 (17), 3625-3637 (2011).
- Sambasivan, R., et al. Pax7-expressing satellite cells are indispensable for adult skeletal muscle regeneration. Development. 138 (17), 3647-3656 (2011).
- Hicks, M. R., Pyle, A. D. The emergence of the stem cell niche. Trends in Cell Biology. 33 (22), 112-123 (2022).
- Relaix, F., et al. Perspectives on skeletal muscle stem cells. Nature Communications. 12 (1), 692(2021).
- Gama, J. F. G., et al. Role of regulatory T cells in skeletal muscle regeneration: A systematic review. Biomolecules. 12 (6), 817(2022).
- Loreti, M., Sacco, A. The jam session between muscle stem cells and the extracellular matrix in the tissue microenvironment. NPJ Regenerative Medicine. 7 (1), 16(2022).
- Sambasivan, R., et al. Distinct regulatory cascades govern extraocular and pharyngeal arch muscle progenitor cell fates. Developmental Cell. 16 (6), 810-821 (2009).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Bismuth, K., Relaix, F. Genetic regulation of skeletal muscle development. Experimental Cell Research. 316 (18), 3081-3086 (2010).
- Yin, H., Price, F., Rudnicki, M. A. Satellite cells and the muscle stem cell niche. Physiological Reviews. 93 (1), 23-67 (2013).
- Lertkiatmongkol, P., Liao, D., Mei, H., Hu, Y., Newman, P. J. Endothelial functions of platelet/endothelial cell adhesion molecule-1 (CD31). Current Opinion in Hematology. 23 (3), 253-259 (2016).
- Scholzen, T., Gerdes, J. The Ki-67 protein: From the known and the unknown. Journal of Cellular Physiology. 182 (3), 311-322 (2000).
- Abou-Khalil, R., Le Grand, F., Chazaud, B. Human and murine skeletal muscle reserve cells. Stem Cell Niche. 1035, 165-177 (2013).
- Pasut, A., Oleynik, P., Rudnicki, M. A. Isolation of muscle stem cells by fluorescence activated cell sorting cytometry. Methods in Molecular Biology. 798, 53-64 (2011).
- Liu, L., Cheung, T. H., Charville, G. W., Rando, T. A. Isolation of skeletal muscle stem cells by fluorescence-activated cell sorting. Nature Protocols. 10 (10), 1612-1624 (2015).
- Montarras, D., et al. Direct isolation of satellite cells for skeletal muscle regeneration. Science. 309 (5743), 2064-2067 (2005).
- Qu, Y., Edwards, K., Barrow, J. Isolation, culture, and use of primary murine myoblasts in small-molecule screens. STAR Protocols. 4 (2), 102149(2023).
- Danoviz, M. E., Yablonka-Reuveni, Z. Skeletal muscle satellite cells: Background and methods for isolation and analysis in a primary culture system. Methods in Molecular Biology. 798, 21-52 (2011).
- Saclier, M., Theret, M., Mounier, R., Chazaud, B. Effects of macrophage conditioned-medium on murine and human muscle cells: analysis of proliferation, differentiation, and fusion. Methods in Molecular Biology. 1556, 317-327 (2017).
- Giordani, L., et al. High-dimensional single-cell cartography reveals novel skeletal muscle-resident cell populations. Molecular Cell. 74 (3), 609-621 (2019).
- Tabula Muris Consortium et al. Single-cell transcriptomics of 20 mouse organs creates a Tabula Muris. Nature. 562 (7727), 367-372 (2018).
- Brunetti, J., Koenig, S., Monnier, A., Frieden, M. Nanopattern surface improves cultured human myotube maturation. Skeletal Muscle. 11 (1), 12(2021).
- Denes, L. T., et al. Culturing C2C12 myotubes on micromolded gelatin hydrogels accelerates myotube maturation. Skeletal Muscle. 9 (1), 17(2019).
- LaFramboise, W. A., et al. Effect of muscle origin and phenotype on satellite cell muscle-specific gene expression. Journal of Molecular and Cellular Cardiology. 35 (10), 1307-1318 (2003).
- Azhar, M., Wardhani, B. W. K., Renesteen, E. The regenerative potential of Pax3/Pax7 on skeletal muscle injury. Journal of Generic Engineering and Biotechnology. 20 (1), 143(2022).
- Hardy, D., et al. Comparative study of injury models for studying muscle regeneration in mice. PLoS One. 11 (1), e0147198(2016).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены