Оптимизированное производство и анализ рекомбинантных везикул, заполненных белком, из E. coli
В этой статье
Резюме
В настоящем протоколе подробно описан способ бактериальной продукции рекомбинантных белков, включая типично нерастворимые или содержащие дисульфидные связи белки, упакованные внутри везикул, связанных с внеклеточной мембраной. Это может быть применено к различным областям научных исследований, включая прикладную биотехнологию и медицину.
Аннотация
Эта инновационная система, использующая короткую пептидную метку, которая экспортирует несколько рекомбинантных белков в мембраносвязанных везикулах из кишечной палочки, обеспечивает эффективное решение ряда проблем, связанных с экспрессией бактериального рекомбинантного белка. Эти рекомбинантные везикулы разделяют белки в микросреде, что способствует производству белков, содержащих сложные токсичные, нерастворимые или дисульфидные связи, из бактерий. Выход белка значительно увеличивается по сравнению с типичной экспрессией бактерий в отсутствие пептидной метки, образующей зародышеобразование везикул. Высвобождение белков, упакованных в везикулы, поддерживает изоляцию от питательной среды и обеспечивает долгосрочное активное хранение белка. Эта технология приводит к увеличению выхода функциональных белков, упакованных в везикулы, для упрощенной последующей обработки для широкого спектра применений от прикладной биотехнологии до научных открытий и медицины. В настоящей статье и связанном с ней видео приведен подробный протокол метода, в котором выделены ключевые шаги в методологии для максимизации производства везикул, заполненных рекомбинантным белком.
Введение
Грамотрицательные бактерии E. coli являются привлекательной системой для производства рекомбинантного белка как в промышленном, так и в академическом масштабе. Культивирование партиями с высокой плотностью не только рентабельно и просто, но и создан широкий спектр реагентов, штаммов, инструментов и промоторов для стимулирования генерации функциональных белков в E. coli1. Кроме того, методы синтетической биологии в настоящее время преодолевают препятствия, обычно связанные с применением посттрансляционных модификаций и сворачивания сложных белков2. Способность нацеливаться на секрецию рекомбинантных белков в питательные среды привлекательна для повышения выхода и снижения производственных затрат. Контролируемая упаковка определяемых пользователем белков в мембранные везикулы способствует разработке продуктов и технологий в прикладной биотехнологии и медицинской промышленности. До сих пор не хватало широко применимых методов секреции рекомбинантных белков из E. coli 3.
Eastwood et al. недавно разработали основанный на пептидной маркировке метод получения и выделения рекомбинантных белковых везикул из E. coli1. Этот нуклеирующий пептид везикул (VNp) позволяет производить внеклеточные бактериальные мембранные везикулы, в которые может быть нацелен выбранный рекомбинантный белок для упрощения очистки и хранения целевого белка, и обеспечивает значительно более высокие выходы, чем обычно допускается при встряхивании колбовых культур. Сообщалось о выходах около 3 г рекомбинантного белка на литр культуры колбы, при этом выходы в > 100 раз выше, чем у эквивалентных белков, лишенных метки VNp. Эти рекомбинантные везикулы, обогащенные белкомбинами, могут быть быстро очищены и сконцентрированы из питательных сред и обеспечивают стабильную среду для хранения. Эта технология представляет собой крупный прорыв в производстве рекомбинантного белка E. coli. Везикулы разделяют токсичные и дисульфидные белки, содержащие белки в растворимой и функциональной форме, и поддерживают простую, эффективную и быструю очистку функциональных белков, упакованных в везикулы, для длительного хранения или прямой обработки1.
Основными преимуществами этой технологии по сравнению с существующими методами являются: (1) применимость к диапазону размеров (от 1 кДа до >100 кДа) и типов белка; (2) содействие образованию межбелковых и внутрибелковых дисульфидных связей; (3) применимо к мультибелковым комплексам; (4) может использоваться с рядом промоторов и стандартных штаммов лабораторной кишечной палочки ; (5) получение выходов белков из встряхивающих колб, обычно наблюдаемых только с ферментационными культурами; Белки экспортируются и упаковываются в связанные с мембраной везикулы, которые (6) обеспечивают стабильную среду для хранения активного растворимого белка; и (7) упрощает последующую обработку и очистку белка. Этот простой и экономичный рекомбинантный белковый инструмент, вероятно, окажет положительное влияние на биотехнологическую и медицинскую промышленность, а также на науку открытий.
Здесь подробный протокол, разработанный в течение нескольких лет, описывает оптимальные условия для получения рекомбинантных везикул, заполненных белком, из бактерий с помощью технологии VNp. Показаны примеры изображений этой системы на практике с экспрессией флуоресцентного белка, что позволяет визуализировать присутствие везикул на разных стадиях производства, очистки и концентрации. Наконец, предоставляется руководство о том, как использовать визуализацию живых клеток для проверки производства везикул, содержащих слияние VNp, из бактерий.
протокол
Проводимая работа с бактериями проводится в соответствии с местными, национальными и международными правилами сдерживания биобезопасности, соответствующими конкретному уровню опасности биобезопасности каждого штамма.
1. Выбор различных виртуальных машин
- Определите последовательности виртуальных машин.
ПРИМЕЧАНИЕ: Для настоящего исследования были идентифицированы три последовательностиVNp 1 , которые приводят к максимальному выходу и везикулярному экспорту белков, исследованных на сегодняшний день: VNp2, VNp6 и VNp15. В настоящее время неясно, почему некоторые варианты VNp работают более эффективно с одними белками, чем с другими; поэтому рекомендуется, чтобы слияния генерировались между новым интересующим белком с каждым вариантом VNp (т.е. VNp2, 6 или 15).
VNp2: MDVFMKGLSKAKEGVVAAAEKTKQGVAEA
АГКТКЕГВЛ
VNp6: MDVFKKGFSIADEGVVGAVEKTDQGVTEA
AEKTKEGVM
VNp15: MDVFKKGFSIADEGVVGAVE
Плазмиды, которые позволяют экспрессировать интересующий белок с различными аминоконцевыми слияниями VNp, были коммерчески доступны (см. Таблицу материалов). - Разработайте стратегию клонирования, чтобы вставить интересующий ген в 3'-конец кДНК, кодирующей VNp, в одну из этих конструкций или адаптировать существующую плазмиду путем интеграции синтезированной кДНК VNp выше по течению от первого кодона ATG гена, кодирующего интересующий белок. Используйте методы, описанные впункте 1.
- Для токсичных белков используйте вектор с репрессируемым промотором экспрессии или промотор с минимальным неиндуцированным шумом экспрессии.
- Клонируйте метку последовательности VNp на аминоконце белка слияния. Убедитесь, что аффинные метки, последовательности расщепления протеазы и т. д., а также интересующий белок расположены на карбоксильной стороне метки VNp. Рекомендуется отделять VNp от нисходящего пептида с помощью гибкой линкерной области, такой как два или три повтора полипептидной последовательности -G-G-S-G- (рис. 1).
ПРИМЕЧАНИЕ: Используйте плазмиды с выбором антибиотика, который не нацелен на пептидогликан, который ослабляет клеточную поверхность и снижает выход везикул. Канамицин и хлорамфеникол (см. Таблицу материалов) были предпочтительными антибиотиками, используемыми для этого исследования.
2. Культивирование бактериальных клеток и индукция белка
ПРИМЕЧАНИЕ: Бактериальные штаммы, обычно используемые в этом протоколе, представляют собой Escherichia coli BL21 (DE3) или W3110. Клетки E. coli культивируют в лизогенного бульоне (LB) (10 г/л триптона; 10 г/л NaCl; 5 г/л дрожжевого экстракта) или потрясающем бульоне (TB) (12 г/л триптона; 24 г/л дрожжевого экстракта; 4 мл/л 10% глицерина; 17 мМ KH 2 PO 4; 72 мМ K2HPO4, соли автоклавируют отдельно) (см. Таблицу материалов). Примеры изображений, показывающих каждый этап индукции белка и последующий процесс выделения и очистки, показаны на рисунке 2.
- Культивируйте закваски 5 мл LB от свежих бактериальных превращений при 37 ° C до насыщения и используйте их для инокуляции 25 мл туберкулеза в коническую колбу объемом 500 мл, все с соответствующим подбором антибиотиков.
- Соотношение площади поверхности и объема является важным фактором оптимизации этой системы. Используйте колбу как можно большего объема (например, колбу объемом 5 л, содержащую 1 л культуры; для оптимизации используйте 25 мл среды в колбе объемом 500 мл).
- Инкубируют более крупные культуры встряхивающих колб в инкубаторе при 37 °C с встряхиванием при 200 об/мин (орбитальный бросок ≥25 мм) до достижения значения оптической плотности 600 нм (OD600) 0,8-1,0.
ПРИМЕЧАНИЕ: Везикуляция оптимальна, когда клетки выращиваются при 37 ° C. Однако некоторые рекомбинантные белки требуют экспрессии при более низких температурах. Если это относится к интересующему белку, необходимо использовать метку VNp6, так как она позволяет экспортировать везикулы с высоким выходом при температурах до 25 °C. - Чтобы индуцировать экспрессию рекомбинантного белка из промотора Т7, добавьте изопропил β-D-1-тиогалактопиранозид (IPTG) до конечной концентрации до 20 мкг / мл (84 мкМ) (см. Таблицу материалов). Индукция экспрессии рекомбинантного белка должна происходить в поздней логарифмической фазе (т.е. типичный OD600 0,8-1,0) для производства везикул.
ПРИМЕЧАНИЕ: Продолжительность индукционного периода может различаться между белками, при этом некоторые достигают максимальной продукции через 4 часа, а другие - ночью (18 часов). На сегодняшний день максимальный вывоз везикул получен в ночных культурах.
3. Выделение рекомбинантных везикул
- Гранулируют ячейки центрифугированием при 3 000 x g (4 °C) в течение 20 мин.
- Для стерилизации везикулсодержащих сред для длительного хранения пропустите очищенные питательные среды через стерильный и не содержащий моющих средств полиэфирсульфоновый фильтр (ПЭС) 0,45 мкм (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Чтобы проверить исключение жизнеспособных клеток из везикулосодержащего фильтрата, наложите пластину на агар LB и инкубируйте в течение ночи при 37 ° C. - Чтобы сконцентрировать везикулы в меньшем объеме, пропустите стерильную везикулосодержащую среду через стерильный и не содержащий моющих средств фильтр 0,1 мкм смешанных эфиров целлюлозы (MCE) (см. Таблицу материалов).
- Аккуратно промойте мембрану 0,5-1 мл стерильного PBS с помощью клеточного скребка или пластикового разбрасывателя, чтобы осторожно удалить везикулы с мембраны. Переложите в свежую пробирку с микрофугой.
ПРИМЕЧАНИЕ: Очищенные везикулы можно хранить в стерильных средах или фосфатно-буферном физиологическом растворе (PBS) при температуре 4 °C. Существуют примеры рекомбинантных белков, хранящихся в этих везикулах в течение 6 месяцев, таким образом, без потери ферментативной активности.
4. Высвобождение растворимого белка из изолированных везикул
- После того, как везикулы, содержащие белок, были выделены в стерильную среду / буфер, подвергните везикулярные липидные мембраны обработке ультразвуком, используя соответствующий график для аппарата (например, 6x 20 с включения и выключения циклов) и центрифугу при 39 000 x g (4 ° C) в течение 20 минут для удаления остатков везикул.
ПРИМЕЧАНИЕ: Осмотический шок или детергентная обработка могут быть использованы в качестве альтернативы для вскрытия везикул, но необходимо учитывать влияние на функциональность белка и / или последующее применение. - Если слияние VNp остается цитозольным и не высвобождается в среду, изолируйте белок, используя стандартные протоколы (например, ресуспендируйте клеточные гранулы в 5 мл соответствующего экстракционного буфера (20 мМ трис, 500 мМ NaCl), обработайте ультразвуком и удалите клеточный мусор центрифугированием).
5. Определение концентрации белка
- Определяют концентрацию белков методом гель-денситометрии тройных образцов1. Выполняйте вместе со стандартами загрузки бычьего сывороточного альбумина (BSA) на окрашенных кумасси гелях электрофореза полиакриламидного геля додецилсульфата натрия (SDS-PAGE). Отсканируйте и проанализируйте гели с помощью соответствующего программного обеспечения (например, изображение J; см. Таблицу материалов).
6. Визуализация образования везикул и изолированных везикул методом флуоресцентной микроскопии
ПРИМЕЧАНИЕ: Если клетки содержат флуоресцентно меченные VNp слияние или мембранные маркеры, визуализация живых клеток может быть использована для отслеживания образования везикул. В качестве альтернативы флуоресцентные липидные красители могут быть использованы для визуализации везикул для подтверждения производства и очистки.
- Монтаж ячеек
- Индуцируйте экспрессию слияния VNp в течение нескольких часов перед установкой на покровное стекло.
- Метод агарозной прокладки (рис. 3A-C): пипеткой нанесите клетки на тонкую (<1 мм) круглую прокладку из LB-агарозы (2%), которой дали сформироваться и установить на чистое предметное стекло. Дайте клеткам осесть и уравновесить и поместите покровное стекло размером 50 мм x 25 мм на подушку и ячейки. Удерживайте покровное стекло на месте с помощью прокладок и клейкой ленты.
- Метод полиэтиленимина (PEI) (рис. 3D-F): нанесите 20 мкл 0,05% PEI (в dH2O) на покровное стекло наконечником пипетки и оставьте на 3-5 минут для связывания со стеклом, не давая высохнуть. Добавьте 50 мкл клеточной культуры и оставьте на 5-10 минут, чтобы убедиться, что бактерии связались с поверхностью, покрытой PEI4. Промойте покровное стекло 100 мкл носителя перед тем, как поместить его на предметное стекло, и удерживайте его на месте с помощью прокладок и клейкой ленты.
- Монтажные везикулы
- Пипеткой наносят очищенные везикулы на тонкую (<1 мм) круглую LB-агарозную (2%) прокладку, которой дали сформироваться и установить на чистое предметное стекло. Как только жидкость высохнет, поместите покровное стекло размером 50 мм x 25 мм на подушечку и везикулы. Удерживайте покровное стекло на месте с помощью прокладок и клейкой ленты.
- Флуоресцентный липидный краситель FM4-64 способен окрашивать мембраны5, а потому может быть использован для визуализации везикул. Добавьте FM4-64 (см. Таблицу материалов) к очищенным везикулам в конечной концентрации 2 мкМ (из сырья 2 мМ, растворенного в диметилсульфоксиде [ДМСО]) и изображение после 10-минутной инкубации. Это особенно полезно для идентификации везикул, содержащих нефлуоресцентно маркированные грузы5.
- Промойте покровные стекла тем же носителем, который использовался для культивирования наблюдаемых клеток.
ПРИМЕЧАНИЕ: Некоторые сложные среды (например, туберкулез) могут проявлять автофлуоресценцию, что может привести к избыточному фоновому сигналу.
- Визуализация везикул
ПРИМЕЧАНИЕ: Примеры микроскопических изображений рекомбинантных везикул VNp можно увидеть на рисунке 4.- Установите предметное стекло на перевернутый микроскоп (см. Таблицу материалов) с помощью масляного иммерсионного объектива и оставьте на 2-3 минуты, чтобы образец осел и температура уравновешивалась.
ПРИМЕЧАНИЕ: Все изображения живых клеток для каждого образца должны быть завершены в течение 30 минут после установки ячеек на покровные стекла, чтобы свести к минимуму влияние фототоксичности и анаэробного стресса. По этой причине одноплоскостные изображения предпочтительнее z-стеков. - Используйте соответствующие источники света (например, светодиод [LED] или галогенную лампу; см. Таблицу материалов) и комбинации фильтров для используемого флуоресцентного белка (белков) / красителя (красителей)6.
- Используйте линзу с большим увеличением (например, 100x или 150x) и высокой числовой апертурой (например, NA ≥1.4) для визуализации микробных клеток и везикул.
- Определите минимальную интенсивность света, необходимую для визуализации сигналов флуоресценции от клеток и/или везикул. Для этого может потребоваться некоторая регулировка настроек экспозиции и усиления для используемой камеры.
ПРИМЕЧАНИЕ: Типичное время экспозиции современных камер с комплементарным металл-оксидным полупроводником (КМОП) варьируется от 50 до 200 мс в зависимости от системы визуализации. - Для однокадровых изображений используйте усреднение трех изображений, чтобы уменьшить аппаратно-зависимый случайный фоновый шум.
- Для покадровой съемки подождите 3-5 минут между отдельными кадрами.
ПРИМЕЧАНИЕ: В зависимости от настроек микроскопа может потребоваться периодическая регулировка фокуса во время длительных экспериментов с интервальной съемкой.
- Установите предметное стекло на перевернутый микроскоп (см. Таблицу материалов) с помощью масляного иммерсионного объектива и оставьте на 2-3 минуты, чтобы образец осел и температура уравновешивалась.
Результаты
BL21 DE3 E. coli, содержащие конструкцию экспрессии VNp6-mNeongreen, были выращены до поздней логарифмической фазы (рис. 2A). Экспрессию VNp6-mNeongreen индуцировали добавлением IPTG в культуру (конечная концентрация 20 мкг/мл или 84 мкМ), которую впоследствии оставляли расти в течение ночи при 37 °C при энергичном встряхивании (200 об/мин, орбитальный бросок ≥25 мм). На следующее утро культура показала флуоресценциюmNeongreen 7 (рис. 2B), которая оставалась видимой в среде после удаления бактериальных клеток центрифугированием (рис. 2C). Присутствие VNp-mNeongreen в культуре и очищенных питательных средах было подтверждено SDS-PAGE (рис. 2D). Везикулы, содержащие mNeongreen, были выделены на 0,1 мкм фильтре MCE (рис. 2E) и ресуспендированы в PBS (рис. 2F). Очищенные везикулы впоследствии устанавливали на агарозную подушку (рис. 3A-C) и визуализировали с помощью широкопольной флуоресцентной микроскопии (рис. 4A). Наличие мембран везикул было подтверждено с помощью липофильного флуоресцентного красителя FM4-64 (рис. 4B). Клетки E. coli, экспрессирующие белок внутренней мембраны CydB, слитые с mNeongreen (зеленый) и VNp6-mCherry2 (пурпурный)8, демонстрируют продукцию везикул и вставку груза в живые бактериальные клетки (рис. 4C). Рисунки 4A,B были получены с помощью широкопольного флуоресцентного микроскопа, в то время как рисунок 4C был получен с помощью структурированной световой микроскопии (SIM) с использованием методов, описанных ранее 9,10.
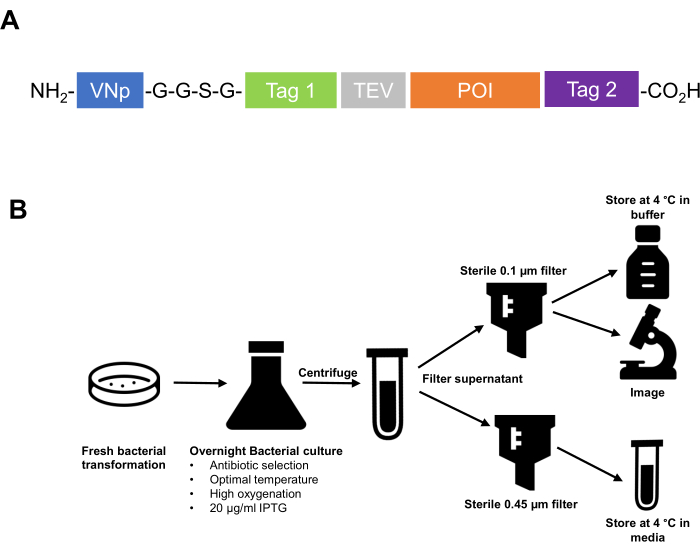
Рисунок 1: Краткое изложение технологии VNp от разработки стратегии клонирования до очистки и хранения внеклеточных везикул . (A) Схема типичного белка слияния VNp. VNp на конце NH2, за которым следует гибкий линкер и соответствующая комбинация меток аффинности и флуоресценции (Tag1, Tag 2, сайт расщепления протеазы [например, TEV]) и интересующий белок. (B) Принципиальная схема, обобщающая протокол экспрессии и очистки мембранных везикул, заполненных рекомбинантным белком, от кишечной палочки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
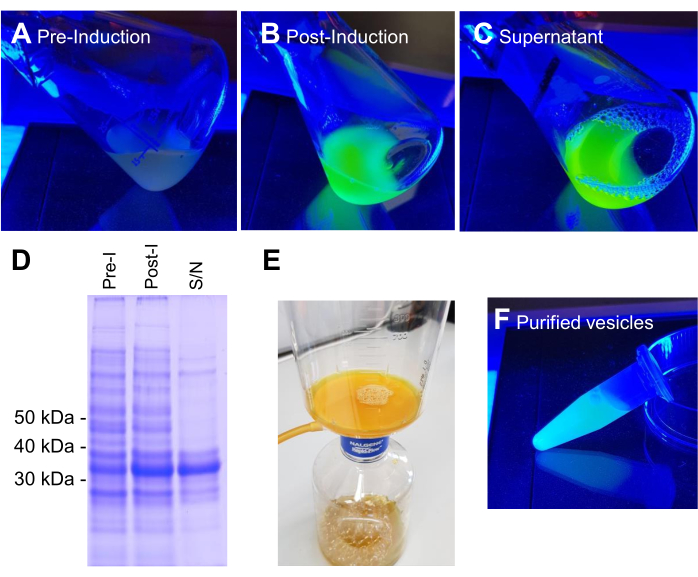
Рисунок 2: Стадии производства и очистки везикул VNp6-mNg. Культуры клеток E. coli, содержащие экспрессию VNp-mNeongreen, конструируют в синем свете либо до, либо после (B) индуцированной IPTG экспрессии белка слияния. Клетки из (B) удаляли центрифугированием, оставляя в среде (C) везикулы, заполненные VNp-mNeongreen. (D) Эквивалентные образцы из A, B и C были проанализированы с помощью SDS-PAGE и окрашивания coomassie. Везикулы выделяли на фильтр 0,1 мкм (E) и затем смывали в соответствующий объем буфера (F). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
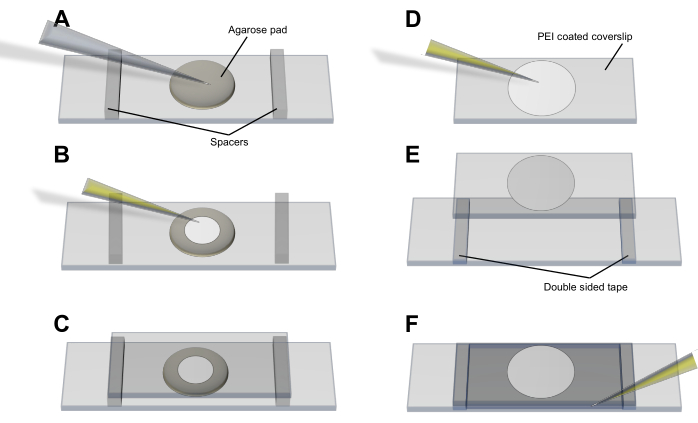
Рисунок 3: Процедура крепления клеток для визуализации везикул и производства везикул. (A-C) Метод агарозной прокладки и (D-F) метод PEI для крепления клеток E. coli на покровное стекло. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
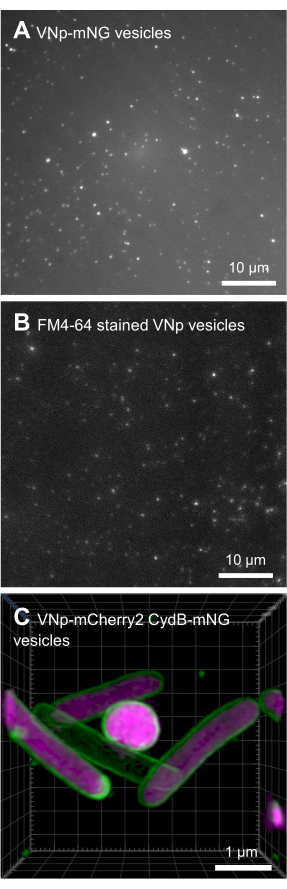
Рисунок 4: Микроскопические изображения рекомбинантных везикул VNp. Зеленые (A) и красные (B) изображения излучения из разных полей FM4-64, меченных VNp6-mNeongreen-содержащими везикулами, установленными на агарозной подушке. (C) Визуализация клеток E. coli , экспрессирующих белок внутренней мембраны CydB, слитый с mNeongreen (зеленый) и VNp6-mCherry2 (пурпурный), показывает продукцию везикул и вставку груза в живые бактериальные клетки. (A, B) были изображены с помощью широкопольного флуоресцентного микроскопа, а (C) были получены с помощью микроскопии структурированного освещения (SIM). Масштабные линейки: (A,B) = 10 мкм; (C) = 1 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Описанный выше метод получения рекомбинантных белков, меченный аминоконцевыми пептидами, представляет собой простой процесс, при котором последовательно получается большое количество белка, которое может быть эффективно выделено и/или храниться в течение нескольких месяцев.
Важно выделить ключевые шаги в протоколе, которые необходимы для оптимального использования этой системы. Во-первых, меткаVNp 1 должна быть расположена на N-конце, за ней следует интересующий белок и любые соответствующие метки. Также важно избегать использования антибиотиков, которые нацелены на пептидогликановый слой, таких как ампициллин.
С точки зрения условий роста, для максимизации производства везикул необходимы богатые среды (например, среды LB или TB) и высокое соотношение площади поверхности и объема. Оптимальная температура для производства внеклеточных везикул составляет 37 ° C, но также необходимо учитывать условия, обычно необходимые для экспрессии интересующего белка. Для более низких температур индукции необходимо использовать VNp6. Важно отметить, что индукция промотора Т7 должна быть достигнута с использованием не более 20 мкг / мл (84 мкМ) IPTG, как только клетки достигают OD600 0,8-1,0. Белки, экспрессируемые с помощью системы, достигают максимальной продукции везикул либо через 4 часа, либо после ночной индукции.
Несмотря на простоту этого протокола, он требует оптимизации. Вариант слияния VNp, температуры экспрессии и периоды времени индукции могут различаться в зависимости от интересующего белка. Кроме того, необходимо оптимизировать очистку и последующую концентрацию внеклеточных везикул из сред. Текущая процедура не масштабируется и может занять много времени. Таковы ограничения этой методологии.
Технология VNp имеет много преимуществ по сравнению с традиционными методами2. Он позволяет везикулярно экспортировать различные белки, при этом максимальный размер, успешно выраженный на сегодняшний день, составляет 175 кДа для везикул, которые остаются внутренними, и 85 кДа для тех, которые экспортируются. Кроме того, эта технология может значительно увеличить выход рекомбинантных белков с рядом физических свойств и активностей. Экспортируемые везикулы, содержащие интересующий белок, могут быть выделены простой фильтрацией из предварительно очищенной среды и впоследствии могут храниться в стерильных питательных средах или буфере при 4°С в течение нескольких месяцев.
Применение этой системы разнообразно: от науки об открытиях до прикладной биотехнологии и медицины (например, через производство функциональных терапевтических средств)3. Простота производства, последующая переработка и высокая производительность являются привлекательными качествами в этих областях и особенно в промышленности.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов или других конфликтов интересов.
Благодарности
Авторы благодарят различных пользователей Twitter, которые подняли вопросы о протоколе, представленном в статье, описывающей технологию VNp. Рисунок 1A был сгенерирован с использованием значков из flaticon.com. Эта работа была поддержана Кентским университетом и финансировалась Исследовательским советом по биотехнологии и биологическим наукам (BB/T008/768/1 и BB/S005544/1).
Материалы
| Name | Company | Catalog Number | Comments |
| Ampicillin | Melford | 69-52-3 | |
| Chloramphenicol | Acros Organics (Thermofisher Scientific) | 56-75-7 | |
| E. coli BL21 (DE3) | Lab Stock | N/A | |
| E. coli DH10β | Lab Stock | N/A | |
| Filters for microscope | Chroma | ||
| FM4-64 | Molecular Probes (Invitrogen) | T-3166 | Dissolved in DMSO, stock concentration 2 mM |
| ImageJ | Open Source | Downloaded from: https://imagej.net/ij/index.html | |
| Inverted microscope | Olympus | ||
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | Melford | 367-93-1 | |
| Kanamycin sulphate | Gibco (Thermofisher Scientific) | 11815-024 | |
| LED light source for micrscope | Cairn Research Ltd | ||
| Lysogeny Broth (LB) / LB agar | Lab Stock | N/A | 10 g/L Tryptone; 10 g/L NaCl; 5 g/L Yeast Extract (1.5 g/L agar) |
| Metamorph imaging software | Molecular Devices | ||
| MF-Millipore Membrane filter (0.1 µm, MCE) | Merck | VCWP04700 | |
| Millipore Express PLUS membrane filter (0.45 µm, PES) | Merck | HPWP04700 | |
| Phosphate buffered saline (PBS) | Lab Stock | N/A | |
| Plasmids allowing expression of protein of interest with different VNp amino terminal fusions | Addgene | https://www.addgene.org/Dan_Mulvihill/ | |
| Terrific Broth (TB) | Lab Stock | N/A | 12 g/L Tryptone; 24 g/L Yeast Extract; 4 ml/L 10% glycerol; 17 mM KH2PO4 72 mM K2HPO4 |
Ссылки
- Eastwood, T. A., et al. High-yield vesicle-packaged recombinant protein production from E. coli. Cell Reports Methods. 3 (2), 100396 (2023).
- Makino, T., Skretas, G., Georgiou, G. Strain engineering for improved expression of recombinant proteins in bacteria. Microbial Cell Factories. 10, 32 (2011).
- Peng, C., et al. Factors influencing recombinant protein secretion efficiency in gram-positive bacteria: Signal peptide and beyond. Frontiers in Bioengineering and Biotechnology. 7, 139 (2019).
- Lewis, K., Klibanov, A. M. Surpassing nature: rational design of sterile-surface materials. Trends in Biotechnology. 23 (7), 343-348 (2005).
- Betz, W. J., Mao, F., Smith, C. B. Imaging exocytosis and endocytosis. Current Opinion in Neurobiology. 6 (3), 365-371 (1996).
- Mulvihill, D. P. Live cell imaging in fission yeast. Cold Spring Harbor Protocols. 2017 (10), (2017).
- Shaner, N. C., et al. A bright monomeric green fluorescent protein derived from Branchiostoma lanceolatum. Nature Methods. 10 (5), 407-409 (2013).
- Shen, Y., Chen, Y., Wu, J., Shaner, N. C., Campbell, R. E. Engineering of mCherry variants with long Stokes shift, red-shifted fluorescence, and low cytotoxicity. PloS One. 12 (2), e0171257 (2017).
- Periz, J., et al. A highly dynamic F-actin network regulates transport and recycling of micronemes in Toxoplasma gondii vacuoles. Nature Communications. 10 (1), 4183 (2019).
- Qiu, H., et al. Uniform patchy and hollow rectangular platelet micelles from crystallizable polymer blends. Science. 352 (6286), 697-701 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены