Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокопроизводительные поведенческие анализы старения и продолжительности жизни с помощью Lifespan Machine
В этой статье
Резюме
Платформа визуализации «The Lifespan Machine» автоматизирует пожизненное наблюдение за большими популяциями. Мы показываем шаги, необходимые для проведения анализов продолжительности жизни, стрессоустойчивости, патогенеза и поведенческого старения. Качество и объем данных позволяют исследователям изучать вмешательства в старение, несмотря на наличие биологических и экологических вариаций.
Аннотация
Генетически идентичные животные, содержащиеся в постоянной окружающей среде, демонстрируют широкое распределение продолжительности жизни, что отражает большой негенетический, стохастический аспект старения, сохраняющийся у всех изученных организмов. Этот стохастический компонент означает, что для того, чтобы понять старение и определить успешные вмешательства, которые продлевают продолжительность жизни или улучшают здоровье, исследователи должны одновременно наблюдать за большими популяциями экспериментальных животных. Традиционная ручная оценка смертности ограничивает пропускную способность и масштаб, необходимые для крупномасштабной проверки гипотез, что приводит к разработке автоматизированных методов для высокопроизводительных анализов продолжительности жизни. Lifespan Machine (LSM) — это высокопроизводительная платформа визуализации, которая сочетает в себе модифицированные планшетные сканеры с настраиваемым программным обеспечением для обработки изображений и проверки данных для отслеживания нематод в течение всего срока службы. Платформа представляет собой крупный технический прогресс, генерируя данные о продолжительности жизни больших популяций животных с высоким временным разрешением в беспрецедентном масштабе и со статистической точностью и точностью, равными ручным анализам, выполняемым опытными исследователями. В последнее время LSM был усовершенствован для количественной оценки поведенческих и морфологических изменений, наблюдаемых во время старения, и соотнесения их с продолжительностью жизни. В этой статье мы опишем, как спланировать, запустить и проанализировать автоматизированный эксперимент по увеличению продолжительности жизни с помощью LSM. Далее мы выделяем важнейшие шаги, необходимые для успешного сбора поведенческих данных и высококачественных кривых выживаемости.
Введение
Старение – это сложный, многогранный процесс, характеризующийся снижением физиологической функции организма, что приводит к увеличению риска заболеваний и смерти стечением времени1. Продолжительность жизни, измеряемая как время от рождения или начала взрослой жизни до смерти, дает однозначный результат старения2 и косвенный, но строго количественный показатель для измерения относительной скорости старения между популяциями3. Исследования старения часто зависят от точных измерений продолжительности жизни, аналогичных клиническим испытаниям, для сравнения исходов между одной популяцией, подвергшейся вмешательству, и контрольной группой, не подвергшейся воздействию. К сожалению, проблемы воспроизводимости пронизывают все исследования старения, иногда из-за статистически недостаточно мощных экспериментов, а часто из-за присущей анализам продолжительности жизни чувствительности к тонким изменениямв окружающей среде. Робастные эксперименты требуют многократного повторения больших популяций, и этот процесс особенно выигрывает от экспериментальной масштабируемости, предлагаемой автоматизацией6.
Строгие требования к анализу продолжительности жизни проистекают из непредсказуемости самого процесса старения. Изогенные индивидуумы, содержащиеся в одинаковых условиях, демонстрируют разное время смерти и скорость физиологического упадка7, что позволяет предположить, что продолжительность жизни включает в себя высокую степень стохастичности 7,8. Таким образом, большие популяции должны измерять количественные изменения в процессе старения, такие как изменения средней или максимальной продолжительности жизни, и преодолевать систематические ошибки, возникающие из-за индивидуальной изменчивости. Кроме того, возможность проведения высокопроизводительных анализов продолжительности жизни имеет решающее значение для поддержки исследований форм кривых выживания и моделей динамики старения9.
Нематода Caenorhabditis elegans является бесценной моделью для исследований старения из-за ее короткой продолжительности жизни, генетической трактовки и быстрого времени генерации, что подчеркивает ее пригодность для высокопроизводительных анализов старения и продолжительности жизни. Традиционно продолжительность жизни в С. elegans измеряется путем наблюдения за синхронизированной небольшой популяцией из 50-100 животных в течение длительного времени на твердых носителях и записи времени смерти отдельных особей. По мере того, как животные стареют и теряют подвижность, ручная оценка времени смерти требует индивидуального подталкивания животных и проверки незначительных движений головы или хвоста. Обычно это утомительный и трудоемкий процесс, хотя были предприняты усилия, чтобы ускорить его 10,11,12. Важно отметить, что медленные экспериментальные конвейеры препятствуют прогрессу в нашем понимании старения и эффективности проверенных вмешательств.
Чтобы удовлетворить потребности в исследованиях старения для получения количественных данных, было разработано множество технологий для автоматизации сбора данных, в том числе замечательный спектр подходов от микрофлюидных камер до планшетных сканеров13, 14, 15, 16, 17, 18. LSM отличается от других методов своей обширной оптимизацией для сбора высокоточных и точных данных о сроке службы, что достигается за счет разработки тщательных протоколов калибровки оборудования в сочетании с обширным пакетом программного обеспечения, позволяющим пользователям проверять, корректировать и уточнять автоматизированные анализы13. Несмотря на то, что программное обеспечение в принципе может быть применено к различным методам визуализации, на практике большинство пользователей используют планшетные сканеры, модифицированные для обеспечения точного контроля над температурой и влажностью окружающей среды - факторами, имеющими решающее значение из-за их значительного влияния на срокслужбы. LSM делает снимки нематод каждые 20 минут с интервалом от нескольких дней до нескольких месяцев, в зависимости от условий окружающей среды и генотипа. Полученные данные имеют гораздо более высокое временное разрешение по сравнению с данными, полученными при ручном анализе, а собранные изображения обеспечивают постоянную визуальную запись положения нематоды на протяжении всей жизни. Используя методы машинного обучения, каждому человеку автоматически присваивается время смерти. Эти результаты могут быть быстро проверены вручную с помощью клиентского программного обеспечения под названием "Worm Browser". Благодаря своему аппаратному и программному обеспечению, LSM может генерировать кривые выживаемости, которые статистически неотличимы от ручной оценки смертности, проводимой опытными исследователями, с дополнительным преимуществом в виде снижения рабочей нагрузки и более высокой масштабируемости13.
Последняя версия LSM также позволяет изучать поведенческое старение, собирая морфологические и поведенческие данные на протяжении всей жизни нематоды и сообщая о них вместе с продолжительностью жизни каждой особи. В частности, LSM фиксирует время прекращения энергичных движений (VMC) каждого животного, что часто используется для количественной оценки «продолжительности здоровья» индивидуума в отличие от продолжительности его жизни. Одновременно собирая данные о продолжительности жизни и поведенческом старении, LSM поддерживает изучение вмешательств, которые могут оказывать дифференцированное влияние на различные фенотипические исходы старения20 лет. Для изучения поведенческого старения могут быть использованы различные макроскопически наблюдаемые фенотипы, такие как движение тела или перекачивание фарингеза21, целостность тканей22 и скорость движения или поворот, вызванный стимулом17. Сравнение различных фенотипов старения может помочь в анализе причинно-следственной структуры процессов старения. Например, сравнение между VMC и продолжительностью жизни было недавно использовано для характеристики двух различных процессов старения у C. elegans23.
Несмотря на то, что первоначально LSM был разработан для измерения продолжительности жизни у C. elegans, он поддерживает сбор данных о выживаемости и поведении ряда видов нематод, включая C. briggsae, C. tropicalis, C. japonica, C. Бреннери и . Пасификус23. Технология облегчает изучение влияния биологических и экологических вмешательств на продолжительность жизни, стрессоустойчивость и устойчивость к патогенам и может быть связана с экспериментальными инструментами, такими как таргетные анализы РНК-интерференции или ауксин-индуцируемые системы деградации белков. На сегодняшний день он используется в научной литературе для широкого спектра применений 6,24,25,26,27,28,29,30.
В этой статье мы опишем пошаговый протокол выполнения эксперимента Lifespan Machine с использованием агаровых пластин, начиная с начальных этапов экспериментальной установки и заканчивая получением результирующих кривых выживаемости. Отличительной чертой LSM является то, что работа выполняется на начальном этапе, а это означает, что большая часть времени исследователя тратится на экспериментальную установку и, в небольшой степени, на получение изображений после нее. Сбор данных полностью автоматизирован на протяжении всего эксперимента и позволяет исследователю работать без помощи рук. Шаги, описанные здесь, являются общими для многих различных типов тестов на выживание - одна и та же экспериментальная установка выполняется для анализов продолжительности жизни, термотолерантности, окислительного стресса и патогенеза. В разделе «Репрезентативные результаты» мы обсуждаем подмножество данных из недавно опубликованной рукописи, чтобы проиллюстрировать эффективность конвейера анализа и выделить наиболее важные этапы анализа изображений23.
протокол
1. Требования к программному и аппаратному обеспечению
- Планшетные сканеры: В принципе, LSM может быть реализован с использованием различных устройств визуализации. Подробные инструкции по модификации сканера и фокусировке см. в другом месте13. Аппаратное обеспечение LSM показано на дополнительном рисунке 1.
- Инструменты анализа данных: Программное обеспечение LSM состоит из трех взаимодействующих компонентов: пакета программного обеспечения для управления сканером на базе Linux, пакета управления метаданными на основе веб-браузера и пакета программного обеспечения для анализа изображений клиентов Windows и Linux. Обратитесь к инструкции по установке программных средств, опубликованной в репозитории GitHub (https://github.com/nstroustrup/lifespan).
- Программное обеспечение для визуализации и проверки данных: Используйте клиентскую программу Worm Browser для планирования экспериментов, проверки анализа изображений, ручного аннотирования передвижения нематоды и вывода данных о выживаемости. Двоичные исполняемые файлы предоставляются для браузера-червя в Windows 7, Windows 8 и Windows 10, а браузер-червь компилируется из исходного кода в Linux или Apple iOS. Руководство по установке доступно в репозитории GitHub, упомянутом выше.
Дополнительный рисунок 1: Срок службы аппаратного обеспечения машины. Один планшетный сканер с открытой крышкой для отображения загруженных пластин, которые помещаются лицевой стороной вниз в 16 отверстий, вырезанных на резиновом коврике. Резиновый коврик помещается на поверхность стеклянного сканера. Метки для условий написаны на боковых сторонах пластин, чтобы избежать проблем при анализе изображений. Маркировочная лента с номером («1») и/или названием устройства («Jabba») облегчает последующую проверку местоположения образца при работе с несколькими сканерами. Более подробную информацию об аппаратных компонентах LSM можно найти в другом месте13. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
2. Настройка до дня эксперимента
- Калибровка температуры инкубатора: Температура окружающей среды является основным фактором, определяющим C. Продолжительность жизни elegans 19. Чтобы получить точные результаты, выполняйте получение изображений при тщательно откалиброванной температуре, которая поддерживается постоянной на протяжении всего эксперимента. Для этого за несколько дней до начала эксперимента измерьте и откалибруйте температуру поверхности каждого сканера во время работы. Используйте высокоточные термопары, как описано в другом месте31 (см. таблицу материалов).
- Компоновка планшетов сканера: Перед началом эксперимента спланируйте оптимальное расположение планшетов для каждого сканера.
ПРИМЕЧАНИЕ: Это делается для того, чтобы избежать появления искажающих факторов, возникающих в результате изменения температуры между сканерами и по всей поверхности каждого сканера. Сканеры незначительно различаются по средней температуре поверхности и, кроме того, демонстрируют незначительные температурные смещения по всей поверхности31.- Положение пластины сканера: Чтобы контролировать эти тепловые эффекты при последующем анализе данных, рандомизируйте все биологические ковариаты, касающиеся положения сканера, и стандартизируйте расположение пластины на всех сканерах.
- Количество образцов на сканерах: При использовании 16 резиновых ковриков (см. Таблицу материалов) поместите в каждый сканер по четыре пластины для каждого состояния, всего не менее четырех сканеров. Это гарантирует, что каждое условие распределяется между несколькими сканерами, так что искажающие эффекты температуры сканера могут быть идентифицированы и устранены во время анализа данных13. Чтобы упростить этот анализ, включите общее эталонное условие (например, образцы дикого типа) для каждого сканера.
ПРИМЕЧАНИЕ: Как правило, из-за расположения вентиляторов сканера пластины в правом верхнем углу резинового коврика более склонны к высыханию. При необходимости оставьте это место пустым.
- Планшеты и пробоподготовка
- Заливка культуральных планшетов: Для оптимальной сушки планшетов для культуры сканера (см. Таблицу материалов) залить агаровой средой за 4 дня до загрузки нематод. Несмотря на то, что фокусировка сканера регулируется для добавления различных объемов агара в пластины, стандартный объем планшета составляет 8 мл.
ПРИМЕЧАНИЕ: Может быть полезно залить пластины перистальтическим насосом, особенно для больших экспериментов. - Посев пластин: Засейте пластины желаемой бактериальной культурой не менее чем за 2 дня до начала эксперимента, чтобы обеспечить надлежащую сушку и рост бактериального газона. Обычно 200 мкл бактериальной культуры достаточно для формирования газона, который будет кормить 40 нематод в течение нескольких недель.
ПРИМЕЧАНИЕ: Планшеты, обычно используемые для визуализации, более плотно запечатаны, чем стандартные чашки Петри для культивирования; Поэтому рекомендуется высевать и сушить пластины внутри лабораторного колпака, обычно в течение примерно 1 ч или до тех пор, пока они не высохнут должным образом.
- Заливка культуральных планшетов: Для оптимальной сушки планшетов для культуры сканера (см. Таблицу материалов) залить агаровой средой за 4 дня до загрузки нематод. Несмотря на то, что фокусировка сканера регулируется для добавления различных объемов агара в пластины, стандартный объем планшета составляет 8 мл.
- Борьба с нематодами
- Размер популяции: Количество нематод, которые могут быть надежно визуализированы на одной пластине, зависит от генотипа, возраста, в котором нематоды размещены, и количества пищи, добавленной в каждую пластину. Для экспериментов с продолжительностью жизни, которые начинаются в раннем взрослом возрасте, загружайте примерно 40 животных на тарелку. Такое количество обеспечивает достаточное количество пищи и позволяет избежать скопления людей.
- Выращивание больших популяций: Чтобы подготовиться к расширению и синхронизации популяции, начните с популяции нематод, подходящей для выбранного метода синхронизации (см. ниже). Стремитесь выполнить синхронизацию на животных в их возрасте максимальной яйценоскости, который для животных дикого типа N2 составляет 2-й день взрослой жизни32.
Примечание: Еще одна причина для синхронизации популяций с использованием животных на второй день их взрослой жизни заключается в том, чтобы исключить материнский возраст как фактор, способствующий гетерогенности популяции. Возраст матери в С. Было показано, что elegans влияет на несколько признаков приспособленности у потомства, при этом животные дикого типа на 2-й день производят «самое качественное» потомство33. - Выполнение синхронизации по возрасту: Для получения точных результатов синхронизируйте возраст животных как можно точнее. В этом протоколе синхронизация возраста выполняется с использованием модифицированной обработки гипохлоритом34. Другие методы могут включать синхронизацию путем откладки яиц, остановки личинки L1 или ручного отбора личинок L4.
ПРИМЕЧАНИЕ: Для синхронизации возраста с помощью гипохлорита рассчитывайте получить три-четыре яйцеклетки от каждого взрослого гермафродита. - Поддержание популяций, свободных от потомства: Поддержание популяций, свободных от потомства, путем воздействия на нематод на поздней стадии L4 5-фтор-2'-дезоксиуридина (FUdR)35.
ПРИМЕЧАНИЕ: В низких дозах FuDR смертелен для развивающихся эмбрионов, не вызывая макроскопически видимых изменений в зародышевой линии или скорости производства ооцитов. Другие методы включают использование стерильных мутантов, стерилизующих конструкций РНК-интерференции или просто ожидание пострепродуктивного старения, чтобы перенести нематод на планшеты для визуализации. - Перенос популяций: При перемещении тысяч животных между планшетами стандартный протокол, включающий платиново-иридиевую проволоку, становится трудоемким. Методы, включающие жидкую суспензию нематод, облегчают переносы и делают их более эффективными. Соберите нематод с помощью буфера M9 + Mg (Na2HPO4 42,27 мМ, KH2PO4 22,05 мМ, NaCl 85,56 мМ, MgSO4 1 мМ), уменьшите общий объем после того, как нематоды осядут под действием силы тяжести, а затем быстро перенесите нематод на планшеты, используемые для визуализации.
ПРИМЕЧАНИЕ: Перенос нематод с помощью жидкой суспензии может привести к изменению количества животных, переносимых на каждую пластину. Старайтесь соответствовать количеству нематод на каждой пластине, чтобы избежать экспериментальной изменчивости. - Применение вмешательств: Остановка и перезапуск получения изображения во время эксперимента усложняет анализ изображения (см. обсуждение). Поэтому приступайте к экспериментам LSM только после того, как будет завершена вся необходимая обработка нематод.
- Стерилизация резиновых ковриков: Автоклавирование большого количества ковриков одновременно, путем индивидуальной упаковки их в алюминиевую фольгу.
ПРИМЕЧАНИЕ: Резиновые коврики следует стерилизовать между использованиями, чтобы избежать накопления грибковых или бактериальных загрязнителей. Большинство типов обычно используемого каучука разлагаются в результате агрессивной обработки этанолом.
3. Настройка в день эксперимента
- Подставка для пластин и подготовка стекла сканера: Для упрощения работы с планшетами не загружайте чашки Петри непосредственно на поверхность сканера, а удерживайте их на месте с помощью резиновых ковриков, поддерживаемых стеклянными панелями (см. Таблицу материалов). Популяции визуализируются через это стекло, поэтому содержите стекло в чистоте и обрабатывайте его антизапотевающим, гидрофобным и стерилизующим покрытием (см. Таблицу материалов).
- Перед загрузкой пластин в инкубатор очистите поверхность опорного стекла пластины с обеих сторон средством для мытья стекол против запотевания.
- Перед загрузкой пластин на опорное стекло нанесите защитную гидрофобную обработку стекла (см. Таблицу материалов), чтобы свести к минимуму запотевание на той стороне стекла, которая будет контактировать с резиновым ковриком. Хорошо распределите эту процедуру и оставьте на стекле на 5-10 минут, прежде чем переходить к следующему шагу. Энергично очистите после нанесения, чтобы удалить остатки.
- Нанесите 70% этиловый спирт для дезинфекции поверхности стекла, которая будет контактировать с резиновым матовым покрытием. Оставьте на 1 минуту или 2 минуты, а затем удалите тканью или бумажным полотенцем.
- Загрузка пластин на сканеры
- Сначала положите автоклавные резиновые коврики поверх обработанного опорного стекла пластины.
- Снимите крышку с пластин, используемых для визуализации с загруженными нематодами, и положите их на резиновый коврик лицом к стеклянной поверхности. Убедитесь, что резиновый коврик плотно прилегает ко всем пластинам, например, добавив сверху еще один стеклянный лист и убедившись, что он лежит ровно, или постукивая по верхней части каждой тарелки (свободные пластины будут слегка двигаться и ударяться о стекло, издавая звук, в то время как плотно закрепленные пластины не будут двигаться при постукивании).
ПРИМЕЧАНИЕ: Полезно индивидуально маркировать каждый лист опорного стекла маркировочной лентой с информацией о содержимом пластины и предполагаемом сканере. Эти данные могут быть использованы после эксперимента для разрешения любых потенциальных неясностей в отношении расположения пластин. - Перед загрузкой пластин в сканеры отключите вентиляторы сканера, чтобы защитить пальцы экспериментатора во время загрузки планшетов.
- Осторожно сдвиньте пластины и поддерживающий их стеклянный лист на поверхность сканера.
ПРИМЕЧАНИЕ: Не давите непосредственно на резиновый коврик, так как это приводит к скольжению коврика по стеклу опоры пластины. Когда маты скользят, пластины часто выбивают из коврика. - Снова включите вентиляторы сканера и визуально убедитесь, что передний и боковой вентиляторы включены. Если сканеры выключены, включите их на этом этапе.
4. Предварительное получение изображения
ПРИМЕЧАНИЕ: На рисунке 1 показана комплексная блок-схема, объединяющая все программные этапы получения изображения.
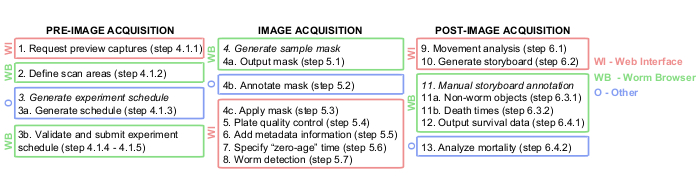
Рисунок 1: Графический обзор конвейера анализа изображений Lifespan Machine. Этапы до, во время и после получения изображений в основном выполняются в веб-интерфейсе (WI, красный) и в браузере Worm Browser (WB, зеленый). Некоторые действия выполняются на других платформах (O, синим цветом), например в документах TXT на шаге 3a, Photoshop или эквиваленте на шаге 4b и JMP или эквиваленте на шаге 13. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Настройка получения изображений: создание файла с указанием графика эксперимента и расположения пластин на каждом сканере для настройки получения изображения.
ПРИМЕЧАНИЕ: Этот файл содержит важные метаданные, такие как название эксперимента, частота захвата изображений и общая продолжительность эксперимента. Как правило, этот файл не генерируется de novo для каждого эксперимента, но вместо этого в качестве шаблонов повторно используются файлы экспериментов из предыдущих экспериментов. Для первого эксперимента пользователя предоставляется файл шаблона (Дополнительный файл 1).- Запрос снимков предварительного просмотра: укажите расположение всех пластин на каждом сканере. Для ускорения этого процесса предусмотрено несколько инструментов. Во-первых, с помощью сканера получите изображение всей поверхности сканера, которое называется «Предварительный просмотр». Убедитесь в том, что на изображениях предварительного просмотра четко видна вся поверхность каждой пластины (рис. 2A) без полос или обрезки кромок пластин.
- С помощью веб-интерфейса найдите на главной странице раздел «Получение изображений » и перейдите по ссылке «Устройства захвата и серверы изображений». На этой странице нажмите кнопку с пометкой «Поиск новых устройств (т.е. сканеров)» в поле «Серверы захвата и обработки изображений ». Следите за ходом работы сервера по обнаружению сканеров, нажав на ссылку [log] рядом с сервером.
ПРИМЕЧАНИЕ: Перед выполнением этого шага убедитесь, что нужные сканеры включены и подключены к серверу. - На той же странице веб-интерфейса убедитесь, что каждый сканер, подключенный к серверу, отображается в поле Устройства захвата изображений . Метка «Отсутствует» в разделе «Текущее состояние» больше не отображается, если устройство успешно обнаружено. Установите флажок, соответствующий каждому сканеру, содержащему только что загруженные пластины.
- В нижней части раздела «Устройства захвата изображений » нажмите кнопку «Запросить предварительный захват». В течение 1 минуты или 2 минут сканеры должны загореться и начать сканирование.
ПРИМЕЧАНИЕ: Начальное положение стеклянных опорных листов часто должно быть отрегулировано, чтобы привести все пластины в видимый диапазон. Положения можно скорректировать, проверив изображения предварительного просмотра, внеся корректировки в положение пластины и повторно сделав новые изображения предварительного просмотра. Если сканирование выполняется очень медленно (несколько минут для одного сканирования) или если изображения предварительного просмотра содержат длинные белые полосы, это признак того, что пластина, резиновый коврик или какой-либо другой объект блокируют свет в области калибровки сканера (обозначается белыми стрелками на поверхности сканера). Все объекты должны быть перемещены таким образом, чтобы только стеклянное опорное стекло занимало эту область.
- С помощью веб-интерфейса найдите на главной странице раздел «Получение изображений » и перейдите по ссылке «Устройства захвата и серверы изображений». На этой странице нажмите кнопку с пометкой «Поиск новых устройств (т.е. сканеров)» в поле «Серверы захвата и обработки изображений ». Следите за ходом работы сервера по обнаружению сканеров, нажав на ссылку [log] рядом с сервером.
- Определение областей сканирования: Выполните следующие шаги в браузере Worm Browser, чтобы проанализировать изображения предварительного просмотра и собрать их в единое составное изображение, которое используется для указания местоположения каждой пластины для анализа данных. Убедитесь, что полученное изображение выглядит примерно так, как показано на рисунке 2B.
- Во-первых, с помощью браузера Worm откройте каждое изображение для предварительного просмотра, выбрав пункт меню File > Open Image, и выберите нужное изображение.
- На каждом изображении щелкните, чтобы выбрать столбцы для областей с пластинами (если резиновый коврик имеет 16 мест расположения пластин, выберите 4 столбца).
ПРИМЕЧАНИЕ: Области сканирования должны быть указаны в виде высоких столбцов (а не широких строк), так как сканирование сканером происходит медленнее для более широких областей, что приводит к размытым изображениям из-за движения нематоды. - После того, как все изображения определены, экспортируйте спецификации регионов на диск, выбрав пункт меню Получение изображений > Определить области сканирования > Сохранить выбранные области сканирования на диск и выбрав нужное местоположение.
- Создайте расписание эксперимента:
- В соответствии с форматом Дополнительного файла 1 соберите файл, содержащий название эксперимента, физическое расположение каждого столбца на сканерах (скопированное из файла областей сканирования, созданного на шаге 4.1.2.3), общую продолжительность эксперимента и частоту захвата изображения, и сохраните его как в формате TXT, так и в виде XML-файла.
- Затем в браузере Worm нажмите Image Acquisition > Submit Experiment Schedule и выберите сгенерированный XML-файл. Браузер червей спросит, следует ли вывести сводку по расписанию или запустить эксперимент. Нажмите «Создать сводный файл».
- Проверка сводного файла: После отправки расписания эксперимента браузер червей выдаст сводку по расписанию. Эта сводка отображается на экране и записывается на диск. Прочтите его и проверьте даты запланированных снимков, а также местоположение, название и количество сканеров.
- Отправить расписание эксперимента: Если вы удовлетворены итоговым файлом, снова загрузите XML-файл с расписанием эксперимента в браузер Worm, выбрав пункт меню Image Acquisition > Submit Experiment Schedule. Браузер червей во второй раз выдаст запрос на вывод сводки по расписанию или на запуск эксперимента. На этот раз нажмите « Выполнить!».
ПРИМЕЧАНИЕ: Через несколько минут после отправки эксперимента целесообразно использовать веб-интерфейс, чтобы подтвердить, что эксперимент был успешно отправлен и сканы собираются всеми сканерами. Как правило, первые несколько сканирований пропускаются, особенно в крупных экспериментах. - Организуйте эксперименты в веб-интерфейсе: загруженный кластер сканеров может производить сотни экспериментальных наборов данных, собранных множеством разных пользователей. Чтобы упорядочить этот список, назначьте эксперименты отдельным группам, например, соответствующим имени пользователя, ответственного за эксперимент.
- Создайте новую группу или измените существующую: Создайте новые группы в веб-интерфейсе, нажав « Управление группами экспериментов » в поле «Получение изображений». На появившейся новой странице добавьте нужное имя в поле «Создать новую группу » и нажмите « Создать». Чтобы изменить имя существующей группы, в том же поле выберите нужную группу рядом с пунктом Изменить существующую группу, а затем нажмите кнопку Изменить.
- Назначить эксперименты группе: Чтобы назначить новые эксперименты определенной группе, перейдите в веб-интерфейс и найдите нужный эксперимент, который по умолчанию будет отнесен к группе Без группы в нижней части списка экспериментов. Нажмите на ссылку в правой части раздела эксперимента с надписью «Изменить» и в раскрывающемся списке выберите имя группы, которую хотите использовать. Затем нажмите кнопку Сохранить.
- Отмена эксперимента:
ПРИМЕЧАНИЕ: LSM будет продолжать работать автономно до тех пор, пока окончательные результаты сканирования не будут указаны в расписании эксперимента. После завершения экспериментального расписания LSM по умолчанию продолжает собирать сканы, но немедленно отбрасывает данные изображения в процессе, называемом автосканированием. Эти автоматические сканирования выполняются для предотвращения выключения и охлаждения сканеров, а также для поддержания стандартного температурного профиля, чтобы выключение других сканеров не повлияло на другие эксперименты, выполняемые в том же пространстве (но из другого эксперимента).- Остановить автосканирование: Чтобы остановить автосканирование в текущем эксперименте в веб-интерфейсе, нажмите «Изменить » рядом с нужным экспериментом, затем «Отменить ожидающие проверки» и выберите «Отменить запланированные записи».
- Запрос снимков предварительного просмотра: укажите расположение всех пластин на каждом сканере. Для ускорения этого процесса предусмотрено несколько инструментов. Во-первых, с помощью сканера получите изображение всей поверхности сканера, которое называется «Предварительный просмотр». Убедитесь в том, что на изображениях предварительного просмотра четко видна вся поверхность каждой пластины (рис. 2A) без полос или обрезки кромок пластин.
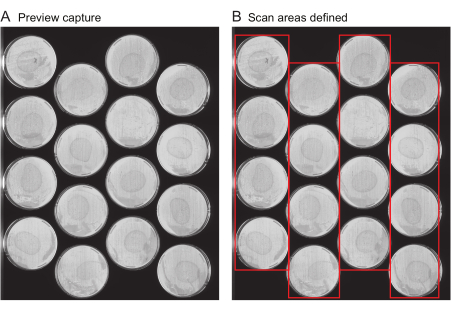
Рисунок 2: Предварительный просмотр изображения и выбор области сканирования. (A) Для каждого сканера в эксперименте создается изображение предварительного захвата. (B) Выбор одного ряда пластин за раз (красные прямоугольники), что увеличивает скорость сканирования и предотвращает размытие движения червячка в результате слишком широких областей сканирования. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
5. Получение изображения
ПРИМЕЧАНИЕ: Следующие шаги можно выполнять как во время выполнения эксперимента, так и после его завершения.
- Выведите файл маски эксперимента: Необработанные данные изображения со сканеров содержат множество областей, которые не нужно обрабатывать (области за пределами пластин). Для фокусировки анализа на каждой пластине в отдельности создается «маска», которая определяет площадь, занимаемую каждой пластиной на каждом сканере. Создайте эту маску, нарисовав положение каждой пластины в виде наложения на изображения, собранные сканерами.
- С помощью браузера Worm выберите нужный эксперимент, выбрав «Файл» > «Выбрать текущий эксперимент», а затем нажмите на название эксперимента.
- Снова в браузере Worm Browser выберите Image Acquisition > Define Sample Masks > Generate Experiment Mask Composite и сохраните маску в нужном месте. Убедитесь, что полученный файл выглядит примерно так, как показано на рисунке 3A.

Рисунок 3: Спецификация расположения пластин для каждого сканера с использованием масок образцов. Чтобы обеспечить независимый анализ пластин в пределах выборок столбцов, показанных на рисунке 1, отдельные пластины должны быть идентифицированы путем создания композитной маски изображения. (A) Снимок сканов сканеров открывается с помощью программного обеспечения для обработки изображений (обратите внимание на название сканера «han» над отсканированной выборкой и «a-d», относящееся к каждой из колонок). (B) Отдельные шаги создания маски для обозначения местоположения каждой пластины в композитной маске требуют, чтобы фон был установлен на черный цвет, (C) удаление неровных краев и краев невыбранных пластин путем расширения, а затем сжатия фона, и (D) выбор пластин переднего плана и заполнение областей полностью белыми пикселями.) Для того, чтобы LSM распознавал отдельные пластины в сканируемых строках, каждая белая область в ряду заполняется другим оттенком серого, обычно с возрастающей яркостью. (F) На этом этапе маска сохраняется (сжатие LZW без указания слоев, если оно сгенерировано в Photoshop). Затем маска сканируется браузером Worm Browser, и программное обеспечение генерирует визуализацию маски. Правильная визуализация маски должна отображать один определенный квадрат на пластину с маленьким крестиком в центре и разным цветом для каждого ряда. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Аннотирование маски эксперимента: Откройте файл, созданный на предыдущем шаге, с помощью программы для работы с изображениями (например, Photoshop или GIMP), чтобы отметить расположение каждой пластины на изображении. Обзор всех этапов редактирования масок с помощью Photoshop описан ниже.
- В Photoshop выберите инструмент «Заливка » с нулевым допуском, выбранным параметром «Смежный» и снятым флажком «Сглаживание». Нажмите на серый фон, чтобы сделать его полностью черным. Убедитесь, что полученное изображение выглядит примерно так, как показано на рисунке 3B.
- С помощью инструмента «Волшебная палочка» выделите черный фон с выключенным сглаживанием, нулевым допуском и выбранным параметром «Смежный». Чтобы сгладить края, расширьте выбранный фон на 30 пикселей, нажав на Выделить > Изменить > Развернуть. Затем уменьшите выделение на 20 пикселей с помощью Выбрать > изменить > контракте. Убедитесь, что полученное изображение выглядит примерно так, как показано на рисунке 3C.
- Полностью заполните сглаженный фон черными пикселями, например, установив допуск инструмента «Заливка » на 255 и заполнив выбранную область. Затем нажмите на Выделить > Инвертировать , чтобы инвертировать выделение, и выберите передний план. Заполните новую область полностью белыми пикселями, например, установив допуск инструмента заливки равным 255 и заполнив область белым. Убедитесь, что полученное изображение выглядит примерно так, как показано на рисунке 3D.
- Чтобы отделить каждую пластину внутри одной области, заполните каждую строку разным градиентом серого с возрастающей яркостью. Это можно сделать с помощью инструмента «Заливка», а затем выбрав нужный цвет с допуском, установленным на 0. Убедитесь, что полученное изображение выглядит примерно так, как показано на рисунке 3E. Сохраните его в сжатии LZW без указания "Layers".
ПРИМЕЧАНИЕ: Порядок пластин задается цветом указанных областей. Чтобы назвать таблички 1-4 в порядке сверху вниз, укажите цвета с возрастающей яркостью для каждой строки. - В браузере Worm выберите Image Acquisition > Define Sample Masks > Analyze Plate Locations Draw on Experiment Mask Composite и выберите файл, созданный на предыдущем шаге. Теперь программе потребуется несколько секунд для анализа отправленной маски.
- Браузер червей отобразит визуализацию маски. Проверьте маску на наличие возможных ошибок в файле. Убедитесь, что каждый ряд пластин заполнен разным цветом и обведен цветным прямоугольником. Убедитесь, что полученное изображение выглядит примерно так, как показано на рисунке 3F.
ПРИМЕЧАНИЕ: Если на одной пластине изображено два или более кругов, или если два круга имеют одинаковый цвет, вернитесь к шагу 5.2, чтобы исправить файл маски, и снова загрузите его в браузер Worm. - Убедившись в правильности визуализации маски, в браузере Worm выберите Image Acquisition > Define Sample Masks > Submit Analyze Experiment Mask Composite to Cluster. Теперь сервер анализа изображений проанализирует расположение всех пластин в эксперименте.
- Применение маски: LSM использует маски для разделения необработанных данных изображения на отдельные пластины. Чтобы начать этот процесс, запланируйте задание приложения маски с помощью веб-интерфейса.
- Перед отправкой задания убедитесь, что все сканеры определили области в маске. Перейдите на главную страницу веб-интерфейса, найдите название эксперимента и столбец «Анализ изображений» и нажмите « Запустить анализ». Убедитесь, что все устройства в разделе Экспериментальные образцы имеют идентифицированные регионы.
- Чтобы применить маску, в том же интерфейсе нажмите на New Job for All Samples. В поле «Запланировать задание для отдельных изображений» установите флажок «Применить маску», а затем — «Сохранить задание».
ПРИМЕЧАНИЕ: Маска будет применена ко всем уже снятым изображениям, а также к любым изображениям, снятым в будущем.
- Выполнение контроля качества пластин:
ПРИМЕЧАНИЕ: Пластины, подверженные загрязнению, высыханию или запотеванию, подвергаются цензуре на этом этапе анализа изображений. Пример загрязненных, высохших, запотевших и оптимальных пластин показан на рисунке 4. Другие причины цензуры включают голод, пустые тарелки или личинки в стерильных популяциях. Недействительные пластины часто содержат сложные формы, которые машина стремится интерпретировать как нематоды. На этом этапе важно исключить недействительные пластины, чтобы предотвратить длительное время обработки на последующих этапах анализа изображения.- Используя веб-интерфейс, исключите пластины, подлежащие цензуре, найдя нужный эксперимент и столбец с именем «Аннотировать информацию о пластине » и выбрав «По изображению».
- Чтобы осмотреть пластины, нажмите « Показать изображения».
ПРИМЕЧАНИЕ: Если шаг для отображения изображений работает неправильно, возможно, сервер Linux настроен неправильно. Инструкции о том, как это сделать, доступны в руководстве по установке программного обеспечения в вышеупомянутом репозитории GitHub. - Чтобы исключить таблички, установите флажок «Цензор», выберите в выпадающем списке вариант «Причина цензуры», а затем нажмите « Сохранить» для каждой страницы.
- Добавление информации о метаданных: Метаданные описывают содержимое каждой пластины в эксперименте. Эта информация затем включается во все последующие файлы статистических данных.
- Чтобы добавить метаданные о штамме, генотипе, температуре, питании и т.д., перейдите на главную страницу веб-интерфейса, найдите нужный эксперимент и столбец Annotate Plate Information, и выберите By Position.
- Введите метки и выберите сканеры, для которых нужно сохранить метаданные, нажав « Сохранить на устройства » в левом нижнем углу.
- Чтобы повторно использовать метаданные между разными сканерами без необходимости повторного ввода всех меток, перейдите в раздел «Загрузить с устройства » в правом верхнем углу, выберите сканер, с которого нужно повторно использовать метаданные, и нажмите «Загрузить с устройства».
- Укажите время "нулевого возраста": По умолчанию LSM измеряет время по отношению к началу эпохи UNIX. Это редко бывает удобно, поэтому требуется указание эталонного времени (например, даты, когда все особи вылупились или достигли взрослого возраста).
- Чтобы указать информацию о нулевом возрасте, перейдите на главную страницу веб-интерфейса, найдите нужный эксперимент и столбец с именем «Анализ изображений» и выберите «Запустить анализ».
- На появившейся новой странице выберите Новое задание для всех регионов. В поле «Обновить информацию о регионе» выберите «Время, в которое возраст животных был равен 0», добавьте информацию и нажмите « Обновить выбранные поля».
ПРИМЕЧАНИЕ: Если у всех животных разное время нулевого возраста, выберите вместо этого Новое задание для определенных типов животных и повторите описанные выше шаги для каждой группы.
- Запланируйте обнаружение червей: LSM может автоматизировать обнаружение каждой нематоды в зависимости от ее положения на планшете.
- Чтобы запустить автоматическое обнаружение нематод для каждого изображения, перейдите на главную страницу веб-интерфейса, найдите нужный эксперимент и столбец «Анализ изображений» и выберите «Запустить анализ».
- На появившейся новой странице нажмите « Новое задание для всех регионов», затем поле «Запланировать задание для отдельных образов» и установите флажки «Медианный фильтр > порог» > «Обнаружение червей > «Сохранить задание». Эти задания будут применены ко всем прошлым и будущим снимкам.
ПРИМЕЧАНИЕ: Для того, чтобы запланировать задание только для определенного штамма или состояния, нажмите вместо этого на Задания для определенных типов животных. Классификация объектов выполняется с помощью SVM-моделей, которые задаются в виде файлов, хранящихся во вложенной папке Models каталога долгосрочного хранения LSM. Наборы параметров обнаружения нематод версии 2.0 для LSM можно скачать из репозитория GitHub.
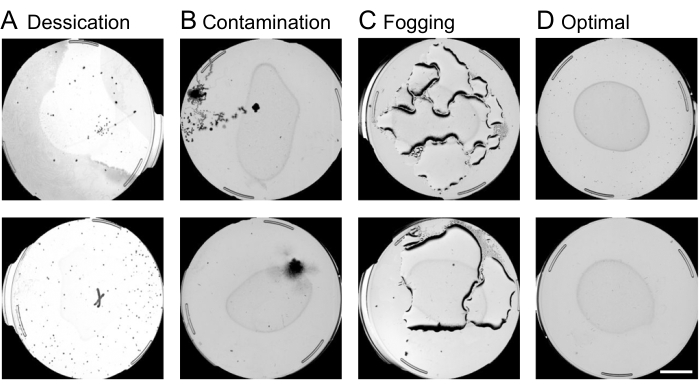
Рисунок 4: Контроль качества пластин с помощью веб-интерфейса. Цензура неоптимальных пластин в веб-интерфейсе перед анализом движения червяка имеет решающее значение для ускорения процесса обработки изображений. Примерами пластин, подлежащих удалению, являются условия (А) высыхания, (Б) загрязнения или (В) запотевания. (D) Оптимальные пластины, которые должны быть включены в дальнейший анализ. Масштабная линейка 10 мм накладывается на изображение предварительного просмотра. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
6. Получение постизображений
ПРИМЕЧАНИЕ: После того, как обнаружение червей завершено, все данные, собранные в ходе эксперимента, должны быть агрегированы с течением времени, чтобы отслеживать каждую особь на протяжении всей ее жизни и определять время смерти всех особей. Подождите, пока все животные в эксперименте не умрут и пока не будут завершены все задания по обнаружению червей, а затем выполните следующие действия:
- Запланируйте анализ движения:
- Анализ движений интегрирует все экспериментальные данные с течением времени для оценки времени смерти. Чтобы начать это задание, перейдите на главную страницу веб-интерфейса и найдите нужный эксперимент в столбце «Анализ изображений». Выберите ссылку Run Analysis.
- На появившейся новой странице нажмите на ссылку New Job for All Regions и в раскрывающемся меню Scheduled a Job for an Whole Region выберите Analyze Worm Movement и нажмите кнопку Save Job.
- Сервер получения изображений LSM автоматически начнет анализировать движение по всем пластинам.
ПРИМЕЧАНИЕ: Анализ движения является самой большой работой. На современном многоядерном процессоре анализ каждой пластины из эксперимента продолжительностью 1 месяц может занимать 20 минут и более.
- Создание раскадровки: После завершения анализа движения раскадровка LSM позволяет пользователям вручную проверить автоматизированные результаты и убедиться, что программное обеспечение делает правильные предположения о морфологии и поведении нематоды.
- На главной странице веб-интерфейса найдите нужный эксперимент и столбец «Анализ изображений» и выберите «Запустить анализ». На появившейся новой странице нажмите « Новое задание эксперимента». Затем в разделе Запланировать задание для всего региона выберите Создать раскадровку животного и нажмите кнопку Сохранить задание.
- После того как LSM завершит создание раскадровки, перейдите в браузер Worm и выберите нужный эксперимент. Вернитесь в главное меню, выберите «Проверка» > «Просмотреть весь эксперимент > сразу после смерти каждого червя».
- Аннотирование раскадровок в браузере Worm: Типичная раскадровка в браузере Worm должна выглядеть следующим образом: Рисунок 5.
- Аннотирование объектов, не являющихся червями
ПРИМЕЧАНИЕ: Каждый объект, обнаруженный во время движения, отображается на раскадровке, упорядоченной по предполагаемому времени смерти. Если пользователь не укажет иное, каждый объект будет включен в результирующие кривые выживания. Классификация объектов LSM намеренно откалибрована таким образом, чтобы иметь высокий уровень ложноположительных результатов, чтобы свести к минимуму количество необнаруженных нематод. Исключение объектов, не являющихся червями, важно для получения высококачественных кривых выживаемости (см. репрезентативные результаты). На первой и последней страницах раскадровки обычно обнаруживается большое количество объектов, не являющихся червями, которые можно быстро исключить вручную.- Чтобы исключить объекты, не являющиеся червями, на раскадровке, щелкните правой кнопкой мыши изображение объекта. Теперь исключенный объект будет обведен белым прямоугольником. Чтобы исключить несколько объектов одновременно, удерживайте клавишу Control и щелкните правой кнопкой мыши один раз любой объект, и все объекты на странице раскадровки будут исключены.
- После исключения объекта из анализа этот объект можно снова включить, дважды щелкнув правой кнопкой мыши.
- Чтобы сохранить аннотации, сделанные во время раскадровки, нажмите на кнопку Сохранить . Рекомендуется часто сохранять ход выполнения при аннотировании.
- Аннотируйте время смерти:
ПРИМЕЧАНИЕ: Без вмешательства пользователя LSM точно оценивает время смерти для большинства групп населения. Тем не менее, рекомендуется регулярно подтверждать точность автоматических результатов, вручную проверяя случайную выборку людей из каждого эксперимента. Особое внимание следует уделять самым короткоживущим и самым долгоживущим особям, так как любые ошибки в автоматизированном анализе имеют тенденцию группироваться в этих группах.- Щелкните левой кнопкой мыши один раз любой объект раскадровки, чтобы открыть новое окно, в котором отображаются подробные сведения о временных рядах этого объекта. Это окно позволяет просматривать все изображения объекта, собранные в ходе эксперимента, а также количественно оценивать динамику и морфологию движения объекта. Используя тот же интерфейс, вручную аннотируйте время смерти. Интерфейс для аннотации времени смерти показан на рисунке 6.
- Чтобы вручную аннотировать время смерти, щелкните левой кнопкой мыши по нижней панели в точке, соответствующей времени смерти. Используйте пробел и стрелки вправо или влево на клавиатуре для перемещения по временным рамкам или нажмите непосредственно на строку на нужном временном интервале.
ПРИМЕЧАНИЕ: Визуализация представляет состояние движения животных с течением времени, как горизонтальная гистограмма с отметкой времени по оси X. Розово-фиолетовая часть указывает на период времени, в течение которого объект активно движется, желтый — на слабое движение, красный — на неподвижных животных, а зеленый — на период расширения, связанного со смертью. Нематоды демонстрируют характерные морфологические события, связанные со смертью: постепенное сокращение тела, обычно происходящее перед смертью, за которым следует быстрое расширение тела во время или сразу после смерти (рис. 6B). Объекты, не являющиеся червями, такие как пыль или тени, не демонстрируют такой динамики в размерах тела, а вместо этого, как правило, следуют линейному, постепенному изменению размера и интенсивности с течением времени. Эта различная динамика размеров тела обеспечивает быстрый и простой метод быстрой классификации и ручного исключения. - В зависимости от подхода к анализу, время смерти можно рассматривать либо как время прекращения движения (начало красной полосы в визуализации движения), либо как время связанного со смертью расширения (зеленая полоса в визуализации движения). Чтобы вручную аннотировать события сжатия и расширения, щелкните правой кнопкой мыши по нижней панели на нужном временном интервале.
- Некоторые элементарные визуализации данных о смертности встроены в клиент браузера-червя. Кривые выживаемости и диагностика времени смерти показаны для каждой популяции, присутствующей в раскадровке (рис. 7). Посмотрите на кривые выживаемости в левой части и диаграмму рассеяния, сравнивающую время прекращения энергичного движения (VMC) со временем смерти каждой особи в правой части раскадровки.
ПРИМЕЧАНИЕ: Эти результаты можно сгруппировать в соответствии с различными экспериментальными параметрами, установив на нижней панели поднастройки для таких условий, как определенные деформации, сканеры или пластины. Отдельные черви могут быть выбраны в зависимости от времени их смерти, щелкнув левой кнопкой мыши по отдельным точкам на графике зависимости VMC от времени смерти.
- Аннотирование объектов, не являющихся червями
- Запись данных о смертности на диск: LSM создает данные о смертности в виде файлов CSV. Постройте выходные кривые выживаемости и проанализируйте их с помощью любого статистического программного обеспечения, такого как R, SAS, STATA или JMP.
- Чтобы сгенерировать эти файлы, выберите эксперимент в браузере Worm и в меню выберите Data Files, Death Times, а затем нажмите Generate Death Times for Current Experiment. LSM сгенерирует выходной файл с данными о выживаемости эксперимента, который будет сохранен в каталоге results.
- Если в раскадровке были выполнены рукописные аннотации, в браузере Worm появится запрос на обработку рукописных аннотаций. Нажмите «Немедленно», чтобы включить рукописные аннотации в выходной файл времени смерти.
ПРИМЕЧАНИЕ: Файлы данных о смертности записываются в каталог результатов, указанный в файле imageserver.ini. Пишутся различные файлы, но наиболее часто используемой версией является "survival_simple/survival=machine_hand", которая включает в себя все ручные аннотации, сделанные с помощью раскадровки. - Анализируйте данные о смертности в выбранном статистическом программном обеспечении.
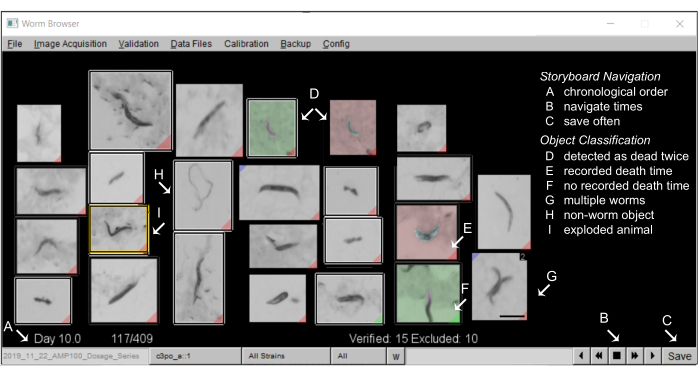
Рисунок 5: Раскадровка животного в браузере червей. (А) Все неподвижные черви показаны в хронологическом порядке времени смерти, аннотированного машиной. Для навигации по раскадровке нажимайте кнопки в правом нижнем углу (B) и (C) часто сохраняйте аннотации. (D) На изображениях с несерым фоном изображены два случая смерти червей (ранняя смерть зеленым цветом, поздняя смерть красным), которые могут произойти, когда два червя умирают близко друг к другу, или когда мертвые черви перемещаются проходящим червем и, таким образом, обнаруживаются как мертвые дважды. (E) Красная метка в нижнем углу изображения идентифицирует червей с обнаруженным временем смерти; (F) зеленая метка указывает на то, что объект не оставался неподвижным достаточно долго, чтобы зафиксировать время смерти. (G) Несколько червей в одном кадре могут быть помечены нажатием клавиши Shift и щелчком левой кнопки мыши. (H) Объекты, не являющиеся червями, исключаются из анализа щелчком правой кнопкой мыши. (I) Взорвавшиеся черви исключаются из анализа путем нажатия на соответствующее изображение (открывается окно аннотации от руки) и нажатия клавиши Shift и щелчка правой кнопкой мыши до тех пор, пока не появится сообщение «Животное взорвалось». Масштабная линейка 0,5 мм и метки накладываются на снимок экрана окна браузера-червя. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
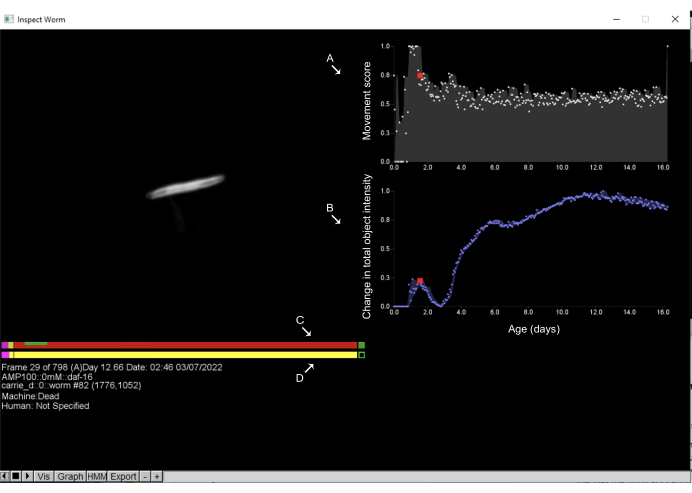
Рисунок 6: Проверка объектов и аннотация времени смерти в браузере Worm Browser. Щелчок левой кнопкой мыши по любому объекту на раскадровке Worm Browser открывает новый интерфейс и позволяет пользователю проверить динамику движения объекта. С правой стороны отображается оценка движения (A), которая количественно оценивает движение объекта; Это оценивается по изменению интенсивности пикселей между последовательными наблюдениями. Кроме того, с правой стороны (B) отображается изменение общей интенсивности объекта, которое количественно определяет изменения размера объекта. С левой стороны верхняя полоса показывает (C) оценку времени смерти, в то время как нижняя полоса представляет собой заметку (D), сделанную вручную человеком. Щелчок по любой точке полосы и нажатие клавиши пробела позволяет пользователю перемещаться по временным рамкам, в которых был изображен червь. На этих полосах розовый цвет представляет время, проведенное в энергичном движении, красный — время, проведенное в смерти, а желтый — все, что находится между ними. Зеленым цветом показано время, затраченное на расширение и сжатие после времени смерти. Метки накладываются на снимок экрана окна браузера-червя. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
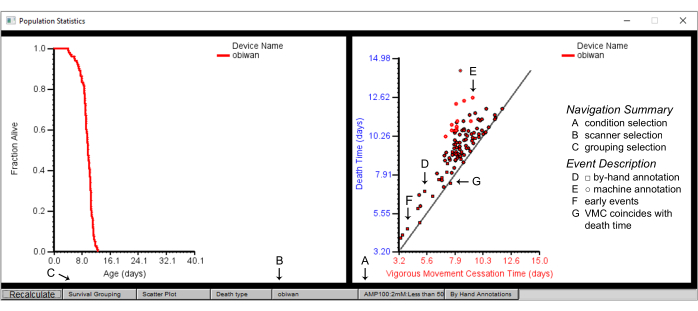
Рисунок 7: Сводная статистика популяции в браузере Worm Browser. Популяционная статистика для сканера «обиван» с графиком выживаемости (левая панель) и диаграммой рассеяния времени прекращения энергичного движения (VMC) в зависимости от времени смерти (правая панель). На графике показаны детали (А) одного условия, полученного с помощью (Б) одного сканера, достигнутого путем предварительного выбора (С) группировки выживаемости по штамму. (D) Квадратные фигуры на точечной диаграмме изображают события, аннотированные вручную, в то время как (E) круглые фигуры изображают события, аннотированные машиной. (F) Рукописное аннотирование часто требуется для случаев смерти, которые происходят рано, или (G) для тех, когда время прекращения энергичных движений совпадает со временем смерти. Метки накладываются на снимок экрана окна браузера-червя. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Результаты
Экспериментальная воспроизводимость в анализах продолжительности жизни является сложной задачей и требует как строго контролируемых экспериментальных условий, так и больших популяций для достижения достаточного статистического разрешения 4,36. LSM уни?...
Обсуждение
Здесь мы предоставляем подробный, доступный протокол для выполнения эксперимента с использованием последней версии Lifespan Machine. Мы показали, что критическим шагом для получения хорошо разрешенных кривых выживаемости является ручное исключение объектов, не являющихся червями, во время ?...
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Мы благодарим Джулиана Серона (Julian Ceron) и Джереми Висенсио (Jeremy Vicencio) (IDIBELL Barcelona) за получение аллеля rpb-2 (cer135). Этот проект был профинансирован Европейским исследовательским советом (ERC) в рамках программы исследований и инноваций Европейского союза «Горизонт 2020» (Соглашение о гранте No 852201), Министерством экономики, промышленности и конкурентоспособности Испании (MEIC) в партнерстве с EMBL, Centro de Excelencia Severo Ochoa (CEX2020-001049-S, MCIN/AEI /10.13039/501100011033), Программой CERCA / Женералитат Каталонии, премией MEIC Excelencia BFU2017-88615-P, и премия Фонда Гленна по медицинским исследованиям.
Материалы
| Name | Company | Catalog Number | Comments |
| 1-Naphtaleneacetic acid (Auxin) | Sigma | N0640 | Solubilize Auxin in 1M potassium hydroxide and add into molten agar |
| 5-fluoro-2-deoxyuridine (FUDR) | Sigma | F0503 | 27.5 μg/mL of FUDR was used to eliminate progeny from populations on UV-inactivated bacteria |
| Glass cleaner | Kristal-M | QB-KRISTAL-M125ml | |
| Hydrophobic anti-fog glass treatment | Rain-X Scheibenreiniger | C. 059140 | |
| Rubber matt | Local crafstman | Cut on a high-strength EPDM rubber sheet stock | |
| Scanner glass | Local hardware supplier | 9" x 11.5" inch glass sheet | |
| Scanner plates | Life Sciences | 351006 | 50 mm x 9 mm, polystyrene petri dish |
| USB Reference Thermometer | USB Brando | ULIFE055500 | For calibrating temperature of scanners |
Ссылки
- Harman, D. The aging process: Major risk factor for disease and death. Proceedings of the National Academy of Sciences of the United States of America. 88 (12), 5360-5363 (1991).
- Vaupel, J. W. Biodemography of human ageing. Nature. 464 (7288), 536-542 (2010).
- Mair, W., Goymer, P., Pletcher, S. D., Partridge, L. Demography of dietary restriction and death in Drosophila. Science. 301 (5640), 1731-1733 (2003).
- Petrascheck, M., Miller, D. L. Computational analysis of lifespan experiment reproducibility. Frontiers in Genetics. 8, 92 (2017).
- Lucanic, M., et al. Impact of genetic background and experimental reproducibility on identifying chemical compounds with robust longevity effects. Nature Communications. 8 (1), 14256 (2017).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Herndon, L. A., et al. Stochastic and genetic factors influence tissue-specific decline in ageing C. elegans. Nature. 419 (6909), 808-814 (2002).
- Kirkwood, T. B., et al. What accounts for the wide variation in life span of genetically identical organisms reared in a constant environment. Mechanisms of Ageing and Development. 126 (3), 439-443 (2005).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Hamilton, B., et al. A systematic RNAi screen for longevity genes in C. elegans. Genes & Development. 19 (13), 1544-1555 (2005).
- Lee, S. S., et al. A systematic RNAi screen identifies a critical role for mitochondria in C. elegans longevity. Nature Genetics. 33 (1), 40-48 (2003).
- Cornwell, A. B., Llop, J. R., Salzman, P., Thakar, J., Samuelson, A. V. The replica set method: A high-throughput approach to quantitatively measure Caenorhabditis elegans lifespan. Journal of Visualized Experiments. (136), e57819 (2018).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: A quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Hulme, S. E., et al. Lifespan-on-a-chip: Microfluidic chambers for performing lifelong observation of C. elegans. Lab on a Chip. 10 (5), 589-597 (2010).
- Kerr, R. A., Roux, A. E., Goudeau, J. F., Kenyon, C. The C. elegans observatory: High-throughput exploration of behavioral aging. Frontiers in Aging. 3, 932696 (2022).
- Javer, A., Ripoll-Sánchez, L., Brown, A. E. Powerful and interpretable behavioural features for quantitative phenotyping of Caenorhabditis elegans. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1758), 20170375 (2018).
- Miller, H., et al. Genetic interaction with temperature is an important determinant of nematode longevity. Aging Cell. 16 (6), 1425-1429 (2017).
- Bansal, A., Zhu, L. J., Yen, K., Tissenbaum, H. A. Uncoupling lifespan and healthspan in Caenorhabditis elegans longevity mutants. Proceedings of the National Academy of Sciences of the United States of America. 112 (3), E277-E286 (2015).
- Huang, C., Xiong, C., Kornfeld, K. Measurements of age-related changes of physiological processes that predict lifespan of Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 101 (21), 8084-8089 (2004).
- Garigan, D., et al. Genetic analysis of tissue aging in Caenorhabditis elegans: A role for heat-shock factor and bacterial proliferation. Genetics. 161 (3), 1101-1112 (2002).
- Oswal, N., Martin, O. M., Stroustrup, S., Bruckner, M. A. M., Stroustrup, N. A hierarchical process model links behavioral aging and lifespan in C. elegans. PLoS Computational Biology. 18 (9), 1010415 (2022).
- Sen, I., et al. DAF-16/FOXO requires protein phosphatase 4 to initiate transcription of stress resistance and longevity promoting genes. Nature Communications. 11 (1), 138 (2020).
- Schiffer, J. A., et al. et al.Caenorhabditis elegans processes sensory information to choose between freeloading and self-defense strategies. Elife. 9, 56186 (2020).
- Bazopoulou, D., et al. Developmental ROS individualizes organismal stress resistance and lifespan. Nature. 576 (7786), 301-305 (2019).
- Guerrero-Rubio, M. A., Hernández-García, S., García-Carmona, F., Gandía-Herrero, F. Extension of life-span using a RNAi model and in vivo antioxidant effect of Opuntia fruit extracts and pure betalains in Caenorhabditis elegans. Food Chemistry. 274, 840-847 (2019).
- Janssens, G. E., et al. Transcriptomics-based screening identifies pharmacological inhibition of Hsp90 as a means to defer aging. Cell Reports. 27 (2), 467-480 (2019).
- Kasimatis, K. R., Moerdyk-Schauwecker, M. J., Phillips, P. C. Auxin-mediated sterility induction system for longevity and mating studies in Caenorhabditis elegans. G3: Genes, Genomes, Genetics. 8 (8), 2655-2662 (2018).
- Lin, X. -. X., et al. DAF-16/FOXO and HLH-30/TFEB function as combinatorial transcription factors to promote stress resistance and longevity. Nature Communications. 9 (1), 4400 (2018).
- Stroustrup, N., et al. The temporal scaling of Caenorhabditis elegans ageing. Nature. 530 (7588), 103-107 (2016).
- Byerly, L., Cassada, R., Russell, R. The life cycle of the nematode Caenorhabditis elegans: I. Wild-type growth and reproduction. Developmental Biology. 51 (1), 23-33 (1976).
- Perez, M. F., Francesconi, M., Hidalgo-Carcedo, C., Lehner, B. Maternal age generates phenotypic variation in Caenorhabditis elegans. Nature. 552 (7683), 106-109 (2017).
- Wilkinson, D. S., Taylor, R. C., Dillin, A. Analysis of aging in Caenorhabditis elegans. Methods in Cell Biology. 107, 353-381 (2012).
- Hosono, R. Sterilization and growth inhibition of Caenorhabditis elegans by 5-fluorodeoxyuridine. Experimental Gerontology. 13 (5), 369-373 (1978).
- Lithgow, G. J., Driscoll, M., Phillips, P. A long journey to reproducible results. Nature. 548 (7668), 387-388 (2017).
- Zhang, L., Ward, J. D., Cheng, Z., Dernburg, A. F. The auxin-inducible degradation (AID) system enables versatile conditional protein depletion in C. elegans. Development. 142 (24), 4374-4384 (2015).
- Baeriswyl, S., et al. Modulation of aging profiles in isogenic populations of Caenorhabditis elegans by bacteria causing different extrinsic mortality rates. Biogerontology. 11 (1), 53 (2010).
- Banse, S. A., Blue, B. W., Robinson, K. J., Jarrett, C. M., Phillips, P. C. The Stress-Chip: A microfluidic platform for stress analysis in Caenorhabditis elegans. PLoS One. 14 (5), e0216283 (2019).
- Banse, S. A., et al. Automated lifespan determination across Caenorhabditis strains and species reveals assay-specific effects of chemical interventions. Geroscience. 41 (6), 945-960 (2019).
- Swindell, W. R. Accelerated failure time models provide a useful statistical framework for aging research. Experimental Gerontology. 44 (3), 190-200 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены