In Vitro Модель эмбрионального сосуда человека на чипе для изучения механобиологии развития
В этой статье
Резюме
Здесь описан простой рабочий процесс для дифференциации эндотелиальных клеток от плюрипотентных стволовых клеток человека, за которым следует подробный протокол их механической стимуляции. Это позволяет изучать механобиологию развития эндотелиальных клеток. Этот подход совместим с последующими анализами живых клеток, собранных с культурального чипа после механической стимуляции.
Аннотация
Сердце является первым органом, который функционирует во время развития, тем самым инициируя кровообращение на ранних сроках беременности. Помимо транспортировки кислорода и питательных веществ для обеспечения роста плода, кровообращение плода контролирует многие важные события развития, происходящие в эндотелиальном слое с помощью механических сигналов. Биомеханические сигналы индуцируют структурные изменения кровеносных сосудов, устанавливают артериовенозную спецификацию и контролируют развитие гемопоэтических стволовых клеток. Труднодоступность развивающихся тканей ограничивает понимание роли кровообращения в раннем развитии человека; Таким образом, модели in vitro являются ключевыми инструментами для изучения механобиологии сосудов. В данной работе описывается протокол дифференциации эндотелиальных клеток от индуцированных плюрипотентных стволовых клеток человека и их последующего посева в жидкостное устройство для изучения их реакции на механические сигналы. Этот подход позволяет проводить длительное культивирование эндотелиальных клеток при механической стимуляции с последующим извлечением эндотелиальных клеток для фенотипической и функциональной характеристики. Созданная здесь модель in vitro будет полезна для выяснения внутриклеточных молекулярных механизмов, которые трансдуцируют сигналы, опосредованные механическими сигналами, которые в конечном итоге управляют развитием сосудов во время внутриутробной жизни человека.
Введение
Во время эмбрионального развития сердце является первым органом, который устанавливает функциональность1, с обнаруживаемыми сокращениями с самой ранней стадии формирования эндокардиальной трубки2. Кровообращение, наряду с механическими сигналами, опосредованными потоком крови в сосуде, контролирует многие важнейшие аспекты раннего развития. До установления циркуляции крови плода сосудистая сеть организуется в первичное капиллярное сплетение; При функционировании сердца это сплетение реорганизуется в венозную и артериальную сосудистую сеть3. Роль механических сигналов в артериовенозной спецификации отражается в панэндотелиальной экспрессии артериальных и венозных маркеров до начала кровотока4.
Гемодинамические силы не только контролируют развитие самой сосудистой сети, но и играют фундаментальную роль в контроле образования клеток крови. Гемопоэтические стволовые и прогениторные клетки (ГСПК) возникают из специализированных эндотелиальных клеток, называемых гемогенным эндотелием 5,6,7,8, присутствующих в различных анатомических областях эмбрионов исключительно на ранней стадии развития. Модели с сердечной недостаточностью вместе с моделями in vitro продемонстрировали, что механические сигналы инструктируют и увеличивают продукцию HSPC из гемогенного эндотелия 9,10,11,12,13,14.
Было показано, что различные типы динамики потока дифференцированно контролируют клеточный цикл15, который, как известно, важен как для гемогенного эндотелия 16,17, так и для спецификации артериальных клеток18. В целом, механические сигналы являются важнейшими детерминантами идентичности и функционирования клеток во время развития. Новые жидкостные устройства in vitro позволяют нам преодолеть ограничения, связанные с изучением механобиологии развития во время развития крови человека in vivo.
Общая цель протокола в данной рукописи состоит в том, чтобы описать, шаг за шагом, экспериментальный процесс изучения влияния сдвигового стресса на эндотелиальные клетки человека, полученные in vitro из индуцированных плюрипотентных стволовых клеток человека (ИПСК). Данный протокол содержит подробные инструкции по дифференцировке ИПСК в эндотелиальные клетки и их последующему посеву в флюидные чипы для протокола стимуляции. Используя это, различные эндотелиальные клетки, полученные in vitro, могут быть протестированы на их способность ощущать напряжение сдвига, анализируя их ориентацию в ответ на поток. Это позволит другим лабораториям ответить на вопросы о реакции на сдвиговое напряжение и его функциональных последствиях для различных идентичностей эндотелиальных клеток.
протокол
ПРИМЕЧАНИЕ: Все методы культивирования клеток должны выполняться в стерильных условиях в ламинарном колпаке, а клетки должны инкубироваться при 37 °C в гумифицированной атмосфере с 5%CO2. Инструкции по всем препаратам цитокинов как для поддерживающей терапии (rhbFGF), так и для протокола дифференцировки (rhBMP4, rhVEGF, rhbFGF, rhIL6, rhFLT3L, rhIGF1, rhIL11, rhSCF, rhEPO, rhTPO, rhIL3) приведены в Дополнительной таблице S1.
1. Культивирование ИПСК - размораживание, поддержание и замораживание клеток
- Приготовление поддерживающей среды, факторов роста и других реагентов
- Приготовьте питательную среду, добавив добавку с цельной сывороточной средой hESCs, 36 мл 25% бычьего сывороточного альбумина (BSA) и 1 мл 55 мМ β-меркаптоэтанола в базальную среду Dulbecco Modified Eagle Medium/F12 (DMEM/F-12) (см. таблицу материалов).
- Ресуспендировать 1 мг ингибитора Ро-киназы (iRock) в 1 мл ДМСО, сделать аликвоты по 50 мкл и хранить их при -20 °C.
ПРИМЕЧАНИЕ: Эти аликвоты можно хранить при температуре -20 °C в течение 1 года. После размораживания их можно хранить при температуре 4 °C в течение 1 недели. - Раствор витронектина (VTN-N) разморозить на льду и в количестве 60 мкл на флакон перед хранением при -80 °C. Непосредственно перед нанесением покрытия на планшеты разбавьте 60 мкл 60 мкл 6 мл фосфатно-солевого буфера (DPBS) Dulbecco; конечная концентрация 5 мкг/мл.
- Размораживание клеточной линии hiPSC
ПРИМЕЧАНИЕ: Линия плюрипотентных стволовых клеток человека SFCi55 была ранее получена и широко использовалась для дифференцировки в различные типы клеток и различные эмбриональные линии 19,20,21,22.- Одну лунку 6-луночного планшета покрыть 1 мл раствора VTN-N в течение 1 ч при 37 °C.
ПРИМЕЧАНИЕ: После инкубации пластины с покрытием можно хранить при температуре 4 °C до 1 недели. - Аспирировать раствор VTN-N с помощью аспирационной пипетки и добавить 1 мл предварительно подогретой питательной среды с добавлением 20 нг/мл rhbFGF (дополнительная таблица S1).
- Быстро разморозьте флакон с ИПСК на водяной бане и перенесите клетку в 5 мл предварительно подогретой питательной среды.
- Отжим клетки в течение 3 мин при температуре 300 × г при комнатной температуре.
- Ресуспендировать клеточную гранулу в 0,5 мл питательной среды с добавлением 20 нг/мл rhbFGF.
- Переложите клетки в одну лунку с покрытием, содержащую уже 1 мл среды.
- Добавьте 5 мкл iRock в лунки, содержащие клетки, в общей сложности 1,5 мл среды.
- Культивируйте клетки в инкубаторе, меняйте среду ежедневно в течение недели и дважды кормите клетки, добавляя в клетки в два раза больше нормального объема среды, чтобы обеспечить кормление в выходные дни.
ПРИМЕЧАНИЕ: Клетки выращиваются в присутствии iRock только в течение 24 часов.
- Одну лунку 6-луночного планшета покрыть 1 мл раствора VTN-N в течение 1 ч при 37 °C.
- Поддержание и передача ИПСК
- Ежедневно меняйте среду свежей, предварительно подогретой питательной средой с добавлением 20 нг/мл rhbFGF.
- Проходите клетки, когда они достигают примерно 80% слияния, как правило, два раза в неделю.
- Для прохождения ячеек покройте пластину VTN-N, как описано ранее в шагах 1.2.1 и 1.2.2.
- Аспирировать среду из лунок с ячейками и промыть их ДПБС.
- Аспирировать ДПБС и добавить 1 мл диссоциационного реагента (см. таблицу материалов) и инкубировать в течение 1 мин.
- Отсасывайте реагент для диссоциации и инкубируйте еще 3 мин. Сильно постучите по тарелке 10 раз с каждой стороны.
ПРИМЕЧАНИЕ: На этапе диссоциации может потребоваться оптимизация времени инкубации и процедуры постукивания в зависимости от типа клетки. - Добавьте 1 мл питательной среды к клеткам и пипеткой Пастера промойте их один раз, чтобы убедиться, что большая часть колоний собрана.
- Добавьте 150 мкл клеточной суспензии в каждую лунку, чтобы обеспечить коэффициент пассажа 1 лунка к 6.
ПРИМЕЧАНИЕ: Сразу после размораживания нового флакона лучше пассировать клетки в более низком соотношении, например, 1:1 или 1:2 в течение одного или двух проходов, чтобы они достигли устойчивой фазы роста, прежде чем пассировать в соотношении 1:6. - Культивируйте клетки в инкубаторе, меняйте среду ежедневно в течение недели и дважды подкармливайте клетки один раз в выходные.
- Замораживание клеточной линии ИПСК
ПРИМЕЧАНИЕ: Замораживайте клетки в течение первых двух проходов после размораживания, чтобы обеспечить постоянное количество замороженных флаконов с низким проходом для начала культивирования. Заморозьте клетки, когда они достигнут слияния примерно 80%.- Смените среду на свежую, предварительно подогретую питательную среду с добавлением 20 нг/мл rhbFGF и 5 мкл iRock и инкубируйте не менее 1 ч.
- Отсоедините ячейки, как описано в шагах 1.3.2.2-1.3.2.5.
- Соберите отделенные клетки в центрифужную пробирку объемом 15 мл, содержащую 5 мл питательной среды.
- Центрифугу в течение 3 мин при 300 × г при комнатной температуре.
- Отсасывают надосадочную жидкость и добавляют 1 мл раствора криоконсервации (см. Таблицу материалов).
- С помощью пипетки Пастера осторожно пропипетируйте клетки вверх и вниз, чтобы смешать их в растворе для криоконсервации.
ПРИМЕЧАНИЕ: Избегайте чрезмерного пипетирования, которое может привести к диссоциации клеточных кластеров. - Разделите клеточную суспензию на два криоконсервационных флакона по 0,5 мл каждый.
- Переложите криоконсервационные флаконы в контейнер для криоконсервации, предварительно охлажденный до 4 °C.
- Переместите контейнер с ячейками в морозильную камеру с температурой -80 °C на 24 часа, прежде чем переместить флаконы в жидкий азот для длительного хранения.
2. Дифференцировка ИПСК в эндотелиальные клетки
- Приготовление дифференцировочной среды, цитокинов и факторов роста
- Готовят бессывороточную дифференцировочную среду (СФО) в соответствии с таблицей 1. Используйте это средство с 0-го по 5-й день дифференциации.
- Приготовьте безсывороточную среду для клеток CD34+ (SFM-34), добавив 34 питательные добавки и 5 мл добавки L-глютамина в базальную среду 34 SFM (см. таблицу материалов). Используйте это средство, начиная с 6-го дня дифференциации.
- Ресуспендировать 1 мг CHIR99021 в 716 мкл ДМСО для получения 3 мМ раствора. Инкубировать при комнатной температуре до полной ресуспендации; при необходимости быстро прогрейте до 37 °C. Изготовьте аликвоты объемом 20 мкл и храните их при -20 °C до 6 месяцев. Используйте сразу после размораживания, не замораживайте повторно и не храните.
- Ресуспендируйте цитокины в соответствии с инструкцией, приведенной в дополнительной таблице S1. Все аликвоты цитокинов хранят при температуре -80 °C.
- Дифференцировка эндотелиальных клеток
ПРИМЕЧАНИЕ: Для каждого дня дифференцировки приготовьте 18 мл (3 мл среды/лунки) предварительно подогретой среды SFD в соответствии со смесями цитокинов, описанными в Таблица 2.- День 0 - формирование эмбриоидных телец (ЭБ)
- Приготовьте 18 мл среды SFD с цитокином Mix 1 в соответствии с таблицей 2 для каждой 6-луночной чашки (3 мл/лунка).
- Добавьте 2 мл предварительно подогретой среды SFD с Смешайте по 1 цитокину в каждой лунке 6-луночного планшета, отталкивающего клетки (см. таблицу материалов).
- Чтобы сформировать EB, выполните действия, описанные в шагах 1.3.2.2-1.3.2.4.
ПРИМЕЧАНИЕ: Убедитесь, что ИПСК сливаются на 70-80%, чтобы начать дифференцировку. - Добавьте 1 мл предварительно подогретой среды SFD с цитокинами Mix 1 в каждую лунку отделенных клеточных кластеров.
- Используйте пипетку Пастера, чтобы аккуратно переместить клеточные кластеры в одну лунку с клеточными репеллентами для образования ЭП в соотношении 1:1.
- Поместив пластину в инкубатор, перемещайте ее вперед и назад, вправо и влево, чтобы равномерно распределить ЭБ в лунке.
- День 1 - средняя смена EB
ПРИМЕЧАНИЕ: Этот шаг необходим только в том случае, если к 1-му дню дифференцировки в суспензии находится много одиночных клеток вместе с БЭ.- Приготовьте 18 мл среды SFD с цитокином Mix 1 в соответствии с таблицей 2 для каждой 6-луночной чашки (3 мл/лунка).
- Вращайте пластину с ЭБ, чтобы переместить их в центр, и соберите их с помощью пипетки Пастера в центрифужную пробирку объемом 15 мл.
ПРИМЕЧАНИЕ: Если EB выглядят слипшимисяся, как в нити, разделите их, пипетируя вверх и вниз с помощью P1000, прежде чем собрать их в центрифужную пробирку объемом 15 мл. - Подождите 5-10 минут, пока ЭБ не осядут на дне пробирки.
ПРИМЕЧАНИЕ: Если ЭБ слишком малы, центрифугируйте их в течение 5 минут при 100 × г , чтобы они успокоились. - Промойте пластины, отталкивающие клетки, стерильной водой или DPBS, чтобы удалить отдельные клетки или мусор.
- Осторожно и медленно отсасывайте надосадочную жидкость из ЭБ, не выбивая их.
- Добавьте 2 мл SFD с цитокинами Mix 1 в каждую лунку клеточных репеллентных пластин.
- Ресуспендируйте ЭБ, используя 1 мл среды SFD с цитокинами Mix 1 для каждой стартовой лунки - для 6-луночного планшета добавьте 6 мл среды.
- Переносят ЭБ на клеточные репеллентные пластины в объеме 1 мл на лунку, которая уже содержит 2 мл среды SFD.
- Поместив пластину в инкубатор, перемещайте ее вперед и назад, вправо и влево, чтобы равномерно распределить ЭБ в лунке.
- День 2 - добавление CHIR99021
- Вкрутите ЭБ в центр пластины и добавьте CHIR99021 в соответствии с таблицей 2 на боковой стороне лунки, чтобы избежать прямого контакта с ячейками.
ПРИМЕЧАНИЕ: Если среда не была заменена в 1-й день, замените всю среду, а не только CHIR. Приготовьте 18 мл среды SFD со смесью 2 в соответствии с таблицей 2 для каждой 6-луночной чашки (3 мл/лунка). - Поместив пластину в инкубатор, перемещайте ее вперед и назад, вправо и влево, чтобы равномерно распределить ЭБ в лунке.
- Вкрутите ЭБ в центр пластины и добавьте CHIR99021 в соответствии с таблицей 2 на боковой стороне лунки, чтобы избежать прямого контакта с ячейками.
- День 3 - изменение среднего уровня БЭ и добавление цитокинов Mix 3
- Приготовьте 18 мл среды SFD со смешайте 3 цитокина в соответствии с таблицей 2 для каждой 6-луночной чашки (3 мл/лунка).
- Соберите EB, как описано в шагах 2.2.2.2-2.2.2.4.
- Добавьте предварительно подогретые 2 мл среды SFD с цитокинами Mix 3 на пластины, отталкивающие клетки.
- Осторожно аспирируйте надосадочную жидкость из ЭБ. Добавьте 1 мл/лунку SFD со смесью 3 цитокинов.
- Распределите ЭБ между лунками, как описано в шагах 2.2.2.8-2.2.2.9.
- День 6 - изменение среднего уровня SFM-34 и добавление цитокинов Mix 4
- Приготовьте 18 мл среды SFD с 4 цитокинами в соответствии с таблицей 2 для каждой 6-луночной пластины (3 мл/лунка).
- Соберите EB, как описано в шагах 2.2.2.2-2.2.2.4.
- Добавьте 2 мл предварительно подогретой среды SFM-34 с цитокинами Mix 4 на пластины, отталкивающие клетки.
- Осторожно аспирируйте надосадочную жидкость из ЭБ. Добавьте 1 мл/лунку SFM-34 со смешайте 4 цитокина.
- Распределите ЭБ между лунками, как описано в шагах 2.2.2.8-2.2.2.9.
- День 0 - формирование эмбриоидных телец (ЭБ)
3. Выделение CD34+ клеток и посев в чип
ПРИМЕЧАНИЕ: Клетки CD34+ выделяют методом положительной изоляции с помощью набора микрогранул CD34 (см. таблицу материалов), который содержит микрогранулы CD34, конъюгированные с моноклональными мышиными антителами, антитела CD34 и реагент, блокирующий FcR (Human IgG). Важно проверить эффективность изоляции колонки путем окрашивания клеток до и после выделения для анализа методом проточной цитометрии, Ниже указано, когда необходимо взять клетки для этого анализа.
- Подготовьте материалы и реактивы.
- Приготовьте промывочный буфер, добавив 5 мл 5% раствора БСА и 200 мкл ЭДТА 0,5 М к 45 мл ДПБС для получения PBS + 0,5% БСА + 2 мМ ЭДТА. Готовьте свежие для каждой изоляции, процеживайте, стерилизуйте и храните в холодильнике до использования.
- Жидкостную стружку покрыть раствором ламинина, приготовленным путем разведения rhLaminin 521 1:50 в DPBS Ca 2+ Mg2+. Покройте каждую стружку соответствующим объемом для используемой стружки и инкубируйте в инкубаторе в течение 2 ч перед посевом.
ПРИМЕЧАНИЕ: Для покрытия могут быть использованы другие матрицы, которые должны быть протестированы для конкретного типа клеток/эксперимента. - Приготовьте среду Mix 4 SFM-34, добавив 18 мл среды SFM-34 цитокинами Mix 4 в соответствии с таблицей 2 , и поместите смесь в пробирку объемом 50 мл в инкубатор с слегка отвинченной крышкой для облегчения газообмена.
- Поместите выбранные перфузионные наборы и любые другие трубки, которые будут использоваться в инкубаторе, для дегазации.
- 8 день - диссоциация БЭ и выделение CD34+
- Соберите EB, как описано в шагах 2.2.2.2-2.2.2.5.
- Добавьте 1 мл реагента для диссоциации клеток на каждую стартовую лунку собранных ЭБ (если было собрано 6 лунок, добавьте 6 мл).
- Перенесите обратно 1 мл суспензии ЭБ в реагенте для диссоциации клеток в каждую лунку пластины, отпугивающей клетку.
- Инкубируют в течение 10 мин в инкубаторе.
- Осторожно пипетируйте ЭБ вверх и вниз с помощью P1000 не более 10 раз.
- Повторите шаги 3.2.4-3.2.5, чтобы получить в общей сложности 3 раза.
ПРИМЕЧАНИЕ: Если ЭБ трудно диссоциировать, повторите описанные выше шаги в общей сложности 4 раза. - Добавьте 5 мл промывочного буфера на каждую лунку диссоциированных ЭБ.
- Соберите клетки в центрифужную пробирку объемом 50 мл, пропустив их через ситечко 40 мкм. Возьмите 10 мкл клеточной суспензии, чтобы подсчитать клетки.
ПРИМЕЧАНИЕ: Чтобы проверить эффективность изоляции, пересадите 105 клеток/пробирку в две разные пробирки (неокрашенный контрольный и предварительно отсортированный тестовый образец), которые будут использоваться позже для проточной цитометрии (как описано в шагах 4.3.9-4.3.13). Для 6-луночной планшета после фильтрации следует собрать ~106 ячеек. - Отжимайте клетки в течение 10 мин при 300 × г.
- Повторно суспендируйте клетки в 300 мкл промывочного буфера, осторожно пипетируя несколько раз, чтобы убедиться в отсутствии комков. Продолжайте следовать протоколу производителя (см. Таблицу материалов).
- Посев CD34+ клеток в жидкостные чипы
ПРИМЕЧАНИЕ: Жидкостный чип, используемый в протоколе, имеет высоту канала 0,6 мм и длину 50 мм, что обеспечивает общую площадь роста 2,5см2 (дополнительный рисунок S1). Этот тип чипов засевается общим объемом клеточной суспензии 150 мкл. Можно использовать различные чипы, а объем затравки и плотность клеток должны быть адаптированы в соответствии с областью роста. Может потребоваться дополнительная оптимизация в зависимости от используемой клеточной линии и ее роста.- Ресуспендант изолированных CD34+ клеток в 300 мкл предварительно нагретой среды SFM-34 с цитокинами Mix 4.
- Возьмите 10 мкл клеточной суспензии и посчитайте клетки.
- Ресуспендировать 2,5 × 105 ячеек в конечном объеме 150 мкл с добавкой SFM-34; добавьте 0,5 мкл iRock.
ПРИМЕЧАНИЕ: Чтобы проверить эффективность выделения, перенесите 105 клеток/пробирку в пробирку (тестовый образец после сортировки), которая будет использоваться позже для проточной цитометрии (как описано в шагах 4.3.9-4.3.13). - Медленно отсасывайте ламинин из жидкой стружки, поместив наконечник P200 внутрь резервуара на краю канала.
ПРИМЕЧАНИЕ: Если жидкость трудно собрать, медленно поднимите одну сторону стружки, чтобы помочь жидкости переместиться в противоположный резервуар. - Постепенно добавляйте клеточную суспензию в канал, чтобы убедиться, что не образуются пузырьки.
ПРИМЕЧАНИЕ: Выполняйте шаги 3.3.4-3.3.5 быстро, но аккуратно, чтобы избежать высыхания ламинина и образования пузырьков в каналах стружки. Если образуются пузырьки, поднимите одну сторону чипа и осторожно постучите по слайду, чтобы мобилизовать пузырьки; Когда они достигнут водохранилища, они поднимутся на воздушную границу и не смогут войти в канал. - Перенесите чип в инкубатор и оставьте на ночь, чтобы клетки полностью прикрепились к каналу и выглядели вытянутыми.
- Когда клетки полностью прикрепятся, аспирируйте среду, как показано на этапе 3.3.4, и замените ее 200 мкл SFM-34 с добавлением цитокинов.
- С этого момента заменяйте среду ежедневно до тех пор, пока ячейки не достигнут 90%-100% слияния.
4. Применение непрерывного потока к эндотелиальным клеткам - Аорта-на-чипе
- Подготовьте материалы и реактивы.
- Приготовьте среду Mix 4 SFM-34, добавив 18 мл среды SFM-34 цитокинами Mix 4 в соответствии с таблицей 2 и поместив ее в пробирку объемом 50 мл в инкубатор с слегка отвинченной крышкой для облегчения газообмена.
- Поместите выбранные перфузионные наборы и все трубки, которые будут использоваться для установки жидкости, в инкубатор для дегазации.
- Сборка жидкостной системы
- Установите перфузионный набор в аппарат в соответствии с протоколом производителя.
ПРИМЕЧАНИЕ: Не забывайте использовать зажимы в системе. Если для этого шага используются скользящие зажимы, их необходимо надеть на трубку перед подключением к чипу. - Прикрепите новый жидкостный чип и добавьте питательную среду SFM-34 с цитокинами, убедившись, что оба резервуара заполнены в стерильных условиях в колпаке.
- Выполните программу удаления пузырьков и этап калибровки.
- Извлеките жидкостный блок с подключенным комплектом из инкубатора и перенесите его в колпак; Возьмите также стружку, содержащую клетки из инкубатора.
- Зажмите трубку с обеих сторон испытуемой стружки.
- Снимите трубку с тестовой стружки.
ПРИМЕЧАНИЕ: Убедитесь, что в соединителе Луэра на конце трубки нет пузырьков. Если пузырьки видны, осторожно аспирируйте их с помощью пипетки P200 и при необходимости добавьте больше среды, чтобы убедиться, что соединитель заполнен средой. - Соедините микросхему, содержащую ячейки, с трубкой.
- Снимите или откройте зажимы.
- Перенесите систему в инкубатор и подключите воздушный насос к жидкостному блоку.
- Запустите предварительно выбранную программу с помощью специального программного обеспечения для насоса (дополнительный рисунок S2) с постепенным увеличением напряжения сдвига, описанного в таблице 3.
ПРИМЕЧАНИЕ: В зависимости от конкретного эксперимента, который необходим, программа стимуляции может нуждаться в оптимизации. Здесь описано постепенное увеличение напряжения сдвига, приводящее к конечному значению 5 дин/см2, которое имитирует напряжение сдвига, которое, по расчетам, испытывает стенка дорсальной аорты в начале кровообращения плода 9. Независимо от конечного напряжения сдвига, которое будет использоваться, его необходимо постепенно увеличивать с течением времени, чтобы позволить элементам адаптироваться к силе, не вызывая их отрыва от чипа. Если выбранный протокол стимуляции длится более 3 дней, цитокины следует долить в систему, добавив 1 мл SFM-34, содержащего цитокины Mix 4, которые обычно добавляются в 18 мл. Для этого программу помпы быстро приостанавливают и добавляют 500 мкл добавленной среды в каждый из двух шприцев в наборе жидкости.
- Установите перфузионный набор в аппарат в соответствии с протоколом производителя.
- Забор клеток для анализа
- Разогрейте диссоциационный буфер на водяной бане.
- Извлеките жидкостный блок из инкубатора и переместите его в колпак.
- Зажмите трубку, обрамляющую стружку, с обеих сторон и извлеките трубки из резервуаров на стружке.
- Аккуратно удалите среду с чипа и замените ее DPBS Ca 2+ Mg2+, чтобы промыть ячейки.
ПРИМЕЧАНИЕ: Этот этап промывки PBS можно пропустить, если клетки начинают отделяться. - Осторожно добавьте 150 мкл диссоциационного буфера и инкубируйте в течение 3 минут при 37 °C.
ПРИМЕЧАНИЕ: Проверьте под микроскопом, являются ли клетки одиночными и отделенными; В противном случае инкубируйте еще 2 мин. Важно, чтобы клетки были полностью отделены от канала перед аспирацией среды, так как чип не позволяет способствовать отсоединению клеток путем пипетирования. Для отделения клеток могут быть использованы другие растворы, такие как трипсин или буферы на основе ЭДТА. - Соберите диссоциационный буфер, содержащий клетки, из одного резервуара, переложите в центрифужную пробирку объемом 15 мл и промойте канал один раз DPBS, чтобы собрать все отделившиеся клетки.
- Добавьте 1 мл промывочного буфера в пробирку объемом 15 мл с ячейками и возьмите 10 мкл для подсчета клеток.
- Разделите клеточную суспензию на пробирки для проточной цитометрии так, чтобы в пробирке оставалось от 10до 5 клеток.
- Вращайте пробирки в течение 5 мин при 300 × г.
- Приготовьте раствор для окрашивания так, чтобы на каждую пробирку для окрашивания оставалось 50 мкл. Добавьте CD34 PerCP-efluor710 или CD34-PE в разведении 1:100 и 1:200 соответственно.
- Ресуспендируйте клетки в 50 мкл раствора для окрашивания и инкубируйте в течение 30 мин при 4 °C.
- Промойте клетки, добавив 2 мл промывочного буфера, и отжим в течение 5 мин при 300 × г.
- Ресуспендируйте гранулы в 100 мкл красящего раствора и получите данные с помощью проточного цитометра.
ПРИМЕЧАНИЕ: Клетки также могут быть лизированы непосредственно в чипе для экстракции РНК с использованием 150 мкл лизисного буфера РНК или зафиксированы для визуализации с использованием 4% параформальдегида в DPBS в течение 10 минут при комнатной температуре.
- Анализ ориентации ячеек
- Проанализируйте изображения, чтобы количественно оценить изменения ориентации ячеек с помощью FIJI23 (дополнительный рисунок S3).
- Откройте диспетчер области интереса (ROI) в меню Анализ | Инструменты | Меню менеджера ROI.
- Нарисуйте контуры ячеек вручную с помощью инструмента «Выделение полигонов » и добавьте их в диспетчер ROI, нажав кнопку « Добавить » или используя сочетание клавиш CTRL+T .
- Измерьте ориентацию каждого ROI, выбрав меру Подогнать эллипс в окне Анализ | Меню «Установить измерения».
- Примените измерение ко всем показателям рентабельности инвестиций с помощью кнопки Подробнее... Команда Multi Measure в менеджере ROI.
ПРИМЕЧАНИЕ: На этом шаге мы подгоним эллипс к каждому ROI и создадим таблицу, содержащую длину большой и малой осей эллипса, а также угол. - Экспортируйте таблицу в CSV-файл для импорта в другое программное обеспечение для построения графиков.
ПРИМЕЧАНИЕ: Скрипт, используемый для графиков, доступен по адресу https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885
0ДДК.
- Проанализируйте изображения, чтобы количественно оценить изменения ориентации ячеек с помощью FIJI23 (дополнительный рисунок S3).
Результаты
Мы описываем протокол дифференцировки и механостимуляции эндотелиальных клеток, полученных из ИПСК, который позволяет изучать их реакцию на механические сигналы (рис. 1). Этот протокол приводит к выработке функционально механочувствительных эндотелиальных клеток. Мы приводим репрезентативные результаты и описываем ожидаемый фенотип, чтобы оценить, как клетки реагируют на стимуляцию цитокинов во время дифференцировки.
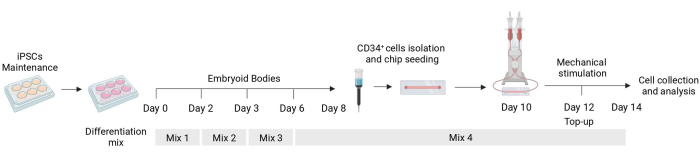
Рисунок 1: Схема протокола дифференцировки и механической стимуляции. Схема протокола дифференцировки, показывающая время различных смесей цитокинов, выделение CD34+ клеток, флюидный посев чипов и окончательный анализ механически стимулированных клеток. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Культура ИПСК
Важно начинать протокол с ИПСК, которые правильно растут в условиях самообновления. Хорошим показателем качества культуры является скорость их роста. После оттаивания клеткам может потребоваться 2-3 недели, чтобы достичь правильной фазы роста, которая обеспечит хорошую дифференцировку. Когда клетки можно пассировать два раза в неделю в соотношении 1:6, достигая почти полного слияния, это время, когда они готовы к дифференцировке в тот же день, когда они должны быть пассированы.
Дифференцировка ИПСК в эндотелиальные клетки
Первый этап дифференцировки, заключающийся в образовании эмбриоидных тел (ЭБ), зависит от клеточной линии и может нуждаться в некоторой оптимизации для конкретной используемой клеточной линии. Диссоциацию, описанную на этапах протокола 1.3.2.2-1.3.2.4, можно модифицировать путем сокращения или продления инкубации с реагентом для диссоциации и последующей диссоциации с помощью пипетки Пастера. Кроме того, для этого этапа могут быть использованы другие реагенты для диссоциации в дополнение к физической диссоциации колоний с помощью режущего инструмента или наконечника пипетки P100. БЭ хорошего качества показывают четкий край ко 2-му дню дифференциации и выглядят четкими и яркими при наблюдении с помощью микроскопа; более темные участки могут указывать на гибель клеток в БЭ (рис. 2).
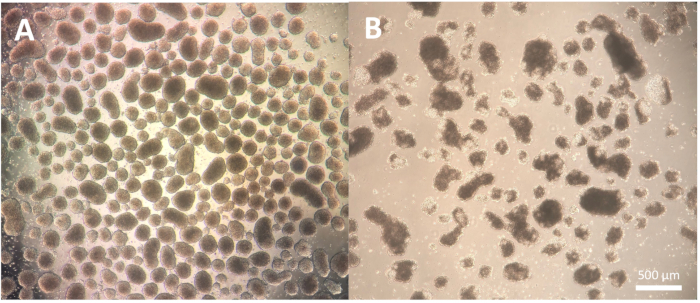
Рисунок 2: Морфология эмбриоидных тел. (A) На 2-й день эмбриоидные тела с четко очерченными внешними краями и постоянным размером. (Б) На 2-й день эмбриоидные тела плохого качества, демонстрирующие обширную гибель клеток, приводящую к дезагрегации структуры. Масштабная линейка = 500 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
На 2-й день добавление CHIR99021 к БЭ ингибирует белок GSK-3, что приводит к активации пути Wnt. Различные клеточные линии имеют различную реакцию на лечение CHIR, и это должно быть проверено путем количественного определения количества CD34+ клеток, полученных на 8-й день с использованием различных концентраций (рис. 3).
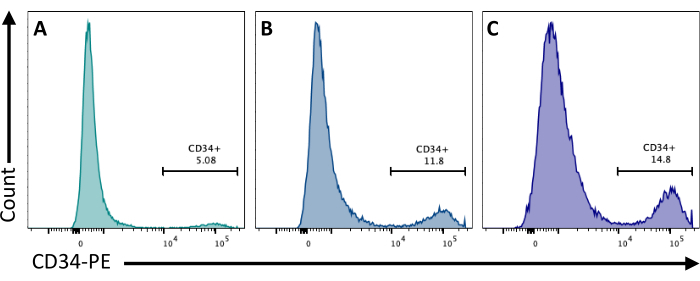
Рисунок 3: Дифференцировка эндотелиальных клеток при различных методах лечения CHIR. Приверженность эндотелиальных клеток количественно определяли методом проточной цитометрии на 8-й день дифференцировки по экспрессии мембраны CD34 после лечения CHIR на 2-е сутки при (A) 3 мкМ, (B) 5 мкМ и (C) 7 мкМ. Данные проточной цитометрии были получены с помощью пятилазерных цитометров и специального программного обеспечения (см. таблицу материалов). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Выделение CD34+ клеток
Важно подтвердить, что обогащение CD34+ с помощью магнитных шариков обеспечивает не менее 80% CD34+ после элюирования колонки. Для обеспечения достаточной чистоты аликвота клеток, полученных в результате магнитной изоляции, может быть проанализирована с помощью проточной цитометрии, при этом используется клон антитела, отличный от того, который используется для магнитного обогащения. Здесь был использован клон 4H11 и достигнута чистота ~85% после обогащения (рис. 4).
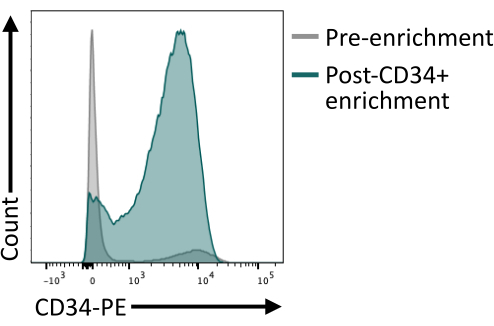
Рисунок 4: Мембранная экспрессия CD34 до и после обогащения методом магнитной сортировки. Диссоциированные эмбриоидные тельца на 8-й день (серые) и клетки после магнитного обогащения (зеленые) окрашивали на экспрессию CD34 и анализировали методом проточной цитометрии, показав успешную сортировку после обогащения. Данные проточной цитометрии были получены с помощью пятилазерных цитометров и специального программного обеспечения (см. таблицу материалов). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Посев клеток в флюидный канал
При посеве клеток в флюидный канал крайне важно отслеживать адгезию и пролиферацию эндотелиальных клеток. После посева клеткам требуется ~5 ч, чтобы полностью прилипнуть к каналу (рис. 5А). На этом этапе также может быть опробовано альтернативное решение для покрытия для улучшения адгезии. Чтобы подтвердить, что тестируемые клетки механочувствительны и, следовательно, способны реагировать на механическую стимуляцию, ориентация клеток может быть проверена в течение долгого времени. Клетки перед стимуляцией имеют случайную ориентацию (рис. 5А и Рис. 5С) и переориентируются параллельно направлению потока (рис. 5В, С). Описанный здесь протокол позволяет отбирать клетки из канала для выполнения последующего анализа, например, проточной цитометрии, для изучения их мембранного иммунофенотипа, обеспечивая эндотелиальную идентичность стимулированных клеток (рис. 5D, E).
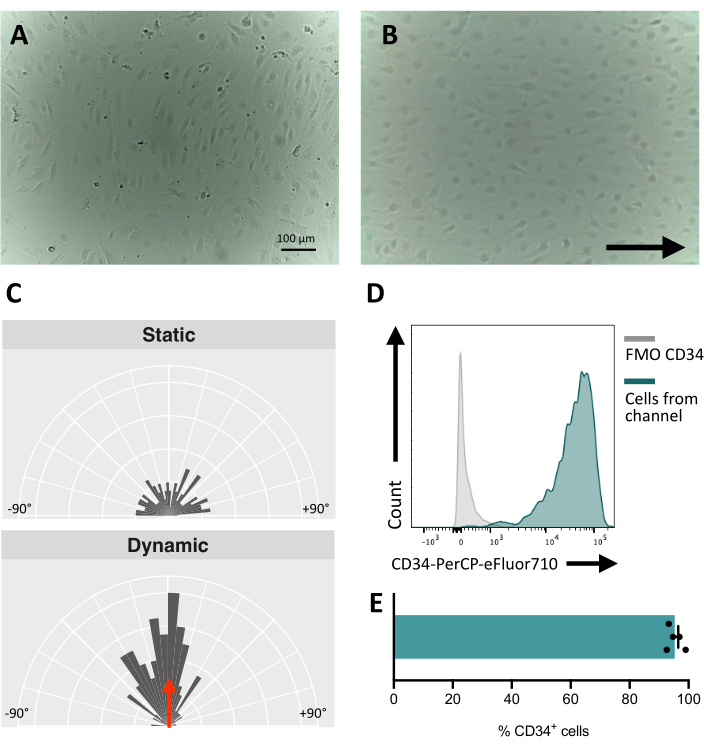
Рисунок 5: Механочувствительность эндотелиальных клеток, полученных из ИПСК . (A) Конфлюентный слой изолированных CD34+ клеток через 48 ч после посева. (Б) Переориентированный слой эндотелиальных клеток 3 дня в динамической культуре. (C) Ориентационный анализ эндотелиальных клеток после 5 дней динамического культивирования. (D) Профиль экспрессии CD34 клеток, культивируемых под потоком в течение 5 дней. (E) Процент CD34+ клеток клеточной популяции, извлеченных из флюидного канала. Изображения были сделаны с помощью перевернутого инкубаторного микроскопа; Данные проточной цитометрии были получены с помощью пятилазерных цитометров и специального программного обеспечения (см. таблицу материалов). Масштабные линейки = 100 мкм (A,B). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
| Реагентов | Концентрация запасов | Добавленный объем | Конечная концентрация |
| Модифицированный медиум Дульбекко (IMDM) | - | 333 мл | - |
| Питательная смесь для ветчины F-12 (F-12) | - | 167 мл | - |
| Добавка N-2 (100x) | 100 х | 5 мл | В 1 раз |
| Добавка B-27 (50 шт.) | 50 х | 10 мл | В 1 раз |
| Аскорбиновая кислота | 10 мг/мл | 1,25 мл | 25 мкг/мл |
| α-монотиоглицерин (MTG) | 11,5 М | 19,5 мкл | 448,5 мкМ |
| Сывороточный альбумин человека | 100 мг/мл | 2,5 мл | 0,5 мг/мл |
| Голо-Трансферрин | 100 мг/мл | 0,75 мл | 150 мкг/мл |
Таблица 1: Состав и рецептура на 500 мл среды для безсывороточной дифференцировки (SFD).
| Дни дифференциации | Цитокиновая смесь | Цитокин | Конечная концентрация |
| День 0 - 2 | Микс 1 | БМП4 | 20 нг/мл |
| День 2 | Микс 2 | CHIR99021 | 7 мкМ |
| Начиная с 3-го дня | Смешайте 3 и 4 | ВЭГФ | 15 нг/мл |
| bFGF | 5 нг/мл | ||
| Начиная с 6-го дня | Микс 4 | ИЛ6 | 10 нг/мл |
| FLT3L | 10 нг/мл | ||
| ИФР1 | 25 нг/мл | ||
| ИЛ11 | 5 нг/мл | ||
| СКФ | 50 нг/мл | ||
| ЭПО | 3 ЕД/мл | ||
| ТПО | 30 нг/мл | ||
| ИЛ3 | 30 нг/мл |
Таблица 2: Смеси цитокинов, используемых для дифференцировки эндотелиальных клеток, дни, в которые они добавляются в среду SFD, и конечная концентрация.
| Напряжение сдвига (дин/см2) | Время (ч) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | До конца эксперимента |
Таблица 3: Значения касательных напряжений для динамических культур и продолжительность их применения.
Дополнительный рисунок S1: Геометрия и размеры микросхемы и трубки, используемых для этого протокола. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный рисунок S2: Пошаговое руководство по программному обеспечению для управления воздушным насосом с описанием каждого шага. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный рисунок S3: Руководство по анализу ориентации с использованием FIJI, показывающее чертеж формы ячейки, эллиптической аппроксимации и окончательного измерения. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица S1: Размер единицы, объем ресуспензии и концентрация запасов цитокинов, используемых в протоколе дифференцировки. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Протокол, который мы здесь описываем, позволяет генерировать механочувствительные эндотелиальные клетки из плюрипотентных стволовых клеток человека и изучать их реакцию на механическую стимуляцию, опосредованную контролируемым напряжением сдвига. Этот протокол полностью основан на цитокинах и полностью совместим с реагентами GMP для потенциальной трансляции в производство клеток для клеточной терапии.
Получение ИПСК предоставляет ученым инструментальную модель для ранних стадий эмбрионального развития, которая позволяет изучать процессы, которые иначе трудно изучать in vivo24. На самом деле, человеческие эмбриональные ткани, доступные для исследования, собираются из эмбрионов, лишенных кровообращения, и это может оказать значительное влияние на молекулярную сигнатуру, контролируемую механическими сигналами. Описанный здесь подход позволяет визуализировать в реальном времени и изучать реакцию клеток на напряжение сдвига. Комбинация ИПСК с флюидикой обеспечивает модель исследования, которая преодолевает ограниченную доступность и недоступность развивающихся тканей плода, когда инициация кровообращения ремоделирует и контролирует создание сердечно-сосудистой системы и системы крови 3,9,10,25.
Ограничением протокола является то, что эндотелиальные клетки, полученные из этого протокола, могут не отражать различные идентичности различных эндотелиальных клеток, присутствующих в развивающихся тканях. Для преодоления этого ограничения может потребоваться специфическая комбинация цитокинов в процессе дифференцировки, предшествующем флюидной стимуляции, для получения желаемой идентичности или тканеспецифического фенотипа26. Выделение эндотелиальных субпопуляций может быть получено с использованием более уточненного иммунофенотипа на этапе выделения. Этот протокол изолирует эндотелиальные клетки только на основе экспрессии CD34, что позволяет выделять колонки вместо флуоресцентно-активированной сортировки клеток (FACS); Это снижает гибель клеток и риск загрязнения. Кроме того, этот протокол специально разработан для изучения роли напряжения сдвига, опосредованного ламинарным потоком. Альтернативные флюидные подходы должны быть использованы для изучения влияния других механических сигналов, таких как растяжение или сжатие, или других типов потока, таких как возмущенный или возмущенный поток.
Ранее мы показали, что эндотелиальные клетки, полученные из ИПСК, имитируют гетерогенные артериовенозные клеточные идентичности27, аналогичные тем, которые наблюдаются в дорсальной аорте плода28,29,30. Это имеет особое значение в контексте развития сосудов и клеточной спецификации, которые, как известно, контролируются кровообращением. Исследования на различных моделях показали, что недостаточное кровообращение приводит к изменению артериовенозной спецификации11,14,31. Механизмы, связывающие механические сигналы со спецификацией клетки, до сих пор неизвестны, и описанный здесь конвейер позволяет проводить уточненные функциональные исследования, которые не могут быть проверены in vivo.
Этот конвейер описывает производство и стимуляцию эндотелиальных клеток, полученных из ИПСК, с использованием коммерчески доступных флюидных каналов, что позволяет избежать необходимости отливки устройств, как в случае с широко используемыми устройствами из полидиметилсилоксана (ПДМС)12. Кроме того, использование чипов PDMS делает сбор стимулированных клеток особенно сложным, в то время как с помощью этого протокола клетки могут быть легко извлечены из канала. Это значительно повышает аналитическую мощность, позволяя проводить последующие анализы, такие как протеомный и транскриптомный анализы, проточная цитометрия и функциональные анализы, которые могут потребовать дальнейшего культивирования или анализа in vivo .
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Эта работа была поддержана грантом Research Advanced Grant 2021 от Европейской ассоциации гематологов, Global Research Award 2021 от Американского общества гематологов и Фондом поддержки внутренней стратегии ISSF3, финансируемым Welcome Trust и Эдинбургским университетом. Мы благодарим Фиону Росси (Fiona Rossi) из Центра проточной цитометрии за поддержку в анализе проточной цитометрии. В целях открытого доступа автор применил лицензию Creative Commons Attribution (CC BY) к любой версии рукописи, принятой автором, возникшей в результате этой публикации.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
Ссылки
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены