Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Респирометрия высокого разрешения для оценки функции митохондрий в сперматозоидах человека
В этой статье
Erratum Notice
Резюме
Анализ митохондриальной функции сперматозоидов с помощью респирометрии высокого разрешения позволяет измерять потребление кислорода свободно движущимися сперматозоидами в замкнутой камере. Метод может быть применен для измерения дыхания в сперматозоидах человека, что дает информацию о митохондриальных характеристиках и целостности сперматозоидов.
Аннотация
Качество спермы часто изучается с помощью рутинного анализа спермы, который является описательным и часто неубедительным. Мужское бесплодие связано с измененной митохондриальной активностью сперматозоидов, поэтому измерение митохондриальной функции сперматозоидов является показателем качества спермы. Респирометрия высокого разрешения — это метод измерения потребления кислорода клетками или тканями в системе с закрытой камерой. Этот метод может быть применен для измерения дыхания в сперматозоидах человека и предоставляет информацию о качестве и целостности митохондрий сперматозоидов. Респирометрия с высоким разрешением позволяет клеткам свободно двигаться, что является априорным преимуществом в случае сперматозоидов. Этот метод может применяться с интактными или пермеабилизированными сперматозоидами и позволяет исследовать интактную функцию митохондрий сперматозоидов и активность отдельных комплексов дыхательной цепи. Оксиграф высокого разрешения использует датчики для измерения концентрации кислорода в сочетании с чувствительным программным обеспечением для расчета потребления кислорода. Полученные данные используются для расчета дыхательных индексов на основе коэффициентов потребления кислорода. Следовательно, индексы представляют собой пропорции двух скоростей потребления кислорода и внутренне нормируются к количеству клеток или массе белка. Дыхательные индексы являются индикатором митохондриальной функции и дисфункции сперматозоидов.
Введение
По оценкам, мужское бесплодие составляет 40-50% всех случаев бесплодия в парах1. Обычный анализ спермы играет решающую роль в определении мужской фертильности; Тем не менее, примерно 15% бесплодных мужчин имеют нормальные параметры сперматозоидов2. Кроме того, рутинный анализ спермы дает ограниченную информацию о функции сперматозоидов и не отражает малозаметные дефекты сперматозоидов3.
Митохондрии сперматозоидов имеют особое строение, так как расположены в виде спиральной оболочки вокруг жгутиков. Митохондриальная оболочка содержит переменное число митохондрий, соединенных межмитохондриальными линкерами и закрепленных в цитоскелете упорядоченными белковыми расположениями на внешней митохондриальной мембране 4,5. Такая структура особенно затрудняет выделение митохондрий сперматозоидов. Поэтому в большинстве исследований митохондриальной функции сперматозоидов используют анализ in situ или демембрированных сперматозоидов6.
Митохондриальная структура и функции сперматозоидов последовательно связаны с мужским бесплодием 7,8,9,10,11, что позволяет предположить, что анализ структуры и функции этих органелл может быть хорошим кандидатом для включения в анализ спермы.
Митохондрии играют важную роль в клеточном энергетическом метаболизме, в частности, используя кислород для производства аденозинтрифосфата (АТФ) путем окислительного фосфорилирования (OXPHOS). В сперматозоидах, в частности, источник АТФ (гликолиз против OXPHOS) является спорным, и большая часть данных остается спорной и зависит от различных экспериментальных подходов 4,12,13. Измерения дыхания с помощью оксиметрии дают важное представление о дыхательной способности митохондрий, целостности митохондрий и энергетическом метаболизме клетки14,15,16. Традиционно этот метод выполнялся с использованием кислородного электрода Кларка – прибора, который использовался для измерения митохондриального дыхания более 50лет. Кроме того, было проанализировано потребление кислорода митохондриями сперматозоидов с помощью классического кислородного электрода Кларка 19,20,21. Респирометрия высокого разрешения (HRR) с использованием оксиграфов (Oroboros) обеспечивает более высокую чувствительность, чем использование классических респирометрических приборов22. Оксиграфы состоят из двух камер с инжекционными портами, и каждая камера оснащена полярографическим датчиком кислорода. С помощью этого метода можно анализировать тканевые слайды, клетки и изолированные митохондриальные суспензии. Образец непрерывно перемешивается в камере, и во время эксперимента измеряется потребление кислорода, а скорость кислорода рассчитывается с помощью специального программного обеспечения. Камеры демонстрируют пониженную утечку кислорода, что является преимуществом по сравнению с обычными кислородными электродными устройствами 14,23.
Как и в случае с другими клетками, в случае сперматозоидов чувствительность оборудования HRR выше, чем для обычной респирометрии, что означает, что оборудование HRR может быть использовано для анализа ограниченного количества интактных или пермеабилизированных сперматозоидов. Существует две основные стратегии оценки митохондриальной функции сперматозоидов с помощью HRR: (а) измерение потребления кислорода в интактных клетках, которое включает воспроизведение дыхательной функции в среде, содержащей субстраты, такие как глюкоза, или (б) измерение потребления кислорода в пермеабилизированных клетках с использованием одного из комплексов OXPHOS с добавлением специфических субстратов для мониторинга каждой функции отдельно.
В настоящем исследовании мы описываем использование HRR для определения митохондриального дыхания в сперматозоидах человека.
протокол
Эксперименты были одобрены Комитетом по этике Медицинского факультета Университета Республики в Монтевидео, Уругвай.
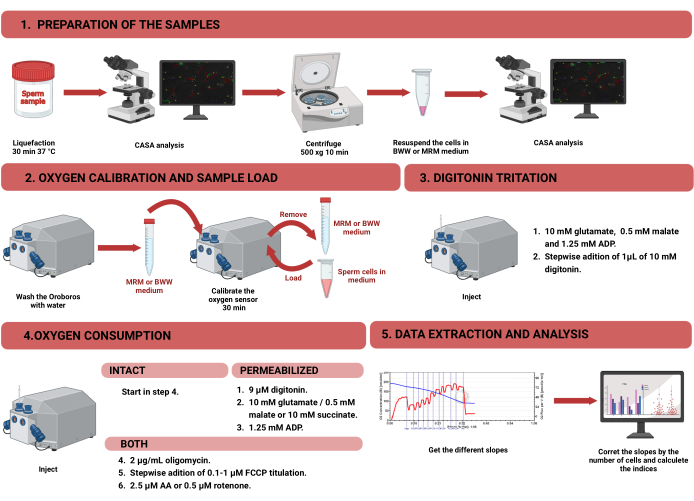
Рисунок 1: Рабочий процесс для респирометрии высокого разрешения для оценки функции митохондрий в интактных и пермеабилизированных сперматозоидах человека. Протокол был разделен на четыре этапа: 1) подготовка образца, 2) калибровка кислорода в приборе «Ороборос», 3) измерение потребления кислорода для интактных и пермеабилизированных ячеек и 4) извлечение данных из оборудования и анализ. Сокращения: CASA = компьютерный анализ спермы; BWW = Biggers Whitten Whittingham средний; MRM = среда митохондриального дыхания; АДФ = аденозиндифосфат; FCCP = карбонильцианид --трифторметоксифенилгидразон; AA = антимицин А. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
ПРИМЕЧАНИЕ: Рабочий процесс измерения потребления кислорода в сперматозоидах с помощью HRR показан на рисунке 1. Информация о материалах, оборудовании и реактивах, используемых в протоколе, представлена в Таблице материалов.
1. Пробоподготовка
- Отбор проб
- Соберите свежеэякулированную человеческую сперму путем мастурбации после рекомендуемого 3-дневного воздержания в стерильном пластиковом контейнере. Немедленно транспортируйте образцы в лабораторию.
- Инкубируют образцы в течение 30-60 мин при комнатной температуре (RT) до полного разжижения24.
- После сжижения храните образцы при температуре 37 °C до начала эксперимента.
- Оценка сперматозоидов с помощью компьютерного анализа спермы (CASA)
- Смешайте образец и загрузите 7 мкл в предварительно разогретую камеру для подсчета сперматозоидов.
- Поместите камеру на предварительно нагретый (37 °C) предметный столик микроскопа прямого света.
- Откройте компьютеризированное программное обеспечение для анализа спермы и войдите в модуль подвижности и концентрации спермы (нажмите на Mot).
- Выберите конфигурацию, соответствующую состоянию сперматозоидов человека.
ПРИМЕЧАНИЕ: Конфигурация должна быть адаптирована к типу и глубине камеры, а также к видам образцов и системе CASA. - Случайным образом проанализируйте 10 различных полей в камере, нажав на кнопку «Анализировать ».
- Нажмите « Результаты », чтобы получить концентрацию и подвижность образца.
- Подготовка клеток
ПРИМЕЧАНИЕ: Если HRR не откалиброван, начните с шагов 2.1-2.2 перед подготовкой ячеек (шаг 1.3). Важно измерять потребление кислорода сразу после того, как сперматозоиды ресуспендируют в среде.- Центрифугируют образцы при 400 x g в течение 10 мин при RT.
- Удалите семенную плазму и ресуспендируйте сперматозоиды в 2 мл Biggers Whitten Whittingham (BWW) для экспериментов с интактными клетками или митохондриальной дыхательной средой (MRM) для исследований с пермеабилизированными клетками. Составы сред приведены в таблице 1.
- Повторите шаги, описанные в шаге 1.2, для исследования концентрации сперматозоидов.
2. Респирометрия высокого разрешения: анализ OXPHOS
ПРИМЕЧАНИЕ: HRR интегрирует высокочувствительные оксиграфы (Oxygraph-2 K; Oroboros Instruments GmbH, Инсбрук, Австрия) с программным обеспечением (DatLab, версия 4.2; Ороборос Инструментс ГмбХ). Экспериментальные данные отображаются в виде зависимости концентрации кислорода от времени (в виде пмоль O2/106 клеток·мин−1) и в виде преобразований этих данных в реальном времени, что позволяет экспериментатору отслеживать дыхание (потребление кислорода, поток кислорода) биологических и биохимических образцов во время эксперимента. HRR может быть использован для отслеживания дыхания живых и подвижных клеток, что особенно полезно для сперматозоидов, подвижность которых связана с качеством сперматозоидов и потенциалом фертильности. В лаборатории используется HRR Oroboros Oxygraph 2-k, Oroboros Instruments, с двумя камерами. Шаги, описанные в этом протоколе, должны выполняться независимо для обеих камер объемом 2 мл.
- Подготовка оборудования
- Включите HRR и подключите его к программному обеспечению для респирометрии (DatLab) для сбора и анализа данных.
- Замените 70% этанол в камере оксиграфа на ddH2O. Непрерывно перемешивайте его магнитной мешалкой в камере со скоростью 750 об/мин. Дайте ему постоять 10 минут, а затем отсосите двойную дистилляцию (dd) H2O.
- Промойте камеру три раза с ddH2O в течение 5 минут каждый раз.
ПРИМЕЧАНИЕ: Этот шаг необходим для удаления оставшегося этанола из камер. Сперматозоиды очень чувствительны к этанолу. Запись может быть скомпрометирована, если пропустить этот шаг.
- Калибровка лямбда-зондов
ПРИМЕЧАНИЕ: Процедура калибровки немного отличается в зависимости от прибора. Выполняют воздушную калибровку полярографического датчика кислорода, как описано изготовителем25. В этом разделе кратко описан протокол калибровки.- Удалите ddH 2 O и пипетку2мл той же среды, которая использовалась для подготовки клеток, в камеру. Установите пробки, оставив пузырь воздухообмена.
ПРИМЕЧАНИЕ: Важно знать объем камеры, чтобы определить точный объем необходимой среды. - Запишите значения калибровки кислорода (нажмите на Layout > 01 Calibration Exp. Gr3-Temp), чтобы контролировать производительность мембраны датчика, перемешивая среду с помощью мешалки при 750 об/мин в течение не менее 30 минут при 37 °C. Используйте другие настройки, как уже упоминалось: усиление для датчика: 2; поляризационное напряжение: 800 мВ; Интервал записи данных: 2,0 с.
ПРИМЕЧАНИЕ: Ожидается получение наклонаO2 без коррекции (красная линия) в пределах ±2 пмоль∙с−1∙мл−1 при стабильном сигнале от полярографического датчика. - Перетащите мышь, удерживая левую кнопку мыши и клавишу Shift, чтобы выбрать область, где изменение концентрации кислорода (концентрация Y1 O2, синяя линия) стабильно.
- Откройте окно O2 Calibration (нажмите на Oxygraph > O2 Calibration). В разделе «Калибровка воздуха» измените выбранную метку на регион, выбранный на шаге 2.2.3. Завершите, нажав « Калибровка» и «Копировать в буфер обмена».
- Остановите запись и сохраните, нажав «Оксиграф» > « Ok Control» > «Сохранить и отключить».
ПРИМЕЧАНИЕ: Этот набор данных должен быть сохранен, чтобы его можно было использовать во всех экспериментах дня. Калибровка выполняется только один раз в день для каждого носителя.
- Удалите ddH 2 O и пипетку2мл той же среды, которая использовалась для подготовки клеток, в камеру. Установите пробки, оставив пузырь воздухообмена.
- Дигитонин-пермеабилизационное титрование
- Откройте камеру и аспирируйте среду внутри.
- Загрузите в камеру не менее 24 х 10 6 и не более 70 х 106 сперматозоидов в конечный объем 2 мл МРМ.
ПРИМЕЧАНИЕ: Важно измерить количество клеток в камере, чтобы отрегулировать потребление кислорода в конце эксперимента. Меньшее количество клеток, чем рекомендуется, не может быть измерено. - Закройте камеру, протолкнув пробки до упора, и аспирируйте оставшуюся жидкость наверху. Начните эксперимент с теми же настройками, что и для калибровки: скорость перемешивания: 750 об/мин; температура: 37 °C; усиление для датчика: 2; поляризационное напряжение: 800 мВ; и интервал записи данных: 2,0 с.
- Чтобы загрузить калибровку, дважды щелкните по окошку Pos Calib в нижнем углу. Откройте калибровку, выполненную на шаге 2.2 (нажмите «Оксиграф» > « Калибровка O2» > «Копировать из файла»), и нажмите «Калибровка и копирование в буфер обмена».
ПРИМЕЧАНИЕ: Коробка POS Calib изменится с желтого на зеленый. Данные отображаются в виде графиков расхода кислорода с поправкой на объем (Layout 05 Flux per Volume uncorrected). В Oxygraph > Layout доступны различные макеты. - Добавьте 5 мкл 0,5 М аденозиндифосфата (АДФ), 10 мкл 2 М глутамата и 2,5 мкл 0,4 М малата (конечные концентрации: 1,25 мМ, 10 мМ и 0,5 мМ). Измеряйте расход кислорода до тех пор, пока сигнал не стабилизируется.
ПРИМЕЧАНИЕ: Прецизионные микрошприцы Hamilton используются для инъекций через загрузочное отверстие в пробке. Используйте один шприц для каждого препарата, чтобы избежать перекрестного загрязнения. Нажмите на F4 , чтобы зарегистрироваться, и отметьте в кислородном регистре добавление процедуры.
ПРИМЕЧАНИЕ: Субстраты готовят в сверхчистой воде и хранят при температуре −20 °C в течение 3 месяцев. - Тритат путем добавления 1 мкл 10 мМ дигитонина в последовательных шагах до тех пор, пока потребление кислорода не достигнет максимального уровня.
ПРИМЕЧАНИЕ: Тщательная промывка водой, 70% этанола и 100% этанолом необходима, если одна и та же камера используется для двух экспериментов в один и тот же день.
ПРИМЕЧАНИЕ: Дигитонин готовят в сверхчистой воде и хранят при температуре −20 °C в течение 3 месяцев.
- Протокол рутинной дыхательной оценки интактных и пермеабилизированных сперматозоидов (комплекс I или комплекс II)
- Откройте камеру и аспирируйте среду внутри.
- Загрузите в камеру не менее 24 х 10 6 и не более 70 х 106 сперматозоидов в конечном объеме 2 мл BWW (анализ интактных клеток) или MRM (анализ пермеабилизированных клеток).
- Начните эксперимент с теми же настройками, что и для калибровки (это описано в шаге 2.3.3).
- Загрузите калибровку, выполненную на шаге 2.2, как описано в шаге 2.3.4.
- Записывайте дыхание клеток не менее 5 мин до получения стабильного сигнала. Этот показатель соответствует базальному дыханию в интактных клетках.
- Если эксперимент проводится с интактными клетками, переходите к шагу 2.4.9. Для пермеабилизированных клеток вводят 4,5 мкл 10 мМ дигитонина (конечная концентрация: 22,5 мкМ). Пермеабилизируйте клетки в течение 5 мин.
- Добавьте субстраты: 10 мкл 2 М глутамата и 2,5 мкл 0,4 М малата (конечные концентрации: 10 мМ и 0,5 мМ соответственно) для комплекса I или 20 мкл 1 М сукцината (конечная концентрация: 10 мМ) для комплекса II. Измеряйте расход кислорода до тех пор, пока сигнал не усилится и не стабилизируется. Это состояние 4, что означает опорное дыхание базального комплекса I или базального комплекса II при отсутствии АДФ.
ПРИМЕЧАНИЕ: Субстраты готовят в сверхчистой воде и хранят при температуре −20 °C в течение 3 месяцев. - Ввести 5 мкл 0,5 М АДФ (конечная концентрация: 1,25 мМ). Измеряйте расход кислорода до тех пор, пока сигнал не усилится и не стабилизируется. Добавление АДФ увеличивает сигнал, соответствующий максимальному потреблению кислорода через комплекс I или комплекс II (состояние 3, в пермеабилизированных клетках).
- Добавьте 1 мкл 4 мг/мл олигомицина (конечная концентрация: 2 мкг/мл), ингибитора АТФ-синтетазы. Измеряйте расход кислорода до тех пор, пока сигнал не уменьшится и не стабилизируется.
ПРИМЕЧАНИЕ: Олигомицин готовят в этаноле и хранят при температуре −20 °C в течение 3 месяцев. - Титрование путем добавления от 1 мкл от 0,1 мМ до 1 мМ карбонилцианида--трифторметоксифенилгидразона (FCCP) в последовательные этапы до достижения максимальной скорости несвязанного дыхания. Измеряйте расход кислорода до тех пор, пока сигнал не усилится и не стабилизируется.
ПРИМЕЧАНИЕ: FCCP готовят в этаноле и хранят при температуре −20 °C в течение 3 месяцев. - Конечная концентрация FCCP зависит от образца. Прекратите вводить препарат, когда потребление кислорода начнет снижаться.
- Наконец, введите 1 мкл антимицина А 5 мМ (конечная концентрация 2,5 мкМ). Это комплексный ингибитор III для различения митохондриального и остаточного потребления кислорода (немитохондриальное дыхание). Для анализа комплекса I добавляют 1 мкл 1 мМ ротенона (конечная концентрация 0,5 мкМ), ингибитора этого комплекса, вместо АА. Измеряйте расход кислорода до тех пор, пока сигнал не уменьшится и не стабилизируется.
ПРИМЕЧАНИЕ: Препараты готовят в этаноле и хранят при температуре −20 °C в течение 3 месяцев.
3. Извлечение и анализ данных
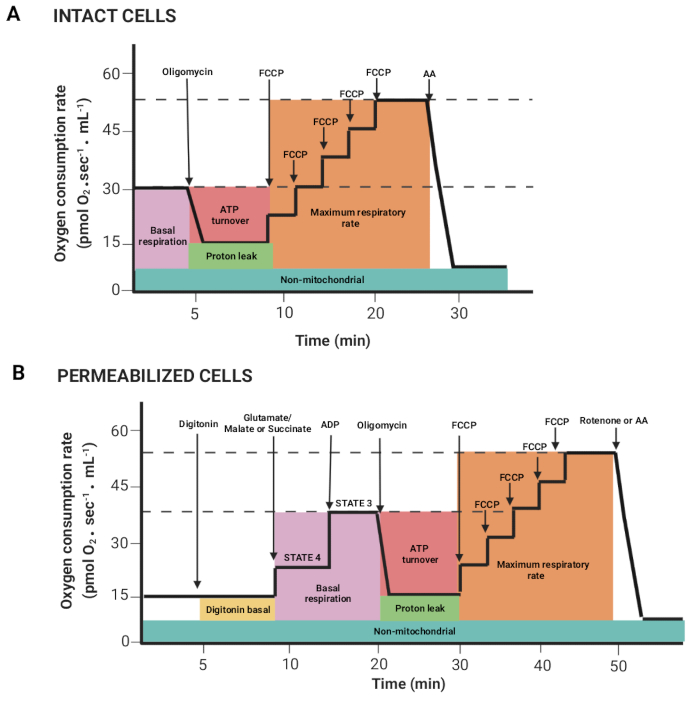
Рисунок 2: Получение параметров дыхания из эксперимента по респирометрии с высоким разрешением. (A,B) Схематические изображения графиков, полученных, как описано на рисунке 1, для интактных и пермеабилизированных клеток соответственно. Эти параметры были описаны ранее15. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
- Перетащите мышь, нажав левую кнопку мыши и клавишу Shift, чтобы выбрать области, где поток кислорода на объем коррелирует (Y2 O2 наклон некоррелированный, красная линия) стабилен после введения субстрата или ингибитора. На рисунке 2 показаны различные параметры, полученные из ранее описанного регистра15.
ПРИМЕЧАНИЕ: Параметры зависят от эксперимента; все они следующие: базальное дыхание в интактных клетках и дыхание в присутствии глутамата/малата или сукцината (состояние 4), АДФ (состояние 3), олигомицина (утечка протонов), FCCP (максимальная частота дыхания), ротенон/АА (немитохондриальное дыхание). В пермеабилизированных клетках базальное дыхание соответствует состоянию 3. - Нажмите на окна Метки > Статистика и экспортируйте данные.
- Нормализуйте полученные данные на 1 миллион сперматозоидов. Единицами наклона являются пмольО2·с−1·мл−1·мл−1·10−6 клеток.
- Вычтите немитохондриальное потребление кислорода из всех значений перед расчетом индексов.
- Рассчитайте индексы, используя различные уравнения, описанные ранее15:

Результаты
Определение оптимальной концентрации дигитонина в сперматозоидах
В этом протоколе мы представляем использование HRR для мониторинга изменений OXPHOS в сперматозоидах человека в режиме реального времени. Поскольку метод может быть использован для анализа интактных или дигито?...
Обсуждение
HRR критически зависит от нескольких этапов: (а) техническое обслуживание оборудования, (б) точная калибровка датчиков кислорода, (в) титрование развязки26 и, наконец, (г) адекватное использование индексов, представляющих митохондриальную функцию. Техническое обслуживание об?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы хотели бы поблагодарить андрологическую клинику Fertilab, особенно Хосе Марию Монтеса и Андреа Торрентса, за то, что они предоставили нам доступ к донорам. Финансирование: A.C. поддерживается грантами Universidad de la República (CSIC_2018, Espacio Interdisciplinario_2021). Дополнительное финансирование было получено от Programa de Desarrollo de Ciencias Básicas (PEDECIBA, Уругвай). P.I. и R.S. поддерживаются Universidad de la República (I+D, CSIC 2014; I+D, CSIC 2016, Iniciación a la Investigación, CSIC 2019 и FMV_1_2017_1_136490 ANII-Уругвай). P.I. поддерживается POS_FMV_2018_1_1007814 и CAP-UDELAR 2020. Рисунки проиллюстрированы с помощью Biorender.com.
Материалы
| Name | Company | Catalog Number | Comments |
| Acid free- Bovine serum albumine | Sigma Aldrich | A8806 | |
| Adenosine 5'-diphosphate monopotassium salt dihydrate | Sigma Aldrich | A5285 | |
| Animycin A from streptomyces sp. | Sigma Aldrich | A8674 | |
| Calcium chloride | Sigma Aldrich | C4901 | |
| carbonyl cyanide-P- trifluoromethoxy-phenylhydrazone | Sigma Aldrich | C2920 | |
| DatLab sofware version 4,2 | Oroboros Instruments GmbH | N/A | |
| D-glucose | Sigma Aldrich | G7021 | |
| Digitonin | Sigma Aldrich | D141 | |
| EGTA | Sigma Aldrich | E4378 | |
| HEPES | Sigma Aldrich | H3375 | |
| L glutamic acid | Sigma Aldrich | G1251 | |
| L malic acid | Sigma Aldrich | M1000 | |
| Magnesium sulphate | Sigma Aldrich | M7506 | |
| Microliter Syringes | Hamilton | 87900 or 80400 | |
| Microscope camera | Basler | acA780-75gc | |
| Microscope Eclipse E200 with phase contrast 10X Ph+ | Nikon | N/A | |
| Monopotassium phosphate | Sigma Aldrich | P5655 | |
| MOPS | Sigma Aldrich | M1254 | |
| Oligomycin A | Sigma Aldrich | 75351 | |
| Oxygraph-2 K | Oroboros Instruments GmbH | N/A | |
| Potassium chloride | Sigma Aldrich | P3911 | |
| Power O2k-Respirometer | Oroboros Intruments | 10033-01 | |
| Rotenone | Sigma Aldrich | R8875 | |
| Saccharose | Sigma Aldrich | S0389 | |
| Sodium bicarbonate | Sigma Aldrich | S5761 | |
| Sodium lactate | Sigma Aldrich | L7022 | |
| Sodium pyruvate | Sigma Aldrich | P2256 | |
| Sperm class analyzer 6.3.0.59 Evolution-SCA Research | Microptic | N/A | |
| Sperm Counting Chamber DRM-600 | Millennium Sciences CELL-VU | N/A | |
| Succinate disodium salt | Sigma Aldrich | W327700 |
Ссылки
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reproductive Biology and Endocrinology. 13, 37 (2015).
- Guzick, D. S., et al. Sperm morphology, motility, and concentration in fertile and infertile men. The New England Journal of Medicine. 345 (19), 1388-1393 (2001).
- Wang, C., Swerdloff, R. S. Limitations of semen analysis as a test of male fertility and anticipated needs from newer tests. Fertility and Sterility. 102 (6), 1502-1507 (2014).
- Amaral, A. Energy metabolism in mammalian sperm motility. WIREs Mechanisms of Disease. 14 (5), e1569 (2022).
- Leung, M. R., et al. In-cell structures of conserved supramolecular protein arrays at the mitochondria-cytoskeleton interface in mammalian sperm. Proceedings of the National Academy of Sciences of the United States of America. 118 (45), e2110996118 (2021).
- Moraes, C. R., Meyers, S. The sperm mitochondrion: Organelle of many functions. Animal Reproduction Science. 194, 71-80 (2018).
- Cassina, A., et al. Defective human sperm cells are associated with mitochondrial dysfunction and oxidant production. Biology of Reproduction. 93 (5), 119 (2015).
- Marchetti, C., Obert, G., Deffosez, A., Formstecher, P., Marchetti, P. Study of mitochondrial membrane potential, reactive oxygen species, DNA fragmentation and cell viability by flow cytometry in human sperm. Human Reproduction. 17 (5), 1257-1265 (2002).
- Amaral, A., Lourenço, B., Marques, M., Ramalho-Santos, J. Mitochondria functionality and sperm quality. Reproduction. 146 (5), R163-R174 (2013).
- Durairajanayagam, D., Singh, D., Agarwal, A., Henkel, R. Causes and consequences of sperm mitochondrial dysfunction. Andrologia. 53 (1), e13666 (2021).
- Uribe, P., et al. Use of the fluorescent dye tetramethylrhodamine methyl ester perchlorate for mitochondrial membrane potential assessment in human spermatozoa. Andrologia. 49 (9), e12753 (2017).
- Storey, B. T. Mammalian sperm metabolism: Oxygen and sugar, friend and foe. The International Journal of Developmental Biology. 52 (5-6), 427-437 (2008).
- Tourmente, M., Sansegundo, E., Rial, E., Roldan, E. R. S. Capacitation promotes a shift in energy metabolism in murine sperm. Frontiers in Cell and Developmental Biology. 10, 950979 (2022).
- Gnaiger, E., Dykens, J. A., Will, Y. Chapter 12 - Polarographic oxygen sensors, the oxygraph, and high-resolution respirometry to assess mitochondrial function. Drug-Induced Mitochondrial Dysfunction. , 325-352 (2008).
- Brand, M. D., Nicholls, D. G. Assessing mitochondrial dysfunction in cells. Biochemical Journal. 435 (2), 297-312 (2011).
- Awadhpersad, R., Jackson, C. B. High-resolution respirometry to assess bioenergetics in cells and tissues using chamber- and plate-based respirometers. Journal of Visualized Experiments: JoVE. (176), e63000 (2021).
- Chance, B., Williams, G. R. A simple and rapid assay of oxidative phosphorylation. Nature. 175 (4469), 1120-1121 (1955).
- Li, Z., Graham, B. H. Measurement of mitochondrial oxygen consumption using a Clark electrode. Methods in Molecular Biology. 837, 63-72 (2012).
- Stendardi, A., et al. Evaluation of mitochondrial respiratory efficiency during in vitro capacitation of human spermatozoa. International Journal of Andrology. 34 (3), 247-255 (2011).
- Ferramosca, A., Focarelli, R., Piomboni, P., Coppola, L., Zara, V. Oxygen uptake by mitochondria in demembranated human spermatozoa: A reliable tool for the evaluation of sperm respiratory efficiency. International Journal of Andrology. 31 (3), 337-345 (2008).
- Ferramosca, A., et al. Modulation of human sperm mitochondrial respiration efficiency by plant polyphenols. Antioxidants. 10 (2), 217 (2021).
- Gnaiger, E., Steinlechner-Maran, R., Méndez, G., Eberl, T., Margreiter, R. Control of mitochondrial and cellular respiration by oxygen. Journal of Bioenergetics and Biomembranes. 27 (6), 583-596 (1995).
- . O2k Quality Control 1: Polarographic oxygen sensors and accuracy of calibration Available from: https://www.bioblst.at/images/archive/7/77/20210819114548%21MiPNet06.03_POS-Calibration-SOP.pdf (2020)
- WHO Laboratory Manual for the Examination and Processing of Human Semen. World Health Organization Available from: https://www.who.int/publications/i/item/9789240030787 (2010)
- . O2k-protocols SOP: O2k quality control 1 Available from: https://www.bioblast.at/images/9/9c/MiPNet06.03_POS-Calibration-SOP_DatLab8.pdf (2021)
- Gnaiger, E. . Mitochondrial Pathways and Respiratory Control. , (2012).
- Steinlechner-Maran, R., Eberl, T., Kunc, M., Margreiter, R., Gnaiger, E. Oxygen dependence of respiration in coupled and uncoupled endothelial cells. The American Journal of Physiology. 271, C2053-C2061 (1996).
- Holt, W. V., Van Look, K. J. W. Concepts in sperm heterogeneity, sperm selection and sperm competition as biological foundations for laboratory tests of semen quality. Reproduction. 127 (5), 527-535 (2004).
- Sousa, A. P., et al. Not all sperm are equal: Functional mitochondria characterize a subpopulation of human sperm with better fertilization potential. PloS One. 6 (3), e18112 (2011).
- Moscatelli, N., et al. Single-cell-based evaluation of sperm progressive motility via fluorescent assessment of mitochondria membrane potential. Scientific Reports. 7, 17931 (2017).
- Ferreira, J. J., et al. Increased mitochondrial activity upon CatSper channel activation is required for mouse sperm capacitation. Redox Biology. 48, 102176 (2021).
- Irigoyen, P., et al. Mitochondrial metabolism determines the functional status of human sperm and correlates with semen parameters. Frontiers in Cell and Developmental Biology. 10, 926684 (2022).
Erratum
Formal Correction: Erratum: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa
Posted by JoVE Editors on 9/26/2023. Citeable Link.
An erratum was issued for: High-Resolution Respirometry to Assess Mitochondrial Function in Human Spermatozoa. The Protocol and Representative Result sections were updated.
Step 2.4.12 of the Protocol was updated from:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex II inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
to:
Finally, inject 1 µL of 5 mM antimycin A (2.5 µM final concentration). This is a complex III inhibitor to discriminate between the mitochondrial and residual oxygen consumption (non-mitochondrial respiration). For the analysis of complex I, add 1 µL of 1 mM rotenone (0.5 µM final concentration), an inhibitor of this complex, instead of AA. Measure the oxygen consumption until the signal decreases and stabilizes.
Figure 3 in the Representative Results section was updated from:
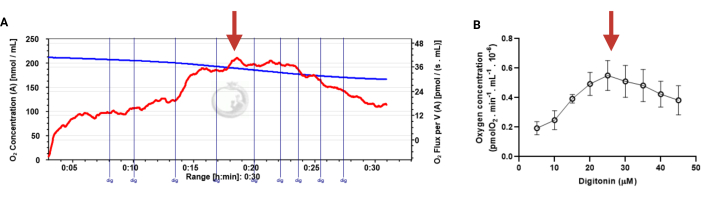
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
to:
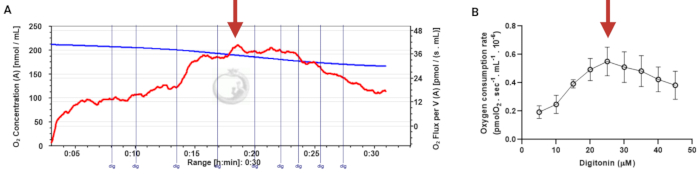
Figure 3: Determination of the optimal concentration of digitonin for the permeabilization of human sperm cells. The respiration rates were measured at 37 °C in MRM medium with glutamate, malate, and adenosine diphosphate. (A) Representative respiratory trace. The blue line is the O2 concentration, and the red line represents the O2 flow per volume correlated. (B) Mitochondria respiration rate means ± standard error, n = 4. The red arrow represents the optimal concentration. Abbreviation: dig = digitonin. Please click here to view a larger version of this figure.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены