Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
3D-биопечать фотонастраиваемых гидрогелей для изучения активации фибробластов
В этой статье
Резюме
В данной статье описывается, как выполнить 3D-биопечать фотонастраиваемых гидрогелей для изучения жесткости внеклеточного матрикса и активации фибробластов.
Аннотация
Фотонастраиваемые гидрогели могут трансформироваться пространственно и во времени в ответ на воздействие света. Включение этих типов биоматериалов в платформы клеточных культур и динамический запуск изменений, таких как увеличение жесткости микросреды, позволяет исследователям моделировать изменения во внеклеточном матриксе (ВКМ), которые происходят во время прогрессирования фиброзного заболевания. Представлен метод 3D-биопечати фотонастраиваемого гидрогелевого биоматериала, способного к двум последовательным реакциям полимеризации в ванне с желатиновой подложкой. Техника биопечати Freeform Reversible Embedding of Suspended Hydrogels (FRESH) была адаптирована путем регулировки pH опорной ванны для облегчения реакции присоединения по Майклу. Во-первых, биочернила, содержащие полиэтиленгликоль-альфа-метакрилат (ПЭГαМА), реагировали вне стехиометрии с клеточным разлагаемым сшивающим агентом с образованием мягких гидрогелей. Эти мягкие гидрогели позже подвергались воздействию фотоинициатора и света, чтобы вызвать гомополимеризацию непрореагировавших групп и сделать гидрогель более жестким. Этот протокол охватывает синтез гидрогеля, 3D-биопечать, фоторестирирование и характеризацию конечных точек для оценки активации фибробластов в 3D-структурах. Представленный здесь метод позволяет исследователям напечатать на 3D-принтере различные материалы, которые подвергаются реакциям полимеризации, катализируемым pH, и может быть реализован для создания различных моделей тканевого гомеостаза, заболеваний и репарации.
Введение
3D-биопечать — это революционная технология, которая позволяет исследователям точно депонировать клетки и биоматериалы в 3D-объемах и воссоздавать сложную иерархическую структуру биологических тканей. За последнее десятилетие достижения в области 3D-биопечати позволили создать биющиеся сердечные тканичеловека1, функциональные модели тканей почек2, модели газообмена в легких3 и модели опухолей для исследования рака4. Изобретение встроенных методов 3D-биопечати, таких как реверсивное встраивание взвешенных гидрогелевых биопринтов Freeform (FRESH), позволило воспроизвести в 3D сложные структуры мягких тканей, такие как легочные кровеносные сосуды5 и даже человеческое сердце6 . 3D-биопечать FRESH облегчает послойную печать мягких и маловязких биочернил путем экструзии в поддерживающей ванне для разбавления сдвига. Опорная ванна состоит из такого материала, как плотно упакованные микрочастицы желатина, которые действуют как пластик Бингама и сохраняют заданную форму и структуру биочернил после печати. После того, как напечатанная конструкция затвердеет, опорную ванну можно растворить, повысив температуру до 37 °C7.
В недавней обзорной статье были обобщены материалы, которые были напечатаны на 3D-принтере в различных изданиях с использованием техники FRESH. Эти материалы природного происхождения варьируются от коллагена I типа до метакрилированной гиалуроновой кислоты и представляют собой несколько различных механизмов гелеобразования7. В большинстве исследований, проведенных с использованием этой техники 3D-биопечати, используются статические биоматериалы, которые не изменяются в ответ на внешние раздражители. Динамические фотонастраиваемые гидрогелевые биоматериалы были использованы нашей лабораторией и другими лабораториями 8,9,10,11,12 для моделирования различных фиброзных заболеваний. В отличие от статических биоматериалов, фотонастраиваемые биочернила позволяют создать размягченную модель с более низким значением модуля упругости, а затем сделать ее более жесткой для изучения клеточных реакций на увеличение жесткости в микросреде.
Фиброзные заболевания характеризуются увеличением выработки внеклеточного матрикса, что может вызвать рубцевание и скованность13. Огрубение тканей может инициировать дальнейшее повреждение и разрушение пораженных тканей, вызывая необратимое повреждение органов и даже смерть; Фиброзные заболевания являются причиной одной трети смертности во всем мире. Фибробласты продуцируют избыточный и аберрантный внеклеточный матрикс в этом болезненном состоянии14,15. Повышенная пролиферация фибробластов и отложение внеклеточного матрикса еще больше укрепляют ткань и активируют профибротическую петлю положительной обратной связи16,17,18,19. Изучение активации фибробластов имеет жизненно важное значение для понимания фиброзных заболеваний. Здесь мы представляем легочную артериальную гипертензию (ЛАГ) человека в качестве примера одного фиброзного заболевания, при котором важно имитировать 3D-геометрию кровеносного сосуда с помощью 3D-биопечати и внедрять динамические возможности жесткости фотонастраиваемых гидрогелей. ЛАГ - это состояние, при котором давление в основных легочных артериях превышает нормальный уровень и оказывает давление на сердце, увеличивая активацию адвентициальных фибробластов легочной артерии человека (HPAAF) и укрепляя ткани кровеносных сосудов16,17,18,19. Фотонастраиваемая формула биочернил на основе полиэтиленгликоля-альфа-метакрилата (ПЭГαМА) обеспечивает временное затвердевание конструкций и помогает моделировать как здоровые ткани, так и прогрессирование заболевания 5,8,9,10. Использование этой уникальной функции позволяет количественно оценить активацию и пролиферацию HPAAF в ответ на усиление микросреды в 3D и может дать ценную информацию о клеточных механизмах, участвующих в этом заболевании. Описанный здесь протокол позволит исследователям создавать 3D-модели, которые повторяют изменения во внеклеточном микроокружении во время прогрессирования заболевания или восстановления тканей и изучают активацию фибробластов.
протокол
1. Синтез и характеристика ПЭГαМА
ПРИМЕЧАНИЕ: Синтез поли(этиленгликоля)-альфа-метакрилата (ПЭГαМА) был адаптирован из Hewawasam et al . и осуществлялся в условиях отсутствия влаги9.
- Взвесьте реагенты.
ПРИМЕЧАНИЕ: Например, взвесьте 5 г 10 кг/моль 8-плечевого ПЭГ-гидроксила (ПЭГ-ОН) и 0,38 г гидрида натрия () (см. Таблицу материалов). - Добавьте перемешиватель в колбу Schlenk объемом 250 мл и продуйте аргоном.
- Растворите PEG-OH в минимальном объеме безводного тетрагидрофурана (ТГФ), необходимом для растворения в колбе Schlenk.
ПРИМЕЧАНИЕ: Примерно 80 мл ТГФ растворяют 5 г PEG-OH. Добавьте минимальное количество ТГФ, необходимое для растворения PEG-OH. - Добавьте в реакционную смесь 3-кратный молярный избыток и перемешивайте при комнатной температуре (RT) в течение 30 мин.
- Добавьте 6-кратный молярный избыток этил-2-(бромметил)акрилата (EBrMA, см. таблицу материалов) по каплям в колбу Schlenk и накройте реакционный сосуд алюминиевой фольгой, чтобы защитить его от света. Перемешивайте реакцию при комнатной температуре в течение примерно 48 часов.
ПРИМЕЧАНИЕ: Для 5 г PEG-OH и 0,38 г используйте 3,68 мл EBrMA для этой реакции. - Добавьте несколько капель 1 Н уксусной кислоты, чтобы погасить реакцию. Вакуумируйте раствор через фильтрующее приспособление.
ПРИМЕЧАНИЕ: Добавление уксусной кислоты приведет к образованию пузырьков газа. Прекратите добавлять капли уксусной кислоты, когда перестанут образовываться пузырьки, так как это указывает на то, что смесь была успешно затушена. - Сконцентрируйте фильтрат на ротационном испарителе и выпайте в осадок в диэтиловом эфире с температурой 4 °C. Оставьте осадок в защищенном от света месте при температуре 4 °С на 12-18 ч.
- Добавьте ватман в воронку Бюхнера. Медленно вылейте реакционную смесь на фильтровальную бумагу и используйте вакуумное всасывание, чтобы отделить осадок от диэтилового эфира. Соберите осадок в сухую и чистую фильтрационную колбу.
- Высушите продукт в вакууме не менее 5 часов или в течение ночи при комнатной температуре и растворите в минимальном необходимом объеме деионизированной воды. Переложите растворенный продукт в диализную трубку (см. таблицу материалов) и диализируйте 3,5 л деионизированной воды не менее четырех дней. Меняйте диализную воду каждые 12 часов.
ПРИМЕЧАНИЕ: Продукт будет выглядеть как полностью сухой чистый белый твердый порошок после вакуумной сушки. - Мгновенно заморозьте продукт и лиофилизируйте в течение примерно 72 часов или до полного высыхания.
- Растворите средство в хлороформе D (CDCl3). Запустите образец с помощью 1-часового ЯМР с протоколом, который выполняет 248 сканирований со временем релаксации 2,5 с.
- Проверьте функционализацию и чистоту продукта, откалибровав пиковую концентрацию растворителя CDCl3 до 7,26 ppm. Интегрируем пик для основных протонов ПЭГ (d3.71) и калибруем интегрирование до 114.
- Интегрируем остальные пики: PEGαMA 1 H ЯМР (300 МГц, CDCl 3): d (ppm) 1,36(t, 3H, CH 3-),3,71 (s, 114H, PEG CH 2-CH 2), 4,29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH 2-C(=CH 2)-), 5,93 (q, 1H, -C=CH2), 6,34 (q, 1H, -C=CH 2) и сравниваем интегрирование для пиков конечной группы алкена αMA с ожидаемым значением (1H) на основе калибровки PEG (Рисунок 1).
ПРИМЕЧАНИЕ: Усредните два пика, помеченных как "a" (Рисунок 1), и умножьте на 100, чтобы получить средний процент функционализации PEGαMA.
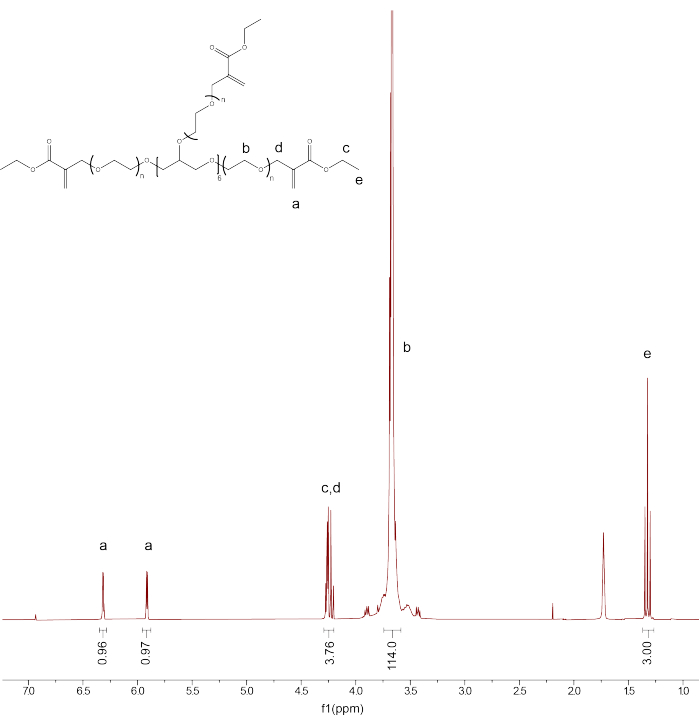
Рисунок 1: Протонный ЯМР подтвердил успешную функционализацию PEGαMA. ЯМР-анализ проводили в хлороформе-Д (CDCl3) и показали функционализацию 96,5%. ПЭГαМА 1 Н ЯМР (300 МГц, CDCl3): d (ppm) 1,36(t, 3H, CH 3-),3,71 (s, 114H, PEG CH 2-CH 2), 4,29 (t, s, 4H, -CH 2-C(O)-O-O, -O-CH2-C(=CH 2)-), 5,93 (q, 1H, -C=CH 2), 6,34 (q, 1H, -C=CH 2). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
2. Дизайн модели и настройка 3D-биопринтера
ПРИМЕЧАНИЕ: Коммерчески доступный 3D-принтер (см. Таблицу материалов) был модифицирован путем замены экструдера для термопластов на специально изготовленный экструдер со шприцевым насосом и адаптирован из Hinton et al.20. Проекты с открытым исходным кодом доступны в Интернете: https://3d.nih.gov/users/awfeinberg.
- Откройте программное обеспечение Fusion 360 (см. таблицу материалов) и создайте компьютерную 3D-конструкцию полого цилиндра.
ПРИМЕЧАНИЕ: Загружаемый файл, который можно использовать для этого шага и который имитирует геометрию кровеносных сосудов, можно найти в Дополнительном файле 1. - Сохраните файл и откройте его в программе Slic3r (см. Таблицу материалов). Убедитесь, что все параметры соответствуют требованиям, а затем нажмите кнопку экспорта G-кода. Сохраните G-код на компьютере.
- Откройте программу Pronterface (см. Таблицу материалов) и загрузите файл G-кода.
ПРИМЕЧАНИЕ: Программное обеспечение Pronterface взаимодействует с биопринтером и обеспечивает достаточный аппаратный контроль ввода. Пригодный для использования файл G-кода можно найти в Дополнительном файле 2. - Переместите биопринтер и все связанные с ним детали в шкаф биобезопасности (BSC) с помощью асептических методов.
- Прикрепите тупой кончик иглы 30 г длиной 0,5 дюйма (см. Таблицу материалов) к стеклянному шприцу для печати и отложите в сторону.
- Вставьте шнур питания биопринтера в розетку. Нажмите красную кнопку питания на передней панели биопринтера, чтобы включить его. Подсоедините кабель универсальной последовательной шины (USB) между компьютером и биопринтером и убедитесь, что все проводные соединения установлены и подключены.
3. Подготовка опорной ванны и реагентов
ПРИМЕЧАНИЕ: Выполняйте все шаги в шкафу биобезопасности с использованием асептических методов.
- Приготовьте питательную среду для клеток, состоящую из базальной среды SmBM (CC-3181) и добавки SmGM-2 SingleQuots (CC-4149), исключая фетальную бычью сыворотку (FBS), в соответствии с инструкциями производителя. Хранить при температуре 4 °C до использования.
- Аликвоту 50 мл питательной среды для клеточной культуры и добавьте 1% v/v FBS (CC-4149) (см. таблицу материалов) для получения среды с низким содержанием сыворотки. Хранить при температуре 4 °C до использования.
- Ресуспендируйте порошок желатиновой суспензии в соответствии с инструкциями производителя, используя стерильные питательные среды для клеток без FBS в качестве растворителя (см. Таблицу материалов). Непосредственно перед использованием отрегулируйте окончательный pH желатиновой суспензии до pH 9 с помощью 2 М гидроксида калия (KOH) и/или 2 М соляной кислоты (HCl), чтобы отрегулировать рН раствора по мере необходимости с помощью рН-метра.
- Заполните желаемое количество лунок из 24-луночной пластины, каждая из которых заполнена примерно наполовину, используя 1 мл желатиновой суспензии на лунку с помощью шприца без иглы.
ПРИМЕЧАНИЕ: Равномерно заполните центр лунок и убедитесь, что нет воздушных пробок. Постучите по пластине, чтобы равномерно распределить суспензию микрочастиц. При необходимости отрегулируйте высоту и объем суспензии для каждой лунки в соответствии с размером и формой каждого биоотпечатка. Пользователи могут создать самодельный шприц для перекачки желатиновой суспензии в каждую лунку. Это можно сделать, добавив поршень шприца подходящего размера в пробирку объемом 50 мл, в которой на дне уже находится спрессованная желатиновая суспензия. Вставляя поршень, вставьте небольшую направляющую проволоку рядом с пробиркой, чтобы помочь воздуху выходить, а затем снимите ее, когда поршень соприкоснется с желатиновой суспензией. Непосредственно перед использованием отрежьте кончик пробирки лезвием бритвы, чтобы создать отверстие для выдавливания желатиновой суспензии и надавить на поршень. - Поместите заполненную 24-луночную пластину в центр столика биопринтера и закрепите ее на предметном столике.
ПРИМЕЧАНИЕ: На рисунке 2 показана общая настройка биопринтера. Поместите резиновую ленту вокруг стола печати, чтобы закрепить 24-луночную пластину на платформе и предотвратить смещение.

Рисунок 2: Базовая настройка 3D-биопечати. Биопринтер был установлен в стерильной среде, такой как шкаф биобезопасности, а печатающая головка была собрана таким образом, что стеклянный шприц и игла были вертикально опущены в зону печати в опорной ванне. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
4. Клеточная культура
ПРИМЕЧАНИЕ: Выполняйте все шаги в шкафу биобезопасности с использованием асептических методов.
- Разморозьте клетки HPAAF (полученные в промышленных масштабах, см. Таблицу материалов) и разложите их в пластиковых колбах, обработанных тканевой культурой T-75, содержащих базальную среду SmBM (CC-3181) и все добавки SmGM-2 SingleQuots (CC-4149) в соответствии с инструкциями производителя (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Следует использовать стандартные протоколы культивирования клеток для адгезивных клеток, поддерживая клетки при температуре 37 °C и 5%CO2 и пополняя среду каждые несколько дней. - После того, как HPAAF достигнут ~80-90% слияния, аспирируйте среду и промойте клетки один раз фосфатно-солевым буфером (PBS).
- Добавьте примерно 4 мл предварительно подогретого 0,05% трипсина-ЭДТА в каждую колбу Т-75. Наклоните колбу, чтобы убедиться, что вся поверхность клеточной культуры покрыта 0,05% раствором трипсина-ЭДТА. Инкубируйте колбы в течение 3-5 мин при 37 °C и проверяйте на отслоение клеток.
- После того, как клетки всплывут, добавьте не менее 6 мл модифицированной орлиной среды (DMEM) Dulbecco в каждую колбу и перенесите клетки в коническую пробирку объемом 50 мл.
- Центрифугируйте клеточную суспензию при 300 x g в течение 5 минут при комнатной температуре, чтобы гранулировать клетки. Отсасывайте надосадочную жидкость из клеточной гранулы и ресуспендируйте клетки в среде 1-3 мл с FBS с помощью пипетки на 1000 мкл, обеспечивая одноклеточную суспензию.
- Перелейте 10 мкл клеточной суспензии в микроцентрифужную пробирку. Добавьте 10 мкл раствора трипанового синего и хорошо перемешайте. Используйте 10 мкл этой смеси для подсчета клеток в гемоцитометре с помощью микроскопа с инвертированным светом.
ПРИМЕЧАНИЕ: Для достижения конечной концентрации биочернил 4 x 106 клеток/мл на каждые 200 мкл биочернил было выделено 800 000 фибробластов.
5. Приготовление гидрогелевых биочернил
ПРИМЕЧАНИЕ: Препарат Bioink был адаптирован из Davis-Hall et al.5. Этапы 5.1-5.2 могут быть выполнены параллельно с шагами 4.1-4.3, чтобы свести к минимуму время между сбором клеток и повторной суспензией в биочернилах. Выполняйте шаги в шкафу биобезопасности с использованием асептической техники.
- Приготовьте 20 мМ раствор трис(2-карбоксиэтил) фосфина (TCEP, см. таблицу материалов) pH 7 и стерильный фильтр с помощью шприцевого фильтра 0,2 мкм. Непосредственно перед использованием добавьте 2 М КОН и/или 2 М HCl для корректировки рН раствора по мере необходимости. Измерьте рН-метром и отрегулируйте соответствующим образом.
ПРИМЕЧАНИЕ: TCEP уменьшает дисульфидные связи. - Готовят исходный раствор ПЭГαМА в концентрации 0,25 мг/мл, ресуспендированный в стерильных питательных средах клеток без FBS, 250 мМ исходные растворы 1,4-дитиотрейтола (DTT), разлагаемого сшивающего агента MMP2 и пептида CGRGDS (RGD) (см. таблицу материалов), ресуспендируя все в стерильном TCEP 20 мМ, и 15 мас.% исходный раствор полиэтиленоксида (PEO) в дистиллированной воде (DI) с помощью пипеток по мере необходимости.
- Следуя таблице 1 в качестве руководства, объедините соответствующие необходимые количества PEGαMA, DTT, MMP2-разлагаемого сшивающего агента, PEO, CGRGDS и питательных сред с низким содержанием сыворотки крови вместе с фибробластами в конической пробирке объемом 50 мл.
ПРИМЕЧАНИЕ: Рекомендуется проверять pH с помощью pH-полосок после добавления всех сред, кроме клеточной культуры, так как эта комбинация должна привести к тому, что pH будет очень близок к 6,2. Если требуется дальнейшая регулировка pH, следите за тем, сколько дополнительного объема требуется для регулировки pH раствора прекурсора. Доведите общий объем до 200 мкл, добавив оставшийся объем среды для клеточной культуры за вычетом объема, добавленного во время окончательной регулировки pH. - Смешайте биочернила с помощью пипетки прямого вытеснения, чтобы убедиться, что клетки являются единичными, и убедитесь, что окончательный раствор прекурсора имеет pH 6,2, чтобы предотвратить полимеризацию, катализируемую основанием, во время 3D-биопечати.
- Загрузите биочернила в стеклянный шприц, сняв поршень и используя отдельный шприц с тупым кончиком иглы 15 калибра длиной 1,5 дюйма (см. Таблицу материалов), прикрепленный для переноса биочернил из центрифужной пробирки в шприц, соблюдая осторожность, чтобы избежать образования пузырьков воздуха внутри раствора.
- Поместите стеклянный шприц в печатающую головку и прикрепите компоненты печатающей головки так, чтобы все было надежно собрано и готово к печати.
ПРИМЕЧАНИЕ: На этом этапе стеклянный шприц внутри печатающей головки должен иметь тупой кончик иглы 30 калибра длиной 0,5 дюйма для печати.
| Компонент | Концентрация исходного раствора | Сумма для добавления |
| ПЭГαМА | 0,25 мг/мл | 140 мкл |
| ДТТ | 250 мМ | 12,24 мкл |
| MMP2 Разлагаемый сшивающий агент | 250 мМ | 5,25 мкл |
| РГД | 250 мМ | 1,6 мкл |
| ПЭО | 15 мас.% | 33,33 мкл |
| Активационная среда и/или реагенты для регулировки pH | - | 7,58 мкл |
| Фибробласты | - | 800000 ячеек |
Таблица 1: Примеры объемов, необходимых для приготовления 200 мкл биочернил (раствора прекурсора гидрогеля и клеток фибробластов).
6. .3D биопечать
ПРИМЕЧАНИЕ: Выполняйте все шаги в шкафу биобезопасности с использованием асептических методов.
- С помощью стрелок направления в программном обеспечении Pronterface вручную отрегулируйте положение экструзионной иглы в центре колодца и в суспензии опорной ванны. Оставьте не менее 1 мм опорной суспензии для ванны ниже кончика иглы.
ПРИМЕЧАНИЕ: Программное обеспечение не имеет возможности определить, где находится игла в пространстве. Пользователь может перемещать иглу вручную, нажимая стрелки в программном обеспечении (например, нажатие на стрелку вверх переместит иглу вверх или в сторону от печатной платформы и т. д.). Осторожно маневрируйте иглой, чтобы убедиться, что она не заденет границы колодца. - После того, как кончик иглы окажется в центре суспензии в лунке, нажмите кнопку запуска в передней части и дождитесь завершения печати, чтобы получить конструкции, как показано на рисунке 3A.
ПРИМЕЧАНИЕ: Для биопечати одной конструкции с помощью предоставленного файла (Дополнительный файл 1) потребуется примерно 3 минуты. Требуется около 5 минут, чтобы сориентировать и переместить стрелку, а затем полностью распечатать одну конструкцию от начала до конца. - Повторяйте шаги 6.1-6.2 до тех пор, пока не будет достигнуто желаемое количество биопечатных конструкций.
ПРИМЕЧАНИЕ: Рекомендуется создавать больше конструкций, чем необходимо, чтобы учесть любые неудачные отпечатки. В случае отказа переходим к следующей скважине, сбрасываем все и снова повторяем шаги 6.1-6.2. - Оставьте пластину при комнатной температуре и накройте ее в BSC на 1 час после завершения печати, чтобы обеспечить катализируемую основанием полимеризацию фотонастраиваемого гидрогеля.
- Поместите планшет с 3D-биопечатными конструкциями в стерильный инкубатор с температурой 37 °C и оставьте на 12-18 часов, чтобы растопить суспензию опорной ванны.
Рисунок 3: Экспериментальная схема. Этот протокол был описан в три основных этапа: (A) 3D-биопечать полых трубок PEGαMA со встроенными клетками для имитации легочной сосудистой системы. (B) Фотоинициирование реакции гомополимеризации для придания жесткости клеточному микроокружению. (C) Оценка клеточных маркеров на пролиферацию и активацию. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
7.3D. 3D-биопечатная конструкционная культура и фотофиксация
ПРИМЕЧАНИЕ: Все этапы должны выполняться в шкафу биобезопасности с использованием асептических методов.
- Приготовьте исходный раствор 2,2 мМ лития-фенил-2,4,6-триметилбензоилфосфината (LAP) (см. таблицу материалов) в ПБС и стерильном фильтре с помощью шприцевого фильтра 0,2 мкм. Храните раствор LAP в защищенном от света месте.
- Через 12-18 ч смените носитель, окружающий биопечатные конструкции. Вручную удалите носитель и расплавленную желатиновую опорную ванну внутри лунок и будьте осторожны, чтобы не повредить биопечатные конструкции.
ПРИМЕЧАНИЕ: Полезно медленно удалять фильтрующий материал, держа пластину под углом 45°, чтобы конструкции всплыли внутри лунки и были видны. Прозрачный гидрогелевый цилиндр должен быть идентифицирован в каждой лунке с успешной печатью (Рисунок 4A). - Добавьте соответствующий объем среды с низким содержанием сыворотки в каждую лунку.
ПРИМЕЧАНИЕ: Для 24-луночного планшета среда 700 мкл на лунку должна полностью покрывать биопечатные конструкции. При необходимости отрегулируйте. - Верните планшет в инкубатор и меняйте среды на образцах каждые 3 дня или в соответствии с экспериментальным дизайном.
- За двадцать четыре часа до желаемого времени затвердевания удалите среду из образцов и замените их средами с низким содержанием сыворотки, дополненными стерильным LAP 2,2 мМ.
ПРИМЕЧАНИЕ: Чтобы флуоресцентно пометить структуру, набухните 3D-биопечатные конструкции в PBS, добавленные 10 мкМ метакрилоксиэтилтиокарбамоилродамина B (см. раздел«Материалы»), в течение ночи, а затем затвердейте, как описано в шаге 7.6, чтобы флуоресцентно пометить структуру. Перенесите в PBS на 2 дня при 4 °C, чтобы удалить излишки родамина и получить изображение с помощью фильтра TRITC (рис. 4B, C). - В желаемый момент времени затвердевания удалите половину фильтрующего материала из лунок, для которых требуется затвердеть, и поместите пластину со снятой крышкой под ультрафиолетовый свет. Включите ультрафиолетовое излучение и придайте жесткость этим конструкциям, применяя свет 10 мВт/см2 365 нм в течение 5 минут с помощью Omnicure (см. таблицу материалов) и полосового фильтра 365 нм (рис. 3B).
ПРИМЕЧАНИЕ: Используйте радиометр/фотометр, чтобы убедиться, что интенсивность света правильная, прежде чем подвергать клетки воздействию ультрафиолета. - Удалите оставшуюся среду из этих лунок и добавьте в каждую лунку свежую среду с низким содержанием сыворотки. Верните тарелку в инкубатор.
- Выньте планшет из инкубатора и выполните исследование активации фибробластов в желаемый момент времени после шага 9.
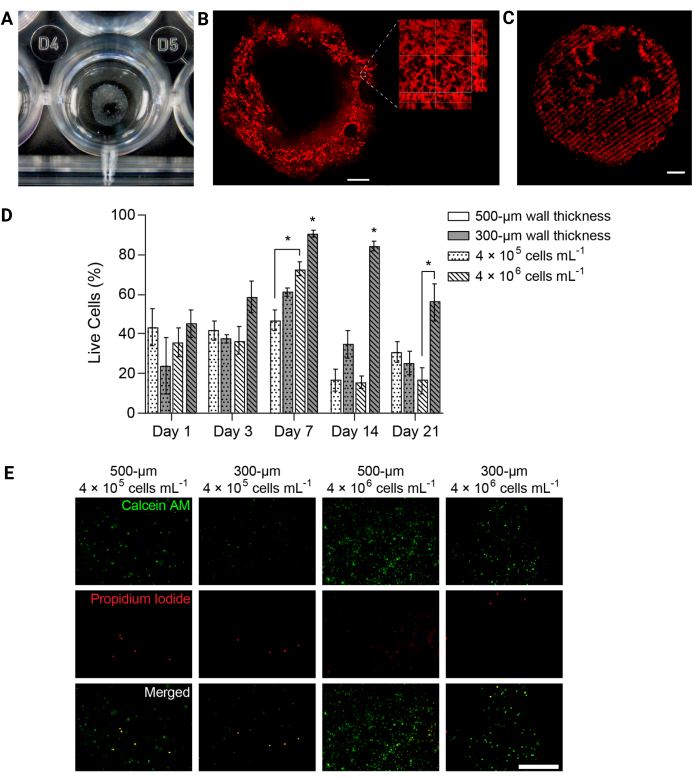
Рисунок 4: Гидрогелевые структуры, напечатанные на 3D-биопринтере, поддерживали жизнеспособность клеток с течением времени. (А) Фотография напечатанной на 3D-принтере структуры гидрогеля в 24-луночном планшете. (B) Проекция максимальной интенсивности флуоресцентно меченного гидрогеля PEGαMA, напечатанного на 3D-принтере. Масштабная линейка = 1 мм. Микроскопия с большим увеличением показала поры в структуре гидрогеля, индуцированные микрочастицами желатина в опорной ванне для биопечати FRESH. (C) Напечатанная на 3D-принтере трубка PEGαMA с флуоресцентно помеченными жесткими областями, изображенная на конфокальном микроскопе (100 мкм z-стек, отображаемый в виде проекции максимальной интенсивности), показала пространственный контроль над жесткостью в 3D. Масштабная линейка = 500 мкм. (D) Жизнеспособность HPAAF в конструкциях, напечатанных на 3D-принтере, измеренная с помощью анализов Live/Dead. Конструкции толщиной 300 мкм и концентрацией 4 ×10 6 клеток/мл превзошли все остальные условия в любой момент времени. Пик жизнеспособности пришелся на 7-й день. Это условие и момент времени были выбраны для будущих экспериментов. Столбцы показывают среднее значение ± SEM, n = 3. *, стр . < 0,05, ANOVA, Tukey HSD. (E) Репрезентативные конфокальные изображения клеток в 3D-конструкциях, окрашенных живым/мертвым реагентом на 7-й день, в момент времени с наибольшей общей жизнеспособностью. Кальцеин AM помечает живые клетки зеленым цветом, а йодид пропидия – красным. Крайний правый столбец показывает, что наиболее эффективное состояние имело равномерное распределение клеток и высокий процент живых клеток. Масштабная линейка = 500 мкм. Воспроизведено с разрешения Davis-Hall et al.5. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
8. Оценка жизнеспособности фибробластов
- При достижении желаемых сроков жизнеспособности окрашивают с использованием кальцеина AM и йодида пропидия (см. таблицу материалов).
ПРИМЕЧАНИЕ: Подводя итог, можно сказать, что среда должна быть удалена из каждой лунки, а конструкции должны быть промыты стерильным PBS. Инкубируйте конструкции в живом/мертвом растворе для окрашивания в течение 40 мин при 37°C на коромысле. Раствор для окрашивания должен содержать кальцеин AM (в разведении 1:1000) и йодид пропидия (в разведении 1:1000) для идентификации живых или мертвых клеток при визуализации. - Перенесите конструкции в стерильный PBS и сразу же получите изображение на конфокальном флуоресцентном микроскопе. Получение трех различных изображений Z-стека размером 100 мкм на образец в определенный момент времени и выражение жизнеспособности в виде среднего процента живых клеток (рис. 4D, E).
9. Оценка активации фибробластов
- Приготовьте 3% мас.в. бычьего сывороточного альбумина (БСА) и 0,1% м.в. Tween 20 в PBS. Этот раствор будет называться иммунофлуоресцентным (ИФ) раствором.
- В нужные моменты времени удалите среду из лунок для отбора проб и промойте конструкции с помощью PBS. Замените PBS на 4% параформальдегид (PFA) и держите эти образцы при температуре 37 °C в течение 30 минут на коромысле. Затем замените 4% PFA на 100 мМ глицин в PBS и оставьте эти образцы на коромысле при комнатной температуре (RT) еще на 15 минут.
- Затем переложите эти образцы в криоформы Tissue-Tek, полностью покройте образец раствором оптимальной температуры резки (OCT) (см. Таблицу материалов) и дайте ОКТ диффундировать в образцы в течение 12-18 ч при 4 °C.
- Мгновенную заморозку образцов, пропитанных ОКТ, в 2-метилбутане с использованием жидкого азота. Наполните пенопластовую коробку или другую подходящую емкость жидким азотом, а затем поместите вторую емкость, наполненную 2-метилбутаном, внутрь жидкого азота так, чтобы она была погружена не менее чем наполовину. Используйте щипцы, чтобы удерживать каждый криомолд, содержащий образец, покрытый ОКТ, в жидком азоте, охлажденном 2-метилбутаном, до тех пор, пока он не замерзнет. Эти образцы можно хранить при температуре -80 °C до тех пор, пока они не будут готовы к криосекции.
ВНИМАНИЕ: При работе с жидким азотом следует использовать средства индивидуальной защиты (СИЗ), такие как перчатки для защиты от холода, фартук для защиты от простуды и лицевой щиток, входящие в комплект криогенной безопасности (см. Таблицу материалов). - Криосекцию замороженных образцов ОКТ при -22 °C и прикрепляют срезы толщиной 10 мкм к положительно заряженным предметным стеклам микроскопа. Подготовьте три предметных стекла микроскопа с не менее чем 3-5 криосекциями на предметное стекло для каждого образца 3D-гидрогеля.
ПРИМЕЧАНИЕ: При необходимости предметные стекла микроскопа можно хранить при температуре -80 °C в качестве точки остановки. - Зафиксируйте криосекции в ледяном ацетоне на 15 минут, чтобы помочь криосекциям прилипнуть к предметным стеклам. Осторожно промойте криосекции водой RT, чтобы удалить остатки OCT. Дайте этим образцам высохнуть и обведите криосекции гидрофобной ручкой (см. Таблицу материалов).
- Пермеабилизацию образцов при комнатной температуре 0,2% об/в Triton X-100 в ПБС в течение 10 мин, а затем блокирование срезов 5% БСА с ПБС в течение 1 ч при РТ.
- Добавьте в раствор ИФ первичное мышиное антитело к альфа-гладкомышечному актину (αSMA) (разведение 1:250) (см. таблицу материалов). Храните эти секционированные образцы с первичными антителами в течение ночи при температуре 4 °C. Промойте образцы 3 раза раствором IF.
- Инкубируют срезы в растворе IF, содержащем вторичное антитело Alexa Fluor 555 против коз (разведение 1:250) и две капли ActinGreen 488 ReadyProbe (см. таблицу материалов) на миллилитр раствора IF. Накройте образцы для всех последующих этапов алюминиевой фольгой, чтобы защитить их от света, и оставьте раствор вторичных антител на образцах в течение 1 ч при RT.
- Промойте срезы 3 раза раствором IF. Инкубируют их в 300 нМ 4',6-диамидино-2-филиндол (DAPI) в деионизированной воде в течение 15 мин при RT. Проведите окончательную промывку срезов 3 раза деионизированной водой.
- Используя 10 мкл имеющегося в продаже антизатухающего реагента (см. таблицу материалов), покройте срезы стандартными методами.
ПРИМЕЧАНИЕ: Установленные предметные стекла можно хранить в защищенном от света месте в морозильной камере при температуре -80 °C до тех пор, пока они не понадобятся для визуализации. - Визуализируйте криошлифы с помощью флуоресцентного микроскопа (рис. 3C и рис. 5B). Изобразите три случайных фрагмента на слайде, используя объектив 10x.
ПРИМЕЧАНИЕ: Изображения должны быть сделаны в каналах DAPI, FITC и TRITC. - Загрузите изображения в ImageJ (NIH). Количественно определите процент αSMA-положительных клеток в качестве измерения активации фибробластов (рис. 5A), разделив общее количество αSMA-положительных клеток на общее количество клеточных ядер для каждого поля зрения.
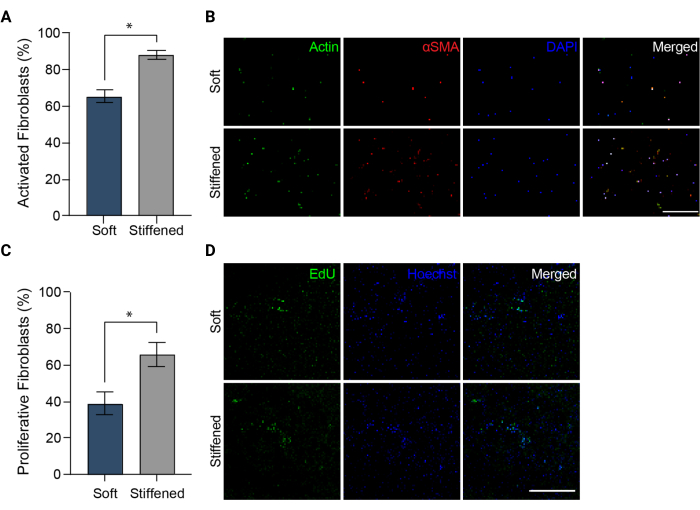
Рисунок 5: Активация фибробластов в 3D-биопечатных моделях легочной артериальной адвентиции . (A) Фиброзная активация в мягких и застывших 3D-гидрогелях, измеренная экспрессией αSMA. HPAAF в жестких конструкциях были значительно более позитивны для αSMA, чем клетки в мягких конструкциях. Столбцы представляют среднее значение ± SEM, n = 3. *, стр < 0,05, U-критерий Манна-Уитни. (B) Репрезентативные конфокальные изображения иммуноокрашивания для αSMA, актина и DAPI в мягких и затвердевших 3D-гидрогелях. HPAAF в ригидных конструкциях показали более распространенную иммунофлуоресценцию αSMA, чем клетки в мягких конструкциях. Масштабная линейка = 250 мкм. (C) Пролиферация фибробластов в мягких и застывших 3D-биопечатных конструкциях, измеренная с помощью положительности EdU. HPAAF в жестких конструкциях были значительно более позитивными для EdU, чем клетки в мягких конструкциях. Столбцы представляют среднее значение ± SEM, n = 3. *, стр < 0,05, U-критерий Манна-Уитни. (D) Репрезентативные конфокальные изображения иммуноокрашивания для красителей EdU и Hoechst в мягких и затвердевших 3D-гидрогелях. HPAAF в ригидных конструкциях показали более распространенную иммунофлуоресценцию EdU, чем клетки в мягких конструкциях. Масштабная линейка = 300 мкм. Воспроизведено с разрешения Davis-Hall et al.5. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
10. Оценка пролиферации фибробластов
- За 24 часа до желаемого момента пролиферации извлеките питательную среду из каждой лунки и замените ее питательной средой с низким содержанием сыворотки, дополненной 10 мкМ раствором EdU из имеющегося в продаже набора для пролиферации клеток (см. таблицу материалов). Верните образцы в инкубатор для ночной инкубации.
- В желаемый момент времени пролиферации зафиксируйте образцы, инкубированные с EdU с использованием 4% PFA при 37 °C в течение 30 мин на коромысле. Замените 4% раствор PFA 100 мМ глицина в PBS и инкубируйте образцы при 37 °C не менее 15 минут. Добавьте Hoechst в соответствующей концентрации в течение 30 минут, а затем промойте конструкции 2 раза PBS.
ПРИМЕЧАНИЕ: Образцы можно хранить в защищенном от света месте при температуре 4 °C до получения изображения. - Визуализируйте все фиксированные и сохраненные образцы EdU с помощью флуоресцентного микроскопа, а также рекомендуемые производителем настройки и фильтры для пролиферации клеток (рис. 3C и Рис. 5D). Получение трех различных изображений 100 мкм z-стека на образец и создание максимальных проекций из каждого из этих z-стеков. Измерьте пролиферацию HPAAF, подсчитав количество EdU-положительных клеток и разделив их на общее количество клеток, идентифицированных с помощью контрокрашивания Хёхста в максимальной проекции изображений (рис. 5C).
Результаты
Этот протокол описывает, как 3D-биопечать фотонастраиваемых гидрогелей в опорной ванне для создания конструкций, способных к динамическому и временному затвердеванию, для изучения активации фибробластов в геометрии, имитирующей ткани человека. Во-первых, протокол объяснял, как синтез?...
Обсуждение
Двухступенчатые реакции полимеризации в ответ на контролируемое воздействие света могут придать жесткость биоматериалам с пространственным и временным контролем. В нескольких исследованиях этот метод использовался для оценки взаимодействия клетки с матриксом на различных платфор?...
Раскрытие информации
У авторов нет конфликта интересов, который они могли бы раскрыть. Части этой рукописи воспроизводятся с разрешения © IOP Publishing https://doi.org/10.1088/1758-5090/aca8cf. 5 Все права защищены.
Благодарности
Авторы выражают благодарность доктору Адаму Файнбергу (Университет Карнеги-Меллона) и тем, кто провел семинар по 3D-биопечати с открытым исходным кодом. Эти люди позволили изучить методы биопечати FRESH и построить 3D-биопринтер, используемый для этих исследований. Кроме того, авторы хотели бы выразить признательность Biorender.com, которая была использована для создания рисунков в этой рукописи. Эта работа была поддержана несколькими группами или источниками финансирования, включая Фонд сообщества Роуз (DDH и CMM), Колорадскую премию за исследования легочных сосудистых заболеваний (DDH и CMM), Национальный научный фонд в рамках Премии 1941401 (CMM), Министерство армии США в рамках Гранта W81XWH-20-1-0037 (CMM), Национальный институт рака NIH в рамках Гранта R21 CA252172 (CMM), Центр исследований женского здоровья семьи Людеман в медицинском кампусе Аншутц Университета Колорадо (DDH и CMM), Национальный институт сердца, легких и крови Национальных институтов здравоохранения в рамках грантов R01 HL080396 (CMM), R01 HL153096 (CMM), F31 HL151122 (DDH) и T32 HL072738 (DDH и AT).
Материалы
| Name | Company | Catalog Number | Comments |
| AccuMax Radiometer/Photometer Kit | Spectronics Corporation | XPR-3000 | To measure light intensity, used for photostiffening |
| Acetic Acid | Fisher Scientific | BP2401-500 | Used during PEGaMA synthesis |
| Acetone | Fisher Scientific | A184 | Used with the cryosections |
| ActinGreen 488 ReadyProbes | Fisher Scientific | R37110 | Used for staining |
| Aluminum Foil | Reynolds | F28028 | |
| Anhydrous Tetrahydrofuran (THF) | Sigma-Aldrich | 401757-1L | Used during PEGaMA synthesis |
| Argon Compressed Gas | Airgas | AR R300 | Used during PEGaMA synthesis |
| 8 Arm Poly(ethylene glycol)-hydroxyl (PEG-OH) | JenKem Technology | 8ARM-PEG-10K | Used during PEGaMA synthesis |
| 365 nm Bandpass Filter | Edmund Optics | 65-191 | Used for photostiffening |
| Bovine Serum Albumin (BSA) | Fisher Scientific | BP9700-100 | Used during staining process |
| Buchner Funnel | Quark Glass | QFN-8-14 | Used during PEGaMA synthesis |
| Calcein AM | Invitrogen | 65-0853-39 | Used during staining process |
| Celite 545 (Filtration Aid) | EMD Millipore | CX0574-1 | Used during PEGaMA synthesis |
| Charged Microscope Slides | Globe Scientific | 1358W | |
| Chloroform-d | Sigma-Aldrich | 151823-10X0.75ML | Used to characterize PEGaMA |
| Click-iT Plus EdU Cell Proliferation Kit | Invitrogen | C10637 | Used for staining |
| 50 mL Conical Tubes | CELLTREAT | 667050B | |
| Cryogenic Safety Kit | Cole-Parmer | EW-25000-85 | |
| Cryostat | Leica | CM 1850-3-1 | |
| Dialysis Tubing | Repligen | 132105 | |
| 4’,6-Diamidino-2-Phylindole (DAPI) | Sigma-Aldrich | D9542-1MG | Used for staining |
| Diethyl Ether | Fisher Scientific | E1384 | Used during PEGaMA synthesis |
| 1,4-Dithiothreitol (DTT) | Sigma-Aldrich | 10197777001 | Bioink component |
| Dulbecco's Modified Eagle's Medium (DMEM) | Cytiva | SH30271.FS | |
| Filter Paper | Whatman | 1001-090 | Used during PEGaMA synthesis |
| Freezone 2.5L Freeze Dry System | Labconco | LA-2.5LR | Lyophilizer |
| Fusion 360 | Autodesk | N/A | Software download |
| 2.5 mL Gastight Syringe | Hamilton | 81420 | Used for bioprinting |
| 15 Gauge 1.5" IT Series Tip | Jensen Global | JG15-1.5X | Used for bioprinting |
| 30 Gauge 0.5" HP Series Tip | Jensen Global | JG30-0.5HPX | Used for bioprinting |
| Goat Anti-Mouse Alexa Fluor 555 Antibody | Fisher Scientific | A21422 | Used for staining |
| Glycine | Fisher Scientific | C2H5NO2 | Used during staining process |
| Hemocytometer | Fisher Scientific | 1461 | |
| Hoechst | Thermo Scientific | 62249 | Used during staining process |
| Human Pulmonary Artery Adventitial Fibroblasts (HPAAFs) | AcceGen | ABC-TC3773 | From a 2-year-old male patient |
| Hydrochloric Acid (HCl) | Fisher Scientific | A144-500 | Used to pH adjust solutions |
| ImageJ | National Institutes of Health (NIH) | N/A | Free software download |
| ImmEdge® Pen | Vector Laboratories | H-4000 | Used during staining process |
| Incubator | VWR | VWR51014991 | |
| LifeSupport Gelatin Microparticle Slurry (Gelatin Slurry) | Advanced Biomatrix | 5244-10GM | Used for bioprinting |
| Light Microscope | Olympus | CKX53 | Inverted light microscope |
| Lithium Phenyl-2,4,6-Trimethylbenzoylphosphinate (LAP) | Sigma-Aldrich | 900889-5G | Photoinitiator used for photostiffening |
| Liquid Nitrogen | N/A | N/A | |
| LulzBot Mini 2 | LulzBot | N/A | Bioprinter adapted |
| Methacryloxyethyl Thiocarbamoyl Rhodamine B | Polysciences Inc. | 669775-30-8 | |
| 2-Methylbutane | Sigma-Aldrich | M32631-4L | |
| Microman Capillary Pistons CP1000 | VWR | 76178-166 | Positive displacement pipette tips |
| MMP2 Degradable Crosslinker (KCGGPQGIWGQGCK) | GL Biochem | N/A | Bioink component |
| Mouse Anti-Human αSMA Monoclonal Antibody | Fisher Scientific | MA5-11547 | Used for staining |
| OmniCure Series 2000 | Lumen Dynamics | S2000-XLA | UV light source used for photostiffening |
| Paraformaldehyde (PFA) | Electron Microscopy Sciences | 15710 | Used to fix samples |
| pH Meter | Mettler Toledo | FP20 | |
| pH Strips | Cytiva | 10362010 | |
| Phosphate Buffered Saline (PBS) | Hyclone Laboratories, Inc. | Cytiva SH30256.FS | |
| Pipette Set | Fisher Scientific | 14-388-100 | |
| 10 µL Pipette Tips | USA Scientific | 1120-3710 | |
| 20 µL Pipette Tips | USA Scientific | 1183-1510 | |
| 200 µL Pipette Tips | USA Scientific | 1111-0700 | |
| 1000 µL Pipette Tips | USA Scientific | 1111-2721 | |
| Poly(Ethylene Glycol)-Alpha Methacrylate (PEGαMA) | N/A | N/A | Refer to manuscript for synthesis steps |
| Poly(Ethylene Oxide) (PEO) | Sigma-Aldrich | 372773-250G | Bioink component |
| Positive Displacement Pipette | Fisher Scientific | FD10004G | 100-1000 µL |
| Potassium Hydroxide (KOH) | Sigma-Aldrich | 221473-500G | Used to pH adjust solutions |
| ProLong Gold Antifade Reagent | Invitrogen | P36930 | Used during staining process |
| Pronterface | All3DP | N/A | Software download |
| Propidium Iodide | Sigma-Aldrich | P4864-10ML | Used for staining |
| RGD Peptide (CGRGDS) | GL Biochem | N/A | Bioink component |
| Rocker | VWR | 10127-876 | |
| Rotary Evaporator | Thomas Scientific | 11100V2022 | Used during PEGaMA synthesis |
| Rubber Band | Staples | 808659 | |
| Schlenk Flask | Kemtech America | F902450 | Used during PEGaMA synthesis |
| Slic3r | Slic3r | N/A | Software download |
| Smooth Muscle Cell Growth Medium-2 (SmGM-2) BulletKit | Lonza | CC-3182 | Kit contains CC-3181 and CC-4149 components |
| Sodium Hydride | Sigma-Aldrich | 223441-50G | Used during PEGaMA synthesis |
| Sorvall ST 40R Centrifuge | Fisher Scientific | 75-004-525 | |
| Stir Bar | VWR | 58948-091 | |
| Syringe Filter | VWR | 28145-483 | Used to sterile filter solutions |
| T-75 Tissue-Cultured Treated Flask | VWR | 82050-856 | Used for cell culture work |
| Tissue-Tek Cyromold | Sakura | 4557 | |
| Tissue-Tek O.C.T Compound (OCT) | Sakura | 4583 | |
| Tris(2-Carboxyethyl) Phosphine (TCEP) | Sigma-Aldrich | C4706-2G | |
| Triton X-100 | Fisher Bioreagents | C34H622O11 | Used during staining process |
| Trypan Blue | Sigma-Aldrich | T8154-20ML | Used for cell culture work |
| 0.05% Trypsin-EDTA | Gibco | 25-300-062 | Used for cell culture work |
| Tween 20 | Fisher Bioreagents | C58H114O26 | Used during staining process |
| Upright Microscope | Olympus | BX63F | Fluorescent microscope capabilities |
| Water Bath | PolyScience | WBE20A11B | |
| 24-Well Tissue Culture Plates | Corning | 3527 |
Ссылки
- Ahrens, J. H., et al. Programming cellular alignment in engineered cardiac tissue via bioprinting anisotropic organ building blocks. Advanced Materials. 34 (26), e2200217 (2022).
- Lin, N. Y. C., et al. Renal reabsorption in 3D vascularized proximal tubule models. Proceedings of the National Academy of Sciences of the United States of America. 116 (12), 5399-5404 (2019).
- Grigoryan, B., et al. Multivascular networks and functional intravascular topologies within biocompatible hydrogels. Science. 364 (6439), 458-464 (2019).
- Kang, Y., Datta, P., Shanmughapriya, S., Ozbolat, I. T. 3D bioprinting of tumor models for cancer research. ACS Applied Biomaterials. 3 (9), 5552-5573 (2020).
- Davis-Hall, D., Thomas, E., Pena, B., Magin, C. M. 3D-bioprinted, phototunable hydrogel models for studying adventitial fibroblast activation in pulmonary arterial hypertension. Biofabrication. 15 (1), (2022).
- Mirdamadi, E., Tashman, J. W., Shiwarski, D. J., Palchesko, R. N., Feinberg, A. W. FRESH 3D bioprinting of a full-size model of the human heart. ACS Biomaterials Science & Engineering. 6 (11), 6453-6459 (2020).
- Shiwarski, D. J., Hudson, A. R., Tashman, J. W., Feinberg, A. W. Emergence of FRESH 3D printing as a platform for advanced tissue biofabrication. APL Bioengineering. 5 (1), 010904 (2021).
- Petrou, C. L., et al. Clickable decellularized extracellular matrix as a new tool for building hybrid hydrogels to model chronic fibrotic diseases in vitro. Journal of Materials Chemistry B. 8 (31), 6814-6826 (2020).
- Hewawasam, R. S., Blomberg, R., Serbedzija, P., Magin, C. M. Chemical modification of human decellularized extracellular matrix for incorporation into phototunable hybrid hydrogel models of tissue fibrosis. ACS Applied Materials & Interfaces. 15 (12), 15071-15083 (2023).
- Saleh, K. S., et al. Engineering hybrid hydrogels comprised healthy or diseased decellularized extracellular matrix to study pulmonary fibrosis. Cellular and Molecular Bioengineering. 15 (5), 505-519 (2022).
- Guvendiren, M., Burdick, J. A. Stiffening hydrogels to probe short- and long-term cellular responses to dynamic mechanics. Nature Communications. 3, 792 (2012).
- Rosales, A. M., Vega, S. L., DelRio, F. W., Burdick, J. A., Anseth, K. S. Hydrogels with reversible mechanics to probe dynamic cell microenvironments. Angewandte Chemie International Edition English. 56 (40), 12132-12136 (2017).
- Wynn, T. A., Ramalingam, T. R. Mechanisms of fibrosis: therapeutic translation for fibrotic disease. Nature Medicine. 18 (7), 1028-1040 (2012).
- Huertas, A., Tu, L., Humbert, M., Guignabert, C. Chronic inflammation within the vascular wall in pulmonary arterial hypertension: more than a spectator. Cardiovascular Research. 116 (5), 885-893 (2020).
- Kendall, R. T., Feghali-Bostwick, C. A. Fibroblasts in fibrosis: novel roles and mediators. Frontiers in Pharmacology. 5, 123 (2014).
- Parker, M. W., et al. Fibrotic extracellular matrix activates a profibrotic positive feedback loop. The Journal of Clinical Investigation. 124 (4), 1622-1635 (2014).
- Habiel, D. M., Hogaboam, C. Heterogeneity in fibroblast proliferation and survival in idiopathic pulmonary fibrosis. Frontiers in Pharmacology. 5, 2 (2014).
- Hu, C. J., Zhang, H., Laux, A., Pullamsetti, S. S., Stenmark, K. R. Mechanisms contributing to persistently activated cell phenotypes in pulmonary hypertension. The Journal of Physiology. 597 (4), 1103-1119 (2019).
- Li, M., et al. Emergence of fibroblasts with a proinflammatory epigenetically altered phenotype in severe hypoxic pulmonary hypertension. The Journal of Immunology. 187 (5), 2711-2722 (2011).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform-reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Brown, T. E., et al. Secondary photocrosslinking of click hydrogels to probe myoblast mechanotransduction in three dimensions. Journal of the American Chemical Society. 140 (37), 11585-11588 (2018).
- Ondeck, M. G., et al. Dynamically stiffened matrix promotes malignant transformation of mammary epithelial cells via collective mechanical signaling. Proceedings of the National Academy of Sciences of the United States of America. 116 (9), 3502-3507 (2019).
- Caliari, S. R., et al. Stiffening hydrogels for investigating the dynamics of hepatic stellate cell mechanotransduction during myofibroblast activation. Scientific Reports. 6, 21387 (2016).
- Liu, F., et al. Feedback amplification of fibrosis through matrix stiffening and COX-2 suppression. Journal of Cell Biology. 190 (4), 693-706 (2010).
- Tschumperlin, D. J., Ligresti, G., Hilscher, M. B., Shah, V. H. Mechanosensing and fibrosis. The Journal of Clinical Investigation. 128 (1), 74-84 (2018).
- Chelladurai, P., Seeger, W., Pullamsetti, S. S. Matrix metalloproteinases and their inhibitors in pulmonary hypertension. European Respiratory Journal. 40 (3), 766-782 (2012).
- Caracena, T., et al. Alveolar epithelial cells and microenvironmental stiffness synergistically drive fibroblast activation in three-dimensional hydrogel lung models. Biomaterials Science. 10 (24), 7133-7148 (2022).
- Ruskowitz, E. R., DeForest, C. A. Proteome-wide analysis of cellular response to ultraviolet light for biomaterial synthesis and modification. ACS Biomaterials Science & Engineering. 5 (5), 2111-2116 (2019).
- Kruse, C. R., et al. The effect of pH on cell viability, cell migration, cell proliferation, wound closure, and wound reepithelialization: In vitro and in vivo study. Wound Repair and Regeneration. 25 (2), 260-269 (2017).
- Filippi, M., et al. Perfusable biohybrid designs for bioprinted skeletal muscle tissue. Advanced Healthcare Materials. , e1500758 (2023).
- Matthiesen, I., et al. Astrocyte 3D culture and bioprinting using peptide-functionalized hyaluronan hydrogels. Science and Technology of Advanced Materials. 24 (1), 2165871 (2023).
- Xu, L., et al. Bioprinting a skin patch with dual-crosslinked gelatin (GelMA) and silk fibroin (SilMA): An approach to accelerating cutaneous wound healing. Materials Today Bio. 18, 100550 (2023).
- Bliley, J. M., Shiwarski, D. J., Feinberg, A. W. 3D-bioprinted human tissue and the path toward clinical translation. Science Translational Medicine. 14 (666), eabo7047 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены