Ex vivo Культивирование потока эксплантов плаценты - имитация динамических условий в утробе матери
В этой статье
Резюме
Вот протокол культивирования плацентарных эксплантов в условиях постоянного потока. Этот подход улучшает традиционные статические системы культивирования ворсинок, позволяя воспроизводить динамические физиологические среды.
Аннотация
Существующие модели культивирования эксплантов плаценты ex vivo в основном основаны на статических культуральных системах с использованием планшетов. Однако эти модели неадекватно отражают динамику внутриутробного развития , когда плацента испытывает постоянное небольшое напряжение сдвига из-за плазмы или кровотока. Чтобы устранить это ограничение, была разработана система проточной культуры, которая приближает культивирование эксплантов плаценты ex vivo к условиям внутриутробного потока, наблюдаемым в материнском организме. В рамках этого подхода экспланты плаценты культивируются в последовательности из пяти взаимосвязанных проточных камер. Эта настройка поддерживает физиологическую концентрацию кислорода и постоянный расход. Собранные данные показывают, что в условиях потока сохранение морфологии тканей заметно улучшается по сравнению с традиционными статическими методами. Этот инновационный метод представляет собой простой способ эксплантации плацентарной культуры ex vivo, предлагая более точное представление динамики среды in vivo . Кроме того, данное исследование открывает новые возможности для изучения функциональной динамики фетоматеринского интерфейса. Использование осуществимых динамических методологий способствует более глубокому пониманию биологии плаценты, подчеркивая ее значимость для здоровья матери и плода.
Введение
С 1960-х годов для изучения фетоматеринского интерфейса 1,2,3 используется культивирование плацентарных эксплантов на дне лунки. Этот метод хорошо зарекомендовал себя и прост, позволяя использовать человеческие ткани для различных исследований, в дополнение к культурам одиночных клеток 2,3. С течением времени экспериментальные схемы для культур плацентарных эксплантов были модифицированы с учетом концентрации кислорода4 и предотвращения оседания тканина дне планшета 2,5,6. Однако этот метод не был адаптирован к условиям in vivo в матке, в частности, к наличиюпостоянного потока3.
Успех беременности зависит от адекватной и последовательной перфузии межворсинчатого пространства материнской кровью, установления динамического контура с непрерывным притоком и оттоком крови и веществ, передающихся через кровь 7,8,9,10,11,12. Плацента имеет две различные системы кровоснабжения, одну для материнской крови и одну для фетальной крови, что приводит к двойной перфузии как плодной, так и материнской системами13. Материнская кровь начинает перфузировать межворсинчатое пространство плаценты в конце первого триместра, медленно протекая по расширенным спиральным артериям матки10,11,14. Следовательно, плацентарные ворсинчатые деревья омываются материнской кровью, доставляя питательные вещества и кислород к плоду. Эта материнская кровь течет через межворсинчатое пространство, прежде чем вернуться в материнский кровоток через маточно-плацентарные вены. При его прохождении через межворсинчатое пространство диффузия и активное поглощение кислорода и питательных веществ в кровь плода приводят к снижению уровня кислорода и питательных веществ в крови матери12,15. Однако кровь межворсинчатого пространства полностью замещается свежей, богатой кислородом кровью примерно два-три раза в минуту, обеспечивая непрерывное поступление питательных веществ и газов13. Примечательно, что синцитиотрофобласт, самая внешняя часть плацентарного барьера, является единственным компонентом плацентарного ворсинчатого дерева, непосредственно контактирующего с материнской кровью15,16,17. Следовательно, синцитиотрофобласт испытывает постоянное слабое напряжение сдвига от протекающей материнской крови 3,14.
Современные научные знания о среде плацентарного оттока и современные технические достижения позволяют проводить адаптированное и физиологически приближенное культивирование плацентарных эксплантов в условиях потока. Кроме того, данные свидетельствуют о том, что сдвиговые силы влияют на биологические функции синцитиотрофобласта 18,19,20,21. Хорошо известным подходом, учитывающим кровоток, является плацентарная двухдолевая перфузионная система22. Однако эти эксперименты требуют значительных знаний, ограничены по времени (проводятся всего несколько часов) и возможны только с образцами плаценты третьего триместра 3,23. В отличие от этого, мы разработали простой и неинвазивный метод эксплантации ex vivo плацентарных ворсинчатых эксплантов при постоянных настройках потока, учитывающий ткани плаценты как в первом, так и в третьем триместре3. В этой установке экспланты плаценты культивируются в пяти последовательно соединенных проточных камерах. Ворсинчатые экспланты крепятся ко дну камеры с помощью игольчатых возвышений на тонких металлических пластинах. Построенный проточный контур затем переносится в биореактор, где регулируются как концентрация кислорода, так и расход3. Результаты проточной культуры показывают, что целостность тканей сохраняется лучше по сравнению с обычно используемым статическим методом3. Кроме того, этот динамический подход позволяет создавать новые и адаптированные экспериментальные проекты для культивирования эксплантов тканей, что позволяет проводить эксперименты in vitro, которые более точно имитируют естественную среду3.
протокол
Комитет по этике Медицинского университета Граца одобрил это исследование (31-019 ex 18/19 version 1.2 и 29-319 ex 16/17). Информированное согласие было получено от всех субъектов, участвовавших в исследовании.
1. Подготовка к эксперименту с потоком
ПРИМЕЧАНИЕ: Эксперименты проводятся в биореакторе со встроенными перистальтическими насосами (см. таблицу материалов). Влажность, температуру и уровень газа внутри биореактора можно регулировать.
- Включите биореактор и сделайте все необходимые приготовления (например, калибровку насосов, предварительный подогрев, газовый режим и влажность) для эксперимента в соответствии с инструкцией по эксплуатации биореактора. Перед началом эксперимента требуемые параметры (температура, газообразование, влажность) должны быть стабилизированы в течение нескольких часов или в течение ночи. Для этого запустите биореактор и программное обеспечение, а затем нажмите на Change SetPoints в пункте меню «Инкубатор».
- Предварительно подогрейте PBS и требуемую среду (среду для выращивания эндотелиальных клеток, дополненную прилагаемыми добавками hEGF-5, HC-500, а также 5% истощенной экзосомами фетальной бычьей сывороткой, 1% пенициллин/стрептомицин) (см. таблицу материалов) до 37 °C.
2. Вскрытие плацентарного образца
- Сразу после родов вырежьте три раза по 2см3 плацентарные образцы из средней плацентарной области, как описано в Kupper et al.3 Кратко храните образцы в PBS. Отбракуйте с образца хорионическую пластинку, материнскую дециду и участки видимых инфарктов.
- Оставшийся образец ткани рассекают на ворсинчатые экспланты диаметром поперечного сечения около 0,5 см (влажный вес около 7,5 мг). Переложите их в чашку Петри со свежим PBS.
- Промойте экспланты в ПБС, аккуратно встряхнув их в жидкости пинцетом, чтобы удалить остатки крови.
ПРИМЕЧАНИЕ: Препарируйте образцы в чашке Петри с PBS для предварительной промывки и предотвращения их высыхания и используйте стерилизованные/автоклавные инструменты для обработки ткани.
3. Эксперимент с потоком
- Под стерильным колпаком последовательно соедините пять камер с резервуаром с помощью замков Люэра в соответствии с инструкцией по эксплуатации проточных камер (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Стерилизуйте и/или автоклавируйте все материалы перед использованием в соответствии с соответствующим руководством. Используйте воздушный фильтр на баллоне резервуара для стерильного газообмена. Чтобы открыть и закрыть камеры, аккуратно сожмите ушки камер. Шаг 3.1. также могут быть подготовлены раньше. - Переверните камеры вверх дном и откройте их, сняв дно. Используйте щипцы, чтобы переместить металлические пластины по центру в верхней части камер так, чтобы штифты были направлены вверх.
- Наполните камеры 1 мл предварительно подогретой среды (37 °C). Затем наполните резервуар еще 20 мл. Для контура требуется в общей сложности 25 мл, включая объем в каждой проточной камере, в пробирках и резервуаре. При потоке конечный объем среды в заполненной камере составляет 2 мл.
- Используйте щипцы и переносите один ворсинчатый эксплант за другим между иглами металлической пластины в камере. Пусть иглы скользят между ворсинками плаценты, чтобы избежать прокола ткани. Перенесите четыре экспланта в одну камеру. Закройте камеры, осторожно установив нижнюю часть. Полный контур содержит в общей сложности 20 эксплантов. Камеры должны оставаться в перевернутом положении.
ПРИМЕЧАНИЕ: Осторожно возьмитесь за эксплантаты щипцами; Старайтесь не сдавливать их. Убедитесь, что камеры и контур полностью герметичны, чтобы предотвратить утечку. Камеры всегда используются в перевернутом виде. Количество эксплантов в камере и количество самих камер варьируются. Процедура для тканей первого триместра аналогична процедуре для тканей третьего триместра с небольшим дополнением: чтобы зафиксировать ворсинки, слегка согните иглы над эксплантами после того, как ткань была перенесена на металлическую пластину (личное сообщение Brugger et al.). Это фиксирует хрупкую ткань на металлической пластине и предотвращает соскальзывание образцов. - Перенесите проточный узел в биореактор.
- Подсоедините проточный контур к перистальтическому насосу внутри биореактора, подсоединив трубку насоса к насосу. Зафиксируйте его на4-м этапе (вы услышите, как он щелкает четыре раза).
- Если требуется статический контроль, то также поместите планшет лунки в биореактор.
ПРИМЕЧАНИЕ: Для статической культуры пять лунок шестилуночной пластины заполняют 4 мл среды на лунку и 4 ворсинчатых эксплантата на лунку. Планшет с заполненной лункой также помещается в биореактор и культивируется в той же атмосфере, что и экспланты проточной культуры. Более подробная информация описана в Kupper et al.3 - Установите режим насоса на Ручной в пункте меню «Насосы». Затем установите скорость насоса на 1 мл/мин и начните закачивать среду в трубку, нажав кнопку «Выполнить». Пока контур заполняется средой, держите камеры под углом, чтобы они были полностью заполнены средой.
ПРИМЕЧАНИЕ: В Дополнительной таблице 1 приведены экспериментальные настройки для плацентарного ворсинчатого потока и статического культивирования. Технические характеристики расходной и статической системы приведены в Дополнительной таблице 2.
ВНИМАНИЕ: Осторожно наклоняйте камеру во время наполнения, чтобы образцы не соскальзывали с игл. - После завершения наполнения камеры остаются в перевернутом положении. Убедитесь, что камеры стоят надежно и вертикально, и закройте обе крышки биореактора.
ПРИМЕЧАНИЕ: Окончательный объем среды в заполненной проточной камере составляет 2 мл. Экспериментальные настройки и технические характеристики проточных камер и скважинных планшетов, используемых в экспериментах, описаны в работе Kupper et al.3 - Инкубируйте ткань в течение нужного времени.
ПРИМЕЧАНИЕ: Температуру, уровень газа и расход можно контролировать на компьютере, не открывая крышку биореактора повторно. - Остановите помпу после инкубации ткани на нужное время, нажав на кнопку « Прервать » под пунктом меню «Насосы». Откройте две крышки биореактора, а затем по одной проточной камере за раз. Осторожно извлеките экспланты из металлической пластины с помощью щипцов.
- Обработайте ткань и надосадочную жидкость в соответствии с выбранным последующим анализом. При этом выполняли иммуногистохимическое окрашивание и электронную микроскопию3. Подробную информацию об антителах, используемых для иммуногистохимии и иммунофлуоресценции, см. в Дополнительной таблице 3 .
ПРИМЕЧАНИЕ: После удаления ткани слейте среду из контура, вращая насос против часовой стрелки. - Разберите и очистите проточный контур в соответствии с инструкциями производителя для проточных камер и трубок.
Результаты
Части этой публикации и ее результаты уже опубликованы (см. ссылки 3 и 23).
Экспериментальная установка
Экспериментальная установка показана на рисунке 1. Составной проточный цикл состоит из пяти проточных камер, соединенных между собой последовательно (Рисунок 1A). В каждой проточной камере культивируются четыре экспланта, каждый с диаметром поперечного сечения около 0,5 см (Рисунок 1 A,C). Для статического контрольного эксперимента экспланты культивируют в отдельных лунках шестилуночной пластины (рис. 1Б). Чтобы предотвратить вымывание эксплантов, их прикрепляют к металлическим пластинам с узкими игольчатыми выступами (рис. 1 D, E). Для того, чтобы подвергнуть экспланты прямому потоку среды, камеры инвертированы, а входы и выходы расположены в головной секции (рис. 1 F,G). В биореакторе проточный цикл связан с перистальтическим насосом. С целью сравнения целостности тканей между тканями, культивируемыми потоком, и тканями, культивируемыми традиционным статическим культивированием, экспланты помещаются в шестилуночную пластину, прилегающую к циклу потока. Это обеспечивает проверку стабильных условий культивирования с точки зрения кислорода, температуры и влажности (Рисунок 1A)3.
Морфологический анализ
β-актин
Были проведены различные процедуры иммуногистохимического окрашивания для изучения гистологических различий в целостности тканей, связанных с различными условиями культивирования (рис. 2). Экспланты, которые были быстро внедрены после вскрытия, служили исходным ориентиром. Для анализа актинового цитоскелета в ворсинчатых эксплантатах выполняли окрашивание β-актином (рис. 2А-Е). Описательный анализ выявил хорошо структурированное и организованное визуальное представление цитоскелета в свежеполученной ткани (рис. 2А). Со временем, по мере культивирования, наблюдалась агрегация микрофиламентов, означающая деградацию цитоскелетной структуры. Это явление последовательно наблюдалось у ворсинчатых эксплантов, подвергшихся статичному культивированию3 (рис. 2С, Е, обозначены звездочками).
Окрашивание H&E
Окрашивание H&E обеспечило дополнительное подкрепление наблюдения о том, что целостность тканей уменьшается в ходе статической культуры, и эта тенденция улучшается в контексте проточной культуры (рис. 2F-J). Свежая ткань демонстрировала структурированную и характерную гистологическую картину ворсинчатых эксплантов, характеризующуюся плотной и плотно упакованной стромой (рис. 2F). Кроме того, синцитиотрофобласт был прочно прикреплен к нижележащей строме (рис. 2F). Аналогичная картина отмечена у ворсинчатых эксплантов, культивируемых в проточной среде в течение 24 ч (рис. 2G). Однако после 48 ч культивирования в потоке наблюдалось частичное отделение частей синцитиотрофобласта (рис. 2I, обозначено стрелкой), что сопровождалось спорадическими небольшими лакунами в строме. Гистологическое исследование ткани показало, что целостность ткани через 24 ч в условиях статической культуры была сохранена неадекватно (рис. 2H). Более того, эта целостность заметно ухудшалась после 48 ч в статической культуре (рис. 2J). Строма имела пористый и ямчатый вид, а значительный отрыв синцитиотрофобласта от стромы был очевиден на более крупных участках (рис. 2J, стрелки)3.
CD34II
Для визуализации эндотелиальных клеток и, следовательно, фетоплацентарных кровеносных сосудов в ворсинчатых эксплантах использовали окрашивание CD34II (рис. 2K-O). Ткань, которая была внедрена непосредственно после вскрытия, демонстрировала отчетливо организованное расположение эндотелиальных клеток (рис. 2К). Морфологическая целостность фетоплацентарных кровеносных сосудов оставалась хорошо сохраненной после 24 ч посева потока, а часто даже через 48 ч, хотя отдельные случаи коллапса кровеносных сосудов отмечались в условиях потока (рис. 2, L, N). Однако после 24 ч статического культивирования кровеносные сосуды демонстрировали частичный коллапс, о чем свидетельствовал их нарушенный внешний вид (рис. 2М, обозначен стрелками). Это ухудшение кровеносных сосудов в условиях статической культуры, по-видимому, усугублялось при длительном времени культивирования. Таким образом, описательная морфологическая оценка ворсинчатых эксплантов после проточной и статической культуры показала, что целостность тканей, по-видимому, более эффективно сохраняется в проточной системе по сравнению со статическим режимом культивирования3.
Ультраструктурный анализ культивируемой ткани
Просвечивающая электронная микроскопия
Для более детального изучения морфологии ворсинчатых эксплантов были проведены дополнительные ультраструктурные анализы с помощью просвечивающей электронной микроскопии (ПЭМ) (рис. 3А-Е). Эти данные подтвердили результаты гистологических исследований. В тканях, которые были внедрены непосредственно после препарирования, морфология сохранилась исключительно хорошо (рис. 3А). Микроворсинки были отчетливо различимы на поверхности синцитиотрофобласта. Синцитиотрофобласт представлял собой характерный непрерывный слой без боковых границ клеток, устанавливая прямой контакт с базальной мембраной. Строма свежей ткани имела плотную уплотнение без значительных перфораций и разрывов. Кроме того, ультраструктурный вид кровеносных сосудов и индивидуализированные внутрисосудистые эритроциты также продемонстрировали отличную сохранность (рис. 3А).
Даже после 24 ч проточной культуры общая морфология образцов тканей оставалась относительно хорошо сохраненной (рис. 3D). Несмотря на то, что микроворсинок на поверхности синцитиотрофобласта было несколько меньше по сравнению со свежей тканью, синцитиотрофобласт оставался в основном прикрепленным к базальной мембране. Ядра и отдельные мелкие вакуоли наблюдались во внутренней части синцитиотрофобласта. Строма в плацентарных ворсинках хорошо сохранилась и была очень похожа на свежую ткань (рис. 3D). Даже после 48 ч проточной культуры стромальные клетки демонстрировали относительно хорошую сохранность, хотя и с некоторыми перфорациями (рис. 3E). Интересно, что в тканях были обнаружены липидные капли. В то время как у синцитиотрофобласта наблюдались вакуоли и уменьшение количества микроворсинок, он оставался прикрепленным к базальной мембране во многих областях, и синцитиальные и клеточные ядра были отчетливо видны (рис. 3E).
В отличие от ткани из проточной культуры, морфология ворсинчатой ткани, подвергнутой статической культуре, ухудшилась уже через 24 ч (рис. 3B). Синцитиотрофобласт диссоциировал от базальной мембраны в нескольких местах и показал относительно значительные перфорации. Кроме того, липидные капли часто обнаруживались как в синцитиотрофобласте, так и в строме (рис. 3B). После 48 ч статической культуры наблюдалось прогрессирующее снижение ультраструктуры (рис. 3С). Синцитиотрофобласт в значительной степени отличался многочисленными перфорациями и отслоением от базальной мембраны. Идентификация клеток в строме, а также эндотелиальных клеток, составляющих кровеносные сосуды, стала сложной задачей. Кроме того, наблюдалось заметное накопление липидных капель в ворсинчатых эксплантах после 48 ч статической культуры (рис. 3C). Таким образом, ультраструктура ткани в статической культуре демонстрировала последовательное ухудшение в течение всего периода культивирования, и эта тенденция была смягчена культивированием в условиях потока3.
Сканирующая электронная микроскопия
С помощью сканирующей электронной микроскопии (СЭМ) было проведено детальное исследование поверхности ворсинчатых эксплантов (рис. 4A-J). Ткань, которая была только что внедрена, имела плотно заселенный массив микроворсинок по всей своей поверхности (рис. 4, А, Б). В некоторых регионах наблюдались везикулоподобные структуры. Напротив, в тканях статической культуры наблюдалось значительное уменьшение микроворсинок через 24 ч (рис. 4C, D), которое сохранялось через 48 ч (рис. 4E, F). В то время как в некоторых областях наблюдалась агрегация везикулоподобных структур, которые не были высвобождены, другие области казались голыми и эродированными (рис. 4D, F). В тканях, подвергнутых проточной культуре, микроворсинки все еще присутствовали на поверхности через 24 ч (рис. 4G,H), а также через 48 ч (рис. 4I,J), хотя и в меньшей степени, чем в свежих тканях. По сравнению со статичной культурой преобладание везикулоподобных структур на поверхности было уменьшено. Интересно, что эти везикулоподобные структуры были заметно сконцентрированы в определенных углублениях, где поток мог быть уменьшен или отсутствовать (рис. 4H, J), что позволяет предположить, что они могли быть смещены с поверхности ткани, подверженной воздействию потока, из-за потока среды3.

Рисунок 1: Настройка проточной системы . (А) Собранная проточная система, состоящая из резервуара и пяти проточных камер, соединена с одним из перистальтических насосов. С правой стороны находится шестилуночная пластина, в которой экспланты культивируются статически. (В,В) При обоих методах культивирования плацентарные образцы рассекают на ворсинчатые экспланты размером примерно 0,5 см2 , из которых затем используют четыре экспланта на лунку или камеру. При экспериментальном подходе используются пять камер или скважин. (Д,Э) Для закрепления эксплантов используется металлическая пластина с узкими игольчатыми возвышениями. (Ж,Ж) Отверстия трубок расположены в верхней части камер и, таким образом, используются вверх ногами, чтобы гарантировать, что ткань подвергается воздействию прямого потока. Этот рисунок воспроизведен по Kupper et al.3. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
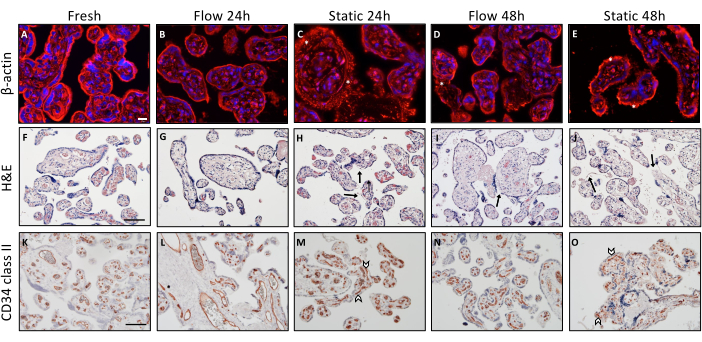
Рисунок 2: Морфологический анализ эксплантов ворсинок плаценты при проточной и статической культуре. (А-Е) Иммунофлуоресцентное окрашивание на β-актин для визуализации цитоскелета эксплантов на культуре. Для анализа было использовано шесть случайно выбранных мест на каждом слайде. Показаны репрезентативные изображения. (А) Визуализация цитоскелета ткани, внедренной непосредственно после препарирования. Масштабная линейка: 20 мкм. (B-E) Репрезентативное изображение как зависимой от времени, так и от режима культивирования дегенерации актинового цитоскелета в культивируемых эксплантах проточной и статической культуры. (К-Э) Звездочки означают повышенное накопление актиновых микрофиламентов, что является признаком деградации актинового цитоскелета. (Ф-Д) Окрашивание гематоксилин-эозином ворсинчатых эксплантов. Масштабная линейка: 100 мкм. (F,G) Свежевнедренные ткани (F) и экспланты текучих культур в течение 24 ч (G) демонстрируют хорошо сохранившуюся морфологию ворсинчатого экспланта. (I) Экспланты, культивируемые в потоке, в течение 48 ч показывают периодически отделяющиеся участки синцитиотрофобласта (стрелка). (Х,Дж) Зависящее от времени ухудшение структурной целостности после статической эксплантированной культуры, на что указывает смещение синцитиотрофобласта (стрелка) и перфорированной стромы. (К-О) CD34 II использовали для окрашивания ворсинчатых эндотелиальных клеток. Масштабная линейка: 100 мкм. (K,L) Свежая ткань (K) и экспланты, культивируемые в течение 24 ч в условиях потока (L), демонстрируют характерный структурно выровненный рисунок эндотелиальных клеток. (N) Через 48 ч при посеве в потоке сосудистая целостность в некоторой степени снижается. (М,О) В статической культуре разрушенные кровеносные сосуды видны уже через 24 ч (М), и было замечено, что они увеличиваются с увеличением времени статического культивирования (О). Этот рисунок воспроизведен по Kupper et al.3. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
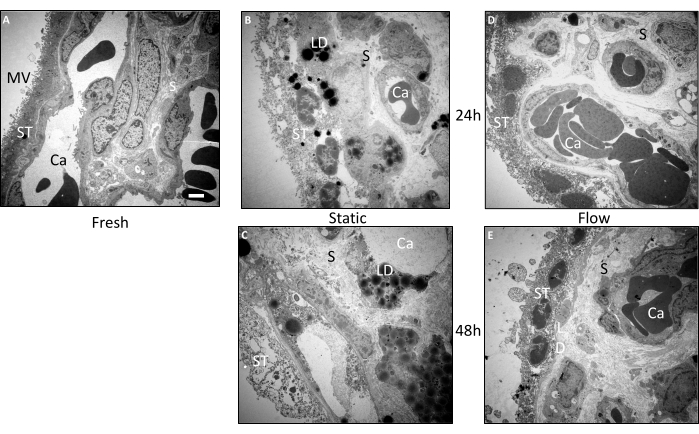
Рисунок 3: Ультраструктурное исследование ворсинчатых эксплантов до и после культивирования с помощью просвечивающей электронной микроскопии. Для анализа изображений была использована ткань из трех независимых экспериментов. (А) На репрезентативном изображении свежевнедренной ткани видно большое количество микроворсинок (MV) на поверхности синцитиотрофобласта (ST). Структурно неповрежденные капилляры (Ca) видны в хорошо сохранившейся строме (S). (Б) В ткани, которая подвергалась статическому культивированию в течение 24 ч, наблюдается ухудшение структурной целостности синцитиотрофобласта, который, по-видимому, в некоторых областях не соединен с базальной мембраной. Также наблюдается заметное скопление липидных капель (ЛД). (C) После 48 ч в статической культуре наблюдается сильное ультраструктурное разрушение. Строма, как и синцитиотрофобласт, перфорирована, и очевидно массивное скопление липидных капель. Кровеносные сосуды едва можно было проследить. (Д,Э) Ультраструктура ткани из проточной культуры относительно хорошо сохранялась через 24 ч (D), а также через 48 ч (E). Масштабная линейка: 2 мкм. MV: микроворсинки, ST: синцитиотрофобласт, S: строма, Ca: капиллярный, LD: липидные капли. Этот рисунок воспроизведен по Kupper et al.3. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 4: Ультраструктурное исследование эксплантов ворсинок до и после культивирования с помощью сканирующей электронной микроскопии. (A,C,E,G,I) Обзорные изображения поверхности ворсинчатых деревьев плаценты с соответствующими детальными изображениями (B,D,F,H,J). (А,Б) Свежевросшая ткань демонстрирует плотный шов микроворсинок. (Б) В некоторых местах можно заметить пористые структуры. (К-Ж) Через 24 ч и 48 ч в статической культуре видно уменьшение микроворсинок на поверхности синцитиотрофобласта. Бросается в глаза обширное скопление везикулярных частиц на поверхности экспланта. (F) Частицы, по-видимому, увядают через 48 ч в статической культуре. (Г-Ж) Поверхность ткани из проточной культуры, по-видимому, лучше сохраняется через 24 ч (G,H), а также через 48 ч (I,J) по сравнению со статической культурой. Микроворсинки видны на поверхности (H,J), хотя и не такой высокой плотности, как в свежей ткани. (Б) Везикулярные частицы могут быть рассеяны в нишах с пониженным потоком. Этот рисунок воспроизведен по Kupper et al.3. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Дополнительная таблица 1: Экспериментальные настройки для плацентарного ворсинчатого оттока и статического культивирования. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица 2: Технические характеристики расходной и статической системы. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительная таблица 3: Антитела для иммуногистохимии и иммунофлуоресценции, использованные в данном исследовании. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
В этом исследовании представлен уникальный взгляд на метод проточной культуры для эксплантов плаценты, предназначенный для воспроизведения динамики внутриутробной среды 3,23. Полученные результаты показывают, что морфология ткани, культивируемой в проточных условиях, лучше сохраняется по сравнению с традиционным статическим методом культивирования3. Примечательно, что, несмотря на то, что ни статические, ни проточные условия культивирования не способствуют перфузии плацентарных сосудов, разрушение фетоплацентарных кровеносных сосудов внутри ворсинчатой стромы наблюдалось преимущественно в статической культуре, в то время как целостность кровеносных сосудов, по-видимому, лучше сохранялась в течение более длительного времени в проточной культуре3.
Одно из возможных объяснений этого наблюдения может быть связано с решающей защитной и эндокринной ролью синцитиотрофобласта, функцией, хорошо задокументированной в литературе 12,24,25,26. Учитывая это, можно предположить, что общая целостность наружного слоя ворсинок в значительной степени способствует поддержанию нижележащей стромы, включая кровеносные сосуды. Следовательно, устойчивая клеточная целостность кровеносных сосудов в условиях потока может быть приписана непрерывному потоку среды. Это движение способствует пассивному движению эксплантов, облегчая обмен газами, питательными веществами и наночастицами (например, внеклеточными везикулами) через плацентарный барьер. Это, в свою очередь, может положительно повлиять на сохранение морфологии кровеносных сосудов. Кроме того, феномен механочувствительности играет роль в морфогенезе тканей в различных тканях27,28. Исследования показали, что механочувствительность влияет на клеточные процессы на нескольких уровнях, вызывая ряд биохимических реакций, которые в конечном итоге влияютна функциональность тканей и органов. Примечательно, что механочувствительные белки экспрессируются синцитиотрофобластом на протяжении всей гестации28. Кроме того, исследование предполагает, что микроворсинки на поверхности тканей могут быть вовлечены в этот контекст28.
Еще одна перспектива, которую стоит рассмотреть, — это потенциальная роль митохондрий в клеточном ответе на поток. Например, в эндотелиальных клетках митохондрии служат преобразователями сигналов клеточных реакций настимулы окружающей среды. Повышенное накопление липидных капель, наблюдаемое в статической культивируемой ткани через TEM3, было связано с индукцией апоптоза из-за митохондриальной дисфункции31. Необходимы дальнейшие исследования, чтобы раскрыть основные механизмы и ключевые факторы, связывающие их с нисходящими сигнальными путями. Это исследование может улучшить наше понимание того, как ткань воспринимает и реагирует на напряжение сдвига, что приведет к улучшению жизнеспособности и целостности ворсинчатых эксплантов в культуре23.
Несколько критически важных шагов протокола должны быть повторены и выполнены с осторожностью. После плацентарных родов ткань должна быть культивирована как можно быстрее. Во время подготовки эксплантата очень важно избегать участков с видимыми инфарктами. Важно осторожно обращаться с эксплантами щипцами, чтобы предотвратить сдавливание. Рекомендуется держать ткани покрытыми жидкостью на протяжении всей процедуры и проводить ее быстро.
Важно отметить, что данное исследование не позволяет определить точное напряжение сдвига в представленной проточной системе, что следует рассматривать как ограничение в будущих исследованиях 3,23. Тем не менее, важно понимать, что точная скорость потока и напряжение сдвига для конкретного ворсинки плаценты in vivo зависят от множества параметров, таких как геометрические характеристики межворсинчатого пространства, расположение ворсинок в этом пространстве, а также его близость и угол к материнским спиральным артериям и маточным венам 3,19,23,32 . Необходимо также учитывать сложность геометрической структуры плаценты, которая варьируется у разных людей23,32. Уже существуют математические модели, оценивающие кровоток в межворсинчатом пространстве32 и расчеты напряжения сдвига стенки синцитиотрофобласта19,28. Интересно, что в одном исследовании предсказывалось, что напряжение сдвига синцитиотрофобласта ниже в третьем триместре по сравнению с первым триместром28, в то время как другое исследование продемонстрировало пространственно неоднородное напряжение сдвига стенки на синцитиотрофобласте19. Определение точной скорости потока и напряжения сдвига для конкретного ворсинки плаценты остается сложной задачей 3,19,23,32. Такие расчеты дают приблизительное представление о диапазоне напряжений сдвига для будущих исследований, но они могут потребовать постоянной анатомической корректировки и оптимизации23. Кроме того, в будущих исследованиях могут быть разработаны новые и усовершенствованные методы проточного культивирования, учитывающие сложную геометрию межворсинчатого пространства и стратегии увеличения количества образцов в эксперименте. Ожидается дальнейший прогресс и развитие проточной системы, в которой потенциально могут использоваться альтернативные проточные камеры (Brugger et al., неопубликованные данные, 2023 г.).
В заключение, это исследование закладывает прочную основу, демонстрируя легко реализуемую технику проточной культуры ex vivo, которая поддерживает структурную целостность культивируемых ворсинчатых эксплантов. Это подчеркивает важность динамических методов в исследованиях функциональной биологии плаценты, прокладывая путь к дальнейшему развитию систем проточных культур и генерации новых идей и гипотез 3,23.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Авторы выражают признательность Беттине Амтманн и Петре Винклер за отличную техническую поддержку при взятии образцов тканей. Это исследование финансировалось Австрийским научным фондом FWF (DOC 31-B26) и Медицинским университетом Граца, Австрия, в рамках программы PhD «Воспалительные заболевания во время беременности» (DP-iDP).
Материалы
| Name | Company | Catalog Number | Comments |
| 6-well plates | NUNC, ThermoFisher Scientific, Waltham, MA, USA | 140675 | |
| Alexa Fluor 555 goat-anti-mouse | ThermoFisher Scientific, Waltham, MA, USA | A21422 | Diluted in PBS, 1:200 |
| antibody diluent | Dako, Santa Clara, CA, USA | S3022 | |
| anti-β-actin (AC-15) | Abcam, Cambridge, UK | ab6276 | Stock concentration: 2.1 mg/mL, diluted in antibody diluent, 1:10,000 |
| Bioreactor TEB500 | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Serial Number: TEB505 / 1000EW/ 117 | |
| CD34 Class II (QBEnd-10) | Dako, Santa Clara, CA, USA | M7165 | Stock concentration: 12 mg/l, diluted in antibody diluent, 1:500 |
| CPD 030 critically point dryer | Bal-Tec, Balzers, Liechtenstein) | Critically point dryer | |
| DAPI | ThermoFisher Scientific, Waltham, MA, USA | D21490 | Diluted in PBS, 1:1000 |
| Ebers TEB505 Series Software | TEB500, EBERS Medical Technology SL, Zaragoza, Spain | Series Software 1.4 | |
| Endothelial Cell Growth Medium MV | PromoCell PC-C-22120, Heidelberg, Germany; | C-22120 | Used without EGCS/h and FCS, any other medium suitable for the tissue can be used |
| Excelsior AS Tissue Processor | ThermoFisher Scientific, Waltham, MA, USA | ||
| Exosome-depleted fetal bovine serum | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | A2720803 | |
| Histolab Clear | Histolab, Askim, Sweden | 14250-TY | |
| Hydrogen Peroxide Block | ThermoFisher Scientific, Waltham, MA, USA | TA125H202Q | |
| Kaiser’s Glycerin Gelatine | Merck, Darmstadt, Germany | 1092420100 | |
| Leica DM 6000 B microscope | Leica, Wetzlar, Germany | Equipped with an Olympus DP 72 Camera | |
| Leica UC7 ultramicrotome | Leica Microsystems, Vienna, Austria) | ||
| Metal plate with needles | In-house construction | ||
| Microtome | Microtome Microm HM 355 S, ThermoFisher Scientific, Waltham, MA, USA | ||
| Microwave oven | Miele, Guetersloh, Germany | ||
| Olympus microscope (BX63) | Olympus, Hamburg, Germany | Serial Number: 1A52421 | |
| PBS | ThermoFisher Scientific, Waltham, MA, USA | 10010015 | |
| Penicillin/Streptomycin | Gibco by Life Technologies, ThermoFisher Scientific, Waltham, MA, USA | 2585627 | |
| Primary antibody enhancer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-PB | |
| ProLong Gold Antifade Reagent | ThermoFisher Scientific, Waltham, MA, USA | P36934 | |
| Pumping tube | Tygon, Bartelt, Graz, Austria | 6.078 175 | 1.02 mm diameter |
| QV500 Flow chambers | Kirkstall Ltd., Quasi Vivo, North Yorkshire, UK | QV500 | Other chambers would work as well |
| SCD 500, sputter coater | Bal-Tec, Balzers, Liechtenstein | Sputter coater | |
| Substrate amino-ethyl carbazole, AEC substrate kit | Abcam, Cambridge, UK | ab64252 | |
| Superfrost Plus slides | Menzel-Glaeser, Braunschweig, Germany | J1800AMNZ | |
| Syringe Filter | Corning Incorporated, NY, USA | 431219 | 0.2 µm Pore SFCA Membrane, air filter for the reservoir bottle |
| TAAB epoxy resin | Agar Scientific, Stansted, Essex, UK | T001 | |
| UltraVision LP-Detection System HRP-Polymer | ThermoFisher Scientific, Waltham, MA, USA | TL-125-HL | |
| UltraVision Protein Block | ThermoFisher Scientific, Waltham, MA, USA | TA125BPQ | |
| Zeiss EM 900 transmission electron microscope | Zeiss, Oberkochen, Germany | ||
| Zeiss Sigma 500 field emission scanning electron microscope | Zeiss, Cambridge, UK | Used with a back-scattered electron detector at 5 kV acceleration voltage |
Ссылки
- Villee, C. A. The metabolism of human placenta in vitro. Journal of Biological Chemistry. 205 (1), 113-123 (1953).
- Miller, R. K., et al. Human placental explants in culture: Approaches and assessments. Placenta. 26 (6), 439-448 (2005).
- Kupper, N., Pritz, E., Siwetz, M., Guettler, J., Huppertz, B. Placental villous explant culture 2.0: flow culture allows studies closer to the in vivo situation. International Journal of Molecular Sciences. 22 (14), 7464 (2021).
- Reti, N. G., et al. Effect of high oxygen on placental function in short-term explant cultures. Cell and Tissue Research. 328 (3), 607-616 (2007).
- Simán, C. M., Sibley, C. P., Jones, C. J. P., Turner, M. A., Greenwood, S. L. The functional regeneration of syncytiotrophoblast in cultured explants of term placenta. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 280 (4), R1116-R1122 (2001).
- Toro, A. R., et al. Leptin is an anti-apoptotic effector in placental cells involving p53 downregulation. PLoS ONE. 9 (6), e99187 (2014).
- Morley, L. C., Debant, M., Walker, J. J., Beech, D. J., Simpson, N. A. B. Placental blood flow sensing and regulation in fetal growth restriction. Placenta. 113, 23-28 (2021).
- Wang, Y. Z. S., Wang, Y., Zhao, S. Placental blood circulation. Vascular biology of the placenta. Chapter 2, (2010).
- Huppertz, B. The anatomy of the normal placenta. Journal of Clinical Pathology. 61 (12), 1296-1302 (2008).
- Weiss, G., Sundl, M., Glasner, A., Huppertz, B., Moser, G. The trophoblast plug during early pregnancy: a deeper insight. Histochemistry and Cell Biology. 146 (6), 749-756 (2016).
- Burton, G. J., Woods, A. W., Jauniaux, E., Kingdom, J. C. P. Rheological and physiological consequences of conversion of the maternal spiral arteries for uteroplacental blood flow during human pregnancy. Placenta. 30 (6), 473-482 (2009).
- Gude, N. M., Roberts, C. T., Kalionis, B., King, R. G. Growth and function of the normal human placenta. Thrombosis Research. 114 (5-6), 397-407 (2004).
- Wang, Y. Vascular biology of the placenta. Colloquium Series on Integrated Systems Physiology: From Molecule to Function. 2 (1), 1-98 (2010).
- Moser, G., Windsperger, K., Pollheimer, J., de Sousa Lopes, S. C., Huppertz, B. Human trophoblast invasion: new and unexpected routes and functions. Histochemistry and Cell Biology. 150 (4), 361-370 (2018).
- Kupper, N., Huppertz, B. The endogenous exposome of the pregnant mother: Placental extracellular vesicles and their effect on the maternal system. Molecular Aspects of Medicine. 87 (October 2020), 100955 (2022).
- Huppertz, B. IFPA award in placentology lecture: biology of the placental syncytiotrophoblast - myths and facts. Placenta. 31 (SUPPL), S75-S81 (2010).
- Gauster, M., Moser, G., Wernitznig, S., Kupper, N., Huppertz, B. Early human trophoblast development: from morphology to function. Cellular and Molecular Life Sciences. 79 (6), 345 (2022).
- Lecarpentier, E., et al. Fluid shear stress promotes placental growth factor upregulation in human syncytiotrophoblast through the cAMP-pKA signaling pathway. Hypertension. 68 (6), 1438-1446 (2016).
- Lecarpentier, E., et al. Computational fluid dynamic simulations of maternal circulation: wall shear stress in the human placenta and its biological implications. PLOS ONE. 11 (1), e0147262 (2016).
- Miura, S., Sato, K., Kato-Negishi, M., Teshima, T., Takeuchi, S. Fluid shear triggers microvilli formation via mechanosensitive activation of TRPV6. Nature Communications. 6 (1), 8871 (2015).
- Jauniaux, E., et al. Onset of maternal arterial blood flow and placental oxidative stress. The American Journal of Pathology. 157 (6), 2111-2122 (2000).
- Sodha, R. J., Proegler, M., Schneider, H. Transfer and metabolism of norepinephrine studied from maternal-to-fetal and fetal-to-maternal sides in the in vitro perfused human placental lobe. American Journal of Obstetrics and Gynecology. 148 (4), 474-481 (1984).
- Kupper, N. . Extracellular vesicles from advanced placental explant flow culture and their role in preeclampsia [Dissertation]. , (2022).
- Burton, G. J., Fowden, A. L. The placenta: a multifaceted, transient organ. Philosophical Transactions of the Royal Society B: Biological Sciences. 370 (1663), 20140066 (2015).
- Arora, N., Sadovsky, Y., Dermody, T. S., Coyne, C. B. Microbial vertical transmission during human pregnancy. Cell Host & Microbe. 21 (5), 561-567 (2017).
- Cheong, M. L., et al. A Positive feedback loop between glial cells missing 1 and human chorionic gonadotropin (hCG) regulates placental hCGβ expression and cell differentiation. Molecular and Cellular Biology. 36 (1), 197-209 (2016).
- Heisenberg, C. P., Bellaïche, Y. Forces in tissue morphogenesis and patterning. Cell. 153 (5), 948-962 (2013).
- Lee, T. C., Moulvi, A., James, J. L., Clark, A. R. Multi-scale modelling of shear stress on the syncytiotrophoblast: could maternal blood flow impact placental function across gestation. Annals of Biomedical Engineering. 51 (6), 1256-1269 (2023).
- Kluge, M. A., Fetterman, J. L., Vita, J. A. Mitochondria and endothelial function. Circulation Research. 112 (8), 1171-1188 (2013).
- Boren, J., Brindle, K. M. Apoptosis-induced mitochondrial dysfunction causes cytoplasmic lipid droplet formation. Cell Death & Differentiation. 19 (9), 1561-1570 (2012).
- Chernyavsky, I. L., Jensen, O. E., Leach, L. A Mathematical model of intervillous blood flow in the human placentone. Placenta. 31 (1), 44-52 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены