Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
CRISPR-Cas9 Редактирование генома крысиных эмбрионов с использованием аденоассоциированного вируса (AAV) и электропорации 2-клеточных эмбрионов
В этой статье
Резюме
Этот протокол представляет собой оптимизированный подход к производству генетически модифицированных моделей крыс. Аденоассоциированный вирус (AAV) используется для доставки матрицы репарации ДНК, а электропорация используется для доставки реагентов CRISPR-Cas9 для завершения процесса редактирования генома в 2-клеточном эмбрионе.
Аннотация
Технология редактирования генома широко используется для получения генетически модифицированных животных, в том числе крыс. Цитоплазматическая или пронуклеарная инъекция матриц репарации ДНК и реагентов CRISPR-Cas является наиболее распространенным методом доставки в эмбрионы. Однако этот вид микроманипуляций требует доступа к специализированному оборудованию, является трудоемким и требует определенного уровня технических навыков. Кроме того, методы микроинъекций часто приводят к снижению выживаемости эмбрионов из-за механического воздействия на эмбрион. В рамках этого протокола мы разработали оптимизированный метод доставки больших шаблонов репарации ДНК для работы в сочетании с редактированием генома CRISPR-Cas9 без необходимости микроинъекций. Этот протокол сочетает в себе AAV-опосредованную доставку ДНК одноцепочечных донорских матриц ДНК вместе с доставкой рибонуклеопротеина CRISPR-Cas9 (RNP) путем электропорации для модификации 2-клеточных эмбрионов. Используя эту новую стратегию, мы успешно создали целевые модели крыс с вкраплением последовательностей ДНК размером от 1,2 до 3,0 кб с эффективностью от 42% до 90%.
Введение
Разработка инструментов редактирования генома на основе CRISPR ускорила нашу способность эффективно создавать новые и более сложные генетически модифицированные модели крыс. Однонаправляющая РНК вместе с нуклеазой Cas9 объединяется с образованием комплексов рибонуклеопротеинов (РНП), которые нацелены на интересующие последовательности ДНК в геноме и приводят к двухцепочечным разрывам ДНК. Поскольку механизмы репарации клеточной ДНК подвержены ошибкам, в процессе репарации вносятся инсерции и делеции (INDEL), которые могут нарушить функцию гена-мишени. Когда происходит совместная доставка желаемой сконструированной последовательности ДНК (репарационного шаблона) вместе с реагентами для редактирования генома, вставка репарирующей матрицы в область, содержащую двухцепочечный разрыв ДНК, происходит с помощью процесса, называемого гомологической направленной репарацией (HDR). Это эффективная стратегия для создания животных моделей с целевыми вставками/заменой ДНК (knock-in). Одним из ограничений является то, что последовательности с выбиванием часто имеют большой размер, что, как было показано, снижает эффективность редактирования генов, тем самымзатрудняя создание желаемой модели. Стратегии повышения эффективности нокаутирования включают линеаризацию как двухцепочечной ДНК (дцДНК), так и одноцепочечной ДНК (мцДНК) и химическую модификацию шаблонов репарации ДНК 2,3,4. Кроме того, были предприняты попытки пронуклеарной микроинъекции вместе со стимулирующими HDR соединениями, применение электрических импульсов в сочетании с микроинъекциями и микроинъекции по времени в 2-клеточные эмбрионы 5,6,7. Несмотря на успех некоторых из этих подходов, включение последовательностей ДНК размером более 1,0 кб остается технически сложной задачей.
Электропорация, которая является распространенным методом введения реагентов в культивируемые клеточные линии, предлагает альтернативу микроинъекциям для доставки компонентов CRISPR-Cas9 в эмбрионы. Электропорация эмбрионов, впервые продемонстрированная на эмбрионах крыс8, с тех пор успешно используется в качестве метода доставки у мышей 9,10,11,12,13, свиней 14,15 и других животных модельных организмов 16,17,18. Эмбрионы, подвешенные в среде, содержащей реагенты CRISPR-Cas9, помещают в кювету или на предметное стекло между двумя электродами и подвергают воздействию прямых импульсов электрического тока. Это создает временные отверстия в zona pellucida и плазматической мембране эмбриона, через которые компоненты CRISPR-Cas9 попадают в эмбрионы. Как правило, электрические импульсы среднего уровня используются для создания временных отверстий, за которыми следуют электрические «переходные импульсы» более низкого уровня, которые облегчают перемещение отрицательно заряженных компонентов редактирования генома. Электропорация эмбрионов эффективна, имеет высокую пропускную способность и проста в выполнении. Однако, несмотря на то, что электропорация эмбрионов показала высокую успешность при внедрении малых (<200.н.) шаблонов репарации мцДНК, существует мало сообщений об успешной электропорации более крупных (>1,0 kb) шаблонов репарации13,19. Это ограничение по размеру представляет собой основное ограничение электропорации эмбрионов для создания моделей животных, требующих больших введений.
В контексте генной терапии аденоассоциированные вирусы (ААВ) уже давно используются в качестве транспортных средств для доставки генетического материала из-за их эффективной in vivo инфекционности как делящихся, так и неделящихся клеток, отсутствия патогенности и редкой геномной интеграции20,21. В последнее время все больше исследований объединяют AAV с технологией CRISPR-Cas9 для внедрения матриц репарации ДНК и реагентов CRISPR 22,23,24. Такой подход позволяет доставлять более крупные шаблоны репарации ДНК без необходимости использования методов микроинъекций.
Путь HDR более активен в поздних фазах S и G2 клеточного цикла25,26. В исследованиях, проведенных in vitro, значительное повышение эффективности нокаутирования было достигнуто путем доставки CRISPR-Cas9 RNP и матриц репарации ДНК в G2-синхронизированные клетки или путем ограничения присутствия белка Cas9 поздними фазами S и G2 с использованием белка слияния Cas9-Geminin2. Кроме того, существует крупное событие активации зиготного генома (ZGA), которое происходит во время расширенной фазы G2 эмбриона на 2-клеточной стадии, и это связано с открытым состоянием хроматина. Предполагается, что это обеспечивает CRISPR-Cas9 RNP и шаблоны репарации с большей доступностью к геномной ДНК.
Наша цель состояла в том, чтобы, объединив подход AAV с электропорацией эмбрионов, внедрить CRISPR-Cas9 RNP на 2-клеточной стадии развития эмбриона. Эта стратегия использует преимущества большей способности AAV по доставке шаблонов репарации ДНК, технической простоты электропорации и более оптимальной временной точки доступа генома к 2 клеткам во время развития эмбриона для создания эффективного метода таргетной генной инженерии вставок ДНК. Как подчеркивается в этом протоколе, наш оптимизированный метод позволяет создавать целевые модели крыс с вкраплением последовательностей ДНК размером от 1,2 до 3,0 кб без необходимости использования методов микроинъекций.
Access restricted. Please log in or start a trial to view this content.
протокол
Все экспериментальные процедуры были одобрены Комитетом по уходу и использованию животных Университета Миссури (протокол ACUC #25580) и выполнялись в соответствии с рекомендациями, изложенными в Руководстве по использованию и уходу за лабораторными животными.
1. AAV-опосредованная доставка шаблона репарации ДНК
- Спроектируйте конструкцию ДНК таким образом, чтобы она содержала желаемую последовательность нокаутирования между двумя плечами гомологии. Типичная длина плеча гомологии составляет 300-500.н. Убедитесь, что весь шаблон репарации ДНК (плечи гомологии + желаемая последовательность нокаутирования) окружен инвертированными концевыми повторами (ITR) путем клонирования в соответствующий плазмидный остов и упаковки в рекомбинантный ssAAV1 или ssAAV6 (серотипы 1 или 6).
ПРИМЕЧАНИЕ: Если целевая последовательность sgRNA присутствует в матрице репарации ДНК, важно спроектировать тихие мутации, чтобы нарушить эту последовательность, тем самым предотвращая опосредованное CRISPR-Cas9 редактирование правильно направленного аллеля.
ВНИМАНИЕ: Рекомбинантные вирусные векторы AAV не интегрируются и классифицируются как BSL-1. Стандартные асептические методы используются для пипетирования и обработки эмбрионов, подвергшихся воздействию вируса. - В 30 мкл среды KSOM-R27,28 добавляют сконструированный ssAAV1 или ssAAV6 (упакованные с шаблоном репарации ДНК) до конечной концентрации 3 × 107 геномных копий (ГК)/мкл под минеральным маслом в чашке Петри 35 мм.
- Поместите зиготы с видимыми пронуклеусами в среду KSOM-R, содержащую инженерный ssAAV.
ПРИМЕЧАНИЕ: При использовании этого протокола нет необходимости истончать zona pellucida, так как серотипы AAV 1 и 6 способны легко проходить через него для эффективной доставки шаблона репарации ДНК. - Инкубировать при температуре 37 °C с содержаниемСО2 5% и максимальной влажностью в течение 18-20 ч, чтобы обеспечить достаточную вирусную трансдукцию.
2. Электропорационная подготовка
- На следующий день приготовьте электропорационную смесь, содержащую 100 нг/мкл sgРНК и 100 нг/мкл белка Cas9, разведенного в среде Opti-MEM в стерильной пробирке, свободной от РНКазы. Аккуратно перемешайте.
- Инкубируйте при комнатной температуре в течение 10 мин, чтобы обеспечить образование RNP.
- Во время инкубации включите электропоратор и подсоедините провода к стеклянному скользящему электроду с зазором 1,5 мм.
- Установите параметры электропорации, как описано в таблице 1.
3. Электропорация 2-клеточного эмбриона
- Осторожно надавите пипеткой 5 мкл электропорационной смеси CRISPR между двумя электродами на предметном стекле, стараясь не допустить попадания пузырьков воздуха в раствор.
- Извлеките эмбрион на 2-клеточной стадии из раствора AAV. Выровняйте 2-клеточные эмбрионы в смеси, не позволяя им касаться боковых сторон электродов. Это делается для того, чтобы избежать лизиса.
- Нажмите кнопку Ом , чтобы измерить импеданс. Убедитесь, что импеданс находится в диапазоне от 0,100 до 0,300 кОм. Объем реакции изменит импеданс (добавьте объем, чтобы уменьшить импеданс, и вычтите объем, чтобы увеличить импеданс).
- Нажмите кнопку Старт. Процесс занимает несколько секунд.
- Сразу после электропорации удалить эмбрионы и промыть 3 раза в свежих каплях по 30 мкл среды KSOM-R.
- Поместите эмбрионы обратно в инкубатор с температурой 37 °C с 5%CO2 и максимальной влажностью для культивирования in vitro в каплях 500 мкл среды KSOM-R под минеральным маслом. В качестве альтернативы хирургическим путем перенос эмбрионов ложнобеременной самке крысы через 1,5 дня после коитума (dpc) для получения живого потомства.
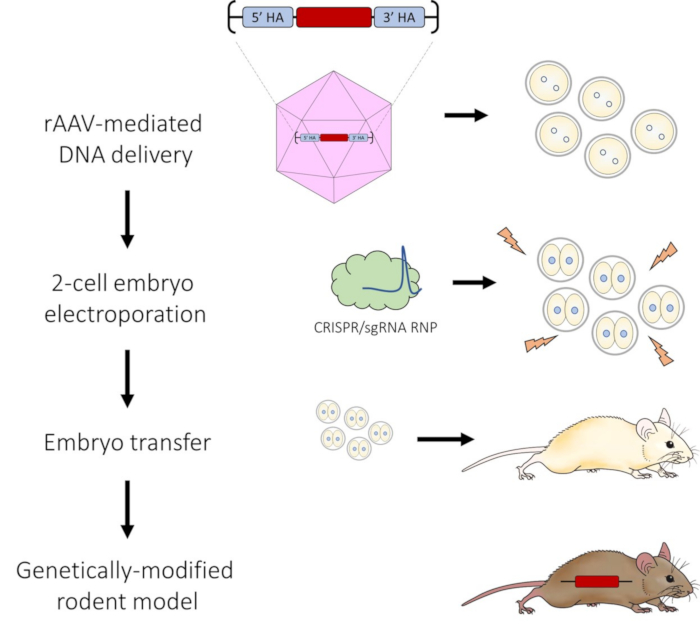
Рисунок 1: Схема AAV-опосредованной доставки ДНК и электропорации 2-клеточного эмбриона для редактирования генома CRISPR-Cas9. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
В соответствии с протоколом, существует эффективная AAV-опосредованная доставка матрицы репарации ДНК, позволяющая проводить высокоэффективную HDR после электропорации 2-клеточных эмбрионов с помощью CRISPR-Cas9 RNP. Как показано на видео, успешный процесс электропорации при...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Система редактирования генома CRISPR-Cas произвела революцию в области генной инженерии, позволив эффективно производить как простые, так и сложные, индивидуальные генетические модификации у различных видов животных. Частые уточнения и усовершенствования методов, связанных с редактиров?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликта интересов, о котором можно было бы заявлять.
Благодарности
Авторы благодарят Нолана Дэвиса за помощь в видеосъемке и монтаже видео.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Leads with alligator clips for electrodes | NepaGene | C117 | |
| Mineral oil | MilliporeSigma | M5310 | |
| NepaGene21 Super Electroporator | NepaGene | NEPA21 | |
| Platinum plate electrodes on slide glass | NepaGene | CUY501P1-1.5 | |
| PURedit Cas9 Protein | MilliporeSigma | PECAS9 | |
| sgRNA (chemically-modified) | Synthego | N/A | |
| ssAAV1 or ssAAV6 packaged DNA repair template | Vectorbuilder | N/A |
Ссылки
- Lau, C. H., Tin, C., Suh, Y. CRISPR-based strategies for targeted transgene knock-in and gene correction. Fac Rev. 9, 20(2020).
- Gutschner, T., Haemmerle, M., Genovese, G., Draetta, G. F., Chin, L. Post-translational Regulation of Cas9 during G1 Enhances Homology-Directed Repair. Cell Rep. 14 (6), 1555-1566 (2016).
- Zhang, J. P., et al. Efficient precise knockin with a double cut HDR donor after CRISPR/Cas9-mediated double-stranded DNA cleavage. Genome Biol. 18 (1), 35(2017).
- Miura, H., Quadros, R. M., Gurumurthy, C. B., Ohtsuka, M. Easi-CRISPR for creating knock-in and conditional knockout mouse models using long ssDNA donors. Nat Protoc. 13 (1), 195-215 (2018).
- Gu, B., Posfai, E., Gertsenstein, M., Rossant, J. Efficient generation of large-fragment knock-in mouse models using 2-cell (2C)-homologous recombination (HR)-CRISPR. Curr Protoc Mouse Biol. 10 (1), e67(2020).
- Gu, B., Posfai, E., Rossant, J. Efficient generation of targeted large insertions by microinjection into two-cell-stage mouse embryos. Nat Biotechnol. 36 (7), 632-637 (2018).
- Kurihara, T., et al. DNA repair protein RAD51 enhances the CRISPR/Cas9-mediated knock-in efficiency in brain neurons. Biochem Biophys Res Commun. 524 (3), 621-628 (2020).
- Kaneko, T., Sakuma, T., Yamamoto, T., Mashimo, T. Simple knockout by electroporation of engineered endonucleases into intact rat embryos. Sci Rep. 4, 6382(2014).
- Chen, S., Lee, B., Lee, A. Y., Modzelewski, A. J., He, L. Highly efficient mouse genome editing by CRISPR ribonucleoprotein electroporation of zygotes. J Biol Chem. 291 (28), 14457-14467 (2016).
- Hashimoto, M., Yamashita, Y., Takemoto, T. Electroporation of Cas9 protein/sgRNA into early pronuclear zygotes generates non-mosaic mutants in the mouse. Dev Biol. 418 (1), 1-9 (2016).
- Wang, W., et al. Delivery of Cas9 protein into mouse zygotes through a series of electroporation dramatically increases the efficiency of model creation. J Genet Genomics. 43 (5), 319-327 (2016).
- Troder, S. E., et al. An optimized electroporation approach for efficient CRISPR/Cas9 genome editing in murine zygotes. PLoS One. 13 (5), e0196891(2018).
- Teixeira, M., et al. Electroporation of mice zygotes with dual guide RNA/Cas9 complexes for simple and efficient cloning-free genome editing. Sci Rep. 8 (1), 474(2018).
- Tanihara, F., et al. Efficient generation of GGTA1-deficient pigs by electroporation of the CRISPR/Cas9 system into in vitro-fertilized zygotes. BMC Biotechnol. 20 (1), 40(2020).
- Tanihara, F., et al. Generation of CD163-edited pig via electroporation of the CRISPR/Cas9 system into porcine in vitro-fertilized zygotes. Anim Biotechnol. 32 (2), 147-154 (2021).
- Camargo, L. S. A., Owen, J. R., Van Eenennaam, A. L., Ross, P. J. Efficient one-step knockout by electroporation of ribonucleoproteins into zona-intact bovine embryos. Front Genet. 11, 570069(2020).
- Lin, J. C., Van Eenennaam, A. L. Electroporation-mediated genome editing of livestock zygotes. Front Genet. 12, 648482(2021).
- Betters, E., Charney, R. M., Garcia-Castro, M. I. Electroporation and in vitro culture of early rabbit embryos. Data Brief. 21, 316-320 (2018).
- Miyasaka, Y., et al. CLICK: one-step generation of conditional knockout mice. BMC Genomics. 19 (1), 318(2018).
- Epstein, B. E., Schaffer, D. V. Combining engineered nucleases with adeno-associated viral vectors for therapeutic gene editing. Adv Exp Med Biol. 1016, 29-42 (2017).
- Gaj, T., Epstein, B. E., Schaffer, D. V. Genome engineering using adeno-associated virus: basic and clinical research applications. Mol Ther. 24 (3), 458-464 (2016).
- Chen, S., et al. CRISPR-READI: Efficient generation of knockin mice by CRISPR RNP electroporation and AAV donor infection. Cell Rep. 27 (13), 3780-3789 (2019).
- Mizuno, N., et al. Intra-embryo gene cassette knockin by CRISPR/CAS9-mediated genome editing with adeno-associated viral vector. iScience. 9, 286-297 (2018).
- Davis, D. J., et al. Efficient DNA knock-in using AAV-mediated delivery with 2-cell embryo CRISPR-Cas9 electroporation. Front Genome Ed. 5, 1256451(2023).
- Smirnikhina, S. A., Zaynitdinova, M. I., Sergeeva, V. A., Lavrov, A. V. Improving homology-directed repair in genome editing experiments by influencing the cell cycle. Int J Mol Sci. 23 (11), (2022).
- Takata, M., et al. Homologous recombination and non-homologous end-joining pathways of DNA double-strand break repair have overlapping roles in the maintenance of chromosomal integrity in vertebrate cells. EMBO J. 17 (18), 5497-5508 (1998).
- Men, H., Stone, B. J., Bryda, E. C. Media optimization to promote rat embryonic development to the blastocyst stage in vitro. Theriogenology. 151, 81-85 (2020).
- Men, H., Amos-Landgraf, J. M., Bryda, E. C., Franklin, C. L. KSOM-R supports both mouse and rat preimplantation embryo development in vitro. Theriogenology. 198, 69-74 (2023).
- Romeo, C., et al. AAV diffuses across zona pellucida for effortless gene delivery to fertilized eggs. Biochem Biophys Res Commun. 526 (1), 85-90 (2020).
- Fulka, J., Moor, R. M., Fulka, J. Electrofusion of mammalian oocytes and embryonic cells. Methods Mol Biol. 48, 309-316 (1995).
- Rems, L., et al. Cell electrofusion using nanosecond electric pulses. Sci Rep. 3, 3382(2013).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены