Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Модель опухоли с дорсальной складкой кожи и оконной камерой для комбинированной прижизненной микроскопии и магнитно-резонансной томографии в исследованиях трансляционного рака
* Эти авторы внесли равный вклад
В этой статье
Резюме
Трансляция результатов прижизненной микроскопии затруднена из-за ее малой глубины проникновения в ткани. В данной работе мы описываем модель мыши с камерой дорсального окна, которая позволяет проводить совместную регистрацию прижизненной микроскопии и клинически применимых методов визуализации (например, КТ, МРТ) для прямой пространственной корреляции, потенциально оптимизируя клиническую трансляцию результатов прижизненной микроскопии.
Аннотация
Доклиническая прижизненная визуализация, такая как микроскопия и оптическая когерентная томография, оказалась ценным инструментом в исследованиях рака для визуализации микроокружения опухоли и ее реакции на терапию. Эти методы визуализации имеют разрешение в микронном масштабе, но имеют ограниченное применение в клинике из-за малой глубины проникновения в ткани. Более клинически применимые методы визуализации, такие как КТ, МРТ и ПЭТ, имеют гораздо большую глубину проникновения, но имеют сравнительно более низкое пространственное разрешение (миллиметровый масштаб).
Чтобы перенести результаты доклинической прижизненной визуализации в клинику, необходимо разработать новые методы для преодоления этого разрыва между микро- и макроразрешением . Здесь мы описываем мышиную модель опухоли с обратной складкой кожи и оконной камерой, предназначенную для обеспечения доклинической прижизненной и клинически применимой (КТ и МРТ) визуализации на одном и том же животном, а также платформу анализа изображений, которая связывает эти два несопоставимых метода визуализации. Важно отметить, что описанный подход с использованием оконной камеры позволяет совместно регистрировать различные модальности визуализации в 3D с использованием реперных маркеров на оконной камере для прямого пространственного согласования. Эта модель может быть использована для валидации существующих методов клинической визуализации, а также для разработки новых за счет прямой корреляции с «наземными» прижизненными результатами с высоким разрешением.
Наконец, реакция опухоли на различные методы лечения - химиотерапию, лучевую терапию, фотодинамическую терапию - может контролироваться в течение длительного времени с помощью этой методологии с использованием доклинических и клинически применимых методов визуализации. Таким образом, описанная здесь модель опухоли с тыльной складкой кожи и платформы визуализации могут быть использованы в различных исследованиях рака, например, для перевода результатов доклинической прижизненной микроскопии в более клинически применимые методы визуализации, такие как КТ или МРТ.
Введение
Опухолевое микроциркуляторное русло является важным компонентом опухолевого микроокружения, который может быть мишенью для терапии и определяющим фактором ответа на лечение. В доклинических условиях микроциркуляторное русло обычно изучают с помощью прижизненной микроскопии на животных в ортотопических или гетеротопических моделях оконной камеры 1,2. Это имеет ряд преимуществ по сравнению с гистологическими исследованиями, поскольку визуализация проводится в живых тканях, и опухоль может контролироваться в продольном режиме в течение нескольких недель или даже месяцев. Эти исследования могут использовать возможности прижизненной микроскопии с высоким разрешением для изучения доставки терапевтических препаратов к опухоли 4,5, причин резистентности к лечению6 и реакции микрососудов на такие методы лечения, как антиангиогенное лечение 7,8 и лучевая терапия 2,9.
Прижизненная микроскопия, безусловно, играет важную роль в доклинических исследованиях рака; Однако как измерить особенности микроокружения опухоли в клинике? Микрососудистая информация была бы полезна в клинике для измерения кровоснабжения и гипоксии опухолевых клеток, что важно для определения резистентности к лечению при лучевойтерапии10, а также способности микроциркуляторного русла доставлять химиотерапевтические агенты к окружающим опухолевым клеткам11. Например, при лучевой терапии пространственная информация о структуре и функции опухолевого микроциркуляторного русла может помочь персонализировать план лечения пациента за счет корректировки графика фракционирования или за счет преимущественного увеличения дозы до аваскулярных и, вероятно, гипоксических областей12.
Прижизненная микроскопия может измерить эти важные микрососудистые особенности, поскольку она имеет очень высокое разрешение (масштаб μм); Тем не менее, его глубина проникновения в ткани ограничена несколькими сотнями микрон или несколькими миллиметрами, что в лучшем случае затрудняет клиническое внедрение. Действительно, существуют некоторые новые применения прижизненной микроскопии в клинике13; Тем не менее, они по-прежнему ограничены исследованиями тканей приповерхностного уровня, таких как кожа14 или слизистая/эндотелиальная выстилка различных полостей тела с помощью гибких катетеров/эндоскопов15,16.
Чаще всего микроциркуляторное русло изучается с помощью методов визуализации, таких как КТ17 или МРТ18. Эти методы клинической визуализации могут получать изображения на любую глубину внутри тела, но они имеют гораздо более низкое пространственное разрешение (в масштабе мм). Таким образом, существует необходимость преодоления разрыва в разрешении между доклинической прижизненной микроскопией и методами клинической визуализации, чтобы обеспечить получениев клинике микрососудистой информации с высоким разрешением и подробной информацией. Было разработано несколько методов функциональной визуализации для улучшения возможностей микрососудистой визуализации в таких методах клинической визуализации, как МРТ и КТ20 с динамическим контрастированием (DCE) и МРТ21 с интравоксельным некогерентным движением (IVIM). Тем не менее, эти методы основаны на моделях, которые обеспечивают косвенные измерения микроциркуляторного русла и, таким образом, должны быть подтверждены соответствующими «достоверными» измерениями микроциркуляторного русла19,22.
Мы разработали модель опухолевой камеры задней складки кожи (DSFC) мыши, чтобы преодолеть этот разрыв между доклинической прижизненной микроскопией и клинически применимыми методами визуализации, такими как КТ и МРТ. DSFC обеспечивает прямой доступ к опухоли для прижизненной микроскопии с высоким разрешением через стеклянное окно, а также клинически применимую визуализацию, такую как МРТ, поскольку она изготовлена из материалов, совместимых с МРТ (пластик и стекло). Кроме того, включенный код MATLAB выполняет мультимодальную 3D-корегистрацию для прямых пространственных корреляций между доклинической прижизненной микроскопией и клинически применимыми методами визуализации. В этой статье мы опишем конструкцию и операцию по установке DSFC, а также процедуру совместной регистрации прижизненной микроскопии и клинически применимых методов визуализации.
протокол
Все процедуры на животных выполнялись в соответствии с Руководством по уходу и использованию экспериментальных животных, которое изложено Канадским советом по уходу за животными. Эксперименты проводились в соответствии с протоколом, утвержденным Комитетом по уходу за животными и их использованию Университетской сети здравоохранения в Торонто, Канада.
1. Ориентир на инокуляцию опухоли
ПРИМЕЧАНИЕ: «Ориентирование» относится к процессу маркировки кожи мыши для указания места, куда следует ввести опухолевые клетки для оптимизации размещения DSFC. Эту процедуру межевания следует сделать в тот же день или за 1 день до прививки. Иммунокомпрометированный НОД. Для этой работы использовалась мышь Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ (NRG).
- Обезболите мышь, используя 5% изофлуран для индукции и 2% изофлуран для поддержания (скорость потока кислорода установлена на 0,5 л/мин). Поддерживайте температуру тела, положив мышь на грелку, завернутую в автоклавный хирургический коврик.
- Подготовьте мышь к инокуляции опухолевых клеток путем бритья с последующим нанесением лечебного крема для эпиляции. Тщательно удалите крем для эпиляции через 30-60 с с помощью влажного стерилизованного бумажного полотенца. Наносите ветеринарную смазку для глаз для предотвращения сухости.
- Продезинфицируйте кожу спиртовым тампоном.
- Аккуратно расправьте тело мыши и приподнимите кожу вдоль корешка мыши. С помощью хирургического маркера нарисуйте одну точку с одной стороны мыши в центре тентовой кожи. Точка должна располагаться примерно в центре грудного отдела позвоночника мыши.
ПРИМЕЧАНИЕ: Это будет желаемое расположение опухоли.
2. Посев опухоли
ПРИМЕЧАНИЕ: В этом исследовании мы используем клеточную линию рака поджелудочной железы человека (BxPC3). Также могут быть использованы другие клеточные линии; Тем не менее, конкретные этапы культивирования клеток могут варьироваться в зависимости от клеточных линий. Обратитесь к инструкциям, прилагаемым к ячейкам, для внесения изменений в приведенную ниже процедуру.
- Выращивайте клетки за 2 недели до инокуляции с использованием полной питательной среды (среда Roswell Park Memorial Institute 1640 с 10% фетальной бычьей сыворотки и 1% пенициллина/стрептомицина) в колбе объемом 75 мл при 37 °C и 5%CO2. Убедитесь, что клетки поддерживаются в фазе экспоненциального роста.
ПРИМЕЧАНИЕ: Количество пассажей должно быть ограничено до 10-15 раз, а колба объемом 75 мл должна содержать около 6 миллионов клеток (~70% слияния) на момент инокуляции. - Отсадите среду и промойте клетки 5 мл фосфатно-солевого буфера (PBS) без кальция или магния.
- Добавьте 5 мл агента для диссоциации клеток и инкубируйте при 37 °C и 5%CO2 в течение 6-7 минут. Подтвердите отделение клеток с помощью микроскопа и добавьте 5 мл полной питательной среды.
ПРИМЕЧАНИЕ: Осторожное постукивание по боковой стороне колбы может помочь отсоединить ячейки. - Переложите суспензию в центрифужную пробирку объемом 15 мл и центрифугируйте при давлении 500 × г в течение 5 минут для гранулирования клеток. Аспирируйте среду и ресуспендируйте клетки в 5 мл полной питательной среды.
- Определите концентрацию клеток и общее количество клеток с помощью гемоцитометра.
- Центрифугируйте при 500 × г в течение 5 мин для гранулирования ячеек и аспирации среды.
- Основываясь на общем количестве клеток, полученном на шаге 2.5, добавьте соответствующее количество полной питательной среды, чтобы достичь концентрации,
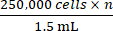 где n — общее количество мышей, подлежащих инокуляции. Повторно суспендируйте клетки.
где n — общее количество мышей, подлежащих инокуляции. Повторно суспендируйте клетки.
ПРИМЕЧАНИЕ: Целевое количество клеток, подлежащих инокуляции на одну мышь, составляет 250 000. - Перелейте 1,5 мл, содержащий 250 000 клеток × n, в микроцентрифужную пробирку объемом 1,5 мл. Центрифугируйте микроцентрифужную пробирку объемом 1,5 мл при давлении 500 × г в течение 5 минут и отаскуйте среду.
ПРИМЕЧАНИЕ: Любую избыточную суспензию клеток можно хранить в водяной бане, нагретой до 37 °C, чтобы при необходимости использовать ее для дополнительных прививок. - Ресуспендируйте клетки в 10 μл × n PBS. Поместите клетки на лед, чтобы охладить суспензию.
ПРИМЕЧАНИЕ: После того, как клетки были охлаждены на льду, их необходимо ввести мышке в течение 20 минут. - Добавьте 10 μL × n растворенной базальной мембраны с помощью охлажденных наконечников для пипеток. Загрузите охлажденные иглы инсулина 29-го калибра по 20 мкл каждой из клеточных суспензий. Держите шприцы на льду.
- Обезболите мышь, используя 5% изофлуран для индукции и 2% изофлуран для поддержания (скорость потока кислорода установлена на 0,5 л/мин).
- Поместите мышь на грелку, завернутую в стерилизованный хирургический коврик.
- Продезинфицируйте кожу в месте инъекции спиртовым тампоном.
- Введите иглу на ~1 см до точки ориентира и перемещайте иглу под кожу, пока она не окажется на ориентире. Расположите скошенную сторону иглы вверх и введите 20 мкл клеточной суспензии.
- Подождите 45 с, чтобы растворилизированная базальная мембрана затвердела, прежде чем извлекать шприц.
- Извлеките мышь из наркоза, подождите, пока мышь начнет передвигаться, и верните ее в клетку вместе с другими мышами.
- Ежедневно контролируйте опухоль путем пальпации и позволяйте опухоли расти в течение 4 недель или до тех пор, пока опухоль не достигнет 4-8 мм в диаметре. Усыпьте мышь при наличии любого из следующих условий: размер опухоли превышает 1,5 см, изъязвленная опухоль или любые признаки системного заболевания (вялость, потеря веса более 20% от нормальной массы тела, нарушение передвижения, неспособность регулировать температуру тела, анорексия, сгорбленная осанка, видимые признаки боли (мимика и т. д.) или обезвоживание).
3. Хирургия оконной камеры
ПРИМЕЧАНИЕ: DSFC состоит из четырех деталей, напечатанных на 3D-принтере, как показано на рисунке 1. Схемы каждой детали включены в Дополнительный файл 1. На всех деталях нанесена печать из биосовместимой прозрачной пластиковой смолы. Главный узел оконной камеры состоит из трех частей (Рисунок 1A-C) с дополнительным реперным маркерным кольцом (Рисунок 1D), которое может быть прикреплено во время МРТ или КТ.
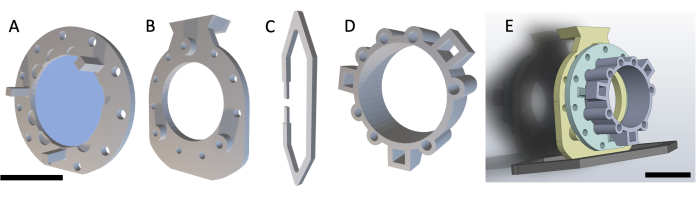
Рисунок 1: Схема спинной оконной камеры. Главная оконная камера состоит из трех частей. Во-первых, (A) передняя рамка пришивается под кожей мыши и содержит стеклянную покровную крышку, прикрепленную с помощью клея, отверждаемого ультрафиолетовым излучением. (B) Задняя рама пришивается к передней раме с внешней стороны обшивки. (C) Опорный зажим крепится к нижней части задней рамы и удерживает DSFC в вертикальном положении на корпусе мыши. (D) Реперное маркерное кольцо содержит семь «отверстий», куда могут быть вставлены реперные маркеры. Реперное габаритное кольцо может быть прикреплено к передней раме DSFC с помощью трех опорных стоек. (E) Показан полный узел DSFC с реперным маркерным кольцом. Масштабные линейки = 1 см (A-D, внизу слева; E). Аббревиатура: DSFC = спинная оконная камера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Введите 1 мг/кг 0,6 мг/мл бупренорфина с пролонгированным высвобождением подкожно за 1-3 ч до операции. Убедитесь, что размер и вес мыши достаточны для того, чтобы выдерживать DSFC без сужения грудной клетки.
- Стерилизуйте основные детали оконной камеры (рис. 1А-В) в жидком дезинфицирующем средстве высокого уровня в течение 12 мин с последующим замачиванием в изопропиловом спирте не менее чем на 5 мин.
- Обезболите мышь, используя 5% изофлуран для индукции и 2% изофлуран для поддержания (скорость потока кислорода установлена на 0,5 л/мин).
- Переложите мышь на стерильный хирургический коврик с грелкой под ним.
- Побрейте мышь и нанесите лечебный крем для эпиляции, если волосы присутствуют. Через 30-60 с удалите крем для эпиляции, используя стерильные влажные бумажные полотенца.
- Наносите ветеринарную смазку для глаз для предотвращения сухости. Наносите повторно каждые 30 минут или по мере необходимости на протяжении всей операции.
- Продезинфицируйте кожу, нанеся 7,5% повидон-йодный скраб и смов 70% изопропиловым спиртом. Дайте коже высохнуть на воздухе.
- Нанесите на кожу 10% раствор повидон-йода и дайте ей высохнуть на воздухе (рисунок 2А).
- Замените хирургический коврик на новый стерилизованный коврик.
- Убедитесь, что мышь достигла хирургической плоскости анестезии, зажав палец ноги.
- Поднимите кожу мыши вдоль позвоночника и ищите опухоль, растущую на одной из двух боковых складок кожи. Поместите заднюю рамку DSFC (рисунок 2B) на ту же сторону кожи, на которой растет опухоль, убедившись, что опухоль находится в центре кадра.
- Добавьте по три шва к каждому из трех верхних отверстий DSFC и хирургического шаблона, чтобы зафиксировать положение задней рамы (рис. 2B).
- Вставьте три иглы через заднюю раму DSFC в отверстия, содержащие прокладки (рис. 2B).
ПРИМЕЧАНИЕ: На задней раме DSFC есть три «прокладки» для поддержания зазора между передней и задней рамами, чтобы гарантировать, что кровоток не ограничивается тканями внутри DSFC. Распорки видны на рисунке 1B. - С помощью хирургического маркера отметьте шесть точек, в которых с обеих сторон кожи будут расположены прокладки задней рамы DSFC (точки 1-6 на рисунке 2C,D).
ПРИМЕЧАНИЕ: Вставленные иглы следует использовать в качестве ориентира для точного расположения этих точек. - Нарисуйте круг диаметром 1 см, чтобы обозначить кожу, которая будет снята на стороне, противоположной задней раме (рисунок 2D).
- Удалите иглы и заднюю рамку с кожи, разрезав швы.
- Вырежьте отверстие диаметром 1 см в коже, отмеченное на шаге 3.15, хирургическими микроножницами (рисунок 2E).
- Наложите временный шов, чтобы закрепить все части оконной камеры на коже. Введите шов через точку 4, через верхнее отверстие передней рамки DSFC, а затем через точку 1 на противоположной стороне мыши (рисунок 2F и шаги 1-2 на дополнительном рисунке S1).
- Проденьте шов через верхнюю опорную стойку задней рамы, а затем обратно через опорную стойку на задней раме, которая находится ближе всего к головке мыши (рисунок 2F).
- Введите шов через точку 2. Затем проденьте шов через соответствующее отверстие в передней раме (Рисунок 2G и шаг 3 на Дополнительном рисунке S1).
- С внутренней стороны кожи проденьте шов через точку 6, как показано на рисунке 2H , и выполните шаги 3-4 на дополнительном рисунке S1.
- Проденьте шов через точку 5, как показано на рисунке 2I , и шаг 4 на дополнительном рисунке S1.
- Проведите шов через переднюю раму, точку 3, а затем через заднюю раму, как показано на рисунке 2J и шаг 5 на дополнительном рисунке S1.
- Проведите шов обратно через точку 1, переднюю раму DSFC, а затем через точку 4, как показано на рисунке 2K и шаг 6 на дополнительном рисунке S1.
- Затяните всю сборку этим швом и проденьте переднюю раму под кожу через отверстие, созданное на шаге 3.17 (Рисунок 2L,M).
- Свяжите два конца этого шва вместе и обрежьте лишнюю веревку.
- Выполните постоянные швы через отверстия по периметру передней и задней рам DSFC. Сшите две рамы вместе, как показано на рисунке 2N и дополнительном рисунке S2.
- Разрежьте и снимите временный шов.
- Прикрепите опорный зажим к задней раме DSFC, вставив его в выступ из задней рамы (Рисунок 2O).
ПРИМЕЧАНИЕ: Изображение мыши через 2 недели после операции показано на рисунке 2P, Q. Поддерживающий зажим используется для удержания DSFC в вертикальном положении на мыши, чтобы уменьшить напряжение кожи и дискомфорт. - Введите 5 мг/кг массы тела мелоксикам, нестероидный противовоспалительный препарат, подкожно для уменьшения боли и воспаления.
- Извлеките мышь из наркоза, подождите, пока мышь станет амбулаторной, и верните ее в клетку.
- Проверяйте мышь через 2-3 ч после операции, а затем ежедневно в течение как минимум 1 недели. Учитывайте конечную точку, достигнутую через 2 месяца после операции в оконной камере, или если выполняются какие-либо из условий, описанных на шаге 2.17 (в зависимости от того, что произойдет раньше).
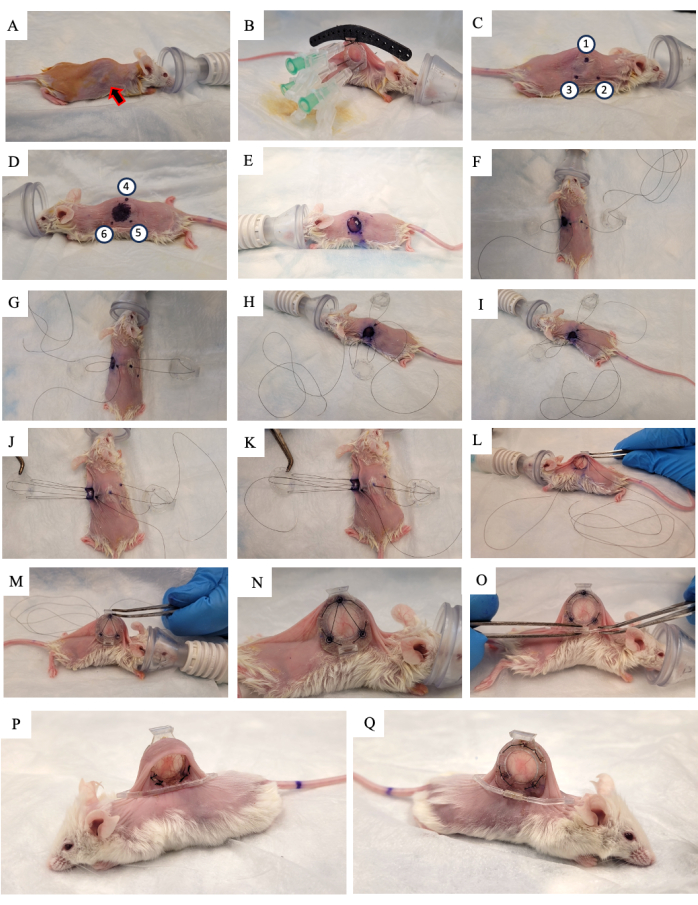
Рисунок 2: Хирургическая процедура DSFC. (A) Мышь подготавливается к операции путем удаления волос и дезинфекции кожи. Подкожная опухоль обозначается стрелкой. (B) Задняя рама устанавливается в соответствующее положение и фиксируется тремя шприцами, а также временными швами, прикрепленными к черному хирургическому шаблону. (К,Г) Места расположения распорок (точки 1-6) и отверстия отмечены с обеих сторон обшивки. (E) Кожица удаляется. (Ф-К) Временный шов продевается через два слоя кожи, переднюю и заднюю рамы DSFC для фиксации всех частей вместе. (Л,М) Временный шов затягивается, а передняя рама вставляется под кожу. (N) Восемь постоянных швов накладываются для фиксации DSFC. (O) Наконец, временный шов снимается, и прикрепляется поддерживающий зажим. (,К) Одна и та же мышь показана через 2 недели после операции с обеих сторон. Аббревиатура: DSFC = спинная оконная камера. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Оптическая визуализация
- Дайте мыши зажить и воспаление уменьшится в течение как минимум 5 дней после операции перед визуализацией.
- Обезболите мышь, используя 5% изофлуран для индукции и 2% изофлуран для поддержания (скорость потока кислорода установлена на 0,5 л/мин).
- Наносите ветеринарную смазку для глаз для предотвращения сухости. Наносите повторно каждые 30 минут или по мере необходимости.
- Закрепите мышь в сцене визуализации с помощью насадки для газовой анестезии, как показано на дополнительном рисунке S3.
- Получение светлопольного микроскопического изображения с широким полем зрения (>ширина 1,5 см). Убедитесь, что углубления реперного маркера на передней рамке DSFC видны.
ПРИМЕЧАНИЕ: По периметру стекла на передней раме имеется семь углублений, которые совпадают с семью ячейками реперных маркеров на креплении реперного маркерного кольца. Эти углубления видны на рисунке 1А. - В тот же день получите микрососудистое изображение с использованием метода прижизненной микроскопии по выбору. Для этого используйте тот же столик визуализации, что и на шаге 4.4 (дополнительный рисунок S3). Извлеките мышь из наркоза, подождите, пока мышь станет амбулаторной, и верните ее в клетку.
ПРИМЕЧАНИЕ: Мы используем спекл-вариационную оптическую когерентную томографию (svOCT) для получения 3D-изображений микрососудов с высоким разрешением.
5. Магнитно-резонансная томография
- Поместите клетку для мыши под тепловую лампу, чтобы согреть мышей примерно на 15 минут, прежде чем обезболить мышь.
ПРИМЕЧАНИЕ: Согревание способствует расширению сосудов, что способствует установке катетера в хвостовую вену. - Обезболите мышь, используя 5% изофлуран для индукции и 2% изофлуран для поддержания (скорость потока кислорода установлена на 0,5 л/мин).
- Запишите вес мыши с помощью электронных весов для правильного дозирования препарата.
ПРИМЕЧАНИЕ: Для точного измерения массы тела обязательно вычтите вес узла DSFC (0,83 г). - Поместите мышь на ложе для МРТ и нанесите ветеринарную смазку для глаз, чтобы предотвратить сухость.
- Поддерживайте температуру тела мыши с помощью водонагревателя и насосной системы.
- Поместите подушку для мониторинга дыхания под диафрагму мыши и поддерживайте скорость 30 ± 5 вдохов/мин.
- При использовании контрастного вещества введите иглу бабочки 27 г в хвостовую вену с прикрепленной микротрубкой (30 мкл мертвого объема предварительно заполнено 1% раствором герапина и физиологического раствора). Закрепите иглу и микротрубку на ложе для МРТ с помощью хирургической ленты.
- Закрепите оконную камеру с помощью напечатанного на 3D-принтере «иммобилизационного устройства», как показано на рисунке 3.
- С помощью иглы 18 G введите ветеринарную глазную смазку в семь трубок на реперном маркере МРТ.
- Прикрепите реперный маркер к DSFC, совместив три квадратных соединителя с тремя стойками, выступающими из передней рамы (рис. 3).
- Подсоедините катетер хвостовой вены к линии подачи лекарства и шприц к автоматическому насосу. Вставьте кровать в доклинический МРТ-сканер мощностью 7 Тесла.
- Получение корональных и аксиальных Т2-взвешенных (T2w) изображений для визуализации плоскости оконной камеры (время эха TE = 25 мс; время повторения TR = 2 500 мс; поле зрения 40 x 40 мм с матрицей 64 x 64 для разрешения в плоскости 0,5 x 0,5 мм; толщина среза 0,5 мм; 25 с). Прописать сагиттальный Т2-взвешенный набор (TE = 25 мс; TR = 2 500 мс; поле зрения 32 x 32 мм с матрицей 128 x 128 для разрешения в плоскости 0,25 x 0,25 мм; не менее 11 визуализирующих срезов; толщина среза 0,5 мм; 87 с), который затем поворачивается в плоскость DSFC и реперных маркеров на основе коронального и аксиального видов, как показано на рисунке 4. Итеративно переориентируйте и расположите сагиттальный набор до тех пор, пока срезы визуализации не будут полностью выровнены таким образом, чтобы срез 5 полностью содержал тканевый сигнал в DSFC, а срез 6 не содержал тканевый сигнал в DSFC.
- Выполните микрососудистую визуализацию с использованием выбранного метода микрососудистой МРТ.
ПРИМЕЧАНИЕ: Для получения микрососудистых МРТ срезы реперных маркеров не нуждаются в визуализации, поскольку изображения получены в той же системе отсчета, что и регистрационные изображения T2w.- Получите все данные, описанные в шагах 5.12 и 5.13, в поле зрения 32 x 32 мм с матрицей 64 x 64 с разрешением 0,5 x 0,5 мм в плоскости. Для всех исследований МРТ используйте согласованные РЧ-импульсы для улучшения геометрической согласованности в сквозной плоскости (возбуждение sinc; перефокусировка sinc3; полоса пропускания 2 484 Гц).
- Для визуализации DCE:
- Если требуется измерение концентрации гадолиния, получите карты T1 с использованием изображений 2D-RARE, полученных с переменным временем повторения (TE = 7 мс; РЕДКИЙ МНОЖИТЕЛЬ = 2; TR = 350, 500, 750, 1000, 1500, 2500 и 4000 мс; 8 мин 28 с).
- Выполнение визуализации временных рядов с использованием изображений 2D RARE (TE = 8,1 мс; РЕДКИЙ МНОЖИТЕЛЬ = 2; TR = 200 мс; угол откидывания = 90°; временное разрешение = 12,8 с; 188 повторений; общее время мониторинга = 40 мин 6 с).
- Введите гадобутрол в дозе 0,75 ммоль/кг массы тела в течение 10 с через хвостовую вену после завершения пяти повторений изображений с помощью автоматизированного МР-совместимого шприцевого насоса.
- Для МРТ IVIM:
- Выполнение диффузионно-взвешенной визуализации со следующими B-значениями: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1 000 с/мм2 с тремя средними значениями B = 0 с/мм2 и изотропной выборкой (TE = 16 мс; TR = 800 мс; длительность градиента = 2,2 мс; градиентное разделение = 9 мс; 61 мин).
ПРИМЕЧАНИЕ: Диффузионно-взвешенная визуализация получается с использованием 2D-преобразования Фурье, а не с подверженной искажениям эхо-планарной визуализации, чтобы обеспечить геометрическую согласованность сигналов опухоли и окружающих тканей в DSFC на всех наборах изображений и с изображениями прижизненной микроскопии.
- Выполнение диффузионно-взвешенной визуализации со следующими B-значениями: 0, 20, 40, 60, 80, 100, 150, 200, 400, 600, 800, 1 000 с/мм2 с тремя средними значениями B = 0 с/мм2 и изотропной выборкой (TE = 16 мс; TR = 800 мс; длительность градиента = 2,2 мс; градиентное разделение = 9 мс; 61 мин).
- Извлеките мышь из наркоза, подождите, пока мышь станет амбулаторной, и верните ее в клетку.
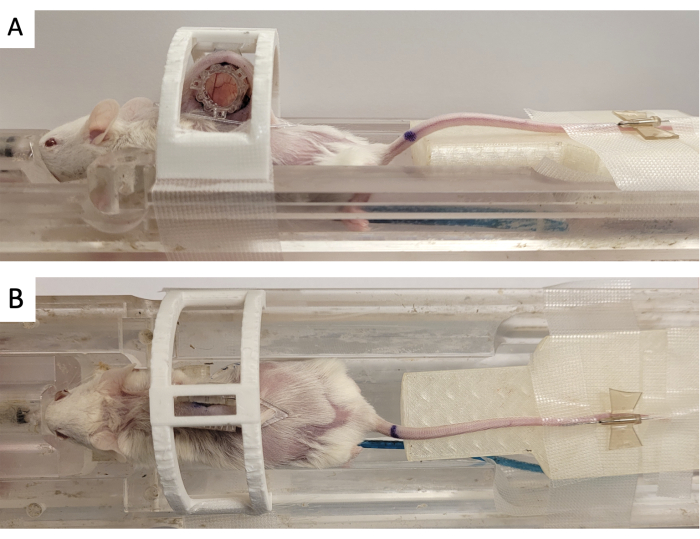
Рисунок 3: Установка для МРТ-визуализации DSFC. (A) Вид сбоку и (B) сверху мыши на ложе для МРТ с закрепленным и обездвиженным DSFC. Мышь имеет катетер в хвостовой вене для введения контрастного вещества, а реперное кольцо прикреплено к передней раме DSFC. Сокращения: DSFC = спинная оконная камера; МРТ = магнитно-резонансная томография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
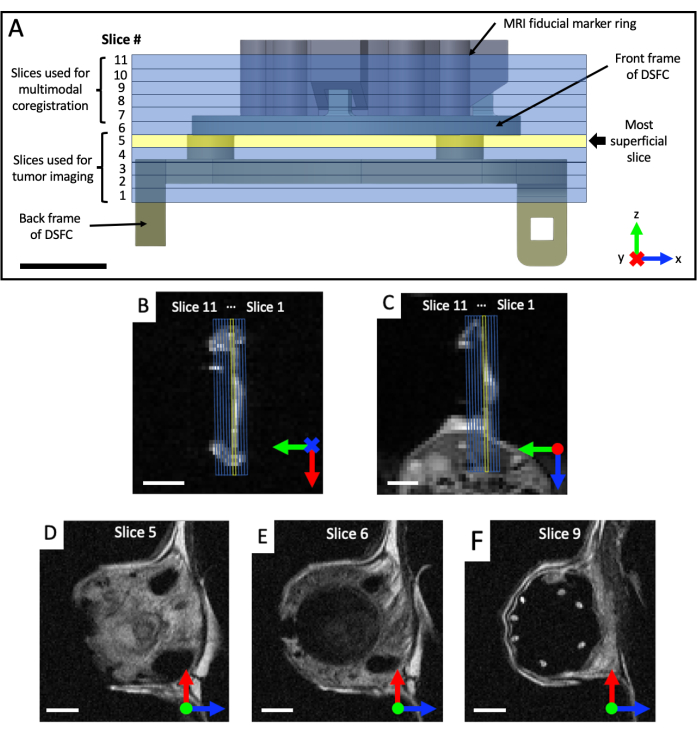
Рисунок 4: Расположение срезов МРТ относительно реперных маркеров и оконной камеры. (A) Схема DSFC с прикреплением кольца реперных маркеров с 11 наложенными срезами МРТ. Необходимо получить несколько Т2-взвешенных изображений, чтобы убедиться, что срезы правильно выровнены с DSFC и тканью. (В,В) Правильное позиционирование 11 срезов по отношению к ткани в DSFC с разных ориентаций. (D) Срез 5 является наиболее поверхностным срезом, на котором будет проводиться анализ корреляции интермодальности. (E) Срез 6 не содержит сигнала ткани, указывающего на то, что он правильно выровнен с DSFC. (F) Наконец, 7 реперных знаков четко видны в срезе 9. Масштабные линейки = 5 мм. Буква «X» на оси указывает на то, что ось уходит внутрь страницы, а круг указывает на то, что ось выходит за пределы страницы. Сокращения: DSFC = спинная оконная камера; МРТ = магнитно-резонансная томография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
6. Совместная регистрация МРТ с прижизненной микроскопией
- В MATLAB откройте файл Multimodal_Image_Register.m, содержащийся в Дополнительном файле 2.
- В рабочую область загрузите микрососудистое изображение (рисунок 5A), изображение светлопольной микроскопии (рисунок 5B) и данные микрососудистой МРТ (карты параметров IVIM и/или DCE MRI).
- Нажмите кнопку «Выполнить ».
- С помощью всплывающего средства поиска файлов перейдите к файлу, содержащему срезы МРТ T2w.
- Выберите до четырех срезов МРТ T2w, на которых четко отображаются реперные маркеры (рис. 5C).
- Будет отображен пользовательский интерфейс, показывающий микроскопическое изображение (Рисунок 5B) и усредненные по глубине срезы МРТ T2w (Рисунок 5C). Поместите точку на каждый из семи реперных маркеров на изображении МРТ и сопоставьте их с соответствующей точкой на микроскопическом изображении (реперные знаки углубляются по периметру стекла на передней раме DSFC), как показано зелеными точками на рисунке 5B, C.
- Закройте окно.
- Рисунок, содержащий наложенные изображения МРТ и микроскопии, поможет оценить качество регистрации между двумя наборами данных. Если регистрация адекватна, продолжайте код, набрав y, затем нажмите enter в командном окне. В противном случае повторите этот шаг, введя n в командном окне и нажав Enter.
ПРИМЕЧАНИЕ: Успешная совмещение набора данных МРТ с микроскопическим изображением означает, что семь ярких реперных маркеров из набора данных МРТ центрированы и полностью содержатся в соответствующих углублениях на передней рамке DSFC. - Будет отображен пользовательский интерфейс, показывающий микроскопическое изображение (рисунок 5B) и набор данных микрососудистой визуализации svOCT (рисунок 5A). Выберите не менее трех микрососудистых ориентиров на микрососудистом изображении svOCT и соответствующие точки на микроскопическом изображении, как показано синими точками на рисунке 5A, B.
- Закройте окно.
- Рисунок, содержащий наложенные изображения svOCT и микроскопии, поможет оценить качество совместной регистрации между двумя наборами данных. Если регистрация адекватна, продолжайте код, набрав y, затем нажмите enter в командном окне. В противном случае повторите этот шаг, введя n в командном окне и нажав Enter.
ПРИМЕЧАНИЕ: Успешная совмещение набора данных svOCT с микроскопическим изображением означает, что сосуды из обоих наборов данных идеально накладываются друг на друга. - Закройте окно.
- После этого появится совместно зарегистрированное микроскопическое изображение. Контурируйте опухоль на этом изображении.
- Закройте окно.
- Затем будут отображены несколько рисунков: набор микрососудистых данных svOCT (рисунок 5D), совместное микроскопическое изображение (рисунок 5E) и совместно зарегистрированные карты параметров МРТ (рисунок 5F). Сохраните карты для последующего анализа.
ПРИМЕЧАНИЕ: Отображаемые карты МРТ ограничены контуром опухоли, нарисованным пользователем (Рисунок 5F).
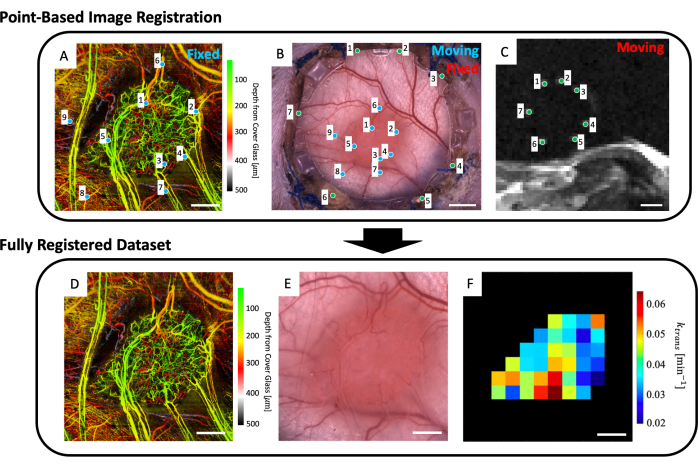
Рисунок 5: Мультимодальная точечная корегистрация. (A) Набор данных микрососудистых svOCT с цветовой глубиной; масштабная линейка = 1 мм. (B) Светлопольное микроскопическое изображение оконной камеры; масштабная линейка = 2 мм. (C) Среднее значение срезов МРТ T2w 8-11, показывающих семь реперных маркеров, содержащихся в реперном маркерном кольце; масштабная линейка = 5 мм. (C) Во-первых, «движущийся» набор данных МРТ T2w регистрируется совместно с «фиксированным» изображением светлопольной микроскопии с использованием введенных пользователем зеленых маркеров на обоих наборах изображений. Затем «движущееся» изображение светлопольной микроскопии и совместное зарегистрированное изображение МРТ регистрируются в «фиксированном наборе данных svOCT» с использованием синих маркеров в точках А и В. Окончательный совместно зарегистрированный набор данных включает в себя (D) svOCT, (E) изображение светлопольной микроскопии и (F) функциональную карту параметров МРТ. Черные воксели в F находятся вне опухоли и поэтому не учитываются при анализе. Для D-F масштабная линейка = 1 мм. Сокращения: svOCT = спекл-дисперсионная оптическая когерентная томография; МРТ = магнитно-резонансная томография. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Спекл-вариансная оптическая когерентная томография (svOCT) была выполнена для получения 3D-изображений микрососудов с большим полем зрения (6 x 6 мм,2 боковых x 1 мм). Для получения этих изображений использовали ранее описанную систему ОКТ со свип-источником на основе квадратурного инте...
Обсуждение
В этой работе мы разработали рабочий процесс для выполнения как прижизненной микроскопии, так и клинически применимой визуализации (КТ, МРТ и ПЭТ) на одном и том же животном. Это было сделано с целью переноса результатов доклинической микроскопии в клинику путем прямой корреляции прижи...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы благодарим доктора Карлу Кальсаду (постдокторанта, Онкологический центр принцессы Маргарет) и доктора Тимоти Сэмюэля (аспиранта, Онкологический центр принцессы Маргарет) за помощь в культивировании опухолевых клеток и разработке протокола вакцинации. Д-р Кэтлин Ма, д-р Анна Петрашек и д-р Алисса Гольдштейн (Центр исследований животных, Онкологический центр принцессы Маргарет) помогли с разработкой протокола операции. Джейкоб Броске (технолог медицинской техники, Онкологический центр принцессы Маргарет) и Уэйн Келлер (руководитель по работе с клиентами оборудования, Javelin Technologies – компания группы TriMech) напечатали оконные камеры на 3D-принтере. Джеймс Джонкман (James Jonkman) (Advanced Optical Microscopy Facility, University Health Network) предоставил ценные рекомендации по получению изображений в светлопольной и флуоресцентной микроскопии.
Материалы
| Name | Company | Catalog Number | Comments |
| Cell Culture Materials | |||
| BxPC-3 Human Pancreatic Cancer Cells | ATCC (American Type Culture Collection) | CRL-1687 | |
| Corning Matrigel Basement Membrane Matrix, LDEV-free, 10 mL | Corning | 354234 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 07-202-350 | |
| Dulbecco Phospphate buffered saline without Calcium, Magnesium, or phenol red, 500 mL | Gibco | 14190144 | |
| Fetal Bovine Serum (Canada), 500 mL | Sigma-Aldrich | F1051-500ML | |
| Penicillin-Streptomycin 100x (liquid,stabilized, sterile-filtered, cell culture tested) | Sigma-Aldrich | P4333-100ML | |
| RPMI Medium 1640 (1x), liquid; with L-Glutamine, 500 mL | Gibco | 11875093 | |
| TrypLE Express Enzyme, 500 mL | Gibco | 12605028 | |
| Window Chamber Materials | |||
| 12 mm Glass Coverslip | Harvard Apparatus | CS-12R No. 1.5 | |
| Connex 500 3D Printer | Stratasys | N/A | |
| Biocompatible clear MED610 resin | Stratasys | RGD810 | |
| Loctite AA 3105 UV curable glue | Loctite | LCT1214249 | |
| Window chamber back frame | Trimech Inc | N/A | |
| Window chamber fiducial marker | Trimech Inc | N/A | |
| Window Chamber front frame | Trimech Inc | N/A | |
| Window chamber support clip | Trimech Inc | N/A | |
| inoculation and Surgery Materials | |||
| BD SafetyGlide Insulin Syringes with Permanently Attached Needles, 0.5 mL, 29 G x 1/2" | BD | CABD305932 | |
| Betadine Solution | Betadine | AP-B002C2R98U | |
| Cidex OPA 14 Day Solution 3.8 L | ASP | JOH20394 | |
| Disposable Surgical Underpads 23 inch x 24 inch | Kendall | 7134 | |
| Eye lubricant | Optixcare | 50-218-8442 | |
| Hair removal cream | Nair | 061700222611 | |
| Halstead Hemostatic Forceps | Almedic | 7742-A12-150 | |
| Heating pad | Sunbeam | B086MCN59R | |
| Iris Scissors | Almedic | 7601-A8-690 | |
| Isoflurane | Sigma | 792632 | |
| Metacam | Boehringer Ingelheim Animal Health USA Inc | NDC 0010-6015-03 | |
| NOD.Cg-Rag1tm1Mom Il2rgtm1Wjl/SzJ mouse | the Jackson laboratory | 7799 | |
| Peanut Clipper & Trimmer | Wahl | 8655-200 | |
| SOFSILK Nonabsorbable Surgical Suture #5-0 with 3/8" Taper point needle (17 mm) (Wax Coated,Braided Black Silk, Sterile) | Syneture | VS880 | |
| Splinter Forceps | Almedic | 7725-A10-634 | |
| MR Imaging | |||
| 3D printed window chamber immobilization device. | custom 3D printed, refer to figure 3 for details. | ||
| Convection heating device | 3M Bair Hugger | 70200791401 | |
| Drug injection system | Harvard Apparatus | PY2 70-2131 | PHD 22/2200 MRI compatible Syringe Pump |
| Gadovist 1.0 | Bayer | 2241089 | |
| Respiratory monitoring system | SAII | Model 1030 | MR-compatible monitoring and gating system for small animals. |
| Tail vein catheter (27 G 0.5" ) | Terumo Medical Corp | 15253 | |
| Optical Imaging | |||
| 3D printed imaging stage | Custom 3D printed, refer to supplementary figure 3 for details. | ||
| 12 V 7 W Flexible Polyimide Heater Plate Thin Adhesive PI Heating Film 25 mm x 50 mm | BANRIA | B09X16XCVS | Heating element used for mouse body temeprature regulation. |
| DC power supply | BK Precission | 1761 | Used to power the heating element. |
| Leica MZ FLIII | Leica Microsystems | 15209 | |
| svOCT imaging system | In-house made imaging system. Details can be found in reference 23. | ||
| Software | |||
| MATLAB Software | MathWorks | R2020A |
Ссылки
- Fukumura, D., Duda, D. G., Munn, L. L., Jain, R. K. Tumor microvasculature and microenvironment: Novel insights through intravital imaging in pre-clinical models. Microcirculation. 17 (3), 206-225 (2010).
- Demidov, V., et al. Preclinical longitudinal imaging of tumor microvascular radiobiological response with functional optical coherence tomography. Sci Rep. 8 (1), 38 (2018).
- Alieva, M., Ritsma, L., Giedt, R. J., Weissleder, R., van Rheenen, J. Imaging windows for long-term intravital imaging. IntraVital. 3 (2), e29917 (2014).
- Dreher, M. R., et al. Tumor vascular permeability, accumulation, and penetration of macromolecular drug carriers. J Natl Cancer Inst. 98 (5), 335-344 (2006).
- Momiyama, M., et al. Subcellular real-time imaging of the efficacy of temozolomide on cancer cells in the brain of live mice. Anticancer Res. 33 (1), 103-106 (2013).
- Dadgar, S., Rajaram, N. Optical imaging approaches to investigating radiation resistance. Front Oncol. 9, 1152 (2019).
- Fukumura, D., Jain, R. K. Tumor microvasculature and microenvironment: Targets for anti-angiogenesis and normalization. Microvasc Res. 74 (2-3), 72-84 (2007).
- Dirkx, A. E. M., et al. Anti-angiogenesis therapy can overcome endothelial cell anergy and promote leukocyte-endothelium interactions and infiltration in tumors. FASEB J. 20 (6), 621-630 (2006).
- Allam, N., et al. Longitudinal in-vivo quantification of tumour microvascular heterogeneity by optical coherence angiography in pre-clinical radiation therapy. Sci Rep. 12, 6140 (2022).
- Stadlbauer, A., et al. Tissue hypoxia and alterations in microvascular architecture predict glioblastoma recurrence in humans. Clin Cancer Res. 27 (6), 1641-1649 (2021).
- Danquah, M. K., Zhang, X. A., Mahato, R. I. Extravasation of polymeric nanomedicines across tumor vasculature. Adv Drug Deliv Rev. 63 (8), 623-639 (2011).
- Bentzen, S. M., Gregoire, V. Molecular imaging-based dose painting: a novel paradigm for radiation therapy prescription. Semin Radiat Oncol. 21 (2), 101-110 (2011).
- Gabriel, E. M., Fisher, D. T., Evans, S., Takabe, K., Skitzki, J. J. Intravital microscopy in the study of the tumor microenvironment: from bench to human application. Oncotarget. 9 (28), 20165-20178 (2018).
- Demidov, V., et al. Preclinical quantitative in-vivo assessment of skin tissue vascularity in radiation-induced fibrosis with optical coherence tomography. J Biomed Opt. 23 (10), 1-9 (2018).
- Wallace, M. B., et al. The safety of intravenous fluorescein for confocal laser endomicroscopy in the gastrointestinal tract. Aliment Pharmacol Ther. 31 (5), 548-552 (2010).
- Standish, B. A., et al. In vivo endoscopic multi-beam optical coherence tomography. Phys Med Biol. 55 (3), 615-622 (2010).
- Wang, J. H., et al. Dynamic CT evaluation of tumor vascularity in renal cell carcinoma. AJR Am J Roentgenol. 186 (5), 1423-1430 (2006).
- Tropres, I., et al. Imaging the microvessel caliber and density: Principles and applications of microvascular MRI. Magn Reson Med. 73 (1), 325-341 (2014).
- McDonald, D. M., Choyke, P. L. Imaging of angiogenesis: from microscope to clinic. Nat Med. 9, 713-725 (2003).
- O'Connor, J. P. B., et al. Dynamic contrast-enhanced imaging techniques: CT and MRI. Brit J Radiol. 84, S112-S120 (2011).
- Lima, M., Le Bihan, D. Clinical intravoxel incoherent motion and diffusion MR imaging: past, present, and future. Radiology. 278 (1), 13-32 (2015).
- Zabel, W. J., et al. Bridging the macro to micro resolution gap with angiographic optical coherence tomography and dynamic contrast enhanced MRI. Sci Rep. 12 (1), 3159 (2022).
- Mao, Y., Flueraru, C., Chang, S., Popescu, D. P., Sowa, M. G. High-quality tissue imaging using a catheter-based swept-source optical coherence tomography systems with an integrated semiconductor optical amplifier. IEEE Trans Instrum Meas. 60 (10), 3376-3383 (2011).
- Mariampillai, A., et al. Optimized speckle variance OCT imaging of microvasculature. Opt Lett. 35 (8), 1257-1259 (2010).
- Tofts, P. S., et al. Estimating kinetic parameters from dynamic contrast-enhanced T1-weighted MRI of a diffusible tracer: standardized quantities and symbols. J Magn Res Imaging. 10 (3), 223-232 (1999).
- Khalifa, F., et al. Models and methods for analyzing DCE-MRI: a review. Med Phys. 41 (12), 124301 (2014).
- Reitan, N. K., Thuen, M., Goa, P. E., de Lange Davies, C. Characterization of tumor microvascular structure and permeability: comparison between magnetic resonance imaging and intravital confocal imaging. J Biomed Opt. 15 (3), 036004 (2010).
- Dhani, N. C., et al. Analysis of the intra- and intertumoral heterogeneity of hypoxia in pancreatic cancer patients receiving the nitroimidazole tracer pimonidazole. Br J Cancer. 113 (6), 864-871 (2015).
- Gaustad, J. V., Brurberg, K. G., Simonsen, T. G., Mollatt, C. S., Rofstad, E. K. Tumor vascularity assessed by magnetic resonance imaging and intravital microscopy imaging. Neoplasia. 10 (4), 354-362 (2008).
- Rouffiac, V., et al. Multimodal imaging for tumour characterization from micro to macroscopic level using a newly developed dorsal chamber designed for long-term follow-up. J Biophotonics. 13 (1), 201900217 (2020).
- Leung, H. M., Schafer, R., Pagel, M. M., Robey, I. F., Gmitro, A. F. Multimodality pH imaging in a mouse dorsal skin fold window chamber model. Proc SPIE Int Soc Opt Eng. 8574, 85740L (2013).
- Erten, A., et al. Magnetic resonance and fluorescence imaging of doxorubicin-loaded nanoparticles using a novel in vivo model. Nanomed. 6 (6), 797-807 (2010).
- Maeda, A., DaCosta, R. S. Optimization of the dorsal skinfold window chamber model and multi-parametric characterization of tumor-associated vasculature. Intravital. 3 (1), e27935 (2014).
- Allam, N., Taylor, E., Vitkin, I. A. Low-cost 3D-printed tools towards robust longitudinal multi-modal pre-clinical imaging. bioRxiv. , (2023).
- Alexander, S., Weigelin, B., Winkler, F., Friedl, P. Preclinical intravital microscopy of the tumour-stroma interface: invasion, metastasis, and therapy response. Curr Opin Cell Biol. 25 (5), 659-671 (2013).
- Steven, A. J., Zhuo, J., Melhem, E. R. Diffusion kurtosis imaging: an emerging technique for evaluating the microstructural environment of the brain.Am. J Roentgenol. 202 (1), W26-W33 (2014).
- Mayer, P., et al. Diffusion kurtosis imaging-a superior approach to assess tumor-stroma ratio in pancreatic ductal adenocarcinoma. Cancers (Basel). 12 (6), 1656 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены