Method Article
Создание срезов ткани поджелудочной железы человека для изучения эндокринной и экзокринной физиологии поджелудочной железы
В этой статье
Резюме
Этот протокол описывает, как получить срезы поджелудочной железы человека от умерших доноров органов для изучения функции клеток в условиях, близких к физиологическим. Этот инновационный подход позволяет исследовать нормальные и структурно поврежденные островки и сложное взаимодействие между эндокринными и экзокринными компартментами.
Аннотация
Крайне важно изучить поджелудочную железу человека, чтобы понять патофизиологические механизмы, связанные с диабетом 1 типа (СД1) и диабетом 2 типа (СД2), а также эндокринную и экзокринную физиологию и взаимодействие поджелудочной железы. Многое было изучено из изучения изолированных островков поджелудочной железы, но это не позволяет исследовать их функции и взаимодействия в контексте всей ткани. Срезы поджелудочной железы предоставляют уникальную возможность исследовать физиологию нормальных, воспаленных и структурно поврежденных островков в их естественной среде, что, в свою очередь, позволяет изучать взаимодействия между эндокринными и экзокринными компартментами для лучшего изучения сложной динамики ткани поджелудочной железы. Таким образом, внедрение платформы для срезов живой поджелудочной железы представляет собой значительный прогресс в этой области. В этом протоколе описывается, как получить срезы живых тканей от умерших доноров органов путем встраивания тканей в агарозный и вибратомный срез, а также их использование для оценки функциональных показаний, таких как динамическая секреция и визуализация живых клеток.
Введение
Исследования физиологии островков имеют основополагающее значение для понимания патогенеза диабета и разработки новых терапевтических подходов. До сих пор исследования полагались на изолированные островки, которые подвергают островки механическим и ферментативным стрессам, вероятно, вызывая изменения в физиологии клеток; Кроме того, невозможно оценить функцию островков в контексте их естественной тканевой среды, на которую, вероятно, влияют экзокринные и сосудистые клетки, среди прочего1. При изучении поджелудочной железы доноров с СД1 существует проблема, заключающаяся в том, что их островки трудно изолировать и они могут быть фрагментированы во время изоляции, что может вызвать эффект отбора на островках, которые могут не представлять популяцию in vivo2. Кроме того, островки будут отделены от своей сложной среды и клеточных связей, особенно от проникающих иммунных клеток, которые находятся в воспаленных островках и более многочисленны на периферии островков. Таким образом, хотя изолированные островки являются краеугольным камнем в исследованиях диабета, существуют ограничения. В ответ на это мы представляем новаторский протокол для создания живых срезов поджелудочной железы, предлагая решение этих проблем.
Недавняя разработка и внедрение методов среза ткани поджелудочной железы считается прорывом в нашей способности исследовать сложную биологию и функции поджелудочной железы. Эта инновация открыла новые возможности для динамических исследований физиологии островков и взаимодействия между эндокринными, экзокринными, нервными, сосудистыми и иммунными клетками в их естественном анатомическом контексте. В отличие от традиционных подходов, эта установка in vitro сохраняет большую часть цитоархитектуры органа, что позволяет более близко приблизиться к его родной биологии. Первоначально разработанный на мышах Спейером и Рупником в 2003г.3, этот метод продемонстрировал свою полезность для оценки визуализации кальция, электрофизиологии и секреции гормонов как для внутриклеточной, так и для межклеточной передачи сигналов 4,5,6,7,8,9. Затем платформу для среза поджелудочной железы применяли для исследования ткани поджелудочной железы человека, полученной с помощью хирургической биопсии 4,10,11,12. Наша группа продемонстрировала возможность получения и использования срезов поджелудочной железы от трупных доноров органов в рамках деятельности Сети доноров органов поджелудочной железы с диабетом (nPOD)13. nPOD предоставляет ткани поджелудочной железы утвержденным исследователям, проводящим исследования диабета 1 типа у человека, и с момента внедрения платформы для срезов поджелудочной железы nPOD регулярно генерирует и распределяет живые срезы поджелудочной железы 14,15,16,17. С момента внедрения платформы для срезов поджелудочной железы в 2020 году nPOD успешно распределил срезы тканей от 43 доноров (в том числе 12 доноров с СД1) многочисленным исследователям. Используя эти срезы, исследователи провели новаторские исследования критических аспектов функции островков и изучили взаимодействие между островками и сосудистой сетью, нервной системой и иммунными клетками в контексте диабета 1 типа 13,18,19,20,21,22,23,24. Многочисленные исследования подчеркнули ограничения традиционных подходов и подчеркнули важность методов, которые могут фиксировать динамическое взаимодействие в поджелудочной железе 25,26,27. Адаптивность методов среза от мыши до поджелудочной железы человека в сочетании с их интеграцией в такие программы, как Сеть доноров органов поджелудочной железы с диабетом (nPOD), иллюстрирует растущее признание потенциала метода для раскрытия ценных сведений о таких заболеваниях, как диабет 1 типа.
протокол
Срезы поджелудочной железы человека от доноров тканей обоих полов были получены через банк тканей Сети доноров органов поджелудочной железы с диабетом (nPOD) Университета Флориды. Ткани органов умерших людей без идентификаторов были определены как нечеловеческие субъекты, исследуемые в соответствии с законами и нормативными актами о донорстве органов, и классифицированы как нечеловеческие субъекты Институциональным наблюдательным советом Университета Флориды (IRB; IRB No 392-2008), отказавшись от необходимости получения согласия. Ткани nPOD, специально используемые для этого проекта, были одобрены IRB Университета Флориды как нечеловеческие (IRB20140093).
ПРИМЕЧАНИЕ: Для читателей, совершенно не знакомых с методом среза и его приложениями, такими как перифузия и визуализация кальция, может быть целесообразно получить практический опыт и развить базовые навыки с использованием срезов 3,28 мыши или крысы, прежде чем работать с человеческими образцами.
1. Подготовка
ПРИМЕЧАНИЕ: Эти препараты должны быть выполнены до прибытия ткани.
- Приготовьте буфер HEPES, смешав 125 мМ NaCl, 5,9 мМ KCl, 2,56 мМ CaCl2, 1 мМ MgCl2, 25 мМ HEPES, 0,1% BSA, 2 мМ L-аланин, L-аргинин и L-глутамин. Отрегулируйте pH до 7,4 и простерилизуйте фильтром.
- Добавьте глюкозу и/или другие стимулы в буфер для приготовления растворов для эксперимента по перифузии. В качестве исходного буфера добавьте 5,5 мМ глюкозы. Этот буфер будет использоваться для процедур нарезки, сбора срезов и перифузионных препаратов.
- Подготовьте как минимум две чашки для сбора ломтиков, добавив апротинин (10 мкг/мл) в исходный буфер.
- Приготовьте 3,8 % раствор агарозы с низкой температурой плавления в буфере HEPES без БСА и аминокислот (125 мМ NaCl, 5,9 мМ KCl, 2,56 мМ CaCl2, 1 мМ MgCl2, 25 мМ HEPES) и поддерживайте его при температуре 37 °C.
- Соберите вибратом, поместив в держатель свежее лезвие. Если применимо, установите угол лезвия на 15° (при использовании Leica VT1200S). Если применимо, откалибруйте вибратом.
- Включите перифузионную машину, выберите количество камер и запрограммируйте протокол.
- Поместите все необходимые растворы в перифузионную машину, заправьте систему и держите растворы горячими. Машина рассчитывает необходимые объемы каждого раствора, используемого для протокола.
2. Обработка тканей
ПРИМЕЧАНИЕ: Срезы должны быть сгенерированы сразу после получения. Любое промедление может вызвать трудности в процедуре и привести к деградации тканей.
- Поместите ткань поджелудочной железы в чашку с базовым буфером под стереомикроскопом (рисунок 1A). Аккуратно удалите соединительные, фиброзные и жировые ткани с помощью щипцов и ножниц.
- Разрежьте ткань на несколько небольших кусочков размером примерно 0,5см3 (рисунок 1B) с помощью ножниц или скальпеля. Промокните сухие кусочки поджелудочной железы на папиросной бумаге.
- Переложите 4 кусочка в чашку Петри диаметром 35 мм и наполните чашку раствором агарозы до полного погружения. Дайте агарозе полностью застыть.
- Аккуратно вырежьте кусочки из агарозы. Проведите скальпелем по краю посуды, чтобы удалить агарозу и аккуратно отделить блоки ткани. Убедитесь, что кусочки окружены тонким слоем агарозы.
3. Нарезка
- Приклейте кусочки ткани на металлическую пластину вибратома, положив их вверх дном.
- Установите планшет в лоток и заполните лоток базовым буфером (HEPES, содержащим 5,5 мМ базового уровня глюкозы).
- Установите вибратом на автоматическую нарезку на 120 μм и отрегулируйте начальное и конечное положение.
- Переместите лезвие немного выше ткани и начните нарезать с низкой скоростью (0,1 мм/с) и амплитудой 0,8 мм. Скорость может быть увеличена, если позволяет ткань (Рисунок 1C).
- Соберите срезы с помощью изогнутых щипцов или небольшой кисти. Накапливайте срезы в базовом буфере, содержащем апротинин (рис. 1D).
- Дайте ломтикам постоять не менее 1 часа в исходном буфере с апротинином. Поместите ломтики на медленный орбитальный шейкер, чтобы обеспечить вымывание ферментов, высвобождаемых в процессе резки.
4. Анализ живого/мертвого
ПРИМЕЧАНИЕ: Это дополнительный анализ, который покажет жизнеспособность срезов ткани после процедуры. Однако срезы нельзя использовать повторно после окрашивания.
- Переложите один ломтик в лунку, заполненную базовым буфером.
- Добавьте флуоресцеиновый диацетат (FDA, 50 мкг/мл), инкубируйте 1 мин при комнатной температуре и беречь от света.
- Добавить йодид пропидия (PI, 50 мкг/мл), инкубировать 1 мин при комнатной температуре, беречь от света.
- Переложите ломтик в другое углубление, наполненное PBS, чтобы промыть в течение 1 минуты.
- Перенесите срезы в чашку Петри или установите на предметное стекло с покровным стеклом для визуализации (рис. 2A, B).
5. Перифузия
ПРИМЕЧАНИЕ: Этот протокол описывает, как выполнять динамическую перифузию для срезов ткани, однако он также подходит для изолированных островков. Островковые камеры должны быть подготовлены фильтровальной бумагой и раствором гранул перед загрузкой островков, как описано в руководстве по эксплуатации машины. Тем не менее, островок и срезная камера могут быть использованы вместе в одном эксперименте.
- Выберите 3 ломтика и обрежьте агарозу до минимума под стереомикроскопом с помощью кисти и скальпеля.
- Добавьте каплю базового буфера (HEPES, содержащего 5,5 мМ базовой глюкозы) на решетку камеры для срезов и аккуратно поместите один срез на сетку. Повторите для каждого из 3 срезов (рисунок 3A). Если ломтики очень маленькие, сложите более 3 камер, чтобы увеличить количество островков. Не кладите более одного ломтика в камеру.
ПРИМЕЧАНИЕ: Количество островков на срезе сильно варьируется у разных доноров и зависит от размера среза (10-100 островков на срез). В общей сложности было доказано, что 3 среза достаточны для измерения секреции инсулина и глюкагона. - Для изолированных островков используйте минимум 30 островков на колонку для секреции инсулина. Рекомендуется использовать 100 островков для определения глюкагона. Соберите отдельные детали камеры для нарезки сверху вниз.
- Подсоедините нарезную камеру к входным и выходным трубкам в машине и запустите протокол (рис. 3C).
- Используйте камерный обогрев и насос для охлаждения лотков во время протокола. Меняйте сборные пластины во время протокола и храните при температуре 4 °C, если количественное определение проводится в тот же день, или храните при -80 °C до этого времени.
- Когда протокол будет выполнен, удалите камеры, разберите и соберите срезы для лизиса (3% HCl в абсолютном этаноле) или фиксации (в 4% параформальдегида).
- Очистите машину, промыв ее водой, 10% отбеливателем, водой и воздухом.
- Количественное определение секреции гормонов с помощью имеющихся в продаже наборов для обнаружения.
ПРИМЕЧАНИЕ: На рисунке 4 показаны абсолютные уровни секреции инсулина и глюкагона в 3 срезах для оценки диапазонов концентраций.
6. Визуализация кальция
- Приготовьте раствор кальциевого красителя (например, Fluo4-AM, Calbryte) в соответствии с инструкцией производителя.
- Разведите краситель в исходном буферном растворе HEPES и добавьте апротинин (10 мкг/мл).
- Переложите один ломтик и выдержите в течение 30-60 минут в орбитальном шейкере при комнатной температуре и беречь от света.
- Во время инкубации подготовьте установку для визуализации срезов, заполнив перифузионные шприцы и затравив трубки (рис. 5A, B).
- Подключите все устройства, включите нагреватель и запустите насос. Рекомендуется использовать как подогрев потоком, так и платформенный нагреватель с расходом 0,5 мл/мин.
- Аккуратно поместите один ломтик в камеру визуализации и закрепите арфой.
- Используйте объектив с малым увеличением для определения области изображения. Использование отражения помогает определить площадь островков (рисунок 5C).
- Переключитесь на объектив с большим увеличением (например, 20x или 40x) и отрегулируйте положение в соответствии с экспериментальной установкой.
ПРИМЕЧАНИЕ: Для обеспечения оптимальной жизнеспособности ячеек и целостности островков рекомендуется, чтобы оптические срезы находились на 1-2 клеточных слоя ниже режущей поверхности. - Задайте z-стек и/или положение сканирования плитки. Установите интервал визуализации и продолжительность записи. В данном случае использовали разрешение не менее 256 x 256 для обеспечения различения отдельных клеток, интервал визуализации 5-10 с и диапазон z-стека (если применимо) 30-60 мкм с интервалом 10 мкм между плоскостями (один клеточный слой). Подробные настройки изображения см. на рисунке 6 .
ПРИМЕЧАНИЕ: Установите параметр изображения, чтобы получить наилучшее разрешение и максимальную площадь, но избегайте обесцвечивания образца. - Запустите визуализацию и переключите поступление раствора в соответствии с экспериментом. Как только это будет сделано, соберите срезы и зафиксируйте их для иммуногистохимии.
Результаты
При успешном выполнении протокола из 1 г ткани поджелудочной железы получается примерно 100-200 срезов. Затем эти срезы должны пройти стереомикроскопическое обследование для выявления тех, которые богаты островками, прежде чем приступать к функциональной оценке. Ожидается, что жизнеспособность, определяемая путем мечения флуоресцеиновым диацетатом (FDA) и йодидом пропидия (PI), достигнет 80%-90% (рис. 2A). Жизнеспособность может быть значительно ниже на режущей поверхности из-за повреждения клеток в процессе нарезки. В жизнеспособных срезах наблюдается динамическая секреция гормонов (рис. 2B), что приводит к сильному высвобождению инсулина при воздействии высокого уровня глюкозы и деполяризации мембраны хлоридом калия (KCl).
И наоборот, когда во время процедуры среза есть задержки или качество ткани неоптимальное, результаты значительно отличаются. Количество полученных срезов может уменьшиться, а оценка жизнеспособности может указывать на более высокую долю нежизнеспособных клеток, меченных PI (рисунок 2C). В этих случаях функциональная оценка указывает на снижение или даже отсутствие ответа на высокий уровень глюкозы и деполяризацию мембраны (рис. 2D). Данные неоптимальных экспериментов иллюстрируют важность точного и своевременного выполнения и качества тканей, поскольку они могут привести к снижению жизнеспособности тканей и нарушению функциональности. Эти негативные результаты служат ценным напоминанием о критических факторах, которые следует учитывать для успеха этого метода.
Общие результаты визуализации кальция визуализируются в виде тепловой карты, как показано на рисунке 5D, или в виде отдельных следов для отдельных клеток, как показано на рисунке 5E. Важно подчеркнуть, что краситель помечает все типы клеток без разбора, поэтому специфические стимулы необходимы для различения клеток на основе их реакций. Чтобы идентифицировать жизнеспособные клетки, мы используем KCl и сортируем клетки на основе ответов, которые превышают средний исходный ответ более чем на две стандартные ошибки. Кроме того, срезы могут быть зафиксированы и окрашены, что позволяет идентифицировать типы клеток.
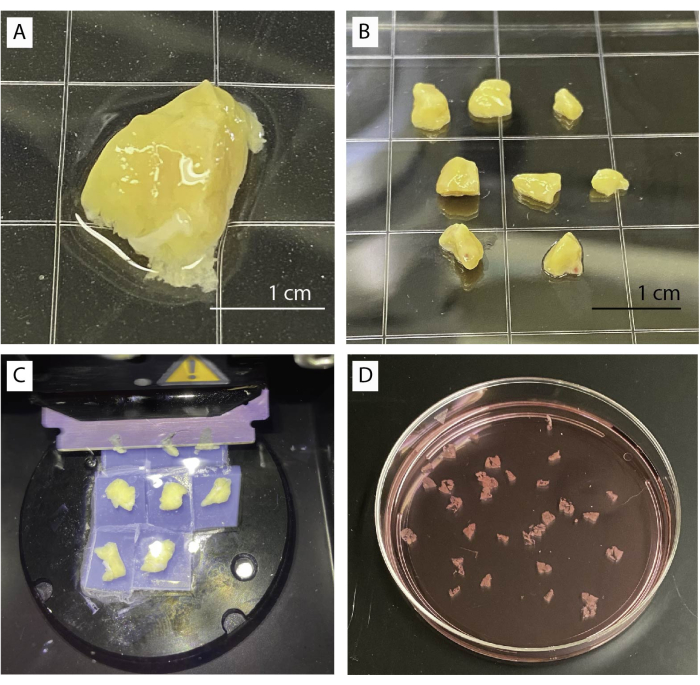
Рисунок 1: Обработка и разрезание ткани. (A) 1 г необработанной ткани поджелудочной железы. (B) Очищенные части поджелудочной железы, готовые к заделке агарозы. (C) Процедура нарезки с помощью вибратома. (D) Свеженарезанные ломтики человеческой поджелудочной железы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
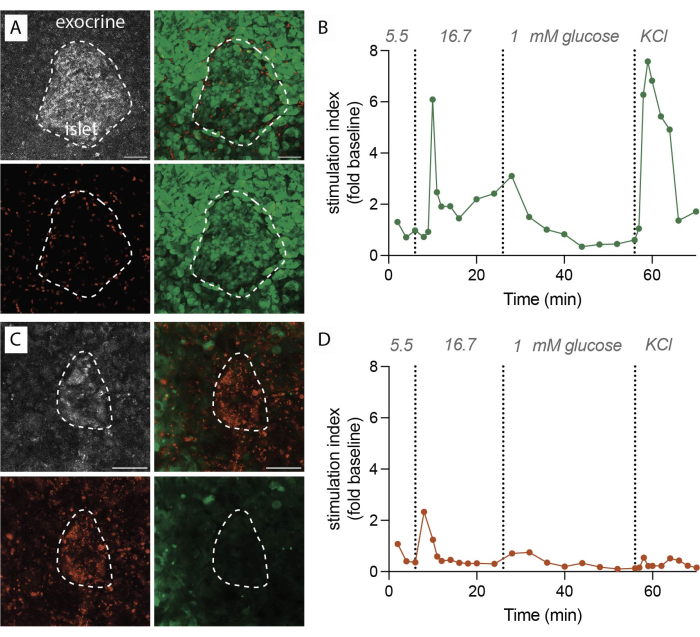
Рисунок 2: Данные о жизнеспособности тканей и секреции инсулина. (A) Репрезентативные изображения жизнеспособных срезов тканей. Проекция максимальной интенсивности отраженного лазерного света (серый, вверху слева), PI для мертвых клеток (красный, внизу слева), FDA для живых клеток (зеленый, внизу справа) и объединенные изображения для живых и мертвых клеток (вверху справа). Пунктирной линией обозначен островок. Масштабная линейка 50 мкм. (B) Динамическая секреция инсулина в срезах ткани поджелудочной железы человека от одного донора, не страдающего диабетом. Кинетика инсулина показывает первую фазу пикового ответа через 6 минут стимуляции высоким уровнем глюкозы, за которой следует плато второй фазы. Данные нормализуются до средней исходной секреции при 5,5 мМ глюкозы (индекс стимуляции, изменение кратности). Секреция была выполнена на срезах от того же донора, как показано на рисунке (A). (C) Репрезентативные изображения для нежизнеспособных срезов ткани. Проекция максимальной интенсивности отраженного лазерного света (серый, вверху слева), PI для мертвых клеток (красный, внизу слева), FDA для живых клеток (зеленый, внизу справа) и объединенные изображения для живых и мертвых клеток (вверху справа). Пунктирной линией обозначен островок. Масштабная линейка 50 мкм. (D) Динамическая секреция инсулина в срезах ткани поджелудочной железы человека от одного донора, не страдающего диабетом. Кинетика инсулина демонстрирует явную потерю как глюкозостимулированной секреции инсулина, так и деполяризации мембраны при KCl. Данные нормализованы до средней исходной секреции при 5,5 мМ глюкозе (индекс стимуляции, изменение в разы). Секреция была выполнена на срезах от того же донора, как показано на рисунке (C). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Загрузка ткани для динамического перифузии. (A) Штабелированные камеры для срезов. Отдельные срезы загружаются на металлическую сетку, как показано на пластине. (B) Загрузка изолированных островков в островковые камеры. Камеры для срезов и островков, подключенные к перифузионной машине. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
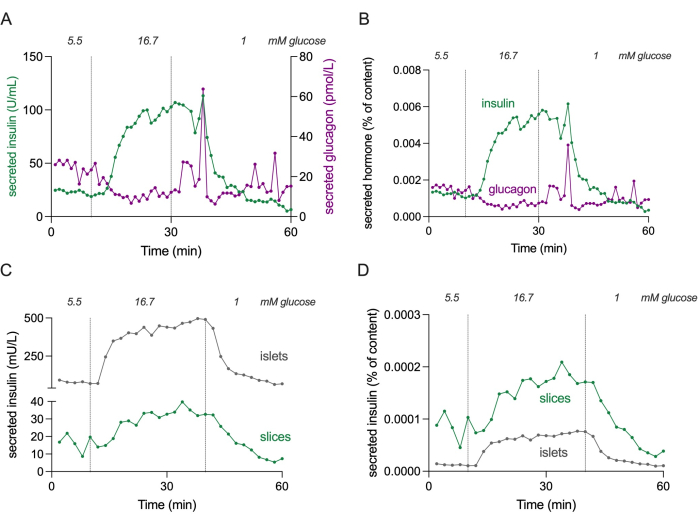
Рисунок 4: Секреция гормонов в срезах и изолированных островках. Данные, показанные на панелях (A) и (B), получены от другого донора по сравнению с панелями (C) и (D). (А) Абсолютная секреция гормонов из 3 срезов ткани поджелудочной железы от одного донора, не страдающего диабетом. Секреция инсулина показана зеленым цветом, а секреция глюкагона пурпурным. (Б) Секреция гормонов, показанная на (А), нормализована до общего содержания гормонов (% от содержания). Содержимое измеряется по всем 3 срезам, используемым в эксперименте. (C) Динамическая секреция инсулина изолированных островков (100 островков) и срезов ткани поджелудочной железы (3 среза) от одного и того же донора, не страдающего диабетом. Данные отображаются в абсолютных числах (мЕд/л). (D) Секреция инсулина, показанная на (C), нормализовалась до общего содержания инсулина (% от содержания). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
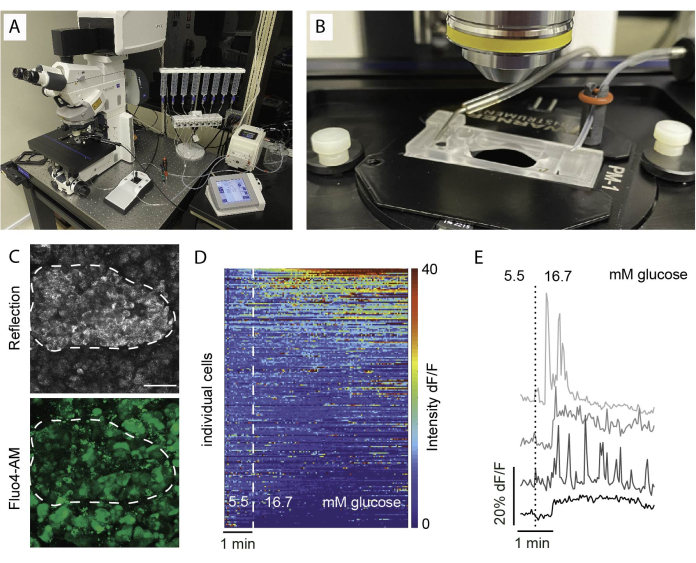
Рисунок 5: Установка для визуализации и ожидаемые результаты. (A) Установка для функциональной визуализации с помощью вертикального конфокального микроскопа и перифузионной установки. (B) Камера визуализации, подключенная к притоку и выходу. (C) Стек Z конфокальных изображений островка в срезе ткани от здорового донора, показывающий отраженный свет (вверху) и сигнал Fluo4 (внизу). Отражение используется для идентификации островков внутри среза (пунктирная линия). (D) Тепловая карта, показывающая in vitro динамикуCa2+ островковых клеток, выраженную в виде интенсивности флуоресценции Fluo4, нормализованной до интенсивности базального сигнала при 5,5 мМ глюкозы и стимуляции высокой глюкозой (16,7 мМ). Каждая строка представляет собой одну клетку, за которой следуют с течением времени по оси x, и их реакцию в изменении магнитуды (%) интенсивности флуоресценции по сравнению с исходным уровнем (dF/F), показанной на цветовой шкале от синего (низкая интенсивность) до красного (высокая интенсивность). (E) Репрезентативные следы 4 отдельных клеток, показывающие реакцию на высокий уровень глюкозы. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
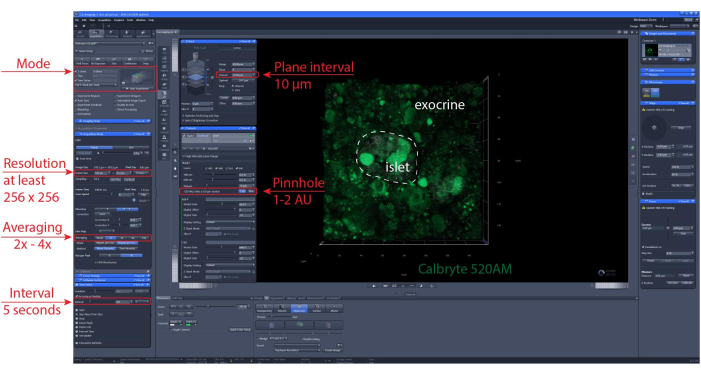
Рисунок 6: Настройки визуализации кальция. Скриншот программного обеспечения с репрезентативными настройками, выбранными для выполнения покадровой записи 40 мкм (XYZT-визуализация). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Здесь мы представляем протокол создания жизнеспособных срезов ткани поджелудочной железы и их использование для функциональных считываний, таких как динамическая секреция гормонов и функциональная визуализация. Как и в случае с изоляцией островков человека, на успех процедуры среза влияют различные факторы, включая характеристики донора, время транспортировки ткании качество ткани. Поэтому очень важно тщательно отобрать образцы тканей для эксперимента и свести время ишемии к минимуму. В этом контексте следует тщательно рассмотреть другие потенциальные источники человеческих тканей, помимо трупных доноров. Включение хирургических доноров дает возможность комбинировать данные функциональных срезов с соответствующей информацией in vivo от одного и того же пациента, усиливая трансляционную значимость11. Однако этот источник ткани приносит и другие факторы, поскольку биопсия обычно берется у пожилых пациентов, перенесших панкреатэктомию, в основном из-за локализованной опухоли. Примечательно, что биопсия поджелудочной железы не проводится в контексте диабета.
При выполнении фактической процедуры нарезки своевременная обработка тканей имеет решающее значение. Срезы могут храниться в течение нескольких часов, как описано в этом протоколе, или культивироваться в течение длительного времени, как описано в Qadir et al.19. В настоящее время этот протокол является единственным методом поддержания жизнеспособности срезов в течение длительного времени, однако будущие усилия должны оценивать функциональные изменения в различных культурах и проводить сравнения с изолированными островками от одного и того же донора.
Наиболее важным этапом в этом процессе является тщательная подготовка тканей перед внедрением в агарозу. Большие протоки и фиброзная ткань могут усложнить процесс среза и потенциально привести к вырыву тканевых блоков из агарозы. Если это произойдет и кусочки останутся разумного размера, их можно повторно обработать и заложить для нарезки. Поддержание хорошего качества тканей и тщательная обработка значительно повышают эффективность процедуры нарезки и дают максимальное количество и качество ломтиков. Время, прошедшее от препарирования тканей до образования срезов, не должно превышать 2-3 ч, так как более длительные интервалы существенно влияют на жизнеспособность тканей.
Во время перифузии ломтика простым, но важным этапом является точная обрезка ломтика, чтобы обеспечить идеальное прилегание к камере. Это обеспечивает правильное купание тканей и непрерывный поток. После начала протокола важно избегать дальнейших манипуляций с камерами, чтобы предотвратить нежелательные всплески высвобождения гормонов. Должен быть подготовлен достаточный буфер, а трубки должны достигать дна раствора, чтобы предотвратить всасывание воздуха и пересыхание камер.
Для визуализации кальция важно тщательно выбирать интересующую область, в зависимости от экспериментальных потребностей и дизайна. Важно свести к минимуму фотообесцвечивание, выбирая параметры визуализации, которые уменьшают воздействие света или сокращают общее время протокола. Как и динамическая секреция гормонов, поддержание правильного потока раствора и нагрева имеет решающее значение, поскольку для оптимального функционирования ломтиков требуются условия, близкие к физиологическим (например, 37 °C).
Срезы ткани поджелудочной железы эффективно поддерживают структурную целостность поджелудочной железы, сохраняя межклеточные связи между ее различными типами клеток. Следовательно, они представляют собой альтернативу работе с изолированными островками, облегчая одновременное изучение как эндокринных, так и экзокринных функций и их взаимодействия. Чтобы оценить взаимодействие отдельных типов клеток, крайне важно различать их. Последующее окрашивание является одним из вариантов, но у него есть ограничения с точки зрения доступных флуоресцентных зондов и проблема обнаружения точных слоев клеток. Поэтому рекомендуется включить в протокол клеточно-специфические стимулы, чтобы обеспечить возможность клеточного различения на основе ответов. Для различения типов клеток в срезах мышей или человека эффективными стимулами являются адреналин для альфа-клеток21,30, грелин для дельта-клеток31, церулеин для ацинарных клеток 5,32, желчные кислоты для протоковых клеток33 и норадреналин для сосудистых клеток22. Аналогичные стимулы могут быть использованы для измерения секреторных реакций. В то время как визуализирующие исследования сосредоточены на отдельных клетках, исследования секреции анализируют коллективный ответ. Следовательно, крайне важно включить достаточное количество срезов, чтобы определить желаемые результаты. Оптимальное количество может варьироваться в зависимости от типа клеток, при этом для эндокринных клеток достаточно трех срезов; Однако рекомендуется использовать больше срезов, чтобы обеспечить обнаруживаемость, а не рисковать упустить ценную информацию.
Как и любой другой метод, срезы тканей имеют ограничения, которые следует учитывать при интерпретации результатов. Применение стимула, нацеленное на определенные типы клеток, может привести к воздействию на другие типы клеток в срезе, потенциально запуская петли обратной связи. Однако их также важно изучать, и, таким образом, измеренные ответы могут быть более репрезентативными для физиологической реакции. Для селективного нацеливания на клетки могут использоваться традиционные протоколы in vitro . Важно отметить, что ацинарные клетки содержат ферменты поджелудочной железы, которые могут расщеплять белки и переваривать срез ткани, что приводит к клеточной деградации в течение нескольких часов. Для поддержания жизнеспособности необходимо последовательное использование ингибиторов трипсина, когда срезы находятся в статическом состоянии, даже если их применение может помешать успешному переносу вирусов, используемых для целей мечения.
По сравнению с изоляцией островков, вариабельность донора и качество тканей могут влиять как на количество, так и на жизнеспособность полученных срезов. Недостаточная жизнеспособность после нарезки может привести к короткому сроку жизни и затруднить возможность культивирования срезов. Кроме того, количество островков может значительно варьироваться у разных доноров, что затрудняет оценку содержимого островков перед проведением экспериментов. Следовательно, тщательный выбор критериев принятия донора и внедрение соответствующих методов нормализации, таких как процентное содержание гормонов для секреции или изменение складки к исходному уровню, имеют решающее значение. Для получения стабильных результатов рекомендуется оценить жизнеспособность среза ткани перед экспериментом. Кроме того, рекомендуется включить в эксперимент соответствующие контрольные стимулы (например, KCl). В случаях индивидуального клеточного анализа, такого как визуализация, может быть реализована предварительная сортировка клеток на основе их реакции на эти контрольные стимулы. Несмотря на упомянутые проблемы, срезы предлагают ценное дополнение к текущим методам исследования.
Описанный протокол может быть использован в качестве отправной точки для нескольких применений, и можно манипулировать срезами поджелудочной железы и исследовать ответы после различных стимулов. Мы также направляем читателей к многочисленным исследованиям с использованием срезов поджелудочной железы мыши или человека, предоставляя ценную информацию для тех, кто планирует свои эксперименты. В будущем возможно, что потенциальные методы лечения могут быть исследованы с использованием срезов поджелудочной железы или что могут быть смоделированы механизмы заболевания.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование было проведено при поддержке Сети доноров органов поджелудочной железы с диабетом (nPOD; RRID:SCR_014641), совместный исследовательский проект по диабету 1 типа, поддерживаемый JDRF (nPOD: 5-SRA-2018-557-Q-R) и Благотворительным фондом Леоны М. и Гарри Б. Хелмсли (Grant#2018PG-T1D053, G-2108-04793). Содержание и высказанные мнения являются ответственностью авторов и не обязательно отражают официальную точку зрения nPOD. Организации по закупке органов (OPO), сотрудничающие с nPOD для предоставления исследовательских ресурсов, перечислены на http://www.jdrfnpod.org/for-partners/npod-partners/. Авторы благодарны донорам и их семьям за их неоценимый вклад. Эта работа была поддержана Американской диабетической ассоциацией 4-22-PDFPM (J.K.P.) и Благотворительным фондом Леоны М. и Гарри Б. Хелмсли (грант 2015-PG-T1D-052).
Материалы
| Name | Company | Catalog Number | Comments |
| Alanine | Sigma | A7627 | amino acid |
| AlexaFluor 488 goat anti-guineapig | Invitrogen | A11073 | secondary antibody |
| AlexaFluor 546 goat anti-rat | Thermo Fisher | A11077 | secondary antibody |
| AlexaFluor 647 goat anti-mouse | Thermo Fisher | A21235 | secondary antibody |
| Aprotinin | Sigma | A1153 | inhibitor |
| Arginine | Sigma | A5006 | amino acid |
| Calbryte 520 AM | AAT Bioquest | 20651 | Calcium dye |
| Fluo4-AM | Invitrogen | F14201 | Calcium dye |
| Fluorescein diacetat | Sigma | F7378 | viability marker |
| Glucagon | Sigma | G2654 | primary antibody |
| Glucagon ELISA (human kit) | Mercodia | 10-1271-01 | ELISA for hormone detection |
| Glutamine | Sigma | G3126 | amino acid |
| Insulin | Dako | A-0546 | primary antibody |
| Insulin ELISA (human) | Mercodia | 10-1113-01 | ELISA for hormone detection |
| Low melting point agarose | Sigma | A9414 | |
| LSM 900 | Zeiss | confocal microscope | |
| Pancreas Slice Chamber | Biorep Technologies | PERI-PSC-001 | slice chamber for perifucion |
| Pancreas Slice Chamber Extender Kit | Biorep Technologies | PERI-PSC-EXT | slice chamber for perifucion |
| Pancreas Slice Chamber Perforated Plate | Biorep Technologies | PERI-PSC-PP | slice chamber for perifucion |
| Perifusion system with automated tray handling | Biorep Technologies | PERI4-02-230-FA | |
| Propidium iodide | Life technologies | P1304MP | dead marker |
| Semi-automatic vibratome VT1200S | Leica | 14048142066 | |
| Somatostatin | Millipore | MAB354 | primary antibody |
Ссылки
- Abdelli, S., et al. Intracellular stress signaling pathways activated during human islet preparation and following acute cytokine exposure. Diabetes. 53 (11), 2815-2823 (2004).
- Lyon, J., et al. Research-focused isolation of human islets from donors with and without diabetes at the alberta diabetes institute isletcore. Endocrinology. 157 (2), 560-569 (2016).
- Speier, S., Rupnik, M. A novel approach to in situ characterization of pancreatic beta-cells. Pflugers Arch. 446 (5), 553-558 (2003).
- Cohrs, C. M., et al. Vessel network architecture of adult human islets promotes distinct cell-cell interactions in situ and is altered after transplantation. Endocrinology. 158 (5), 1373-1385 (2017).
- Marolt, U., et al. Calcium imaging in intact mouse acinar cells in acute pancreas tissue slices. PLoS One. 17 (6), 0268644(2022).
- Stozer, A., et al. Confocal laser scanning microscopy of calcium dynamics in acute mouse pancreatic tissue slices. J Vis Exp. (170), e62293(2021).
- Stozer, A., Dolensek, J., Rupnik, M. S. Glucose-stimulated calcium dynamics in islets of langerhans in acute mouse pancreas tissue slices. PLoS One. 8 (1), e54638(2013).
- Weitz, J. R., et al. Mouse pancreatic islet macrophages use locally released atp to monitor beta cell activity. Diabetologia. 61 (1), 182-192 (2018).
- Speier, S., Yang, S. B., Sroka, K., Rose, T., Rupnik, M. Katp-channels in beta-cells in tissue slices are directly modulated by millimolar atp. Mol Cell Endocrinol. 230 (1-2), 51-58 (2005).
- Chen, C., Cohrs, C. M., Stertmann, J., Bozsak, R., Speier, S. Human beta cell mass and function in diabetes: Recent advances in knowledge and technologies to understand disease pathogenesis. Mol Metab. 6 (9), 943-957 (2017).
- Cohrs, C. M., et al. Dysfunction of persisting beta cells is a key feature of early type 2 diabetes pathogenesis. Cell Rep. 31 (1), 107469(2020).
- Marciniak, A., et al. Using pancreas tissue slices for in situ studies of islet of langerhans and acinar cell biology. Nat Protoc. 9 (12), 2809-2822 (2014).
- Panzer, J. K., et al. Pancreas tissue slices from organ donors enable in situ analysis of type 1 diabetes pathogenesis. JCI Insight. 5 (8), e134525(2020).
- Campbell-Thompson, M., et al. Network for pancreatic organ donors with diabetes (npod): Developing a tissue biobank for type 1 diabetes. Diabetes Metab Res Rev. 28 (7), 608-617 (2012).
- Kaddis, J. S., Pugliese, A., Atkinson, M. A. A run on the biobank: What have we learned about type 1 diabetes from the npod tissue repository. Curr Opin Endocrinol Diabetes Obes. 22 (4), 290-295 (2015).
- Pugliese, A., et al. New insight on human type 1 diabetes biology: Npod and npod-transplantation. Curr Diab Rep. 14 (10), 530(2014).
- Pugliese, A., et al. The juvenile diabetes research foundation network for pancreatic organ donors with diabetes (npod) program: Goals, operational model and emerging findings. Pediatr Diabetes. 15 (1), 1-9 (2014).
- Liang, T., et al. Ex vivo human pancreatic slice preparations offer a valuable model for studying pancreatic exocrine biology. J Biol Chem. 292 (14), 5957-5969 (2017).
- Qadir, M. M. F., et al. Long-term culture of human pancreatic slices as a model to study real-time islet regeneration. Nat Commun. 11 (1), 3265(2020).
- Huber, M. K., et al. Observing islet function and islet-immune cell interactions in live pancreatic tissue slices. J Vis Exp. (170), e62207(2021).
- Panzer, J. K., Tamayo, A., Caicedo, A. Restoring glutamate receptor signaling in pancreatic alpha cells rescues glucagon responses in type 1 diabetes. Cell Rep. 41 (11), 111792(2022).
- Mateus Goncalves, L., Almaca, J. Functional characterization of the human islet microvasculature using living pancreas slices. Front Endocrinol (Lausanne). 11, 602519(2020).
- Doke, M., et al. Dynamic scrna-seq of live human pancreatic slices reveals functional endocrine cell neogenesis through an intermediate ducto-acinar stage. Cell Metab. 35 (11), 1944-1960 (2023).
- Mateus Goncalves, L., et al. Pericyte dysfunction and impaired vasomotion are hallmarks of islets during the pathogenesis of type 1 diabetes. Cell Rep. 42 (8), 112913(2023).
- Hanley, S. C., Paraskevas, S., Rosenberg, L. Donor and isolation variables predicting human islet isolation success. Transplantation. 85 (7), 950-955 (2008).
- Hart, N. J., Powers, A. C. Use of human islets to understand islet biology and diabetes: Progress, challenges and suggestions. Diabetologia. 62 (2), 212-222 (2019).
- Henquin, J. C. The challenge of correctly reporting hormones content and secretion in isolated human islets. Mol Metab. 30, 230-239 (2019).
- Panzer, J. K., Caicedo, A. Protocol to generate and utilize pancreatic tissue slices to study endocrine and exocrine physiology in situ from mouse and human tissue. STAR Protoc. 4 (3), 102399(2023).
- Toso, C., et al. Factors affecting human islet of langerhans isolation yields. Transplant Proc. 34 (3), 826-827 (2002).
- Hamilton, A., et al. Adrenaline stimulates glucagon secretion by tpc2-dependent ca(2+) mobilization from acidic stores in pancreatic alpha-cells. Diabetes. 67 (6), 1128-1139 (2018).
- Adriaenssens, A. E., et al. Transcriptomic profiling of pancreatic alpha, beta and delta cell populations identifies delta cells as a principal target for ghrelin in mouse islets. Diabetologia. 59 (10), 2156-2165 (2016).
- Marciniak, A., Selck, C., Friedrich, B., Speier, S. Mouse pancreas tissue slice culture facilitates long-term studies of exocrine and endocrine cell physiology in situ. PLoS One. 8 (11), e78706(2013).
- Gal, E., et al. A novel in situ approach to studying pancreatic ducts in mice. Front Physiol. 10, 938(2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены