Method Article
Модифицированный метод интратекальной катетеризации у крыс
В этой статье
Резюме
В данной работе мы представляем модифицированный метод интратекальной катетеризации у крыс, который представляет собой простой, удобный и надежный подход к повторному интратекальному введению лекарственных препаратов.
Аннотация
Интратекальная катетеризация широко применяется в экспериментах на животных, особенно на нейропатических болях. Тем не менее, традиционные методы все еще имеют несколько ограничений. Несмотря на то, что некоторые исследователи пытались усовершенствовать традиционные методы, имеющиеся методы все еще нуждаются в модификации. В данной работе мы представляем модифицированный метод интратекальной катетеризации у крыс.
В этом методе используется проволока из нержавеющей стали длиной 20 см (диаметр 0,2 мм), пластиковая трубка PE10 длиной 15 см, самодельный уплотнительный колпачок и противоаллергическая лента × 0,3 см 0,5 см. Наш модифицированный метод интратекальной катетеризации имеет ряд преимуществ. Во-первых, введение проволоки из нержавеющей стали в трубку PE10 повышает эластичность трубки, улучшает вероятность успеха интратекальной катетеризации, уменьшает количество пространства, необходимого для операции, и сводит к минимуму повреждение тканей вокруг поясничного отдела позвоночника. Во-вторых, длина трубки PE10 определяется перед операцией, и время пребывания катетера может превышать одну неделю. В-третьих, трубка ПЭ10 фиксируется швом в форме восьмерки, 4 раза, что предотвращает смещение трубки и втягивание при движении животного. В-четвертых, для герметизации трубки PE10 используется самодельный уплотнительный колпачок, который не только предотвращает утечку спинномозговой жидкости, но и снижает необходимость повторного разрезания трубки PE10. Наконец, экстракорпоральный конец трубки PE10 обвязывается лентой, которая предотвращает втягивание трубки при движении животного.
Этот метод может увеличить вероятность успешности катетеризации у крыс, так как примерно 80% трубок PE10 оставались на месте даже через 28 дней после операции. Таким образом, этот модифицированный метод может представлять собой простой, удобный и надежный подход к повторному интратекальному введению лекарственных средств.
Введение
Интратекальная катетеризация (также известная как субарахноидальная катетеризация) у крыс — это метод, который включает введение катетера в субарахноидальное пространство через межпозвоночное пространство1. Лекарства вводятся непосредственно в субарахноидальное пространство через катетер, что помогает исследователям исследовать влияние лекарств на спинной мозг без учета эффектов лекарств, которые проникают через гематоэнцефалический барьер 2,3. Кроме того, спинномозговая жидкость может быть собрана после интратекальной катетеризации для исследования микроокружения центральной нервной системы 4,5. Используемый в настоящее время метод интратекальной катетеризации был впервые установлен Якшем и Руди6 в 1976 году, и с тех пор он широко применяется в экспериментах на животных в области неврологии, анестезии и анальгезии, опосредованной спинным мозгом сердечно-сосудистой регуляции и особенно нейропатическойболи. Тем не менее, этот метод все еще имеет ряд ограничений, таких как высокая частота повреждения спинного мозга, субарахноидальное кровоизлияние, послеоперационная сенсорная и двигательная дисфункция, высокая послеоперационная смертность и высокий риск неврологических нарушений 4,5,8,9,10 . В попытке преодолеть эти ограничения, в 1996-11 гг. Størkson et al. предложили катетеризацию субарахноидального пространства через поясничные промежутки, и сообщалось о более высоком показателе послеоперационного успеха. Примечательно, что фиксация постоянного катетера все еще является проблемой в этом методе, а ретракция катетера распространена из-за движения животного, что делает интратекальное введение препарата неудобным.
Из-за вышеуказанных ограничений некоторые исследователи 12,13,14,15 пытались усовершенствовать инструменты для пункции, методы катетеризации и методы фиксации катетера, но имеющиеся методы все еще нуждаются в модификации из-за трудности количественного определения диаметра используемых бусин, необходимости повторных проколов и короткой длины катетера. и т.д.11
В соответствии с поясничным подходом для интратекальной катетеризации1 и методом Сельдингера для катетеризации центральной вены,16 мы разработали метод интратекальной катетеризации у крыс, в котором используется проволока из нержавеющей стали, самодельный герметизирующий колпачок и антиаллергическая лента для упрощения существующего метода. Благодаря этому методу катетер может быть легко введен в субарахноидальное пространство и устойчиво зафиксирован на спине крысы, при этом исключается необходимость повторных проколов для повторного интратекального введения препарата.
В данной работе мы представляем модифицированный метод, который может повысить вероятность успешности интратекальной катетеризации у крыс и представляет собой простой, удобный и надежный подход к повторному интратекальному введению лекарств.
протокол
Интратекальная катетеризация проводилась в строгом соответствии с рекомендациями, содержащимися в Руководстве по уходу за лабораторными животными и их использованию Национальных институтов здравоохранения, а протокол был одобрен Комитетом по этике экспериментальных животных, Китай (No 100). TJBH15523201). В эксперименте использовались самцы крыс породы Спрэг-Доули (SD). Были приняты меры для минимизации боли и дискомфорта животных.
1. Подготовка материала и инструментов
ПРИМЕЧАНИЕ: Подготовка материалов и инструментов очень важна для успешной интратекальной катетеризации.
- Подготовьте трубку из ПЭ10 длиной 15 см (длина определяется в зависимости от расстояния между головой крысы и концом хвоста), вставьте проволоку из нержавеющей стали длиной 20 см (диаметром 0,2 мм) с двумя полированными концами в трубку ПЭ10 в качестве опоры и отметьте трубку на расстоянии 2 см от одного конца, чтобы указать глубину введения (как отмечено черными крестиками на рисунке 1А). Б).
- Отрежьте острый кончик иглы 22 G и запечатайте дистальный конец (рисунок 1C).
- Разрежьте эпидуральный катетер (наружный диаметр 1,0 мм) на фрагменты по 1 см. Затем введите фрагмент в иглу 22 G без острого кончика (Рисунок 1D) и запечатайте дистальный конец фрагмента парой нагретых прямых щипцов. Это устройство называется уплотнительным колпачком трубки (рис. 1E).
- Приготовьте противоаллергическую ленту размером 0,3 см × 0,5 см, разрезав ножницами шелковую ленту (1,25 см × 9,1 м) (рисунок 1F).
2. Подготовка к операции
- Подготовьте инструменты к интратекальной катетеризации, стерилизовав их перед операцией. Инструментами, используемыми для операции, являются зубчатые щипцы, ножницы, зондовый аппарат, рукоятка скальпеля и лезвия #10. (Рисунок 2).
- Погрузите трубку PE10 и направляющую проволоку в 75% этанол для стерилизации примерно на 2 часа.
3. Хирургия
- Обезболить крысу 3% изофлураном со скоростью потока 3 л/мин.
- Поместите крысу на операционный стол и соблюдайте рефлекс отмены при защемлении задней лапы щипцами. Отсутствие движения задней лапы в ответ на стимуляцию подтвердило успешное обезболивание. Провести адекватную анальгезию путем внутримышечного введения 1 мг/кг мелоксикама перед интратекальной катетеризацией.
- Удалите волосы с поясничного отдела позвоночника, области спины и области между двумя ушами с помощью бритвы.
- Поместите центрифужную трубку (3 см в диаметре) под брюшную полость крысы на стыке талии и бедра, чтобы увеличить сгибание в поясничном отделе позвоночника, дав больше места для прохождения иглы и катетера.
- Стерилизуйте места проведения операций (область над поясничным отделом позвоночника и область между двумя ушами) раствором повидон-йода, а затем раствором этанола три раза. Накройте крысу асептической повязкой и обнажите места операции. Затем промойте трубку PE10 и направляющую проволоку обычным физиологическим раствором перед операцией.
ПРИМЕЧАНИЕ: Хвост не был закрыт, чтобы можно было наблюдать движение хвоста во время интратекальной катетеризации. - Определите расположение межпозвонкового пространства между L5 и L6, обнаружив остистый отросток L6 в средней точке между левым и правым двусторонними гребнями подвздошной кости. Зафиксируйте кожу большим пальцем левой руки и указательным пальцем левой руки оператора, а затем сделайте разрез по средней линии длиной 3-4 см чуть выше остистого отростка между L4 и S1.
- Тупо отделите подкожные ткани ножницами. Снова найдите межпозвонковое пространство между L5 и L6 и сделайте небольшой разрез (0,3 - 0,5 см) с обеих сторон дорсальных отростков L5 и L6.
- Зажмите и приподнимите спинной отросток L5 с помощью пары зубчатых щипцов, чтобы расширить межпозвоночное пространство. Затем тупо разделите мышцы вокруг тела позвонка ножницами, пока верхняя часть спинного отростка L6 полностью не обнажена.
ПРИМЕЧАНИЕ: Следует избегать удаления любой части тела позвонка и мышц с целью минимизации повреждения окружающих тканей. - Когда дорсальный отросток L5 будет поднят парой зубчатых щипцов и межпозвоночное пространство расширено еще одной парой щипцов, очистите межпозвоночное пространство L5-6 ватным тампоном до полного обнажения вывернутой V-образной области.
- Проколите позвоночник иглой 23 G в области перевернутой буквы «V» прямо под верхней частью спинного отростка L6.
ПРИМЕЧАНИЕ: Наблюдается взмах хвоста и/или бесцветная прозрачная жидкость вытекает из субарахноидального пространства, что указывает на успешный прокол в субарахноидальное пространство. - Осторожно вставьте трубку PE10, содержащую проволоку из нержавеющей стали, в спинномозговой канал в месте прокола, наклонив ее на 30° к хвосту. Регулируйте угол введения до тех пор, пока трубка PE10 не будет успешно вставлена без сопротивления (во время этого процесса наблюдался взмах хвоста).
- Когда отмеченный участок трубки PE10 достигает задней мышцы, катетеризация прекращается.
- Медленно снимите нержавеющую проволоку с трубки PE10. Можно наблюдать взмах хвоста.
ПРИМЕЧАНИЕ: Может наблюдаться взмах хвоста, и после удаления провода прозрачная жидкость (или светло-красная жидкость) может вытекать из трубки. - Затем подсоедините трубку PE10 к шприцу объемом 1 мл, через который вводится 20 мкл физиологического раствора. После извлечения шприца физиологический раствор будет непрерывно вытекать из трубки PE10, указывая на то, что он был успешно введен в субарахноидальное пространство.
- Как только будет подтверждено, что трубка PE10 свободна, зашите мышцы с одной стороны тела позвонка швом 4-0 и завяжите узел. Затем завяжите шов вокруг трубки PE10 и завяжите еще один узел. Не режьте шов; сшить мышцы с другой стороны; Снова завяжите шов на трубке PE10, сделайте третий узел и разрежьте шов.
ПРИМЕЧАНИЕ: Этот процесс фиксирует трубку PE10 шовным материалом в виде цифры 8 для уменьшения возможности смещения и втягивания трубки. - Сделайте разрез длиной 0,5 см на 1 см ниже средней точки между ушами. Тупо отделите подкожные ткани ножницами и вставьте металлическую зондовую трубку по направлению к хвосту до тех пор, пока кончик не станет виден в поясничном разрезе.
- Вставьте дистальный конец трубки PE10 в зондовую трубку до тех пор, пока трубка PE10 не выйдет из другого конца зондовой трубки; Затем аккуратно вытащите зонд.
- Когда подтвердится, что трубка PE10 снова свободна, зашите оставшиеся мышцы вокруг поясничного разреза швом 4-0, завяжите шов вокруг трубки PE10 и завяжите еще один узел, чтобы снова зафиксировать трубку PE10.
- Зашивайте кожу, не допуская повреждения трубки PE10. Затем зашить кожу шеи швом 4-0, завязать шов вокруг трубки PE10 и сделать узел для фиксации трубки PE10.
- Когда подтвердится, что трубка PE10 снова свободна, запечатайте экстракорпоральный конец трубки PE10 уплотнительным колпачком.
- Вытрите пробирку PE10 кусочком ткани, а затем несколько раз обвяжите антиаллергическую ленту вокруг трубки PE10, чтобы предотвратить втягивание трубки PE10 во время движения крысы.
4. Эксперимент по валидации лидокаина
- После операции верните крысу в клетку (по одной на клетку) и внимательно наблюдайте за ней во время восстановления после анестезии, пока крыса не придет в сознание.
- После того, как крыса полностью придет в себя, снимите уплотнительный колпачок и введите 20 мкл 2% лидокаина в пробирку PE10 со скоростью 0,02 мл/с через шприц Гамильтона, после чего введите 10 мкл нормального физиологического раствора.
- Запечатайте пробирку PE10 уплотнительным колпачком.
- Поставьте крысу на стол и внимательно наблюдайте. Наличие паралича задних конечностей после интратекальной инъекции лидокаина (из трубки PE10) свидетельствует об успешной катетеризации (рис. 3). Паралич задних конечностей обычно длится около 30 минут10 минут.
ПРИМЕЧАНИЕ: Дайте крысе восстановиться в течение 5-7 дней перед следующими экспериментами. - Внимательно наблюдайте за крысой в период восстановления до полного восстановления функции конечностей.
Результаты
Для интратекального введения экстракорпоральный кончик трубки PE10 отрезали, а трубку PE10 запечатывали герметизирующим колпачком между двумя инъекциями препарата. В нашем пилотном исследовании успешность интратекальной катетеризации составила примерно 95% (19 из 20 крыс); Об успехе свидетельствовало взмах хвостом и/или выделение бесцветной прозрачной жидкости во время процедуры. Примерно 85% труб остались на месте через 7 дней после операции, и примерно 80% остались на месте через 28 дней после операции. Крысы восстановились вскоре после операции, и в течение 7 дней после операции никаких осложнений не наблюдалось. Ежедневное движение было нормальным, поведенческих отклонений не наблюдалось. Эти результаты указывают на то, что наш метод превосходит те, о которых сообщалось ранее, с точки зрения успешности и частоты длительного проживания.
Полный паралич нижних конечностей при введении лидокаина через катетеры свидетельствует об успешной интратекальной катетеризации15. Вероятность успешности интратекальной катетеризации рассчитывается путем деления общего числа крыс на количество крыс с успешной катетеризацией. При использовании нашего модифицированного метода вероятность успеха составила 95%, что было выше, чем при использовании метода, описанного Hou et al. (88%)15. Это показано на рисунке 4.
Интратекальная трубка контролировалась через 2, 5 и 7 дней после интратекальной катетеризации, и частота успешного введения постоянного катетера рассчитывалась как количество крыс с успешным постоянным катетером / общее количество крыс × 100%. Через 2, 5 и 7 дней после интратекальной катетеризации частота успешной установки постоянного катетера составила 94%, 81% и 65% соответственно в исследовании StØrkson et al.11. Частота успешного введения постоянного катетера через 2, 5 и 7 дней после интратекальной катетеризации составила 95%, 90% и 85% соответственно при использовании нашей методики (рис. 5).

Рисунок 1. Материалы и инструменты, используемые для интратекальной катетеризации. (A) Была подготовлена трубка PE10 длиной 15 см, и на ней была нанесена маркировка на расстоянии 2 см от одного конца, указывающая глубину введения. (Б) Проволока из нержавеющей стали длиной 20 см с двумя полированными концами была вставлена в трубку ПЭ10 в качестве опоры. (C) Острый кончик иглы 22G был разрезан ножницами, а дистальный конец был запечатан парой щипцов. (D) Эпидуральный катетер (внешний диаметр 1,0 мм) был разрезан на фрагменты размером 1 см, которые затем были введены в иглу 22G без острого кончика. (E) Дистальный конец эпидурального катетера был запечатан парой нагретых прямых щипцов; Этот аппарат назывался уплотнительным колпачком трубки. (F) Противоаллергическую ленту размером 0,3 см × 0,5 см (шелковая лента, 1,25 см × 9,1 м) готовили с помощью ножниц. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
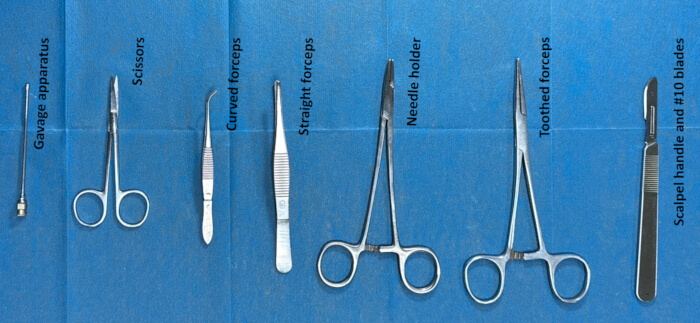
Рисунок 2. Подготовка инструментов для интратекальной катетеризации. Инструменты (такие как зубчатые щипцы, ножницы, гаважный аппарат, рукоятка скальпеля и лезвия #10) стерилизовались этанолом в течение примерно 2 часов, а затем промывались обычным физиологическим раствором примерно за 30 минут до операции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
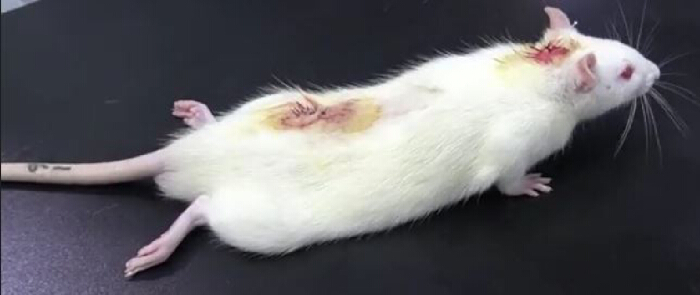
Рисунок 3. Результаты эксперимента по валидации лидокаина после интратекальной катетеризации. После интратекального введения 20 мкл 2% лидокаина с последующей инъекцией 10 мкл нормального физиологического раствора крыса была временно парализована: паралич нижних конечностей возник в течение 30 с и исчез через 30 мин, что свидетельствует об успешной интратекальной катетеризации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
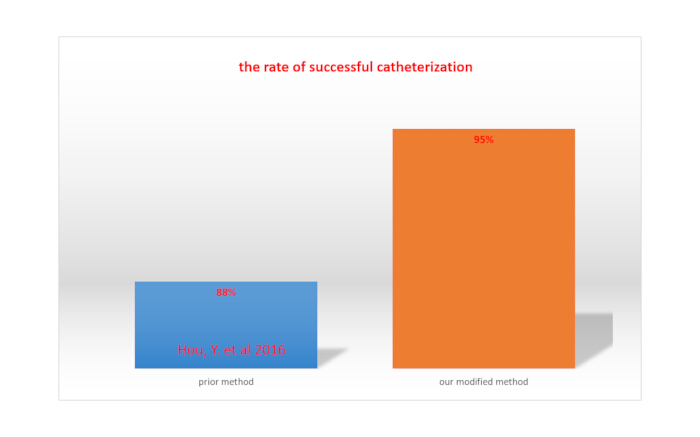
Рисунок 4. Сравнение частоты успешной катетеризации между нашим модифицированным методом и ранее описанным методом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
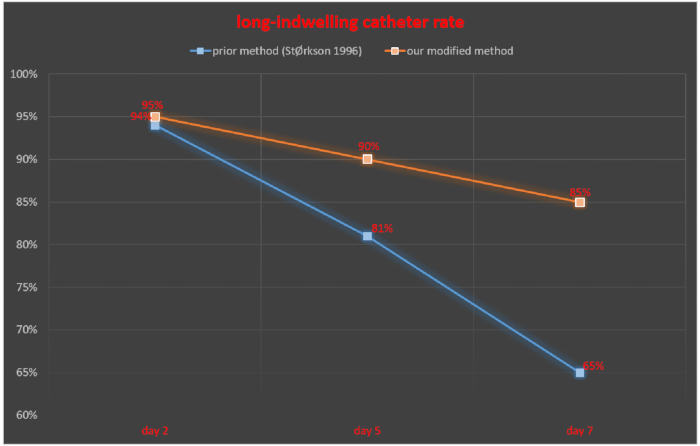
Рисунок 5. Сравнение частоты длительно пребывания катетера между нашим модифицированным методом и ранее описанным методом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Модифицированный метод | Предыдущий метод | Преимущества модифицированного метода | Недостатки предыдущего метода | |
| Метод ведения для введения | проволока из нержавеющей стали | Направляющая канюля (20G 0,9× 38 мм) | Повышает эластичность трубки, | Сопротивление трудно почувствовать, что увеличивает сложность эксплуатации |
| Повышает вероятность успешности интратекальной катетеризации | Повреждение тканей из-за повторного прокола | |||
| Снижает потребность в рабочем пространстве | Один конец трубки растягивается в 1,5 раза от первоначальной длины, что делает диаметр обоих концов разным | |||
| Минимизирует повреждение тканей вокруг поясничного отдела позвоночника | Подверженность утечке спинномозговой жидкости из-за того, что диаметр направляющей канюли 20G в 2 и более раз больше диаметра растянутой трубки PE10 | |||
| Длина трубки PE10 | 15 см | 14 или 28 см | Легко определить длину трубки PE10 независимо от продолжительности пребывания катетера | Продолжительность пребывания катетера короче при более короткой трубке PE10; подверженность выпадению из тела для длинной трубки PE10 |
| Метод фиксации | «8» шов и 4 раза | 1 или 2 бусины | Предотвращает смещение и втягивание трубки во время работы с животными | Разница в диаметре трубки с обоих концов и подверженность смещению трубки из ПЭ10 при изготовлении бисера |
| Метод герметизации труб | Самодельный колпачок | Нет | Предотвращает подтекание спинномозговой жидкости | Требование повторной резки трубы PE10 |
| Позволяет избежать многократного разрезания трубы PE10 | ||||
| Метод профилактики ретракции | Антиаллергенная лента | 1 или 2 бусины | Предотвращает втягивание трубки во время деятельности животного | Склонность к ретракции |
Таблица 1. Преимущества и недостатки модифицированного метода и ранее описанного метода.
Обсуждение
Есть несколько важных советов для этого модифицированного метода, чтобы максимизировать вероятность успеха интратекальной катетеризации. Сначала следует подготовить проволоку из нержавеющей стали длиной 20 см с двумя полированными концами, которая должна быть вставлена в трубку PE10 в качестве опоры. Во-вторых, оператор должен полностью обнажить вывернутую V-образную область после очистки межпозвоночного пространства L5-6 ватным тампоном, а межпозвоночное пространство должно быть расширено с помощью других щипцов при подъеме спинного отростка L5 зубчатыми щипцами. В-третьих, трубка ПЭ10 должна быть зафиксирована швом в виде цифры 8 четыре раза. Наконец, экстракорпоральный конец пробирки PE10 следует обвязать лентой и запечатать самодельным колпачком.
Успешность интратекальной катетеризации и повреждение тканей вокруг тел позвонков могут существенно повлиять на достоверность экспериментальных результатов15. Таким образом, максимально возможное повышение коэффициента успеха и уменьшение повреждения окружающих тканей имеют решающее значение для создания животных моделей исоответствующих экспериментов. В этом модифицированном методе проволока из нержавеющей стали вставляется в трубку PE10 для наведения, что увеличивает эластичность трубки и улучшает вероятность успешности интратекальной катетеризации. Кроме того, количество пространства, необходимого для операции, уменьшается с помощью этого модифицированного метода, а повреждение тканей вокруг поясничного отдела позвоночника сводится к минимуму, поскольку окружающие ткани тупо разделяются, но не разрезаются. Для сравнения, в ранее описанном способе11 для снижения сопротивления во время пункции используется направляющая канюля 20 G, и часто требуется повторная пункция, которая может повредить ткани. Кроме того, в ранее описанном способе для уменьшения диаметра трубки PE10 ее погружают в теплую воду (60°C), а затем растягивают с одного конца примерно на 150% от первоначальной длины, что может не обеспечить постоянство диаметра трубки и, следовательно, может вызвать утечку спинномозговой жидкости, поскольку диаметр направляющей канюли 20G примерно в два раза больше или равен диаметру растянутой трубки PE10. Более того, в нашем методе функция поясницы сохраняется в наибольшей степени, что позволяет избежать влияния хирургического вмешательства на результаты последующих экспериментов. Эти результаты согласуются с результатами, представленными Xu et al. 2.
В ранее описанном способе11 длина трубки PE10 составляет приблизительно 14 см, если трубка зафиксирована в месте вокруг места прокола, но время пребывания катетера часто короче 7 дней в этих условиях (или трубка извлекается из тела крысой). Длина трубки PE10 составляет примерно 28 см, если трубка закреплена в задней части горловины, что значительно длиннее, чем используемая в нашем методе трубка PE10 (15 см). Несмотря на то, что бусины были сформированы в соответствии с протоколом, описанным Størkson et al.11, некоторые трубки были удалены из организма, и только около 65% трубок были все еще зафиксированы на месте через 7 дней после операции, что значительно повлияло на результаты последующих экспериментов. В нашем методе трубка ПЭ10 фиксируется швом в виде фигуры 8 4 раза, а экстракорпоральный конец трубки ПЭ10 перевязывается лентой для уменьшения возможности смещения и втягивания. Следуя нашему методу, примерно 85% труб оставались на месте через 7 дней после операции, и примерно 80% труб оставались на месте через 28 дней после операции.
В ранее описанном способе11 экстракорпоральный кончик интратекального катетера должен быть отрезан при каждом введении препарата. Однако повторное интратекальное введение лекарств может сократить время пребывания катетера в организме, что делает интратекальное введение лекарств неудобным. Поэтому в нашем методе для герметизации пробирки PE10 используется самодельный колпачок, который стерилизуется этанолом один раз в день. Это не только предотвращает утечку спинномозговой жидкости, но и снижает необходимость многократного разрезания трубки ПЭ10 для интратекального введения лекарственных препаратов, обеспечивая эффективную доставку лекарственных препаратов.
Преимущества и недостатки модифицированного метода и ранее описанного метода обобщены в таблице 1. Во-первых, при модифицированном методе использование проволоки из нержавеющей стали в трубке PE10 повышает эластичность трубки и улучшает вероятность успешности интратекальной катетеризации, уменьшается количество пространства, необходимого для операции, и сводится к минимуму повреждение тканей вокруг поясничного отдела позвоночника. При использовании ранее описанного метода направляющая канюля 20G вводится до тех пор, пока не будет ощущаться сопротивление, и часто требуется повторный прокол, что может привести к повреждению тканей. Кроме того, трубка PE10 на одном конце растягивается до тех пор, пока ее длина не достигнет примерно 150% от первоначальной длины, что может привести к утечке спинномозговой жидкости, поскольку диаметр направляющей канюли 20G в 2 раза больше или равен диаметру растянутой трубки PE10. Во-вторых, в модифицированном методе длина трубки PE10 определяется до операции, а время пребывания катетера в катетере может превышать одну неделю. При использовании ранее описанного метода длина трубки PE10 составляет примерно 14 см, если она зафиксирована в месте прокола, но время нахождения катетера часто короче 7 дней, поскольку трубка подвержена вытягиванию крысы из тела; длина трубки PE10 составляет примерно 28 см, если она закреплена в задней части горлышка, что значительно больше, чем длина трубки, используемой в нашем методе. В-третьих, при модифицированном методе трубка ПЭ10 фиксируется швом в виде фигуры-8 4 раза для предотвращения смещения и втягивания трубки; Для герметизации трубки ПЭ10 используется самодельный колпачок, который не только предотвращает утечку спинномозговой жидкости, но и предотвращает необходимость повторного разрезания трубки ПЭ10. При использовании ранее описанного метода трудно получить бусины с одинаковым диаметром, смещение трубки из ПЭ10 является обычным явлением при формировании бусин, и часто требуется повторная резка трубки ПЭ10. Наконец, при модифицированном способе экстракорпоральный конец трубки PE10 обвязывается лентой, которая предотвращает втягивание трубки во время движения. Однако в предыдущем методе бусины не могут надежно предотвратить втягивание трубки PE10, поскольку трудно получить бусины с одинаковым диаметром.
В целом, этот модифицированный метод интратекальной катетеризации имеет следующие преимущества. Во-первых, использование проволоки из нержавеющей стали в трубке PE10 повышает эластичность трубки и улучшает вероятность успешности интратекальной катетеризации, уменьшается объем пространства, необходимого для операции, и сводится к минимуму повреждение тканей вокруг поясничного отдела позвоночника, что в максимально возможной степени сохраняет функцию поясничного отдела и позволяет избежать влияния хирургического вмешательства на результаты последующих экспериментов. Во-вторых, трубка ПЭ10 фиксируется швом в форме восьмерки 4 раза, что предотвращает смещение трубки и втягивание во время движения. В-третьих, для герметизации трубки PE10 используется самодельный уплотнительный колпачок, который не только предотвращает утечку спинномозговой жидкости, но и предотвращает необходимость повторного разрезания трубки PE10. Многократное перерезание катетера может привести к укорочению катетера, что делает доставку лекарств неудобной. Наконец, экстракорпоральный конец трубки PE10 перевязывается антиаллергенной лентой, которая предотвращает втягивание трубки во время движения.
Тем не менее, существует несколько ограничений в этой модифицированной технике интратекальной катетеризации. Во-первых, после операции крысы должны содержаться отдельно (по одному в клетке), чтобы избежать повреждения экстракорпорального конца трубки PE10. Во-вторых, необходимо восстановление в течение 5-7 дней после интратекального введения лидокаина перед последующими экспериментами.
В заключение следует отметить, что этот модифицированный метод интратекальной катетеризации может служить полезным инструментом для повторного интратекального введения лекарственных препаратов и представлять собой простой, удобный и надежный способ сократить продолжительность экспериментов.
Раскрытие информации
Авторы данной рукописи заявляют об отсутствии конфликта интересов.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук (No 81971042) и Проектами специалистов по ключевой поддержке Шанхайской районной комиссии по здравоохранению Хункоу (No 15). HKZK2020A06).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 cc syringe | Jiangxi Hongda Medical Equipment Co., Ltd | 1 cc | |
| 22 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 22G | |
| 23 gauge × 1” needles | Jiangxi Hongda Medical Equipment Co., Ltd | 23G | |
| 25 μL Hamilton Syringes | Shanghai Bolige Co.,Ltd | 0.31mm 25 μL | |
| 4-O MERSILK NON-ABSORBABLE SUTURE | ETHICON | SA83G | |
| 50 mL corning centrifuge tubes 3 cm diameter | 430820 | CORNING | |
| Epidural catheter and connector | Henan Tuoren Medical Device Co., Ltd | regular type | |
| Gavage apparatus | Shanghai Bolige Co.,Ltd | 8# | |
| PE-10 Mirco Medical Tubing | BB31695-PE/1 | Scientific Commodities, Inc | |
| Scalpel handle and #10 blades | Jiangsu Songxin Medical Equipment Co., Ltd | 125mm | |
| Scissors | Jiangsu Songxin Medical Equipment Co., Ltd | 100mm | |
| Sprague-Dawley (SD) rats | Shanghai BK/KY Biotechnology Co., Ltd | Male | |
| Stainless steel wire 0.2 mm diameter | Dongguan Jiazhi Metal Products Technology Co., Ltd. | 0.2mm × 1m | |
| Toothed forceps | Jiangsu Songxin Medical Equipment Co., Ltd | 18cm | |
| URGO silk tape | URGO | 1.25cm × 9.1m |
Ссылки
- Kong, G., Huang, Z., Zhu, Q., Wan, Y. Comparison of two modified methods of intrathecal catheterization in rats. Exp Anim. 69 (2), 219-223 (2020).
- Xu, C. S., Sun, P., Lin, C. a new design puncture needle and a device of microcatheter protection for lumbar intrathecal catheterization in rats. Zhongguo Ying Yong Sheng Li Xue Za Zhi. 36 (3), 283-288 (2020).
- Yamamoto, G., et al. Neurosteroid dehydroepiandrosterone sulphate enhances pain transmission in rat spinal cord dorsal horn. Br J Anaesth. 123 (2), e215-e225 (2019).
- Mattioli, T. A., Sutak, M., Milne, B., Jhamandas, K., Cahill, C. M. Intrathecal catheterization influences tolerance to chronic morphine in rats. Anesth Analg. 114 (3), 690-693 (2012).
- Wang, B. C., Hillman, D. E., Li, D., Turndorf, H. Lumbar subarachnoid catheterization in rats. Pharmacol Biochem Behav. 38 (3), 685-688 (1991).
- Yaksh, T. L., Rudy, T. A. Chronic catheterization of the spinal subarachnoid space. Physiol Behav. 17 (6), 1031-1036 (1976).
- Martin, H., Kocher, L., Chery-Croze, S. Chronic lumbar intrathecal catheterization in the rat with reduced-length spinal compression. Physiol Behav. 33 (1), 159-161 (1984).
- Mazur, C., et al. Development of a simple, rapid, and robust intrathecal catheterization method in the rat. J Neurosci Methods. 280, 36-46 (2017).
- Zhang, S. X., Huang, F., Gates, M., White, J., Holmberg, E. G. Extensive scarring induced by chronic intrathecal tubing augmented cord tissue damage and worsened functional recovery after rat spinal cord injury. J Neurosci Methods. 191 (2), 201-207 (2010).
- Ohara, P. T. Long-term intrathecal catheterization in the rat. J Neurosci Methods. 110 (1-2), 81-89 (2001).
- StØrkson, R. V., KjØrsvik, A., TjØlsen, A., Hole, K. Lumbar catheterization of the spinal subarachnoid space in the rat. J Neurosci Methods. 65 (2), 167-172 (1996).
- Poon, Y. Y., Chang, A. Y., Ko, S. F., Chan, S. H. An improved procedure for catheterization of the thoracic spinal subarachnoid space in the rat. Anesth Analg. 101 (1), table of contents 155-160 (2005).
- Xu, F., Li, T., Zhang, B. An improved method for protecting and fixing the lumbar catheters placed in the spinal subarachnoid space of rats. J Neurosci Methods. 183 (2), 114-118 (2009).
- Igawa, Y., Andersson, K. E., Post, C., Uvelius, B., Mattiasson, A. A rat model for investigation of spinal mechanisms in detrusor instability associated with infravesical outflow obstruction. Urol Res. 21 (4), 239-244 (1993).
- Hou, Y., et al. A modified procedure for lumbar intrathecal catheterization in rats. Neurol Res. 38 (8), 725-732 (2016).
- Farhadi, E., et al. Comparison of open and ultrasound-guided placement of central venous catheter in children weighing less than five kilograms; a randomized clinical trial. Acad Radiol. 30 (7), 1419-1425 (2023).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены