Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение микротвердости зубов и альвеолярной кости на моделях заболеваний полости рта грызунов
В этой статье
Резюме
Микротвердость — это механическое свойство и информативный параметр для оценки патофизиологии твердых тканей. Здесь мы демонстрируем стандартизированный протокол (подготовка образцов, полировка, плоская поверхность и участки вдавливания) для анализа микротвердости зубов и альвеолярной кости на моделях заболеваний полости рта грызунов, а именно флюороз зубов и лигатурно-индуцированная резорбция пародонтальной кости.
Аннотация
Механические свойства, микротвердость, оцениваются в зубной эмали, дентине и кости на моделях заболеваний полости рта, включая флюороз зубов и пародонтит. Микро-КТ (μКТ) предоставляет 3D-визуализацию информации (объем и минеральная плотность), а сканирующая электронная микроскопия (СЭМ) создает изображения микроструктуры (эмалевая призма и костная лакуна-каналикулярная). В дополнение к структурному анализу с помощью μCT и SEM микротвердость является одним из информативных параметров для оценки того, как структурные изменения изменяют механические свойства. Несмотря на то, что это полезный параметр, исследования микротвердости альвеолярной кости при заболеваниях полости рта ограничены. На сегодняшний день сообщалось о расходящихся методах измерения микротвердости. Поскольку значения микротвердости варьируются в зависимости от подготовки образца (полировка и плоская поверхность) и места вдавливания, различные протоколы могут привести к расхождениям между исследованиями. Стандартизация протокола микротвердости имеет важное значение для последовательной и точной оценки в моделях заболеваний полости рта. В настоящем исследовании мы демонстрируем стандартизированный протокол анализа микротвердости зубов и альвеолярной кости. Использовались следующие образцы: для модели флюороза зубов резцы собирали у мышей, обработанных фторсодержащей водой или без нее в течение 6 недель; для модели лигатурно-индуцированной резорбции пародонтальной кости (L-PBR) альвеолярные кости с резорбцией пародонтальной кости были собраны у мышей, перевязанных на2-м моляре верхней челюсти. Через 2 недели после перевязки была собрана верхняя челюсть. Твердость по Виккерсу анализировали в этих образцах по стандартизированному протоколу. Протокол предоставляет подробные материалы и методы для внедрения смолы, серийной полировки и вдавливания резцов и альвеолярных отверстий. Насколько нам известно, это первый стандартизированный протокол микротвердости для оценки механических свойств зуба и альвеолярной кости в моделях заболеваний полости рта грызунов.
Введение
Твердость является одним из механических свойств (например, эластичность, твердость, вязкоупругость и поведение при разрушении) и обычно используется для характеристики способности противостоять деформации при сжатии и разрушению локальной области материала. Статический тест на твердость при вдавливании является наиболее часто используемым методом, включая твердость по Виккерсу и твердость по Кнупу1. Испытание на твердость по Виккерсу осуществляется путем вдавливания алмазного индентора в поверхность под действием фиксированной испытательной нагрузки. Индентор имеет форму пирамиды, с квадратным основанием и углом 136° между противоположными гранями. Измеряется длина обеих диагоналей, сформированных на поверхности испытания, и среднее значение используется для расчета твердости, которая определяется отношением F/A (где F — сила, а A — площадь поверхности вдавливания). Число микротвердости по Виккерсу (HV = F/A) обычно выражается в килограммах-силе (кгс) на мм2 вдавливания, при этом 1 HV ≈ 0,1891 F/d2 (N/мм2). Твердость по Кнупу также состоит из алмазного квадратного пирамидального индентора, образованного двумя неравными противоположными углами. Число твердости Кнупа (HK) равно отношению приложенной нагрузки к проектируемой площади контакта. Испытания на твердость подразделяются на испытания на микровдавливание (микротвердость) и испытания на макровдавливание в зависимости от силы, приложенной к испытуемому материалу. При испытаниях на микроиндентирование обычно используются нагрузки в диапазоне 0,01-2 Н (около 1-203 гс); в то же время в тестах с макроиндентированием используется более 10 Н (10119 gf)1.
Для оценки особенностей твердых тканей зубов при заболеваниях полости рта, включая зубы и альвеолярную кость, для структурного анализа используют микро-КТ (μКТ) и сканирующую электронную микроскопию (СЭМ). μКТ предоставляет информацию 3D-визуализации (объем и минеральная плотность)2, а СЭМ создает изображения микроструктуры (призма эмали и костная лакуна-каналик)3. В дополнение к структурному анализу с помощью μCT и SEM, микротвердость является одним из информативных параметров для оценки того, как структурные изменения изменяют механические свойства зуба и альвеолярной кости при заболеваниях полости рта, например, при пороках развития эмали и резорбции кости пародонта. Значение микротвердости по Виккерсу эмали человека (HV = 283-374) примерно в 4-5 раз выше, чем у дентина (HV = 53-63)4,5. В моделях флюороза зубов грызунов микротвердость эмали значительно снижается в резцах мышей, обработанных фтором (HV = 136), по сравнению с контрольной эмалью (HV = 334)6,7. Это говорит о том, что фторизованная эмаль мягче и слабее с меньшим содержанием минералов и более высоким содержанием белка, чем в нефторизованной эмали. Микротвердость используется для оценки механических свойств кости. В нескольких предыдущих исследованиях изучалось механическое поведение человеческой кости из различных анатомических участков, включая микротвердость длинной кости 8,9,10. Средняя микротвердость фторированных бедренных костей человека показала значительное снижение (HV = 222,4) по сравнению с нефторированными бедренными копытами (HV = 294,4)11. Несмотря на то, что это полезный параметр, существует мало литературы, описывающей микротвердость (либо по Виккерсу12, либо по Кнупу 13,14) альвеолярной кости при заболеваниях полости рта.
На сегодняшний день сообщалось о расходящихся методах измерения микротвердости. Поскольку значения микротвердости варьируются15 в зависимости от подготовки образца (полировка и плоская поверхность) и места вдавливания, различные протоколы могут привести к расхождениям между исследованиями. Стандартизация протокола определения микротвердости имеет важное значение для последовательной и точной оценки в моделях заболеваний полости рта. В настоящем исследовании мы демонстрируем стандартизированный протокол анализа микротвердости зубов и альвеолярной кости в модели флюороза зубов мышей и модели резорбции костной ткани пародонта.
протокол
Все процедуры, описанные в этом протоколе, были выполнены в соответствии с руководящими принципами и правилами использования позвоночных животных, утвержденными Комитетом по институциональному уходу за животными (IACUC) в Университете Огасты и в Юго-Восточном университете Нова, который аккредитован Международной ассоциацией по оценке и аккредитации ухода за лабораторными животными (AAALAC). Обратите внимание, что доктор Судзуки работал в Университете Огасты, где были завершены эксперименты по флюорозу зубов у мышей.
1. Удаление резцов нижней челюсти на модели флюороза зубов мыши
- Кормите мышей C57BL/6 (5-недельный самец) кормами без фтора за 1 неделю до приема фтора и до прекращения лечения фтором.
- Приготовьте фторсодержащую воду, добавив NaF в дистиллированную воду с последующей вакуумной фильтрацией с помощью фильтра 0,2 мкм. Давать животным фторсодержащую воду в виде NaF (0 ppm и 125 ppm; N=5/группа) ad libitum в течение 6 недель. Заменяйте фторсодержащую воду свежеприготовленной партией каждые 2 дня.
- После 6 недель обработки фторсодержащей водой усыпляют животных сСО2 с последующим обезглавливанием.
- Извлеките получелюстную челюсть резцом от каждой мыши. Чтобы собрать получелюсть резцом, разрежьте мышцы вокруг нижней челюсти, не прикладывая чрезмерной силы.
- Поместите получелюстную челюсть в PBS и поддерживайте ее при температуре 4 °C до μ-КТ-анализа (по желанию). Отделите резец от нижней челюсти с помощью скальпеля (#15) и ножниц, не повреждая и не ломая образец.
- Изолированный резец промыть PBS и провести обезвоживание, погрузив его в спирт возрастающей крепости (70% и 100% этанол) на 2-3 ч.
Примечание: Если ткань (например, пульпа) недостаточно обезвожена, пропитка смолой, вероятно, будет ингибирована, и последующая оценка, вероятно, будет неадекватной. - После обезвоживания этанолом заделайте резец горизонтально в смолу. Перейдите к шагу 3.
2. Извлечение верхнечелюстных альвеолярных костей в модели мышиной резорбции пародонтальной кости (L-PBR), индуцированной лигатурой
- Введите 0,8 мл кетамина (100 мг/мл) + 0,1 мл ксилазина (100 мг/мл) + 9,1 мл PBS внутрибрюшинно (в/в) мышам (C57BL/6, 8-12 недель, самец) в качестве анестетиков. Дозировка составляет 0,01 мл/г (вес). Нанесите офтальмологическую мазь на оба глаза, чтобы предотвратить сухость под анестезией.
- Поместите мышь под наркозом на грелку на 5-10 минут. Оцените реакцию на защемление хвоста/пальца ног и сохранность глазного рефлекса. Убедитесь, что мышь не реагирует на вредные раздражители и рефлекс отсутствует.
- Поместите мышь на лечебный стол и держите рот открытым с помощью шелкового шва лигатуры 5-0, привязанного к магнитному столбу на процедурном столе.
- Под хирургическим микроскопом намотать лигатуру (плетеный шелковый шов 6-0) вокруг одной стороны второго моляра верхней челюсти (один слой) с помощью микроиглодержателей. Сведите к минимуму индивидуальные различия в анализе, используя одну сторону в качестве стороны лечения, а другую сторону в качестве контроля.
- Завяжите лигатуру и завяжите узел на нёбной стороне. После завязывания узла обрежьте оставшуюся лигатуру как можно короче, чтобы излишняя лигатура не мешала жевать или есть. Это важно для того, чтобы лигатура не ослабла при жевании в течение последующего периода наблюдения.
ПРИМЕЧАНИЕ: Не оставляйте животное без присмотра, пока оно не придет в сознание, достаточное для поддержания лежачего положения грудины. Не возвращайте животное, перенесшее операцию, в компанию других животных до полного выздоровления. Поддерживайте стерильные условия во время выживания. - Кормите мышей рационом и водой в течение 2 недель. После 2 недель лигирования усыпить мышей с CO2 с последующей обезглавливанием.
- Извлеките обе боковые верхние челюсти (лигатурную сторону и контрольную сторону) коренными зубами от каждой мыши. Чтобы собрать верхние челюсти с коренными зубами, разрежьте мышцы и кость вокруг челюсти с помощью ножниц, не прикладывая чрезмерной силы. Поместите каждую верхнюю челюсть в PBS и поддерживайте ее при температуре 4 °C до анализа μCT (по желанию).
- Отделите альвеолярную кость коренными зубами (с1-го по3-й) от верхней челюсти с помощью скальпеля (#15) и ножниц, не повреждая и не ломая образец.
- Изолированную альвеолярную кость промыть PBS, затем обезвожить и обезжирить, погрузив в спирт повышенной крепости (70% и 100% этанол) на 2-3 часа.
ПРИМЕЧАНИЕ: Если ткань (например, пульпа и кость) недостаточно обезвожена, пропитка смолой, вероятно, будет ингибирована, и последующая оценка, вероятно, будет неадекватной. - После обезвоживания этанолом альвеолярную кость горизонтально погрузить в смолу. Перейдите к шагу 3.
- Дополнительно: Перед тестированием на микротвердость выполните оценку μКТ.
- Перед испытанием на микротвердость выполните неразрушающий структурный анализ (например, μCT) с использованием того же образца для определения микротвердости в качестве дополнительной оценки (Рисунок 1). Структурная информация (3D-изображение, плотность минералов, объем) с помощью μCT может помочь оценить механические свойства и качество образца, которые могут повлиять на результаты микротвердости.
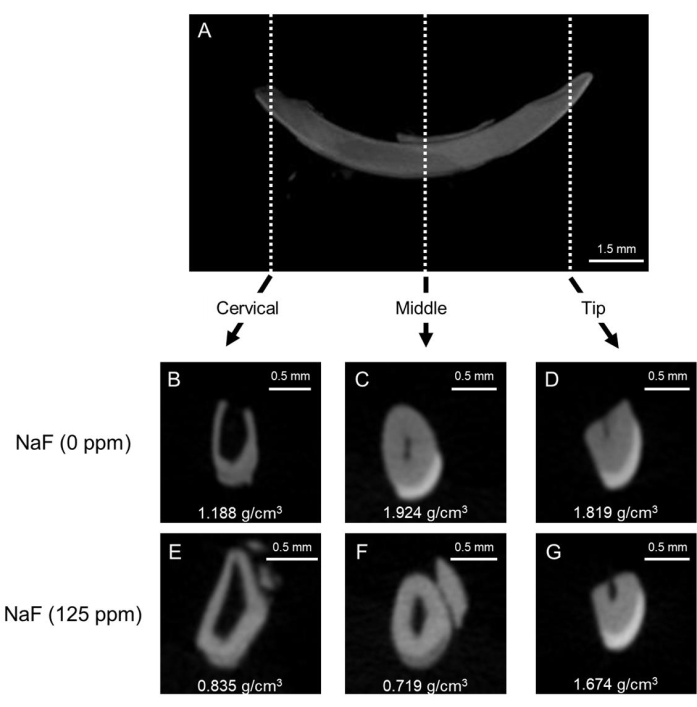
Рисунок 1: Репрезентативные μКТ-изображения эмали в резцах контрольной группы и обработанных фтором резцов мышей. (A) Репрезентативное сагиттальное изображение резца нижней челюсти. (B-D) корональные изображения контрольного резца (NaF 0 ppm). (E-G) μКТ корональных изображений резца, обработанного NaF (125 ppm). Показана репрезентативная минеральная плотность эмали (EMD) (г/см3). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
3. Погружение образцов в смолу
- Продолжайте с шага 1.7 (модель флюороза зубов) или шага 2.10 (модель L-PBR).
- Покройте внутреннюю поверхность монтажной чашки (1 дюйм) тонким слоем вазелина. Смешайте смолу (смолу для заделки холодного схватывания) в соответствии с инструкцией. Налейте смолу и отвердитель в прилагаемый пластиковый стаканчик в соотношении объема 15:2 и тщательно перемешайте деревянным шпателем не менее 2 минут. Избегайте пузырьков воздуха.
- Поместите обезвоженный и обезжиренный резец (рисунок 2A) или альвеолярную кость с коренными зубами (рисунок 2B), ориентированными горизонтально и параллельно дну монтажной чашки (1 образец на чашку).
- Налейте смешанную смолу (достаточно смолы, около 1,5 мл) в монтажную чашку, чтобы полностью покрыть образец. Избегайте добавления большего количества смолы, чем необходимо, так как избыток смолы будет препятствовать процессу полировки (Рисунок 2C,D). Поместите монтажный стакан с образцом на горячую пластину при температуре 50 °C не менее чем на 8 часов, чтобы стимулировать полимеризацию смолы. Эта процедура способствует удержанию образца в устойчивом положении.
ПРИМЕЧАНИЕ: В зависимости от размера образца отрегулируйте количество смолы, чтобы полностью покрыть образец. Не заливайте слишком много смолы, иначе потребуется больше времени, чтобы удалить лишнюю смолу. - После отверждения извлеките смолу, содержащую образец, из монтажной чашки. Удалите заусенцы и расположите плоскость образца и плоскость противоположной стороны как параллельную и плоскую с помощью усовершенствованной шлифовальной машины-полировальной машины с шероховатой водостойкой наждачной бумагой (зернистость 60/P60 и 120/P120) под заводнением водой. Держите высоту образца примерно 3 мм для резцов и альвеолярной кости (рис. 2E, F).
ПРИМЕЧАНИЕ: При анализе образца с помощью СЭМ после измерения микротвердости толщина образца должна составлять около 3 мм, чтобы последующее наблюдение СЭМ не повлияло на последующее наблюдение СЭМ. Меньшими образцами сложнее манипулировать с помощью шлифовальной машины. Для образцов, предназначенных только для микротвердости, высота образца может увеличиться примерно до 10-20 мм. - Обрежьте внешнюю форму, чтобы получить прямоугольный твердый блок смолы и закруглить углы (приблизительно, ширина 30 мм, длина 10 мм для резца (рисунок 2G) и ширина 10 мм, длина 5 мм для альвеолярной кости (рисунок 2H)) с помощью прецизионной отрезной пилы.
- После завершения грубой коррекции формы удалите мусор и частицы из блока смолы с помощью ультразвукового очистителя (около 1 минуты). Перейдите к шагу 4.

Рисунок 2: Процесс заделки и полировки смолы. (A) Обезвоженный и обезжиренный резец. (B) Обезвоженная и обезжиренная альвеолярная кость в L-PBR. (С, Г) резцы и альвеолярная кость погружены в смолу. (Е, Ж) Срезав смолу, легче отполировать целевую поверхность ткани. (Г, Н) Смоляные углы закруглены для процесса полировки. Сокращения: L-PBR = лигатурно-индуцированная резорбция пародонтальной кости. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
4. Полировка образцов
ПРИМЕЧАНИЕ: Полировка образцов производится вручную с использованием водостойкой наждачной бумаги (от грубой до более тонкой) на усовершенствованной шлифовальной машине-полировальщике под заводнением водой.
- Положите на шлифовальную машину шероховатую водостойкую абразивную бумагу (зернистость 600/P1200). Поместите обрезанный и очищенный блок смолы (из шага 3.7) на шероховатую водостойкую наждачную бумагу.
- Наливая воду, держите блок смолы и отполируйте оценочную поверхность образца на шлифовальной машине-полировальщике (скорость 1-10 x g). В это время осторожно держите блок смолы так, чтобы оценочная поверхность была параллельна земле. Чтобы поверхность оценки оставалась нетронутой, проверьте ее невооруженным глазом или под микроскопом.
ПРИМЕЧАНИЕ: Обратите внимание, что шлифовальная машина вращается по часовой стрелке, и равномерное давление может привести к непараллельной поверхности. Чтобы получить параллельную поверхность, поддерживайте постоянную скорость вращения планера и осторожно прижимайте образец в течение нескольких секунд, а затем поверните образец на 180°, чтобы прессовать в течение того же времени. Грубая наждачная бумага может удалить не только смолу, но и образец. - Замените наждачную бумагу на зернистость 800/P2400 и поместите на нее блок смолы. Повторите шаг 4.2.
- Удалите мусор и частицы из блока смолы с помощью ультразвукового очистителя (около 1 мин).
ПРИМЕЧАНИЕ: Прежде чем продолжить, рекомендуется использовать ультразвуковой очиститель для удаления любого поверхностного мусора, чтобы предотвратить засорение. - Затем выполните серийную полировку с использованием более мелкой наждачной бумаги; Порядок полировки составляет 12 μм, 9 μм, 3 μм, 1 μм и 0,3 μм.
- Поместите притирочную пленку (12 мкм) на шлифовально-полировальный стол без вращения и поместите блок смолы на притирочную пленку.
ПРИМЕЧАНИЕ: В этом эксперименте шлифовальный стол подходит для получения плоской поверхности при заводнении водой. В качестве альтернативы также можно использовать большое плоское зеркало (или аналогичное), обеспечивающее параллельность. - При водяном охлаждении тщательно отполируйте оценочную поверхность образца на притирочной пленке вручную. Перемещайте образец по вертикали, горизонтали и диагонали в течение одинакового количества секунд под впрыском воды с ходом от 2 до 3 см (1 дюйм). Когда процедура полировки выполнена правильно, образец смолы прилипает к притирочной пленке.
- Удалите мусор и частицы, как в шаге 4.4. Замените наждачную бумагу на следующий размер в соответствии с последовательным порядком полировки (от 12 μм до 0,3 μм) и поместите на нее блок смолы.
- Наливая воду, придерживайте блок смолы и тщательно отполируйте поверхность образца на притирочной пленке вручную. Удалите мусор и частицы, как в шаге 4.4.
- Повторите шаги 4,5 - 4,8, чтобы завершить окончательную полировку (0,3 μм). После завершения окончательной полировки (0,3 мкм) образец должен иметь зеркальную поверхность (рис. 3A).
- Очистите поверхность образца этанолом (100%) для обезжиривания и обезвоживания и храните блоки смолы при комнатной температуре до определения микротвердости. Во время хранения следует избегать чрезмерной влажности и пыли. Перейдите к шагу 5.
5. Тест на микротвердость по Виккерсу
ПРИМЕЧАНИЕ: Вдавливание образца зеркальной поверхности выполняется с помощью микротвердомера. Испытание проводится с нагрузкой 25 g в течение 10 с с наконечником Vickers.
- Тест на микротвердость резцов по Виккерсу (модель флюороза зубов)
ПРИМЕЧАНИЕ: Эмаль может быть разделена на три слоя от внешнего (со стороны полости рта) до внутреннего (со стороны пульпы); а именно, поверхностный слой, средний слой и глубокий слой (дентин-эмалевое соединение, DEJ) (рис. 3B)16. В этом протоколе тестируются три слоя эмали.- Установите усилие загрузки на 25 g и продолжительность заряжания на 10 с. Поместите блок смолы на сцену.
- Сделайте отступ по 6 точек в каждом слое эмали (поверхностном, среднем и DEJ) и дентине в каждой области (шейном, среднем и кончике; Рисунок 3B).
- Измерьте длину двух диагоналей (d1 и d2; Рисунок 3В) для расчета значения микротвердости по Виккерсу (HV; Рисунок 4).
- Тест на микротвердость альвеолярной кости по Виккерсу (модель L-PBR)
- Установите усилие загрузки на 25 g и продолжительность заряжания на 10 с. Поместите блок смолы на сцену.
- Отступите 3-6 точек на каждой мезиальной и дистальной стороне альвеолярной кости от альвеолярного гребня. Углубление альвеолярных костей между1-м и2-м молярами (белый квадрат) и2-м и3-м молярами.
ПРИМЕЧАНИЕ: В этом протоколе 6 точек на каждой мезиальной и дистальной стороне (всего 12 точек) были оценены для контрольной (интактной) кости, а 3 точки с каждой стороны (всего 6 точек) были оценены для L-PBR. Количество точек вдавливания зависит от условий поражения (например, слишком большая потеря костной массы ограничивает область вмятины).
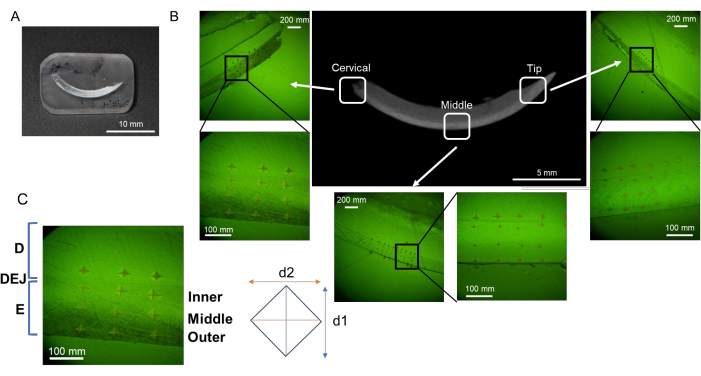
Иллюстрация 3: Оценочные области микротвердости нижнечелюстного резца. (A) Образец зеркальной поверхности, содержащий нижнечелюстной резец. (B) отступы в каждом регионе; шейный, средний и кончик (NaF 0 ppm). (С) Три слоя эмали; из DEJ, внутренней, средней и внешней эмали. Сокращения: D = дентин, E = эмаль, DEJ = соединение дентиновой эмали Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
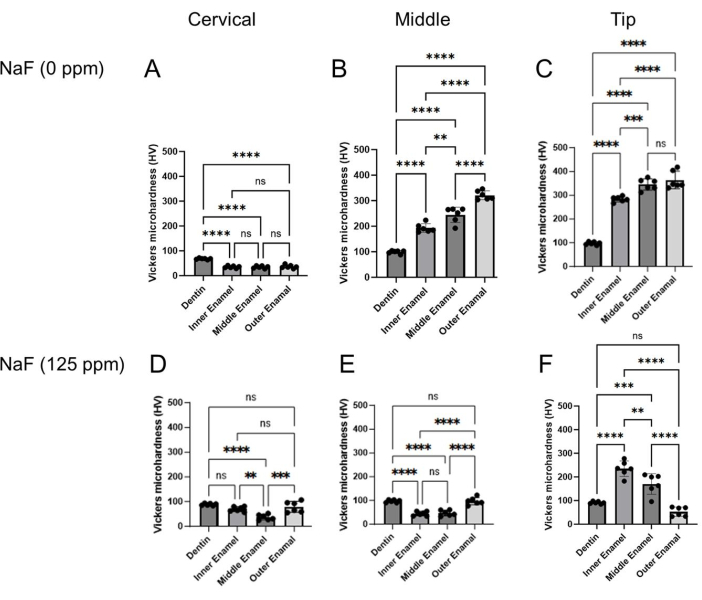
Иллюстрация 4: Микротвердость эмали по Виккерсу, обработанной с NaF или без него. Микротвердость дентина и трех слоев эмали оценивали в каждой области, шейной, средней и кончиковой области. (А-С) Контроль и обработка (D-F) NaF (125 ppm). Данные представлены в виде среднего ± SD. Достоверные различия оценивались с помощью однофакторного ANOVA с апостериорным тестом Тьюки. значения p < 0,05 считались статистически значимыми. **p < 0,005, ***p < 0,0005, ***p < 0,0001 Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Модель флюороза зубов: На рисунке 1 показаны репрезентативные КТ-изображения резцов в контрольной группе и мышей, обработанных фтором. В контроле (рис. 1B-D) в шейной области наблюдалась более низкая минеральная плотность эмали (EMD) 1,188 г/см3 (
Обсуждение
Микротвердость выполняется для оценки механических свойств твердых тканей, таких как зуб и кость. На сегодняшний день сообщалось о расходящихся методах измерения микротвердости. Большая часть информации об измерениях, особенно подготовка образцов и места вдавливания, вероятно, будет...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Исследования, представленные в этой публикации, были поддержаны JSPS KAKENHI JP21K09915 (MO) и Национальным институтом общих медицинских наук; T34GM145509 (MM) и Национальный институт стоматологических и черепно-лицевых исследований; R01DE025255 и R21DE032156 (XH); R01DE029709, R21DE028715 и R15DE027851 (ТЗ); R01DE027648 и K02DE029531 (РС).
Материалы
| Name | Company | Catalog Number | Comments |
| Braided Silk Suture 6-0 | Teleflex | ||
| Canica Small Animal Surgery System | Kent Scientific Corporation | SURGI 5001 | |
| CarbiMet PSA 120/P120 | Buehler | 30080120 | |
| CarbiMet PSA 60/P60 | Buehler | 36080060 | |
| CarbiMet PSA 600/P1200 | Buehler | 36080600 | |
| Castroviejo Micro Needle hilder | F.S.T | 12060-01 | |
| Epofix cold setting embeding Resin | Electron Microscopey Science | CAT-1237 | |
| Fisherbrand 112xx Series Advanced Ultrasonic Cleaner | Fisher Brand | FB11201 | |
| Fluoride-free Rodent diet | Bio Serv | F1515 | AIN-76A, 1/2" Pellets |
| in-vivo microCT Skyscan 1176 | Bruker | ||
| Isomet 1000 Precison saw | Buehler | MA112180 | |
| Lapping film 0.3µm | Maruto instrument co, LTD. Japan | 26-4203 | Alternative A3-0.3 SHT, 3M USA |
| Lapping film 1µm | Maruto instrument co, LTD. Japan | 26-4206 | Alternative A3-1 SHT, 3M USA |
| Lapping film 12µm | Maruto instrument co, LTD. Japan | 26-4211 | Alternative A3-12 SHT, 3M USA |
| Lapping film 3µm | Maruto instrument co, LTD. Japan | 26-4204 | Alternative A3-3 SHT, 3M USA |
| Lapping film 9µm | Maruto instrument co, LTD. Japan | 26-4201 | Alternative A3-9 SHT, 3M USA |
| Leica wild microscope | Leica | LEIC M690 | |
| Metaserv 2000 Variable speed Grinder polisher | Buehler | No: 557-MG1-1160 | |
| MicroCut PSA 1200/P2500 | Buehler | 36081200 | |
| MicroCut PSA P4000 | Buehler | 36084000 | |
| Microhardness tester, ALPHA-MHT-1000Z | PACE Technologies | ||
| SamplKups 1 inch | Buehler | No: 209178 | |
| Sodium Fluoride | Fisher Scientific | S299-100 | |
| West cott Stitch Scissor | JEDMED | Cat. #25-1180 | |
| ZooMed Repti Thern Undertank heater (U.T.H) | Zoo Med Laboratories, Inc. | RH-4 |
Ссылки
- Broitman, E. Indentation hardness measurements at macro-, micro-, and nanoscale: A critical overview. Tribol Lett. 65 (1), 23 (2017).
- Lee, M. J., et al. Sirt6 activation ameliorates inflammatory bone loss in ligature-induced periodontitis in mice. Int J Mol Sci. 24 (13), 10714 (2023).
- Min, J., et al. Investigation on the gradient nanomechanical behavior of dental fluorosis enamel. Nanoscale Res Lett. 13 (1), 347 (2018).
- Craig, R. G., Peyton, F. A. The micro-hardness of enamel and dentin. J Dent Res. 37 (4), 661-668 (1958).
- Chun, K., Choi, H., Lee, J. Comparison of mechanical property and role between enamel and dentin in the human teeth. J Dent Biomech. 5, (2014).
- Suzuki, M., Everett, E. T., Whitford, G. M., Bartlett, J. D. 4-phenylbutyrate mitigates fluoride-induced cytotoxicity in alc cells. Front Physiol. 8, 302 (2017).
- Sharma, R., et al. Assessment of dental fluorosis in mmp20 +/- mice. J Dent Res. 90 (6), 788-792 (2011).
- Wu, W. W., et al. Bone hardness of different anatomical regions of human radius and its impact on the pullout strength of screws. Orthop Surg. 11 (2), 270-276 (2019).
- Li, S., et al. Atlas of human skeleton hardness obtained using the micro-indentation technique. Orthop Surg. 13 (4), 1417-1422 (2021).
- Ibrahim, A., et al. Hardness an important indicator of bone quality, and the role of collagen in bone hardness. J Funct Biomater. 11 (4), 85 (2020).
- Vandana, K. L., Srishti Raj, B., Desai, R. Dental fluorosis and periodontium: An original research report of in vitro and in vivo institutional studies. Biol Trace Elem Res. 199 (10), 3579-3592 (2021).
- Xia, P. F., et al. Microcarriers containing "hypoxia-engine" for simultaneous enhanced osteogenesis and angiogenesis. Chemical Engineering Journal. 456, 141014 (2023).
- Chiu, R., et al. Effects of biglycan on physico-chemical properties of ligament-mineralized tissue attachment sites. Arch Oral Biol. 57 (2), 177-187 (2012).
- Leong, N. L., et al. Age-related adaptation of bone-pdl-tooth complex: Rattus-norvegicus as a model system. PLoS One. 7 (4), e35980 (2012).
- Johnson, W. M., Rapoff, A. J. Microindentation in bone: Hardness variation with five independent variables. J Mater Sci Mater Med. 18 (4), 591-597 (2007).
- Kweon, Y. S., et al. Effects of fam83h overexpression on enamel and dentine formation. Arch Oral Biol. 58 (9), 1148-1154 (2013).
- Boivin, G., et al. The role of mineralization and organic matrix in the microhardness of bone tissue from controls and osteoporotic patients. Bone. 43 (3), 532-538 (2008).
- Okamoto, M., et al. Microstructural evaluation of the mineralized apical barrier induced by a calcium hydroxide paste containing iodoform: A case report. J Endod. 2 (2), 243-251 (2024).
- Wang, Y., et al. B10 cells alleviate periodontal bone loss in experimental periodontitis. Infect Immun. 85 (9), e00335 (2017).
- Chen, Y., et al. Nlrp3 regulates alveolar bone loss in ligature-induced periodontitis by promoting osteoclastic differentiation. Cell Prolif. 54 (2), e12973 (2021).
- Robinson, J. W., et al. Male mice with elevated c-type natriuretic peptide-dependent guanylyl cyclase-b activity have increased osteoblasts, bone mass and bone strength. Bone. 135, 115320 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены