Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Иммунокомпетентная модель кишечника на чипе для анализа иммунных реакций слизистой оболочки кишечника
* Эти авторы внесли равный вклад
В этой статье
Резюме
В нашем подробном протоколе описывается создание и использование усовершенствованной модели кишечника на чипе, которая имитирует слизистую оболочку кишечника человека с помощью 3D-структур и различных типов клеток, что позволяет проводить глубокий анализ иммунных реакций и клеточных функций в ответ на микробную колонизацию.
Аннотация
Разработана усовершенствованная модель кишечника на чипе, воссоздающая эпителиальные 3D-органотипические структуры, похожие на ворсинки и крипты. Иммунокомпетентная модель включает эндотелиальные клетки пупочных вен человека (HUVEC), эпителиальные клетки кишечника Caco-2, тканевые резидентные макрофаги и дендритные клетки, которые самоорганизуются в ткани, отражая характеристики слизистой оболочки кишечника человека. Уникальным аспектом этой платформы является ее способность интегрировать циркулирующие первичные иммунные клетки человека, повышая физиологическую значимость. Модель предназначена для изучения реакции иммунной системы кишечника на бактериальную и грибковую колонизацию и инфекцию. Благодаря увеличенному размеру полости модель предлагает различные функциональные показания, такие как анализы проникновения, высвобождения цитокинов и инфильтрации иммунных клеток, а также совместима с иммунофлуоресцентным измерением 3D-структур, образованных слоем эпителиальных клеток. Таким образом, он дает всестороннее представление о дифференцировке и функционировании клеток. Платформа «кишечник-на-чипе» продемонстрировала свой потенциал в выяснении сложных взаимодействий между суррогатами живой микробиоты и тканью хозяина человека в рамках платформы микрофизиологических перфузированных биочипов.
Введение
Системы «орган на чипе» (OoC) представляют собой новую технологию 3D-клеточной культуры, способную преодолеть разрыв между традиционной 2D-культурой клеток и животными моделями. Платформы OoC обычно состоят из одного или нескольких компартментов, содержащих тканеспецифические клетки, выращенные на широком спектре каркасов, таких как мембраны или гидрогели1. Модели способны имитировать одну или несколько определенных органотипических функций. Насосы обеспечивают непрерывную микрофлюидную перфузию среды для клеточных культур для удаления продуктов клеточных отходов, снабжения питательными веществами и факторами роста для улучшения клеточной дифференцировки, а также для воссоздания необходимых условий in vivo. Благодаря интеграции иммунных клеток, системы OoC могут имитировать иммунный ответ человека in vitro2. На сегодняшний день представлен широкий спектр органов и функциональных единиц1. Эти системы включают модели сосудистой сети3, легких4, печени 2,5 и кишечника 6, которые могут быть облегчены для тестирования лекарств 5,7 и исследований инфекций 6,8.
В данной работе мы представляем модель кишечника на чипе человека, объединяющую эпителиальные клетки человека, формирующую органотипическую 3D-топографию ворсинчатых и криптоподобных структур в сочетании с эндотелиальной выстилкой и тканевыми резидентными макрофагами. Модель культивируется в микрофлюидно перфузированном биочипе в формате микроскопического предметного стекла. Каждый биочип состоит из двух отдельных микрофлюидных полостей. Каждая полость разделена пористой мембраной из полиэтилентерефталата (ПЭТ) на верхнюю и нижнюю камеры. Сама мембрана также служит каркасом для роста клеток с каждой стороны. Поры мембраны обеспечивают клеточные перекрестные помехи и миграцию клеток между клеточными слоями. Доступ к каждой камере осуществляется через два порта с гнездовым замком Люэра. Опционально дополнительный порт размером с замок мини-люэра может обеспечить доступ к верхней или нижней камере (рис. 1).
Платформа OoC предлагает ряд показаний, которые могут быть получены в результате одного эксперимента. Кишечник-на-чипе предназначен для объединения перфузионной 3D-культуры клеток, анализа сточных вод и флуоресцентной микроскопии для оценки экспрессии клеточных маркеров, скорости метаболизма, иммунного ответа, микробной колонизации и инфекции, а также барьерной функции 3,6,8. Модель включает в себя тканевые резидентные иммунные клетки и прямой контакт живых микроорганизмов с тканью хозяина, что является преимуществом по сравнению с другими опубликованными моделями9. Кроме того, эпителиальные клетки самоорганизуются в трехмерные структуры, которые обеспечивают физиологически релевантный интерфейс для колонизации живой микробиотой6.
Access restricted. Please log in or start a trial to view this content.
протокол
Этот протокол требует доступа к ~20 мл свежей крови на биочип от здоровых доноров для выделения первичных моноцитов человека. Все доноры дали письменное информированное согласие на участие в данном исследовании, которое было одобрено комитетом по этике университетской клиники Йены (номер разрешения 2018-1052-BO). Подробнее о материалах читайте в Таблице материалов. Подробно о составе всех растворов и сред см. в таблице 1.
1. Общие замечания по обращению с биочипом
- Осторожно отделите полоску резервуаров и отсоедините крышки с помощью нагретого ножа, чтобы получить отдельные резервуары и крышки. Расширьте отверстие крышки, чтобы силиконовая трубка плотно прилегала.
- Силиконовая трубка имеет внутренний диаметр 0,5 мм, является асимметричной и разделена на более длинную (20 см) и более короткую (12 см) стороны двумя перистальтическими пробками насоса. Соберите по две пробирки каждой симметрии на биочип, прикрепив трубку к замку-соединителю с наружной резьбой и крышке на противоположной стороне трубки. Также соберите четыре резервуара на каждый биочип.
ПРИМЕЧАНИЕ: Заранее подготовьте трубки и резервуары и простерилизуйте путем автоклавирования перед использованием. Поскольку силиконовая трубка имеет ограниченный срок службы, замените трубку после 3-5 экспериментов. Для определенных исследовательских интересов, таких как тестирование лекарств, рекомендуется готовить новые трубки для каждого эксперимента. Многие шаги этого протокола выполняются параллельно; обратитесь к обзорному рисунку, на котором показаны различные шаги, выполненные в один день, как показано на рисунке 2.
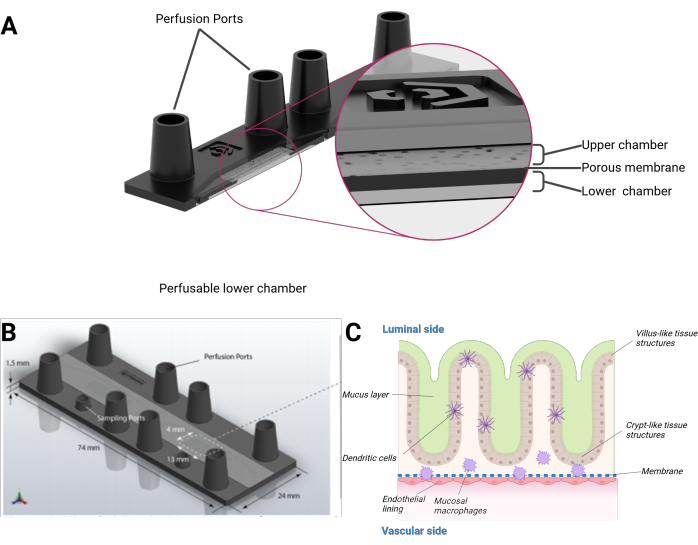
Рисунок 1: Схематическое изображение модели кишечника на чипе. (A) Биочип представлен в виде поперечного сечения. (B) Видны размеры всего биочипа, а также плоской съемной мембраны из ПЭТ. Общий объем верхней камеры, включая внутренние порты люэровского замка, составляет 290 мкл и 270 мкл для нижней камеры соответственно. (C) Можно увидеть схематическую композицию кишечного биочипа, трехмерного эпителия, напоминающего ворсинчатые и криптоподобные структуры, включая дифференцированные иммунные клетки и слой слизи. Другая сторона мембраны ПЭТ покрыта эндотелиальным монослоем. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
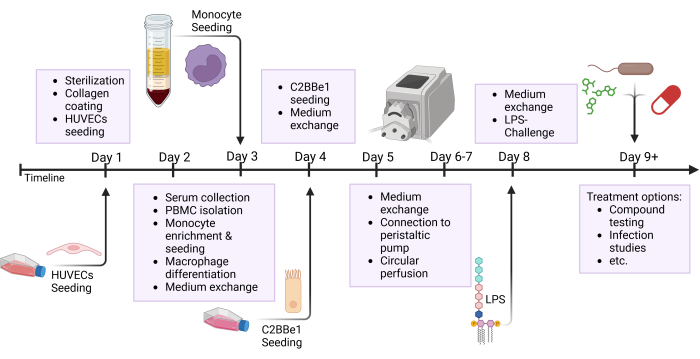
Рисунок 2: Схематический обзор графика построения модели и экспериментальной установки. На этом рисунке показан схематический обзор представленного протокола. Важные процедуры, такие как посев клеток и эпителиальная провокация с помощью ЛПС, обозначены стрелками. Сокращения: HUVECs = эндотелиальные клетки пупочных вен человека; ЛПС = липополисахарид. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Стерилизация биочипом
- Наполните стерильную стеклянную чашку Петри, обладающую диаметром 15 см, 70% неденатурированным этанолом. Поместите биочип внутрь так, чтобы все порты биочипа были полностью закрыты раствором этанола.
- Два раза на порт протяните 1 мл 70% этанола через все камеры чипа. Выдерживать в течение 45-60 мин при комнатной температуре (ОТ).
ПРИМЕЧАНИЕ: Убедитесь, что воздух не задерживается внутри биочипа. С этого момента воздух не должен попадать в систему биочипов, а полости должны оставаться заполненными жидкостью. - Удалите этанол из чашки Петри и замените его стерильной водой двойной дистилляции (ddH2O) до полного закрытия всех портов. Опять же, два раза на порт, втяните 1 мл ddH2O через полость биочипа. Освежите ddH2O в чашке Петри и повторите процедуру.
- Удалите всю жидкость из чашки Петри. После этого храните полностью стерилизованные биочипы внутри закрытой чашки Петри, когда они находятся вне стерильной среды. Добавьте в чашку Петри небольшой резервуар (например, крышку пробирки объемом 50 мл) объемом 2-5 мл ddH2O, чтобы уменьшить испарение жидкости внутри биочипа.
ПРИМЕЧАНИЕ: Биочипы можно стерилизовать за 3 дня, если они хранятся в стерильной среде до использования. Это обеспечивает гибкость рабочей нагрузки в течение одного дня.
3. Уборка и посев HUVEC
ПРИМЕЧАНИЕ: Эндотелиальные клетки пупочных вен человека (HUVECs) были выделены из пуповины в соответствии с предыдущими10.
- Перед посевом HUVEC покройте мембрану человеческим коллагеном IV. Для этого приготовьте разведение стокового раствора коллагена в соотношении 1:100 (Таблица 1) в фосфатно-солевом буфере Дульбекко, содержащем магний и кальций (PBS +/+). Добавьте 350 мкл разбавленного исходного раствора в соответствующую камеру. Инкубировать в течение 5 минут при RT.
ПРИМЕЧАНИЕ: При работе с биочипом в стерильном капюшоне мы рекомендуем поместить под него стерильную салфетку для сбора излишков среды. - Дважды промойте все камеры 350 мкл PBS +/+, чтобы вымыть остатки коллагена и уксусной кислоты. Затем добавьте по 350 мкл среды для роста эндотелиальных клеток (EC) в каждую камеру.
ПРИМЕЧАНИЕ: После этого биочипы готовы к засеванию клеток и могут храниться при температуре 37 °C до использования. - Используйте HUVEC в проходах 1-3 при 80-90% слиянии клеток. Культивируйте HUVEC в EC-среде, содержащей определенную смесь добавок, предоставленную производителем. Репрезентативное светлопольное изображение клеточной культуры HUVEC представлено на рисунке 3A.
ПРИМЕЧАНИЕ: В зависимости от донора, HUVEC высших пассажей могут начать дедифференцироваться и не могут надежно образовывать плотный и сливающийся монослой внутри биочипа. Использование антибиотиков, т.е. 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина, является необязательным, но рекомендуется в качестве добавки к ЕС-среде для предотвращения микробного загрязнения. - Извлеките питательную среду из колбы для клеточных культур T25 и осторожно промойте клетки 3-5 мл фосфатно-солевого буфера Дульбекко без магния и кальция (PBS -/-). Удалите PBS -/- и добавьте 1 мл реагента для диссоциации трипсина (Таблица 1). Инкубировать в течение 5 минут при 37 °C до тех пор, пока клетки не отделятся от колбы для клеточных культур.
- Перенесите отделенные клетки в пробирку с использованием 9 мл 5% фетальной бычьей сыворотки (FBS) в PBS -/-. Центрифугировать при 350 × г в течение 5 мин при ОТ. Удалить надосадочную жидкость, ресуспендировать в 1 мл ЕС-среды и определить количество клеток. Отрегулируйте концентрацию ячеек до 0,4 × 106 клеток на 150 μл (посев в нижнюю камеру) или на 250 μл (посев в верхнюю камеру).
- Добавьте в камеру соответствующий объем ячеек. При посеве в нижнюю камеру закройте все порты и сразу расположите биочип вверх ногами, чтобы клетки попали на мембрану ПЭТ. Инкубируйте биочипы в увлажненном инкубаторе при температуре 37 °C и 5%CO2.
- Через 24 ч проведите замену среды, содержащей HUVEC-камеру, на 350 мкл EC-среды. Среда в противоположной камере не нуждается в замене.
4. Забор сыворотки крови человека и выделение моноцитов из мононуклеарных клеток периферической крови (PBMC)
ПРИМЕЧАНИЕ: PBMC были выделены, как описано в Mosig et al.11.
- Изъятие венозной крови человека у здоровых доноров. Для каждого биочипа необходимо заготовить не менее 10 мл цельной крови в силикатсодержащих пробирках для сбора крови. После полной коагуляции центрифугируйте пробирки для сбора крови при температуре 2500 × г в течение 10 минут в режиме RT. Соберите сыворотку, аликвоту и храните при температуре -20 °C до дальнейшего использования.
- Закупите не менее 10 мл цельной крови от того же донора в пробирках для сбора крови, содержащих ЭДТА, для выделения PBMC. Осторожно перемешайте некоагулированную кровь в соотношении 1:1 с изобуфером (табл. 1) методом инверсии и медленно выложите 35 мл этой смеси поверх 15 мл градиентной среды плотности с плотностью 1,077 г/мл в пробирку объемом 50 мл.
- Центрифугируйте при 800 × г в течение 20 мин без тормоза при ЛТ. Осторожно извлеките образовавшийся слой иммунных клеток, появляющийся поверх градиентной среды плотности, и перенесите его в новую пробирку объемом 50 мл. Наполните до 50 мл холодным изобуфером и промойте ячейки путем щадящей инверсии.
- Центрифуга при 200 × г в течение 8 мин без тормоза при 4 °C. Выбросьте надосадочную жидкость и повторно суспендируйте в 10 мл изобуфера на градиент плотности. Опционально: Объединяйте PBMC одного донора, если несколько градиентов выполняются параллельно.
- Центрифуга при 150 × г в течение 8 мин при 4 °C. Выбросьте надосадочную жидкость и повторно суспендируйте гранулу в 10 мл изобуфера на градиент плотности. Повторите этап центрифугирования 4.4. Наконец, отбросьте надосадочную жидкость и ресуспендируйте клетки в 2 мл среды для дифференцировки моноцитов (табл. 1).
Примечание: Добавление M-CSF и GM-CSF усиливает дифференцировку выделенных моноцитов в макрофаги, полученные из моноцитов, и дендритные клетки, полученные из моноцитов (в комбинации с липополисахаридом [ЛПС], который добавляется в более позднем пункте данного протокола). Использование антибиотиков, т.е. 100 ЕД/мл пенициллина и 100 мкг/мл стрептомицина, является необязательным, но рекомендуется в качестве добавки к среде для предотвращения микробного загрязнения. - Определите количество клеток и затравку ~10 × 106 клеток на лунку 6-луночного планшета в 2 мл среды для дифференцировки моноцитов (табл. 1). Инкубировать в увлажненном инкубаторе при температуре 37 °C в течение 1 ч, чтобы обеспечить присоединение моноцитов к пластику 6-луночного планшета.
- Осторожно выбросьте надосадочную жидкость и промойте 2 раза предварительно подогретой 2 мл среды для гемопоэтических клеток, чтобы удалить несвязанные клетки. Инкубировать при 37 °C еще 24 ч в среде для дифференцировки моноцитов.
- Чтобы собрать моноциты, осторожно выбросьте надосадочную жидкость и промойте один раз 2 мл предварительно подогретого PBS -/-. На рисунке 3B приведен пример светлопольного изображения культуры моноцитов на данный момент. Затем инкубируйте клетки в течение 7 мин в 1 мл предварительно подогретого реагента для отслойки моноцитов (табл. 1) при 37 °С, чтобы обеспечить отслоение моноцитов от пластика 6-луночного планшета.
- Перенесите отделенные моноциты в трубку с низким уровнем связывания. Дополнительно: для достижения более высокого выхода клеток тщательно промойте 6-луночный планшет несколько раз PBS -/-.
- Центрифугировать при 300 × г в течение 8 мин при RT. Выбросьте надосадочную жидкость и повторно суспендируйте в среду, кондиционированную EC (Таблица 1). Определите количество клеток и отрегулируйте концентрацию клеток до 0,1 ×10 6 клеток на 150 мкл (затравка в нижнюю полость) или на 250 мкл (затравка в верхнюю полость).
ПРИМЕЧАНИЕ: Будьте осторожны на всех этапах выделения иммунных клеток и уменьшайте силы сдвига, чтобы предотвратить активацию иммунных клеток. При установлении этой изоляции проверьте чистоту моноцитов, полученных из PBMC (например, с помощью проточной цитометрии). Более 95% всех клеток должны быть положительными на типичные моноцитарные маркеры, такие как CD14.
5. Посев моноцитов
- В камере, содержащей HUVEC, необходимо произвести замену среды с 350 мкл предварительно подогретой среды, кондиционированной ЕС.
- Добавьте 150 мкл (нижняя камера) или 250 мкл (верхняя камера) приготовленной моноцитарной суспензии (см. шаг 4.10) в ту же камеру. При посеве в нижнюю камеру закройте все отверстия и немедленно поместите биочип вверх ногами, чтобы клетки упали на слой HUVEC. Инкубируйте биочип в увлажненном инкубаторе при температуре 37 °C и 5%CO2.
- Проводите обмен среды в камере HUVEC + с моноцитами, содержащей 350 мкл среды, кондиционированной ЕС, каждые 24 ч.
6. Уборка и посев C2BBe1
ПРИМЕЧАНИЕ: Клетки 1 (C2BBe1)12 с каймой Caco-2 используются до пассажа 35 и берутся из колб с конфлюенцией 80-90%. Репрезентативное светлопольное изображение культуры C2BBe1 представлено на рисунке 3C.
- Культивируйте клетки C2BBe1 в среде C2 (табл. 1).
ПРИМЕЧАНИЕ: Использование антибиотиков, т.е. 20 мкг/мл гентамицина, является необязательным, но рекомендуется в качестве добавки к среде С2 для предотвращения микробного загрязнения. - Удалите питательную среду из колбы для клеточных культур T25 и аккуратно промойте клетки 3-5 мл PBS -/-. Удалите PBS -/- и добавьте 1 мл реагента для диссоциации трипсина (Таблица 1). Инкубировать в течение 5 минут при 37 °C до тех пор, пока клетки не отделятся от колбы для клеточных культур.
- Перенесите отделенные клетки в пробирку, используя 9 мл 5% фетальной бычьей сыворотки (FBS) в PBS -/-. Центрифугируйте при 350 × г в течение 5 мин при RT. Удалите надосадочную жидкость, повторно суспендируйте в 1 мл С2-среды и определите количество клеток. Отрегулируйте концентрацию клеток до 0,5 × 106 клеток на 150 μл (посев в нижнюю камеру) или на 250 μл (посев в верхнюю камеру).
- Перед посевом C2BBe1 аккуратно промойте соответствующую камеру 350 μл C2-среды.
- Добавьте 150 мкл (нижняя камера) или 250 мкл (верхняя камера) приготовленной суспензии C2BBe1 (см. шаг 6.3) в соответствующую камеру. При посеве в нижнюю камеру закройте все порты и сразу расположите биочип вверх дном, чтобы клетки попали на мембрану ПЭТ. Инкубируйте биочипы в увлажненном инкубаторе при температуре 37 °C и 5%CO2.

Рисунок 3: Клеточная морфология HUVECs, моноцитов и C2BBe1 до посева в биочип. На этом рисунке показаны репрезентативные светлопольные изображения различных источников сот, используемых в протоколе. Изображения были получены с помощью обратного светлопольного микроскопа с использованием 10-кратного увеличения. Все типы клеток, (A) HUVEC, (B) моноциты и (C) C2BBe1 культивировали в культуре 2D монослойных клеток, как описано в соответствующих разделах протокола. Масштабные линейки = 200 мкм. Сокращения: HUVECs = эндотелиальные клетки пупочных вен человека; PBMCs = мононуклеарные клетки периферической крови. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
7. Подключение к перистальтическому насосу и круговой перфузии
- Подготовьте пустой инкубатор с добавлением перистальтического насоса. Тщательно очистите все зоны инкубатора и прокачайте их дезинфицирующим средством, чтобы обеспечить квазистерильную среду.
ПРИМЕЧАНИЕ: Перистальтические насосы могут выделять много тепла во время работы. В хорошо изолированных инкубаторах или лабораториях с плохим кондиционированием воздуха количество используемых насосов на инкубатор может быть ограничено, поскольку инкубаторы имеют тенденцию к перегреву. Двух перистальтических насосов на инкубатор должно быть достаточно. - Перед подключением стерилизованных пробирок к биочипу промойте каждую трубку 700 мкл PBS +/+, а затем 500 мкл среды C2 или кондиционированной ЕС. Подготовьте по одной трубке каждой симметрии для каждой среды (см. шаг 1.2). Используйте трубку с коротким расстоянием от замка Люэра до перистальтической пробки насоса для левой полости и трубку с другой симметрией для правой полости.
- Извлеките биочип из инкубатора и произведите замену среды по 350 мкл для каждой камеры. Снимите все заглушки и заполните все порты до самого верха.
- Начиная с левой полости, подсоедините первую трубку к правому порту верхней камеры, вставив адаптер люэровского замка в порт биочипа. Затем подсоедините вторую трубку к левому порту нижней камеры. Повторите эту процедуру для правой микрофлюидной полости.
- Возьмите резервуар и добавьте на дно резервуара небольшую каплю среды для клеточных культур. Затем вставьте резервуар на противоположную сторону от первой трубки и повторите для другой камеры. После того, как все порты будут подключены к трубке или резервуару, заполните резервуары 3,5 мл среды для клеточных культур.
- Поместите свободную сторону трубки, к которой прикреплена крышка, на верхнюю часть резервуара, чтобы закрыть микрофлюидную систему каждой камеры. В этом состоянии транспортируйте биочип к перистальтическому насосу.
ПРИМЕЧАНИЕ: В зависимости от расстояния до инкубатора и окружения лаборатории, для переноса чипов в инкубатор можно использовать предварительно очищенную и автоклавную коробку. - Используйте перистальтические пробки насоса для подсоединения трубки к насосу. Подсоедините каждую трубку к перистальтическому насосу таким образом, чтобы среда поступала из резервуара в полость, в трубку и через насос обратно в резервуар (рис. 4). Резервуар служит ловушкой пузырьков в круговой перфузии и предотвращает попадание воздуха в систему. Перфузируйте каждую камеру с расходом 50 мкл/мин, что приводит к напряжению сдвига 0,013 дин/см2 в верхней камере и 0,006 дин/см2 в нижней камере8.
Примечание: Если среда нижней и верхней полостей перемещается в противоположных направлениях, то может быть достигнут более высокий трехмерный рост кишечной ткани13. Таким образом, резервуары верхней и нижней полостей размещаются на противоположных сторонах (рис. 4). Круговая перфузия уменьшает количество необходимой среды для клеточных культур, но потенциально может привести к обогащению цитокинов и метаболитов. При желании также возможна линейная перфузия биочипа. - Перфузируйте биочип в течение 72 ч при 37 °C и 5%CO2.

Рисунок 4: Биочип подключен к перистальтическому насосу. Представлен пример биочипа, подключенного к перистальтическому насосу. Эпителиальные клетки C2BBe1 культивируются в нижней камере (красная C2-среда находится в резервуарах спереди), в то время как HUVEC культивируются в верхней камере (желтоватая EC-кондиционированная среда находится в резервуарах в задней части). Различные среды для клеточных культур не смешиваются из-за барьерной функции выращенной ткани. Биочип подключен к перистальтическому насосу таким образом, что среда стекает из резервуара в полость. Отсюда среда поступает обратно в резервуар через насосно-компрессорные трубы через насос. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
8. ЛПС-кондиционирование эпителиального барьера
- После 72 ч предварительной перфузии остановите перистальтический насос и снимите крышку, соединенную с трубкой каждого резервуара. Поместите его на стерильную салфетку рядом с помпой.
- Удалите всю среду и наполните резервуары 2 мл свежеприготовленной среды. Для эпителиальной стороны, содержащей C2BBe1-клетки, добавьте в среду 100 нг/мл ЛПС.
ПРИМЕЧАНИЕ: ЛПС повышает барьерную функцию ткани, стимулирует макрофаги, полученные из моноцитов, мигрировать в эпителиальную ткань и обеспечивает дифференцировку дендритных клеток, полученных из моноцитов. - Подсоедините трубки и крышки к резервуару и продолжайте круговую перфузию со скоростью потока 50 мкл/мин в течение еще 24 часов.
ПРИМЕЧАНИЕ: С этого момента модель чипа может быть использована в экспериментах - тестировании соединений или исследованиях инфекций. Мы рекомендуем подмена среды в размере 2 мл на резервуар каждые 24 часа.
9. Доступ к ткани для различных методов считывания
- Соберите надосадочную жидкость для клеточных культур из резервуаров в течение всего периода перфузии. Откройте резервуар и наберите нужный объем (см. пункты 8.1-8.3). Используйте эти надосадочные жидкости для обнаружения метаболитов, цитокинов или других молекул.
- Чтобы получить доступ к ткани, с помощью скальпеля сделайте точный разрез по внешней стороне верхней камеры и снимите связующую фольгу, чтобы открыть микрофлюидную полость. Ткань модели кишечного биочипа теперь доступна. Аккуратно разрежьте вдоль внешней стороны микрофлюидной камеры, чтобы отсоединить мембрану от биочипа. Соберите тканесодержащую мембрану с помощью пинцета.
ВНИМАНИЕ: Помните о расположении пальцев во время этого шага и тщательно работайте, чтобы предотвратить несчастные случаи. Рекомендуется использовать перчатки, устойчивые к порезам. - В качестве альтернативы можно собрать клетки из отдельных слоев внутри биочипа с помощью ферментных растворов, т.е. трипсина или клеток, лизированных с помощью буферов, содержащих Triton X-100.
10. Оценка проницаемости с помощью диффузии FITC-декстрана
ПРИМЕЧАНИЕ: Барьерная функция ткани может быть проанализирована с помощью анализа проницаемости FITC-декстрана после отсоединения перистальтического насоса. Оценка проницаемости FITC-декстрана была адаптирована из Deinhardt-Emmer et al.4.
- Приготовьте стоковый раствор флуоресцеина изотиоцианата (ФИТК)-декстрана (молекулярная масса 3-5 кДа, табл. 1).
- Опорожните резервуары и отсоедините чип от перфузии.
- Проведите замену среды в верхней и нижней камере с фенольной средой, не содержащей красных.
ПРИМЕЧАНИЕ: Этот шаг не является необходимым, если во время эксперимента уже использовалась среда, не содержащая фенола красного. - Добавьте 350 мкл 1 мг/мл раствора ФИТК-декстрана в камеру, содержащую клетки C2BBe1.
- Закройте порты и инкубируйте чип в течение 60 минут при температуре 37 °C эпителиальной стороной вверх.
- По истечении времени инкубации соберите питательную среду из обеих камер чипа отдельно и храните при температуре 4 °С, в защищенном от света месте до начала измерения.
- Для измерения необходимо подготовить стандартную кривую в среде C2 и кондиционированной EC среде без фенольного красного в диапазоне от 1 000 мкг/мл до 0 мкг/мл FITC-декстрана с 11 последовательными последовательными разведениями 1:2.
- Перелейте по 200 мкл каждого образца в черную 96-луночную пластину с прозрачным дном. Измерьте флуоресценцию с помощью микропланшетного ридера на длине волны возбуждения 495 нм и длине волны излучения 517 нм.
- Используйте стандартную кривую для расчета концентрации FITC-декстрана в образцах и, следовательно, коэффициента проницаемости.
11. Иммунофлюоресцентное окрашивание
ПРИМЕЧАНИЕ: Живая ткань может быть исследована под микроскопом. Для более удобного обращения мы рекомендуем отсоединение биочипа от перистальтического насоса и использование дальних объективов на инвертированном микроскопе. В качестве анализа конечной точки ткань может быть зафиксирована внутри биочипа для таких процедур, как иммунофлуоресцентное окрашивание.
- Остановите перистальтический насос и откройте резервуары всех полостей. Опорожните резервуары и отсоедините трубки, а также резервуары от биочипа.
- Дважды в каждой камере промойте микрофлюидные полости 500 μл холодного PBS +/+. Добавьте 500 μL ледяного метанола во все полости и инкубируйте в течение 15 минут при температуре -20 °C. Затем дважды на полость промойте микрофлюидную камеру 500 мкл PBS +/+.
ПРИМЕЧАНИЕ: Другие методы фиксации, такие как фиксация 4% параформальдегидом или фиксатором Карнуа, также подходят. После фиксации чипы можно хранить при температуре 4 °C или приступать непосредственно к иммунофлуоресцентному окрашиванию. ВНИМАНИЕ: Фиксирующие химические вещества, такие как метанол или параформальдегид, токсичны. Выполняйте соответствующие задачи под вытяжным шкафом и собирайте отходы соответствующим образом. - Откройте чип, как описано в шаге 9.2, чтобы получить доступ к ткани. Разрежьте тканесодержащую ПЭТ-мембрану на три части для окрашивания параллельно различными иммунопанелями.
- С помощью прецизионного пинцета перенесите каждый из кусочков мембраны на отдельную 24-луночную пластину, содержащую блокирующий и проникающий раствор (Таблица 1). Следите за тем, чтобы интересующий нас слой клеток всегда был обращен вверх в течение всего процесса окрашивания. Инкубируйте кусочки мембраны в течение 30 минут при RT.
ПРИМЕЧАНИЕ: Наилучшие результаты окрашивания получаются при сопоставлении сыворотки с вторичным антителом. Например, если вторичные антитела получены из козьих видов, мы рекомендуем использовать обычную козью сыворотку. - Переложите кусочки мембраны на чистое предметное стекло внутри влажной камеры. Приготовьте первичную панель антител в окрашивающем растворе (Таблица 1) и добавьте 50 мкл на каждый кусочек мембраны. Выдерживать в течение ночи при температуре 4 °C.
ПРИМЕЧАНИЕ: Оптимальная концентрация антител и эффективность окрашивания могут различаться у разных производителей и клонов. Мы рекомендуем предварительно протестировать окрашивающие панели в 2D-культуре клеток. - После инкубации переложите образцы в 24-луночный планшет и аккуратно промойте мембраны в течение 3 х 5 мин промывочным раствором (Таблица 1).
- Снова перенесите кусочки мембраны на чистое предметное стекло внутри влажной камеры. Приготовьте вторичную панель антител в окрашивающем растворе (Таблица 1) и добавьте 50 мкл на каждый кусочек мембраны. При необходимости добавьте ядерное противопятно, например, 4',6-диамидино-2-фенилиндол (DAPI) или Hoechst. Инкубировать в течение 30 минут при RT.
ПРИМЕЧАНИЕ: При работе с флуорофорами храните образцы в защищенном от света месте, чтобы предотвратить фотообесцвечивание и повысить качество изображения. - После инкубации переложите образцы в 24-луночный планшет и аккуратно промойте мембраны 2 х 5 мин промывочным раствором (Таблица 1). Затем умыться один раз PBS +/+ в течение 5 минут.
- Закрепите детали мембраны на чистом предметном стекле с помощью флуоресцентного монтажного носителя и покровного стекла. Хранить при температуре 4 °C до получения микроскопической визуализации.
Access restricted. Please log in or start a trial to view this content.
Результаты
Эти репрезентативные результаты показывают различные слои тканей модели «кишечник-на-чипе». Они окрашены иммунофлуоресцентно, как описано в разделе 11 протокола. Изображения были получены с помощью эпифлуоресцентного или конфокального флуоресцентного микроскопа в виде z-стеков и обр?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
В представленном протоколе подробно описаны необходимые шаги для создания иммунокомпетентной модели кишечника на чипе. Мы описали конкретные методы и возможные методы считывания, такие как иммунофлуоресцентная микроскопия, анализ цитокинов и метаболитов, проточная цитометрия, белк?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
М.Р. является генеральным директором Dynamic42 GmbH и владеет акциями компании. A.S.M. является научным консультантом компании Dynamic 42 GmbH и владеет акциями компании.
Благодарности
Работа была выполнена при финансовой поддержке Центра совместных исследований PolyTarget 1278 (номер проекта 316213987) для V.D.W. и A.S.M. A.F. и A.S.M. также выражают финансовую поддержку со стороны Кластера передового опыта «Баланс микровселенной» в соответствии со стратегией превосходства Германии - EXC 2051 - Project-ID 690 390713860. Мы выражаем признательность Астрид Таннерт и Йенской лаборатории биофотоники и визуализации (JBIL) за предоставленный нам доступ к их конфокальному лазерному сканирующему микроскопу ZEISS LSM980. Рисунок 1C и рисунок 2 были созданы с помощью Biorender.com.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 96-well plate black, clear bottom | Thermo Fisher | 10000631 | Consumables |
| Acetic acid | Roth | 3738.4 | Chemicals |
| Alexa Fluor 488 AffiniPure, donkey, anti-mouse IgG (H+L) | Jackson Immuno Research | 715-545-150 | Secondary Antibody Vascular Staining and Epithelial Staining |
| Alexa Fluor 647 AffiniPure, donkey, anti-rabbit IgG (H+L) | Jackson Immuno Research | 711-605-152 | Secondary Antibody Epithelial Staining |
| Alexa Fluor 647, donkey, anti-rabbit IgG (H+L) | Thermo Fisher Scientific, Invitrogen | A31573 | Secondary Antibody Vascular Staining |
| Axiocam ERc5s camera | Zeiss | 426540-9901-000 | Technical equipment |
| Basal Medium MV, phenol red-free | Promocell | C-22225 | Cell culture consumables |
| Biochip | Dynamic 42 | BC002 | Microfluidic consumables |
| BSA fraction V | Gibco | 15260-037 | Cell culture consumables |
| C2BBe1 (clone of Caco-2) | ATCC | CRL-2102 | Epithelial Cell Source |
| Chloroform | Sigma | C2432 | Chemicals |
| CO2 Incubator | Heracell | 150i | Technical equipment |
| Collagen IV from human placenta | Sigma-Aldrich | C5533 | Cell culture consumables |
| Coverslips (24 x 40 mm; #1.5) | Menzel-Gläser | 15747592 | Consumables |
| Cy3 AffiniPure, donkey, anti-goat IgG (H+L) | Jackson Immuno Research | 705-165-147 | Secondary Antibody Vascular Staining |
| Cy3 AffiniPure, donkey, anti-rat IgG (H+L) | Jackson Immuno Research | 712-165-150 | Secondary Antibody Epithelial Staining |
| Descosept PUR | Dr.Schuhmacher | 00-323-100 | Cell culture consumables |
| DMEM high glucose | Gibco | 41965-062 | Cell culture consumables |
| DMEM high glucose w/o phenol red | Gibco | 31053028 | Cell culture consumables |
| DPBS (-/-) | Gibco | 14190-169 | Cell culture consumables |
| DPBS (+/+) | Gibco | 14040-133 | Cell culture consumables |
| EDTA solution | Invitrogen | 15575-038 | Cell culture consumables |
| Endothelial Cell Growth Medium | Promocell | C-22020 | Cell culture consumables |
| Endothelial Cell Growth Medium supplement mix | Promocell | C-39225 | Cell culture consumables |
| Ethanol 96%, undenatured | Nordbrand-Nordhausen | 410 | Chemicals |
| Fetal bovine Serum | invitrogen | 10270106 | Cell culture consumables |
| Fluorescein isothiocyanate (FITC)-dextran (3-5 kDa) | Sigma Aldrich | FD4-100MG | Chemicals |
| Fluorescent Mounting Medium | Dako | S3023 | Chemicals |
| Gentamycin (10mg/mL) | Sigma Aldrich | G1272 | Cell culture consumables |
| GlutaMAX Supplement (100x) | Gibco | 35050061 | Cell culture consumables |
| Histopaque | Sigma-Aldrich | 10771 | Cell culture consumables |
| Hoechst (bisBenzimid) H33342 | Sigma-Aldrich | 14533 | Epithelial Staining |
| Holotransferrin (5mg/mL) Transferrin, Holo, Human Plasma | Millipore | 616397 | Cell culture consumables |
| Human recombinant GM-CSF | Peprotech | 300-30 | Cell culture consumables |
| Human recombinant M-CSF | Peprotech | 300-25 | Cell culture consumables |
| Illumination device | Zeiss | HXP 120 C | Fluorescence Microscope Setup |
| Laser Scanning Microscope | Zeiss | CLSM980 | Fluorescence Microscope Setup |
| Lidocain hydrochloride | Sigma-Aldrich | L5647 | Cell culture consumables |
| Lipopolysaccharide (LPS) | Sigma | L2630 | Cell culture consumables |
| Loftex Wipes | Loftex | 1250115 | Consumables |
| Low attachment tubes (PS, 5 mL) | Falcon | 352052 | Consumables |
| Luer adapter for the top cap (M) | Mo Bi Tec | M3003 | Microfluidic consumables |
| Male mini luer plugs, row of four,PP, opaque | Microfluidic chipshop | 09-0556-0336-09 | Microfluidic consumables |
| MEM Non-Essential Amino Acids Solution | Gibco | 11140 | Cell culture consumables |
| Methanol | Roth | 8388.2 | Chemicals |
| Microscope | Zeiss | Axio Observer 5 | Fluorescence Microscope Setup |
| Microscope slides | Menzel | MZ-0002 | Consumables |
| Monoclonal, mouse, anti-human CD68 Antibody (KP1) | Thermo Fisher Scientific, Invitrogen | 14-0688-82 | Primary Antibody Vascular Staining |
| Monoclonal, rat, anti-human E-Cadherin antibody (DECMA-1) | Sigma-Aldrich, Millipore | MABT26 | Primary Antibody Epithelial Staining |
| Multiskan Go plate reader | Thermo Fisher | 51119300 | Technical equipment |
| Normal donkey serum | Biozol | LIN-END9010-10 | Chemicals |
| Optical Sectioning | Zeiss | ApoTome | Fluorescence Microscope Setup |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140-122 | Cell culture consumables |
| Plugs | Cole Parmer | GZ-45555-56 | Microfluidic consumables |
| Polyclonal, goat, anti-human VE-Cadherin Antibody | R&D Systems | AF938 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human Von Willebrand Factor Antibody | Dako | A0082 | Primary Antibody Vascular Staining |
| Polyclonal, rabbit, anti-human ZO-1 antibody | Thermo Fisher Scientific, Invitrogen | 61-7300 | Primary Antibody Epithelial Staining |
| Power Supply Microscope | Zeiss | Eplax Vp232 | Fluorescence Microscope Setup |
| Primovert microscope | Zeiss | 415510-1101-000 | Technical equipment |
| Reglo ICC peristaltic pump | Ismatec | ISM4412 | Technical equipment |
| SAHA (Vorinostat) | Sigma Aldrich | SML0061-25MG | Chemicals |
| Saponin | Fluka | 47036 | Chemicals |
| S-Monovette, 7.5 mL Z-Gel | Sarstedt | 01.1602 | Consumables |
| S-Monovette, 9.0 mL K3E | Sarstedt | 02.1066.001 | Consumables |
| Sodium Pyruvate | Gibco | 11360-088 | Cell culture consumables |
| Tank 4.5 mL | ChipShop | 10000079 | Microfluidic consumables |
| Trypane blue stain 0.4% | Invitrogen | T10282 | Cell culture consumables |
| Trypsin | Gibco | 11538876 | Cell culture consumables |
| Tubing | Dynamic 42 | ST001 | Microfluidic consumables |
| Tweezers (Präzisionspinzette DUMONT abgewinkelt Inox08, 5/45, 0,06 mm) | Roth | K343.1 | Consumables |
| Wheat Germ Agglutinin (WGA) | Thermo Fisher Scientific, Invitrogen | W32464 | Epithelial Staining |
| X-VIVO 15 | Lonza | BE02-060F | Cell culture consumables, Hematopoietic cell medium |
| Zellkultur Multiwell Platten, 24 Well, sterile | Greiner Bio-One | 662 160 | Consumables |
| Zellkultur Multiwell Platten, 6 Well, sterile | Greiner Bio-One | 657 160 | Consumables |
| Zen Blue Software | Zeiss | Version 3.7 | Microscopy Software |
Ссылки
- Alonso-Roman, R., et al. Organ-on-chip models for infectious disease research. Nat Microbiol. 9 (4), 891-904 (2024).
- Fahrner, R., Groger, M., Settmacher, U., Mosig, A. S. Functional integration of natural killer cells in a microfluidically perfused liver on-a-chip model. BMC Res Notes. 16 (1), 285(2023).
- Raasch, M., et al. Microfluidically supported biochip design for culture of endothelial cell layers with improved perfusion conditions. Biofabrication. 7 (1), 015013(2015).
- Deinhardt-Emmer, S., et al. Co-infection with Staphylococcus aureus after primary influenza virus infection leads to damage of the endothelium in a human alveolus-on-a-chip model. Biofabrication. 12 (2), 025012(2020).
- Kaden, T., et al. Generation & characterization of expandable human liver sinusoidal endothelial cells and their application to assess hepatotoxicity in an advanced in vitro liver model. Toxicology. 483, 153374(2023).
- Maurer, M., et al. A three-dimensional immunocompetent intestine-on-chip model as in vitro platform for functional and microbial interaction studies. Biomaterials. 220, 119396(2019).
- Hoang, T. N. M., et al. Invasive aspergillosis-on-chip: A quantitative treatment study of human aspergillus fumigatus infection. Biomaterials. 283, 121420(2022).
- Kaden, T., et al. Modeling of intravenous caspofungin administration using an intestine-on-chip reveals altered Candida albicans microcolonies and pathogenicity. Biomaterials. 307, 122525(2024).
- Shah, P., et al. A microfluidics-based in vitro model of the gastrointestinal human-microbe interface. Nat Commun. 7, 11535(2016).
- Jaffe, E. A., Nachman, R. L., Becker, C. G., Minick, C. R. Culture of human endothelial cells derived from umbilical veins. Identification by morphologic and immunologic criteria. J Clin Invest. 52 (11), 2745-2756 (1973).
- Mosig, S., et al. Different functions of monocyte subsets in familial hypercholesterolemia: Potential function of cd14+ cd16+ monocytes in detoxification of oxidized ldl. FASEB J. 23 (3), 866-874 (2009).
- Peterson, M., Mooseker, M. Characterization of the enterocyte-like brush border cytoskeieton of the c2bbe clones of the human intestinal cell line, caco-2. J Cell Sci. 102, Pt 3 581-600 (1992).
- Shin, W., Hinojosa, C. D., Ingber, D. E., Kim, H. J. Human intestinal morphogenesis controlled by transepithelial morphogen gradient and flow-dependent physical cues in a microengineered gut-on-a-chip. iScience. 15, 391-406 (2019).
- Kim, H. J., Ingber, D. E. Gut-on-a-chip microenvironment induces human intestinal cells to undergo villus differentiation. Integr Biol (Camb). 5 (9), 1130-1140 (2013).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab Chip. 12 (12), 2165-2174 (2012).
- Karra, N., Fernandes, J., James, J., Swindle, E. J., Morgan, H. The effect of membrane properties on cell growth in an 'airway barrier on a chip'. Organs-on-a-Chip. 5, 10025(2023).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены