Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественная оценка податливости и растяжимости нижней полой вены в модели овцы in vivo с помощью 3D-ангиографии
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол позволяет проводить in vivo количественную оценку податливости и растяжимости вен с использованием катетеризации и 3D-ангиографии в качестве процедуры выживания, что позволяет использовать ее в различных потенциальных целях.
Аннотация
Синтетические сосудистые трансплантаты преодолевают некоторые проблемы, связанные с аллотрансплантатами, аутотрансплантатами и ксенотрансплантатами, но часто являются более жесткими и менее податливыми, чем нативный сосуд, в который они имплантируются. Соответствие соответствию нативному сосуду становится ключевым свойством для успеха трансплантата. Текущий золотой стандарт оценки соответствия судна требованиям включает в себя иссечение сосуда и двухосные механические испытания ex vivo . Мы разработали метод in vivo для оценки податливости и растяжимости вен, который лучше отражает естественную физиологию и учитывает влияние изменения давления, вызванного текущей кровью и любыми присутствующими морфологическими изменениями.
Этот метод разработан как процедура выживания, облегчающая продольные исследования и потенциально снижающая потребность в использовании животных. Наш метод включает в себя введение болюса с концентрацией физиологического раствора 20 мл/кг в венозную сосудистую сеть с последующим получением 3D-ангиограмм до и после болюса для наблюдения за изменениями, вызванными болюсом, одновременно с измерением внутрисосудистого давления в целевых областях. Затем мы можем измерить окружность и площадь поперечного сечения сосуда до и после болюса.
С помощью этих данных и внутрисосудистого давления мы можем рассчитать податливость и растяжимость с конкретными уравнениями. Этот метод был использован для сравнения податливости и растяжимости нижней полой вены у местных неоперированных овец с каналом овец, которым был имплантирован долгосрочный трансплантат из политетрафторэтилена (ПТФЭ). Было обнаружено, что нативный сосуд более податлив и растяжим, чем фторопластовый трансплантат во всех измеряемых местах. Мы приходим к выводу, что этот метод безопасно обеспечивает in vivo измерения податливости и растяжимости вен.
Введение
Пациенты с критическими аномалиями сердца нуждаются в реконструктивной хирургии. Большинство реконструктивных операций требуют использования протезных материалов, в том числе сосудистых трансплантатов. Потенциальными каналами для преодоления этого пространства являются синтетические или биологические материалы. Первоначально гомотрансплантаты использовались в качестве канала Фонтена, но с тех пор от них отказались из-за высокой частоты кальцификации и инцидентов острой фазы1. В настоящее время используются синтетические сосудистые трансплантаты, полученные из неорганических полимеров. Остается проблема, заключающаяся в том, что эти трансплантаты менее податливы, чем нативный сосуд, в который они имплантированы, и имеют долгосрочные осложнения, такие как стеноз, окклюзия и кальцификация 1,2,3,4,5.
Структура синтетических сосудистых трансплантатов обеспечивает механическую прочность на разрыв, что приводит к их неизменно более низкой податливости по сравнению с нативнойтканью2. Сосудистая податливость, определяющая изменение объема сосуда при изменении давления, служит индикатором реакции сосуда на механические нагрузки. Разница между материалом трансплантата и свойствами нативного сосуда создает несоответствие податливости, которое, как было продемонстрировано, нарушает характер кровотока, что приводит к образованию зон рециркуляции и разделения потока 2,6,7,8,9. Это явление изменяет напряжение сдвига на эндотелиальной стенке и вызывает гиперплазию интимы 2,7,8,9. Такие ответы могут привести к осложнениям, связанным с трансплантатом, что потребует замены трансплантата или повторного вмешательства6.
Поскольку податливость сосудов играет ключевую роль в определении исходов трансплантата, точное измерение этого свойства имеет важное значение. В настоящее время золотым стандартом для измерения податливости сосудов являются трубчатые двухосные механические испытания ex vivo . Этот метод включает в себя иссечение исследуемого трансплантата или сосуда, его подключение к латексным трубкам и нагнетание давления для оценки поведения кольцевого напряжения-растяжения при различных давлениях. Податливость определяется путем сравнения давления с измерением внутреннего диаметра10. Однако методы ex vivo имеют некоторые недостатки. При оценке функциональности имплантированных графтов методом ex vivo необходимо жертвовать животными и эксплантировать графты, что делает невозможным проведение длительных обследований. Поэтому мы разработали протокол измерения соответствия in vivo .
Наша группа специализируется на разработке тканеинженерных сосудистых трансплантатов (TEVG) для использования в хирургии Фонтена для улучшения врожденного порока сердца и синдрома гипоплазии левых отделов сердца (HLHS). Последние разработки в области хирургии врожденных пороков сердца улучшили послеоперационные результаты, что привело к увеличению продолжительности жизни. Это делает долгосрочные свойства и успех имплантированного сосудистого канала все более важными. В настоящее время не существует животной модели СГЛОС, поэтому мы оцениваем наши трансплантаты в ускоренной модели интерпозиционного трансплантата нижней полой вены крупного животного (IVC). Хотя эта модель не пытается создать течение циркуляции Фонтена, она эффективно повторяет уникальные гемодинамические условия. Недавнее использование нами этого протокола in vivo продемонстрировало значительные различия в податливости трансплантата между нашим TEVG и обычными трансплантатами из расширенного политетрафторэтилена (ПТФЭ)11. Поскольку это предыдущее исследование не было сосредоточено на методологии, мы провели дополнительные эксперименты, подробно описывающие этот новый метод in vivo .
Мы имплантировали синтетический трансплантат, который в настоящее время служит стандартом лечения, состоящий из расширенного политетрафторэтилена (ПТФЭ), у исследуемых животных из Дорсета и сравнили его с нативным НПВ у хирургически наивных контрольных животных. Данный протокол был выполнен на группе ПТФЭ через 5-7 лет после имплантации кондуита ПТФЭ и неоперированных контрольных животных различного возраста. Таким образом, в последующих разделах, описывающих протокол и репрезентативные результаты, мы будем иногда ссылаться на интересующую область, как, например, середину области трансплантата (мидграфта) интерпозиционного трансплантата IVC.
Этот протокол позволяет нам анализировать in vivo соответствие трубопровода из ПТФЭ, о котором известно, что он не соответствует требованиям в долгосрочной перспективе, с нативной жилой. Мы решили сравнить клинический стандартный материал, ПТФЭ, с нативной неоперированной веной. Мы выбрали долгосрочный временной момент, потому что известно, что трубопровод из ПТФЭ остается несоответствующим требованиям и склонен к образованию накипи, что еще больше снижает его соответствие11. Мы решили проводить все сравнения in vivo, поскольку системные гемодинамические изменения точно отражаются в измерениях, полученных с помощью методов in vivo. В результате этого сравнения мы обнаружили, что этот протокол способен подтвердить несоответствие ПТФЭ и получить измерения податливости вен in vivo безопасным и воспроизводимым способом. Этот метод был успешно реализован в опубликованном исследовании, чтобы продемонстрировать статистически значимые различия между кондуитами ПТФЭ и тканеинженерными сосудистыми трансплантатами (TEVG) in vivo11.
Общая цель этого протокола заключается в расчете податливости и растяжимости грудного НПВ в модели крупного животного овцы с использованием измерений in vivo в рамках процедуры выживания. С этой целью мы визуализировали и измерили изменения окружности и площади поперечного сечения грудного НПВ в сосудистый болюс. Мы одновременно измерили внутрисосудистое изменение давления и использовали эти измерения для расчета податливости и растяжимости. Использование 3D-ангиографии дает нам множество преимуществ, в том числе возможность корректировать вид изображения после захвата, чтобы гарантировать, что наши измерения проводятся от поперечного сечения вены, а также позволяет нам измерять несколько мест вдоль сосуда. Тремя областями, представляющими интерес в этом исследовании, были область мидграфта, а также два смежных участка анастомоза трансплантата из ПТФЭ и сопоставимые участки в нативной НПВ. Проведение экспериментов in vivo дает преимущества в оценке функциональности трансплантатов в пределах фактического потока крови и в окружении тканей и органов. Считается, что измерения, полученные с помощью этого метода, отражают фактическую функциональность трансплантатов в живом организме.
Протокол разделен на шесть основных разделов, включая предпроцедурную подготовку овец, катетеризацию, сбор исходных данных до болюса, сбор данных исследования, восстановление животных и анализ данных. В разделе, посвященном подготовке животных, мы обсуждаем седацию, инициацию анестезии и размещение оборудования для мониторинга, используемого во время процедуры катетеризации. Во втором разделе мы объясняем процесс установки двух оболочек катетера, необходимых для сбора данных. В соответствии с этим протоколом оба тубуса помещаются в правую внутреннюю яремную вену (IJV), чтобы позволить ввести в сосуд два многодорожечных катетера. Один из них будет расположен в интересующей области для регистрации изменения давления, а другой будет размещен ниже в вене для введения контрастного вещества. После установки катетеров для сравнения берется базовый предболюсный 3D-ангиограф. Сбор данных исследования начинается с подготовки болюса физиологического раствора в системе мешков под давлением для введения, обеспечения болюса физиологического раствора с регистрацией внутрисосудистого давления и снятия постболюсного 3D-ангиографа. Затем мы опишем процесс, облегчающий восстановление овец после протокола. Наконец, мы обсудим метод получения правильных изображений и поперечных измерений для анализа и статистического сравнения.
протокол
Протокол исследования был одобрен Комитетом по уходу за животными и их использованию Национальной детской больницы Исследовательского института Эбигейл Векснер (AR22-0004). Все животные получили гуманный уход в соответствии с Руководством по уходу за лабораторными животными и их использованию, опубликованным Национальными институтами здравоохранения.
1. Подготовка животных
- За 1 неделю до катетеризации ветеринарная бригада проведет осмотр овец, включая физический осмотр и анализ жизненно важных показателей, чтобы убедиться, что животное может безопасно получать анестезию.
- Голодайте на животном в течение ночи или за 12 часов до процедуры, чтобы ограничить риск аспирации содержимого желудка при индукции анестезии.
- Нажмите кнопку включения на панели управления , чтобы включить С-дугу и систему 3D-ангиографии (рис. 1A). Дождитесь полной загрузки системы.
ПРИМЕЧАНИЕ: Убедитесь, что рентгеноскопия приостановлена до тех пор, пока она не будет готова к получению изображения, и что весь персонал носит защитный провод. - Приготовьте гепаринизированный физиологический раствор для использования в процедуре путем добавления 1 мл гепарина (концентрация 1000 единиц USP/мл) к 1000 мл 0,9% физиологического раствора.
- Выбрейте левую сторону шеи и протрите спиртом. Вводите седативный эффект путем инъекции комбинации кетамина (4 мг/кг), буторфанола (0,1 мг/кг) и диазепама (0,5 мг/кг) в левую яремную вену.
- Положите овцу под действием седативных препаратов на больничную койку и положите ее в лежачее положение на грудине для интубации. Интубируйте с помощью эндотрахеальной трубки (ЭТ) диаметром 9-14 мм, в зависимости от размера овцы, надавливая на язык и надгортанник с помощью ларингоскопа и вводя трубку ЭТ в трахею.
- Расположите овцу в правильном боковом положении. Подключите трубку ET к аппарату искусственной вентиляции легких и проводите механическую вентиляцию со 100% кислородом со скоростью 1-3 л/мин.
- Поддерживайте анестезию с помощью 1-3% ингаляционного изофлурана. Установите частоту дыхания на уровне 15-30 вдохов/мин и конечный дыхательный объем на уровне 8-10 мл/кг.
- Установите стандартное оборудование для мониторинга, в том числе манжету для измерения артериального давления на правую переднюю ногу, ушной зажим для контроля насыщения кислородом на правом ухе, датчик температуры в пищевод и монитор концевого приливногоCO2 на трубке ET. Сбрейте шерсть с хвостовой стороны каждого копыта между прибылыми когтями и пяткой. Установите узлы электрокардиограммы (ЭКГ) и закрепите узлы ЭКГ лентой.
- Смажьте оба глаза, нанеся офтальмологическую мазь, и вставьте орогастральный зонд, чтобы обеспечить эвакуацию газов и пищи.
- Установите внутривенную капельницу в левом IJV, чтобы обеспечить введение пропофола для инфузии с постоянной скоростью (CRI) (20-40 мг∙кг-1∙ч-1), поддерживающих жидкостей (10 мл∙кг-1∙ч-1) и болюсного введения физиологического раствора.
- Расположите овцу в левом боковом положении лежа. Побрейте правую сторону шеи, чтобы получить доступ к месту катетеризации (рисунок 2A). Промокните область скрабом с хлоргексидином и спиртом.
- Отключитесь от оборудования для мониторинга и аппарата искусственной вентиляции легких и переместите овец на лабораторный стол для катетеризации. Опять же, расположите животное в левом боковом лежачем положении (рисунок 3А).
- Снова подключите аппарат искусственной вентиляции легких и оборудование для мониторинга (провода ЭКГ, датчик температуры, манжету для измерения артериального давления, пульсоксиметр).
- Поддерживайте анестезию во время процедуры, вводя ингаляционный изофлуран 1-3% со 100%О2 и/или пропофол CRI (20-40 мг∙кг-1∙ч-1).
ПРИМЕЧАНИЕ: Оцените уровень анестезии, измеряя движения животного, реакцию на болевые раздражители, частоту дыхания, пульс и артериальное давление. При необходимости внесите коррективы в седацию, например, используя болюс пропофола в дозе 5-10 мл для индуцирования более глубокой плоскости анестезии. - Измерьте ширину овцы в области сердца с помощью больших штангенциркулей. Разделите ширину на 2, чтобы установить датчик давления.
- Асептически очистите место операции и задрапируйте его стерильным способом (рис. 2B,C).
2. Катетеризация
- Переместите С-образную стрелку из положения стоянки на грудь овцы и при необходимости поднимите стол. Нажмите кнопки 7 и 3 на панели управления, а затем удерживайте кнопку «Пуск », чтобы использовать предварительно запрограммированные настройки для автоматического позиционирования стола и С-дуги с левой стороны стола (рис. 1A).
- Доступ к нужному IJV осуществляется с помощью иглы для микропрокола 21 G и шприца Luer Slip объемом 10 куб. см; доступ к IJV в краниальном/каудальном направлении через кожу, оттягивая поршень шприца. Убедитесь, что кровь отсасывается, чтобы подтвердить, что игла находится в сосуде (рисунок 2А, В).
- Осторожно отсоедините шприц, удерживая иглу неподвижно.
- Вставьте направляющую проволоки из нержавеющей стали (SS) диаметром 0,018 дюйма через иглу в сосуд примерно наполовину. Извлеките иглу из-за проволоки из нержавеющей стали.
- Поместите 5-французский (Fr) расширитель на проволоку из нержавеющей стали и поместите его в сосуд. Снимите внутреннюю часть расширителя и провод из нержавеющей стали. Проведите проводник диаметром 0,038 дюйма через расширитель в сосуд примерно наполовину и снимите расширитель.
- С помощью скальпеля с 11 лезвиями разрежьте кожу над веной, где входит проволока. Подайте оболочку 9-Fr через направляющую проволоку внутрь сосуда. Снимите внутреннюю часть оболочки и направляющую проволоку.
- Подтвердите правильность установки тубуса, аспирировав кровь, а затем промойте тубус гепаринизированным физиологическим раствором.
- Повторите шаги 2.2-2.7 так, чтобы в правой IJV было два оболочки 9-Fr.
- Введите 150 ЕД/кг гепарина через внутривенное введение для предотвращения свертывания.
- Используйте ножную педаль, чтобы начать рентгеноскопию (рисунок 1B). Введите правый катетер Джадкинса (JR) через тубус, следуя за грудным НПВ через диафрагму в брюшную НПВ.
- Проденьте проволоку Розена через катетер JR до тех пор, пока она не достигнет абдоминального IVC и кончик не выйдет из катетера JR. Удерживая провод Розена на месте, осторожно извлеките катетер JR.
- Повторите шаги 2.10-2.11 со вторым чехлом.
- Наденьте катетер 7-Fr Multitrack на каждый провод Розена.
- Под контролем рентгеноскопии поместите один многоканальный ангиографический катетер в брюшную полость IVC для введения контрастного вещества.
- С помощью рентгеноскопии поместите еще один многоканальный ангиографический катетер в конкретную область интереса (например, в центр трансплантата) для измерения давления (рис. 2C).

Рисунок 1: Панель управления. (A) Панель управления системой 3D-ангиографии (B) Ножные педали для рентгеноскопии Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
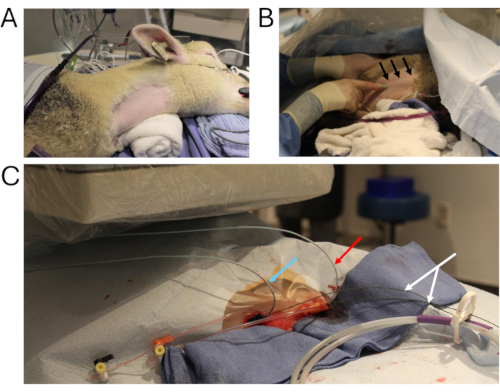
Рисунок 2: Катетеризация животных. (A) Ключевое хирургическое место, подготовленное к катетеризации. (Б) Техника визуализации правой внутренней яремной вены (черные стрелки). (C) Два многодорожечных ангиографических катетера помещаются через правую внутреннюю яремную вену (синяя стрелка: измерение давления в трансплантате; красная стрелка: введение контраста в брюшную НПВ; белая стрелка: жесткие провода). Сокращение: IVC = нижняя полая вена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Сбор предварительной информации
- Подключите мультидорожечную дорожку, центрированную в интересующей области, к преобразователю давления с помощью трехпозиционного запорного крана. Открыв запорный кран для мультигусеничного устройства, оттяните его назад с помощью шприца объемом 10 мл до тех пор, пока не будут удалены пузырьки воздуха и не будет видна кровь.
- Перевернув шприц объемом 10 мл вверх дном, верните кровь овце с осторожностью, чтобы не вытолкнуть воздух обратно в мультигусеницу. Промойте мультидорожечку гепаринизированным физиологическим раствором.
- Переверните запорный кран в выключенное положение на шприце так, чтобы датчик давления и мультигусеничный кран были открыты друг для друга.
- Подготовьте инъектор контрастного вещества, добавив контрастное вещество. Минимальный объем для 3D ангиограммы составляет 60 мл, а общий контраст не может превышать 5 мл/кг или 250 мл.
- Подсоедините инжектор контрастного вещества к многодорожечному НПВ, центрированному в брюшной полости. С помощью контрастного инжектора медленно поворачивайте ручку против часовой стрелки, чтобы вытянуть пузырьки воздуха из мультидорожечника, пока не станет видно кровь. Поверните ручку по часовой стрелке, чтобы медленно продвигать контраст вперед в мультидорожечную ленту.
- Используйте рентгеноскопию, чтобы подтвердить, когда контраст достиг кончика мультидорожек.
- Возьмите общий контраст, используемый для 3D-ангиограммы, и разделите на 5, чтобы получить мл/с. Установите подъем скорости на 0 и 600 фунтов на квадратный дюйм.
- Установите С-дугу в запрограммированный режим, нажав кнопку « Программа» в правой верхней части экрана и кнопку 3D DSA 110 8'' (3D-ангиография с SID 110 см и Field View на 8 дюймов).
- Отодвиньте все предметы и людей подальше от передней или боковой части стола. Запустите программу C-Arm, нажав кнопку под номером 3 на панели управления. Расположите целевую область (например, мидграфт) в центре плоскости x-y (рисунок 3A-C).
- Перейдите ко второй программе, нажав кнопку под номером 4 на панели управления. Отрегулируйте высоту стола соответствующим образом, чтобы центрировать интересующую область.
- Нажмите кнопку под номером 5 и сделайте тестовое изображение.
- Предварительно проверьте диапазон движений С-дуги, нажав кнопку «Подтвердить условия» | Начало (Рисунок 3D,E).
- Попросите анестезиолога провести вентиляцию легких и сделать 3D ротационную ангиограмму с введением контраста, запустив программу средней педалью захвата. Одновременно измеряйте и записывайте среднее давление в целевом регионе.
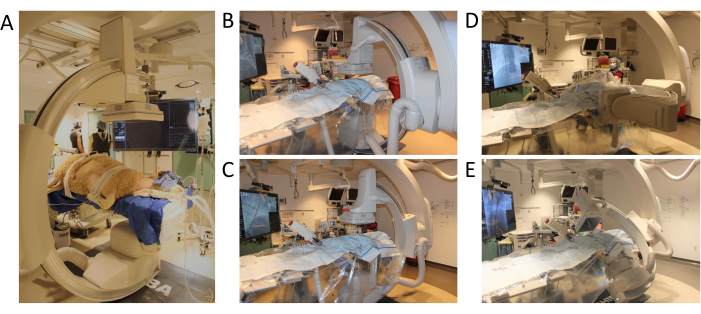
Рисунок 3: Положение С-дуги и диапазон движения. (A) Положение овцы в начале процедуры (B) Первое положение для программы 3D-ангиограммы (C) С-рука перемещена по оси xy (D) С-рука перемещена по оси Z (E) С-рука завершает тестовое вращение с полным диапазоном движений. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Введение болюса физиологического раствора и сбор данных
- Подготовьте 20 мл/кг 0,9% физиологического раствора.
- Чтобы приготовить болюсный мешок под давлением, добавьте мешок объемом 1 000 мл с 0,9% физиологическим раствором в мешок под давлением. При необходимости используйте второй аппарат для достижения общего вводимого объема.
- Сжимайте колбу накачивания до тех пор, пока манометр не поднимется в зеленую зону, непосредственно перед красной линией (давление 250-300 мм рт.ст.). Промойте солевой раствор через линию и удалите пузырьки воздуха.
- Подсоедините солевой мешок под давлением к оболочке 9-Fr и поддерживайте давление 250-300 мм рт.ст., чтобы поддерживать постоянную скорость болюса. Дайте ему течь до тех пор, пока овца не получит болюс, эквивалентный 20 мл/кг, или пока среднее давление не достигнет 15 мм рт.ст.
- Пока болюс течет, ежеминутно записывайте внутрисосудистое давление в целевой области.
- Подготовьте С-дугу к проведению второй 3D-ротационной ангиографии, повторив шаги 3.9-3.12. Как только болюс закончится, прежде чем давление начнет падать, проведите вторую 3D-ангиографию и одновременное измерение внутрисосудистого давления, начав, как описано в шаге 3.13.
5. Восстановление
- После завершения визуализации верните С-дугу обратно в запрограммированное парковочное положение, введя цифру 77 и удерживая кнопку «Пуск », пока С-дуга не займет свое положение.
- Снимите катетеры для многодорожечной ангиографии и провода Розена.
- Снимите оба тубуса, оказывая прямое давление на места введения пластырем гемостаза в течение не менее 7 минут, чтобы остановить кровотечение.
- Оберните стерильный рулон марли вокруг пластырей и горлышка так, чтобы обертывание было надежно и сохраняло давление, но не слишком туго, чтобы не перекрыть кровообращение или не затруднить дыхание.
- Выключите анестетики (изофлуран и/или пропофол CRI).
- Поддерживайте овец на аппарате искусственной вентиляции легких со 100% содержаниемO2 до тех пор, пока они не начнут дышать самостоятельно.
ПРИМЕЧАНИЕ: Признаки того, что овца просыпается, включают движение, моргание, реакцию на болезненные раздражители, тонус челюсти или попытки жевать, а также дыхание без помощи аппарата искусственной вентиляции легких. - Как только овца сможет дышать самостоятельно, проведите экстубацию (удалите трубку) и удалите орогастральный зонд.
- Снимите все оборудование для мониторинга и переложите овец на больничную койку. Переместите его обратно в жилую комнату.
- Помогите овце оставаться в положении лежа на грудине или при попытке встать, пока овца не сможет самостоятельно удерживать равновесие. Не дайте им врезаться в стены.
- Как только они достаточно проснутся, дайте небольшое количество сена или зерна.
6. Анализ данных
- Экспортируйте исходные необработанные данные 3D-ангиографии из программы для визуализации ангиографии в формат файла DICOM.
- Запустите программу просмотра DICOM. Перетащите файл 3D-ангиографии в окно просмотра, чтобы открыть его (рисунок 4A).
- В программном обеспечении для просмотра DICOM выберите инструмент 3D MPR (Multi-Planar Reconstruction) для создания 3D-реконструированного вида данных ангиографии. Это позволит представить три различных 2D-вида с трех различных углов: осевой, сагиттальной (рисунок 4B) и корональной (рисунок 4C) плоскостях.
- Отрегулируйте расположение и ориентацию целевой области в сагиттальной и корональной плоскостях для достижения желаемого вертикального положения, поместив целевую область в центр и вращая направление опорных линий на каждой плоскости с помощью ручного инструмента (рис. 4D).
- С помощью инструмента «Карандаш» в средстве просмотра DICOM обведите контур стенки сосуда в осевом виде целевой области (рис. 4E). Программное обеспечение автоматически рассчитывает и показывает как площадь, так и периметр (окружность) области в центре осевого вида.
- Используйте уравнение (1) для расчета податливости, где A — площадь поперечного сечения (см2), а P — давление (мм рт.ст.):
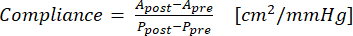 (1)
(1) - Используйте уравнение (2) для вычисления растяжимости, где C — длина окружности (см), а P — давление (мм рт. ст.):
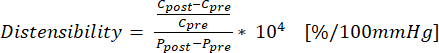 (2)
(2)
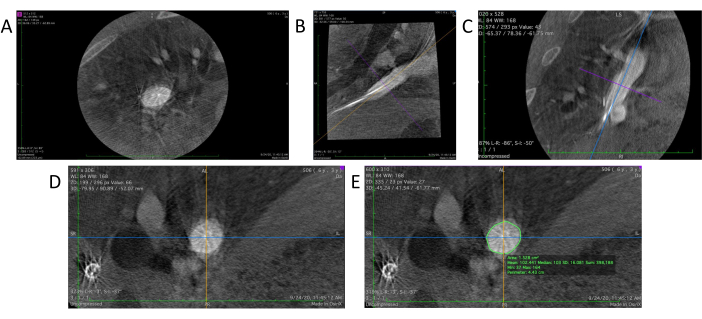
Рисунок 4: Анализ данных в DICOM-просмотрщике. (А) Исходные данные 3D ангиограммы, загруженные в DICOM-просмотрщик. (Б) Сагиттальный срез трансплантата. (В) Коронковый отдел. (D) Истинное поперечное сечение визуализируется после регулировки угла на сагиттальном и корональном срезах. (E) Инструмент «Карандаш» используется для очерчивания целевого сосуда для измерения длины окружности и площади поперечного сечения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Мы успешно провели эту процедуру с более чем 25 овцами. Важно отметить, что не было случаев заболеваемости и смертности, связанных с этой процедурой. У всех овец наблюдалось неосложненное восстановление. Эти репрезентативные результаты были получены от трех овец, которым были имплантир?...
Обсуждение
Податливость и растяжимость являются ключевыми свойствами для функции кровеносных сосудов, служащими индикаторами потенциальных осложнений и вмешательств. Точная количественная оценка и сравнение изменений этих параметров важны для оценки эффективности трансплантата. Наш метод ...
Раскрытие информации
Это исследование было частично спонсировано компанией Gunze Ltd.
Благодарности
Эта работа была поддержана R01 HL163065 и W81XWH1810518. Мы выражаем нашу признательность преданным своему делу сотрудникам Центра исследований животных. Мы также хотели бы выразить нашу благодарность Кармен Арсуага за ее бесценный опыт и бдительную заботу на протяжении всего исследования.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.035" x 260 cm Rosen Curved Wire Guide | Cook Medical | G01253 | Guide for holding placement swapping caths (Multi-track, IVUS, etc) |
| 0.035"x 150 cm Glidewire | Terumo | GR3507 | Guide for JR cath |
| 0.9% Sodium Chloride Saline | Baxter Healthcare Corporation | NCH pharmacy | For diluting norepinpherine, pressure monitoring |
| 10.0 Endotracheal tube | Coviden | 86117 | To secure airway |
| 16 G IV catheter | BD | 382259 | To administer fluids and anesthetic drugs |
| 22 G IV catheter | BD | 381423 | For invasive blood pressure |
| 5Fr x .35" JR2.5 | Cook Medical | G05035 | Guide for rosen wire |
| 70% isopropyl alcohol | Aspen Vet | 11795782 | Topical cleaning solution |
| 7Fr x 100 cm Multi-track | B. Braun | 615001 | Collecting pressure, Administering contrast to specific intravascular location |
| 9Fr Introducer sheath | Terumo | RSS901 | Access catheter through skin into vessel for wires to pass through |
| ACT cartridge | Abbot Diagnostics | 03P86-25 | Activated Clotting Time |
| Angiographic syringe w/ filling spike | Guerbet | 900103S | For contrast injector |
| Bag decanter | Advance Medical Designs, LLC | 10-102 | Punctures saline bag to pour and fill sterile bowl with saline |
| Butorphanol | Zoetis | NCH pharmacy | Sedation drug: Concentration 10 mg/mL, Dosage 0.1 mg/kg |
| Cath Research Pack | Cardinal Health | SAN33RTCH6 | Cath pack with misc. supplies |
| Cetacaine | Cetylite | 220 | Topical anesthetic spray |
| Chloraprep | BD | 930825 | Topical cleaning solution |
| Chlorhexidine 2% solution | Vedco INC | VINV-CLOR-SOLN | Topical cleaning solution |
| Conform stretch bandage | Coviden | 2232 | Neck wrap to prevent bleeding |
| Connection tubing | Deroyal | 77-301713 | Connects t-port to fluid/drug lines |
| Diazepam | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 5 mg/mL, Dosage 0.5 mg/kg |
| EKG monitoring dots | 3M | 2570 | |
| Fluid administration set | Alaris | 2420-0007 | |
| Fluid warming set | Carefusion | 50056 | |
| Hemcon Patch | Tricol Biomedical | 1102 | Patch for hemostasis |
| Heparin | Hospira, Inc | NCH pharmacy | Angicoagulant: 1,000 USP units/mL |
| Infinix-i INFX-8000C | Toshiba Medical Systems | 2B308-124EN*E | Interventional angiography system |
| Invasive pressure transducer | Medline | 23DBB538 | For invasive blood pressure |
| Isoflurane | Baxter Healthcare Corporation | NCH pharmacy | Anesthetic used in prep room |
| Ketamine | Hospira Pharmaceuticals | NCH pharmacy | Sedation drug: Concentration 100 mg/mL, Dosage 4 mg/kg |
| Lubricating Jelly | MedLine | MDS0322273Z | ET tube lubricant |
| Micropuncture Introducer Set | Cook Medical | G47945 | Access through skin into vessel |
| Needle & syringes | Cardinal Health | 309604 | For sedation |
| Norepinpherine Bitartrate Injection, USP | Baxter Healthcare Corporation | NCH pharmacy | 1 mg/mL |
| Optiray 320 | Liebel-Flarsheim Company, LLC | NCH pharmacy | Contrast |
| Optixcare | Aventix | OPX-4252 | Corneal lubricant |
| OsiriX MD | Pixmeo SARL | - | DICOM Viewer and Analysis software |
| Pressure infusor bag | Carefusion | 64-10029 | To maintain invasive blood pressure |
| Propofol | Fresenius Kabi | NCH pharmacy | Anesthetic drug: Concentration 10 mg/mL, Dosage 20-45 mg·kg-1·h-1 |
| Silk suture 3-0 | Ethicon | C013D | To secure IV catheter |
| SoftCarry Stretcher | Four Flags Over Aspen | SSTR-4 | |
| Stomach tube | Jorgensen Lab, INC | J0348R | To release gastric juices and gas and prevent bloat |
| T-port | Medline | DYNDTN0001 | Connects to IV catheter |
| Urine drainage bag | Coviden | 3512 | Connects to stomach tube to collect gastric juices |
| Warming blanket | Jorgensen Lab, INC | J1034B |
Ссылки
- Hagler, D. J., et al. Fate of the Fontan connection: Mechanisms of stenosis and management. Congenit Heart Dis. 14 (4), 571-581 (2019).
- Nezerati, R. M., Eifert, M. B., Dempsey, D. K., Cosgriff-Hernandez, E. Electrospun vascular grafts with improved compliance matching to native vessels. J Biomed Mater Res B Appl Biomater. 103 (2), 313-323 (2015).
- Bates, O., Semple, T., Krupickova, S., Bautisa-Rodriguez, C. Case report of a Gore-Tex TCPC conduit dissection causing severe stenosis. Eur Heart J Case Rep. 5 (11), 1-6 (2021).
- Sathananthan, G., et al. Clinical importance of Fontan Circuit thrombus in the adult population: Significant association with increased risk of cardiovascular events. Can J Cardiol. 35 (12), 1807-1814 (2019).
- Kumar, P., Bhatia, M. Computed tomography in the evaluation of Fontan Circulation. J Cardiovasc Imaging. 29 (2), 108-122 (2021).
- Abbott, W. M., Megerman, J., Hasson, J. E., L'Italien, G., Warnock, D. F. Effect of compliance mismatch on graft patency. J Vasc Surg. 5 (2), 376-382 (1987).
- Weston, M. W., Rhee, K., Tarbell, J. M. Compliance and diameter mismatch affect the wall shear rate distribution near an end-to-end anastomosis. J Biomech. 29 (2), 187-198 (1996).
- Ballyk, P. D., Walsh, C., Butany, J., Ojha, M. Compliance mismatch may promote graft-artery intimal hyperplasia by altering suture-line stress. J Biomech. 31 (3), 229-237 (1997).
- Lemson, M. S., Tordoir, J. H. M., Daemen, M. J. A. P., Kitslaar, P. J. E. H. M. Intimal hyperplasia in vascular grafts. Eur J Vasc Endovasc Surg. 19 (4), 336-350 (2000).
- Blum, K. M., et al. Tissue engineered vascular grafts transform into autologous neovessels capable of native function and growth. Commun Med. 2, 3 (2022).
- Turner, M. E., et al. Tissue engineered vascular grafts are resistant to the formation of dystrophic calcification. Nat Commun. 15, 2187 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены