Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Разработка недорогого электрода для эпимизиальной электромиографии: упрощенный рабочий процесс изготовления и тестирования
В этой статье
Резюме
Наша цель состояла в том, чтобы предоставить обновленное, простое в использовании руководство по изготовлению и тестированию электродов эпимизиальной электромиографии. С этой целью мы предоставляем инструкции по поиску материалов и подробный пошаговый обзор процесса изготовления и тестирования.
Аннотация
Электромиография (ЭМГ) является ценным диагностическим инструментом для выявления нервно-мышечных аномалий. Имплантируемые эпимизиальные электроды обычно используются для измерения сигналов ЭМГ в доклинических моделях. Несмотря на то, что существуют классические источники, описывающие принципы изготовления эпимизионных электродов, существует скудная иллюстративная информация, переводящая теорию электродов на практике. Чтобы исправить эту проблему, мы предоставляем обновленное, простое в использовании руководство по изготовлению и тестированию недорогих эпимизиальных электродов.
Электроды были изготовлены путем складывания и вставки двух платино-иридиевых фольг в предварительно вырезанную силиконовую основу для формирования контактных поверхностей. Затем к каждой контактной поверхности были приварены проволоки из нержавеющей стали с покрытием для формирования выводов электродов. Наконец, для герметизации электрода использовалась силиконовая смесь. Тестирование ex vivo было проведено для сравнения нашего изготовленного по индивидуальному заказу электрода со стандартным электродом в солевой ванне, где были обнаружены высокие уровни согласования сигналов (синусоида [внутриклассовая корреляция - ICC= 0,993], квадрат [ICC = 0,995], треугольник [ICC = 0,958]) и временная синхронность (синус [r = 0,987], квадрат [r = 0,990], треугольник [r = 0,931]) во всех формах сигнала. Низкие уровни импеданса электродов также были количественно определены с помощью спектроскопии электрохимического импеданса.
Также была проведена оценка производительности in vivo , в ходе которой широкая латеральная мышца крысы была хирургически обработана с помощью специально изготовленного электрода, а сигнализация была получена во время ходьбы в гору и вниз по склону. Как и ожидалось, пиковая активность ЭМГ была значительно ниже при ходьбе вниз по склону (0,008 ± 0,005 мВ), чем при подъеме в гору (0,031 ± 0,180 мВ, p = 0,005), что подтверждает валидность устройства. Надежность и биосовместимость устройства также поддерживались последовательной сигнализацией во время ровной ходьбы через 14 и 56 дней после имплантации (0,01 ± 0,007 мВ, 0,012 ± 0,007 мВ соответственно; p > 0,05) и отсутствием гистологического воспаления. В совокупности мы обеспечиваем обновленный рабочий процесс для изготовления и тестирования недорогих эпимизионных электродов.
Введение
Электромиография (ЭМГ) является мощным инструментом для изучения электрической активности мышц. Записи ЭМГ могут быть особенно полезны на доклинических моделях животных для оценки эффективности вмешательств по лечению нервно-мышечной дисфункции. В этих моделях имплантируемые биосовместимые электроды обычно используются для оценки нейрофизиологического интерфейса между моторными нейронами и мышечными волокнами. Эти имплантируемые электроды могут обеспечивать локализованные измерения мышечного возбуждения и могут быть разнообразными с точки зрения конфигурации, формы и материала, при этом оптимальная конструкция в конечном итоге диктуется местоположением и предполагаемым использованием.
Несмотря на их пригодность для оценки мышечного возбуждения в доклинических моделях, использование эпимизиальных электродов может быть ограничено стоимостью. В результате многие исследователи используют изготовленные по индивидуальному заказу эпимизиальные электроды, которые производятся собственными силами. Несмотря на то, что существуют ресурсы, подробно описывающие основные аспекты изготовления, тестирования и использования электродов 1,2, существует потребность в обновленном руководстве с подробным описанием источника, изготовления и валидации эпимизионных электродов с использованием современных методов. Основываясь на фундаментальных работах Леба и Ганса3 и других ученых в области теории электродов, мы представляем современные инструкции по поиску и изготовлению недорогих эпимизиальных электродов и проверяем их производительность в серии экспериментов ex vivo и in vivo. Цель состоит в том, чтобы предложить дружественное руководство для других членов научного сообщества по поиску, изготовлению и тестированию недорогих эпимизиальных электродов для использования на животных, что позволит более широко количественно оценить мышечное возбуждение в доклинических моделях.
В этом протоколе мы предоставляем инструкцию по поиску, изготовлению и тестированию эпимизиальных электродов для использования на животных в современной электрофизиологической лаборатории. Параметры электродов, выбранные для изготовления, такие как форма, размеры, площадь контактной поверхности, расстояние между электродами, длина выводов и т. д., были выбраны в соответствии с нашими экспериментальными потребностями и были сопоставимы с коммерчески доступным стандартным эпимизионным электродом (см. Таблицу материалов). Мы рекомендуем другим группам изменить эти параметры в соответствии со своими потребностями, а также выбрать надежный электрод, который соответствует их сценарию использования.
Чтобы дать читателям относительно быстрое представление о работе электродов, мы также приводим пример протокола испытаний ex vivo с возможностью измерения импеданса электрода. Кроме того, мы приводим пример оценки производительности электродов in vivo. В эксперименте ex vivo специально изготовленный электрод сравнивался с отраслевым стандартом в солевой ванне, чтобы имитировать стабильные физиологические условия. Импеданс также оценивали ex vivo с помощью электрохимической импедансной спектроскопии (ЭИС). Эксперимент in vivo заключался в хирургической имплантации специально изготовленного электрода в латеральную мышцу широкой мышцы (VL) 16-недельной самки крысы породы Лонг Эванс (HsdBlu: LE, Envigo) для измерения сигнала ЭМГ в условиях, вызывающих высокий или низкий сигнал (подъем, ходьба под гору). Для оценки надежности изготовленного по индивидуальному заказу электрода сигнализация ЭМГ была получена во время горизонтальной ходьбы после полного хирургического восстановления и до жертвоприношения (через 14 дней и 56 дней после имплантации соответственно). Окрашивание гематоксилин-эозином (H&E) было проведено на инструментированной мышце для оценки биосовместимости электрода, изготовленного по индивидуальному заказу.
Access restricted. Please log in or start a trial to view this content.
протокол
Процедура in vivo была проведена с одобрения Комитета по институциональному уходу за животными и их использованию при Мичиганском университете (#PRO00010765 одобрения IACUC) и в соответствии с рекомендациями Национальных институтов здравоохранения по уходу и использованию лабораторных животных.
1. Поиск и изготовление электродов
ПРИМЕЧАНИЕ: На рисунке 1 представлена общая сводка всех ключевых этапов изготовления с QR-ссылкой, которая содержит дополнительные визуальные инструкции.
- Закупайте биосовместимые электродные материалы непосредственно у производителя в больших количествах для изготовления. Смотрите таблицу материалов, которая содержит все компоненты электродов и подробную информацию о поставщиках.
ПРИМЕЧАНИЕ: Убедитесь, что силиконовая основа, силиконовый герметик и платино-иридиевая контактная фольга биосовместимы, чтобы избежать неблагоприятного иммунного ответа и обеспечить хроническую имплантацию. Чтобы обосновать экономические преимущества собственного производства, мы представляем подробный анализ стоимости изготовленного по индивидуальному заказу эпимизиального электрода в сравнении с отраслевым стандартом (Таблица материалов). - Подготовьте режущий и фальцевальный кондуктор (Дополнительный файл 1, Дополнительный файл 2). Используйте выбранное программное обеспечение для 3D-печати для проектирования режущих и складывающихся приспособлений для серийного производства идентичных эпимизионных электродов.
- Спроектируйте режущий кондуктор таким образом, чтобы обеспечить одинаковый размер и расстояние между перфорациями силиконовой основы для равной площади контактной поверхности и расстояния между электродами на всех электродах.
- Создайте складной кондуктор для складывания платино-иридиевых контактных поверхностей и упрощения размещения фольги в силиконовой основе.
ПРИМЕЧАНИЕ: Предоставляются файлы Gcode; Изменяйте размеры и технические характеристики режущего и складывающегося кондуктора в соответствии с экспериментальными потребностями.
- Проколотируйте силиконовую основу. Поместите силиконовую основу на режущий кондуктор и прикрепите ее скотчем. Перфорируйте силикон с помощью направляющих в режущем приспособлении с помощью ножа X-acto для размещения контактной пленки.
- Вставьте фольгу в силиконовую основу, чтобы сформировать контактные поверхности. Сложите биосовместимую, предварительно нарезанную платино-иридиевую контактную фольгу (1,25 мм x 5 мм) в U-образную форму с помощью складного приспособления. Затем направьте плечи сложенной фольги в перфорированные пазы в силиконовой основе, чтобы создать контактные поверхности электрода. Таким образом, вставьте все 12 фольг в силиконовую основу; Оставьте одну колонку открытой между электродами, чтобы обеспечить правильное расстояние.
ПРИМЕЧАНИЕ: Эта конфигурация позволит изготовить 6 биполярных эпимизиальных электродов; Редактирование режущего приспособления при необходимости может увеличить производительность. - Снимите силиконовую основу с режущего приспособления. Наложите кусок хирургической ленты на контактные поверхности, чтобы удерживать фольгу на месте. Затем снимите силиконовую основу с режущего приспособления, переверните, чтобы обнажить рукава U-образной фольги, и сложите один рукав U-образной фольги заподлицо с силиконовой основой.
- Подсоедините электродные провода. Приготовьте проволоку из нержавеющей стали с перфторалкокси (PFA), разрезав ее до нужной длины. Затем обнажите один конец проволоки из нержавеющей стали на ~ 1 см с помощью имеющейся в продаже зажигалки. Расположите оголенный конец проволоки из нержавеющей стали на внутренней стороне развернутого плеча фольги. Приварите проволоку из нержавеющей стали к рукаву фольги с помощью сварочного аппарата Micro TIG (длительность импульса = 0, энергия сварного шва = 25).
- Осмотрите интерфейс «свинец-фольга». Проверьте соединение проволоки с фольгой, натянув проволоку из нержавеющей стали. Если соединение держится, сложите рукав фольги вниз заподлицо с силиконовой основой и снимите ленту, окаймляющую силиконовый лист.
ПРИМЕЧАНИЕ: Примените натяжение, которое является репрезентативным для натяжения, приложенного в указанном сценарии использования. - Запечатайте электрод. Чтобы добиться более жидкой консистенции, смешайте 1 г биосовместимого жидкого силикона с 0,75 мл толуола. Наберите смесь с помощью шприца с тупым наконечником 18 г и нанесите его на сварную сторону каждого электрода, чтобы загерметизировать заднюю часть электродов.
ВНИМАНИЕ: Толуол легко воспламеняется, может привести к летальному исходу при проглатывании или попадании в дыхательные пути и вызывает раздражение кожи. Работайте под вытяжным шкафом и держите подальше от открытого огня. - Разделите партию на отдельные электроды. Дайте силикон-толуолу застыть в течение 72 часов, прежде чем работать с электродом. Далее с помощью ножниц разрезаем силиконовую основу на отдельные электроды размером 10 х 5 мм.
ПРИМЕЧАНИЕ: Размер электрода будет зависеть от размеров режущего приспособления и конкретного случая использования. Автоклав и/или очистка электродов в ультразвуковой ванне.
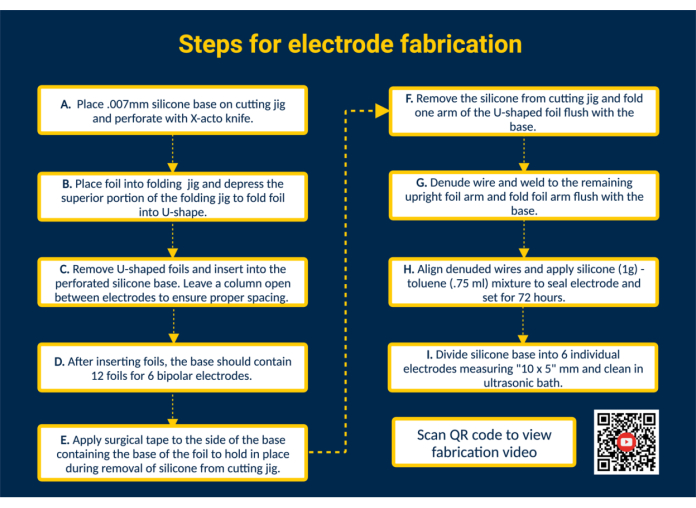
Рисунок 1. Этапы изготовления электродов. (А) Перфорируйте силиконовую основу. (B) Сформируйте U-образную фольгу с помощью складного приспособления. (C) Вставьте U-образную фольгу в перфорированную силиконовую основу. (D) Силиконовая основа содержит 12 фольг, образующих 6 биполярных электродов. (E) Наклейте хирургическую ленту на основание, чтобы закрепить фольгу во время снятия с режущего приспособления. (F) Снимите силиконовую основу с режущего приспособления. (G) Очистите проволоку из нержавеющей стали с покрытием PFA и приварите к вертикальному кронштейну фольги с помощью сварочного аппарата Micro TIG. (H) Выровняйте оголенные провода, нанесите силикон-толуоловый герметик и дайте застыть. (I) Разделите силиконовую основу на отдельные электроды и очистите в ультразвуковой ванне. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Тестирование ex vivo
- Подключите электроды к записывающему устройству. Закрепите каждый электродный подводящий провод в канале на интерфейсной плате электродов (EIB). Повторите этот шаг (используя тот же EIB) для выбранного стандартного электрода для сравнения. Подключите EIB к платформе сбора данных с помощью магнитной кабельной системы.
ПРИМЕЧАНИЕ: Стандартный электрод может быть любым электродом, который считается надежным и подходит для экспериментальных потребностей. - Заземлить ЕИБ. Очистите один конец нержавеющей стали с покрытием из PFA и выполните точечную сварку к источнику заземления (например, винту из нержавеющей стали). Прикрепите подводящий провод заземления к той же интерфейсной плате электродов в назначенном положении «заземление».
- Установите солевую ванну. Наполните стеклянный стакан (250 мл) 180 мл физиологического раствора физиологического раствора (0,9% стерильного физиологического раствора)4. Погрузите изготовленные по индивидуальному заказу и стандартные для отрасли эпимизионные электроды в ванну с солевым раствором и закрепите их в устойчивом положении. Затем погрузите источник заземления в солевую ванну и закрепите его положение. Наконец, погрузите и закрепите два стимулирующих игольчатых электрода в солевой ванне и подключите стимулирующие электроды к генератору сигналов.
- Используйте генератор сигналов для оценки согласования сигналов и временной синхронизации. Используйте генератор сигналов для подачи повторяющихся сигналов с выбранным напряжением и частотой (0,1 В и 5 Гц) в солевую ванну через стимулирующие электроды (Рисунок 2). Подавайте сигналы различных форм (синусоидальные, квадратные и треугольные) для сравнения записанных сигналов между специально изготовленным эпимизионным электродом относительно отраслевого стандарта.
- Оценивайте производительность в неформальной обстановке и визуально в режиме реального времени, чтобы оценить степень изменения сигналов между электродами. Выполнение внутриклассовых корреляций (ICC) и корреляций Пирсона для оценки согласования сигналов и временной синхронности соответственно.
ПРИМЕЧАНИЕ: Для целей нашего анализа было отобрано 8 000 образцов с частотой 4 000 Гц и отфильтровано в режиме реального времени с помощью фильтра Баттерворта высоких и низких частот (верхние частоты = 75 Гц; низкие частоты = 2 кГц). - Измерьте импеданс электрода. Чтобы измерить импеданс электродов, соберите EIS на изготовленных по индивидуальному заказу электродах (например, 10 электродов) на частотах 10 Гц-31 кГц5 с помощью потенциостата, используя процедуру, описанную ниже Richie et al.6. См. Sarolic et al. для получения дополнительной информации об измерении импеданса электродов на биполярных электродах7.
- Следуя процедуре Richie et al., погрузите эпимизиальный электрод на 1 мм в 1x фосфатно-солевой буфер (PBS). Используйте хлорид серебра (Ag|AgCl) электрод сравнения и стержень из нержавеющей стали в качестве противоэлектрода для завершения цепи.
- Приостановка работы Ag|AgCl электрод сравнения и стержень из нержавеющей стали в 1x PBS с помощью зажима для стакана. Подсоедините электрод сравнения к опорному точке используемой импедансной системы и подключитесь к входу противоэлектрода используемой импедансной системы.
- Используйте потенциостат для сканирования импеданса 1 кГц. Частота развертки 1 кГц присреднеквадратичном напряжении 0,01 В в одной синусоидальной осциллограмме. В течение первых 5 секунд сканирования установите потенциостат на 0 В, чтобы стабилизировать записанный сигнал. Используйте программное обеспечение, связанное с потенциостатом, для записи измерений.
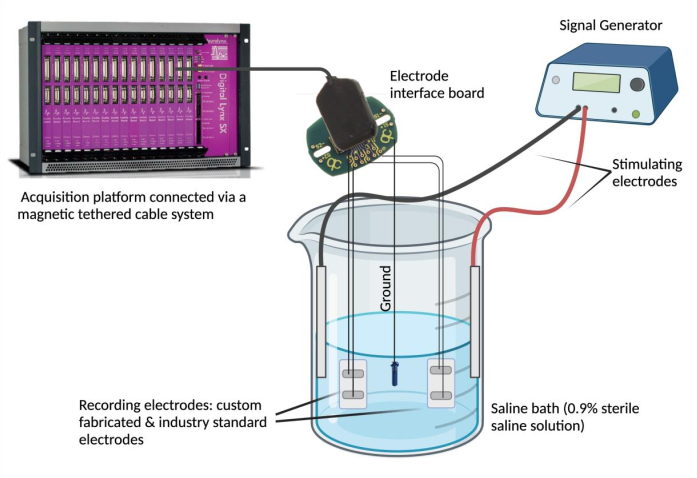
Рисунок 2: Испытание ex vivo : Солевая ванна, содержащая изготовленный по индивидуальному заказу электрод, стандартные электроды, два стимулирующих электрода и источник заземления. Согласование сигналов и временная синхронность оценивались путем подачи синусоидальных, прямоугольных и треугольных волн в соленую ванну от генератора сигналов и записи сигналов, обнаруженных соответствующими электродами, с помощью платформы сбора данных. ПРИМЕЧАНИЕ: Электрохимическая импедансная спектроскопия не изображена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Тестирование in vivo
ПРИМЕЧАНИЕ: Процедура тестирования in vivo описывает наш экспериментальный вариант использования. Рекомендуется, чтобы изготовленные по индивидуальному заказу эпимизиальные электроды тестировались in vivo таким образом, чтобы это соответствовало предполагаемым условиям эксперимента.
- Просмотр хирургической информации; Ознакомьтесь с информацией для хирургов, которые изучают процесс имплантации хронических нейронных записывающих электродов с использованием следующих ресурсов 8,9.
ПРИМЕЧАНИЕ: Учитывая, что основное внимание в нашей рукописи уделяется изготовлению и тестированию электродов, здесь мы приводим только краткий обзор хирургических методов, используемых в нашей лаборатории для тестирования электродов in vivo . - Выберите крысу, которую будут оснастывать (например, самку крысы Лонг Эванса в возрасте 16 недель). Предложите крысе пройти 1-недельный период лабораторной акклиматизации перед акклиматизацией на беговой дорожке. После лабораторной акклиматизации постепенно подвергайте крысу воздействию беговой дорожки грызунов со скоростью до 16 м/мин.
- Подготовьте ЭИБ, сначала прикрепив к нему специально изготовленный эпимизиальный электрод, прикрепив каждый электродный провод к каналу на ЭИБ. Чтобы заземлить EIB, обнажите один конец проволоки из нержавеющей стали с покрытием PFA и выполните точечную сварку к выбранному заземлению (например, винту из нержавеющей стали). Далее прикрепите провод заземления к тому же EIB в обозначенном положении «заземления».
ПРИМЕЧАНИЕ: Чтобы защитить электрод во время работы с контрольно-измерительными приборами, оберните его защитным покрытием (например, парапленкой). - Перед началом операции продезинфицируйте все хирургические инструменты, а также операционную область. Используйте герметичные асептические хирургические принадлежности и автоклавируйте все хирургические инструменты, которые не находятся в стерильной упаковке. Создайте стерильное операционное поле с помощью хирургической простыни.
- Обезболивайте животное с помощью индукционной камеры с 3-5% изофлураном и 1 л/мин кислорода и поддерживайте через носовой конус с 2% изофлураном и 500 мл кислорода во время подготовки крысы. После достижения хирургической плоскости анестезии, оцененной с помощью щипки на пальце ноги, нанесите глазную мазь, контролируйте частоту дыхания (70-110 вдохов/мин) и оцените температуру тела с помощью ректального зонда.
- Затем побрейте место операции машинками для стрижки животных и удалите мусор с места операции. После того, как операционная область будет выбрита, продезинфицируйте место операции с помощью хлоргексидина, изопропилового спирта и повидон-йода, протирая от центра к внешней стороне операционной области. Применяйте анальгетики по мере необходимости и одобрения и обеспечивайте тепло для поддержания температуры тела (37,5-38,5 °C). После подготовки поместите крысу в стереотаксическую рамку и установите стерильное поле.
- Для правильной хирургической подготовки хирурга необходимо тщательно вымыть руки с использованием мыла и/или дезинфицирующего средства (хлоргексидина). Наденьте надлежащие СИЗ: маску, стерильные перчатки и одноразовый халат/топ для скраба. Надевайте новые стерильные перчатки, если по каким-либо причинам нарушена техника асептики.
- Чтобы вставить инструмент на правую VL, с помощью скальпеля сделайте разрез длиной 3-5 см на переднебоковой части правой задней конечности и используйте тупое рассечение для идентификации мышцы VL.
- Сделайте разрез в сагиттальной плоскости диаметром 1 см вдоль коронкового шва и обнажите череп. С помощью тонкой пары щипцов сделайте подкожный тоннель от правой задней конечности к основанию черепа. С помощью щипцов захватите электрод и проведите электрод к VL.
- Используйте костяное сверло, чтобы сделать отверстие в кальварии (убедитесь, что характеристики сверла соответствуют характеристикам винта заземления). Закрепите винт заземления и прикрепите EIB к черепу с помощью стоматологического цемента.
ПРИМЕЧАНИЕ: Небольшое количество перекиси водорода может быть применено для увеличения пористости черепа и улучшения адгезии стоматологического цемента. - Определив мышцу VL, имплантируйте специально изготовленный эпимизиальный электрод, имплантированный на одной линии с мышечными волокнами с использованием нерассасывающейся мононити 4-0. Закройте разрез с помощью зажимов для раны или наложения швов.
- После закрытия извлеките животное из наркоза и поместите его по отдельности в чистую сухую клетку для животных. Дайте крысе восстановиться на подогреваемой подушке и контролируйте температуру и частоту дыхания крысы каждые 15 минут, пока животное не сможет передвигаться. Лечите послеоперационную боль путем введения одобренного анальгетика в течение нескольких дней после применения инструментов.
ПРИМЕЧАНИЕ: крыса должна содержаться индивидуально до полного выздоровления. - По прошествии 14-дневного периода проведите тестирование электродов in vivo , чтобы оценить достоверность изготовленного по индивидуальному заказу эпимизионного электрода для фиксации физиологических изменений в мышечной активности. Поместите крысу с приборами на беговую дорожку для грызунов и произвольно подвергайте ее ходьбе вверх и вниз по склону, что приводит к увеличению или уменьшению сигнализации ЭМГ VL (наклон 16°, снижение под углом 16° со скоростью 16 метров в минуту). Соберите продольные данные (например, за 14 дней и 56 дней после установки контрольно-измерительных приборов) для обеспечения надежности с течением времени.
ПРИМЕЧАНИЕ: 14- и 56-дневные оценки были выбраны, так как период в 14 дней позволяет полностью восстановиться после хирургического вмешательства, а период в 56 дней превышает наш экспериментальный график. Мы рекомендуем другим проверять производительность и надежность электродов с помощью временных рамок, которые повторяют их экспериментальный график перед использованием. Скорость (16 м/мин) и условия ходьбы (уклон 16°, уклон 16°) были подобраны в соответствии с установленными условиями повышенного и пониженного возбуждения VL в данной модели10. - Измените параметры сбора данных в соответствии с потребностями эксперимента. Захватывайте сигналы ЭМГ во время ходьбы с частотой 2 000 Гц с помощью платформы сбора данных и синхронизируйте их с системой захвата движения.
ПРИМЕЧАНИЕ: При использовании другого устройства сбора данных соберите ЭМГ и захват движения в соответствии с инструкциями производителя и в соответствии с экспериментальными потребностями. - Извлекайте данные о походке за 25 секунд из каждого условия ходьбы и экспортируйте их в настраиваемый скрипт Python для дальнейшей обработки и анализа сигналов. Корректируйте базовую линию (ноль), выпрямляйте и сглаживайте с помощью алгоритма среднеквадратичного значения с шириной ячейки 50 мс. Применение алгоритма обнаружения пиков для выбора пиков RMS-EMG для использования в последующем анализе данных.
ПРИМЕЧАНИЕ: Мы кратко описали методы предварительной обработки и анализа данных ЭМГ, поскольку этот шаг сильно варьируется из-за языков программирования и программного и аппаратного обеспечения для сбора данных ЭМГ. Мы рекомендуем авторам обратиться к следующим ресурсам для получения дополнительной информации: 3,11,12,13.
4. Тестирование на биосовместимость
- После окончания лонгитюдного сбора ЭМГ (или в выбранный момент времени) усыпьте крысу с использованием соответствующих и одобренных методов (например, асфиксия с использованием CO2 с последующей двусторонней торакотомией).
- После эвтаназии извлеките двусторонние мышцы ВЛ путем создания разреза на переднебоковых правой и левой задних конечностях. Мгновенно заморозьте в жидком азоте и храните при температуре -80 °C.
ПРИМЕЧАНИЕ: Следите за тем, чтобы электрод оставался на инструментируемой мышце (например, на правой VL) во время извлечения. В качестве альтернативы можно отметить субэлектродную область или извлечь только мышцу из субэлектродной области. Это не относится к контралатеральной/контрольной мышце. - С помощью криостата можно вырезать последовательные поперечные сечения мышц (7 мкм) из области непосредственно под электродно-фасциальной границей раздела. Вырежьте срезы из мышечного живота контралатерального ВЛ в качестве контрольного. Подробнее о криосекции см. в Kumar et al.14.
- Окрашивание гематоксилином и эозином (H&E); см. Wang et al. для получения подробной информации о окрашивании H&E на поперечных срезах скелетных мышц15.
- Исследуйте окрашенные срезы (инструментальные и контрольные) с помощью светового микроскопа с 20-кратным увеличением. Анализируйте гистологические изменения без учета происхождения образцов. Оцените состояние здоровья тканей с использованием следующих патологических признаков: инфильтрация иммунных клеток, внутреннее накопление мионуклеаров, фиброгенез и фрагментация сарколеммы.
5. Предлагаемый статистический анализ
- Чтобы оценить производительность изготовленного по индивидуальному заказу эпимиизального электрода в сравнении с отраслевым стандартом, импортируйте данные ex vivo в выбранный статистический пакет. Примените следующие статистические тесты к данным ex vivo , собранным с изготовленных по индивидуальному заказу и стандартных промышленных электродов (например, 8 000 репрезентативных образцов из синусоидальной, треугольной и квадратной осциллограмм). Установите уровень альфа априори на уровне p ≤ 0.05.
- Чтобы проверить уровень согласования сигналов между электродами, используйте внутриклассовые корреляции (ICCs) и графики Бланда-Альтмана. Рассчитайте оценки ICC и их 95% доверительные интервалы на основе модели одиночного рейтинга (k = 2), абсолютного согласия, 2-сторонней модели случайных эффектов.
- Чтобы проверить степень, в которой запись осциллограмм изменяется с течением времени, также известную как временная синхронность, выполните корреляцию Пирсона со значениями, собранными с помощью изготовленных по индивидуальному заказу и стандартных промышленных электродов.
- Сравните среднее импеданс электродов для обеих контактных поверхностей (измеренное на частоте 1 кГц) выбранных электродов, изготовленных по индивидуальному заказу (например, 10 электродов), с импедансом стандартного электрода.
ПРИМЕЧАНИЕ: Значения импеданса электродов будут отличаться в зависимости от случая использования и материалов, используемых при изготовлении электродов.
- Чтобы оценить качество записей in vivo , импортируйте данные, собранные во время ходьбы на беговой дорожке, в выбранный статистический пакет.
- Чтобы оценить достоверность изготовленного по индивидуальному заказу электрода во время испытаний in vivo (когда походка крысы нарушалась при ходьбе вверх и вниз по склону, что вызывало физиологические изменения в мышечной активности), выполните t-критерий Уэлча для сравнения средних пиковых значений для условий ходьбы в гору и вниз по склону.
ПРИМЕЧАНИЕ: Читателям рекомендуется проводить дополнительные тесты и анализы (например, оценки отношения сигнал/шум (SNR); см. Фундаментальные концепции Delysys в области сбора сигналов ЭМГ), которые не представлены здесь для краткости16. - Чтобы оценить надежность передачи сигналов электродом с течением времени, оцените продольные данные, собранные в стабильных условиях (ровная ходьба со скоростью 16 м/мин с интервалом 14 и 56 дней после имплантации) с помощью парных t-тестов.
- Чтобы оценить достоверность изготовленного по индивидуальному заказу электрода во время испытаний in vivo (когда походка крысы нарушалась при ходьбе вверх и вниз по склону, что вызывало физиологические изменения в мышечной активности), выполните t-критерий Уэлча для сравнения средних пиковых значений для условий ходьбы в гору и вниз по склону.
Access restricted. Please log in or start a trial to view this content.
Результаты
Производительность ex vivo
ICC выявили высокий уровень согласованности между изготовленными по индивидуальному заказу и стандартными отраслевыми электродами по всем формам волн (синус [ICC = 0,993], квадрат [ICC = 0,995], треугольник [ICC = 0,958]; p < 0,001). Графики Бланда-Ал...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Наша цель состояла в том, чтобы оптимизировать процесс изготовления ЭМГ, обеспечив более широкое внедрение и внедрение конструкций эпимизиальных электродов, тем самым способствуя доступности и продвижению нервно-мышечных исследований. С этой целью мы представляем ?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, описанную в этой статье.
Благодарности
Эта работа была поддержана грантом Национального института артрита и скелетно-мышечных и кожных заболеваний R01AR081235 (Л. К. Лепли). Авторы благодарят следующих лиц за их вклад в изготовление и тестирование нашего биосовместимого электрода: Джоэла Пингела, Гранта Геллера, Ахила Рамеша, Джо Летнера, Джеки Тиана и Росса Бранкати.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Electrode Materials | |||
| Quantity & price per electrode | |||
| Contact surface | Prince and Izant PT90/IR10 1.25 mm x 5 mm foil | Catalog #1040055 | 2 per electrode $7.50 per foil $15.00 per electrode |
| PFA coated stainless-steel electrode lead wire | A-M Systems Multi-Stranded PFA-Coated Stainless Steel Wire 50.8 µm strand diameter | Catalog #793500 | Dependent on desired lead length (e.g., 9 inch lead wires x2) $128 per 25 ft spool $5.12 per foot $0.42 per inch (x18) $7.68 per electrode |
| Folding jig | 3D printed (see .gcode file) | NA | NA |
| Sealant for electrode body | Nusil Med-1137 liquid silicone | Catalog #MED-1137 | 1 gram $344.66 per 2 oz. (59.15 mL) $5.83 per electrode |
| Silicone base | Implantech Alliedsil Silicone Sheeting-Reinforced, Long Term Implantable (8” x 6”) .007 thick | Catalog #701-07 | 10mm x 5mm sheet $225.00 per 8 x 6 inch $0.36 per electrode (10 mm x 5 mm) |
| Thinner for sealant mixture | Toluene 99.5% ACS Reagent 500mL or Xylene ACS 99.5% | Catalog #179418-500 ML | 0.75 mL $25.53 per 500 mL $0.38 per electrode |
| Template for perforating silicone base | Cutting jig – 3D printed (see CAD file) | NA | NA |
| Custom-fabricated electrode: $29.25 | |||
| Industry standard electrode (EP105 EMG Patch Electrode, 2 contacts, single-sided, 7mm x 4mm, MicroProbe for Life Science): $305.00 | |||
| Additional Fabrication Materials | |||
| Quantity & price per electrode | |||
| 3D printing software | Solidworks (Solidworks, 2022) | ||
| Micro-Tig welder | Micro-Tig Welder (CD1000SPM, Single Pulse Research and Light Production Resistance Spot Welder, Sunstone) | SKU 301010 | $3,500 |
| Ultrasonic bath | Ultrasonic bath (CPX Series Ultrasonic Bath, Fisherbrand). | 15-337-403 | NA |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Data acquisition platform and software | DigitalLynx 4sX Base Cheetah version 6.0 (Neuralynx Inc.) | NA | EMG acquisition hardware and software |
| Electrode interface board (EIB) | EIB, EIB16-QC, Neuralynx Inc. | 31-0603-0007 | NA |
| Signal generator | 5 MHz Function Generator, B&K Precision | 4005DDS220V | $387.46 |
| Potentiostat | PGSTAT1 potentiostat (EcoChemie, Utrecht, Netherlands) | NA | NA |
| Stainless steel screw | Fine Science Tools | 19010-00 | $98 |
| Ex Vivo Testing Materials | |||
| Quantity & price per electrode | |||
| Rodent treadmill | Exer 3/6 Open Treadmill, Columbus Instruments | NA | NA |
| Dental cement | Excel Formula® Pourable Dental Material, St. George Technology Inc. | #24211 | $125.60 |
| Light microscope | Keyence BZ-X800, Keyence Corporation, Osaka, Japan | NA | NA |
| Motion capture system | Optitrack Color Camera, Optitrack, NaturalPoint Inc. | NA | NA |
| Peak detection algorithm | “SciPy.signal.find_peaks - SciPy v1.8.1 Manual”, 2022 | NA | NA |
| Python software | Python Software Foundation. Python Language Reference, version 3.9. Available at http://www.python.org | NA | NA |
| Rat | HsdBlu: LE, Envigo | 140 | NA |
| Statistical sotware | GraphPad Prism version 10.0.0 (GraphPad Software, Boston, Massachusetts USA) | NA | NA |
Ссылки
- Grandjean, P. A., Mortimer, J. T. Recruitment properties of monopolar and bipolar epimysial electrodes. Ann. Biomed. Eng. 14 (1), 53-66 (1986).
- Memberg, W. D., Stage, T. G., Kirsch, R. F. A fully implanted intramuscular bipolar myoelectric signal recording electrode. Neuromodulation J. Int. Neuromodulation Soc. 17 (8), discussion 799 794-799 (2014).
- Loeb, G. E., Gans, C. Electromyography for Experimentalists. , University of Chicago Press. Chicago, IL. (1986).
- Boehler, C., Carli, S., Fadiga, L., Stieglitz, T., Asplund, M. Tutorial: guidelines for standardized performance tests for electrodes intended for neural interfaces and bioelectronics. Nat. Protoc. 15 (11), 3557-3578 (2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. J. Neural Eng. 12 (4), 046009(2015).
- Richie, J. M., et al. Open-source toolkit: benchtop carbon fiber microelectrode array for nerve recording. J. Vis. Exp. (176), e63099(2021).
- Impedance measurement of bipolar stimulation electrodes immersed in medium. Sarolic, A., Skalic, I., Deftu, A., Sapunar, D. 2018 EMF-Med 1st World Conf. Biomed. Appl. Electromagn. Fields EMF-Med, , 1-2 (2018).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of rodent surgery for the New Surgeon. J. Vis. Exp.: JoVE. (47), e2586(2011).
- Zealear, D., Li, Y., Huang, S. An implantable system for chronic in vivo electromyography. J. Vis. Exp. JoVE. (158), e60345(2020).
- Butterfield, T. A., Leonard, T. R., Herzog, W. Differential serial sarcomere number adaptations in knee extensor muscles of rats is contraction type dependent. J. Appl. Physiol. Bethesda Md 1985. 99 (4), 1352-1358 (2005).
- Farago, E., MacIsaac, D., Suk, M., Chan, A. D. C. A review of techniques for surface electromyography signal quality analysis. IEEE Rev. Biomed. Eng. 16, 472-486 (2023).
- Raez, M. B. I., Hussain, M. S., Mohd-Yasin, F. Techniques of EMG signal analysis: detection, processing, classification and applications. Biol. Proced. Online. 8, 11-35 (2006).
- Tankisi, H., et al. Standards of instrumentation of EMG. Clin. Neurophysiol. 131 (1), 243-258 (2020).
- Kumar, A., Accorsi, A., Younghwa, R., Mahasweta, G. Do's and don'ts in the preparation of muscle cryosections for histological analysis. J. Vis. Exp. JoVE. (99), e52793(2015).
- Wang, C., Yue, F., Kuang, S. Muscle histology characterization using H&E staining and muscle fiber type classification using immunofluorescence staining. Bio-Protoc. 7 (10), e2279(2017).
- Kreifeldt, J. G. Signal versus noise characteristics of filtered EMG used as a control source. IEEE Trans. Biomed. Eng. BME-18 (1), 16-22 (1971).
- Farina, D., Yoshida, K., Stieglitz, T., Koch, K. P. Multichannel thin-film electrode for intramuscular electromyographic recordings. J. Appl. Physiol. 104 (3), 821-827 (2008).
- Muceli, S., et al. Decoding motor neuron activity from epimysial thin-film electrode recordings following targeted muscle reinnervation. J. Neural Eng. 16 (1), 016010(2018).
- Guo, L., Guvanasen, G., Tuthill, C., Nichols, T., Deweerth, S. Characterization of a Stretchable Multielectrode Array for Epimysial Recording. , 694(2011).
- Zwarts, M. J., Stegeman, D. F. Multichannel surface EMG: basic aspects and clinical utility. Muscle Nerve. 28 (1), 1-17 (2003).
- Fabrication and test of robust spherical epimysial electrodes for lower limb stimulation. Aalb. Den. Koch, K. P., Leinenbach, C., Stieglitz, T. IFESS 5th Conf, , (2000).
- Uhlir, J. P., Triolo, R. J., Davis, J. A., Bieri, C. Performance of epimysial stimulating electrodes in the lower extremities of individuals with spinal cord injury. IEEE Trans. Neural Syst. Rehabil. Eng. 12 (2), 279-287 (2004).
- Deer, T. R., et al. The appropriate use of neurostimulation: new and evolving neurostimulation therapies and applicable treatment for chronic pain and selected disease states. Neuromodulation Technol. Neural Interface. 17 (6), 599-615 (2014).
- Ortiz-Catalan, M., Brånemark, R., Håkansson, B., Delbeke, J. On the viability of implantable electrodes for the natural control of artificial limbs: Review and discussion. Biomed. Eng. OnLine. 11, 33(2012).
- Sando, I. C., et al. Regenerative peripheral nerve interface for prostheses control: electrode comparison. J. Reconstr. Microsurg. 32 (3), 194-199 (2016).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены