Образование органоидов тимуса человека в трехмерных фибриновых гидрогелях
* Эти авторы внесли равный вклад
В этой статье
Резюме
В данной статье мы описываем протокол формирования органоидов тимуса человека, полученных из iPSC, выращенных в 3D-фибриновых гидрогелях с целью поддержки созревания эпителиальных клеток тимуса (TEC) и их длительного поддержания, а также тимопоэза in vitro.
Аннотация
Создание функционального и самотолерантного репертуара Т-клеток является сложным процессом, зависящим от микроокружения тимуса и, в первую очередь, от свойств его внеклеточного матрикса (ВКМ). Эпителиальные клетки тимуса (ТЭК) играют решающую роль в тимопоэзе, питая и отбирая развивающиеся Т-клетки путем фильтрации самореактивных клонов. Эмпирически доказано, что ТЭО особенно чувствительны к физическим и химическим сигналам, поступающим от ВКМ, а классическая монослойная клеточная культура приводит к быстрой потере функциональности вплоть до их гибели. Из-за этого деликатного обслуживания в сочетании с относительной редкостью, а также несмотря на высокие ставки в моделировании биологии тимуса in vitro, модели, способные точно имитировать нишу ТЭО в масштабе и с течением времени, все еще отсутствуют. В данной работе мы описываем формирование многоклеточной модели органоида тимуса человека, в которой компартмент ТЭО получен из индуцированных плюрипотентных стволовых клеток человека (ИПСК) и реагрегирован с первичными предшественниками ранних тимоцитов в трехмерном (3D) гидрогеле на основе фибрина. Эта модель отвечает текущим потребностям в масштабируемой системе культивирования, которая воспроизводит микроокружение тимуса ex vivo и демонстрирует функциональность, т.е. способность производить Т-клетки и поддерживать рост органоидов тимуса в течение нескольких недель. Таким образом, мы предлагаем практическую in vitro модель функциональности тимуса с помощью органоидов, полученных из iPSC, которая будет полезна исследованиям в области биологии TEC и генерации Т-клеток ex vivo.
Введение
Тимус является первичным лимфоидным органом, который играет важную роль в формировании компетентной и толерантной иммунной системы 1,2,3. Ранние предшественники тимуса (ЭТП) мигрируют из костного мозга в тимус, где они расширяются и дифференцируются в функциональные Т-клетки 1,2,4,5. Эти процессы опосредованы специализированной популяцией, эпителиальными клетками тимуса (ТЭО)2,6,7. ТЭО происходят из эпителиальных предшественников тимуса (ТЭП)8,9 и включают кортикальные ТЭО (цТЭК) и медуллярные ТЭО (мТЭК), которые играют определенную роль в создании специализированной 3D-микросреды, необходимой для миграции, экспансии и созревания Т-клеток. ТЭО опосредуют развитие Т-клеток в основном за счет обеспечения факторов роста и дифференцировки 1,10,11 и отрицательного отбора нефункциональных и нетолерантных тимоцитов через презентацию собственных антигенов 5,7,12. Сложные взаимодействия между развивающимися Т-клетками и ТЭК также играют центральную роль в созревании и 3D-организации популяций ТЭК в процессе, известном как перекрестные помехи тимуса 1,11. Взаимодействие между клеточными популяциями тимуса в значительной степени зависит от специфического микроокружения, формируемого внеклеточным матриксом (ВКМ). ВКМ тимуса находится в состоянии динамической взаимности с популяциями клеток тимуса, влияя на регуляцию генов и постоянно изменяясь в ответ секрецией ферментов или матричных белков13. ВКМ воздействует на клетки путем изменения биодоступности факторов роста и цитокинов, прямой передачи сигналов через мембраносвязанные рецепторы, такие как интегрины, и формирования цитоскелетов с помощьюфизических сил. Было показано, что компоненты ВКМ тимуса, такие как коллаген и ламинин, обладают высоким сродством к факторам роста TGFb и FGFs, которые имеют решающее значение для поддержания ТЭО и их фиксации путем образования комплексов. Пластичность ВКМ тимуса, модуль упругости и плотность также играют решающую роль в определении судьбы ТЭО и формировании компартментализации тимуса, которая имеет важное значение для его функциональности. Эти подсказки подчеркивают важность учета ЭКМ и его 3D-структуры для имитации тимуса ex vivo. В пользу этого говорит тот факт, что первичные ТЭО быстро дедифференцируются, теряют свою функциональность и в конечном итоге погибают при культивировании в классических клеточных культурах 15,16,17.
Были разработаны модели культур для расширения функциональных популяций ТЭО из эксплантов тимуса человека с целью сохранения структуры ВКМ и важнейших подсказок, которые она дает ТЭО 18,19,20. Эта система культивирования была способна успешно расширять и поддерживать популяцию функциональных ТЭК in vitro, но не могла поддерживаться дольше 7-8дней культивирования. Таким образом, разработка доступной, практичной 3D-системы культивирования, способной воспроизводить микроокружение тимуса и его функциональность in vitro и в долгосрочной перспективе, является важнейшей задачей в этой области. В последнее время разработка систем 3D-культивирования на основе гидрогеля привела к появлению нескольких искусственных органоидных систем тимуса, что представляет собой значительный прогресс в моделировании тимуса in vitro 15,16,21,22. Мы разработали систему совместного культивирования органоида тимуса человека (hTO) путем реагрегации первичных ЭТП человека с человеческими ТЭП, полученными из индуцированных плюрипотентных стволовых клеток (ИПСК), в сфероиды и их посева на фибриновый гидрогель.
Выбор материала и настройки гидрогеля в этом исследовании был направлен на воспроизведение нативной структуры ЭКМ тимуса при сохранении практичности и возможности масштабирования процесса для получения доступного и обильного источника материаладля экспериментов. Эта система hTO демонстрирует мультилинейный потенциал дифференцировки и может поддерживать продуктивный тимопоэз из ETP23. Эта органоидная система представляет собой надежный инструмент для изучения внутритимических клеточных взаимодействий и моделирования нормального и патологического лимфопоэза человека. Использование iPS-клеток также вводит в модель возможности редактирования генов. Эффективная дифференцировка ИПСК в функциональную ткань тимуса была долгосрочной целью в этой области в течение последних 15 лет, и значительный прогресс был достигнут в расшифровке сигналов о судьбе линии TEC 21,24,25,26,27. Чтобы ответить на вопрос о потребности в такой 3D-модели тимуса in vitro, в этой технической записке описываются методы и технические детали для поэтапного получения органоидов тимуса человека, полученных из iPSC, уделяя особое внимание образованию гидрогелевых каркасов, реагрегации и посеву микромассы клеток, а также культивированию и сбору органоидов.
протокол
Линия hiPSC hiN.Fm.m.Lon71.019 была получена из мужских взрослых фибробластов и перепрограммирована с помощью трансфекции мРНК. Линия hiPSC hiN.Fm.f.Lon80.002 была получена из женских взрослых фибробластов и перепрограммирована с помощью трансфекции мРНК. Линия hiPSC hiN.Fs.f.MIPS203.003 была получена из женских взрослых фибробластов и перепрограммирована с помощью рекомбинантной вирусной векторной инфекции Сендая. Все линии сотовой связи были предоставлены платформой Nantes iPSC. Пациенты давали информированное согласие на использование их клеток в исследовательских целях (анонимная коллекция, Lonza, cat # CC-2511). Первичные ЭТП выделяют путем диссоциации постнатальных образцов тимуса человека, полученных в виде анонимизированных отходов от пациентов, перенесших детскую кардиохирургическую операцию в больнице Нанта (CHU Nantes) в тот же день, в соответствии с французским регламентом CODECOH в соответствии с декларацией DC-2017-2987.
1. Направленная дифференциация ИПСК в сторону идентичности ТЭП
ПРИМЕЧАНИЕ: С момента первых работ, опубликованных Лаем и Джином, демонстрирующих дифференцировку эмбриональных стволовых клеток мышей (ESc) в направлении идентичности эпителия тимуса28, в нескольких исследованиях были разработаны и оптимизированы протоколы, описывающие направленную дифференцировку iPS-клеток человека до идентичности TEP 21,24,25,26,27,29 . Эти исследования приводят к дифференциации ТЭП, экспрессирующих маркеры идентичности эпителия тимуса, такие как FOXN1 и PAX9 24,25,28,30, а также функциональных маркеров, таких как DLL4 и AIRE26, но не имеющих маркеров созревания ТЭО24,25. Было показано, что два подхода поддерживают созревание дифференцированных ТЭП до зрелой идентичности ТЭО: трансплантация в модель in vivo, такая как мыши29, и реагрегация в 3D тимические органоидные системы, культивируемые в структуре раздела воздух-жидкость21. Обе системы продемонстрировали решающую роль, которую играет 3D-структура в поддержании и поддержке созревания функциональных популяций ПЭС, способных поддерживать in vivo или in vitro Т-лимфопоэз 15,24,25,31.
- Для системы органоидов тимуса, используемой в данном исследовании, провести дифференцировку iPS-клеток в направлении идентичности TEP в соответствии с протоколом, разработанным и подробно описанным в Provin et al.23.
2. Выделение первичных ЭТП из образца тимуса у детей
ПРИМЕЧАНИЕ: ЭТП являются предшественниками костного мозга, дающими начало линии Т-клеток и дендритным клеткам в тимусе и демонстрирующими следующий фенотип: CD3- CD4- CD8- CD14- CD19- CD56- CD45+ CD34+ CD7+32,33.
- Приготовление истощающихся бусин
- Накануне перенесите магнитные изоляционные шарики клеток (Таблица материалов) в пробирку объемом 15 мл и промойте 4 мл изоляционного буфера (PBS + 0,1% BSA + 2 мМ ЭДТА).
- Поместите трубку в магнитную подставку, удалите надосадочную жидкость и добавьте 2 мл изоляционного буфера.
- Добавьте мышиные антитела к человеческим CD3, CD4 и CD8 в гранулы и инкубируйте в течение 45 мин при 4 °C при перемешивании. Поместите трубку в магнитную подставку, промойте ее несколько раз в изоляционном буфере и снова суспендируйте в 20 мл изоляционного буфера.
- Диссоциация образца тимуса
- Переложите свежие образцы тимуса в чашку Петри, наполненную RPMI1640 (Таблица материалов). Разрежьте его стерильными препарирующими ножницами и плоскогубцами на кусочки размером около 1 мм3 дюйма.
- С помощью пипетки объемом 25 мл несколько раз промойте среду и фрагменты (среда должна помутнеть), затем дайте фрагментам отложиться и соберите половину среды в пробирку объемом 50 мл. Добавьте больше медиума и повторяйте, пока медиум не станет прозрачным.
- Соберите среду в необходимое количество пробирок объемом 50 мл и вращайте пробирки при давлении 200 x g в течение 5 минут.
- Удалите надосадочную жидкость и повторно суспендируйте гранулы в 10 мл раствора для лизиса эритроцитов (Таблица материалов). Инкубировать при комнатной температуре (RT) в течение 5 минут и добавить 20 мл промывочного буфера (PBS + 0,5% BSA + 4 mM EDTA + 1% пенициллин/стрептомицин).
- Вращайте при 200 x g в течение 5 минут и удалите надосадочную жидкость. Повторно суспендируйте гранулы в 10 мл промывочного буфера, процедите через сетчатый фильтр 70 мкм и подсчитайте ячейки.
- Обогащение ЭТП
- После подсчета ячеек отрегулируйте объем до 10 мл на пробирку с промывочным буфером. Добавьте необходимое количество клеточных изоляционных шариков (на 200 миллионов клеток используйте 500 μл гранул в 20 мл изоляционного буфера) и инкубируйте при 4 °C при перемешивании в течение 30 минут.
- Поместите пробирку на магнитную подставку на 2 минуты, и осторожно соберите надосадочную жидкость в чистую пробирку. Извлеките пробирку и очистите шарики 20 мл изоляционного буфера. Сделайте трубку вихревой, поместите ее обратно на магнитную подставку и соберите надосадочную жидкость. Повторите этот шаг дважды.
- Вращайте надосадочную жидкость при 200 x g в течение 5 минут. Суспендируйте гранулы в 2 мл изоляционного буфера и подсчитайте клетки.
- Изоляция ETP
- Отрегулируйте концентрацию до 200 миллионов клеток на мл и соберите небольшой объем в качестве неокрашенного контроля.
- Пометьте клетки мышиными антителами против человека Linage (Lin) (CD3, CD4, CD8, CD14, CD19, CD56), CD7 и CD34 (используйте один и тот же флуорохром для всех маркеров Lin). Выдерживать при температуре 4 °C в течение 45 минут.
- Промойте ячейки в равном объеме промывочного буфера. Вращайте клетки при 200 x g в течение 5 минут, повторно суспендируйте гранулу в 1 мл и подсчитайте клетки.
- Отрегулируйте объем до концентрации 50 миллионов клеток на мл и процедите клетки через сетчатый фильтр 70 мкм.
- Добавьте выбранный маркер жизнеспособности и отсортируйте живые клетки Lin-CD34+ CD7+ с помощью проточной цитометрии с помощью сопла 70 мкм.
3. 3D культуры органоидов тимуса
- Подготовка к ТЭП
- Сразу после выделения ЭТП контролируйте качество посева ТЭП на 13-15 день. Следите за тем, чтобы клетки достигали слияния и образовывали плотный монослой с выпуклостями (рисунок 1).
- Чтобы собрать дифференцированные ТЭП, промойте клетки DPBS-/-, удалите его, добавьте 1 мл TrypLE (Таблица материалов) в лунку и инкубируйте при 37 °C в течение 5-7 минут.
- Добавьте 1 мл XVIVO10 (Таблица материалов) в лунку, промойте несколько раз, чтобы отделить клетки, переложите в пробирку объемом 15 мл и вращайте при 200 x g в течение 5 минут.
- Удалите надосадочную жидкость, повторно суспендируйте гранулу в 1 мл XVIVO10 и посчитайте клетки.
ПРИМЕЧАНИЕ: Чтобы заранее оценить эффективность дифференцировки, используйте культуру отдельно и проверьте экспрессию FOXN1 и PAX9 с помощью ОТ-кПЦР и выход дифференцировки с помощью проточной цитометрии (рассчитывается как доля клеток EPCAM+ CD205+, которая должна быть выше 50%) (Рисунок 1). На этой стадии дифференцировки почти все клетки EPCAM+ также положительны на CD205, что свидетельствует об ихидентичности-предшественнике 11.
- Подготовка к ЭТП
- Сразу после выделения ЭТП вращайте пробирку для сбора при температуре 200 x g в течение 5 минут. Повторно суспендируйте гранулу в 1 мл XVIVO10 и подсчитайте клетки.
- Агрегация органоидов тимуса
- Пипетируйте в подходящих объемах и соедините обе клеточные суспензии в концентрации 2 00 000 TEP и 40 000 ETP на мл, аккуратно пипетируйте вверх и вниз один раз для гомогенизации.
- Добавьте подходящие добавки в соответствии с таблицей 1 и нанесите 100 мкл смешанной клеточной суспензии на лунку в 96-луночные планшеты с U-образным дном с низкой связываемостью. Используйте многоканальный дозатор для увеличения производительности; Тем не менее, классическая пипетка с одним наконечником ограничивает потерю объемов драгоценных клеток. Инкубируйте планшеты при 37 °C и 5%CO2 в течение ночи.
- Приготовление гидрогелей
ПРИМЕЧАНИЕ: Экспериментальная установка, используемая для образования гидрогеля, засева органоидов и распределения питательной среды, показана на рисунке 2.- На следующий день (день 1 фазы культивирования органоидов) разморозьте аликвоты тромбина (10 ЕД/мл), апротинина (26 000 ЕД/мл) и фибриногена (8 мг/мл) (Таблица материалов). Разморозьте тромбин и апротинин на льду, а фибриноген на водяной бане при температуре 37 °C (не ставьте его на лед, так как он выпадет в осадок). Не делайте вихревые, а поместите аликвоты под капот и гомогенизируйте их с помощью аккуратного пипетирования.
- Подготовьте столько подвесных вставок, сколько необходимо для количества производимых органоидов, следуя соотношениям, представленным в таблице 2. Поместите вкладыши в культуральные лунки с помощью стерильных плоскогубцев и оставьте по крайней мере одну колонку или строку пустой в тарелке для культуры.
- Подготовьте столько пробирок объемом 1,5 мл, сколько гелей для литья. В каждую пробирку сначала наберите необходимые объемы фибриногена и апротинина, как подробно описано в таблице 2.
- Во второй раз добавьте необходимый объем Тромбина в одну пробирку, быстро промывайте 2 раза, не создавая пузырьков для гомогенизации реагентов, затем вытягивайте все содержимое пробирки и быстро промывайте смесь в висячую вставку. Расположите пипетку вертикально над центром вкладыша и аккуратно промойте смесь реагентов, не образуя пузырьков.
ПРИМЕЧАНИЕ: На этом этапе решающее значение имеет скорость выполнения, так как реагенты полимеризуются за несколько секунд, и важно правильно их перемешать, чтобы избежать образования комков или неравномерной плотности в геле. Продолжайте работу по одной лунке, используя разные пробирки объемом 1,5 мл для каждой лунки (если пробирка повторно используется для нескольких лунок, оставшиеся твердые гелевые комки могут заблокировать наконечник пипетки). Если полимеризация происходит слишком быстро из-за высокой активности тромбина, используйте разведение в соотношении 1:2. Сразу после литья гели должны быть прозрачными или слегка полупрозрачными и все еще течь через несколько секунд, когда пластина наклонена вертикально. - Инкубируйте не менее 1 часа при 37 °C до тех пор, пока прозрачный раствор не затвердеет и не станет непрозрачным белым, а гели не останутся на месте при вертикальном наклоне планшета (рис. 2A).
- Посев органоидов
- Проверьте качество этапа агрегирования. Убедитесь, что микромассы образуют сферические клеточные массы с компактным ядром, окруженным гало ЭТП с более низкой плотностью (рис. 3).
- Отрежьте кончик конуса P200 и промойте его раствором, препятствующим прилипанию (Таблица материалов). Чтобы собрать клеточные массы, наклоните планшет почти в вертикальное положение: микромассы опустятся к нижней стенке лунок и могут быть легко извлечены путем постепенного проталкивания наконечника пипетки на дно лунки во время аспирации.
- Засейте массу в верхней части гидрогелей, осторожно нанося их, не касаясь геля кончиком пипетки, соблюдая соотношения, представленные в таблице 1 (рисунок 2В). Даже если органоиды кажутся свободно плавающими на этой стадии, при набухании от питательной среды гель размягчится, и органоиды угнездятся в верхнем слое. Проверьте под микроскопом, чтобы в лунках Р96 не осталось органоида.
- Приготовьте необходимый объем питательной среды в соответствии с таблицами 1 и 2 и в каждую лунку медленно добавьте четверть объема в верхней части гидрогелей, не касаясь их, пипетируя вдоль стенок вставки, и оставшиеся три четверти на дне лунки, расположив пипетку между плечами подвесного вкладыша (рисунок 2С).
- Поместите 1 мл PBS в пустые культуральные лунки для поддержания влажности в тарелке. Инкубировать при 37 °C и 5%CO2.
- Культура органоидов тимуса
- На 2-й день проверьте, хорошо ли засеяны органоиды: гидрогели должны остаться на месте, и органоиды не должны иметь осадка на дне вставки.
- Приготовьте необходимое количество питательной среды, следуя Таблице 1 и Таблице 2. Удалите среду, направив кончик аспирационного конуса между плечами висящего вкладыша, стараясь не касаться геля. Добавьте новую среду, расположив пипетку таким же образом.
- Меняйте среду каждые 2 дня, переходя на среду второй фазы (Таблица 1) через 2–4 дня (на 18-й день после начала дифференцировки ТЭП).
ПРИМЕЧАНИЕ: Партия органоидов может сохраняться в культуре таким образом до 6 недель.
- Сбор органоидов
- Приготовьте пробирку объемом 15 мл с 1 мл TrypLE на лунку для сбора урожая.
- Разрежьте кончик конуса P1000 и покройте его раствором, препятствующим прилипанию. Аккуратно нанесите гель пипеткой, расположив наконечник пипетки вертикально в центре вставок (будьте осторожны, чтобы не проколоть мембрану), и перенесите его в пробирку TrypLE. Промойте мембрану вкладыша TrypLE и также перенесите на трубку.
- Инкубировать при 37 °C в течение 15 минут, осторожно вортексируя с интервалом в 5 минут. Следите за тем, чтобы гели и органоиды диссоциировали.
- Через 15 минут процедите фильтр с ячейкой 70 μм и вращайте при 200 x g в течение 5 минут. Повторно суспендируйте гранулу в промывном буфере и приступайте к выбору аналитического метода.
Результаты
Рабочий процесс протокола кратко представлен на рисунке 4. Для этой 3D-модели органоидной культуры мы использовали гидрогель тромбина и фибриногена, который ранее использовался нашей командой для поддержания первичных mTEC мышей в течение нескольких дней, благодаря физическим и механическим сигналам, которые он предоставлял. После полимеризации гель должен иметь рыхлую, губчатую сетчатую структуру (Рисунок 5).
После начальной фазы посева и прикрепления органоиды постепенно росли и развивались как на поверхности, так и в самых верхних слоях геля. В зависимости от свойств геля, условий затравливания и количества органоидов, засеянных на геле, органоиды образовывали сферические или продолговатые структуры (рис. 6) и иногда сливались, образуя более крупные структуры. После первой недели культивирования в органоидах наблюдались два конкретных подуровня организации: во-первых, мы наблюдали длинные, похожие на проекционные структуры клеточной поверхности, образованные крупными клетками, облучающими органоиды и колонизирующими гидрогель во всех направлениях (рис. 6 и рис. 7). Во-вторых, мы наблюдали кластерообразные структуры, образованные более мелкими клетками, концентрирующимися вокруг этих клеточных выступов. Несмотря на то, что нам не удалось выделить оба типа клеток для подтверждения гипотезы исследования, это явление напоминает трехмерные структуры, обнаруженные в коре головного мозга тимуса, образованные взаимодействием отдельных цТЭО с большим числом гораздо более мелких развивающихся Т-клеток, известных как комплексы клеток кормилицы тимуса11 (рис. 8).
В нескольких временных точках фазы культивирования органоидов мы оценивали клеточный состав органоидов тимуса с помощью проточной цитометрии и идентифицировали несколько ключевых компартментов: ТЭО (характеризуются как EPCAM+ CD45-), тимоциты (EPCAM-CD45+ CD3+) (рис. 9), а также компартмент EPCAM-CD45+ CD3-, включающий субпопуляции тимических гемопоэтических нетимоцитов. Более подробную информацию можно найти в Provin et al.23.
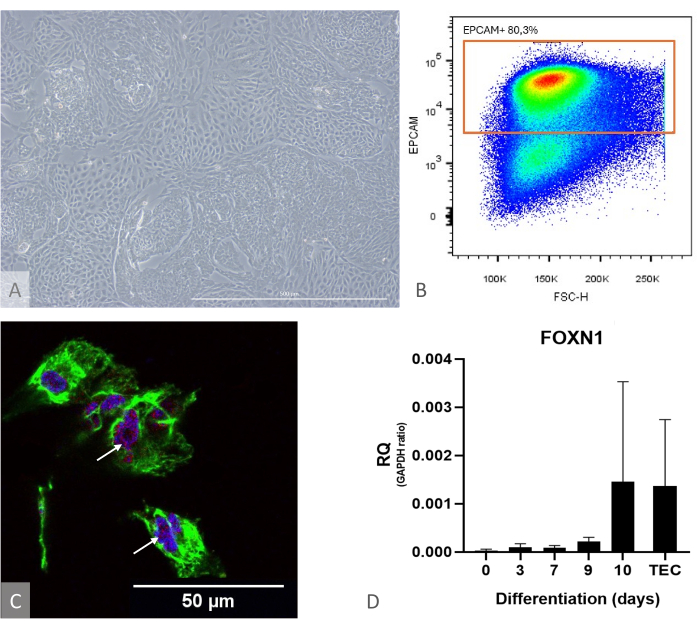
Рисунок 1: Характеристика дифференцировки iPSC в TEP. (A) Пример дифференцировки iPSC в TEP на D13, инвертированный фазово-контрастный микроскоп, 400x. Масштабная линейка: 500 мкм. (B) Пример точечной диаграммы, доля клеток EPCAM+ среди DAPI-клеток на 14-й день дифференцировки, изображение из FlowJo 10.0.7. (C) Иммуноокрашивание в отношении DAPI (синий), PAX9 (красный) и KRT8 (зеленый), иммунофлюоресценция и конфокальная визуализация на 16-й день дифференцировки iPSC в TEP. Белые стрелки указывают на примеры окрашивания анти-PAX9. Масштабная линейка: 50 мкм (D) Уровень экспрессии FOXN1 (RQ to GAPDH) во время дифференцировки iPS в TEP. TEC: положительный контрольный эталон, первичные ПТЭО человека, выделенные из образцов тимуса у детей. График из Prism (GraphPad версии 8.0.1). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
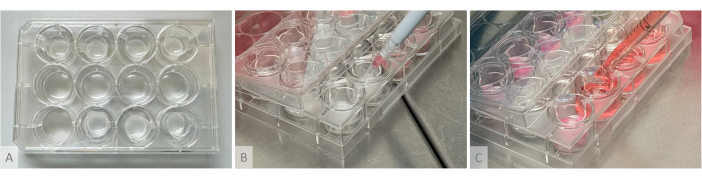
Рисунок 2: Экспериментальная установка для образования гидрогелей, засева органоидов и распределения питательной среды. (A) Культуральная пластина с гидрогелями, отлитыми в подвесные вставки, размещенные в верхнем и нижнем рядах. (B) Затравка органоидов: разрезанный конус пипетки, содержащий 1 органоид, помещается над гидрогелем, не касаясь его, и органоид аккуратно засевается на поверхность геля. (C) Питательная среда осаждается в культуральную лунку путем расположения кончика пипетки между плечами подвешенного вкладыша. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
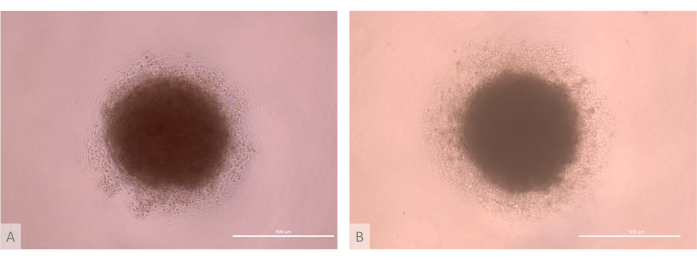
Рисунок 3: D0 культуры органоидов тимуса перед посевом (13-15 дни полного протокола). (А) органоид, полученный с использованием ТЭО, полученных из линии iPS Lon71.019. (B) Органоид, полученный с использованием ТЭО, полученных из линии MIPS203.003 iPS. Инвертированный фазово-контрастный микроскоп, 1000x. Масштабные линейки: 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
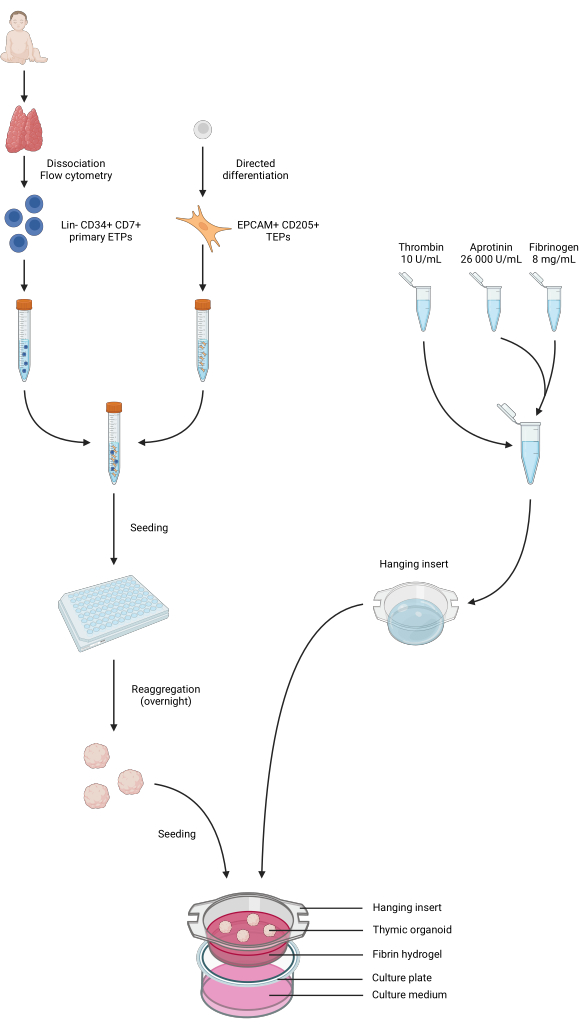
Рисунок 4: Обобщенное представление всех этапов протокола. Образцы тимуса у детей были собраны и диссоциированы, а первичные Lin-CD34+ CD7+ ETP были отсортированы с помощью проточной цитометрии. Дифференцировку iPS-клеток проводили в направлении идентичности TEP. ЭТП и ТЭП, полученные из iPS, были объединены и засеяны в 96-луночные планшеты с низким связыванием и агрегированы в органоиды тимуса в течение ночи. Фибриновые гидрогели получали из апротинина, фибриногена и тромбина и отливали в подвесные вкладыши. После полимеризации органоиды засеивали поверх гидрогелей, а в лунки добавляли питательную среду фазы 1. Органоиды хранились в культуре до 6 недель. Создано в BioRender, лицензия на публикацию AG26EFCZOM. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
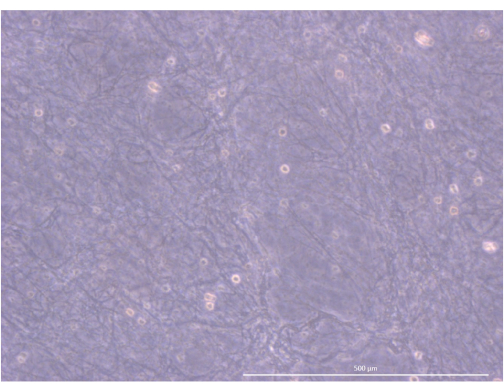
Рисунок 5: Организация и структура гидрогеля. Инвертированный фазово-контрастный микроскоп, 1000x. Масштабная линейка: 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
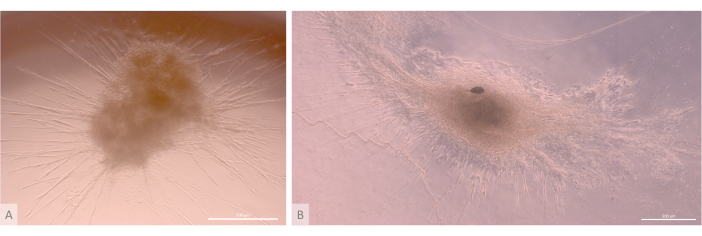
Рисунок 6: Зрелые органоиды и трехмерная структура. (A) Органоид тимуса на 24-й день 3D-культуры, линия MIPS203,003 iPS. (B) Составное изображение органоида тимуса на 32-й день 3D-культуры, линия Lon71.019 iPS. Инвертированный фазово-контрастный микроскоп. Масштабные линейки: 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
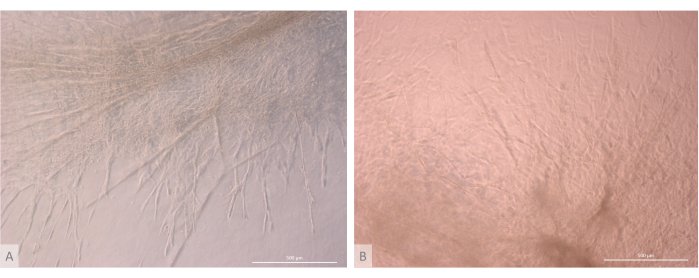
Рисунок 7: Детали структуры органоидов тимуса. (A) Органоид тимуса на 32-й день 3D-культуры, линия L71.019 iPS. (B) Органоид тимуса на 27-й день 3D-культуры, линия L80.002 iPS. Инвертированный фазово-контрастный микроскоп, 400x. Масштабные линейки: 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
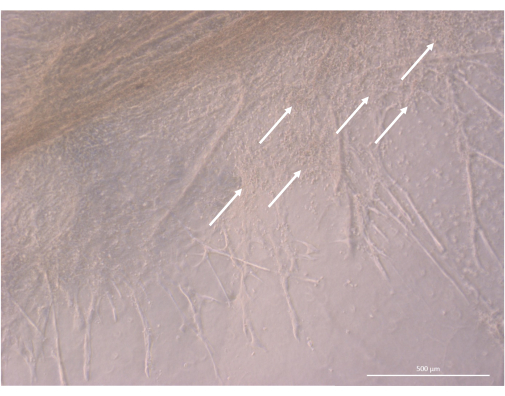
Рисунок 8: Детали структуры органоида тимуса на 32-й день 3D-культуры. Белые стрелки указывают на скопления мелких тимоцитов, пролиферирующих в непосредственной близости от клеток ПЭС. Инвертированный фазово-контрастный микроскоп, 400x. Масштабная линейка: 500 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
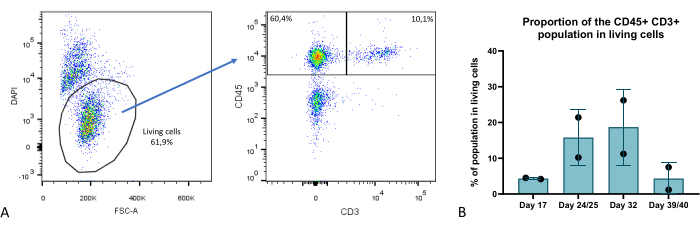
Рисунок 9: Доля компартмента Т-клеток в органоидах тимуса. (A) Пример точечной диаграммы, доля CD45+ CD3+ клеток в живых (DAPI-) клетках в органоидах тимуса на 35-й день 3D-культуры, изображение из FlowJo 10.0.7. Фракция CD45+ CD3- состоит из гемопоэтических клеток, не входящих в состав тимоцитов. (B) Доля CD45+ CD3+ клеток в живых клетках в органоидах тимуса на 17, 24/25, 32 и 39/40 день 3D-культуры, n=2 в техническом дубликате или в тройном экземпляре, график от Prism (GraphPad версии 8.0.1). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Единица | Фаза 1 средняя с 14 по 18 день | Фаза 2 средняя: День 19 и далее | |
| Основа | XVIVO10 | XVIVO10 | |
| БМП4 | нг/мл | 50 | |
| ФГФ8 | нг/мл | 10 | |
| ФГФ10 | нг/мл | 10 | |
| ИФР1 | нг/мл | 10 | |
| ЭФР | нг/мл | 10 | |
| РАНГ L | нг/мл | 50 | 50 |
| Ил7 | нг/мл | 5 | 5 |
| FLT3 Л | нг/мл | 5 | 5 |
| СКФ | нг/мл | 10 | 10 |
| Глутамакс | нг/мл | 1% | 1% |
Таблица 1: Добавки и их соответствующие концентрации.
| Апротинин (μл) | Тромбин (μл) | Фибриноген (μл) | Фаза 1 средняя | Органоиды (единицы) | |
| 24-луночный планшет | 5 | 75 | 75 | 1 | От 3 до 5 |
| 12-луночная пластина | 9.2 | 138.2 | 138.2 | 1.8 | 5 |
| 6-луночная пластина | 16 | 240.8 | 240.8 | 3.2 | 8 до 9 |
Таблица 2: Требуемые соотношения компонентов для приготовления гидрогелей и затравки органоидов в 6-, 12- и 24-луночных планшетах.
Обсуждение
По сравнению с классической монослойной культурой в 2D или даже более продвинутыми современными 3D-моделями, такими как RTOC (реагрегированная культура органов тимуса), модель, которую мы описываем здесь, представляет собой значительные улучшения. С технической точки зрения эта модель обеспечивает улучшенную масштабируемость и воспроизводимость, поскольку ТЭО создаются на основе самообновляющихся iPS-ячеек. Он также позволяет редактировать гены на стадии iPSC для более легких исследований в TEC. Выживаемость органоидов тимуса, показанная в этом исследовании, замечательна и обеспечивает значительное улучшение по сравнению с 2D или RTOC культурами, при этом продемонстрирована генерация Т-клеток в течение 6 недель (Рисунок 9). Таким образом, восстановление 3D-структуры тимуса и свойств ECM приводит к устойчивой функциональности тимуса в наших органоидах тимуса, т.е. к способности генерировать Т-клетки из наиболее зрелого компартмента тимоцитов, недавних эмигрантов тимуса примерно на 4-й неделе 3D-культуры, с генерацией как CD4+, так и CD8+ Т-клеток23.
Поскольку микроокружение тимуса поддерживает интенсивную экспансионистическую и дифференцировочную активность, надлежащий газообменный материал является решающим параметром в любой модели тимуса in vitro. Действительно, более высокие результаты наблюдались в моделях, поддерживаемых либо в обогащенной атмосфере дикислорода, либо на границе раздела воздух-жидкость21,35. Наши наблюдения подтверждают эту точку зрения и подчеркивают важность правильного засева органоидов в верхней части гидрогеля непосредственно под воздушным интерфейсом. Дефекты полимеризации, приводящие к вязким или жидким гидрогелям, вызовут погружение органоидов в нижней части вставок и препятствуют их росту. Кокультура с эндотелиальными клетками на чипе является многообещающей альтернативой, которая может разрушить этот барьер за счет добавления васкуляризации. Размер органоидов тимуса, полученных в этом исследовании, ограничен примерно 5 мм, предположительно из-за недостатка газообмена и обмена питательных веществ в основных областях. Таким образом, васкуляризация позволит масштабировать культуру и, в сочетании с оптимизацией процесса, позволит производить органоиды, содержащие миллионы ТЭК и Т-клеток. Плотность гидрогеля также является важным параметром, а его воспроизводимость в партиях является одним из основных ограничений протокола, учитывая чувствительность ферментов к циклам замораживания и размораживания. Этап литья гидрогеля является критически важным этапом в протоколе; Мы рекомендуем проводить тест путем литья одного гидрогеля за 1 час до любого запланированного эксперимента для проверки активности реагента. В случае недостаточной ферментативной активности, приводящей к нарушению полимеризации, и учитывая стоимость ПЭП, полученных из ИПСК, мы не советуем ничего другого, кроме как начать протокол заново со свежими аликвотами реагентов. ТЭО являются важными производителями ECM; Однако, учитывая последние достижения в понимании роли фибробластов тимуса, может быть интересно добавить популяцию облученных фибробластов в органоидную модель. Эта популяция может секретировать факторы роста и ВКМ, которые будут участвовать в воспроизводстве среды тимуса, оказывая положительное влияние на дифференцировку и поддержание ТЭК и Т-клеток. Другим важным ограничением этой модели органоида тимуса является отсутствие надлежащей кортико-медуллярной сегрегации. Поскольку было показано, что капсульные фибробласты тимуса формируют формирование коры головного мозга, их добавление в культуральную модель может помочь устранить это ограничение. Таким образом, данный протокол положен в основу сложных in vitro моделей вилочковой железы. Он сочетает в себе последние достижения в области дифференцировки iPSC тимуса, 3D-культур на основе гидрогеля и лимфопоэза in vitro. Эта модель может быть дополнительно усовершенствована для решения проблемы масштабируемости и повышения ее сложности, например, путем добавления мезенхимальных и сосудистых компартментов. Таким образом, это может привести к созданию ценных исследовательских платформ по иммунитету или применению в персонализированной клеточной терапии на основе Т-клеток.
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Мы хотим поблагодарить членов основного центра iPSC в Нанте, Франция, во главе с Лораном Давидом. Эта работа была поддержана программой JP-Rare Disease JTC2019 проектом TARID (EJPRD19-208), финансируемым ANR (ANR-19-RAR40011-5) для M.G., грантом RFI Bioregate (ThymIPS) от la Région Pays de la Loire для M.G., ANR (ANR-22-CE15-0045) для M.G. и проектом "SATT Ouest Valorisation" OrgaTreg to M.G. N.P. при поддержке "la fondation d'entreprise ProGreffe". M.d.A. был поддержан "La Fondation pour la Recherche Médicale". Мы благодарим ядро iPSC в Нанте, поддерживаемое IBiSA и Biogenouest, за использование их ресурсов и техническую поддержку. Эта работа была частично профинансирована программой Labex IGO, поддержанной Национальным исследовательским агентством через инвестиции будущей программы ANR-11-LABX-0016-01.
Материалы
| Name | Company | Catalog Number | Comments |
| Aprotinin | Sigma Aldrich | 616370 | |
| BMP4 | Miltenyi | 130-111-165 | |
| CCR7 (CD197) | BD Biosciences | PE | Clone: 3D12; Dilution: 1: 200 |
| CD14 | BD Biosciences | FITC | Clone: M5E2; Dilution: 1: 200 |
| CD19 | BD Biosciences | PE | Clone: HIB19; Dilution: 1: 200 |
| CD205 | BioLegend | FITC | Clone: MG38; Dilution: 1: 200 |
| CD3 | BD Biosciences | PE | Clone: HIT3a; Dilution: 1: 200 |
| CD34 | BD Biosciences | FITC | Clone: 8G12; Dilution: 1: 100 |
| CD4 | BD Biosciences | PE | Clone: RPA-T4; Dilution: 1: 100 |
| CD4 | BD Biosciences | BV711 | Clone: L200; Dilution: 1: 200 |
| CD45 | BD Biosciences | PerCP | Clone: HI30; Dilution: 1: 200 |
| CD56 | BD Biosciences | PE | Clone: B159; Dilution: 1: 200 |
| CD62L | BD Biosciences | BV605 | Clone: DREG-56; Dilution: 1: 200 |
| CD69 | BD Biosciences | BV510 | Clone: FN50; Dilution: 1: 200 |
| CD7 | BD Biosciences | APC | Clone: M-T701; Dilution: 1: 200 |
| CD8 | BD Biosciences | PeCy7 | Clone: RPA-T8; Dilution: 1: 200 |
| CD8 | BD Biosciences | PE | Clone: HIT8a; Dilution: 1: 200 |
| Dynabeads Pan Mouse IgG | Invitrogen | 11041 | |
| EGF | Miltenyi | 130-097-751 | |
| EPCAM (CD326) | BD Biosciences | PE | Clone: HEA-125; Dilution: 1: 200 |
| EPCAM (CD326) | Miltenyi | BV711 | Clone: EBA-1; Dilution: 1: 200 |
| FGF10 | Miltenyi | 130-127-858 | |
| FGF8 | Biotechne R&D | 423-F8 | |
| Fibrinogen | Sigma Aldrich | 341578 | |
| FLT3 L | Peprotech | AF-300-19 | |
| Glutamax | Gibco | 35050-61 | |
| IGF1 | Miltenyi | 130-093-886 | |
| IL7 | Peprotech | AF-200-07 | |
| RANK L | Biotechne R&D | 6449-TEC | |
| Red blood cell lysis solution | Miltenyi | 130-094-183 | |
| RPMI1640 | Gibco | 11875093 | |
| SCF | Peprotech | AF-300-07 | |
| Thrombin | Sigma Aldrich | 605190 | |
| TrypLE | Gibco | 2605010 | |
| XVIVO10 | Lonza | LONBE04-380Q |
Ссылки
- Starr, T. K., Jameson, S. C., Hogquist, K. A. Positive and negative selection of T cells. Annu Rev Immunol. 21, 139-176 (2003).
- Carpenter, A. C., Bosselut, R. Decision checkpoints in the thymus. Nat Immunol. 11 (8), 666-673 (2010).
- Miller, J. F. A. P. The function of the thymus and its impact on modern medicine. Science. 369 (6503), (2020).
- Haddad, R., et al. Dynamics of thymus-colonizing cells during human development. Immunity. 24 (2), 217-230 (2006).
- Cumano, A., et al. New molecular insights into immune cell development. Annu Rev Immunol. 37, 497-519 (2019).
- Bautista, J. L., et al. Single-cell transcriptional profiling of human thymic stroma uncovers novel cellular heterogeneity in the thymic medulla. Nat Commun. 12 (1), 1096 (2021).
- Kadouri, N., Nevo, S., Goldfarb, Y., Abramson, J. Thymic epithelial cell heterogeneity: TEC by TEC. Nat Rev Immunol. 20 (4), 239-253 (2020).
- Alves, N. L., et al. Serial progression of cortical and medullary thymic epithelial microenvironments. Eur J Immunol. 44 (1), 16-22 (2014).
- Baik, S., Jenkinson, E. J., Lane, P. J. L., Anderson, G., Jenkinson, W. E. Generation of both cortical and Aire+ medullary thymic epithelial compartments from CD205+ progenitors. Eur J Immunol. 43 (3), 589-594 (2013).
- Tavian, M., Peault, B. Embryonic development of the human hematopoietic system. Int J Dev Biol. 49 (2-3), 243-250 (2005).
- Abramson, J., Anderson, G. Thymic epithelial cells. Annu Rev Immunol. 35 (1), 85-118 (2017).
- Anderson, M. S., et al. Projection of an immunological self shadow within the thymus by the aire protein. Science. 298 (5597), 1395-1401 (2002).
- Sharma, H., Moroni, L. Recent advancements in regenerative approaches for thymus rejuvenation. Adv Sci. 8 (14), 2100543 (2021).
- Alenghat, F. J., Ingber, D. E. Mechanotransduction: all signals point to cytoskeleton, matrix, and integrins. Sci STKE. 2002 (119), 6 (2002).
- Pinto, S., Schmidt, K., Egle, S., Stark, H. -. J., Boukamp, P., Kyewski, B. An organotypic coculture model supporting proliferation and differentiation of medullary thymic epithelial cells and promiscuous gene expression. J Immunol. 190 (3), 1085-1093 (2013).
- Hun, M., Barsanti, M., Wong, K., Ramshaw, J., Werkmeister, J., Chidgey, A. P. Native thymic extracellular matrix improves in vivo thymic organoid T cell output, and drives in vitro thymic epithelial cell differentiation. Biomaterials. 118, 1-15 (2017).
- Asnaghi, M. A., et al. Thymus extracellular matrix-derived scaffolds support graft-resident thymopoiesis and long-term in vitro culture of adult thymic epithelial cells. Adv Funct Mater. 31 (20), 2010747 (2021).
- Villegas, J. A., et al. Cultured human thymic-derived cells display medullary thymic epithelial cell phenotype and functionality. Front Immunol. 9, 1663 (2018).
- Hauri-Hohl, M., Zuklys, S., Holländer, G. A., Ziegler, S. F. A regulatory role for TGF-β signaling in the establishment and function of the thymic medulla. Nat Immunol. 15 (6), 554-561 (2014).
- Campinoti, S., et al. Reconstitution of a functional human thymus by postnatal stromal progenitor cells and natural whole-organ scaffolds. Nat Commun. 11 (1), 6372 (2020).
- Ramos, S. A., et al. Generation of functional thymic organoids from human pluripotent stem cells. Stem Cell Reports. 18 (4), 829-840 (2023).
- Fan, Y., et al. Bioengineering thymus organoids to restore thymic function and induce donor-specific immune tolerance to allografts. Mol Ther. 23 (7), 1262-1277 (2015).
- Provin, N., et al. Combinatory differentiation of human induced pluripotent stem cells generates thymic epithelium that supports thymic crosstalk and directs dendritic- and CD4/CD8 T-cell full development. bioRxiv. 2023, 572664 (2023).
- Parent, A. V., et al. Generation of functional thymic epithelium from human embryonic stem cells that supports host T cell development. Cell Stem Cell. 13 (2), 219-229 (2013).
- Sun, X., et al. Directed differentiation of human embryonic stem cells into thymic epithelial progenitor-like cells reconstitutes the thymic microenvironment in vivo. Cell Stem Cell. 13 (2), 230-236 (2013).
- Inami, Y., et al. Differentiation of induced pluripotent stem cells to thymic epithelial cells by phenotype. Immunol Cell Biol. 89 (2), 314-321 (2011).
- Gras-Pena, R., et al. Human stem cell-derived thymic epithelial cells enhance human T cell development in a xenogeneic thymus. J Allergy Clin Immunol. 149 (5), 1755-1771 (2022).
- Lai, L., Jin, J. Generation of thymic epithelial cell progenitors by mouse embryonic stem cells. Stem Cells. 27 (12), 3012-3020 (2009).
- Ramos, S. A., et al. Generation of functional human thymic cells from induced pluripotent stem cells. J Allergy Clin Immunol. 149 (2), 767-781 (2022).
- Provin, N., Giraud, M. Differentiation of pluripotent stem cells into thymic epithelial cells and generation of thymic organoids: Applications for therapeutic strategies against APECED. Front Immunol. 13, 930963 (2022).
- Montel-Hagen, A., et al. In vitro recapitulation of murine thymopoiesis from single hematopoietic stem cells. Cell Rep. 33 (4), 108320 (2020).
- Park, J. -. E., et al. A cell atlas of human thymic development defines T cell repertoire formation. Science. 367 (6480), 3224 (2020).
- Flippe, L., et al. Rapid and reproducible differentiation of hematopoietic and T cell progenitors from pluripotent stem cells. Front Cell Dev Biol. 8, 577464 (2020).
- Padonou, F., et al. Aire-dependent transcripts escape Raver2-induced splice-event inclusion in the thymic epithelium. EMBO Rep. 23 (3), e53576 (2022).
- Han, J., Zúñiga-Pflücker, J. C. High-oxygen submersion fetal thymus organ cultures enable FOXN1-dependent and -independent support of T lymphopoiesis. Front Immunol. 12, 652665 (2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены