Органоиды поверхностного эпителия яичников человека как платформа для изучения регенерации тканей
* Эти авторы внесли равный вклад
В этой статье
Резюме
Этот протокол описывает создание трехмерных (3D) тканевых органоидов из первичных клеток эпителия поверхности яичников человека (hOSE). Протокол включает выделение hOSE из свежесобранных яичников, клеточное расширение hOSE, процедуры криоконсервации-размораживания и деривацию органоидов. В него включены иммунофлюоресценция, количественный анализ и демонстрация полезности в качестве платформы для скрининга.
Аннотация
Поверхностный эпителий яичников (OSE), самый внешний слой яичника, претерпевает разрыв во время каждой овуляции и играет решающую роль в заживлении ран яичников, восстанавливая целостность яичников. Кроме того, OSE может служить источником эпителиального рака яичников. Несмотря на то, что регенеративные свойства OSE были хорошо изучены на мышах, понимание точного механизма восстановления тканей яичников человека остается затрудненным из-за ограниченного доступа к яичникам человека и подходящих протоколов культивирования in vitro . Тканеспецифические органоиды, миниатюрные модели in vitro , воспроизводящие как структурные, так и функциональные аспекты исходного органа, открывают новые возможности для изучения физиологии органа, моделирования заболеваний и тестирования лекарств.
В этой статье мы описываем метод выделения первичной человеческой ОГЭ (hOSE) из цельных яичников и создания органоидов hOSE. Мы включили морфологическую и клеточную характеристику, показывающую гетерогенность между донорами. Кроме того, мы демонстрируем способность этого метода культивирования оценивать гормональное влияние на рост OSE-органоидов в течение 2-недельного периода. Этот метод может позволить обнаружить факторы, способствующие регенерации ОГЭ, и облегчить скрининг злокачественных ОГЭ для конкретного пациента.
Введение
Яичники считаются одним из самых динамичных органов в организме, претерпевая постоянные циклы заживления ран и ремоделирования на протяжении всей репродуктивной жизни человека. Основным игроком, участвующим в регенерации ткани яичников после каждого овуляторного цикла, является поверхностный эпителий яичников (OSE)1. OSE представляет собой одиночный слой, полученный из мезотелия, содержащий плоские, кубовидные и столбчатые эпителиальные клетки, которые покрывают всю поверхность яичников2. Перед овуляцией стромальная ткань яичника на поверхности овуляторного фолликула подвергается протеолитическому разрушению, что позволяет высвобождать кумулюс-ооцитарный комплекс. Затем поврежденная область, известная как овуляторное клеймо, восстанавливается, при этом полное закрытие поверхности яичника достигается менее чем за 72 часа у мышей3. Высокоэффективная способность OSE к пролиферации и закрытию овуляторной раны подчеркивает предполагаемое существование резидентной популяции стволовых клеток4. Из-за ограниченной доступности человеческих яичников от доноров репродуктивного возраста, большая часть знаний о механизмах репарации OSE поступает от животных моделей. Тем не менее, видоспецифичные особенности препятствуют переносу исследований яичников на животных на человека5.
В исследованиях in vitro преимущественно использовалась двумерная (2D) клеточная культура человеческого ОГЭ, при которой клетки росли в монослое, прикрепленном к поверхности культивальной пластины, из-за ее экономической эффективности и простоты культивирования 6,7,8. Тем не менее, этот подход имеет ограничения, воспроизводящие сложность динамики ткани яичников9. В связи с этим платформы 3D-клеточных культур с особым акцентом на органоиды яичников произвели революцию в исследованиях яичников10. Тканевые органоиды представляют собой миниатюрные in vitro представления органа, из которого они получены, демонстрируя способность к 3D-самоорганизации и имитируя ключевые функции и структуры своих аналогов in vivo. Эта технология дает возможность пролить свет на фундаментальные вопросы, касающиеся развития, регенерации и восстановления тканей яичников человека. В последние годы исследователи также применили знания об органоидах яичников для создания органоидов рака яичников (РЯ), специфичных для пациента, для моделирования заболеваний и персонализированной медицины 12,13,14.
Основываясь на различных методах, используемых для получения органоидов OSE у мышей и органоидов15,16 фаллопиевых труб (FT), а также органоидов OSE12 и FT органоидов17 человека, мы описываем здесь протокол получения органоидов OSE человека из яичников человека с потенциальными применениями в исследованиях регенерации OSE. Этот протокол эффективно изолирует первичные клетки OSE из цельных яичников человека и включает в себя пошаговое описание 2D-экспансии клеток и 3D-генерации органоидов hOSE. Органоиды hOSE продемонстрировали (специфичную для доноров) изменчивость морфологии и роста, что подчеркивает их полезность для персонализированных исследований. Кроме того, этот протокол включает поддержание органоидов hOSE, пассирование и иммунофлюоресценцию в пределах одной и той же культуральной пластины. Кроме того, в нем дается описание различной морфологии, которую могут принимать органоиды hOSE, и характеризуются изменения иммунофенотипа во время культивирования. Наконец, он демонстрирует полезность, исследуя влияние сигналов окружающей среды, таких как гормоны яичников, на формирование и рост органоидов hOSE на основе количества и размера органоидов hOSE.
Применение технологии органоидов hOSE улучшит наше понимание яичника, уделяя особое внимание механизмам, отвечающим за его замечательную регенеративную способность. По мере того, как 3D-модели яичников человека продолжают развиваться, зависимость от животных моделей в исследованиях яичников будет уменьшаться, что приведет к инновационным методам лечения в области регенеративноймедицины.
протокол
Исследование проводилось в соответствии с руководящими принципами Хельсинкской декларации. План исследования был представлен в Комитет по медицинской этике Медицинского центра Лейденского университета (LUMC), и до начала исследования было получено письмо об отсутствии возражений (B18.029). Первичная ткань яичников человека была собрана у трансмаскулинных людей, перенесших операцию по изменению пола в больнице VUmc (Амстердам, Нидерланды). Подписанное информированное согласие было получено от всех доноров. Все материалы, используемые в этом протоколе, перечислены в Таблице материалов.
1. Выделение первичных клеток ОГЭ человека
- После овариэктомии поместите яичники в 0,9% NaCl или аналогичный стерильный физиологический раствор и транспортируйте его в лабораторию на льду.
- Перенесите отдельные яичники в коническую трубку объемом 50 мл, содержащую 2-3 мл среды для сбраживания (Таблица 1) или достаточную для покрытия яичника.
ВНИМАНИЕ: Если яичник не поврежден (часть органа была разрезана для гистологического анализа), крайне важно не закрывать эту часть средой для пищеварения. - Поместите трубку в предварительно разогретую ванну с шариками (или водяную баню) при температуре 37 °C на 30 минут.
- Осторожно переложите завязь в чашку Петри диаметром 60 мм, содержащую 10 мл среды для сбора (Таблица 1).
- Аккуратно соскребите поверхность яичника, содержащую клетки hOSE, с помощью скребка для клеток. Промойте скребок в среде и повторите этот шаг не менее трех раз (рисунок 1).
ВНИМАНИЕ: Если яичник не поврежден, избегайте соскабливания и погружения поврежденного участка, чтобы свести к минимуму загрязнение нежелательными типами клеток. - Перенесите клетки hOSE из среды для сбора в пробирку объемом 15 мл.
- Вращайте клетки hOSE при 240 x g в течение 5 минут.
- Если гранула имеет красный цвет, свидетельствующий о загрязнении эритроцитами (эритроцитами), повторно суспендируйте гранулу 1 мл буфера для лизиса эритроцитов. Инкубировать в течение 3 минут при комнатной температуре (RT) с периодическим пипетированием, добавить 4 мл PBS с кальцием и магнием (PBS+/+) и центрифугировать при 240 x g в течение 5 минут. Если эритроцит не исчезает, повторите этот шаг.
- Криоконсервируйте клеточную гранулу hOSE (раздел 2), используйте ее для 2D-культивирования (раздел 3) или 3D-органоидов (раздел 4) (рис. 1).
2. Криоконсервация-размораживание клеток hOSE
- Криоконсервация
- Ресуспендируйте клеточную гранулу hOSE в 1 мл среды для замораживания клеток.
- Перенесите клеточную суспензию в криовиалы (2 криовалиала на яичник).
- Поместите криовиалы в контейнер для заморозки и поместите его при температуре -80 °C на ночь.
- Переложите замороженные криовиалы в резервуар с жидким азотом для длительного хранения.
- Таяние:
- Удалите криовиал из жидкого азота.
- Поместите криовиал в предварительно подогретую ванну с шариками (или водяную баню) при температуре 37 °C на 5 минут или до тех пор, пока внутри криовиала не будет видно только небольшое замороженное ядро.
- Пипетируйте суспензию клеток hOSE в пробирку объемом 15 мл с 10 мл среды для сбора (табл. 1).
- Центрифугируйте при 240 х г в течение 5 мин.
- Используйте клеточную гранулу hOSE для 2D-культуры (раздел 3) или 3D-органоидов (раздел 4).
3. 2D культура hOSE в монослое
- Повторно суспендируйте гранулу hOSE в 1 мл OSE_2D среды (табл. 1) и переложите ее в одну лунку из 12-луночного планшета.
- Добавьте в лунку дополнительно 1 мл OSE_2D среды и культивируйте при температуре 37 °C в увлажненном инкубаторе (5%CO2) в течение 72 часов, чтобы убедиться, что клетки hOSE прикрепились до первой смены среды.
- Обновляйте среду каждые 2-3 дня до тех пор, пока клетки hOSE не достигнут 70%-90% конфлюенции (P0) (рисунок 2A).
Примечание: Если эритроциты все еще присутствуют в культуре, они будут удалены во время первой смены среды, и только клетки hOSE останутся прикрепленными к лунке. - Для пассирования клеток hOSE выполните действия, описанные ниже.
- Удалите питательные среды из лунки.
- Умыться 1 мл стерильного PBS.
- Удалите PBS и добавьте достаточное количество 0,05% трипсина/ЭДТА, чтобы покрыть клетки.
- Поместите планшет при температуре 37 °C во увлажненный инкубатор (5%CO2) на 4-7 минут, пока не заметите, что ячейки округляются и отделяются от лунки.
- Остановите ферментативную реакцию, добавив 1 мл среды для сбора.
- Соберите клетки hOSE и центрифугируйте при 240 x g в течение 5 минут.
- Затравите клетки в новую лунку с желаемой плотностью, обновляйте среду каждые 2-3 дня до тех пор, пока клетки hOSE не достигнут 70%-90% конфлюенции, и повторяйте шаг 3.4.
ПРИМЕЧАНИЕ: Первичные клетки hOSE могут быть культивированы до трех пассажей. После этого большая часть клеток станет стареющей (Рисунок 2А).
- Используйте расширенные клетки hOSE для дальнейшей характеристики с помощью иммунофлуоресценции (рис. 2B) для проверки эффектов питательных сред (рис. 2C) или для 3D-органоидов (раздел 4).
4. 3D культуре органоидов hOSE
- Предварительно прогрейте многолуночное предметное стекло при температуре 37 °C.
- Подсчет (свежевыделенных или криоконсервированных-размороженных) hOSE-клеток с помощью автоматизированного счетчика клеток или вручную с помощью гемоцитометра.
- Ресуспендируйте желаемое количество клеток hOSE в 1 мл ледяной основной среды органоида OSE (табл. 1) в пробирке объемом 1,5 мл.
- Центрифугируйте при 240 х г в течение 5 мин.
- Повторно суспендируйте гранулу hOSE в желаемом количестве ледяного неразбавленного раствора экстракта базальной мембраны (BME) для получения клеточной концентрации 1 x 104 клеток/10 μл BME.
- Пипетка hOSE-BME раствор вверх и вниз для обеспечения равномерного распределения.
- Внесите 10 мкл капель раствора hOSE-BME на лунку в предварительно нагретое многолуночное предметное стекло.
ПРИМЕЧАНИЕ: Убедитесь, что каждая капля находится в центре лунки, чтобы получить форму капли. - Поместите планшет с каплями вверх дном при температуре 37 °C во влажный инкубатор (5%CO2) на 15 минут, чтобы гель затвердел.
- Добавьте 100 мкл OSE_3D среду (Таблица 1) и заквашивайте при 37 °C в увлажненном инкубаторе (5%CO2).
- Обновляйте средство каждые 3-4 дня.
Примечание: органоиды hOSE продолжают расти, по крайней мере, до 28 дней в культуре (рис. 3A, B), но рекомендуется пассаж каждые 14-28 дней (скорость роста зависит от донора, свежий против криоHOSE) рекомендуется для стимуляции пролиферации клеток и выживания органоидов. Три независимые органоидные линии hOSE были пройдены не менее 4 раз без признаков старения. Органоиды hOSE имеют различную морфологию (рис. 3C). - Для прохождения органоидов hOSE:
- Удалите среду и добавьте в каждую лунку по 100 мкл ледяного усовершенствованного DMEM/F12.
- Соскребите дно лунок наконечником для пипетки P1000, чтобы отделить капли геля.
- Перенесите каждую плавающую каплю геля в пробирку объемом 1,5 мл.
- Центрифугируйте пробирки с каплями геля при концентрации 240 х г в течение 5 минут.
- Удалите надосадочную жидкость, повторно суспендируйте гранулу в 300 мкл буфера для диссоциации клеток и поместите пробирки в предварительно нагретую ванну с шариками (или водяную баню) при температуре 37 °C на 5-10 минут.
ПРИМЕЧАНИЕ: Если некоторые органоиды остались неповрежденными, сделайте пару раз пипетку вверх и вниз с помощью холодного наконечника пипетки, покрытого бычьей сывороткой, чтобы механически разрушить их. Покрытие кончиков пипеток сывороткой плода крупного рогатого скота предотвращает прилипание органоидов к кончику. - Добавьте 300 μл основной органоидной среды hOSE и центрифугируйте при 240 x g в течение 5 минут.
- Повторно суспендируйте гранулы в желаемом количестве неразбавленного раствора BME, повторно засейте их в подходящем соотношении (распределите содержание 1 капли на 1-4 капли) и заквашивайте, как указано выше.
Примечание: Органоиды не диссоциированы на отдельные клетки, и, следовательно, клетки не могут быть точно подсчитаны для дальнейшего прохождения.
5. Полноразмерная иммунофлуоресценция 3D hOSE-органоидов
ПРИМЕЧАНИЕ: Полноразмерная иммунофлуоресценция может быть выполнена в одной и той же культуральной лунке (в каплях) при использовании многолуночных камерных стекол, подходящих для методов микроскопии.
- Зафиксировать органоиды hOSE в каплях в 4% параформальдегиде (PFA) в течение 20 минут при RT.
- Дважды вымыть PBS в течение 5 минут при RT на вращающейся/встряхивающей платформе.
- Пермеабилизируйте органоиды hOSE в каплях с использованием 100 мкл буфера для пермеабилизации (табл. 1) в течение 15 мин при ОТ.
- Промойте три раза с 100 мкл блокирующего буфера (Таблица 1) в течение 15 минут при RT и заблокируйте на ночь (o/n) при 4 °C на вращающейся/встряхивающей платформе.
- Инкубируют со 100 мкл первичной смеси антител, разведенной в блокирующем буфере при 4 °C o/n на вращающейся/встряхивающей платформе.
ПРИМЕЧАНИЕ: В Таблице материалов приведен список используемых первичных антител, маркированный тип клеток и животная модель, используемая для валидации экспрессии 12,19,20,21,22,23,24,25. - Поднесите пластину к RT и трижды промойте ее 100 μL блокирующего буфера в течение 15 минут при RT на вращающейся/встряхивающей платформе.
- Инкубировать со 100 мкл вторичной смеси антител, разведенной в блокирующем буфере в течение 2 ч при ОТ на вращающейся/встряхивающей платформе, но защищенной от света.
ПРИМЕЧАНИЕ: Список используемых вторичных антител см. в Таблице материалов . Для защиты от света либо поместите пластину внутрь темного ящика, либо накройте его алюминиевой фольгой. - Трижды промыть в 100 мкл PBS в течение 15 мин при RT на вращающейся/встряхивающей платформе.
- Храните пластину при температуре 4 °C, накрытую алюминиевой фольгой, до получения изображения (Рисунок 4).
6. Количественная оценка размера органоида hOSE
- Сделайте 10-кратные снимки светлого поля (изображение в формате TIFF) на микроскопе.
- Скачать и установить Fiji (https://imagej.net/software/fiji/)26.
- Измерьте площадь изображения органоидов hOSE с помощью программного обеспечения ImageJ Fiji:
- Загрузка файлов изображения TIFF на Фиджи.
- Создайте порог для распознавания органоидов hOSE (более темная область) на загруженном изображении светлого поля, нажав на Изображение > Настроить > порог. Отрегулируйте значения снизу и вверху до тех пор, пока большая часть фона не будет удалена и отдельные органоиды не будут сохранены.
- Откройте инструмент ROI, нажав на кнопку «Анализ» > инструмент > ROI.
- Выберите инструмент « Палочка » и кликайте по области с органоидом hOSE, пока не увидите желтую линию, окружающую весь периметр органоида. На панели ROI нажмите кнопку Добавить и измерить , чтобы получить значение площади этого органоида OSE.
- Повторите шаг 6.3.4. для измерения каждого органоида hOSE.
Результаты
2D посев hOSE
Свежевыделенные клетки hOSE были помещены на 12-луночный планшет и культивировались в течение 3 недель. За этот период клетки были пассированы три раза (рис. 2А). Первичные клетки hOSE в культуре демонстрировали булыжную морфологию вплоть до пассажа 3 (P3), но после этого начали проявлять признаки старения, в соответствии с предыдущими результатами, сообщающими об ограниченном периоде прохождения hOSE27. Кроме того, было показано, что мышиный OSE претерпевает эпителиально-мезенхимальный переход (EMT) in vitro, проявляя фибробластоподобные особенности, такие как перестройка цитоскелета актина и отложение коллагена I19. В соответствии с этим, ACTA2+CD44+ hOSE продемонстрировала выраженную апрегуляцию COL1A1 между P2 и P3 (рис. 2B), что позволяет предположить, что клетки hOSE подвергаются ЭМП во время культивирования.
Передача сигналов TGF-β является основным регулятором EMT28, способным индуцировать EMT в различных типах эпителиальных клеток29. Хотя TGF-β не добавлялся в OSE_2D среды, добавленный FBS мог содержать обнаруживаемые уровни этого цитокина30,31. По этой причине мы проверили, может ли добавление рецептора ингибитора TGF-β типа I SB-431542 предотвратить ЭМП, что позволяет продлить двумерное культивирование. Удивительно, но добавление в OSE_2D среды 10 мкМ SB-43154232препятствовало пролиферации клеток (рис. 2C). Мы пришли к выводу, что передача сигналов TGF-β имеет важное значение для пролиферации OSE, и дальнейшие эксперименты с 2D-культурами проводились без ингибитора.
3D культура органоидов hOSE
На основании опубликованных условий культивирования для выращивания человеческих органоидов OSE12 мы получили органоиды hOSE, встроенные в капли BME и выращенные в среде (содержащей стандартную концентрацию 100 нМ эстрадиола) OSE_3D течение 28 дней. В течение 7 дней многие органоиды hOSE, полученные из свежевыделенных клеток OSE, были кистозными со средним диаметром 130 мм (рис. 3A, B). Эти результаты были аналогичны тем, о которых сообщили Коппер и его коллеги о получении органоидов hOSE из измельченной и ферментативно перевареннойткани яичников человека. Интересно, что органоиды hOSE, полученные из свежевыделенных клеток OSE, выросли больше (средний диаметр 160 мм), чем органоиды hOSE из 2D-расширенных клеток OSE (средний диаметр 100 мм) после 14 дней в культуре (рис. 3B), вероятно, из-за склонности 2D-расширенных клеток OSE к снижению пролиферации. Кроме того, в то время как многие 3D-органоиды hOSE состояли из монослоя плоских эпителиальных клеток (рисунок 3C верхняя левая панель), некоторые из них имели кубовидный монослой клеток (рисунок 3C верхняя правая панель), другие были многослойными (рисунок 3C внизу справа) или образовывали нелюменизированный клеточный кластер (рисунок 3C внизу слева).
Чтобы проверить, можно ли получить органоиды hOSE с использованием OSE_2D среды, свежевыделенные клетки hOSE были помещены в капли BME и выращены в OSE_2D среде в течение 12 дней. Через 6 дней были видны веретенообразные клетки, что позволяет предположить, что клетки hOSE подвергались ЭМП в каплях. Важно отметить, что при использовании OSE_2D среды не образовывались органоиды hOSE (рис. 3D).
Клеточные характеристики органоидов hOSE
В яичниках взрослого человека кератин 8 (KRT8) специфически маркирует популяцию OSE (рисунок 4A), и, соответственно, органоиды hOSE сохранили экспрессию KRT8, подтверждая их клеточную идентичность (рисунок 4B). В клетках OSE мышей ядерная локализация Yes1-ассоциированного белка (YAP1) была специфически связана со стволовыми/прогениторными клетками OSE, способными расширять и заживлять поврежденный участок после овуляции24,33. YAP показал ядерную локализацию в большинстве клеток в органоидах hOSE независимо от их размера (рис. 4B). Также были исследованы другие маркеры, экспрессируемые в клетках OSE мышей, такие как CD4420 и LGR522. Интересно, что как CD44, так и LGR5 экспрессировались в небольших органоидах hOSE (<100 мкм в диаметре), в то время как в более крупных органоидах CD44 и LGR5 казались подавленными (рис. 4B).
Затем мы исследовали, демонстрируют ли органоиды hOSE апикально-базальную полярность, типичную для органоидов, встроенных в BME (apical-in)34. Базолатеральный белок интегрин бета 1 (ITGB1) и апикальный белок подокаликсин (PODXL) были использованы для демонстрации полярности клеток в органоидах hOSE, что подтверждает четкую апикальную полярность, независимую от размера органоида hOSE (рис. 4B).
Известно, что ОГЭ человека экспрессирует мезенхимальный маркер N-кадгерин (CDH2), в то время как экспрессия эпителиального маркера E-кадгерина (CDH1) ограничена столбчатыми клетками OSE (рис. 4A)2. Интересно, что органоиды hOSE, полученные в этой работе, экспрессировали мезенхимальные маркеры CDH2 и виментин (VIM), а большие кистозные органоиды hOSE с кубовидным/столбчатым эпителием были как CDH1+, так и CDH2+VIM+ (рис. 4C). Остается неясным, были ли органоиды CDH1+ hOSE получены из первичных клеток CDH1+ OSE или из клеток CDH1-OSE, которые подверглись эпителиальной дифференцировке или (неопластической) трансформации in vitro25,35.
Демонстрация использования органоидов hOSE: влияние овуляторных сигналов на органоиды hOSE
Гормоны фолликулостимулирующий гормон и хорионический гонадотропин человека могут быть использованы для индуцирования роста фолликулов и овуляции, в то время как после овуляции наблюдается заметное увеличение концентрации гормонов, вырабатываемых яичниками, таких как прогестерон и эстрадиол36. Чтобы продемонстрировать удобство использования органоидов hOSE в качестве платформы для скрининга, мы изучили влияние этих гормонов на органоиды hOSE, используя количество и размер органоидов в качестве выходных данных количественной оценки (с использованием Фиджи). Для этого мы получили органоиды hOSE в OSE_3D средах, в которых отсутствует эстрадиол (без гормона), и в OSE_3D средах, содержащих ФСГ, ХГЧ, эстрадиол или прогестерон в различных концентрациях (рис. 5A).
Количество органоидов hOSE, полученных из криоконсервированно-размороженных (неэкстенцированных) клеток hOSE от 3 различных доноров (n=3), было количественно определено на каплю после 7 дней культивирования (рис. 5A, B). Питательные среды меняли каждые 3 дня. Не наблюдалось существенных различий в общем количестве органоидов hOSE в одной капле, образовавшихся в среде, содержащей гормоны, по сравнению со средой без гормонов (рис. 5А, В). Чтобы количественно оценить влияние гормонов на размер органоидов, после 14 дней в культуре каждая капля (из каждого состояния) была визуализирована, а площадь 4 крупнейших органоидов hOSE была измерена с помощью Фиджи. Интересно, что получение органоидов hOSE от двух разных доноров (n = 2) в присутствии прогестерона (1000 нМ) или эстрадиола (200 нМ) приводило, по крайней мере, один очень крупный органоид (около 700 мкм в диаметре) на каплю (рис. 5C, D).
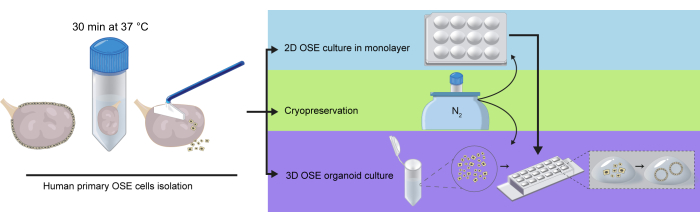
Рисунок 1: Схематическое изображение выделения клеток hOSE из целых яичников. Яичники инкубировали в растворе для сбраживания в течение 30 мин при 37 °C. Клетки hOSE отделяли от поверхности яичников путем осторожного соскабливания и затем криоконсервировали, непосредственно наносили на культуру 2D OSE в монослое или встраивали в экстракт базальной мембраны (BME) для 3D культуры органоидов hOSE. Криоконсервированные-размороженные hOSE-клетки могут быть использованы для 2D-культивирования или 3D-формирования органоидов, а 2D-расширенные hOSE-клетки могут быть использованы для создания 3D-органоидов hOSE. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: 2D первичная культура клеток hOSE. (A) Светлопольные изображения клеток hOSE в местах проходов 0 (P0), 2 (P2) и 3 (P3), отображающие типичную морфологию эпителиального булыжника. Масштабные линейки имеют размеры 750 μм на верхних панелях и 125 μм на нижних панелях. (B) Иммунофлуоресценция для ACTA2, CD44, COL1A1 на 2D hOSE клетках в P2 и P3. Масштабные линейки представляют собой 50 мкм. (C) Светлопольные изображения клеток hOSE, культивируемых с использованием 10 мкМ SB-431542 в точках P0, P2 и P3. Клетки показали признаки старения от P2 и не достигли высокой конфлюенции во время культивирования. Масштабные линейки имеют размеры 750 μм на верхних панелях и 125 μм на нижних панелях. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
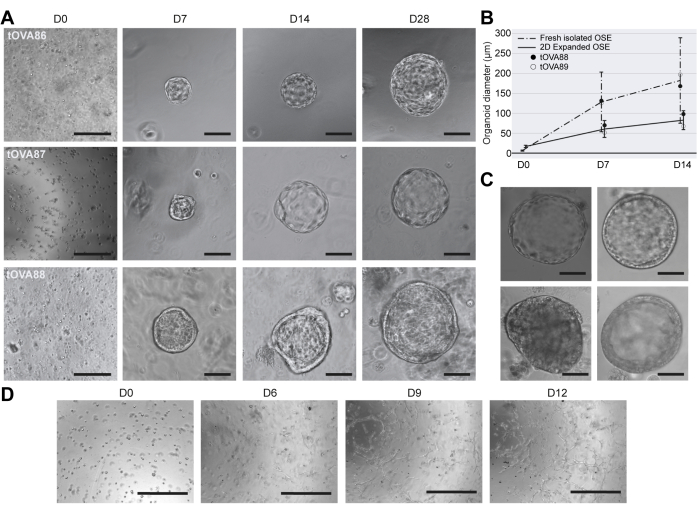
Рисунок 3: Морфологическая характеристика органоидов hOSE. (A) Светлые изображения трех независимых производных органоидов hOSE от трех разных доноров (tOVA86, tOVA87, tOVA88). Изображения были сделаны после встраивания клеток (D0), на 7-й день (D7), на 14-й день (D14) и на 28-й день (D28) культивирования. Масштабные линейки составляют 750 мкм в D0 и 50 мкм в остальных. (B) Диаметр органоидов hOSE, полученных из свежевыделенных клеток hOSE (пунктирная линия) и 2D-расширенных клеток hOSE (сплошная линия). На рисунке изображен средний размер ± стандартное отклонение, измеренное в D0, D7 и D14. Показаны результаты от двух разных доноров (tOVA88 и tOVA89). (C) Светлопольные изображения органоидов hOSE, показывающие различную морфологию: один плоский слой (вверху слева), одиночный столбчатый слой (вверху справа), многослойный (внизу справа) и нелюменизированный клеточный агрегат (внизу слева). Масштабные линейки представляют собой 100 мкм. (D) Светлопольные изображения клеток hOSE, внедренных в BME и культивируемых в течение 12 дней с использованием OSE_2D среды. Изображения были сделаны после встраивания клеток (D0), дня 6 (D6), дня 9 (D9) и дня 12 (D12). Фибробластоподобные клетки обогнали культуру, и органоидоподобные структуры не образовались. Масштабные линейки имеют размер 750 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
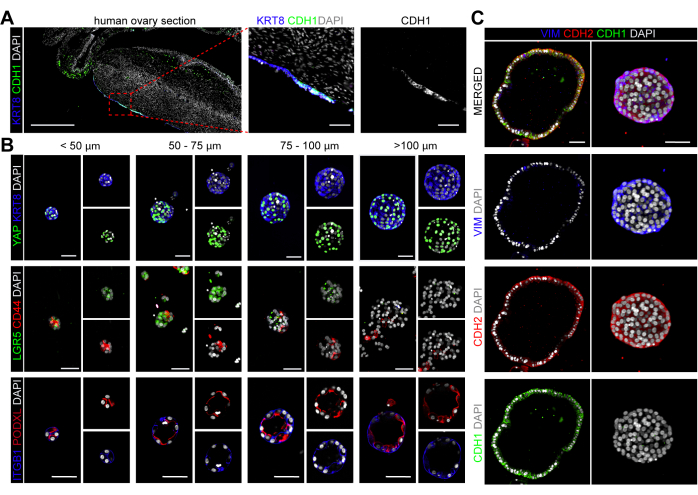
Рисунок 4: Клеточная характеристика органоидов hOSE. (A) Иммунофлюоресценция на KRT8 и CDH1 в отделе яичников человека. Масштабная линейка на левой панели составляет 500 мкм, а средняя и правая панели - 50 мкм. (B) Иммунофлуоресценция для KRT8 и YAP, LGR5 и CD44, а также ITGB1 и PODXL в hOSE органоидах разных размеров (<50 мкм, 50-75 мкм, 75-100 мкм, >100 мкм). Масштабные линейки представляют собой 50 мкм. (C) Иммунофлюоресценция для VIM, CDH1, CDH2 в органоидах hOSE. Масштабные линейки имеют размер 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
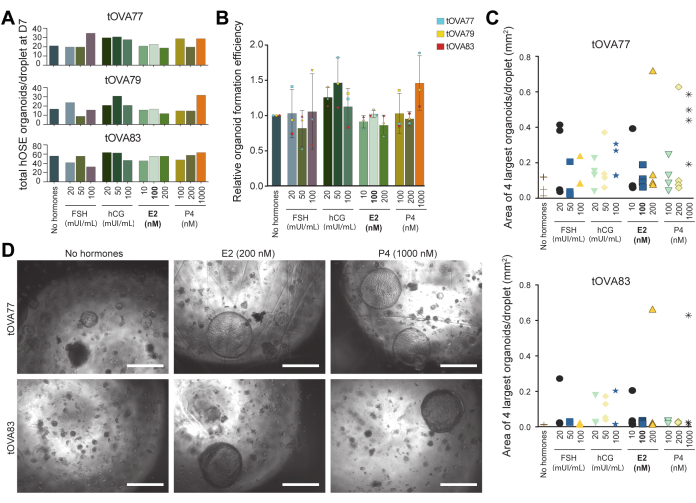
Рисунок 5: Влияние овуляторных сигналов на образование органоидов hOSE. (A) Общее количество органоидов hOSE в одной капле, образовавшейся на 7-й день в различных питательных средах. Органоиды hOSE были получены от трех разных доноров (tOVA77, tOVA79, tOVA83). Жирным шрифтом выделена OSE_3D среда, используемая для получения органоидов. (Б) Относительное образование органоидов по сравнению со средой без гормонов. Объединенные значения органоидов hOSE были получены от трех разных доноров (tOVA77, tOVA79, tOVA83). (C) График, изображающий область изображения 4 крупнейших органоидов hOSE на 14-й день в каждом из экспериментальных условий, протестированных на двух разных донорах (tOVA77, tOVA83). (D) Светлые изображения, показывающие органоиды hOSE на 14-й день посева в среде без гормонов, 200 нМ E2 и 1000 нМ P4 от двух разных доноров (tOVA77, tOVA83). Масштабные линейки имеют размер 750 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Состав рабочих растворов, использованных в исследовании. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Обсуждение
Технология 3D-органоидов становится незаменимым инструментом для медицинских исследований. С одной стороны, эта платформа in vitro дает возможность изучать фундаментальные механистические вопросы регенерации тканей, заживления рани развития. С другой стороны, 3D-органоиды, полученные из образцов пациентов, позволяют проводить персонализированные медицинские исследования, включая диагностику, тестирование лекарств и клеточную терапию 12,13,14,37,38. В области исследований яичников hOSE вызвала значительный интерес с тех пор, как она стала источником эпителиальных карцином яичников39. Несмотря на то, что считается, что большинство серозных раков яичников высокой степени злокачественности (HGSOC), один из наиболее распространенных эпителиальных видов рака яичников, возникает из фаллопиевых труб40, современные исследования на 3D-органоидах яичников у мышей предположили потенциальное двойное происхождение HGSOC от OSE и фаллопиевых труб15,16.
В этой статье мы описали протокол получения 3D-органоидов hOSE и описали его применение для получения новых механистических знаний в регенерации ткани яичников. Этот протокол включает в себя пошаговый метод выделения первичных клеток hOSE из яичников человека и получения 3D-органоидов hOSE. Чтобы обеспечить эффективное происхождение органоидов hOSE, крайне важно свести к минимуму манипуляции с яичниками. Из-за своего расположения на поверхности яичника и монослойной организации, hOSE подвержен повреждениям и потерям во время овариэктомии и манипуляций с органами. По этой причине мы отдали предпочтение ферментативному методу и методу соскабливания, применяемому ко всему яичнику для выделения hOSE 2,8. В настоящем протоколе применялось мягкое ферментативное лечение для нарушения межклеточных связей hOSE с последующим аккуратным выскабливанием поверхности яичника.
Сравнивая 2D с 3D hOSE культурой, важно отметить, что, несмотря на исходно высокую скорость пролиферации клеток hOSE в 2D культуре, их клеточные характеристики изменялись из-за ЭМП, что позволяет предположить, что применяемые условия 2D культуры не подходят для поддержания морфологии эпителия. В отличие от этого, 3D hOSE-органоиды могут быть пропущены по крайней мере 4 раза без признаков старения. Использованная среда для OSE_3D органоидных культур была основана на среде, использованной Коппером и коллегами для получения OC и здоровых органоидов hOSE12 и Kessler и коллегами для получения человеческих органоидов FT17. Основное отличие заключалось в замене кондиционированных сред Wnt3a и R-Spondin-1 человека на коммерчески доступные рекомбинантные белки для облегчения воспроизводимости.
Методы иммунофлуоресценции обычно включают в себя извлечение образца ткани из культурального планшета и его обработку для парафинового или криогионного сечения. При работе с очень маленькими структурами высок риск их потери при обработке образца. В этом протоколе получение органоидов hOSE происходит в планшетах для клеточных культур, что позволяет проводить прямую микроскопическую визуализацию без необходимости удаления органоидов hOSE из матрицы BME. Кроме того, использованный здесь метод полной иммунофлуоресценции, описанный Резанежедадом и коллегами для протоковых органоидовподжелудочной железы 41, позволил in situ наблюдать локализацию белка в морфологически интактных органоидах. Мы продемонстрировали, что при выполнении этого протокола иммунофлуоресценции на органоидах hOSE, полученных в многолуночных камерных предметных стеклах, наблюдается высокоэффективное проникновение антител с очень низким фоновым сигналом.
Хотя большинство органоидов hOSE, полученных с помощью этого метода, не имели экспрессии CDH1, некоторые органоиды CDH1+ hOSE сформировались, достигая больших размеров по сравнению с органоидами CDH1-hOSE. Экспрессия CDH1 была связана с неопластическими фенотипамиhOSE 2,35. Яичники, использованные для выделения hOSE, были донорами от здоровых трансмаскулинных доноров репродуктивного возраста (27,1 ± 5 лет). Эти доноры проходили лечение тестостероном в течение 38 ± 15 месяцев до овариэктомии. Мы не можем исключать возможность того, что клетки CDH1+ hOSE на поверхности яичников могут быть связаны с лечением тестостероном. Несмотря на то, что лечение андрогенами было связано с изменениями яичников, такими как ановуляция42, гиперплазия корковой области43 и повышенная жесткость коры головного мозга44, общая патология яичников остается доброкачественной при использовании тестостерона45.
Таким образом, этот протокол подчеркивает потенциал создания 3D-органоидов hOSE для расшифровки механистических вопросов регенерации ткани яичников. Важно отметить, что этот метод также может быть применен для обнаружения злокачественных клеток, присутствующих в биопсии яичников у пациентов с риском развития рака. В совокупности этот метод поддерживает потенциальное применение этой инновационной платформы in vitro как для фундаментальных исследований функции яичников, так и для клинического применения для индивидуального медицинского лечения.
Раскрытие информации
Никакой.
Благодарности
Мы хотели бы поблагодарить всех пациентов, которые пожертвовали ткани для этого исследования, членов группы Чува де Соуза Лопес за полезные дискуссии и И. Де Поортера за дизайн карикатур, использованных на рисунке 1. Это исследование финансировалось Европейским исследовательским советом, грант No ERC-CoG-2016-725722 (OVOGROWTH) для J.S.D.V. и S.M.C.d.S.L.; и Фонд Ново Нордиск (reNEW), грант номер NNF21CC0073729 для J.S.D.V. и S.M.C.d.S.L.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin/EDTA | Invitrogen | 25200-056 | |
| 12-well Culture Plate | Corning | 3336 | Sterile |
| 15 mL tubes | Greiner | 188271 | Sterile |
| 28cm Cell Scraper | Greiner Bio-One | 541070 | |
| 50 mL tubes | Greiner | 227261 | Sterile |
| 60 mm Petri dish | Greiner Bio-One | 628160 | |
| A83-01 | Stem Cell Technologies | 72024 | |
| Advanced DMEM/F12 | Gibco | 12634-010 | |
| B27 supplement (50x) | ThermoFisher Scientific | 17504-044 | |
| Bead bath | M714 | ||
| Bovine serum albumin (BSA) | Sigma Aldrich | 10735086001 | |
| Cell Dissociation Buffer | ThermoFisher Scientific | 13151014 | |
| Cryo-container "Mr. Frosty" | BD Falcom | 479-3200 | |
| DMEM Medium | ThermoFisher Scientific | 41966-029 | |
| Donkey anti-Goat IgG Alexa Fluor 647 | Invitrogen | A-21447 | |
| Donkey anti-Mouse IgG Alexa Fluor 488 | Invitrogen | A-21202 | |
| Donkey anti-Mouse IgG Alexa Fluor 647 | Invitrogen | A-31571 | |
| Donkey anti-Rabbit IgG Alexa Fluor 488 | Invitrogen | A-21206 | |
| Donkey anti-Rabbit IgG Alexa Fluor 594 | Invitrogen | A-21207 | |
| Donkey anti-Sheep IgG Alexa Flour 647 | Invitrogen | A-21448 | |
| Fetal Bovine Serum (FBS) | ThermoFisher Scientific | A4736401 | |
| Follicle Stimulating Hormone (FSH) | Sigma Aldrich | F4021 | |
| Forskolin | Peprotech | 6652995 | |
| Glutamax (100x) | Gibco | 35050-038 | |
| Goat anti-CDH2 (N/R-cadherin) | Santa Cruz | SC-1502 | Mesenchymal Cells; Wong et al 1999 (human)25 |
| Goat anti-PODXL (podocalyxin of GP135) | R&D Systems | AF1658 | Apical Polarity; Bryant et al 2014 (canine)21 |
| Goat anti-Rat IgG Alexa Fluor 555 | Invitrogen | A-21434 | |
| hEGF | R&D Systems | 263-EG | |
| HEPES | Gibco | 15630-056 | |
| Hydrocortisone | Sigma Aldrich | H0888 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS-X; 100x) | ThermoFisher Scientific | 51500-056 | |
| Liberase DH Research Grade | Sigma Aldrich | A4736401 | |
| Luna-II cell counter | Logos Biosystems | L40001 | |
| Matrigel | Sigma Aldrich | 354277 | |
| McCoy’s 5A Medium | ThermoFisher Scientific | 26600-023 | |
| Mouse anti-ITGB1 (integrin beta 1) | Santa Cruz | SC-53711 | Basolateral Polarity; Bryant et al 2014 (canine)21 |
| Mouse anti-KRT8 (cytokeratin 8) | Santa Cruz | SC-101459 | OSE Cells; Kopper et al 2019 (human)12 |
| Mouse anti-VIM (vimentin) | Abcam | AB0809 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Mycozap Plus-CL | Lonza | V2A-2011 | |
| N-Acetyl-L-cysteine | Sigma Aldrich | A9165 | |
| Nicotinamide | Sigma Aldrich | N0636-100G | |
| OVITRELLE-Choriogonadotropin alfa (hCG) | Merk | G03GA08 | |
| Progesterone (P4) | Sigma Aldrich | P8783 | |
| Rabbit anti-ACTA2 (alpha smooth muscle actin) | Abcam | AB5694 | Mesenchymal Cells; Abedini et al 2020 (mouse)19 |
| Rabbit anti-CDH1 (E-cadherin) | Cell Signaling | CST 3195S | Epithelial Cells; Wong et al 1999 (human)25 |
| Rabbit anti-LGR5 | Abcam | AB75850 | OSE Progenitor Cells; Flesken-Nikitin et al 2013 (mouse)22 |
| Rabbit anti-YAP | Cell Signaling | 14074S | Proliferative OSE; Wang et al 2022 (mouse)24 |
| Rat anti-CD44 PE-conjugated | eBioscience | 12-0441-81 | OSE Progenitor Cells; Bowen et al 2009 (human)20 |
| Recombinant Human Heregulinβ-1 | Peprotech | 100-03 | |
| Recombinant Human Noggin | Peprotech | 120-10C | |
| Recombinant Human Wnt3a | R&D Systems | 5036-WN-010 | |
| Recombinant Rspondin-1 | Peprotech | 120-38 | |
| Red blood cells lysis buffer | eBiosciences | 00-4333-57 | |
| Revitacell Supplement (100x) | ThermoFisher Scientific | A26445-01 | |
| RNAse free DNAse | Qiagen | 79254 | |
| SB-431542 | Tocris Bioscience | 1624/10 | |
| Sheep anti-COL1A1 (pro-collagen 1 alpha 1) | R&D Systems | AF6220 | Mesenchymal Cells; Hosper et al 2013 (human)23 |
| Y-27632 | StemCell Technologies | 72304 | |
| β-Estradiol (E2) | Sigma-Aldrich | E8875 | |
| μ-Slide 18-well culture plate | Ibidi | 8181 | Sterile |
Ссылки
- Ng, A., Barker, N. Ovary and fimbrial stem cells: biology, niche and cancer origins. Nat Rev Mol Cell Biol. 16 (10), 625-638 (2015).
- Auersperg, N., Wong, A. S., Choi, K. C., Kang, S. K., Leung, P. C. Ovarian surface epithelium: biology, endocrinology, and pathology. Endocr Rev. 22 (2), 255-288 (2001).
- Tan, O. L., Fleming, J. S. Proliferating cell nuclear antigen immunoreactivity in the ovarian surface epithelium of mice of varying ages and total lifetime ovulation number following ovulation. Biol Reprod. 71 (5), 1501-1507 (2004).
- Carter, L. E., et al. Transcriptional heterogeneity of stemness phenotypes in the ovarian epithelium. Commun Biol. 4 (1), 527 (2021).
- Chumduri, C., Turco, M. Y. Organoids of the female reproductive tract. J Mol Med (Berl). 99 (4), 531-553 (2021).
- Edmondson, R. J., Monaghan, J. M., Davies, B. R. The human ovarian surface epithelium is an androgen responsive tissue. Br J Cancer. 86 (6), 879-885 (2002).
- Karlan, B. Y., Jones, J., Greenwald, M., Lagasse, L. D. Steroid hormone effects on the proliferation of human ovarian surface epithelium in vitro. Am J Obstet Gynecol. 173 (1), 97-104 (1995).
- Nakamura, M., Katabuchi, H., Ohba, T., Fukumatsu, Y., Okamura, H. Isolation, growth and characteristics of human ovarian surface epithelium. Virchows Arch. 424 (1), 59-67 (1994).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nat Rev Drug Discov. 15 (11), 751-769 (2016).
- Del Valle, J. S., Chuva de Sousa Lopes, S. M. Bioengineered 3D ovarian models as paramount technology for female health management and reproduction. Bioengineering (Basel). 10 (7), 832 (2023).
- Clevers, H. Modeling development and disease with organoids. Cell. 165 (7), 1586-1597 (2016).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Maenhoudt, N., et al. Developing organoids from ovarian cancer as experimental and preclinical models. Stem Cell Reports. 14 (4), 717-729 (2020).
- Senkowski, W., et al. A platform for efficient establishment and drug-response profiling of high-grade serous ovarian cancer organoids. Dev Cell. 58 (12), 1106-1121.e7 (2023).
- Lohmussaar, K., et al. Assessing the origin of high-grade serous ovarian cancer using CRISPR-modification of mouse organoids. Nat Commun. 11 (1), 2660 (2020).
- Zhang, S., et al. Both fallopian tube and ovarian surface epithelium are cells-of-origin for high-grade serous ovarian carcinoma. Nat Commun. 10 (1), 5367 (2019).
- Kessler, M., et al. The Notch and Wnt pathways regulate stemness and differentiation in human fallopian tube organoids. Nat Commun. 6, 8989 (2015).
- Kim, J., Koo, B. K., Knoblich, J. A. Human organoids: model systems for human biology and medicine. Nat Rev Mol Cell Biol. 21 (10), 571-584 (2020).
- Abedini, A., Sayed, C., Carter, L. E., Boerboom, D., Vanderhyden, B. C. Non-canonical WNT5a regulates Epithelial-to-Mesenchymal Transition in the mouse ovarian surface epithelium. Sci Rep. 10 (1), 9695 (2020).
- Bowen, N. J., et al. Gene expression profiling supports the hypothesis that human ovarian surface epithelia are multipotent and capable of serving as ovarian cancer-initiating cells. BMC Med Genomics. 2, 71 (2009).
- Bryant, D. M., et al. A molecular switch for the orientation of epithelial cell polarization. Dev Cell. 31 (2), 171-187 (2014).
- Flesken-Nikitin, A., et al. Ovarian surface epithelium at the junction area contains a cancer-prone stem cell niche. Nature. 495 (7440), 241-245 (2013).
- Hosper, N. A., et al. Epithelial-to-mesenchymal transition in fibrosis: collagen type I expression is highly upregulated after EMT, but does not contribute to collagen deposition. Exp Cell Res. 319 (19), 3000-3009 (2013).
- Wang, J., et al. Selective YAP activation in Procr cells is essential for ovarian stem/progenitor expansion and epithelium repair. Elife. 11, e75449 (2022).
- Wong, A. S., et al. Constitutive and conditional cadherin expression in cultured human ovarian surface epithelium: influence of family history of ovarian cancer. Int J Cancer. 81 (2), 180-188 (1999).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676-682 (2012).
- Shepherd, T. G., Theriault, B. L., Campbell, E. J., Nachtigal, M. W. Primary culture of ovarian surface epithelial cells and ascites-derived ovarian cancer cells from patients. Nat Protoc. 1 (6), 2643-2649 (2006).
- Xu, J., Lamouille, S., Derynck, R. TGF-beta-induced epithelial to mesenchymal transition. Cell Res. 19 (2), 156-172 (2009).
- Miettinen, P. J., Ebner, R., Lopez, A. R., Derynck, R. TGF-beta induced transdifferentiation of mammary epithelial cells to mesenchymal cells: involvement of type I receptors. J Cell Biol. 127 (6 Pt 2), 2021-2036 (1994).
- Danielpour, D., et al. Sandwich enzyme-linked immunosorbent assays (SELISAs) quantitate and distinguish two forms of transforming growth factor-beta (TGF-beta 1 and TGF-beta 2) in complex biological fluids. Growth Factors. 2 (1), 61-71 (1989).
- Oida, T., Weiner, H. L. Depletion of TGF-beta from fetal bovine serum. J Immunol Methods. 362 (1-2), 195-198 (2010).
- Halder, S. K., Beauchamp, R. D., Datta, P. K. A specific inhibitor of TGF-beta receptor kinase, SB-431542, as a potent antitumor agent for human cancers. Neoplasia. 7 (5), 509-521 (2005).
- Wang, J., Wang, D., Chu, K., Li, W., Zeng, Y. A. Procr-expressing progenitor cells are responsible for murine ovulatory rupture repair of ovarian surface epithelium. Nat Commun. 10 (1), 4966 (2019).
- Kawata, M., et al. Polarity switching of ovarian cancer cell clusters via SRC family kinase is involved in the peritoneal dissemination. Cancer Sci. 113 (10), 3437-3448 (2022).
- Davies, B. R., Worsley, S. D., Ponder, B. A. Expression of E-cadherin, alpha-catenin and beta-catenin in normal ovarian surface epithelium and epithelial ovarian cancers. Histopathology. 32 (1), 69-80 (1998).
- Skory, R. M., Xu, Y., Shea, L. D., Woodruff, T. K. Engineering the ovarian cycle using in vitro follicle culture. Hum Reprod. 30 (6), 1386-1395 (2015).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nat Cell Biol. 21 (8), 1041-1051 (2019).
- Phan, N., et al. A simple high-throughput approach identifies actionable drug sensitivities in patient-derived tumor organoids. Commun Biol. 2, 78 (2019).
- Ducie, J., et al. Molecular analysis of high-grade serous ovarian carcinoma with and without associated serous tubal intra-epithelial carcinoma. Nat Commun. 8 (1), 990 (2017).
- Lee, Y., et al. A candidate precursor to serous carcinoma that originates in the distal fallopian tube. J Pathol. 211 (1), 26-35 (2007).
- Rezanejad, H., Lock, J. H., Sullivan, B. A., Bonner-Weir, S. Generation of pancreatic ductal organoids and whole-mount immunostaining of intact organoids. Curr Protoc Cell Biol. 83 (1), e82 (2019).
- Asseler, J. D., et al. One-third of amenorrheic transmasculine people on testosterone ovulate. Cell Rep Med. 5 (3), 101440 (2024).
- Ikeda, K., et al. Excessive androgen exposure in female-to-male transsexual persons of reproductive age induces hyperplasia of the ovarian cortex and stroma but not polycystic ovary morphology. Hum Reprod. 28 (2), 453-461 (2013).
- De Roo, C., et al. Texture profile analysis reveals a stiffer ovarian cortex after testosterone therapy: a pilot study. J Assist Reprod Genet. 36 (9), 1837-1843 (2019).
- Grimstad, F. W., et al. Ovarian histopathology in transmasculine persons on testosterone: A multicenter case series. J Sex Med. 17 (9), 1807-1818 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены