Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
МРТ и спектроскопия легких с гиперполяризацией 129Xe у мышей с искусственной вентиляцией легких
В этой статье
Резюме
Гиперполяризованная ксеноновая МРТ может количественно оценить регионарную микроструктуру легких (размеры воздушного пространства) и физиологию (вентиляция и газообмен) в трансляционных исследованиях и клинической помощи. Несмотря на сложность, она может обеспечить сопоставимое понимание легких в доклинических исследованиях. В этом протоколе описывается инфраструктура и процедуры, необходимые для проведения рутинной МРТ легких с ксеноном у мышей.
Аннотация
Гиперполяризованный (HP) ксенон-129 (129Xe) представляет собой контрастное вещество для ингаляционной магнитно-резонансной томографии (МРТ) с уникальными спектральными и физическими свойствами, которые могут быть использованы для количественной оценки физиологии легких, включая вентиляцию, ограниченную диффузию (размер альвеолярного воздушного пространства) и газообмен. У людей он был использован для оценки тяжести и прогрессирования заболевания при различных легочных заболеваниях и одобрен для клинического использования в Соединенных Штатах и Великобритании. Помимо клинического применения, способность МРТ 129Xe неинвазивно оценивать легочную патофизиологию и предоставлять пространственно разрешенную информацию имеет важное значение для доклинических исследований. Среди животных моделей мыши получили наибольшее распространение из-за доступности генетически модифицированных моделей заболеваний. В этом отношении МРТ 129Xe является перспективным малоинвазивным, безрадиационным и чувствительным методом для продольного мониторинга прогрессирования заболевания легких и ответа на терапию (например, при разработке лекарств). Этот метод может быть расширен до доклинических применений за счет включения аппарата свободного дыхания, запускаемого МРТ, или механического аппарата искусственной вентиляции легких для подачи газа. В этой статье мы описываем шаги и предоставляем контрольные списки для обеспечения надежного сбора и анализа данных, включая создание термически поляризованного ксенонового газового фантома для контроля качества, оптимизацию поляризации, обращение с животными (седация, интубация, вентиляция и уход за мышами), а также протоколы для данных об вентиляции, ограниченной диффузии и газообмене. В то время как доклиническая МРТ 129Xe может применяться на различных животных моделях (например, на крысах, свиньях, овцах), этот протокол ориентирован на мышей из-за проблем, связанных с их небольшой анатомией, которая уравновешивается их ценовой доступностью и доступностью многих моделей заболеваний.
Введение
В то время как легочные заболевания остаются основными причинами глобальной заболеваемости исмертности1, в последнее десятилетие наблюдалось значительное улучшение результатов лечения пациентов. Эти улучшения отчасти обусловлены двумя факторами. Во-первых, клинические испытания III фазы теперь отдают приоритет изменениям в функции легких в качестве конечных точек, а не смертности, что ускоряет испытания лекарств 2,3,4,5. Во-вторых, достижения в области усовершенствованных животных моделей позволили получить представление о механизмах заболевания и помогли разработать терапию 6,7. Мышиные модели часто выбирают для трансляционных исследований, потому что они предлагают физиологические параллели с людьми, доступность и быстрое развитие заболеваний. Генная инженерия расширила диапазон и качество доступных моделей, и в настоящее время Международный ресурс по изучению линий мышей насчитывает более 32 000 линий мышей8 по сравнению с 4 218 линиями крыс (База данных генома крыс9). Эти модели открыли новые возможности для изучения механических движущих сил и терапевтических реакций при ряде заболеваний легких, включая хроническую обструктивную болезнь легких (ХОБЛ)10, муковисцидоз (МВ)11, легочный фиброз12,13, легочную гипертензию 14,15 и астму16.
К сожалению, исследования легких на мышах ограничены доступными методами количественной оценки бремени болезней. Исследования часто основываются на терминальных процедурах, которые 1) предоставляют информацию обо всем легком (биохимические анализы) или локализованную информацию (гистология) и 2) требуют поперечного дизайна и больших размеров выборки. Таким образом, они не отражают ни пространственную, ни временную динамику заболеваний. В отличие от этого, неинвазивная трехмерная визуализация может оценить структуру, молекулярные процессы и функции в легких с течением времени.
Структура легких (например, аномалии дыхательных путей и интерстициальный фиброз) может быть визуализирована с помощью ультракороткой эховременной МРТ (UTE) и микрокомпьютерной томографии (μCT) с высоким разрешением. Функциональная и механистическая информация (например, вентиляция, перфузия, метаболизм опухоли и воспалительные процессы) может быть получена с помощью экзогенных контрастных веществ (например, ксеноновая КТ и кислородно-усиленная UTE) и подходов ионизирующей ядерной медицины (например, позитронно-эмиссионная томография [ПЭТ] и однофотонная эмиссионная компьютерная томография [ОФЭКТ]). Тем не менее, функциональная визуализация является сложной задачей из-за умеренного контраста с шумом (особенно для UTE, усиленной кислородом при высокой напряженности магнитного поля, используемой для доклинической МРТ, гдеT1 удлиняется), доступной без использования ионизирующих методов с более высокими, чем обычно, уровнями излучения. В то время как визуализация с помощью этих методов хорошо переносится на животных моделях с использованием обычных доз, кумулятивное облучение может исказить результаты исследований по иммунологии, воспалению и раку легких17. Тем не менее, гиперполяризованная (HP) ксенон-129 (129Xe) магнитно-резонансная томография (МРТ) обеспечивает минимально инвазивную, необлученную и высокочувствительную структурную и функциональную информацию. Несмотря на то, что этот метод использовался в доклинических исследованиях для характеристики состояний, включая эмфизему18,19, фиброз20, рак легких21, ХОБЛ22 и радиационно-индуцированное повреждение легких23 в один или несколько моментов времени, он остается недостаточно используемым в доклинических условиях.
Для проведения рутинной доклинической МРТ 129Xe требуется несколько предварительных условий, включая институциональную нормативную поддержку, устройство гиперполяризации, радиочастотную (РЧ) катушку с конфигурацией 129Xe и многоядерный сканер. Несмотря на то, что продвинутые приложения 24,25,26,27,28,29,30,31,32,33 требуют программирования импульсов для конкретного поставщика, которое выходит за рамки этого протокола, базовые приложения могут быть реализованы с помощью скромных модификаций программного обеспечения. Поэтому мы уделяем особое внимание контролю качества, обработке намагниченности, сбору данных и процедурам обращения с животными, включая искусственную вентиляцию легких, которые являются уникальными для доклинической МРТ 129Xe (Рисунок 1).
На сегодняшний день при визуализации мелких животных 129Xe используются три безопасных для МРТ подхода к доставке газа, каждый из которых имеет свои преимущества и недостатки: свободное дыхание, поршневой привод и перепад давления. Свободное дыхание позволяет осуществлять спонтанный вдох без риска травмы в результате интубации или трахеостомии, но потребляет значительно больше газа HP и может привести к появлению артефактов движения 34,35. Коммерческие устройства с поршневым приводом являются самокалибрующимися и простыми в использовании «из коробки», но могут быть непомерно дорогими. Используемый здесь подход, основанный на перепаде давления, хорошо описан в литературе, является модульным, настраиваемым и управляется открытым исходным кодом 37,38,39,40. Кроме того, он экономически эффективен, обычно составляет менее 10 тысяч долларов и занимает несколько недель специального времени на сборку. Аппарат ИВЛ с перепадом давления подает 129Xe из дозированного мешка в герметичном контейнере, контролируя давление в дыхательных путях интубированной мыши.
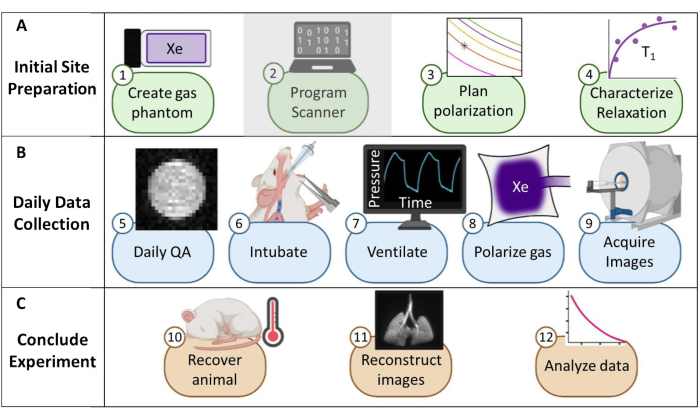
Рисунок 1: Обзор протокола сбора данных магнитно-резонансной томографии (МРТ) ксенона-129 (129Xe) у мышей. (A) Шаги для первоначальной настройки. (Примечание: программирование сканера уникально для каждого поставщика и не описано в этом протоколе). (B) Шаги по ежедневному сбору данных о контроле качества (QA) и животных. (C) Шаги для успешного завершения эксперимента и анализа данных. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
В этой статье мы собираем и анализируем три распространенных класса данных МРТ 129Xe: вентиляция, диффузионно-взвешенная визуализация (размер альвеолярного воздушного пространства) и газообмен. На изображениях вентиляции показано распределение вдыхаемого газа 129Xe. Области легких с пониженным потоком воздуха выглядят темными на изображениях газа HP, а патология количественно оценивается по объему дефектной вентиляции. У людей процент дефектов вентиляции (VDP) показал сильную повторяемость41,42 и высокую чувствительность к обструкции легких при таких заболеваниях, как ХОБЛ 43,44,45 и астма46,47.
Ограниченная диффузия атомов 129Xe в воздушном пространстве может быть измерена с помощью коэффициента кажущейся диффузии (ADC) и служит суррогатом размера воздушного пространства. АЦП рассчитывается путем получения базового изображения (b0) без диффузионного взвешивания и одного или нескольких изображений, полученных в присутствии биполярного градиентно-индуцированного диффузионного взвешивания (bN). Повышенный ADC отражает увеличение размера воздушного пространства из-за старения или эмфизематозного ремоделирования18,48. Кроме того, использование нескольких изображений b-значений (≥4) позволяет рассчитать более подробную морфометрическую информацию (например, среднее линейное пересечение)49,50.
Газообмен можно охарактеризовать благодаря 1) растворимости 129Xe в ткани капиллярной мембраны, плазме и эритроцитах (эритроцитах) и 2) химическому сдвигу >200 ppm вниз по полю 129Xe при растворении в этих компартментах. Как спектроскопические, так и визуализирующие данные дают представление о сердечно-легочных заболеваниях (например, легочной гипертензии и левосердечной недостаточности 51,52,53). В то время как многие виды (люди, собаки и крысы) демонстрируют уникальные спектральные пики, исходящие из каждого отсека, мышам не хватает уникального сигнала эритроцитов из-за различий во взаимодействиях гемоглобина и ксенона. Вместо этого все растворенные компоненты объединяются в один сигнал у мышей54. Тем не менее, можно наблюдать отчетливый резонанс эритроцитов у трансгенных мышей, экспрессирующих человеческий гемоглобин, таких как те, которые использовались в моделях серповидноклеточной анемии54. В целом, спектроскопия и визуализация растворенного 129Xe позволяют получить уникальное представление о патофизиологии сердечно-легочной системы у мышей 55,56.
Прежде чем использовать этот протокол, необходимо ознакомиться с исходной информацией о МРТ-сканере, искусственной вентиляции легких и методах работы с мышами, необходимых для исследований на мышах. Прежде чем начать исследования на животных, все процедуры должны быть одобрены местным Комитетом по уходу за животными и их использованию (IACUC)57. Поскольку общий магнитный момент, доступный в легком мыши, по своей природе мал (т.е. дыхательный объем ~ 250 мкл), размер вокселя должен быть в 1000 раз меньше, чем у человека, чтобы достичь анатомически эквивалентного разрешения. Частота дыхания мышей также чрезвычайно высока (>100 вдохов в минуту). Таким образом, процедуры одиночной задержки дыхания, обычно используемые для визуализации человека, невозможны. Вместо этого в каждом вдохе может быть приложено только несколько радиочастотных возбуждений, поэтому изображения 129Xe должны быть закодированы на десятки и сотни вдохов. Импульсное программирование может потребоваться для обеспечения внешнего запуска регистрации и правильного зацикливания срезов, фазового кодирования и/или диффузионно-взвешенных изображений при балансировке отношения сигнал/шум (SNR), разрешения и продолжительности сканирования. В этом случае аппарат ИВЛ выдает импульс транзисторно-транзисторной логики (TTL) один раз за вдох для запуска сбора данных (Рисунок 2).
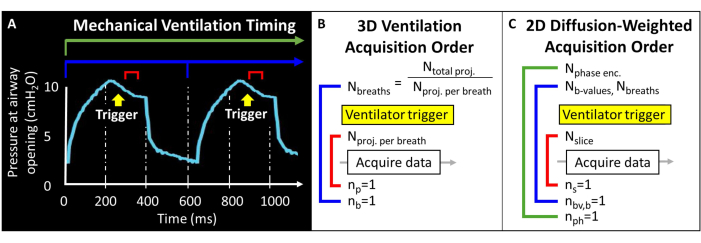
Рисунок 2: Репрезентативная механическая вентиляция и время сбора данных. (A) Управляемая пользователем вентиляция может инициировать сбор данных в конце вдоха, во время задержки дыхания или в конце выдоха. (B) Для этой последовательности 3D радиальной вентиляции пользователь определяет общее количество полученных проекций и количество проекций на один вдох. (C) Для срез-селективного, взвешенного по диффузии 2D-изображения пользователь определяет порядок срезов, изображений с b-значением и фазового кодирования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Для обеспечения надежной вентиляции и доставки 129Xe требуются надежные процедуры седации и интубации. Для каждого исследования необходимо учитывать побочные эффекты каждого анестетика, включая изменения минутной вентиляции, частоты сердечных сокращений (ЧСС) и артериального давления 58,59,60,61,62,63,64,65,66. В то время как для доклинической газовой МРТ с газом HP использовались различные седативные средства, мы используем смесь кетамина, ксилазина и ацепромазина из-за ее доступности, экономичности, надежности и продолжительности67,68. После введения седативных препаратов животные должны быть интубированы для эффективной искусственной вентиляции легких. Интубация мышей затруднена из-за небольшого размера их анатомии, и поэтому важно тщательно тренироваться в этой технике. Мы призываем исследователей ознакомиться с опубликованными видеопротоколами 69,70. Поскольку большинство коммерческих интубационных канюль изготовлены из нержавеющей стали, мы внедряем технологию создания не содержащих металлов (т.е. совместимых с МРТ и HP-газом) клиновидных канюль, которые могут быть настроены в соответствии с диаметром дыхательных путей для создания герметичного уплотнения со стенкой трахеи мыши.
Поскольку изображения 129Xe собираются в течение многих вдохов, настройки аппарата ИВЛ имеют решающее значение. Стратегии защитной вентиляции должны быть тщательно продуманы для предотвращения повреждения легких 71,72,73,74. В частности, использование малого дыхательного объема (TV), умеренного положительного давления в конце выдоха (PEEP) и альвеолярных маневров рекрутирования (RMs) снижает риск повреждения легких, вызванного искусственной вентиляцией, у пациентов и животных моделей 75,76,77,78,79,80,81. Здесь мы рекомендуем простую технику, совместимую с механической вентиляцией с перепадом давления 129Xe, которая является защитной и обеспечивает достаточное отношение сигнал/шум 129Xe. В частности, мы применяем PEEP, добавляя коммерческий клапан PEEP к линии выдоха аппарата ИВЛ. Для выполнения РМ линия выдоха должна быть замкнута таким образом, чтобы животное получало несколько вдохов без выдоха до тех пор, пока не будет достигнуто целевое давление и продолжительность.
На протяжении всего исследования мы приводим общие настройки вентиляции, но рекомендуется ознакомиться с литературой для решения конкретных целей исследования 82,83. Помимо контроля пикового давления на вдохе во время искусственной вентиляции легких, важно следить за температурой животного, что можно сделать с помощью стандартных методов контроля температуры мышей. Хотя мониторинг частоты сердечных сокращений с помощью электрокардиограммы (ЭКГ) не требуется для визуализации, он может быть полезен; ЭКГ может показать, просыпается ли животное от седативного эффекта, передозировки или стресса, что позволяет исследователю вмешаться.
Описываемый нами протокол предназначен для сбора данных радиальной вентиляции 129Xe3D 61, диффузионно-взвешенных данных76 2D GRE и данных газообмена динамической импульсной спектроскопии. Этот протокол направлен на преодоление разрыва между доклиническими исследованиями на моделях мелких животных и потенциалом МРТ 129Xe для улучшения нашего понимания легочных заболеваний.
протокол
Все описанные здесь методы были одобрены Комитетом по уходу за животными и их использованию (IACUC) Медицинского центра детской больницы Цинциннати.
1. Первичная подготовка площадки
- Создание и испытание теплополяризованного газового фантома 129Xe (рис. 3).
- Получите сосуд из боросиликатного стекла (~60 мл), плунжерный клапан с уплотнительным кольцом с передним уплотнением и шлифованный стержень из боросиликатного стекла с номинальным давлением до 150 фунтов на кв. дюйм изб. Убедитесь, что нет магнитных деталей. Прикрепите компрессионный фитинг к стеблю стекла. Затяните, чтобы получилось газонепроницаемое уплотнение.
- Подключите сосуд к вакуумному насосу и резервуару для кислорода в соответствии с рисунком 3А. Вакуумный сосуд с абсолютным давлением менее 100 мТорр.
- Наполните сосуд кислородом до давления 1,5 атм, чтобы снизить 129Xe T1 с > 30 мин до ~2 с (при напряженности магнитного поля 7 Тл; Для сканера 9,4 Тл используйте кислород 1,6 атм). Сосуд для тюленей.
ПРИМЕЧАНИЕ: Для более высоких напряжений поля потребуется несколько более высокое парциальное давление кислорода для достижения T1≤ 2 с84. - Заполните газонепроницаемый резервуар 400 мл изотопно обогащенного ксенона (85% 129Xe).
ПРИМЕЧАНИЕ: Также можно использовать природное содержание ксенона (26% 129Xe), но для смягчения ~3-кратного снижения отношения сигнал/шум необходимо увеличить. - Подключите судно к резервуару 129Xe. Вакуумная трубка с абсолютным давлением менее 100 мТорр.
- Залейте настольную жидкость с открытым горлышком N2 Dewar до ~90%. Погрузите дно сосуда (~5 см) в жидкий азот для конденсации O2 и создания вакуума (рис. 3B). Находясь в погружении, откройте клапан, чтобы 129Xe из резервуара потекли в сосуд (Рисунок 3C).
- Закройте плунжерный клапан, медленно потянув за шток до тех пор, пока впускное отверстие в плунжтере не пройдет за уплотнительное кольцо. Сразу после того, как отверстие пройдет через уплотнительное кольцо, вручную затяните, чтобы запечатать сосуд. Извлеките из сосуда жидкий азот и дайте ему оттаять.
ПРИМЕЧАНИЕ: После размораживания давление в сосуде составит ~4,5 атм (2 атм O2 + 2,5 атм 129Xe). - Защитите стеклянную посуду (например, вставьте сосуд в контейнер с мягкой подкладкой из поливинилхлорида (ПВХ), рисунок 3D).
ПРИМЕЧАНИЕ: При правильном обслуживании фантом может поддерживать давление в течение десятилетия или дольше. - ИзмерьтеT1 фантома (например, с помощью спектроскопической инверсионной последовательности восстановления). Подтвердите T1 < 2 с для сканеров 7 T. Отслеживайте сигнал и T1 с течением времени для обеспечения качества (QA).
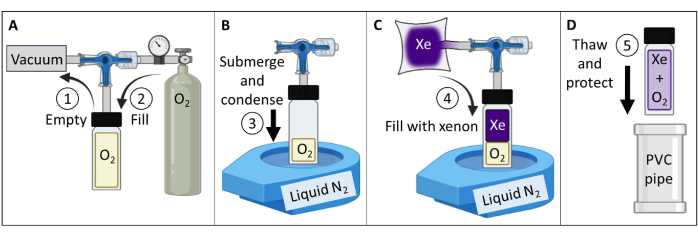
Рисунок 3: Создание термически поляризованного газового фантома 129Xe в соответствии с протоколом, подробно описанным в шаге 1.1. Парциальные давления O2 и 129Xe могут быть изменены для настройки T1 для получения соответствующего значения 129Xe T1 и мощности сигнала при заданной напряженности поля84. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
- Выполнение контроля качества с помощью термополяризованного газового фантома (Таблица 1 и Рисунок 4).
- Поместите катушку 129Xe в изоцентр магнита и центрируйте газовый фантом 129Xe внутри катушки. В последовательности импульсов и захвата («одиночный импульс») установите рабочую частоту в соответствии с приблизительной частотой газа 129Xe в фантоме (~83,07 МГц при 7 Тл).
- Центрируйте частоты регистрации и возбуждения по частоте 129Xe Лармора и используйте эту частоту для всех фантомных калибровок и контроля качества сканирования 129Xe. В таблице 1 приведены экспериментальные параметры для всех сканирований QA. Убедитесь, что фантом центрирован с помощью фантомного локализатора (рис. 4A).
- Проведите эксперимент с нутацией для калибровки угла поворота: предполагая, что отношение сигнал/шум достаточно, используйте одиночные радиочастотные импульсы с интервалом времени повторения (TR) > 5 x T1. Для каждого сбора данных постепенно увеличивайте мощность РЧ до тех пор, пока сигнал не станет нулевым и не начнет инвертироваться. Здесь используется следующий стандарт: количество импульсов = 65; TR = 10 с; длительность импульса = 125 μс; Мощность РЧ = 1-13,8 Вт, увеличенная на 0,2 Вт
- Преобразование Фурье и фазирование первого спектра (т.е. спектра, полученного с наименьшей мощностью радиочастоты). Примените одну и ту же фазировку для всех спектров. Построение графика реальных спектров в зависимости от мощности РЧ-импульса (рис. 4B).
- Мощность, которая создает нулевой пик (т.е. минимальную высоту пика), соответствует углу поворота 180°. Обеспечьте угол поворота на 90°, используя ту же мощность при половине длины импульса, которая необходима для создания угла поворота на 180°. Если программное обеспечение сканера позволяет, установите опорную мощность 90° и длину импульса для последующего масштабирования угла поворота.
- Используйте один импульс для прокладки, минимизировав полную ширину в половине максимума спектра 129Xe (TR ~ 1 с). При необходимости перецентрируйте частоту после шимминга. Запишите половину макса во всю ширину.
- Запустите сканирование 129Xe QA (Таблица 1 и Рисунок 4C). Запись данных QA: отношение сигнал/шум, средний фантомный сигнал и стандартное отклонение шума.
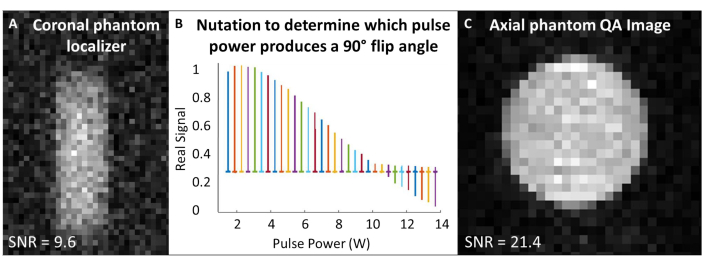
Иллюстрация 4: Контроль качества перед сканированием. (A) Корональный фантомный локализатор 2D GRE с низким разрешением гарантирует, что фантом будет центрирован в магните. (B) Эксперимент с нутацией для установки импульса 90° показывает нулевой пик при импульсе 180°. (C) После локализации и калибровки угла поворота получите изображение 2D GRE QA с более высоким разрешением. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Сокращенное название протокола | Описание последовательности | TR (мс) | TE (мс) | Средние значения / Повторения | Угол поворота (°) | Размер матрицы или Npts | Поле зрения (мм2) | РЧ ширина полосы (кГц) | Толщина среза / плиты (мм) | Продолжительность сканирования |
| Одиночный импульс | Захват импульсов | 1000 | 1 / 1 | 60 | 2048 | 10 | 1 с | |||
| Фантомный локализатор | 2D GRE | 200 | 3.7 | 20 / 1 | 48 | 60 ×32 | 120 ×48 | 3 | 60 | 2 мин |
| Калибровка угла поворота | Захват импульсов | 7000 | 1 / 65 | 20 | 2048 | 5.12 | 7,5 мин | |||
| 129Xe QA | 2D GRE | 5000 | 3.3 | 8 / 1 | 90 | 322 | 322 | 3 | 40 | 21 мин |
Таблица 1: Параметры последовательности обеспечения качества фантомной калибровки. TR = время повторения, TE = время эха, Nпунктов = количество точек, FOV = поле зрения, BW = ширина полосы. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
- Планируйте поляризацию (рис. 5А, Б).
- Выберите поляризованный объем 129Xe и время накопления: 400 мл за 15 минут является оптимальным для этого протокола (Рисунок 5), но может быть легко отрегулирован для других применений и оборудования.
- Предполагая известный мертвый объем в гиперполяризаторе (например, Vмертвый объем = 80 мл), рассчитайте расход (FXe в SLM) для желаемого объема V, 129Xe газовой фракции f и времени накопления tacc:
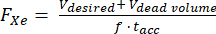 (1)
(1)
ПРИМЕЧАНИЕ: В то время как более длительное время производства обычно приводит к более высокой поляризации, они могут быть непрактичными для визуализации in vivo. Используйте подходящую модель для гиперполяризатора 85,86,87,88, чтобы определить скорость потока, которая сбалансирует время производства и поляризацию. Здесь использовалась модель J. W. Plummer et al.89 (рис. 5A). Это относится к поляризаторам с непрерывным потоком и не применимо к гиперполяризаторам90 с остановленным потоком. - Поляризуйте газ по этим параметрам, измерьте поляризацию с помощью коммерческого или самодельного устройства и сравните ее с прогнозируемой поляризацией для QA.
- Измерьте потери на поляризацию во время транспортировки. Если поляризация уменьшается на достаточно большую величину (например, на >10%), соорудите магнитный чехол для переноски для защиты поляризации во время транспортировки. Смотрите Дополнительный файл 1: Управление поляризацией во время транспортировки и Дополнительный рисунок 1.
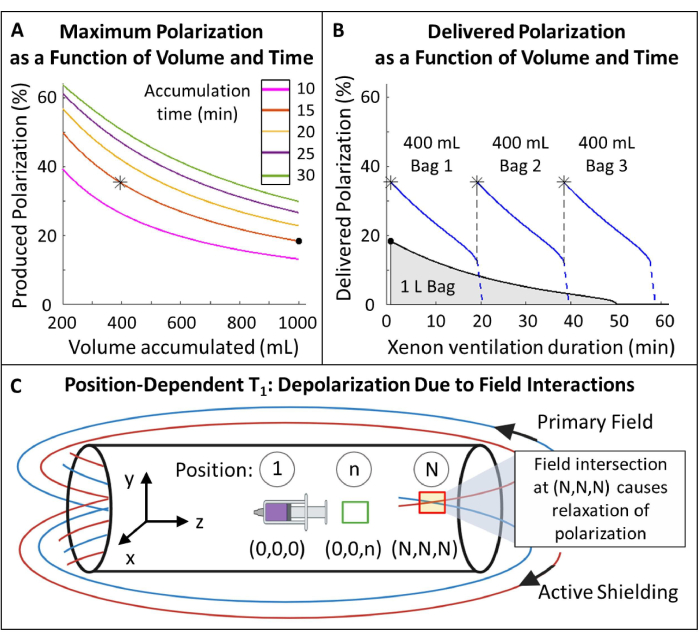
Рисунок 5: Управление поляризацией. (A) Поляризация и производимый объем являются функцией времени накопления и скорости потока. Мешок с газом объемом 400 мл обеспечивает высокую начальную поляризацию (~35%) в течение 20 минут. Несмотря на то, что использование 1 литра газа может показаться привлекательным, он будет иметь меньшую начальную поляризацию (~20%). (B) После ~15 минут вентиляции 1-литровая партия HP 129Xe должна была истощиться до <10% поляризации, в то время как 600 мл газа оставались116. Таким образом, использование нескольких пакетов объемом 400 мл 129Xe поддерживает более высокую среднюю поляризацию. C) Места пересечения основного поля и активного экранирующего поля (красный прямоугольник в позиции (N,N,N)) могут привести к быстрому ослаблению HP 129Xe. Определение характеристик бахромного поля магнита позволяет определить безопасные зоны, в которых резервуары HP 129Xe могут быть размещены без быстрой релаксации (зеленый прямоугольник в позиции (0,0,n)). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный файл 1: Управление поляризацией во время транспортировки. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
- Измерьте зависящее от положения T1 для HP 129Xe в поле полосы (рис. 5C).
- Создание опорных точек с известными расстояниями и положениями относительно изоцентра магнита по размерам X, Y и Z. Обозначьте изоцентр и обозначьте другие положения от n до N. Количество позиций для исследования будет зависеть от доступного места.
- Гиперполяризуйте небольшой объем 129Xe (~250 мл) и транспортируйте его в диспетчерскую МРТ. Наполните большой шприц (50-100 мл) 129Xe и поместите его в изоцентр внутри магнита (позиция 1 на рисунке 5C). Воспроизведите импульс с углом поворота ~1° для измерения сигнала.
- Оставьте шприц в нужном положении на ~10 минут, затем приобретите другой спектр. Измеряйте сигнал каждые 10 минут до тех пор, пока сигнал не затухнет хотя бы на 1Тл1 (т.е. сигнал не угаснет до ~1/3 своего первоначального значения).
- Начните новый эксперимент сТ1 с новым шприцем 129Xe, повторив Шаг 1.4.2.
- Переместите шприц в новое положение (например, в положение n на рисунке 5C) и оставьте его там на 10 минут. Верните шприц в изоцентр, чтобы получить дополнительный спектр угла поворота ~1°.
- Повторите этот процесс: переместите шприц в положение n, подождите 10 минут, верните его обратно в изоцентр и повторно измеряйте сигнал до тех пор, пока он не затухнет хотя бы на 1Тл1.
- Повторите шаги 1.4.4 - 1.4.6 для остальных опорных положений, охватывающих направления X, Y и Z.
- Исходный сигнал (S0) будет затухать моноэкспоненциально в течение n радиочастотных импульсов с углом поворота θ. Подгоним сигнал (S) как функцию времени (t) в поле полосы, чтобы вычислить T1 в каждой позиции:
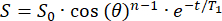 (2)
(2) - Определите позицию с достаточнымT1 (>20 мин) для размещения резервуара 129Xe.
- Создание безметалловых интубационных канюль (Рисунок 6).
- Получите два внутривенных катетера политетрафторэтилена (ПТФЭ) с коннекторами Люэра. Выбросьте иглы в контейнер для утилизации острых предметов.
ПРИМЕЧАНИЕ: Для мышей >25 г используйте катетеры 18 G и 20 G. Для мелких животных используйте катетеры 20 G и 22 G. - Отрежьте разъем Люэра от катетеров. Введите меньший катетер в верхний конец большего катетера, чтобы создать более резко сужающуюся и длинную канюлю. Обрежьте композитную канюлю до ~4,6 см со скошенным концом, не включая основание Люэра (рис. 6А, Б).
- Отрежьте более широкий конец наконечника пипетки объемом 200 мкл до длины ~2,6 см (рис. 6C).
- Покройте внутреннюю часть наконечника пипетки общей смазкой для пресс-формы. Используйте еще один наконечник для дозатора, вставленный внутрь, чтобы тонко распределить смазку. Заполните наконечник пипетки эпоксидной эпоксидной пастой для вулканизации на основе ацетоксисиликона (рис. 6D, E).
- Подключите канюлю проводом 22 G, выходящим с обоих концов. Проведите трубку канюли через силикон в наконечнике пипетки. Вытяните трубку на ~7 мм за конец наконечника пипетки (рис. 6F, G).
- Проденьте трубку канюли на более широкой стороне наконечника пипетки через пластиковый соединитель Люэра с наружной резьбой, склеивая детали вместе эпоксидной смолой. Обрежьте трубку, которая выходит за пределы соединителя Люэра (рис. 6H).
- Подождите, пока эпоксидная смола высохнет (>24 ч), затем осторожно извлеките силиконовую канюлю для интубации из формы для наконечника пипетки. Извлеките провод из канюли, убедившись, что трубка не была закупорена (рисунок 6I).
- Чтобы сделать ручку для легкой интубации, подсоедините трубку (1/16 дюйма или 1/8 дюйма) к гнездовому разъему Luer. Когда будете готовы к интубации, подсоедините этот женский соединитель Люэра к мужской канюле для интубации Люэра. Этот кусочек можно легко отсоединить после интубации (Рисунок 6J).
- Дезинфицируйте перед каждым использованием на животных: протрите внешнюю сторону канюли 70% спиртом. Протрите провод 20 г дезинфицирующим средством, затем пропустите провод через канюлю, чтобы продезинфицировать внутреннюю часть и убедиться в отсутствии засоров.
- Получите два внутривенных катетера политетрафторэтилена (ПТФЭ) с коннекторами Люэра. Выбросьте иглы в контейнер для утилизации острых предметов.
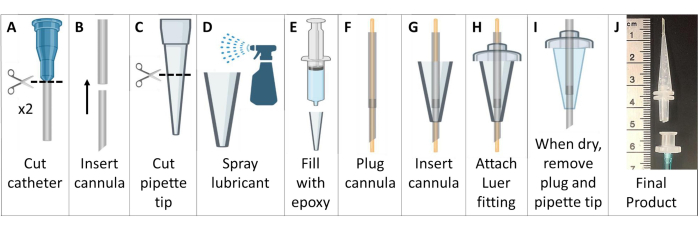
Рисунок 6: Создание МРТ и совместимых с HP 129Xe канюль для интубации мышей. Эти канюли состоят из венозных катетеров, наконечников пипеток и силиконового герметика, как описано в шаге 1.5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Ежедневный сбор данных
ПРИМЕЧАНИЕ: См. Дополнительный файл 2: Контрольный список контроля качества доклинического сканирования.
Дополнительный файл 2: Контрольный список контроля качества доклинического сканирования. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
- Полный ежедневный контроль качества сканера и настройка аппарата ИВЛ (Рисунок 4).
- С помощью фантомов запустите протоколы контроля качества на сканере (см. Таблицу 1 для параметров сканирования контроля качества и Шаг 1.2 для ежедневных шагов контроля качества).
- Калибровка аппарата ИВЛ по методике J. Nouls et al.38. Смотрите Дополнительный файл 3: Калибровка аппарата ИВЛ, Дополнительный рисунок 2 и Дополнительный рисунок 3.
- Установите настройки аппарата ИВЛ для визуализации в конце вдоха (Таблица 2). Поместите лежанку для животных на стойку сканера, а модуль жизнеобеспечения (т. е. детали аппарата искусственной вентиляции легких) — на стол рядом со сканером.
- Активируйте систему обогрева животных для конкретного объекта. Установите нагреватель на 35,5 - 40 °C, включите циркуляцию воздуха и поместите воздушный шланг в пределах ~5 дюймов от того места, где будет лежать голова животного, чтобы предварительно нагреть отверстие сканера.
| Настройка вентиляции | Рекомендации по проведению МРТ HP 129Xe | Примечания |
| Приливный объем (ТВ) | 8–10 мл/кг идеальной массы тела | Умеренное ТВ; низкий уровень телевизора требует более высокой BR, что может привести к артефактам движения на изображении |
| Положительное давление в конце выдоха (PEEP) | 2–6 см H2O | |
| Частота дыхания (BR) | 80–120 руб/мин | |
| Маневры по набору персонала (РМ) | ~35 смЧ2O в течение 6 с каждые 5 мин | |
| Продолжительность вентиляции; Позиция | < 6 ч; ленивый | Лежать на спине, чтобы лучше видеть движение грудной клетки |
| Фракция вдыхаемого кислорода (F,I,O2) | 0.3–0.5 | Предотвращение гипоксии у мышей под наркозом |
| Соотношение вдоха и выдоха (I:E) | 1:2–1:4 | |
| От инспираторного к общей продолжительности цикла | 0.2–0.4 | |
| Минутная вентиляция | ≥0,57 мл·г-1·мин-1 | |
| Наши стандарты: | ||
| BR = 80 руб/мин, длительность вдоха = 200 мс, FIO2 = 0,3 | ||
| Визуализация в конце вдоха: задержка дыхания = 200 мс, задержка запуска = 200 мс после начала вдоха | ||
| Визуализация во время задержки дыхания: задержка дыхания = 250 мс, задержка триггера = 250 мс после начала вдоха | ||
| Визуализация в конце выдоха: задержка дыхания = 200 мс, задержка запуска = 650 мс после начала вдоха | ||
Таблица 2: Рекомендуемые настройки аппарата ИВЛ для визуализации 129Xe. Параметры могут быть точно настроены для конкретных целей исследования и условий эксперимента 117,118,119,120,121,122,123,124. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный файл 3: Калибровка аппарата ИВЛ. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
- Успокоить и интубировать животное.
- Включите инкубатор на 27,7 °C и/или электрическую грелку на 37,7 °C. Измерьте и запишите массу тела животного. Рассчитайте дозировку седативного средства исходя из массы. В таблице 3 приведен типичный режим дозирования.
- Введите седативное средство внутрибрюшинно. Обратите внимание на время инъекции и установите таймер для следующей дозы седативного средства.
ПРИМЕЧАНИЕ: Выполните оставшиеся шаги в разделе 2 (Ежедневный сбор данных) как можно быстрее, чтобы свести к минимуму время приема седативных препаратов и риск передозировки. - Нанесите на глаза животного глазную смазку и поместите животное в клетку на грелке или в инкубатор, чтобы предотвратить переохлаждение.
- Убедитесь, что животное полностью усыплено, выполнив тест с щипцом ноги через 10-15 минут после инъекции седативного средства68. Интубация проводится в соответствии с процедурами, описанными в Das et al.69.
ПРИМЕЧАНИЕ: Статья Das et al.69 сопровождается всесторонней видеодемонстрацией этой техники. Шаги следующие: - Подвесьте животное лежа на спине за зубы на наклонной доске. Используйте депрессор для грызунов, чтобы вытащить язык.
- Чтобы обеспечить видимость голосовых связок, подавайте белый свет через оптоволоконный кабель внутри интубационной канюли или яркий свет, размещенный на внешней стороне горла. Вставьте канюлю менее чем на 5 мм дальше голосовых связок.
- Убедитесь, что канюля находится в трахее, а не в пищеводе, подключив ее к трубке с небольшой каплей воды внутри. Если капля воды движется в такт дыханию животного, то, скорее всего, положение правильное.
| Агент | Доза | Маршрут | Длительность | Комментарии | |||
| Ингаляционные вещества | |||||||
| Изофлуран | Индукция: 4%–5% Техническое обслуживание: 1%– 3% или к эффекту | Вдыхании | Во время непрерывного потока | • Требует использования откалиброванного испарителя | |||
| Инъекционные агенты | |||||||
| Рекомендуется: кетамин + ксилазин + ацепромазин | 90 + 9 + 3 мг/кг | Внутрибрюшинный | 20–60 мин | • Создает восприимчивость к переохлаждению | |||
| • При повторном приеме рекомендуется перейти на смесь кетамин + ксилазин, чтобы предотвратить передозировку | |||||||
| • Вызывает дрожь по мере стирания. Для визуализации строго придерживайтесь графика дозирования | |||||||
| • Может вызвать брадикардию | |||||||
| Кетамин + ксилазин | 90 + 9 мг/кг | Внутрибрюшинный | 20–40 мин | • См. выше (Кетамин + ксилазин + ацепромазин) | |||
| Пентобарбитал | 50 - 70 мг/кг | Внутрибрюшинный | 20–60 мин | • Снижает частоту дыхания и движений | |||
| • Расходы могут быть непомерно высокими | |||||||
| • Фармацевтический класс может быть недоступен | |||||||
| Дисклеймер: Это общие рекомендации. Перед внедрением проконсультируйтесь с ветеринаром для получения дополнительной информации. | |||||||
Таблица 3: Общий формуляр анестетиков для мышей. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
- Проветривание животного (табл. 2).
- Подключите животное к аппарату искусственной вентиляции легких через разъем Люэра на интубационной канюле. Контролируйте движение диафрагмы и пиковое давление на вдохе (~10-12 см H2O для дыхательного объема 10 мл/кг массы тела). Если давление или дыхательные движения ненормальные, осторожно отрегулируйте угол наклона шейки и глубину канюли по мере необходимости.
- Убедитесь, что интубационная канюля герметична, выполнив маневр рекрутинга: предотвратите выдох (например, пальцем заблокируйте порт выдоха) таким образом, чтобы животное делало многократный вдох без выдоха.
ПРИМЕЧАНИЕ: Если давление в дыхательных путях достигает 35 смH2O пикового давления на вдохе в течение ~6 с, уплотнение дыхательных путей достаточно плотное. Если нет, см. обсуждение для устранения неполадок. - Дайте возобновить нормальный выдох. Выполняйте маневры рекрутинга между сканированиями и каждые ~5 минут, когда не сканирование, чтобы поддерживать податливость легких и предотвратить ателектаз. Подсоедините клапан PEEP к линии выдоха. Установите PEEP на 4 см H2O. Наблюдайте, как пиковое давление на вдохе увеличивается на эту величину.
- После успешной интубации спланируйте и инициализируйте выработку HP 129Xe в соответствии с графиком повторной дозы седативного средства, чтобы животное не проснулось во время сканирования. Следите за температурой тела на протяжении всего эксперимента.
- Сбор данных: сбор изображений вентиляции.
ПРИМЕЧАНИЕ: Шаги сбора данных 2.4, 2.5 и 2.6 могут быть выполнены в любом порядке- Настройте аппарат ИВЛ в соответствии с таблицей 2 для визуализации в конце вдоха.
- Загрузите следующие протоколы настройки: протонный локализатор животных, одиночный импульс для центрирования на частоте газа в легких мыши и локализатор животных 129Xe. Параметры сканирования приведены в таблице 4 .
- Расположите животное в изоцентре и подтвердите, что грудная полость находится в центре поля зрения с протонной локализацией. При использовании одночастотных катушек замените протонную катушку на радиочастотную катушку с усилием 129Xe.
- Запишите поляризацию 129Xe и перенесите ее на МРТ-сканер. Смотрите Дополнительный файл 4: Контрольный список контроля качества ксеноновой поляризации.
- Поместите пакет с 129Xe в канистру вентилятора и запечатайте. Подсоедините канистру на одной линии с аппаратом ИВЛ и дайте канистре нагнетать давление (3–6 фунтов на кв. дюйм изб.).
- Инициируйте искусственную вентиляцию легких 129Xe. Каждый раз, когда активируется вентиляция 129Xe, позвольте животному сделать ~5 вдохов перед началом сканирования, чтобы восстановить функциональную остаточную емкость легких.
ПРИМЕЧАНИЕ: Переключитесь на смесь N2/O2 между сканированием 129Xe для сохранения гиперполяризованного газа. - С помощью одного импульса отрегулируйте рабочую частоту в соответствии с резонансной частотой in vivo газообразного 129Xe (~83,07 МГц при 7 Тл). Скопируйте частоту для всех последующих сканирований газовой фазы 129Xe. Выполните локализацию 129Xe, чтобы подтвердить, что легкие находятся в изоцентре.
- Загрузите и запустите последовательность радиальной вентиляции 129Xe. Контролируйте пиковое давление на вдохе.
ПРИМЕЧАНИЕ: Если газ 129Xe закончится до завершения протокола, пиковое давление на вдохе будет быстро снижаться. Мешок объемом 400 мл 129Xe может проветривать мышь массой 30 г в течение ~24 мин при вентиляции с 70% 129Xe при 80 вдохах в минуту с дыхательным объемом 10 мл/кг идеальной массы тела. - Когда сканирование будет завершено, переключитесь на вентиляцию с помощью смеси N2/O2 и удалите пустой пакет с 129Xe.
- Для визуализации в конце выдоха измените продолжительность задержки дыхания и задержку запуска в соответствии с таблицей 2 и повторите шаги 2.4.2 - 2.4.9.
- Экспортируйте необработанные данные со сканера.
| Сокращенное название протокола | Описание последовательности | Триггер | TR (мс) | TE (мс) | Повторений | Угол поворота (°) | Размер матрицы или Npts | Поле зрения (мм2) | РЧ ширина полосы (кГц) | Толщина среза/плиты (мм) | Продолжительность сканирования |
| Одиночный импульс | Захват импульсов (газовая фаза) | Необязательный | 1000 | 1 | 60 | 2048 | 10 | 1 с | |||
| Локализатор животных | 2D GRE | Да | 50 | 1.7 | 1 | 60 | 642 | 322 | 3 | 25 | 60 с |
| Радиальная вентиляция | 3D Мультиэхо радиальный | Да | 20 | Смотрите подпись | 1 | 30 | 613 | 223 | 32.05 | 30 | 16 мин |
| Одиночный импульс с растворенной фазой | Регистрация импульсов (растворенная фаза) | Нет | 80 | 1 | 90 | 512 | 10.35 | 80 мс | |||
| Спецификация динамики растворенной фазы. | Регистрация импульсов (растворенная фаза) | Нет | 50 | 1000 | 90 | 512 | 10.5 | 50 с | |||
| Диффузионно-взвешенный | 2D GRE | Да | 12.2 | 8.1 | 4 | 45 | 642 | 322 | 3 | 1.5 | 18 мин |
Таблица 4: Параметры последовательности in vivo . Описанная ранее последовательность 3D многоэхо-радиальной вентиляции39 позволяет получать изображения с 6 разами эхо-сигнала. Приведены результаты для первого эхо-изображения (TE = 1,12 мс, рис. 7). Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный файл 4: Контрольный список контроля качества поляризации ксенона. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
- Сбор данных: Запуск динамической спектроскопии растворенной фазы.
- Настройте аппарат ИВЛ в соответствии с таблицей 2 для визуализации во время задержки дыхания. Установите BR на 100 вдохов/мин. Подготовьтесь к приобретению нового мешка 129Xe, как описано в шагах 2.4.2 - 2.4.5.
- Инициируйте искусственную вентиляцию легких 129Xe. Загрузите и запустите один импульс, чтобы отрегулировать рабочую частоту в соответствии с частотой растворения (~83,084 МГц при 7 Тл). Скопируйте рабочую частоту в динамическую спектроскопию растворенной фазы.
Примечание: Это будет один пик у мышей с гемоглобиномдикого типа 54. - Загрузите и запустите динамическую спектроскопическую последовательность с центром по частоте растворения в легких животных. Когда сканирование будет завершено, переключитесь на вентиляцию с помощью смеси N2/O2 и удалите пустой пакет с 129Xe. Экспортируйте необработанные данные со сканера.
- Сбор данных: сбор взвешенных по диффузии изображений.
- Настройте аппарат ИВЛ в соответствии с таблицей 2 для визуализации во время задержки дыхания. Подготовьтесь к приобретению нового пакета 129Xe, как в шагах 2.4.2 - 2.4.7.
- Загрузите и запустите диффузионно-взвешенную последовательность. Когда сканирование будет завершено, переключитесь на вентиляцию с помощью смеси N2/O2 и удалите пустой пакет с 129Xe. Экспортируйте необработанные данные со сканера.
3. Завершение эксперимента
- Восстановление животного.
- Вытяните интубационную канюлю прямо изо рта животного. Если животное не сразу начинает дышать самостоятельно, наложите легкие компрессии грудной клетки. Если это возможно, подайте легкий поток медицинского кислорода рядом с мордой животного, чтобы поддержать восстановление после седативного эффекта.
- Как только животное начнет дышать самостоятельно, если животное находилось под действием седативных препаратов в течение >2 ч, введите 0,5 - 1 мл нормального физиологического раствора подкожно, чтобы предотвратить обезвоживание.
- Верните животное в клетку самостоятельно. Поместите клетку в инкубатор или на грелку.
ПРИМЕЧАНИЕ: Усыпленные животные уязвимы к каннибализму и не могут быть помещены в клетку с соседями по клетке до полного выздоровления (т.е. самостоятельного передвижения). Усыпленные животные не могут регулировать температуру своего тела. Используйте тыльную сторону ладони, чтобы каждые несколько минут ощущать температуру животного. - Внимательно следите за животным до тех пор, пока к нему не вернется рефлекс выпрямления (т.е. оно сможет самостоятельно перевернуться из положения лежа на спине в положение лежа).
- Отключите животное от тепловизионной поддержки, как только оно сможет самостоятельно передвигаться. Верните животное в клетку вместе с его товарищами по клетке.
Примечание: если у животного нет соседей по клетке, оно более восприимчиво к гипотермии, вызванной седативным эффектом. Обеспечьте животное дополнительной подстилкой, и если таковая имеется, оставьте животное в инкубаторе на ночь. - Записывайте вес животного один раз в неделю в течение 2 недель, чтобы следить за его здоровьем.
ПРИМЕЧАНИЕ: Если животное получило травму рта или пищевода в результате интубации, оно может перестать есть. Если животное теряет >20% от первоначальной массы тела, обратитесь к ветеринару по поводу эвтаназии.
- Проанализируйте изображения вентиляции (рис. 7).
- Загрузите необработанные данные в платформу программирования. Загрузите платформу реконструкции с открытым исходным кодом для недекартовых изображений91.
- Реконструируйте изображения в соответствии с инструкциями фреймворка с открытым исходным кодом. Нормализуйте первую точку на каждой радиальной проекции39.
- Сегментируйте паренхиму легких на изображениях, включая воксели с низким сигналом 129Xe или без него. Не включайте крупные дыхательные пути. Сегментируйте фоновый шум на изображении, исключая легкие, дыхательные пути и артефакты изображения.
ПРИМЕЧАНИЕ: Изображение протонного локализатора может помочь в определении границ паренхимы. - Рассчитайте отношение сигнал/шум по формуле:
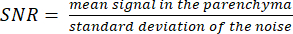 (3)
(3) - Количественно оцените дефектную вентиляцию.
Примечание: Были предложены различные методы количественной оценки нарушенной вентиляции на моделях мелких животных. Методы анализа остаются открытой областью исследований, но легко реализуемые подходы включают: (i) полуколичественную ручную сегментацию92, (ii) гистограммный подход с использованием сигнала от трахеи для нормализации паренхиматозного сигнала47 и (iii) сегментацию общего объема легких (TLV) и определение порога сигнала (например, <60% от общего среднего значения легких) для разделения легких на дефектный объем и объем легких на вентиляцию легких (VV). Количественное определение VDP 93,94 согласно:
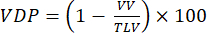 (4)
(4)
- Анализируйте динамическую спектроскопию растворенной фазы (рис. 8).
- Загрузите необработанные данные в платформу программирования. Выполните быстрое преобразование Фурье и фазируйте спектры (для этого приложения достаточно одновременного ручного фазирования спектров нулевого порядка).
- Вычислите стандартные данные ядерного магнитного резонанса (ЯМР) 95,96: SNR, полная ширина half max, интегрированная площадь, химический сдвиг и фаза обоих пиков.
- Исходя из данных о магнитудах, разделите амплитуду сигнала растворенного спектра на амплитуду газового спектра для каждого повторения, чтобы найти отношение растворенного к газу с течением времени.
- Анализируйте диффузионно-взвешенные изображения (рис. 9).
- Загрузите необработанные данные в платформу программирования. Сегментируйте паренхиму легких на изображении b0 , как показано в Шаге 3.2.3. Рассчитайте отношение сигнал/шум для каждого изображения с b-значением.
- Рассчитайте отношение сигнала к шуму, SVNR0, разделив сигнал в каждом вокселе изображения b0 на стандартное отклонение шума изображения. Исключите воксели с SVNR0 < шумом изображения в 2,5 раза97.
ПРИМЕЧАНИЕ: SVNR0 — это индивидуальная воксельная метрика, в то время как паренхиматозная SNR — это метрика всего легкого. - Рассчитать АЦП путем подгонки затухания сигнала по b-значениям (bi) в соответствии с уравнением 598,99:
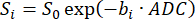 (5)
(5)
Результаты
Изображения вентиляции
Если процедуры подготовки животных и вентиляции выполнены правильно, 3D-радиальная визуализация может успешно фиксировать модели вентиляции при сборе данных на вдохе или истечении (рис. 7). В то время как ...
Обсуждение
Гиперполяризованная МРТ 129Xe становится сложным и мощным методом изучения микроструктуры и функции легких на моделях мелких животных. Этот протокол предназначен для руководства первоначальной подготовкой центра и описания экспериментальных процедур, необход?...
Раскрытие информации
Петер Недбальски является консультантом компании Polarean Imaging, Plc.
Благодарности
Авторы выражают искреннюю благодарность Джерри Далку за то, что он является путеводной звездой в строительстве аппаратов искусственной вентиляции легких. Мы хотели бы поблагодарить Картера Макмастера за приготовление газа HP 129Xe. Мы также хотели бы поблагодарить доктора Мэтью Уиллмеринга и доктора Хуана Парра-Роблеса за их наводящие на размышления научные дискуссии. Фигуры, созданные с помощью BioRender.com. Эта работа финансировалась Национальными институтами здравоохранения (грант No: NHLBI R01HL143011, R01HL151588)
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | fisher scientific | Catalog No.14-955-464 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955464 |
| 10 mL graduated cylinder | Cole-Parmer | UX-34502-69 | https://www.coleparmer.com/i/cole-parmer-essentials-graduated-cylinder-glass-hexagonal-base-10-ml-2-pk/3450269?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7h3do -ssjascARuVviKd7V7kC5ztdIB6 _70DnMr-K3qk9RKeJ7-IrhoCeT 0QAvD_BwE |
| 18 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX1832CA | https://www.shopmedvet.com/product/iv-catheter-18-x-1-25inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 4oTvZkAgWQCda6ocVtQlulVrG 2536FNbu5soMVSFN8xK_g1Uh pXIRoCGwoQAvD_BwE |
| 20 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2051CA | https://www.shopmedvet.com/product/iv-catheter-20-x-2inch?r=GSS17&p=GSS17&utm_source =google&utm_medium=google_ shopping&gad_source=1&gclid= CjwKCAiA0bWvBhBjEiwAtEsoW 87ggCkgToD_XF_UgpQBTpmN dgSNfCml6TkDKlW8k27Dq_daR itPuhoCnBQQAvD_BwE |
| 22 G - veinous PFTE catheters (nonsterile) | Terumo Surflo | SROX2225CA | https://www.shopmedvet.com/product/iv-catheter-22-x-1inch?r=GSS17&p=GSS17&utm_source= google&utm_medium=google_ shopping&gad_source=1&gclid =CjwKCAiA0bWvBhBjEiwAtEso W9IM6mpee6m7e-lBfR8dZhSN KYbMUs7qgEU4gYCRTW_rJAs W_lGkthoCm30QAvD_BwE |
| 400 mL tedlar bags | Jensen Inert Products | GST-001S-3507TJC | NA |
| 60 mL syringe | fisher scientific | Catalog No.14-955-461 | https://www.fishersci.com/shop/products/sterile-syringes-single-use-12/14955461 |
| 70% alcohol | Cole-Parmer | UX-80024-34 | https://www.coleparmer.com/i/labchem-isopropyl-alcohol-70-v-v-500-ml/8002434?PubID=UX&persist=true&ip= no&gad_source=1&gclid=CjwKC AiA6KWvBhAREiwAFPZM7gGh p8g7MBHBBKadaRCAwfEMgV gna5fhYRsuXIuqoqOiToCC4fem nhoCGMEQAvD_BwE |
| Dewar for liquid nitrogen | Terra Universal | 4LDB | https://www.laboratory-equipment.com/tw-4ldb-liquid-nitrogen-dewar-ic-biomedical.html?srsltid=AfmBOooxwMtOA1Z2TweR P8V5Iy5EvYT3alZuzoiY 3UF3Ib9RgFnDxVTfWP0 |
| Eye lubricant | Refresh | REFRESH P.M. | https://www.refreshbrand.com/Products/refresh-pm |
| Fiber optic light | AmScope | HL250-AY | https://amscope.com/products/hl250-ay?tw_source=google &tw_adid=&tw_campaign= 16705014684&gad_source= 1&gclid=CjwKCAiA6KWvBhA REiwAFPZM7p-DpyvHJaGxR pAD1385hzGf1oPdKHHLFDR Sp8yrtxry11SNJeJnKxoCtAoQ AvD_BwE |
| Gaussmeter | Apex Magnets | GMHT201 | https://www.apexmagnets.com/magnets/accessories/ht-digital-gaussmeter-with-peak-hold-can-display-gauss-or-tesla |
| Glass vessel (phantom) | Ace Glass | 8648-24 | https://aceglass.com/results.php?t=8648-24&t=8648-24 |
| Heating pad | Office Depot | 9206211 | Pure Enrichment PureRelief Express Designer Series Heating Pad 12 x 15 Palm Aqua - Office Depot |
| Hyperpolarizer | Polarean | 9820 | https://polarean.com/xenon-mri-platform/ |
| Intubation board | Hallowell EMC | 000A3467 | https://hallowell.com/product/rodent-tilting-workstand/ |
| Intubation supplies | Parts list published elsewhere | NA | https://app.jove.com/t/50318/a-simple-method-of-mouse-lung-intubation |
| Isotopically enriched xenon cylinder | Linde Isotopes | XE-129(1%)N2(10%)HE CGMP 302SZ | NA |
| Liquid nitrogen | Linde | NI LC160-22 | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_liquid _lc160_22_psi_ni_lc160_22 /ni-lc160-22?cat_id=shop&node=b89 |
| Male slip luer | Cole-Parmer | UX-21943-27 | https://www.coleparmer.com/i/diba-omnifit-t-series-solvent-waste-cap-adapter-polypropylene-male-luer-slip-x-1-16-id-hose-barb-5-pk/2194327 |
| Manometer | Grainger | 3T294 | https://www.grainger.com/product/3T294?gucid=N:N:PS: Paid:GGL:CSM-2295:4P7A1P: 20501231&gad_source=1&gclid =CjwKCAiAi6uvBhADEiwAWiyR dltxrPJmmcm0bFiYLuPrB25HV QFdEfKMBqvgJBNdQUs3DZ7b TLr8CRoCanAQAvD_BwE& gclsrc=aw.ds |
| Minivent ventilator | harvard apparatus | 73-0044 | https://www.harvardapparatus.com/minivent-ventilator-for-mice-single-animal-volume-controlled-ventilators.html |
| Mouse ear puncher | fisher scientific | 13-812-201 | https://www.fishersci.com/shop/products/fisherbrand-animal-ear-tag-punch/13812201 |
| Mouse tongue depressor | Medical Tools | VRI-617 | https://medical-tools.com/shop/rodent-tongue-depressor.html |
| Mouse weight scale | Cole-Parmer | UX-11712-12 | https://www.coleparmer.com/i/adam-equipment-cqt2000-core-portable-balance-2000g-x-1g-220-v/1171212?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7iYnAG5Ilc Z5DZWrdJ6wcLDZSCSfNJHOH m2PQOpyyWe0TjFa75R3tBoCjB sQAvD_BwE |
| MRI scanner | Bruker | 7T Biospec horizontal system | https://www.bruker.com/de/products-and-solutions/preclinical-imaging/mri/biospec.html |
| Multimeter | Home Depot | 1007898529 | https://www.homedepot.com/p/Klein-Tools-600-Volt-Digital-Multi-Meter-Manual-Ranging-MM325/320822947 |
| Natural abundance xenon | Linde Isotopes | UN 2036 | NA |
| Needle | fisher scientific | 305194 | https://www.fishersci.com/shop/products/bd-general-use-precisionglide-hypodermic-needles-20/148266C?keyword=true |
| Needle safe syringe holder | fisher scientific | NC2703873 | https://www.fishersci.com/shop/products/ndlsafe-ii-syr-uncap-deca/NC2703873#?keyword=needlesafe |
| Nitrogen cylinder | Linde | NI M-K | https://www.lindedirect.com/store/product-detail/nitrogen_n2_nitrogen_nf_k/ni-m-k?cat_id=shop&node=b89 |
| Oxygen cylinder | Linde | OX M-K | https://www.lindedirect.com/store/product-detail/oxygen_o2_oxygen_usp_k/ox-m-k?cat_id=shop&node=b90 |
| Oxygen sensor | Apogee instruments | MO-200 | https://www.apogeeinstruments.com/mo-200-oxygen-sensor-with-handheld-meter/ |
| Oxygen sensor inline flowhead | Apogee instruments | AO-002 | https://www.apogeeinstruments.com/ao-002-oxygen-meter-sensor-flow-through-head/ |
| PEEP valve | Hallowell EMC | 000A6556A | https://hallowell.com/product/adjustable-peep-valve-with-exhaust-port-range-5-20cm-disposable/ |
| Pipette tips | fisher scientific | Catalog No.02-707-108 | Fisherbrand Stack-Rack Space-Saver Tips: 101-1000 L Standard; Blue; Volume: | Fisher Scientific |
| Plunger valve | Ace glass | 8648-20 | https://www.aceglass.com/results.php?t=8648 |
| Preclinical coil | Doty scientific | custom built | https://dotynmr.com/products/bmax-xy-low-e/ |
| Pressure regulators | Cole-Parmer | UX-98202-11 | https://www.coleparmer.com/i/cole-parmer-single-stage-regulator-1500-scfh-capacity-346-cga-fitting/9820211?PubID=UX&persist=true&ip=no& gad_source=1&gclid=CjwKCAi A6KWvBhAREiwAFPZM7pruR xCAiaj52nA_8Y1nveQZRsD6B f0QO65o2DKFYqRoz0PopSkX QxoCxqcQAvD_BwE |
| Pressure-drop ventilator | Parts list published elsewhere | NA | https://sites.duke.edu/driehuyslab/resources/ |
| PVC pipe for phantom | Home Depot | 193682 | https://www.homedepot.com/p/IPEX-1-2-in-x-10-ft-White-PVC-SCH-40-Potable-Pressure-Water-Pipe-30-05010HD/319692959 |
| SAI animal heating system | SAII | Model 1030 | https://i4sa.com/product/model-1030-monitoring-gating-system/ |
| Saline | Farris Laboratories Inc. | 0409488820-1 | https://www.farrislabs.com/products/bacteriostatic-sodium-chloride-0-9-30ml-bottle?variant=42807174824167¤cy =USD&utm_medium=product_ sync&utm_source=google&utm_ content=sag_organic&utm_ campaign=sag_organic&utm_ campaign=gs-2021-09-24&utm _source=google&utm_medium =smart_campaign&gad_source =1&gclid=CjwKCAiA6KWvBh AREiwAFPZM7oS3-hFDETO_2f6OWOoKyBMb WuDuWqYxdWRYUWEkY M2Py73VfGzVtRoC2FQQAvD_BwE |
| Sharps container | fisher scientific | 22-730-455 | https://www.fishersci.com/shop/products/sharps-container-47/p-7250579#?keyword=needle%20safe |
| Silicone epoxy | Grainger | 3KMY7 | https://www.grainger.com/product/3KMY7?gucid=N:N:PS:Paid:GGL:CSM- 2295:4P7A1P:20501231&gad_ source=1&gclid=CjwKCAiA6KW vBhAREiwAFPZM7voahkm8tda t1Euql1A8DFhC6AZVJ0wXzCE PfE6iUzrIJXV-Hl8o4xoCQLYQA vD_BwE&gclsrc=aw.ds |
| Silicone mold release lubricant | Grainger | 19MW95 | https://www.grainger.com/product/CRC-Mold-Release-Agent-16-oz-19MW95 |
| Spirometer | ADInstruments | FE141 | https://www.adinstruments.com/products/spirometer |
| Spirometer - mouse flowhead | ADInstruments | MLT1L | https://www.adinstruments.com/products/respiratory-flow-heads |
| Tubing - 1/4 OD | Clippard | URH1-0402-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Tubing - 1/8 OD | Clippard | URH1-0804-CLT-050 | https://www.clippard.com/part/URH1-0402-CLT-050 |
| Vacuum pump | Cole-Parmer | UX-60062-11 | https://www.coleparmer.com/i/environmental-express-diaphragm-pump-high-volume-120v/6006211?PubID=UX&persist=true&ip=no&gad _source=1&gclid=CjwKCAiA6K WvBhAREiwAFPZM7uFGwmW pRelHNFgZVvJJV09vDUVyfyG HoKeZTiFNIiVTe-05IpJJPxoCO PoQAvD_BwE |
| Wire - 18 gauge | Digikey | 2328-18H240-ND | https://www.digikey.com/en/products/detail/remington-industries/18H240/15202027?s=N4 IgjCBcoOwBxVAYygMwIYBsDOB TANCAPZQDa4YATPAGwgC6h ADgC5QgDKLATgJYB2AcxAB fQmAAMAFkqIQKSBhwFiZEA GZNATi0SGzNpE48BwsSErqw 6uQqV5CJSOQCsMF%2Bq11 GIVuy58QqLmss4gALbogvy4L AAEAO683LgMIkA |
| Xenon polarization measurement station | Polarean | NA | https://polarean.com/xenon-mri-platform/ |
Ссылки
- World Health Organization. Global health estimates 2020: Deaths by cause, age, sex, by country and by region, 2000-2019. World Health Organization. , (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for cystic fibrosis with a single Phe508del allele. N Engl J Med. 381 (19), 1809-1819 (2019).
- Taylor-Cousar, J. L., et al. Tezacaftor-Ivacaftor in patients with cystic fibrosis homozygous for Phe508del. N Engl J Med. 377 (21), 2013-2023 (2017).
- Richeldi, L., et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2071-2082 (2014).
- King, T. E., et al. A phase 3 trial of pirfenidone in patients with idiopathic pulmonary fibrosis. N Engl J Med. 370 (22), 2083-2092 (2014).
- Yong, K. S. M., Her, Z., Chen, Q. Humanized mice as unique tools for human-specific studies. Arch Immunol Ther Exp (Warsz. 66 (4), 245-266 (2018).
- Li, H., Auwerx, J. Mouse systems genetics as a prelude to precision medicine. Trends Genet. 36 (4), 259-272 (2020).
- Eppig, J. T., Motenko, H., Richardson, J. E., Richards-Smith, B., Smith, C. L. The International Mouse Strain Resource (IMSR): cataloging worldwide mouse and ES cell line resources. Mamm Genome. 26 (9-10), 448-455 (2015).
- Vedi, M., et al. 2022 updates to the rat genome database: A Findable, Accessible, Interoperable, and Reusable (FAIR) resource. Genetics. 224 (1), 042 (2023).
- Ghorani, V., Boskabady, M. H., Khazdair, M. R., Kianmeher, M. Experimental animal models for COPD: a methodological review. Tob Induc Dis. 15, 25 (2017).
- Semaniakou, A., Croll, R. P., Chappe, V. Animal models in the pathophysiology of cystic fibrosis. Front Pharmacol. 9, 1475 (2018).
- Moore, B. B., et al. Animal models of fibrotic lung disease. Am J Respir Cell Mol Biol. 49 (2), 167-179 (2013).
- Jenkins, R. G., et al. An official American thoracic society workshop report: Use of animal models for the preclinical assessment of potential therapies for pulmonary fibrosis. Am J Respir Cell Mol Biol. 56 (5), 667-679 (2017).
- Gomez-Arroyo, J., et al. A brief overview of mouse models of pulmonary arterial hypertension: problems and prospects. Am J Physiol Lung Cell Mol Physiol. 302 (10), L977-L991 (2012).
- Dignam, J. P., Scott, T. E., Kemp-Harper, B. K., Hobbs, A. J. Animal models of pulmonary hypertension: Getting to the heart of the problem. Br J Pharmacol. 179 (5), 811-837 (2022).
- Woodrow, J. S., Sheats, M. K., Cooper, B., Bayless, R. Asthma: The use of animal models and their translational utility. Cells. 12 (7), 1091 (2023).
- Van de Velde, G., et al. Longitudinal in vivo microcomputed tomography of mouse lungs: No evidence for radiotoxicity. Am J Physiol Lung Cell Mol Physiol. 309 (3), L271-L279 (2015).
- Mata, J. F., et al. Evaluation of emphysema severity and progression in a rabbit model: comparison of hyperpolarized 3He and 129Xe diffusion MRI with lung morphometry. J Appl Physiol (1985). 102 (1985), 1273-1280 (2007).
- Boudreau, M., Xu, X., Santyr, G. E. Measurement of 129Xe gas apparent diffusion coefficient anisotropy in an elastase-instilled rat model of emphysema. Magn Reson Med. 69 (1), 211-220 (2013).
- Cleveland, Z. I., et al. 3D MRI of impaired hyperpolarized 129Xe uptake in a rat model of pulmonary fibrosis. NMR Biomed. 27 (12), 1502-1514 (2014).
- Kimura, A., et al. Inflammation during lung cancer progression and ethyl pyruvate treatment observed by pulmonary functional hyperpolarized 129Xe MRI in mice. Contrast Media Mol Imaging. 2021, 9918702 (2021).
- Kimura, A., et al. Treatment response of ethyl pyruvate in a mouse model of chronic obstructive pulmonary disease studied by hyperpolarized 129Xe MRI. Magn Reson Med. 78 (2), 721-729 (2017).
- Ouriadov, A., et al. Early stage radiation-induced lung injury detected using hyperpolarized 129Xe Morphometry: Proof-of-concept demonstration in a rat model. Magn Reson Med. 75 (6), 2421-2431 (2016).
- Willmering, M. M., et al. Improved pulmonary 129Xe ventilation imaging via 3D-spiral UTE MRI. Magn Reson Med. 84 (1), 312-320 (2020).
- Kaushik, S. S., et al. Single-breath clinical imaging of hyperpolarized 129Xe in the airspaces, barrier, and red blood cells using an interleaved 3D radial 1-point Dixon acquisition. Magn Reson Med. 75 (4), 1434-1443 (2016).
- Zanette, B., Munidasa, S., Friedlander, Y., Ratjen, F., Santyr, G. A 3D stack-of-spirals approach for rapid hyperpolarized 129Xe ventilation mapping in pediatric cystic fibrosis lung disease. Magn Reson Med. 89 (3), 1083-1091 (2023).
- Zanette, B., Stirrat, E., Jelveh, S., Hope, A., Santyr, G. Physiological gas exchange mapping of hyperpolarized 129Xe using spiral-IDEAL and MOXE in a model of regional radiation-induced lung injury. Med Phys. 45 (2), 803-816 (2018).
- Collier, G. J., et al. Dissolved 129Xe lung MRI with four-echo 3D radial spectroscopic imaging: Quantification of regional gas transfer in idiopathic pulmonary fibrosis. Magn Reson Med. 85 (5), 2622-2633 (2021).
- Qing, K., et al. Assessment of lung function in asthma and COPD using hyperpolarized 129Xe chemical shift saturation recovery spectroscopy and dissolved-phase MRI. NMR Biomed. 27 (12), 1490-1501 (2014).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Mugler, J. P. Probing lung physiology with xenon polarization transfer contrast (XTC). Magn Reson Med. 44 (3), 349-357 (2000).
- Kern, A. L., et al. Investigating short-time diffusion of hyperpolarized 129Xe in lung air spaces and tissue: A feasibility study in chronic obstructive pulmonary disease patients. Magn Reson Med. 84 (4), 2133-2146 (2020).
- Amzajerdian, F., et al. Simultaneous quantification of hyperpolarized xenon-129 ventilation and gas exchange with multi-breath xenon-polarization transfer contrast (XTC) MRI. Magn Reson Med. 90 (6), 2334-2347 (2023).
- Perron, S., et al. Application of a 2D frequency encoding sectoral approach to hyperpolarized 129Xe MRI at low field. J Magn Reson. 336, 107159 (2022).
- Loza, L. A., et al. Quantification of ventilation and gas uptake in free-breathing mice with hyperpolarized 129Xe MRI. IEEE Trans Med Imaging. 38 (9), 2081-2091 (2019).
- Imai, H., et al. Regional fractional ventilation mapping in spontaneously breathing mice using hyperpolarized 129Xe MRI. NMR Biomed. 28 (1), 24-29 (2015).
- Friedlander, Y., et al. Effect of inhaled oxygen concentration on 129Xe chemical shift of red blood cells in rat lungs. Magn Reson Med. 86 (3), 1187-1193 (2021).
- Virgincar, R. S., et al. A portable ventilator with integrated physiologic monitoring for hyperpolarized 129Xe MRI in rodents. J Magn Reson. 295, 63-71 (2018).
- Nouls, J., Fanarjian, M., Hedlund, L., Driehuys, B. A constant-volume ventilator and gas recapture system for hyperpolarized gas MRI of mouse and rat lungs. Concepts Magn Reson Part B Magn Reson Eng. 39B (2), 78-88 (2011).
- Niedbalski, P. J., et al. Preclinical hyperpolarized 129Xe MRI: ventilation and T2* mapping in mouse lungs at 7 T using multi-echo flyback UTE. NMR Biomed. 33 (7), e4302 (2020).
- Akinyi, T. G. . An Affordable Open-Source Small Animal MR and Hyperpolarized Gas Compatible Ventilator: Feasibility in Preclinical Imaging. , (2017).
- Smith, L. J., et al. The assessment of short and long term changes in lung function in CF using 129Xe MRI. Eur Respir J. 6, 2000441 (2020).
- Svenningsen, S., et al. Reproducibility of hyperpolarized 129Xe MRI ventilation defect percent in severe asthma to evaluate clinical trial feasibility. Acad Radiol. 28 (6), 817-826 (2021).
- Kirby, M., et al. Hyperpolarized 3He and 129Xe MR imaging in healthy volunteers and patients with chronic obstructive pulmonary disease. Radiology. 265 (2), 600-610 (2012).
- Virgincar, R. S., et al. Quantitative analysis of hyperpolarized 129Xe ventilation imaging in healthy volunteers and subjects with chronic obstructive pulmonary disease. NMR Biomed. 26 (4), 424-435 (2013).
- Ebner, L., et al. Multireader determination of clinically significant obstruction using hyperpolarized 129Xe-ventilation MRI. AJR Am J Roentgenol. 212 (4), 758-765 (2019).
- Driehuys, B., et al. 3He MRI in mouse models of asthma. Magn Reson Med. 58 (5), 893-900 (2007).
- Mistry, N. N., Thomas, A., Kaushik, S. S., Johnson, G. A., Driehuys, B. Quantitative analysis of hyperpolarized 3He ventilation changes in mice challenged with methacholine. Magn Reson Med. 63 (3), 658-666 (2010).
- Costa, M., et al. Noninvasive assessment of in vivo mouse lung microstructural changes due to aging and PEEP. Am J Respir Crit Care Med. 207, A4713 (2023).
- Sukstanskii, A. L., Yablonskiy, D. A. Lung morphometry with hyperpolarized 129Xe: theoretical background. Magn Reson Med. 67 (3), 856-866 (2012).
- Chan, H. F., Stewart, N. J., Norquay, G., Collier, G. J., Wild, J. M. 3D diffusion-weighted 129Xe MRI for whole lung morphometry. Magn Reson Med. 79 (6), 2986-2995 (2018).
- Bier, E. A., et al. Noninvasive diagnosis of pulmonary hypertension with hyperpolarised 129Xe magnetic resonance imaging and spectroscopy. ERJ Open Res. 8 (2), 00035 (2022).
- Bier, E. A., et al. A protocol for quantifying cardiogenic oscillations in dynamic 129Xe gas exchange spectroscopy: The effects of idiopathic pulmonary fibrosis. NMR Biomed. 32 (1), e4029 (2019).
- Wang, Z., et al. Diverse cardiopulmonary diseases are associated with distinct xenon magnetic resonance imaging signatures. Eur Respir J. 54 (6), 1900831 (2019).
- Freeman, M. S., Cleveland, Z. I., Qi, Y., Driehuys, B. Enabling hyperpolarized 129Xe MR spectroscopy and imaging of pulmonary gas transfer to the red blood cells in transgenic mice expressing human hemoglobin. Magn Reson Med. 70 (5), 1192-1199 (2013).
- Iguchi, S., et al. Direct imaging of hyperpolarized 129Xe alveolar gas uptake in a mouse model of emphysema. Magn Reson Med. 70 (1), 207-215 (2013).
- Imai, H., et al. Noninvasive detection of pulmonary tissue destruction in a mouse model of emphysema using hyperpolarized 129Xe MRS under spontaneous respiration. Magn Reson Med. 64 (4), 929-938 (2010).
- Silk, S. B., Hampton, L. L., Brown, P. A. What investigators need to know about the use of animals. ILAR J. 54 (3), 324-328 (2014).
- Cereda, M., et al. Mild loss of lung aeration augments stretch in healthy lung regions. J Appl Physiol. 120 (1985), 444-454 (2016).
- Constantinides, C., Murphy, K. Molecular and integrative physiological effects of isoflurane anesthesia: The paradigm of cardiovascular studies in rodents using magnetic resonance imaging. Front Cardiovasc Med. 3, 23 (2016).
- Irwin, M. R., Curay, C. M., Choi, S., Kiyatkin, E. A. Basic physiological effects of ketamine-xylazine mixture as a general anesthetic preparation for rodent surgeries. Brain Res. 1804, 148251 (2023).
- Roth, D. M., Swaney, J. S., Dalton, N. D., Gilpin, E. A., John Ross, J. Impact of anesthesia on cardiac function during echocardiography in mice. Am J Physiol Heart Circ Physiol. 282 (6), H2134-H2140 (2002).
- Massey, C. A., Richerson, G. B. Isoflurane, ketamine-xylazine, and urethane markedly alter breathing even at subtherapeutic doses. J Neurophysiol. 118 (4), 2389-2401 (2017).
- Janssen, B. J. A., et al. Effects of anesthetics on systemic hemodynamics in mice. Am J Physiol Heart Circ Physiol. 287 (4), H1618-H1624 (2004).
- Lenzarini, F., Di Lascio, N., Stea, F., Kusmic, C., Faita, F. Time course of isoflurane-induced vasodilation: A Doppler ultrasound study of the left coronary artery in mice. Ultrasound Med Biol. 42 (4), 999-1009 (2016).
- Mondonedo, J. R., et al. Volatile anesthetics and the treatment of severe bronchospasm: A concept of targeted delivery. Drug Discov Today Dis Models. 15, 43-50 (2015).
- Nolan, J. P. Anaesthesia and Neuromuscular Block. Clinical Pharmacology. , 295-310 (2012).
- Arras, M., Autenried, P., Rettich, A., Spaeni, D., Rülicke, T. Optimization of intraperitoneal injection anesthesia in mice: drugs, dosages, adverse effects, and anesthesia depth. Comp Med. 51 (5), 443-456 (2001).
- Navarro, K. L., et al. Mouse anesthesia: The art and science. ILAR J. 62 (1-2), 238-273 (2021).
- Das, S., MacDonald, K., Chang, H. Y., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Thomas, J. L., et al. Endotracheal intubation in mice via direct laryngoscopy using an otoscope. J Vis Exp. (86), e50269 (2014).
- Slutsky, A. S., Ranieri, V. M. Ventilator-induced lung injury. N Engl J Med. 369 (22), 2126-2136 (2013).
- Matute-Bello, G., et al. An official American thoracic society workshop report: features and measurements of experimental acute lung injury in animals. Am J Respir Cell Mol Biol. 44 (5), 725-738 (2011).
- Kulkarni, H. S., et al. Update on the features and measurements of experimental acute lung injury in animals: An official American thoracic society workshop report. Am J Respir Cell Mol Biol. 66 (2), e1-e14 (2022).
- Tsuchida, S., et al. Atelectasis causes alveolar injury in nonatelectatic lung regions. Am J Respir Crit Care Med. 174 (3), 279-289 (2006).
- Fan, E., et al. An official American thoracic society/European society of intensive care medicine/society of critical care medicine clinical practice guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 195 (9), 1253-1263 (2017).
- Santos, R. S., Silva, P. L., Pelosi, P., Rocco, P. R. Recruitment maneuvers in acute respiratory distress syndrome: The safe way is the best way. World J Crit Care Med. 4 (4), 278-286 (2015).
- Mekontso Dessap, A., et al. Conflicting physiological and genomic cardiopulmonary effects of recruitment maneuvers in murine acute lung injury. Am J Respir Cell Mol Biol. 46 (4), 541-550 (2012).
- García-Fernández, J., et al. Recruitment manoeuvres in anaesthesia: How many more excuses are there not to use them. Rev Esp Anestesiol Reanim (Engl Ed). 65 (4), 209-217 (2018).
- Allen, G. B., Suratt, B. T., Rinaldi, L., Petty, J. M., Bates, J. H. Choosing the frequency of deep inflation in mice: balancing recruitment against ventilator-induced lung injury. Am J Physiol Lung Cell Mol Physiol. 291 (4), L710-L717 (2006).
- da Silva, A. C. L., et al. Sigh maneuver protects healthy lungs during mechanical ventilation in adult Wistar rats. Exp Biol Med. 245 (15), 1404-1413 (2020).
- Riva, D. R., et al. Recruitment maneuver: RAMP versus CPAP pressure profile in a model of acute lung injury. Respir Physiol Neurobiol. 169 (1), 62-68 (2009).
- Schwarte, L. A., Zuurbier, C. J., Ince, C. Mechanical ventilation of mice. Basic Res Cardiol. 95 (6), 510-520 (2000).
- Joelsson, J. P., Ingthorsson, S., Kricker, J., Gudjonsson, T., Karason, S. Ventilator-induced lung-injury in mouse models: Is there a trap. Lab Anim Res. 37 (1), 30 (2021).
- Jameson, C. J., Jameson, A. K., Hwang, J. K. Nuclear spin relaxation by intermolecular magnetic dipole coupling in the gas phase. 129Xe in oxygen. J Chem Phys. 89 (7), 4074-4081 (1988).
- Kelley, M., Branca, R. T. Theoretical models of spin-exchange optical pumping: Revisited and reconciled. J Appl Phys. 129 (15), 1-16 (2021).
- Norquay, G., Leung, G., Stewart, N. J., Wolber, J., Wild, J. M. 129Xe chemical shift in human blood and pulmonary blood oxygenation measurement in humans using hyperpolarized 129Xe NMR. Magn Reson Med. 77 (4), 1399-1408 (2017).
- Norquay, G., Collier, G. J., Rao, M., Stewart, N. J., Wild, J. M. 129Xe-Rb spin-exchange optical pumping with high photon efficiency. Phys Rev Lett. 121 (15), 153201 (2018).
- Ball, J. E., Wild, J. M., Norquay, G. Investigating Rubidium density and temperature distributions in a high-throughput 129Xe-Rb spin-exchange optical pumping polarizer. Molecules. 28 (1), 11 (2022).
- Plummer, J. W., et al. A semi-empirical model to optimize continuous-flow hyperpolarized 129Xe production under practical cryogenic-accumulation conditions. J Magn Reson. 320, 106845 (2020).
- Nikolaou, P., et al. Near-unity nuclear polarization with an open-source 129Xe hyperpolarizer for NMR and MRI. Proc Natl Acad Sci U S A. 110 (35), 14150-14155 (2013).
- Robertson, S. H., et al. Optimizing 3D noncartesian gridding reconstruction for hyperpolarized 129Xe MRI-focus on preclinical applications. Concepts Magn Reson Part A Bridg Educ Res. 44 (4), 190-202 (2015).
- Thomas, A. C., et al. A robust protocol for regional evaluation of methacholine challenge in mouse models of allergic asthma using hyperpolarized 3He MRI. NMR Biomed. 22 (5), 502-515 (2009).
- Niedbalski, P. J., et al. Protocols for multi-site trials using hyperpolarized 129Xe MRI for imaging of ventilation, alveolar-airspace size, and gas exchange: A position paper from the 129Xe MRI clinical trials consortium. Magn Reson Med. 86 (6), 2966-2986 (2021).
- Woodhouse, N., et al. Combined helium-3/proton magnetic resonance imaging measurement of ventilated lung volumes in smokers compared to never-smokers. J Magn Reson Imaging. 21 (4), 365-369 (2005).
- Brown, R. W., Cheng, Y. C. N., Haacke, E. M., Thompson, M. R., Venkatesan, R. . Magnetic Resonance Imaging: Physical Principles and Sequence Design. , (2014).
- Levitt, M. H. . Spin Dynamics: Basics of Nuclear Magnetic Resonance. , (2013).
- Salerno, M., et al. Emphysema: hyperpolarized helium 3 diffusion MR imaging of the lungs compared with spirometric indexes—initial experience. Radiology. 222 (1), 252-260 (2002).
- Niedbalski, P. J., et al. Validating in vivo hyperpolarized 129Xe diffusion MRI and diffusion morphometry in the mouse lung. Magn Reson Med. 85 (4), 2160-2173 (2021).
- Bdaiwi, A. S., et al. Improving hyperpolarized 129Xe ADC mapping in pediatric and adult lungs with uncertainty propagation. NMR Biomed. 35 (3), e4639 (2022).
- Ruppert, K., Brookeman, J. R., Hagspiel, K. D., Driehuys, B., Mugler, J. P. NMR of hyperpolarized 129Xe in the canine chest: spectral dynamics during a breath-hold. NMR Biomed. 13 (4), 220-228 (2000).
- Driehuys, B., et al. Imaging alveolar-capillary gas transfer using hyperpolarized 129Xe MRI. Proc Natl Acad Sci U S A. 103 (48), 18278-18283 (2006).
- Nakamura, K., et al. 129Xe spectra from the heads of rats with and without ligation of the external carotid and pterygopalatine arteries. Magn Reson Med. 53 (3), 528-534 (2005).
- Kershaw, J., et al. Confirming the existence of five peaks in 129Xe rat head spectra. Magn Reson Med. 57 (4), 791-797 (2007).
- Chen, R. Y., et al. Tissue-blood partition coefficient for xenon: temperature and hematocrit dependence. J Appl Physiol. 49 (2), 178-183 (1980).
- Möller, H. E., et al. Magnetic resonance angiography with hyperpolarized 129Xe dissolved in a lipid emulsion. Magn Reson Med. 41 (5), 1058-1064 (1999).
- Norquay, G., et al. Relaxation and exchange dynamics of hyperpolarized 129Xe in human blood. Magn Reson Med. 74 (2), 303-311 (2015).
- Zhang, L., et al. Absolute thermometry of human brown adipose tissue by magnetic resonance with laser polarized 129Xe. Commun Med. 3 (1), 147 (2023).
- Barshishat-Kupper, M., et al. Protein oxidation in the lungs of C57BL/6J mice following X-irradiation. Proteomes. 3 (3), 249-265 (2015).
- Olsson, L. E., et al. Measurement of MR signal and T2* in lung to characterize a tight skin mouse model of emphysema using single-point imaging. J Magn Reson Imaging. 25 (3), 488-494 (2007).
- Crowle, A. J. Delayed hypersensitivity in mice. J Allergy. 30 (2), 151-164 (1959).
- Guo, J., Cao, X., Cleveland, Z. I., Woods, J. C. Murine pulmonary imaging at 7T: T2* and T1 anisotropic UTE. Magn Reson Med. 79 (4), 2254-2264 (2018).
- Sonobe, T., et al. Imaging of the closed-chest mouse pulmonary circulation using synchrotron radiation microangiography. J Appl Physiol. 111 (1), 75-80 (2011).
- Wang, W., et al. Imaging lung microstructure in mice with hyperpolarized 3He diffusion MRI. Magn Reson Med. 65 (3), 620-626 (2011).
- Ouriadov, A. V., et al. Application of a stretched-exponential model for morphometric analysis of accelerated diffusion-weighted 129Xe MRI of the rat lung. Magn Reson Mater Phy. 34 (1), 73-84 (2021).
- O'Halloran, R. L., Holmes, J. H., Altes, T. A., Salerno, M., Fain, S. B. The effects of SNR on ADC measurements in diffusion-weighted hyperpolarized He-3 MRI. J Magn Reson. 185 (1), 42-49 (2007).
- Moller, H. E., Cleveland, Z. I., Driehuys, B. Relaxation of hyperpolarized 129Xe in a deflating polymer bag. J Magn Reson. 212 (1), 109-115 (2011).
- Reiss, L. K., Kowallik, A., Uhlig, S. Recurrent recruitment manoeuvres improve lung mechanics and minimize lung injury during mechanical ventilation of healthy mice. PLoS One. 6 (9), e24527 (2011).
- Cagle, L. A., et al. Effects of positive end-expiratory pressure and recruitment maneuvers in a ventilator-induced injury mouse model. PLoS One. 12 (11), e0187419 (2017).
- Cannizzaro, V., et al. Lung volume recruitment maneuvers and respiratory system mechanics in mechanically ventilated mice. Respir Physiol Neurobiol. 169 (3), 243-251 (2009).
- Hohlbaum, K., et al. Impact of repeated anesthesia with ketamine and xylazine on the well-being of C57BL/6JRj mice. PLoS One. 13 (9), e0203559 (2018).
- Blevins, C. E., Celeste, N. A., Marx, J. O. Effects of oxygen supplementation on injectable and inhalant anesthesia in C57BL/6 mice. J Am Assoc Lab Anim Sci. 60 (3), 289-297 (2021).
- Cannizzaro, V., et al. Impact of supplemental oxygen in mechanically ventilated adult and infant mice. Respir Physiol Neurobiol. 165 (1), 61-66 (2009).
- Sembroski, E., Sanghavi, D. K., Bhardwaj, A. Inverse Ratio Ventilation. StatPearls Publishing. , (2023).
- Boros, S. J. Variations in inspiratory:expiratory ratio and airway pressure wave form during mechanical ventilation: the significance of mean airway pressure. J Pediatr. 94 (1), 114-117 (1979).
- Zheng, W., Cleveland, Z. I., Moller, H. E., Driehuys, B. Gradient-induced longitudinal relaxation of hyperpolarized noble gases in the fringe fields of superconducting magnets used for magnetic resonance. J Magn Reson. 208 (2), 284-290 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены