Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Атомно-силовая микроскопия для измерения хрящей в интактных и регенерирующих конечностях аксолотля
* Эти авторы внесли равный вклад
В этой статье
Резюме
В этом протоколе мы показываем, как подготовить ткань аксолотля для атомно-силовой микроскопии (АСМ) и выполнить измерения вдавливания в неповрежденном и регенерирующем хряще конечности.
Аннотация
Механические силы дают важные сигналы для нормального функционирования клеток и формирования паттернов в развивающихся тканях, и их роль широко изучена в ходе эмбриогенеза и патогенеза. Сравнительно мало известно об этих сигналах во время регенерации животных.
Аксолотль является важным модельным организмом для изучения регенерации, учитывая его способность полностью восстанавливать многие органы и ткани после травмы, включая отсутствующие хрящи и кости. В связи с его важнейшей ролью в качестве основной опорной ткани в организме позвоночных, восстановление скелетной функции во время регенерации требует как восстановления отсутствующих структур, так и их механических свойств. Этот протокол описывает метод обработки образцов конечностей аксолотля для атомно-силовой микроскопии (АСМ), которая является золотым стандартом для исследования механических свойств клеток и тканей с высоким пространственным разрешением.
Используя регенеративные способности аксолотля, в этом исследовании измерялась жесткость хряща конечности во время гомеостаза и двух стадий регенерации конечностей: гистолиз тканей и конденсация хряща. Мы показываем, что АСМ является ценным инструментом для получения информации о динамической реструктуризации тканей и механических изменениях, происходящих во время регенерации.
Введение
Скелет, особенно хрящи и кости, обеспечивает основную механическую поддержку мягких тканей тела у позвоночных. Поэтому любые повреждения в скелетной системе, скорее всего, сильно поставят под угрозу функциональность и даже выживаемость. У людей переломы костей являются одними из наиболее распространенных травматических повреждений1, большинство из которых восстанавливаются в течение нескольких недель, но 5-10% из них имеют задержки в заживлении или никогда полностью не восстанавливаются 2,3. Более того, человек не способен восстановиться после обширной потери костей или хрящей 4,5. Некоторые саламандры, однако, могут регенерировать различные структуры тела, в том числе полные конечности, что делает их идеальной моделью для изучения регенерации скелета.
Аксолотль (Ambystoma mexicanum) — вид саламандры, у которого широко изучена регенерация конечностей. Этот процесс происходит в четырех основных последовательных, но перекрывающихся фазах: 1) заживление раны, 2) воспаление/гистолиз, 3) образование бластемы и 4) разрастание/дифференцировка бластемы (рассмотрено в 7,8). После ампутации кератиноциты, граничащие с местом повреждения, быстро мигрируют, закрывая рану и образуя эпителий раны (ЭП). Во время последующего воспаления и гистолиза патогенные микроорганизмы устраняются, мусор и поврежденные клетки очищаются, а внеклеточный матрикс (ВКМ) под поверхностью ампутации ремоделируется9. Гистолиз тканей необходим для регенерации конечностей10, где секреция протеолитических ферментов имеет решающее значение не только для общего ремоделирования ВКМ, но и для высвобождения клеток, вызывающих бластему, и для высвобождения биоактивных молекул, изолированныхв самой ВКМ. Фактически, исследования во многих регенеративных контекстах и модельных организмах показали, что уникальные свойства материала ВКМ во время гистолиза способны индуцировать процессы дедифференцировки или направлять миграцию клеток к месту повреждения (рассмотрено в11). Кроме того, резорбция кальцинированной ткани на поздних стадиях гистолиза показала себя ключевой для правильной интеграции новообразованных скелетных элементов конечностей12. После стадии гистолиза бластема формируется под раневым эпителием (ВЭ) в виде скопления недифференцированных, многолинейных предшественников, полученных в результате дедифференцированных зрелых клеток тканей или резидентных стволовых клеток. Клетки бластамы пролиферируют и дифференцируются во все типы отсутствующих клеток. Наконец, происходит морфогенез конечностей, при котором скелетная ткань регенерируется путем конденсации хондропрогениторов, полученных из клеток перискелета и трансдифференцированных дермальных фибробластов 13,14,15.
Несмотря на то, что многие биохимические сигналы, регулирующие изменения в идентичности клеток и составе ВКМ, были идентифицированы 10,13,14,16,17,18, механические свойства тканей на различных этапах регенерации конечностей, а также их влияние на регенерацию остаются в значительной степени неизученными. Многие исследования показали, что клетки воспринимают и интегрируют механические сигналы, которые регулируют их судьбу и поведение в нескольких контекстах (рассмотрено в19,20). Таким образом, дополнение наших клеточных и молекулярных знаний о регенерации конечностей механическими измерениями тканей значительно улучшит наше понимание этих процессов.
Были разработаны различные методы, которые позволяют определять механические характеристики и манипулировать биологическими образцами21. Среди этих методов золотым стандартом механобиологии стала атомная силовая микроскопия (АСМ), в которой вязкоупругие свойства биологических образцов исследуются с высоким пространственным разрешением путем индентирования с помощью сверхчувствительного датчика силы — кантилевераАСМ 22. Поскольку этот метод требует прямого контакта с образцом, как правило, образуются срезы ткани, что в некоторых случаях может быть сложной задачей. Таким образом, условия подготовки должны быть адаптированы и оптимизированы для каждого конкретного образца таким образом, чтобы он мог оставаться как можно ближе к физиологическим условиям и генерировались минимальныеартефакты23. В этом протоколе описывается, как измерить жесткость тканей в конечностях аксолотля с помощью АСМ, уделяя особое внимание хрящевым тканям в неповрежденных условиях, во время гизолиза и на стадиях конденсации хряща (рис. 1 и рис. 2). Этот метод может быть расширен и для измерения других типов тканей.
протокол
Аксолотли (Ambystoma mexicanum) были выращены в Аксолотле Центра регенеративной терапии Дрездена (CRTD) Дрезденского технологического университета (TUD). Полное описание условий содержания можно найти встатье 24. Вкратце, в комнатах поддерживалась температура 20-22 °C с циклом день/ночь 12/12 часов. Все манипуляции и хирургические процедуры проводились в соответствии с руководящими принципами местного комитета по этике и были одобрены Земельным управлением Саксонии, Германия.
В этом исследовании для всех экспериментов использовались белые (d/d) аксолотли, встречающийся в природе мутантный штамм, лишенный пигментации тела (мало или вообще без меланофоров и ксантофоров), с иридофорами только в радужной оболочке глаз. В этом исследовании использовались аксолотли размером 8-15 см от морды до хвоста (возраст 5-7 месяцев) без смещения по признаку пола.
1. Подготовка
- Приготовьте 10% (w/v) исходный раствор бензокаина, который будет использоваться для анестезии и эвтаназии аксолотлей (см. ниже). Для этого нужно смешать в объемном флаконе 50 г бензокаина со 100% этанолом до достижения предела в 500 мл.
- Приготовьте 0,03% (масс./об.) исходный раствор бензокаина.
- На 1 л смешайте 50 мл 10-кратного трис-буферного физиологического раствора (TBS) с 30 мл 10% бензокаина и 5 мл 4000% раствора Хольтфретера с 915 мл дистиллированной воды и перемешайте в течение ночи с помощью магнитной мешалки.
- На 1 л 10x раствора TBS смешайте 24,2 г основы Trizma и 90 г NaCl с 990 мл деионизированной воды. Хорошо перемешайте с помощью магнитной мешалки. Затем добавьте примерно 10 мл концентрированной HCl (12 М или 37%) и отрегулируйте pH до 8.
- На 1 л 4000% (w/v) раствора Хольтфретера смешать 158,4 г NaCl, 11,13 г MgSO4·7H2O, 5,36 г CaCl2·2H2O и 2,88 г KCl с деионизированной водой до 1 л.
- Приготовьте рабочее разведение бензокаина на 0,01% (масс./об.) в воде для хранения для анестезии, разбавив 0,03% (масс./об.) исходный раствор в соотношении 1:3.
- На 1 л раствора используйте 333 мл стокового раствора бензокаина плюс 666 мл воды из резервуара для хранения.
- Приготовьте стоковый раствор буторфанола тартрата в концентрации 5 мг/мл для обезболивания. Для этого смешайте 100 мг соли буторфанола (+)-тартрата с 20 мл сверхчистой воды. Хранить аликвоты при температуре 4 °C.
- В день ампутации приготовьте свежеприготовленный рабочий раствор буторфанола тартрата 0,5 мг/л для уменьшения боли животного после хирургических процедур, разбавив исходный раствор в соотношении 1:10 000 в воде резервуара.
- Для животных длиной менее 8 см смешайте 20 μл исходного раствора с 200 мл воды в резервуаре.
- Для более крупных животных смешайте 60 μл исходного раствора с 600 мл воды в резервуаре.
- Приготовьте стерильный амфибийный фосфатно-солевой буфер (APBS), 80% (v/v) раствор PBS, и поддерживайте его при комнатной температуре (RT), смешав 800 мл DPBS с 200 мл деионизированной воды.
- Приготовьте стоковый раствор инсулина в дозе 1 мг/мл. Для этого смешайте 250 мг порошка инсулина с 25 мл HCl 0,1 М и медленно перемешайте до растворения. Во время перемешивания добавьте 225 мл APBS до тех пор, пока раствор не станет прозрачным. Стерильно отфильтруйте и храните 4 мл аликвот при температуре -20 °C.
- Приготовьте стерильную питательную среду (все % (v/v): 62,5% L15 среды, 10% инактивированную при нагревании FBS, 1% пенициллин/стрептомицин, 1% инсулин, 1% L-глютамин) и хранить при температуре 4 °C до дня использования. В день эксперимента отбалансируйте до RT перед использованием.
- На 400 мл питательной среды используйте 250 мл среды L15, 40 мл инактивированного при нагревании FBS, 4 мл пенициллина/стрептомицина, 4 мл раствора инсулина (начиная с Шага 1.7), 4 мл L-глутамина и 98 мл деионизированной стерильной воды. Готовить в стерильных условиях и стерильном фильтре после смешивания всех компонентов. Подготовьте 15 мл аликвот.
- Приготовьте 2,5% и 3% (w/v) агарозу с низкой температурой плавления (lmp) в растворе APBS и нагрейте до 70 °C до полного растворения агарозы. Приготовьте аликвоты в пробирках объемом 1,5 мл и храните при температуре 4 °C до дня использования.
- Для 20 мл 2,5% (w/v) lmp-агарозы смешайте 0,5 г lmp-агарозы с 20 мл APBS в пробирке объемом 50 мл и нагрейте на водяной бане при 70 °C до полного расплавления агарозы. Решение должно стать понятным и прозрачным. Приготовьте аликвоты, пока они еще теплые.
- Для 20 мл 3% (w/v) lmp-агарозы смешайте 0,6 г lmp-агарозы с 20 мл APBS и действуйте, как указано выше.
- (Необязательно): Для 20 мл 1% (по объему) lmp-агарозы смешайте 0,2 г lmp-агарозы с 20 мл APBS и действуйте, как указано выше.
ПРИМЕЧАНИЕ: Время плавления зависит от концентрации lmp-агарозы и может составлять примерно 15-40 минут.
- Для ампутации и крепления тканей используйте светлопольный стереоскоп.
- Соберите пластиковые чашки Петри диаметром 100 мм, щипцы, скальпель и хирургические ножницы для ампутаций и сбора тканей.
- Подготовьте пластиковые чашки Петри диаметром 35 мм для измерения вдавливания.
- Подготовьте цилиндры длиной ~1 см и диаметром ~1 см. Для этого нагрейте картонорез под пламенем горелки Бунзена и отрежьте нагретым лезвием трубку объемом 15 мл.
- Вырежьте небольшие 1 см2 квадрата из парапленки и уберите на хранение.
- Приготовьте металлический или холодный блок при температуре -20 °C, оставив его в морозильной камере минимум на 1 час.
- Подготовьте пластиковые пастеровские пипетки.
- (Необязательно): Приготовьте фиксирующий раствор MEMFa (3-(N-морфолино)пропансульфоновая кислота [MOPS] 0,1 М pH 7,4, этиленгликоль-бис (2-аминоэтиловый эфир)-N,N,N',N'-тетрауксусная кислота [EGTA] 2 мМ, MgSO4·7H2O 1 мМ, 3,7% формальдегид). Для этого добавьте 10,465 г MOPS, 0,123 г MgSO4·7H2O, 2 мл 0,5 M EDTA pH 8,0 и добавьте воды до 45 мл. Добавьте 5 мл формальдегида 37% (по массе) к общему объему 50 мл.
2. Реактивы
- Реагенты, используемые для этой работы, см. в Таблице материалов , но могут быть использованы и другие коммерческие поставщики.
3. Ампутация аксолотля и регенерация конечностей
- Перед всеми экспериментальными процедурами обезболивайте животное в 0,01% (w/v) бензокаина, разведенного в воде резервуара для хранения (шаг 1.3) в течение 20 минут, убедившись, что животные глубоко обезболены и не реагируют на тактильные раздражители.
- Извлеките аксолотль из наркоза и положите его поверх 100-миллиметровой чашки Петри, содержащей бумажную салфетку, смоченную водой, содержащей анестезию. Ориентируйте конечность перпендикулярно оси тела и поместите пластину под стереоскоп для лучшей визуализации.
ПРИМЕЧАНИЕ: Здесь был использован стереоскоп с компактной лампой «гусиная шея». - Ампутируйте конечность острым стерильным скальпелем непосредственно дистальнее кальцинированной области зевгоподиальной области (лучевая/локтевая кость) (рисунок 1А).
ПРИМЕЧАНИЕ: Придерживаясь принципа благополучия животных 3R, рекомендуется использовать конечности, которые были первоначально удалены в результате ампутации, в качестве неповрежденного контроля. - Оставьте животное на миске и накройте его влажной папиросной бумагой, смоченной в воде, содержащей бензокаин, на 15 минут, чтобы обеспечить свертывание крови и закрытие раны.
- Верните животных в резервуар со свежей водой для хранения с анальгетиками (буторфанол тартрат, 0,5 мг/л, начиная с шага 1.5).
- Переместите животных в их первоначальный аквариум со свежей водой через 24 часа после послеоперационного обезболивающего лечения.
- Дайте животным восстановиться до желаемой стадии интереса.
Анализируемые конечности были собраны в день ампутации для интактной фазы и через 5 дней после ампутации (DPA) для фазы гитолиза у 5-месячных животных. Стадия конденсации хряща была измерена при 21 дПа у 7-месячных животных.
4. Монтаж и обработка тканей для измерений
- Нагрейте пробирки объемом 1,5 мл, содержащие 2,5% или 3% (по объему) lmp-агарозы (начиная с шага 1.9) на термоблоке при температуре 70 °C до полного расплавления агарозы. Замените трубки на другой термоблок при температуре 37 °C и дайте температуре выровняться перед использованием.
ПРИМЕЧАНИЕ: Здесь 2,5% lmp-агарозы использовали для измерения регенерирующих тканей и 3% для интактных тканей. - Накройте одну сторону цилиндров длиной 1 см (из шага 1.13) одним из кусков парапленки (шаг 1.14) так, чтобы они были полностью закрыты на дне.
- Уравновесьте 15 мл аликвот питательной среды к RT (с шага 1.8)
- Обезболите животных, погрузив их в воду, содержащую анестетик (0,01% бензокаина, разведенного в воде резервуара) не менее чем на 20 минут.
- Визуализируйте конечности под стереоскопом с помощью программного обеспечения, позволяющего проводить количественные измерения. Измерьте длину исследуемой структуры и рассчитайте, сколько ткани необходимо удалить с дистального конца конечности, пока не будет достигнут интересующий участок.
- Для регенерации конечностей соберите их, разрезав скальпелем и/или хирургическими ножницами на уровне локтя и рассекая лишнюю ткань из конечности. Оставьте ткань в растворе APBS на время подготовки к следующему этапу. Убедитесь, что разрез поперечный (90°) по отношению к оси нижнего рычага, чтобы создать ровную поверхность. Для неповрежденных конечностей удалите руку, разрезав запястную область.
- Усыпьте животных, подвергнув их воздействию смертельной дозы анестезии (0,1% бензокаина) в течение не менее 20 минут. Для этого добавьте необходимый объем 10% (w/v) раствора бензокаина до достижения 0,1% (w/v) концентрации.
- Если животные были обезболены в 100 мл 0,01% (w/v) раствора бензокаина, добавьте 900 мкл 10% (w/v) раствора бензокаина.
- Промойте конечности, погрузив их в раствор APBS.
- Убедитесь, что пипетки Пастера и термоблок (стабилизированный при 37 °C с агарозными аликвотами) находятся рядом с рабочей станцией. Достаньте холодный блок из морозильной камеры при температуре -20 °C и положите цилиндр на него концом, покрытым парапленкой, вниз.
- Возьмитесь за рассеченную конечность и аккуратно удалите лишнюю жидкость с помощью папиросной бумаги. Положите конечность на чистую тарелку, добавьте сверху расплавленную lmp-агарозу и кратковременно переместите конечность в агарозе, чтобы вытеснить остатки APBS с поверхности кожи.
- Работая быстро, поместите конечность внутрь цилиндра, убедившись, что она ориентирована вертикально, а область интереса — вверх.
- Аккуратно удерживая конечность щипцами, добавьте lmp-агарозу внутрь цилиндра до полного покрытия ткани. Аккуратно снимите щипцы до того, как агароза застынет.
- Снимите цилиндр с холодного блока и дайте агарозе полностью застыть при RT в течение примерно 30 с.
- Тканесодержащий агарозный блок немедленно отнесите в вибратомную комнату вместе со стерильной питательной средой аликвотами и APBS во время лучевой терапии.
- Снимите парапленку со дна цилиндра и прикрепите агарозу, содержащую ткань, к вибратомной стадии с помощью цианоакрилатного клея. Убедитесь, что и агароза, и образец приклеены к предметному столику.
- Погрузите столик в APBS для секционирования.
ПРИМЕЧАНИЕ: Неповрежденные ткани включают более жесткую кость/хрящ, в то время как регенерирующие ткани более мягкие. Поэтому параметры вибратома должны быть соответствующим образом отрегулированы. В данном исследовании использовались следующие параметры: Интактные ткани (амплитуда 1,2 мм и скорость 0,1 мм/с) и регенерирующие ткани (амплитуда 0,9 мм и скорость 0,4 мм/с). - Начинайте секционирование агарозы короткими шагами (например, с шагом 100 мкм) до тех пор, пока не будет достигнут кончик ткани. Затем разрежьте тканевый блок до тех пор, пока дистальная часть ткани (рассчитанная на шаге 4.5) не будет удалена. Таким образом, поперечное сечение области интереса будет легко доступно.
ПРИМЕЧАНИЕ: Удаленный участок ткани будет содержать непосредственно прилегающую поверхность к поверхности, прощупываемой с помощью АСМ, и может служить эталоном для структуры ткани. Поэтому его можно использовать для прямого дополнительного анализа или фиксировать для последующего окрашивания (см. раздел 6). - Аккуратно удалите тканесодержащий блок со стадии вибратома лезвием бритвы и удалите все следы клея. Немедленно приклейте блок на пластиковую чашку Петри диаметром 35 мм с помощью клея для хирургической ткани и добавьте примерно 2 мл питательной среды при температуре RT, чтобы убедиться, что ткань полностью покрыта.
ПРИМЕЧАНИЕ: Обнаженная тканевая поверхность в агарозном блоке является поверхностью, подлежащей исследованию.
5. Измерения с помощью АСМ
- Не менее чем за 1 день до измерений подготовьте консоль к измерениям.
ПРИМЕЧАНИЕ: Для этой работы силиконовые консоли без наконечника были функционализированы полистирольными шариками (диаметр 20 мкм), а соединение шарик-кантилевер было оставлено для укрепления по крайней мере на 1 день перед использованием для измерений вдавливания.- Прикрепите бусины к консолям с помощью эпоксидного клея со временем обработки 5 мин.
- Быстро опустите консоль с минимальным контактом на покрытое клеем предметное стекло так, чтобы на его конце образовалась небольшая капелька клея, и сразу после этого приведите ее в контакт с подходящей бусиной.
- Удерживайте контакт консоли с бортом в течение ~10 минут, прежде чем поднять консоль со связанным бортом от поверхности.
- Откалибруйте консоль перед измерениями.
Модифицированный кантилевер калибровался перед каждой серией экспериментов методом теплового шума с использованием встроенных процедур программного обеспечения АСМ. - Вставьте чашку Петри с тканевым блоком (из шага 4.18) и питательную среду в держатель чашки Петри АСМ и получите обзорное изображение в светлопольной микроскопии (рис. 1B).
ПРИМЕЧАНИЕ: Для испытаний на вдавливание используется установка, оснащенная подставным столиком на вершине вертикального светового микроскопа. Установите головку АСМ и расположите кантилевер над тканью и приблизьте кантилевер к поверхности. - Выберите конкретную область интереса и запишите массив кривых сила-расстояние (рис. 2A).
ПРИМЕЧАНИЕ: Уставки относительных сил 2-25 нН использовались для достижения сопоставимой глубины вдавливания ~1-4 мкм для тканей различной жесткости, со скоростью приближения и втягивания 7,5 мкм/с, длиной z 50 мкм, размером сетки 70 мкм x 70 мкм с 3 x 3 точками. - Для каждой зондируемой области получите изображение светлопольной микроскопии, чтобы связать полученные значения с каждой конкретной областью в области конечности.
- Для всех образцов исследуйте не менее 3 различных областей для каждого типа ткани.
Примечание: Во всех случаях в этом исследовании измеряли 4 области в центре хряща и 3 области на периферии хрящевой области и держали ткань под микроскопом не более 1 часа. - После завершения измерений вдавливания выбросьте или зафиксируйте ткань для дальнейшего анализа.
Примечание: Образцы фиксировали после завершения измерений путем помещения их в 2 мл пробирки, содержащие раствор MEMFa, и фиксировали на ночь при 4 °C. Использовали MEMFa (шаг 1.17), но также можно использовать 4% раствор формальдегида (w/v) в PBS.
6. (По желанию) Обработка прилегающих участков тканей
- Если соседние срезы тканей используются для последующего окрашивания, поместите их сразу после срезов в небольшую пробирку объемом 2 мл, содержащую фиксатор, и зафиксируйте на ночь при температуре 4 °C.
- Для выявления архитектуры тканей через мечение актина, цитоскелета и ядер необходимо 3 раза промыть PBS в течение 5 мин для удаления фиксатора и окрашивать раствором, содержащим конъюгированный фаллоидин Alexa Fluor 488 (1:250) и Hoechst 33258 (1:10000) в PBS в течение 1 ч в РТ на качающейся платформе.
- Затем иммобилизуйте окрашенные образцы на верхней части посуды со стеклянным дном, используя 1% (масс./об.) lmp-агарозы в APBS, стабилизированной при 37 °C (начиная с шага 1.9). Убедитесь, что интересующая поверхность обращена к стеклу. Как только агароза затвердеет, накройте образцы PBS, чтобы предотвратить обезвоживание.
ПРИМЕЧАНИЕ: Образцы интакта и гитолза визуализируются с помощью инвертированного конфокального микроскопа (10-кратное увеличение и оптические срезы 8 мкм). Изображения на рисунке 1C представляют собой максимальные проекции из 8 оптических сечений.
- Если прилегающий участок ткани используется для немедленного последующего анализа, требующего свежей ткани (например, экстракция РНК, инкубация с живыми красителями и т. д.), убедитесь, что вы работаете быстро и используете среду для культивирования клеток (начиная с шага 1.8), чтобы обеспечить максимально возможную целостность ткани.
7. Анализ и отображение данных
- Чтобы рассчитать кажущийся модуль Юнга, проанализируйте кривые сила-расстояние, используя модель Герца/Снеддона (уравнение 1) для сферического индентора с помощью программного обеспечения для обработки данных JPK/Bruker, предполагая, что коэффициент Пуассона равен 0,5.
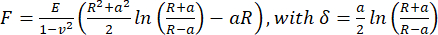 (Уравнение 1)
(Уравнение 1)
где R: радиус индентора, E: модуль упругости, ν: коэффициент Пуассона, a: радиус круговой зоны контакта между индентором и образцом, δ: глубина вдавливания. - Для вязкоупругого анализа проанализируем подходные участки кривых сила-вдавливание в PyJibe 0.15.0 с расширением "Модель Герца, скорректированная на вязкоупругость с использованием уравнения Кельвина-Фойгта-Максвелла (KVM)" (автор Пауль Мюллер, https://github.com/AFM-analysis/PyJibe)25. Функция аппроксимации основана на модели, описанной Абухаттумом и др.26, интегрирующей элементы модели Кельвина-Фойгта-Максвелла.
- Предварительно обработайте кривые вдавливания силы для оценки точки контакта с помощью кусочно-правильной аппроксимации с линией (базовой линией) и полиномиальной функцией аппроксимации для подходящей части.
- Подгонка кривых силы-вдавливания к модели "Модель Герца, скорректированная на вязкоупругость с использованием модели Кельвина-Фойгта-Максвелла (KVM)". Из подгонки получите неослабленный модуль Юнга, кажущийся модуль Юнга и кажущуюся вязкость. Модель также дает Максвеллу время для расслабления и вдавливания.
Примечание: В нескольких проанализированных кривых вдавливания силы (в частности, в неповрежденной ткани) время релаксации Максвелла было значительно больше или меньше времени вдавливания, что указывает на скорее упругое поведение или механическое поведение Кельвина-Фойгта, соответственно.
- Экспортируйте все измерения в электронную таблицу и рассчитайте медианные видимые модули Юнга для каждого типа ткани и образца.
- Стройте графики и статистически анализируйте данные с помощью соответствующего программного обеспечения.
ПРИМЕЧАНИЕ: Здесь используется GraphPad Prism, и при описании результатов исследование ссылается на среднее значение ± SD медианы видимых модулей Юнга на образец (показано на рисунке 2D-F). - Отображайте оптические срезы из конфокальных изображений, проецируя их с помощью функции максимальной проекции Фиджи. Отрегулируйте яркость и контрастность каждого отдельного канала для оптимальной визуализации флуоресцентных окрашиваний.
- Сгенерируйте панель рисунков с помощью соответствующего программного обеспечения.
ПРИМЕЧАНИЕ: Для создания панелей используется Affinity Designer, а модель на рисунке 1A рисуется с помощью Affinity Designer.
Результаты
Используя описанный выше протокол, мы измерили кажущийся модуль Юнга для тканей хрящевых конечностей аксолотля в гомеостатических («интактных») условиях, во время раннего гистолиза хряща и более поздних стадий конденсации хряща (рис. 1A). Мы также иссл?...
Обсуждение
Здесь мы демонстрируем методику измерения жесткости хряща в конечностях аксолотля с помощью АСМ. Тем не менее, этот метод может быть расширен и для зондирования других типов тканей. Ключевым этапом для успешных измерений АСМ является подготовка образцов, которая ока?...
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов
Благодарности
Мы благодарим всех сотрудников лаборатории Сандовал-Гусман за постоянную поддержку и товарищество на протяжении всей этой работы. Мы также благодарны Ане Вагнер, Беате Груль и Джудит Конанц за их преданность уходу за аксолотлями. Мы также благодарим Пауля Мюллера за предоставление кодов для анализа данных АСМ. Эта работа была поддержана Центром световой микроскопии технологической платформы CMCB в Техническом университете Дрездена. АТ является научным сотрудником Центра ранней карьеры Милдред Шеель в Дрездене P2, финансируемого Немецкой организацией помощи больным раком (Deutsche Krebshilfe). RA финансируется за счет временной должности PI (Eigene Stelle) от Deutsche Forschungsgemeinschaft (DFG, Немецкое научно-исследовательское общество) – AI 214/1-1.
Материалы
| Name | Company | Catalog Number | Comments |
| Affinity Designer | Affinity | version 1.10.4 | For figure assembling |
| Agarose Low Melt | Roth | 6351.1 | For sample preparation |
| Alexa Fluor 488 Phalloidin | Invitrogen | A12379 | To stain tissue |
| Axiozoom | Zeiss | To image samplea under the AFM | |
| Benzocaine | Sigma-Aldrich | E1501 | To anesthetize the animals |
| Butorphanol (+)-tartrate salt | Sigma-Aldrich | B9156 | As analgesic |
| Cantilever | NanoWorld | Arrow TL1 | For AFM indentation measurements |
| Cellhesion 200 setup equipped with a motorstage | JPK/Bruker | For AFM indentation measurements | |
| CellSense Entry | For imaging in Stereoscope Olympus UC90 | ||
| Dulbecco’s Phosphate Buffered Saline (DPBS, 1x) | Gibco | 14190-144 | To clean samples and section under vibratome |
| FIJI (ImageJ2) | https://imagej.net/software/fiji | version 2.9.0/1.53t | For image processing |
| GraphPad Prism | GraphPad Software | (version 8.4.3) | To graph and statistically analyze the data |
| Heat-inactivated FBS | Gibco | 10270-106 | For cell culture medium |
| Histoacryl glue (2-Butyl-Cyanoacrylate) | Braun | To glue sample to petri dishes | |
| Hoechst 33258 | Abcam | ab228550 | To stain tissue |
| Insulin | Sigma-Aldrich | I5500 | For cell culture medium |
| Inverted confocal microscope | Zeiss | 780 LSM | To image tissue sections |
| Inverted confocal microscope | Zeiss | 980 LSM | To image tissue sections |
| JPK/Bruker data processing software | JPK/Bruker | SPM 6.4 | To analyze force-distance curves |
| L15 medium (Leibovitz) | Sigma | L1518 | For cell culture medium |
| L-Glutamine | Gibco | 25030-024 | For cell culture medium |
| Penicillin/Streptomycin | Gibco | 15140-122 | For cell culture medium |
| polystyrene beads ( 20 µm diameter); ) | microParticles | For AFM indentation measurements | |
| Pyjibe | written by Paul Müller https://github.com/AFM-analysis/PyJibe | 0.15.0 | For viscoelastic analysis |
| Stereoscope Olympus SX10 | Olympus | SX10 | For limb amputations and tissue mounting |
| Stereoscope Olympus UC90 | Olympus | UC90 | For imaging |
| Vibratome Leica | Leica | VT 1200S | For tissue sectioning |
Ссылки
- Mills, L. A., Aitken, S. A., Simpson, A. H. R. W. The risk of non-union per fracture: current myths and revised figures from a population of over 4 million adults. Acta Orthop. 88 (4), 434-439 (2017).
- Calori, G. M., et al. Non-unions. Clin Cases Miner Bone Metab. 14 (2), 186-188 (2017).
- Nandra, R., Grover, L., Porter, K. Fracture non-union epidemiology and treatment. Trauma. 18 (1), 3-11 (2016).
- Nauth, A., Schemitsch, E., Norris, B., Nollin, Z., Watson, J. T. Critical-size bone defects: Is there a consensus for diagnosis and treatment. J Orthop Trauma. 32 (3 Suppl), S7-S11 (2018).
- Schemitsch, E. H. Size matters: Defining critical in bone defect size. J Orthop Trauma. 31 (10), S20-S22 (2017).
- Joven, A., Elewa, A., Simon, A. Model systems for regeneration: Salamanders. Development (Cambridge). 146 (14), 0 (2019).
- Aires, R., Keeley, S. D., Sandoval-Guzmán, T. Basics of Self-Regeneration. Cell Engineering and Regeneration. , (2020).
- Stocum, D. L. Mechanisms of urodele limb regeneration. Regeneration. 4 (4), 159-200 (2017).
- Bassat, E., Tanaka, E. M. The cellular and signaling dynamics of salamander limb regeneration. Curr Opin Cell Biol. 73, 117-123 (2021).
- Vinarsky, V., Atkinson, D. L., Stevenson, T. J., Keating, M. T., Odelberg, S. J. Normal newt limb regeneration requires matrix metalloproteinase function. Dev Biol. 279 (1), 86-98 (2005).
- Godwin, J., Kuraitis, D., Rosenthal, N. Extracellular matrix considerations for scar-free repair and regeneration: Insights from regenerative diversity among vertebrates. International J Biochem Cell Biol. 56, 47-55 (2014).
- Riquelme-Guzmán, C., et al. Osteoclast-mediated resorption primes the skeleton for successful integration during axolotl limb regeneration. ELife. 11, e79966 (2022).
- Gerber, T., et al. Single-cell analysis uncovers convergence of cell identities during axolotl limb regeneration. Science. 362 (6413), aaq0681 (2018).
- Kragl, M., et al. Cells keep a memory of their tissue origin during axolotl limb regeneration. Nature. 460 (7251), 60-65 (2009).
- Currie, J. D., et al. Live Imaging of Axolotl Digit Regeneration Reveals Spatiotemporal Choreography of Diverse Connective Tissue Progenitor Pools. Dev Cell. 39 (4), 411-423 (2016).
- Qin, T., et al. Single-cell RNA-seq reveals novel mitochondria-related musculoskeletal cell populations during adult axolotl limb regeneration process. Cell Death Differ. 28 (3), 1110-1125 (2021).
- Sandoval-Guzman, T., et al. Fundamental differences in dedifferentiation and stem cell recruitment during skeletal muscle regeneration in two salamander species. Cell Stem Cell. 14, 174-187 (2014).
- Currie, J. D., et al. The Prrx1limb enhancer marks an adult subpopulation of injury-responsive dermal fibroblasts. Biol Open. 8, bio043711 (2019).
- Wagh, K., Ishikawa, M., Garcia, D. A., Stavreva, D. A., Upadhyaya, A., Hager, G. L. Mechanical regulation of transcription: Recent advances. Trends Cell Biol. 31 (6), 457-472 (2021).
- d'Angelo, M., et al. The role of stiffness in cell reprogramming: A potential role for biomaterials in inducing tissue regeneration. Cells. 8 (9), 1036 (2019).
- Akhtar, R., Sherratt, M. J., Cruickshank, J. K., Derby, B. Characterizing the elastic properties of tissues. Mater Today (Kidlington). 14 (3), 96-105 (2011).
- Krieg, M., et al. Atomic force microscopy-based mechanobiology. Nat Rev Phys. 1 (1), 41-57 (2019).
- El Kirat, K., Burton, I., Dupres, V., Dufrene, Y. F. Sample preparation procedures for biological atomic force microscopy. J Microsc. 218 (3), 199-207 (2005).
- Riquelme-Guzmán, C., et al. Postembryonic development and aging of the appendicular skeleton in Ambystoma mexicanum. Dev Dyn. 251 (6), 1015-1034 (2021).
- López-Alonso, J., Eroles, M., Janel, S., et al. PyFMLab: Open-source software for atomic force microscopy microrheology data analysis [version 2; peer review: 2 approved]. Open Res Europe 2024. 3 (187), (2024).
- Abuhattum, S., Mokbel, D., Müller, P., Soteriou, D., Guck, J., Aland, S. An explicit model to extract viscoelastic properties of cells from AFM force-indentation curves. iScience. 25 (4), 104016 (2022).
- Glorieux, L., et al. In-depth analysis of the pancreatic extracellular matrix during development for next-generation tissue engineering. Int J Mol Sci. 24 (12), 10268 (2023).
- Hiratsuka, S., et al. Power-law stress and creep relaxations of single cells measured by colloidal probe atomic force microscopy. Jpn J Appl Phys. 48 (8 PART 3), 08JB17 (2009).
- Johnson, K. L., Kendall, K., Roberts, A. D. Surface energy and the contact of elastic solids. Proc R Soc Lond A. 324, 301-313 (1971).
- Kondiboyina, V., Duerr, T. J., Monaghan, J. R., Shefelbine, S. J. Material properties in regenerating axolotl limbs using inverse finite element analysis. J Mech Behav Biomed Mater. 150, 106341 (2024).
- Calve, S., Simon, H. Biochemical and mechanical environment cooperatively regulate skeletal muscle regeneration. FASEB J. 26 (6), 2538-2545 (2012).
- Calve, S., Simon, H. G. Extracellular control of limb regeneration. IUTAM Symposium on Cellular, Molecular and Tissue Mechanics. IUTAM Bookseries. 16, 257-266 (2010).
- Kaufmann, R. A., Kozin, S. H., Barnes, A., Kalluri, P. Changes in strain distribution along the radius and ulna with loading and interosseous membrane section. J Hand Surg Am. 27 (1), 93-97 (2002).
- Martin, A. R., et al. Measurement of distal forearm bone mineral density: Can different forearm segments be used interchangeably. J Clin Densitom. 2 (4), 381-387 (1999).
- Riquelme-Guzmán, C., et al. In vivo assessment of mechanical properties during axolotl development and regeneration using confocal Brillouin microscopy. Open Biol. 12 (6), 220078 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены