Method Article
Мониторинг богатого лейцином повтора, содержащего 8-канальную активность (LRRC8/VRAC), с использованием резонансного переноса энергии Фёрстера с сенсибилизированным излучением (SE-FRET)
В этой статье
Резюме
Электрофизиология является золотым стандартом для исследования активности ионных каналов. Тем не менее, существует масса альтернативных подходов, в том числе и оптических методов. В данной статье мы описываем метод мониторинга активности богатого лейцином повтора, содержащего 8-канальные (LRRC8)-образованные анионные каналы, с использованием метода, основанного на межсубъединичном резонансном переносе энергии Фёрстера (FRET).
Аннотация
Члены семейства белков LRRC8 образуют гетеромерные ионные и осмолитные каналы, играющие роль в многочисленных физиологических процессах. Как аноновые каналы с регулируемым объемом (VRACs)/чувствительные к объему внешние выпрямляющие каналы (VSORs), они активируются при набухании осмотических клеток и опосредуют экструзию хлоридов и органических осмолитов, что приводит к оттоку воды и, следовательно, к усадке клеток. Помимо своей роли в регуляции осмотического объема, VRAC участвуют в клеточных процессах, таких как дифференцировка, миграция и апоптоз. Благодаря своему влиянию на мембранный потенциал и транспорту различных сигнальных молекул, богатые лейцином повторы, содержащие 8 (LRRC8) каналов, играют роль в коммуникации нейронов и глии, секреции инсулина и иммунном ответе. Механизм активации так и остался неуловимым. Каналы LRRC8, как и другие ионные каналы, обычно изучаются с помощью электрофизиологических методов. В данной статье мы описываем метод детектирования активации канала LRRC8 путем измерения внутрикомплексного сенсибилизированного эмиссионного резонансного переноса энергии Фёрстера (SE-FRET) между флуоресцентными белками, слитыми с С-концевыми лейцин-богатыми повторными доменами субъединиц LRRC8. Этот метод дает возможность изучать активацию каналов in situ без обмена цитозольной средой и во время таких процессов, как дифференцировка клеток и апоптоз.
Введение
Ионные каналы, состоящие из гетеромеров богатых лейцином повторов, содержащих белки семейства 8 (LRRC8), обнаружены во всех клетках позвоночных, участвуя в широком спектре физиологических функций 1,2. Эти каналы LRRC8, впервые идентифицированные как анионные каналы с регулируемым объемом (VRAC) или чувствительные к объему внешние выпрямляющие каналы (VSOR), играют решающую роль в снижении регуляторного объема в клетке 3,4. Они способствуют выведению ионов хлора и органических осмолитов, за которым следует отток воды в ответ на осмотическое набухание. Помимо их роли в реакции на осмотический стресс, их роль в регуляции клеточного объема связана с пролиферацией и миграцией клеток, апоптозом, спермиогенезом и целостностью эпителия 5,6,7. Было показано, что изменение мембранного потенциала при активации LRRC8/VRAC способствует дифференцировке миотрубки8 и секреции инсулина β-клетками поджелудочной железы 9,10,11. Кроме того, каналы LRRC8 проводят различные органические осмолиты, такие как пуринергические сигнальные молекулы АТФ и цГАМФ или возбуждающая аминокислота глутамат, помещая эти каналы в межклеточную коммуникацию в иммунной системе или взаимодействие глиа-нейронов 12,13,14,15,16,17,18,19,20,21,22. Даже ксенобиотики, такие как краситель флуоресцеин, антибиотик бластицидин S или противоопухолевый препарат цисплатин, выводятся по каналам LRRC8 23,24,25.
Существуют многочисленные сообщения о том, что передача сигнала приводит к активации LRRC8/VRAC 26,27,28. Тем не менее, механизм остается неясным, и в литературе представлен широкий спектр потенциальных механизмов, которые могут зависеть от конкретного физиологического процесса. К ним относятся изменения цитозольной ионной силы, взаимодействия с цитоскелетом, состава мембраны, G-белков, окислительно-восстановительного состояния и каскадов фосфорилирования 2,27,29,30,31.
Каналы LRRC8/VRAC содержат LRRC8A в качестве основной субъединицы 3,4, которая должна гетеромеризоваться по меньшей мере с одним из своих паралогов LRRC8B-E для формирования физиологически функциональных каналов 4,14,32. Состав субъединицы определяет биофизические свойства канала, такие как ректификация и деполяризационно-зависимая инактивация 4,29,32,33,34, специфичность субстрата 15,17,20,21,24,35 и некоторые пути активации36,37. Структуры криоэлектронной микроскопии (крио-ЭМ) показывают, что гомомеры LRRC8A, а также гетеромеры собираются как гексамеры38,39,40, в то время как химеры LRRC8A/LRRC8C, образующие функциональные каналы, являются гептамерами41. N-концевая часть всех белков LRRC8 содержит четыре трансмембранные спирали, а С-концевая часть содержит домен с лейцин-богатыми повторами (LRRD). Имеющиеся сложные структуры LRRC8 свидетельствуют о том, что LRRDs, которые простираются в цитозоль 3,4,23, могут подвергаться конформационным перестройкам во время стробирования каналов 34,42,43. Это предположение подтверждается открытием, что С-концевое слияние флуоресцентных белков приводит к активности базального канала14 и что связывание нанотел с доменами может модулировать активность канала44. Кроме того, конформационные изменения С-концов были продемонстрированы при внутрикомплексном резонансном переносе энергии Фёрстера (FRET)45.
Наиболее распространенным методом изучения активности ионных каналов являются электрофизиологические измерения46, которые широко применялись при исследовании VRAC до их молекулярной идентификации47. Тем не менее, существуют различные дополнительные способы косвенного мониторинга активности VRAC, включая измерение его проводимых субстратов — галогенидных ионов или органических осмолитов — или его влиянияна объем клетки. На самом деле, идентификация белков LRRC8 в качестве VRAC основывалась на анализе, основанном на гашении галогенид-чувствительного флуоресцентного белка49 йодидом, поступающим в клетку через активированные VRACs 3,4. Другой метод мониторинга активности каналов LRRC8/VRAC использует движение цитозольных доменов, которое можно наблюдать, как и в других ионных каналах 50,51,52,53, по изменениям в FRET45. С этой целью флуоресцентные белки, которые служат парами FRET, такие как голубой-флуоресцентный белок (CFP)/mCerulean3 в качестве донора и желтый-флуоресцентный белок (YFP)/mVenus в качестве акцептора, были слиты с C-концами белков LRRC8 (рис. 1). Внутрикомплексный FRET между субъединицами LRRC8 был показан в экспериментах по акцепторному фотообесцвечиванию45. Избегая метода деструктивного фотообесцвечивания, изменения FRET с течением времени контролировали с помощью сенсибилизированной эмиссии FRET (SE-FRET), где в основном измеряли сенсибилизированную эмиссию акцептора при возбуждении донора из-за перекрытия спектра излучения донора со спектром возбуждения акцептора. Применение внеклеточной гипотонудии, стимула для активации LRRC8/VRAC, приводило к обратимому снижению интенсивности SE-FRET45. Важно отметить, что одновременные измерения патч-хомута цельных клеток и мониторинг FRET во время гипотонического лечения показали, что это снижение FRET действительно отражает активацию LRRC8/VRAC45. Этот метод, который позволяет избежать разрушения плазматической мембраны или изменения внутриклеточной среды с помощью раствора пипетки, предлагает альтернативу для мониторинга активности LRRC8/VRAC. Это особенно полезно в физиологических условиях, где решающее значение имеет поддержание нативного цитозола, необходимо субклеточное разрешение или требуется длительное наблюдение за активностью каналов.
Здесь мы представляем протокол исследования LRRC8/VRAC с таким считыванием на основе FRET. В протоколе описывается, как обращаться с клетками и трансфицировать их, получать образцы и контрольные изображения, анализировать данные и рассчитывать значения FRET СЕНСИБИЛИЗИРОВАННОЙ ЭМИССИИ (SE-FRET).
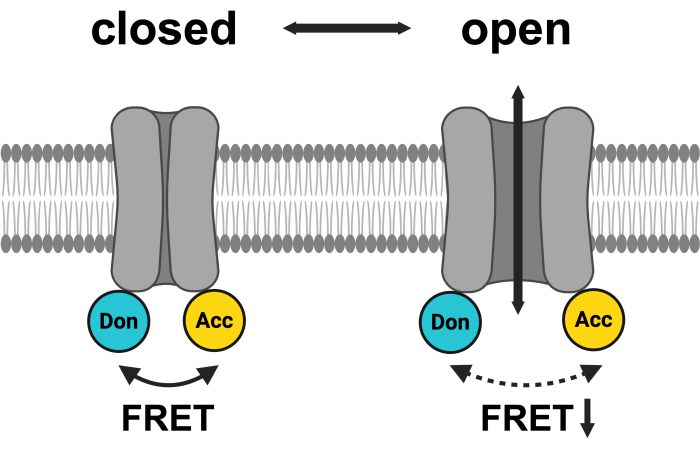
Рисунок 1: Схема системы пар ладов LRRC8 .mCerulean3 обозначен голубым цветом, а mVenus — желтым. После открытия VRAC расстояние (и/или пространственная ориентация) между флуорофорами изменяется, что приводит к уменьшению передачи энергии между донором (Don) и акцептором (Acc) и, в свою очередь, к снижению наблюдаемого FRET. Создано с помощью BioRender.com. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
1. Приготовление буфера и реагентов
- Приготовьте срединные, изотонические, гипотонические и гипертонические буферы и измерьте осмолярность буферов с помощью осмометра, чтобы убедиться, что осмолярность (Osm) находится в ожидаемом диапазоне с допустимым отклонением.
- Среды для клеточных культур: Приготовьте модифицированную среду Dulbecco Eagle Medium (DMEM) с добавлением 10% фетальной сыворотки крупного рогатого скота (FBS) и 1% пенициллина/стрептомицина
- Изотонический буфер для визуализации (~340 мОсм): Приготовьте изотонический буфер для визуализации, смешав 150 мМ NaCl, 6 мМ KCl, 1 мМ MgCl2, 1,5 мМ CaCl2, 10 мМ D(+)-глюкозу и 10 мМ 4-(2-гидроксиэтил)-1-пиперазин этан сульфоновую кислоту (HEPES).
- Гипотонический буфер для визуализации (~250 мОсм): Приготовьте гипотонический буфер для визуализации, смешав 105 мМ NaCl, 6 мМ KCl, 1 мМ MgCl2, 1,5 мМ CaCl2, 10 мМ D(+)-глюкозу и 10 мМ HEPES.
- Буфер для гипертонической визуализации (~500 мОсм): Приготовьте буфер для гипертонической визуализации путем смешивания 160 мМ D(-)-маннита, 150 мМ NaCl, 6 мМ KCl, 1 мМ MgCl2, 1,5 мМ CaCl2, 10 мМ D(+)-глюкозы и 10 мМ HEPES.
ПРИМЕЧАНИЕ: Буферы могут быть дополнены конкретными препаратами в зависимости от того, что будет исследовано.
2. Рост адгезивных клеток на стеклянных донных посудах
- Подготовьте по меньшей мере одну чашку для трансфекции только с белком, представляющим интерес (POI), слитым либо с донором, либо с акцепторным флуорофором, и по крайней мере одну чашку для трансфекции с парой донор и акцептор (Таблица 1 и Рисунок 2). Используйте посуду со стеклянным дном для проведения флуоресцентной микроскопии. В зависимости от типа ячейки предварительно обработайте поверхность специальной очисткой или покройте ее полилизином.
ПРИМЕЧАНИЕ: В данном случае донор FRET mCerulean3 (mCer)54 и акцептор FRET mVenus (mVen)55 используются в качестве пары FRET, но также применимы и другие комбинации флуорофоров. Образцы, экспрессирующие POI, слитые с донором или акцептором, используются только для определения поправочных коэффициентов β и γ (Таблица 1), необходимых для коррекции просачивания донора в канале акцептора и перекрестного возбуждения акцептора по длине волны донорного возбуждения (Рисунок 2Ac, Bf). - За сутки до трансфекции высейте 1 х 105 клеток HeLa в 2 мл клеточных культуральных сред на 35-мм чашках со стеклянным дном, пригодным для флуоресцентной микроскопии. Культивируйте клетки в течение ночи при температуре 37 °C и 5% атмосферыCO2 в инкубаторе для клеточных культур.
Примечание: Объемы реагентов могут быть адаптированы к площади поверхности других чашек/колб для клеточных культур с другим размером. Количество клеток может быть адаптировано к плотности, подходящей для различных клеточных линий и экспериментальных подходов.- Аспирируйте надосадочную жидкость клеточной культуры из монослоя адгезивных клеток, культивируемых на колбах для клеточных культур Т75, с помощью вакуумного насоса.
- Промойте клетки, добавив 10 мл фосфатно-солевого буфера Дульбекко (DPBS) в колбу для клеточных культур и затем отасунув раствор с помощью вакуумного насоса.
- Полностью налейте на клетки 1 мл 0,05% трипсина-ЭДТА и инкубируйте клетки в течение 2 минут при температуре 37 °C и 5%CO2 в атмосфере для клеточных культур.
- Добавьте 9 мл среды для клеточных культур и суспензируйте клетки с помощью пипетирования.
- Перенесите клеточную суспензию в пробирку объемом 15 мл и центрифугируйте при 700 x g в течение 3 минут при комнатной температуре (RT).
- Аспирируйте надосадочную жидкость с помощью вакуумного насоса и ресуспендируйте клеточную гранулу в 10 мл среды для клеточных культур.
- Смешайте в пробирке равные объемы клеточной суспензии и 0,4% трипанового синего и добавьте 10 μл на предметное стекло. Поместите предметное стекло в автоматический счетчик ячеек и начните подсчет с помощью соответствующей программы для подсчета ячеек.
- Чтобы рассчитать объем клеточной суспензии, необходимый для каждой чашки, разделите количество клеток, необходимое для каждой чашки (1 x 105), на количество клеток на миллилитр, полученное из счетчика клеток.
- Приготовьте клеточную суспензию в подходящей пробирке, содержащую количество клеток, необходимое на одну чашку, в объеме, необходимом для каждой чашки (2 мл), плюс количество для одной дополнительной чашки.
- Смешайте клеточную суспензию не менее 20 раз, перевернув пробирку и пипетку по 2 мл клеточной суспензии в каждой чашке.
- Чтобы обеспечить более равномерное распределение клеток, оставьте чашки на 30 минут в режиме RT, прежде чем помещать их в инкубатор для клеточных культур.
3. Клеточная трансфекция
ПРИМЕЧАНИЕ: В данном случае FuGENE использовался в качестве реагента для трансфекции. Также применимы другие реагенты и методы трансфекции. Оптимальные соотношения плазмидной ДНК (пДНК) и трансфекционных реагентов, а также время для оптимальной экспрессии для каждого POI и модели клетки должны быть оценены эмпирически. Здесь использовали 2 мкг общей пДНК на 35 мм чашку. Донорные и акцепторные конструкции FRET использовались в соотношении 1:1, а соотношение пДНК и трансфекционного реагента составило 1:4 (табл. 1).
- Перед трансфекцией замените надосадочную жидкость клеточной культуры свежими 2 мл предварительно подогретой среды.
- Разведите пДНК в среде Opti-Minimal Essential Medium (MEM) с конечным объемом 100 мкл (=раствор пДНК).
- Развести реагент для трансфекции в Opti-MEM с конечным объемом 100 мкл (=раствор реагента).
ПРИМЕЧАНИЕ: Для более равномерной трансфекции приготовьте мастер-смесь для пДНК и раствора реагента. - Хорошо перемешайте пДНК и раствор реагента.
- Добавьте раствор пДНК в раствор реагента (=раствор для трансфекции).
- Хорошо перемешайте раствор для трансфекции.
- Инкубируйте раствор для трансфекции в течение 15 минут при РТ.
- Добавьте раствор для переделки по каплям спиральными движениями в блюдо.
- Перемешайте, перемещая блюдо 5 раз по горизонтали и вертикали по поверхности скамейки.
- Культивируйте клетки в течение ночи при температуре 37 °C и 5% атмосферыCO2 в инкубаторе для клеточных культур.
| Состояние | Конструкт(ы) | Образец | Используется для |
| 1 | LRRC8A-mCerulean | Только конструкция-донор | определить поправочный коэффициент β |
| 2 | LRRC8E-mVenus | Только конструкция акцептора | определить поправочный коэффициент γ |
| 3 | LRRC8A-mCerulean и LRRC8E-mVenus | Пара ладов | Количественная оценка SE-FRET |
Таблица 1: Пример условий, необходимых для типичного эксперимента SE-FRET для измерения активности LRRC8/VRAC канала, состоящего из субъединицы LRRC8A, слитой с донором (mCerulean3), и субъединицы LRRC8E, слитой с акцептором (mVenus) флуорофором.
4. Получение изображения для определения поправочного коэффициента
ПРИМЕЧАНИЕ: Во время FRET происходит просачивание донорского излучения в обнаруженное излучение акцептора. Кроме того, происходит перекрестное возбуждение акцепторного флуорофора по длине волны донорного возбуждения. Эти процессы должны быть компенсированы при расчете SE-FRET. С этой целью определяются поправочные коэффициенты в клетках, экспрессирующих только донора или акцептора FRET, через 24 ч после трансфекции. В данном случае съемка проводилась с помощью имидж-сканера Leica THUNDER, оснащенного лампой Leica LED8, фильтрующим кубическим CYR71010, объективом HC PL APO 63x/1.40 OIL, длинночастотным фильтром для 460/80 и 553/70 и камерой Leica DFC9000GTC. Эксперименты проводились без контроля окружающей среды, но в присутствии HEPES в буферах визуализации для стабилизации pH. Для долгосрочного наблюдения/измерений рекомендуется использовать систему контроля окружающей среды. Для анализа SE-FRET рассчитывается на основе отснятых необработанных изображений. Это можно сделать одновременно во время сбора или после. В данном случае программное обеспечение Leica LAS X с плагином SE-FRET было использовано для упрощения экспериментальной процедуры расчета поправочных коэффициентов и визуализации изменений значений SE-FRET в режиме реального времени во время получения изображения. После сбора данных поправочные коэффициенты и SE-FRET могут быть определены с помощью других программных пакетов (например, FIJI) после сбора исходных данных в соответствии с протоколом, представленным ниже.
- Перед получением изображений одиночных трансфицированных клеток для расчета поправочных коэффициентов используйте один образец, экспрессирующий пару FRET, чтобы настроить настройку микроскопии для всех каналов (донорское возбуждение/донорское излучение DD, донор/акцептор DA и акцептор/акцептор AA; см. таблицу 1 и рисунок 2C и рисунок 3A).
ПРИМЕЧАНИЕ: Для измерений SE-FRET с субъединицами VRAC, помеченными mCerulean3- и mVenus, трансфицированными, как описано выше, использовались следующие параметры: объединение пикселей 8x8, время экспозиции 100 мс и интенсивность светодиодной лампы 10%. - Возьмите образец, экспрессирующий только донорскую конструкцию (рис. 2А), аспирируйте среду для клеточной культуры и трижды промойте клетки 2 мл изотонического буфера.
- Добавьте 3 мл изотонического буфера и поместите образец на предметный столик микроскопа.
- Найдите поле зрения (FOV), в котором хотя бы одна клетка выражает донорскую конструкцию.
- Визуализируйте все каналы (DD, DA и AA см. таблицу 2 и рисунок 2A).
- Нарисуйте область интереса (ROI) вокруг клетки/ячеек и измерьте среднюю интенсивность DA (= IDA; Рисунок 2Ac) и DD (= IDD; Рисунок 2Aa).
- Для вычитания фона нарисуйте ROI в каналах DA и DD, где найден только фоновый сигнал, и измерьте среднюю интенсивность (IBDA и IBDD).
- Вычитаем среднюю интенсивность фонового ROI из средней интенсивности, измеренной в ячейке ROI соответствующего канала (
 и
и 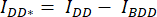 ).
). - Повторите шаги 4.2-4.5 с образцом, выражающим только конструкцию акцептора (рисунок 2B).
- Нарисуйте ROI вокруг ячейки (ячеек) и измерьте среднюю интенсивность DA (= IDA; Рисунок 2Bf) и АА (= IАА; Рисунок 2Be).
- Для вычитания фона нарисуйте ROI в каналах DA и AA, где найден только фоновый сигнал, и измерьте среднюю интенсивность (IBDA и IBAA).
- Вычитаем среднюю интенсивность фонового ROI из средней интенсивности, измеренной в ячейке ROI соответствующего канала (
 и
и 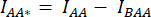 ).
). - Используйте значения, определенные для IDA*, IDD* и IAA* , для вычисления поправочных коэффициентов
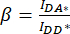 и
и 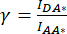 ,
,
При этом поправочный коэффициент β используется для компенсации утечки донорского излучения в канал DA. Поправочный коэффициент γ используется для компенсации перекрестного возбуждения акцепторного флуорофора по длине волны донорского возбуждения в канале DA.
| Возбуждение | Эмиссия | Название канала | Светодиодная линия | Фильтр куб | Фильтр длинных частот |
| Донор | Донор | ДД | 440 нм | CYR71010 | 460/80 нм |
| Донор | Акцептант | ДА | 440 нм | CYR71010 | 535/70 нм |
| Акцептант | Акцептант | АА | 510 нм | CYR71010 | 535/70 нм |
Таблица 2: Сводка каналов, необходимых для экспериментов SE-FRET.
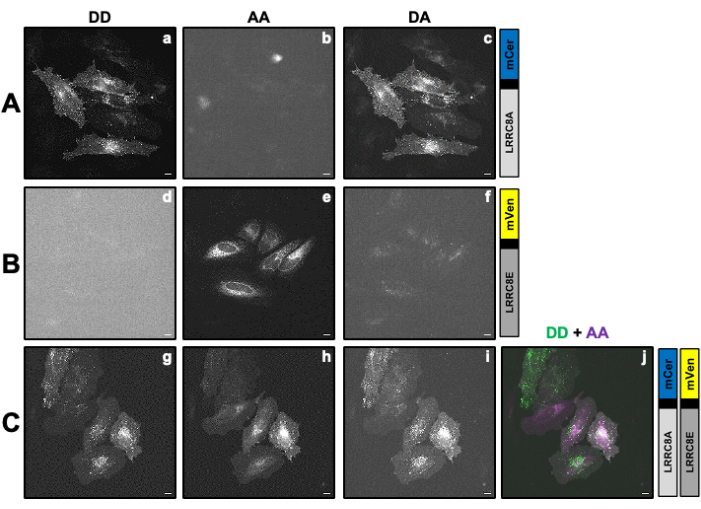
Рисунок 2: Репрезентативные флуоресцентные изображения образцов, использованные для расчета поправочных коэффициентов β и γ, необходимых для определения активности VRAC канала, состоящего из субъединицы LRRC8A, слитой с донором mCerulean3 (mCer), и субъединицы LRRC8E, слитой с акцепторным флуорофором mVenus (mVen) с помощью измерений SE-FRET. (А,Б) Обнаружение донора/донора DD, акцептора/акцептора AA и донора/акцепторного канала DA в клетках HeLa, экспрессирующих только донора (A) LRRC8A-mCer или акцептора (B) LRRC8E-mVen. (C) Обнаружение каналов DD, AA и DA в клетках HeLa, котрансфицированных с донорной и акцепторной парой LRRC8A-mCer и LRRC8E-mVen. На панелях a-i отображаются изображения, полученные в канале обнаружения донора (возбуждение донора и обнаружение сигнала донора; ДД; a, d и g), канал обнаружения акцептора (возбуждение акцептора и обнаружение сигнала акцептора; АА; b, e и h ) и канал детектирования сигнала FRET (возбуждение донора и детектирование сигнала акцептора; ДА; c, f и i). Панель j представляет собой наложение панелей g и h. Канал DD показан зеленым цветом, а канал AA - пурпурным. Масштабная линейка = 10 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
5. Покадровая съемка для количественного определения SE-FRET
- Берут образец, экспрессирующий донорскую и акцепторную конструкцию (табл. 1, рис. 2В и рис. 3А), аспирируют питательные среды для клеточных культур и трижды промывают клетки 2 мл изотонического буфера через 24 ч после трансфекции.
- Добавьте 3 мл изотонического буфера и поместите образец на предметный столик для микроскопии.
- Для последующей аспирации изотонического буфера зафиксируйте и отрегулируйте канюлю для шланга так, чтобы кончик канюли достигал дна чашки.
- Для добавления буферов зафиксируйте и отрегулируйте трубки так, чтобы буфер, приводимый в движение самотеком, мог упасть в чашку.
ПРИМЕЧАНИЕ: Здесь была использована система гравитационной перфузии с клапанным управлением и четырьмя магнитными клапанами для управления буферным потоком, но также применимы и другие методы. - Найдите поле зрения, в котором хотя бы одна клетка одновременно экспрессирует донорскую и акцепторную конструкцию.
- Поставьте покадровый эксперимент для каналов DD, DA и AA с интервалом 10 с и длительностью, охватывающей все условия последовательности стимуляции, например, 12 циклов исходного уровня, за которыми следуют 15 циклов на каждое условие (рис. 3).
ПРИМЕЧАНИЕ: Интервал и количество циклов могут быть приняты в соответствии с экспериментальными потребностями, но всегда должны включать исходное измерение для нормализации для лучшей визуализации и сравнения данных. - После базового измерения промойте образец в буфере для первого состояния.
- Аспирируйте изотонический буфер через канюлю шланга, применяя вакуум с помощью шприца.
- Добавьте 3 мл буфера следующего состояния самотеком.
- Аспирируйте буфер и добавьте еще раз 3 мл того же буфера.
- Повторите шаг 5.7.3 еще раз.
- После измерения первого условия промыть пробу в буфере для следующего условия (шаги 5.7.1-5.7.4).
- Повторяйте шаги 5.5-5.8 до тех пор, пока не будут зафиксированы все условия.
- Для количественного определения SE-FRET нарисуйте ROI вокруг ячейки/ячеек и измерьте среднюю интенсивность в каналах DD = (IDD), DA (IDA) и AA (IAA) для всех изображений (временных точек) во временном ряду (рис. 3A, B).
- Для вычитания фона для сигнала FRET нарисуйте ROI в канале DA, где находится только фоновый сигнал, и измерьте среднюю интенсивность (IBDA).
- Вычтите среднюю интенсивность фонового ROI из средней интенсивности, измеренной в ROI ячейки канала DA (
 ).
). - Используйте определенные значения для вычисления средних значений SE-FRET для каждого ROI и всех временных точек
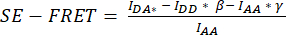 .
. - Для лучшей сопоставимости различных условий и визуализации значений SE-FRET используйте среднее значение базовых значений каждого ROI для нормализации всех временных точек соответствующего ROI.
- Построение графика нормализованных значений SE-FRET во времени (рис. 3B).
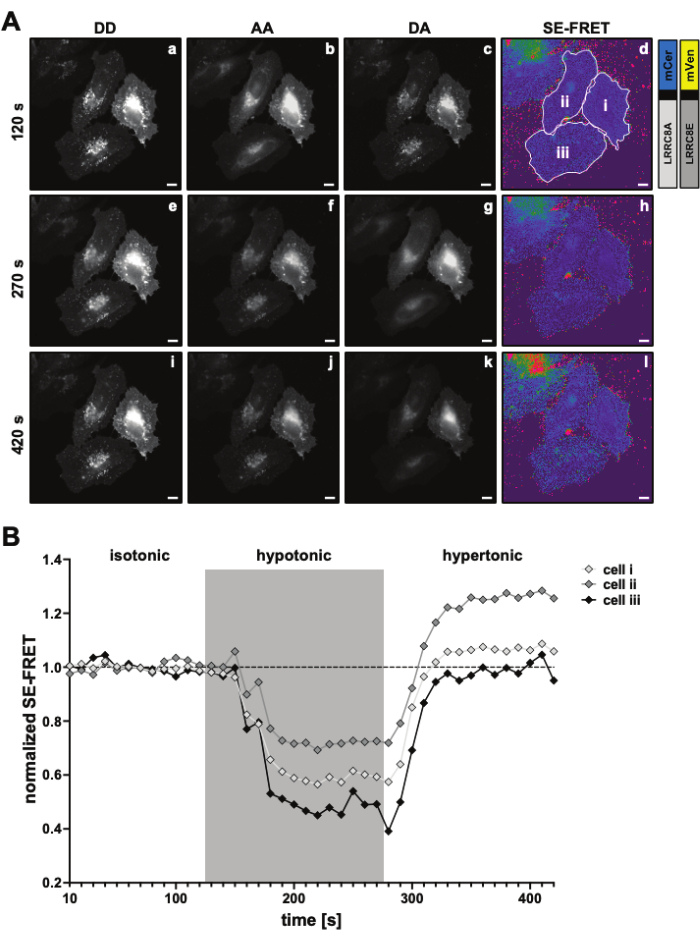
Рисунок 3: Репрезентативные флуоресцентные изображения и видимый SE-FRET для первой временной точки эксперимента для измерения активности VRAC с помощью SE-FRET канала, состоящего из субъединиц LRRC8A и LRRC8E в зависимости от тонусити. Масштабная линейка = 10 мкм. Эти же клетки показаны на рисунке 2C. На панелях a-i показано обнаружение каналов DD, AA и DA, а также расчет кажущегося SE-FRET. Белыми контурами обозначены ROI (ячейки i-iii на панели d), используемые для измерения средней интенсивности сигнала в DD, AA и DA, а также видимое изображение SE-FRET. (B) Количественная оценка значений SE-FRET с течением времени. Последовательность состояний состояла из 12 циклов изотонического визуализирующего буфера (исходного уровня), за которыми следовали 15 циклов гипотонического и 15 циклов гипертонического визуализирующего буфера. Исходное среднее значение SE-FRET для каждого ROI (ячейки i-iii) и временной точки было нормализовано до среднего значения исходного (изотонического) значения для соответствующего ROI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
С помощью этого метода, основанного на FRET, активность LRRC8/VRAC можно контролировать во время осмотической стимуляции, и снижение SE-FRET коррелирует со степенью внеклеточного гипотоника45. Здесь также показаны репрезентативные результаты активации каналов, вызванной гипотонуссией (рис. 3 и рис. 4). Кроме того, может наблюдаться активация LRRC8/VRAC различными изосмотическими стимулами, такими как манипуляция диацилглицериновой сигнализацией45 или во время активации миоцитов56.
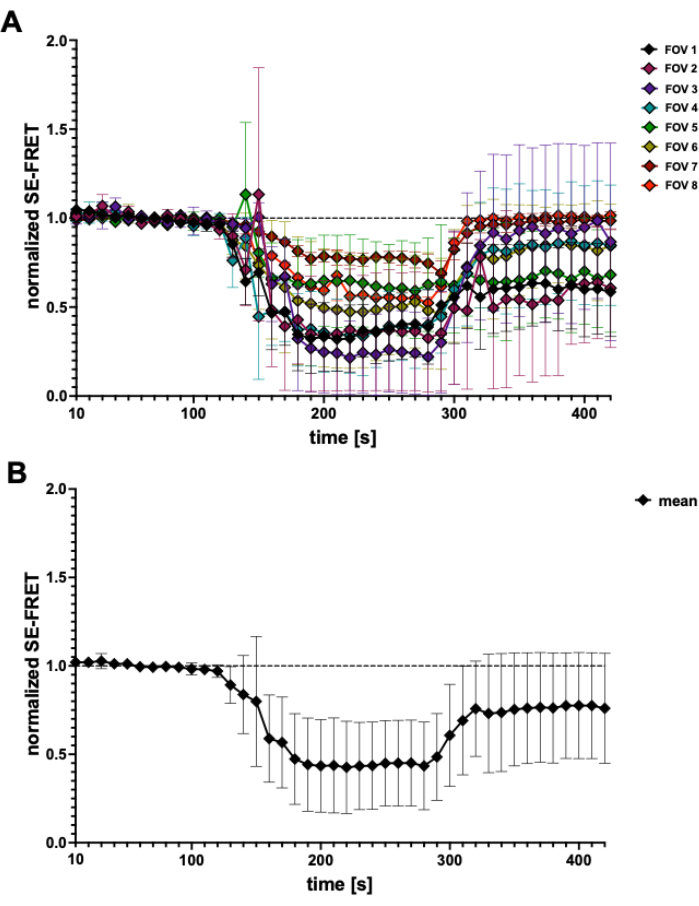
Рисунок 4: Следы SE-FRET. (A) Очевидные следы SE-FRET из 5 независимых экспериментов. Данные представляют собой среднее значение ± SD от N = 2 до N = 7 ячеек на поле зрения (FOV). (B) Среднее SD ± всех клеток (N = 31 ячейка). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Поскольку каналы LRRC8/VRAC также участвуют в уменьшении объема апоптоза24,57, наблюдение за активностью канала при индукции апоптоза было бы еще одним применением описанного здесь метода. Соответственно, протокол мониторинга SE-FRET в клетках HeLa, экспрессирующих LRRC8A-mCerulean3 и LRRC8E-mVenus, проводился при применении препаратов, индуцирующих апоптоз, опосредованных рецепторами смерти. Ранее было показано, что фактор некроза опухоли (TNF)-α и циклогексимид (CHX) вызывают токи VRAC в течениенескольких минут. После добавления 2 нг/мл TNF-α и 1 мкг/мл CHX в изотонический буфер наблюдалось устойчивое снижение SE-FRET (рис. 5). При замене буфера гипертонической средой, даже содержащей TNF-α и CHX, ЗНАЧЕНИЯ SE-FRET восстанавливались близко к исходному уровню (рис. 5A), что соответствует уменьшению токов VRAC в растворе гипертонической ванны во время лечения лигандом Fas58, индуцирующим апоптоз. Обработка клеток ДМСО, растворителем TNF-α и CHX, не привела к снижению SE-FRET. TNF-α + CHX не влиял на SE-FRET CFP-18aa-YFP, тандемную конструкцию EYFP и ECFP в качестве контроля FRET59, демонстрируя специфичность для LRRC8/VRAC (рис. 5B).
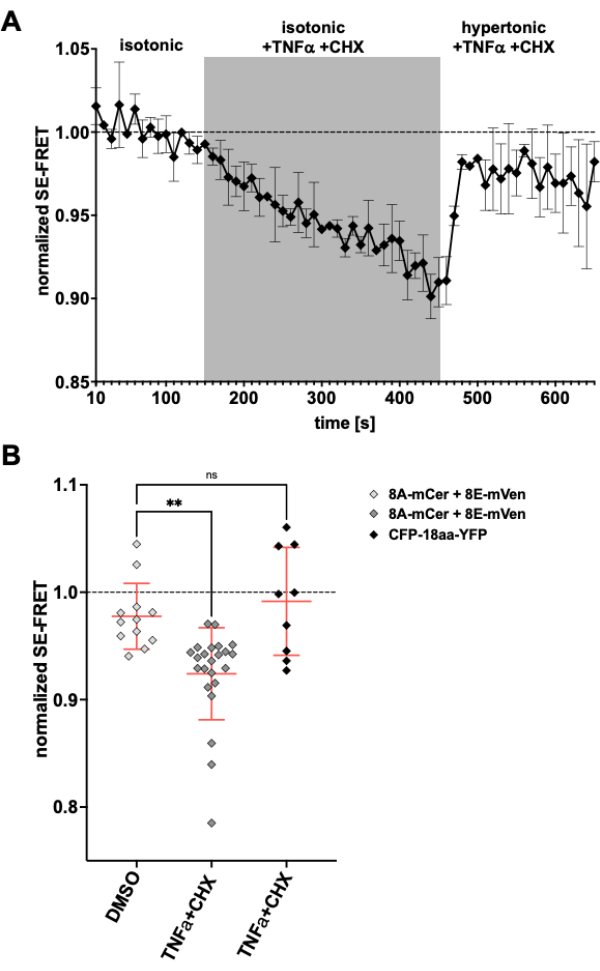
Рисунок 5: Изосмотическая активация VRAC апоптозом, опосредованным рецептором смерти. (A) Нормализованные значения SE-FRET из клеток HeLa, экспрессирующих LRRC8A-mCer/LRRC8E-mVen (n = 8 чашек, 23 клетки) с течением времени. После 15 циклов в изотоническом буфере визуализации (исходный уровень) раствор ванны заменяли изотоническим буфером с добавлением 2 нг/мл TNF-α и 1 мкг/мл циклогексимида (CHX) в течение 30 циклов с последующим 20 циклами гипертонического буфера визуализации с TNF-α и CHX. Исходное среднее значение SE-FRET для каждого ROI и временной точки было нормализовано до среднего значения базового (изотонического) значения для соответствующего ROI. (B) Количественная оценка нормализованных значений SE-FRET LRRC8A/E-экспрессирующих клеток HeLa в A с изотоническим раствором, содержащим ДМСО в качестве средства контроля для CHX (n = 5 тарелок, 12 клеток) или изотонического буфера, содержащего индукторы апоптоза, как в A (n = 8 чашек, 23 клетки), или клеток HeLa, экспрессирующих CFP-18aa-YFP с индукторами апоптоза (n = 3 чашки, 9 клеток). Данные представляют собой среднее значение последних 10 временных точек в соответствующем буфере отдельных ячеек (символов) и среднее значение всех ячеек ± SD; ** p < 0,01 обычного одностороннего ANOVA с последующим множественным сравнением постфактум теста Тьюки. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Микроскопия FRET является хорошо зарекомендовавшим себя и широко используемым методом изучения взаимодействия между белками. Таким образом, методы, основанные на FRET, могут быть применены во многих лабораториях с различной специализацией. Конформационные перегруппировки во время стробирования контролировали для широкого спектра ионных каналов с использованием анализов на основе FRET (например, см. ссылки 34,50,51,52,53,60,61,62,63,64,65,66,67)), в некоторых случаях сочетается с электрофизиологией при патч-зажимной флуориметрии 68,69,70,71. FRET может быть использован для изучения структурно-функциональных отношений этих ионных каналов или для мониторинга их активности независимо от переноса ионов. Представленный здесь метод может иметь явные преимущества перед электрофизиологией, так как позволяет проводить мониторинг активности каналов LRRC8/VRAC in situ.
Важнейшие шаги в протоколе включают в себя нанесение покрытий на клетки для достижения оптимального слияния для трансфекции и визуализации, что в идеале облегчает различение клеток для последующего анализа. Эффективная котрансфекция различных субъединиц имеет решающее значение для правильной субклеточной локализации; например, избыток субъединицы, отличной от LRRC8A, приведет к усиленной локализации эндоплазматического ретикулума (ЭР)4. Поэтому может потребоваться корректировка соотношения плазмид. В зависимости от системы, вновь сгенерированные пары FRET должны быть проверены, например, с помощью акцепторного отбеливания. Биннинг и время экспозиции должны быть сбалансированы друг относительно друга, чтобы обеспечить оптимальное временное и пространственное разрешение для исследуемого вопроса. Биннинг позволяет сократить время воздействия и, следовательно, уменьшить потенциальное обесцвечивание датчика FRET при одновременном снижении пространственного разрешения. Следовательно, если экспериментальная установка требует, например, субклеточной дискриминации активности LRRC8/VRAC, следует избегать биннинга. Исследовательский вопрос в равной степени определяет количество и интервал циклов в таймлапс-ряду. Интервал имеет значение только в том случае, если требуется кинетика изменений FRET (и, следовательно, активация/инактивация LRRC8/VRAC); В противном случае можно также выполнить простую запись «до и после». Продолжительность эксперимента зависит от физиологического процесса. В идеале активность LRRC8/VRAC при воздействии на стимулы должна контролироваться до тех пор, пока SE-FRET не стабилизируется. Эти факторы могут быть определены в пилотных экспериментах. Поправочные коэффициенты для расчета реального сигнала SE-FRET должны быть определены для всех условий. Неправильно определенные поправочные коэффициенты могут привести к завышению или занижению интенсивностей SE-FRET. Наконец, после установления стабильной базовой линии, временной интервал между изображениями должен быть достаточно коротким, чтобы охватить интересующий нас физиологический процесс.
Метод имеет некоторые ограничения. Одна из них заключается в том, что изменения интенсивностей FRET inter-LRRC8 при отражении движений LRRD не обязательно соответствуют переносу ионов или осмолитов через поры. Это ясно из изменений FRET, наблюдаемых с гомомерами LRRC8A45, несмотря на их минимальные токи 4,32,72. Блокираторы пор каналов LRRC8/VRAC могут не влиять на сигнал FRET, что делает этот метод непригодным для поиска конкретных модуляторов каналов. Более того, уровни экспрессии сверхэкспрессированных белков LRRC8 могут влиять на наблюдаемые физиологические процессы, особенно если учесть, что С-терминально меченые белки LRRC8 проявляют базальную активность14.
Аспект, который можно считать ограничением или преимуществом в зависимости от конкретного исследовательского вопроса, заключается в том, что в этом методе избирательно измеряются только эктопически экспрессируемые субъединицы LRRC8. Таким образом, фоновые уровни эндогенных белков практически не влияют на измерения. С другой стороны, сверхэкспрессированные белки могут вести себя не так, как эндогенные каналы LRRC8 с потенциально другим составом субъединиц и стехиометрией. Например, различные стимулы, такие как окисление, могут оказывать противоположные модулирующие эффекты на по-разному скомпонованные каналы LRRC836. Изменяя соотношения между ко-экспрессируемыми субъединицами, их стехиометрию и общую ионную проводимость можно регулировать 14,73, но их нативный состав, вероятно, с более чем двумя паралогами в одном комплексе21, не ясен и может варьироваться между типами клеток 74,75,76. Кроме того, было показано, что слияние флуоресцентных белков с цитозольными C-концами белков LRRC8 увеличивает активность базального канала LRRC8/VRAC в ооцитах Xenopus 14, вероятно, потому, что большие метки модулируют конформацию LRRDs, что может управлять открытием каналов 14,44,45 . Таким образом, размер флуоресцентных белков, линкер и их ориентация могут влиять не только на эффективность FRET, но и на активность канала. Однако, что важно, каналы VRAC белков LRRC8, слитых с флуоресцентными белками, оставались чувствительными к гипотонической стимуляции14, что позволяло использовать их в качестве FRET сенсоров45.
Преимущества этого неинвазивного метода мониторинга активности канала LRRC8/VRAC с помощью световой микроскопии по сравнению с другими методами заключаются в следующем: (i) Он позволяет наблюдать LRRC8/VRAC в клетках или компартментах, обычно недоступных для электрофизиологии. Это включает в себя внутриклеточные органеллы, на которых комплексы LRRC8 могут быть обнаружены или нацелены на 45,77,78. (ii) Цитозольный состав остается неизменным с помощью метода, в то время как при измерениях с помощью патч-зажима целых клеток цитозоль в значительной степени заменяется раствором пипетки, что может влиять на сигнальные пути, как это наблюдается при индуцированной форбол-12-миристат-13-ацетатом (PMA) активацией LRRC8/VRAC45. (iii) Это дает возможность наблюдать активацию LRRC8/VRAC с субклеточным разрешением, например, различать активность на переднем и заднем краях во время миграции клеток, где VRAC ограничен замкнутыми пространствами79,80. (iv) Он обеспечивает непрерывный мониторинг активности LRRC8/VRAC во время расширенных физиологических процессов, таких как дифференцировка миоцитов56.
Несмотря на то, что у этого метода есть ограничения и проблемы, он обещает дальнейшие исследования, включая потенциальное применение на животных моделях. В сочетании с другими методами изучения этого семейства ионных и осмолитных каналов, этот анализ на основе FRET может внести значительный вклад в разгадку механизмов активации и изучение различных физиологических функций каналов LRRC8 в их естественной среде.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Мы благодарим К.Ф. Камински за любезный подарок в виде плазмиды, кодирующей конструкцию CFP-18aa-YFP, А. Клеммера за техническую помощь, а также всех нынешних и бывших сотрудников лаборатории Штаубера, которые внесли свой вклад в развитие этого метода.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | gibco | 25300-054 | |
| Camera DFC9000GTC | Leica | 11547007 | |
| CFP-18aa-YFP | N/A | N/A | Elder et al. 2009 PMCID: PMC2706461; Gift from C.F. Kaminski (University of Cambridge, UK) |
| Cycloheximide (CHX) | Sigma-Aldrich | 66-81-9 | |
| D(-)-Mannitol | Carl Roth | 4175.1 | |
| D(+)-Glucose | Carl Roth | HN06.1 | |
| DMEM (Dulbeccos Modified Eagle Medium) | PAN-Biotech | P04-03590 | |
| DPBS (Dulbecco's Phosphate Buffer Saline) | PAN-Biotech | P04-36500 | |
| Emission filter wheel (460/80, 535/70, 590/50, 642/80, 100%) | Leica | 11525480 | |
| FBS (Fetal Bovine Serum) | PAN-Biotech | P30-3302 | |
| Filter cube CYR71010 | Leica | 11525416 | |
| FuGENE | Promega | E2691 | |
| Glas Bottom Culture Dishes 35 mm | MatTek | P35G-0-10-C | |
| HeLa cells | Leibniz Forschungsinstitut DSMZ | ACC 57 | Mammalian cervix carcinoma/ Obtained from Leibniz Forschungsinstitut DSMZ |
| HEPES | Carl Roth | 9105.4 | |
| ibidi µ-Disch 35 mm | ibidi | 81156 | |
| KCl (Potassium chloride) | Carl Roth | 6781.1 | |
| LAS X FRET Wizard | Leica | 11640862 | |
| Light source LED8 | Leica | 11504256 | |
| LRRC8A-mCerulean3 | N/A | N/A | König et al. 2019 |
| LRRC8E-mVenus | N/A | N/A | König et al. 2019 |
| Luna-II Automated Cell Counter | logos biosystems | L40002 | |
| Luna-II Cell Counter Slides | logos biosystems | L12001 | |
| MgCl2 (Magnesium chloride) | Carl Roth | KK36.1 | |
| Microscope THUNDER Imager live cell | Leica | 11525681 | |
| NaCl (Sodium chloride) | Carl Roth | 9263 | |
| Objective HC PL APO 63x/1.40 OIL | Leica | 11506349 | |
| Opti-Minimal Essential Medium (MEM) | gibco | 11058 | |
| Osmometer OM807 | Vogel | V04807 | |
| Penicillin Streptomycin (Pen Step) | gibco | 15070-063 | |
| Trypan blue solution (0,4%) | Sigma | T8154 | |
| Tumor necrosis factor (TNF)-a | Sigma-Aldrich | 94948-59-1 | |
| Valve Controlled Gravity Perfusion System | ALA Scientific Instruments | VC3-4xG |
Ссылки
- Jentsch, T. J. VRACs and other ion channels and transporters in the regulation of cell volume and beyond. Nat Rev Mol Cell Biol. 17 (5), 293-307 (2016).
- Chen, L., et al. More than just a pressure relief valve: physiological roles of volume-regulated LRRC8 anion channels. Biol Chem. 400 (11), 1481-1496 (2019).
- Qiu, Z., et al. SWELL1, a plasma membrane protein, is an essential component of volume-regulated anion channel. Cell. 157 (2), 447-458 (2014).
- Voss, F. K., et al. Identification of LRRC8 heteromers as an essential component of the volume-regulated anion channel VRAC. Science. 344 (6184), 634-638 (2014).
- Hoffmann, E. K., Schettino, T., Marshall, W. S. The role of volume-sensitive ion transport systems in regulation of epithelial transport. Comp Biochem Physiol A Mol Integr Physiol. 148 (1), 29-43 (2007).
- López-Cayuqueo, K. I., et al. Renal deletion of LRRC8/VRAC channels induces proximal tubulopathy. J Am Soc Nephrol. 33 (8), 1528-1545 (2022).
- Lück, J. C., Puchkov, D., Ullrich, F., Jentsch, T. J. LRRC8/VRAC anion channels are required for late stages of spermatid development in mice. J Biol Chem. 293 (30), 11796-11808 (2018).
- Chen, L., Becker, T. M., Koch, U., Stauber, T. The LRRC8/VRAC anion channel facilitates myogenic differentiation of murine myoblasts by promoting membrane hyperpolarization. J Biol Chem. 294 (39), 14279-14288 (2019).
- Best, L., Brown, P. D., Sener, A., Malaisse, W. J. Electrical activity in pancreatic islet cells: The VRAC hypothesis. Islets. 2 (2), 59-64 (2010).
- Kang, C., et al. SWELL1 is a glucose sensor regulating beta-cell excitability and systemic glycaemia. Nat Commun. 9 (1), 367 (2018).
- Stuhlmann, T., Planells-Cases, R., Jentsch, T. J. LRRC8/VRAC anion channels enhance beta-cell glucose sensing and insulin secretion. Nat Commun. 9 (1), 1974 (2018).
- Hisadome, K., et al. Volume-regulated anion channels serve as an auto/paracrine nucleotide release pathway in aortic endothelial cells. J Gen Physiol. 119 (6), 511-520 (2002).
- Burow, P., Klapperstück, M., Markwardt, F. Activation of ATP secretion via volume-regulated anion channels by sphingosine-1-phosphate in RAW macrophages. Pflügers Arch. 467 (6), 1215-1226 (2015).
- Gaitán-Peñas, H., et al. Investigation of LRRC8-mediated volume-regulated anion currents in Xenopus oocytes. Biophys J. 111 (7), 1429-1443 (2016).
- Lahey, L. J., et al. LRRC8A:C/E heteromeric channels are ubiquitous transporters of cGAMP. Mol Cell. 80 (4), 578-591 (2020).
- Chen, X., et al. Regulation of anion channel LRRC8 volume-regulated anion channels in transport of 2'3'-cyclic GMP-AMP and cisplatin under steady state and inflammation. J Immunol. 206 (9), 2061-2074 (2021).
- Zhou, C., et al. Transfer of cGAMP into bystander cells via LRRC8 volume-regulated anion channels augments STING-mediated interferon responses and anti-viral immunity. Immunity. 52 (5), 767-781 (2020).
- Feustel, P. J., Jin, Y., Kimelberg, H. K. Volume-regulated anion channels are the predominant contributors to release of excitatory amino acids in the ischemic cortical penumbra. Stroke. 35 (5), 1164-1168 (2004).
- Mongin, A. A. Volume-regulated anion channel--a frenemy within the brain. Pflügers Arch. 468 (3), 421-441 (2016).
- Schober, A. L., Wilson, C. S., Mongin, A. A. Molecular composition and heterogeneity of the LRRC8-containing swelling-activated osmolyte channels in primary rat astrocytes. J Physiol. 595 (22), 6939-6951 (2017).
- Lutter, D., Ullrich, F., Lueck, J. C., Kempa, S., Jentsch, T. J. Selective transport of neurotransmitters and modulators by distinct volume-regulated LRRC8 anion channels. J Cell Sci. 130 (6), 1122-1133 (2017).
- Yang, J., et al. Glutamate-releasing SWELL1 channel in astrocytes modulates synaptic transmission and promotes brain damage in stroke. Neuron. 102 (4), 813-827 (2019).
- Lee, C. C., Freinkman, E., Sabatini, D. M., Ploegh, H. L. The protein synthesis inhibitor blasticidin s enters mammalian cells via leucine-rich repeat-containing protein 8D. J Biol Chem. 289 (24), 17124-17131 (2014).
- Planells-Cases, R., et al. Subunit composition of VRAC channels determines substrate specificity and cellular resistance to Pt-based anticancer drugs. EMBO J. 34 (24), 2993-3008 (2015).
- Model, M. A., Nia, F. H., Zook, E., Hollembeak, J. E., Stauber, T. Uptake of fluorescein upon osmotic cell swelling is dependent on the volume-regulated anion channel VRAC/LRRC8. Paracelsus Proc Exp Med. 1 (1), 3-14 (2022).
- Stauber, T. The volume-regulated anion channel is formed by LRRC8 heteromers - molecular identification and roles in membrane transport and physiology. Biol Chem. 396 (9-10), 975-990 (2015).
- Bertelli, S., et al. Mechanisms of activation of LRRC8 volume regulated anion channels. Cell Physiol Biochem. 55 (S1), 41-56 (2021).
- Liu, T., Li, Y., Wang, D., Stauber, T., Zhao, J. Trends in volume-regulated anion channel (VRAC) research: visualization and bibliometric analysis from 2014 to 2022. Front Pharmacol. 14, 1234885 (2023).
- Strange, K., Yamada, T., Denton, J. S. A 30-year journey from volume-regulated anion currents to molecular structure of the LRRC8 channel. J Gen Physiol. 151 (2), 100-117 (2019).
- Osei-Owusu, J., Yang, J., Vitery, M. D. C., Qiu, Z. Molecular biology and physiology of volume-regulated anion channel (VRAC). Curr Top Membr. 81, 177-203 (2018).
- Friard, J., Laurain, A., Rubera, I., Duranton, C. LRRC8/VRAC channels and the redox balance: A complex Relationship. Cell Physiol Biochem. 55 (S1), 106-118 (2021).
- Syeda, R., et al. LRRC8 proteins form volume-regulated anion channels that sense ionic strength. Cell. 164 (3), 499-511 (2016).
- Ullrich, F., Reincke, S. M., Voss, F. K., Stauber, T., Jentsch, T. J. Inactivation and anion selectivity of volume-regulated anion channels (VRACs) depend on C-terminal residues of the first extracellular loop. J Biol Chem. 291 (33), 17040-17048 (2016).
- König, B., Stauber, T. Biophysics and structure-function relationships of LRRC8-formed volume-regulated anion channels. Biophys J. 116 (7), 1185-1193 (2019).
- Concepcion, A. R., et al. The volume-regulated anion channel LRRC8C suppresses T cell function by regulating cyclic dinucleotide transport and STING-p53 signaling. Nat Immunol. 23 (2), 287-302 (2022).
- Gradogna, A., Gavazzo, P., Boccaccio, A., Pusch, M. Subunit-dependent oxidative stress sensitivity of LRRC8 volume-regulated anion channels. J Physiol. 595 (21), 6719-6733 (2017).
- Bertelli, S., Zuccolini, P., Gavazzo, P., Pusch, M. Molecular determinants underlying volume-regulated anion channel subunit-dependent oxidation sensitivity. J Physiol. 600 (17), 3965-3982 (2022).
- Deneka, D., Sawicka, M., Lam, A. K. M., Paulino, C., Dutzler, R. Structure of a volume-regulated anion channel of the LRRC8 family. Nature. 558 (7709), 254-259 (2018).
- Kasuya, G., et al. Cryo-EM structures of the human volume-regulated anion channel LRRC8. Nat Struct Mol Biol. 25 (9), 797-804 (2018).
- Kefauver, J. M., et al. Structure of the human volume regulated anion channel. Elife. 7, e38461 (2018).
- Takahashi, H., Yamada, T., Denton, J. S., Strange, K., Karakas, E. Cryo-EM structures of an LRRC8 chimera with native functional properties reveal heptameric assembly. Elife. 12, e82431 (2023).
- Sawicka, M., Dutzler, R. Regulators of cell volume: The structural and functional properties of anion channels of the LRRC8 family. Curr Opin Struct Biol. 74, 102382 (2022).
- Kasuya, G., Nureki, O. Recent advances in the structural biology of the volume-regulated anion channel LRRC8. Front Pharmacol. 13, 896532 (2022).
- Deneka, D., et al. Allosteric modulation of LRRC8 channels by targeting their cytoplasmic domains. Nat Commun. 12 (1), 5435 (2021).
- König, B., Hao, Y., Schwartz, S., Plested, A. J., Stauber, T. A FRET sensor of C-terminal movement reveals VRAC activation by plasma membrane DAG signaling rather than ionic strength. Elife. 8, e45421 (2019).
- Hille, B. . Ion Channels of Excitable Membranes. 3rd edn. , (2001).
- Pedersen, S. F., Okada, Y., Nilius, B. Biophysics and physiology of the volume-regulated anion channel (VRAC)/volume-sensitive outwardly rectifying anion channel (VSOR). Pflügers Arch. 468 (3), 371-383 (2016).
- Kolobkova, Y., Pervaiz, S., Stauber, T. The expanding toolbox to study the LRRC8-formed volume-regulated anion channel VRAC. Curr Top Membr. 88, 119-163 (2021).
- Galietta, L. J., Haggie, P. M., Verkman, A. S. Green fluorescent protein-based halide indicators with improved chloride and iodide affinities. FEBS Lett. 499 (3), 220-224 (2001).
- Bykova, E. A., Zhang, X. D., Chen, T. Y., Zheng, J. Large movement in the C terminus of CLC-0 chloride channel during slow gating. Nat Struct Mol Biol. 13 (12), 1115-1119 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Miranda, P., et al. State-dependent FRET reports calcium- and voltage-dependent gating-ring motions in BK channels. Proc Natl Acad Sci U S A. 110 (13), 5217-5222 (2013).
- Zachariassen, L. G., et al. Structural rearrangement of the intracellular domains during AMPA receptor activation. Proc Natl Acad Sci U S A. 113 (27), E3950-E3959 (2016).
- Markwardt, M. L., et al. An improved cerulean fluorescent protein with enhanced brightness and reduced reversible photoswitching. PLoS One. 6 (3), e17896 (2011).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nat Biotechnol. 20 (1), 87-90 (2002).
- Chen, L., König, B., Stauber, T. LRRC8 channel activation and reduction in cytosolic chloride concentration during early differentiation of C2C12 myoblasts. Biochem Biophys Res Commun. 532, 482-488 (2020).
- Maeno, E., Ishizaki, Y., Kanaseki, T., Hazama, A., Okada, Y. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis. Proc Natl Acad Sci U S A. 97 (17), 9487-9492 (2000).
- Shimizu, T., Numata, T., Okada, Y. A role of reactive oxygen species in apoptotic activation of volume-sensitive Cl- channel. Proc Natl Acad Sci U S A. 101 (17), 6770-6773 (2004).
- Elder, A. D., et al. A quantitative protocol for dynamic measurements of protein interactions by Förster resonance energy transfer-sensitized fluorescence emission. Journal of the Royal Society Interface. 6, S59-S81 (2009).
- Glauner, K. S., Mannuzzu, L. M., Gandhi, C. S., Isacoff, E. Y. Spectroscopic mapping of voltage sensor movement in the Shaker potassium channel. Nature. 402 (6763), 813-817 (1999).
- Dai, G., Aman, T. K., DiMaio, F., Zagotta, W. N. The HCN channel voltage sensor undergoes a large downward motion during hyperpolarization. Nat Struct Mol Biol. 26 (8), 686-694 (2019).
- Renart, M. L., et al. Conformational plasticity in the KcsA potassium channel pore helix revealed by homo-FRET studies. Sci Rep. 9 (1), 6215 (2019).
- Wang, S., et al. Potassium channel selectivity filter dynamics revealed by single-molecule FRET. Nat Chem Biol. 15 (4), 377-383 (2019).
- Harley, C. A., et al. Conformation-sensitive antibody reveals an altered cytosolic PAS/CNBh assembly during hERG channel gating. Proc Natl Acad Sci U S A. 118 (44), e2108796118 (2021).
- Han, S., et al. Structural dynamics determine voltage and pH gating in human voltage-gated proton channel. Elife. 11, e73093 (2022).
- Cullinan, M. M., Klipp, R. C., Camenisch, A., Bankston, J. R. Dynamic landscape of the intracellular termini of acid-sensing ion channel 1a. Elife. 12, e90755 (2023).
- Kim, J., Won, J., Chung, D. K., Lee, H. H. FRET analysis of the temperature-induced structural changes in human TRPV3. Sci Rep. 13 (1), 10108 (2023).
- Zheng, J., Zagotta, W. N. Patch-clamp fluorometry recording of conformational rearrangements of ion channels. Sci STKE. (176), PL7 (2003).
- Kusch, J., Zifarelli, G. Patch-clamp fluorometry: electrophysiology meets fluorescence. Biophys J. 106 (6), 1250-1257 (2014).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. J Gen Physiol. 151 (10), 1163-1172 (2019).
- Bhat, S., Blunck, R. Characterising ion channel structure and dynamics using fluorescence spectroscopy techniques. Biochem Soc Trans. 50 (5), 1427-1445 (2022).
- Yamada, T., Figueroa, E. E., Denton, J. S., Strange, K. LRRC8A homohexameric channels poorly recapitulate VRAC regulation and pharmacology. Am J Physiol Cell Physiol. 320 (3), C293-C303 (2021).
- Yamada, T., Wondergem, R., Morrison, R., Yin, V. P., Strange, K. Leucine-rich repeat containing protein LRRC8A is essential for swelling-activated Cl- currents and embryonic development in zebrafish. Physiol Rep. 4 (19), e12940 (2016).
- Pervaiz, S., Kopp, A., von Kleist, L., Stauber, T. Absolute protein amounts and relative abundance of volume-regulated anion channel (VRAC) LRRC8 subunits in cells and tissues revealed by quantitative immunoblotting. Int J Mol Sci. 20 (23), 5879 (2019).
- Kern, D. M., et al. Structural basis for assembly and lipid-mediated gating of LRRC8A:C volume-regulated anion channels. Nat Struct Mol Biol. 30 (6), 841-852 (2023).
- Rutz, S., Deneka, D., Dittmann, A., Sawicka, M., Dutzler, R. Structure of a volume-regulated heteromeric LRRC8A/C channel. Nat Struct Mol Biol. 30 (1), 52-61 (2023).
- Li, P., et al. LRRC8 family proteins within lysosomes regulate cellular osmoregulation and enhance cell survival to multiple physiological stresses. Proc Natl Acad Sci U S A. 117 (46), 29155-29165 (2020).
- Kashyap, P., et al. An optogenetic method for the controlled release of single molecules. Nat Methods. 21 (4), 666-672 (2024).
- Liu, T., Stauber, T. The volume-regulated anion channel LRRC8/VRAC is dispensable for cell proliferation and migration. Int J Mol Sci. 20 (11), e2663 (2019).
- Zhang, Y., et al. Polarized NHE1 and SWELL1 regulate migration direction, efficiency and metastasis. Nat Commun. 13 (1), 6128 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены