Method Article
Мышиная модель сосудистых когнитивных нарушений и деменции на основе асимметричного двустороннего стеноза общей сонной артерии под контролем иглы
В этой статье
Резюме
Предложен игольчатый метод асимметричного двустороннего стеноза общей сонной артерии для создания мышиной модели сосудистых когнитивных нарушений и деменции. Он приводит к более долгосрочным результатам по сравнению с ранее созданными моделями и совместим с МРТ в реальном времени. Визуальное представление, демонстрирующее процедуру, дает рекомендации по освоению операции.
Аннотация
Сосудистые когнитивные нарушения и деменция (ВКИД) возникают в результате повреждения сосудов головного мозга. Учитывая высокую заболеваемость VCID, которая, как ожидается, будет продолжать расти по мере старения населения, крайне важно создать надежную модель болезни на животных. В данной работе представлен новый метод создания мышиной модели VCID, основанный на асимметричном двустороннем стенозе общей сонной артерии, который имитирует хроническую гипоперфузию головного мозга человека, вызванную атеросклерозом сонных артерий.
Вкратце, общие сонные артерии (ОСА) перевязываются к иглам разного калибра (32 G для правой ОСА и 34 G для левой ОСА) с использованием шелковых швов 7-0 с последующим немедленным удалением иглы. Оставшиеся шовные кольца вызывают стойкое снижение кровотока и долгосрочные когнитивные нарушения, связанные с повреждением белого вещества, микроинфарктами и реактивным глиозом, таким образом, близко имитируя патогенез VCID. Важно отметить, что в этой игольчатой модели клинические представления не меняются со временем, что обеспечивает надежное долгосрочное когнитивное нарушение. Более того, выживаемость через 24 недели после операции составила 81,6%, что выше по сравнению с другими установленными моделями ВЦИД с аналогичным уровнем снижения кровотока.
К дополнительным преимуществам относятся низкая стоимость материала и совместимость с МРТ для мониторинга черепно-мозговой травмы у живых животных, поскольку металл не имплантируется. Основной проблемой при использовании игольчатой модели VCID является необходимость развития передовых хирургических навыков, поскольку CCA мышей имеют диаметр менее 0,6 мм и очень хрупкие. Таким образом, высококачественное визуальное представление операции поможет исследователям овладеть этой техникой и улучшить наше понимание VCID, что потенциально приведет к разработке новых терапевтических методов для уменьшения разрушительного снижения когнитивных функций, связанного с VCID.
Введение
Сосудистые когнитивные нарушения и деменция (ВКИД) являются второй по значимости причиной снижения когнитивных функций. Несмотря на неоспоримый прогресс, достигнутый в понимании патогенеза VCID и его факторов риска, механизм того, как нейроваскулярная дисфункция способствует снижению когнитивных способностей, остается неясным. Был создан ряд моделей грызунов различной сложности, чтобы индуцировать церебральную ишемию для имитации клинических представлений VCID1 человека. Некоторые из этих моделей основаны на создании транзиторной церебральной гипоперфузии; однако большинство из них генерируются путем индуцирования хронической церебральной гипоперфузии, основного механизма, приводящего к ВЦИ у пациентов2.
Хроническая церебральная гипоперфузия может быть введена с помощью либо двусторонней окклюзии сонной артерии (BCAO), которая вызывает тяжелые, но часто смертельные результаты, либо двустороннего стеноза сонной артерии (BCAS). БКАС обычно выполняется с использованием одного из двух методов: путем размещения идентичных микроспиралей вокруг обоих ССА, что приводит к симметричному стенозу3; или путем имплантации амероидного констриктора и микроспирали вокруг левого и правого ОСА соответственно, вызывая постепенную окклюзию и снижение ~50% кровотока на левом и правом ОСА соответственно4. Недостатками обоих методов являются высокая смертность при слишком тяжелом стенозе или при окклюзии ОСА и несовместимость с МРТ живых животных из-за наличия металла в организме. Также было установлено несколько генетических моделей мышей 1,5,6,7,8. Дополнительные варианты включают церебральную аутосомно-доминантную артериопатию с подкорковыми инфарктами и лейкоэнцефалопатию мышиных моделей 9,10. Тем не менее, ни одна из предложенных моделей не имитирует весь спектр ишемических повреждений, который представлен у пациентов, в связи с чем поиск обновленных моделей ВЦИД продолжается.
В данной работе представлен новый хирургический метод индуцирования асимметричного двустороннего стеноза общей сонной артерии (ABCS) у мышей, при котором стеноз CCA выполняется с использованием шелковых швов и контролируется путем лигирования CCA к иглам различного диаметра с последующим немедленным удалением иглы11. В результате на ОСА навсегда остаются шовные кольца точного диаметра, что обеспечивает хронический стеноз. Преимущество использования ABCS по сравнению с симметричным методом заключается в том, что умеренная гипоперфузия справа обеспечивает лучшую выживаемость, в то время как более выраженная гипоперфузия слева обеспечивает долгосрочные неврологические и патологические проявления. Эта игольчатая модель имеет ряд преимуществ по сравнению с традиционными моделями BCAS11 , таких как стойкие результаты, более низкая смертность, сверхнизкая стоимость, гибкость и возможность использования специальных аналитических подходов.
Чтобы подробнее рассказать об этих преимуществах, три лигирования вызывают фрагмент стеноза CCA, а не стеноз фокальной точки, что приводит к стойкой гипоперфузии, повреждению белого вещества и снижению когнитивных способностей у ~90% мышей. Смертность игольчатых мышей составила ~17%, чтониже, чем у модели 4 амероидного рестриктора/микрокатушки Хаттори, которая, согласно нашему опыту, имеет ~30% смертность в течение 16 недель. Каждая модель BCAS обычно стоит около 100 долларов из-за дорогих микроспиралей или амероидных ограничителей, в то время как игольчатая модель стоит всего около 1 доллара за мышь. Кроме того, калибр игл может быть изменен в зависимости от специфических для исследования требований к ограничению кровотока с любой стороны. В вариации, представленной в настоящей статье, игольчатая модель имитирует патофизиологию тяжелого стеноза сонной артерии, вызванного односторонним постоянным стенозом без окклюзии, что является наиболее распространенным представлением заболевания в клинике11. Кроме того, амероидные рестрикторы и микроспирали, которые используются в традиционных моделях BCAS, изготовлены из металла, что может привести к значительным артефактам при проведении МРТ in vivo , даже несмотря на то, что металл имплантирован не в мозг, а в грудную клетку. Может быть трудно предсказать, как именно присутствие металла повлияет на визуализацию.
Как правило, МРТ in vivo , выполняемая после имплантации микроспирали, обычно представляет собой простую анатомическую визуализацию, не подходящую для количественного анализа множественных повреждений, что крайне желательно для исследований VCID. В отличие от нее, представленная здесь игольчатая модель использует только шелковые швы и полностью совместима с любым видом МРТ in vivo. Это важно по двум причинам: (1) МРТ чрезвычайно чувствительна к небольшим поражениям головного мозга, микрокровоизлияниям или поверхностному сидерозу12, поэтому предпочтительнее других методов анализа, таких как компьютерная томография (2) МРТ in vivo должна быть предпочтительнее МРТ ex vivo , поскольку исследования VCID, несомненно, могут выиграть от отслеживания динамики прогрессирования/заживления поражений, особенно в ответ на предложенные новые методы лечения. Кроме того, функциональная (фМРТ) может быть выполнена на модели иглы, чтобы получить критическое представление о целостности нейроваскулярного взаимодействия в ответ на гипоперфузию головного мозга. Таким образом, возможность использования МРТ in vivo открывает возможности для углубленного анализа сложной корреляции между размером и расположением поражений и когнитивной функцией, а также нейроваскулярной связью, особенно в фармакодинамических исследованиях.
протокол
Все протоколы содержания животных были одобрены Комитетом по уходу за животными и их использованию в Университете Питтсбурга и выполнены в соответствии с Руководством Национальных институтов здравоохранения по уходу и использованию лабораторных животных. Стерильные методы должны поддерживаться во всех операциях по выживанию. В представленных экспериментах использовались двенадцатинедельные самцы мышей C57BL/6J с массой тела 25-30 г.
1. Подготовка материалов и рабочего пространства
- Подготовьте фрагменты иглы (длиной ~4 мм; 32 G для правой ОСА и 34 G для левой ОСА). Слегка притупите острый конец игл, осторожно постукивая острым концом по твердой поверхности, и аккуратно отделите иглы от пластиковых кусочков с помощью иглодержателя. Предварительно разрежьте 7-0 шелковых швов на кусочки длиной 1-2 см.
- Стерилизуйте хирургические инструменты, фрагменты игл и швы методом автоклавирования или любым другим подходящим методом.
2. Проведение операции
- Взвесьте мышь и наведите анестезию, поместив мышь на 2-3 минуты в камеру, проветриваемую 3% изофлураном в смеси 25%О2 и 72%Н2О.
- Поместите мышь вентральной стороной вверх на грелку, покрытую стерильным хирургическим листом для поддержания постоянной температуры тела (37 °C) и закрепите лицевую маску для вентиляции 1% изофлураном в смеси 25% O2 и 74% N2O. Закрепите конечности мыши клейкой лентой.
- Сбрейте шерсть на шее с помощью электробритвы. Очистите тонкие волоски с помощью клейкой ленты или пылесоса для клавиатуры.
- Продезинфицируйте место операции раствором бетадина (10% йода). Обеспечьте кожу антиоксидантным методом с помощью 70% этанола. Повторите дезинфекцию 3 раза. Убедитесь, что уровень анестезии достаточен за счет отсутствия реакции на сильное защемление пальца ноги (педальный рефлекс).
- Задрапируйте операционную область. Затем сделайте вертикальный разрез по средней линии вдоль трахеи и отделите двусторонние щитовидные железы микрощипцами. Оттяните кожу и ткани с помощью стерильных небольших кожных ретракторов.
- Под микроскопом с помощью наклонного пинцета осторожно обнажите и притупите одну из ОЦА от блуждающего нерва и оболочки. Используйте стерильную воду или фосфатно-солевой буфер (PBS) для увлажнения места разреза, если CCA имеет тенденцию прилипать к щипцам. При необходимости поместите небольшой пластиковый шприц под шею для поддержки осанки.
ПРИМЕЧАНИЕ: Будьте особенно осторожны, чтобы не разорвать CCA. - Проденьте три предварительно разрезанных фрагмента шелкового шовного материала (размер 7-0) под ОСА (на расстоянии 1 мм друг от друга) с помощью углового пинцета.
- Нарисуйте очень свободный двойной узел вокруг CCA на одном из фрагментов шва.
ПРИМЕЧАНИЕ: Смачивание места операции и швов стерильной водой или PBS может помочь с завязыванием узла. - Поместите фрагмент иглы (32 G для правой ОСА и 34 G для левой ОСА) параллельно ОСА, внутрь свободного узла (Рисунок 1А). Осторожно затяните первичный узел вокруг иглы и ОСА до тех пор, пока не прекратится кровоток, и закрепите его вторичным узлом. Сразу же вытащите иглу для восстановления частичного кровотока и обрежьте концы шва.
ПРИМЕЧАНИЕ: Хирург должен быть очень осторожным при обрезке концов швов после того, как узлы будут завязаны. Разрезание слишком близко к узлу может привести к ослаблению узла. Кроме того, очень важно соблюдать CCA после извлечения иглы, чтобы убедиться, что кровоток все еще разрешен ниже по течению от узла. Если ОСА выглядит очень бледным после удаления иглы, это означает, что ОСА перепрессована. - Повторите шаги 2.8-2.9 для2-й и3-й нитей шовного материала на одном и том же ОСА, примерно на расстоянии 1 мм друг от друга (рисунок 1В).
- Повторите шаги 2.6-2.10 с противоположным ОСА с использованием фрагмента иглы 32 G.
- Внимательно проверьте, эффективно ли перевязаны оба ОСА: убедитесь, что все три шовных бандажа надежно завязаны на месте, но не настолько туги, чтобы полностью блокировать кровоток (убедитесь, что ОСА не бледные ниже по течению от узлов). Убедитесь, что три полосы швов на каждом CCA находятся на расстоянии примерно 1 мм друг от друга.
- Закройте кожу с помощью стерильных монофиламентных швов.
- Сразу после операции введите 100-150 мкл кетопрофена (1 мг/мл запаса; 5 мг/кг массы тела) внутрибрюшинно, чтобы облегчить послеоперационную боль. Повторите эту инъекцию через 24 ч и 48 ч после операции.
- Поместите мышь на гомеотермическое одеяло при температуре 37 °C для непрерывного наблюдения в течение 2 часов перед возвращением животного в помещение для животных.
ПРИМЕЧАНИЕ: Для фиктивной процедуры шаги 2.7-2.12 должны быть опущены.
3. Валидация модели
ПРИМЕЧАНИЕ: Черепно-мозговая травма была проанализирована с помощью МРТ in vivo и дополнительно подтверждена с помощью окрашивания Luxol fast blue (LFB) и поведенческих тестов.
- Визуализация перфузии крови в головном мозге.
- Обезболивайте мышь с помощью 1-1,5% изофлурана. Простерилизуйте место операции раствором бетадина (10% йода). Затем дейодите кожу с помощью 70% этанола.
- Закрепите череп животного в стереотаксической рамке. Сделайте срединный провисающий разрез на волосистой части головы от лобной до затылочной кости, чтобы обнажить череп, и очистите поверхность черепа стерильным физиологическим раствором.
- Разместите камеру устройства с заряженной связью на высоте 10 см над черепом с помощью двумерной лазерной спекл-системы. Наденьте держатель зонда на место краниэктомии и надежно закрепите его.
- Сделайте снимки перфузии крови за 5 минут до операции и сразу после выпуска иглы или через 7, 14, 21, 28, 35 и 42 дня после операции.
- Закройте кожу с помощью стерильных монофиламентных швов. Введите 100-150 мкл кетопрофена (1 мг/мл запаса; 5 мг/кг массы тела) внутрибрюшинно, чтобы облегчить послеоперационную боль. Повторите эту инъекцию через 24 ч и 48 ч.
- В естественных условиях МРТ
- Обезболивайте мышей с использованием 1-1,5% изофлурана, постоянно контролируя дыхание и поддерживая температуру на уровне 37 °C теплым воздухом во время получения изображения.
- Выполняйте МРТ in vivo с помощью сканера 9,4 Тл, катушки Tx 86 мм и 4-канального приемника мозга мыши, работающего под управлением соответствующего программного обеспечения. После позиционирования и пилотного сканирования получите Т2-взвешенные изображения (T2WI) с использованием последовательности быстрого сбора данных с улучшением релаксации (RARE) со следующими параметрами: Время эхо-сигнала/время повторения (TE/TR) = 40/4 000 мс, средние значения = 8 256 × матрицей 256, 16 срезов с толщиной среза 0,5 мм, фактором RARE = 4 и полем зрения (FOV) 20 x 20 мм.
- Сбор данных диффузионно-тензорной визуализации (DTI) с использованием последовательности эхо-планарной визуализации (EPI)-DTI с использованием той же геометрии и параметров, что и T2WI, со следующими исключениями: TR/TE = 2 300/22 мс, матрица сбора данных = 128 x 128, 2 сегмента, 5 изображений A0 и 30 неколлинеарных диффузионных изображений, Δ/δ = 10/3 мс и b-значение = 1 000 с/мм2.
- Анализируйте данные DTI с помощью программного обеспечения DSI Studio (http://dsistudio.labsolver.org/) в поисках различий в параметрах диффузионных скаляров (фракционная анизотропия (FA), средняя диффузия (MD), осевая диффузия (AD) и радиальная диффузия (RD)). Нарисуйте области интереса (ROI) для мозолистого тела (CC), наружной капсулы (EC), внутренней капсулы (IC), фимбрии, передней спайки (AC), цингулума (Cing), гиппокампа (hippo), коры (C) и стриатума (Str) из обоих полушарий.
- Окрашивание Luxol fast blue (LFB)
- Подготовьте срезы мозга: зафиксируйте мозг 4% PFA на 24 часа, а затем погрузите мозг в 30% сахарозу до тех пор, пока мозг не опустится. Встройте мозг в ОКТ-соединение на сухой лед. Разрежьте корональный срез мозга толщиной 20 мкм на скользящем микротоме. Храните срезы мозга в хранящем растворе (30% глицерина/30% этиленгликоля в PBS).
- Погрузите срезы мозга в LFB (0,1% спиртовой раствор), держите при температуре 56 °C в течение ночи и промойте дистиллированной водой.
- Инкубируйте участки мозга в 0,05% карбонате лития и обезвоживайте с помощью дифференцированных спиртов.
- Окрашивать срезы 0,5% крезилфиолетовым в течение 5 мин, дифференцированным с 70% этанолом.
- Закрепите окрашенные участки мозга с помощью монтажного носителя.
- Оценка когнитивных функций с помощью модифицированного теста Морриса в водном лабиринте
- Наполните круглый резервуар водой (25 °C, глубина 33 см) и погрузите квадратную платформу ~10 x 10 см2 из плексигласа на 1,2 см ниже уровня воды, на 31 см от северного, восточного, южного или западного края бассейна.
ПРИМЕЧАНИЕ: Эта платформа должна оставаться на одном и том же месте в течение всего времени тестирования. - Включите потолочную видеокамеру. Поместите мышь в аквариум (не капайте и не отпускайте на уровне воды), лицом к стене и начиная с северо-востока, юго-востока, юго-запада или северо-запада. Позвольте мыши плавать не более 90 секунд, чтобы найти затопленную платформу.
- Дайте мыши оставаться на погруженной платформе в течение 30 секунд, если платформа найдена. Если платформа не найдена, поместите туда мышь на 30 секунд.
- Дайте мышке отдохнуть в течение 5 минут и повторите плавательное испытание (шаги 3.4.2 - 3.4.3) 2 раза.
- Вытрите мышь насухо куском ткани и верните ее обратно в клетку под нагревательной лампочкой.
- Повторяйте три попытки плавания каждый день в течение 5 дней подряд.
- Используя видеоматериалы, рассчитайте задержку для выхода (сколько времени требуется для поиска платформы в каждой пробной версии).
- В последний день тестирования снимите платформу и запишите время, которое мышь проводит в квадранте, где ранее находилась платформа.
- Наполните круглый резервуар водой (25 °C, глубина 33 см) и погрузите квадратную платформу ~10 x 10 см2 из плексигласа на 1,2 см ниже уровня воды, на 31 см от северного, восточного, южного или западного края бассейна.
Результаты
Длительная асимметричная гипоперфузия головного мозга
Кровоток ОСА измеряли до и сразу после освобождения иглы от последней (третьей) лигирования, как описано ранее11. Кровоток был снижен на ~70% в левой ОСА и на ~50% в правой ОСА. Перфузия крови в мозге динамически контролировалась с помощью двумерного лазерного спекла. Операция вызвала церебральную гипоперфузию в обоих полушариях, причем левое полушарие было поражено сильнее (Рисунок 2). Церебральная гипоперфузия сохраняется в течение как минимум 24 недель после операции11.
Снижение смертности
Выживаемость самцов мышей в течение 6 недель составила 81,6% (Рисунок 3); Мыши были более склонны к смерти в первую неделю после операции.
Выявление черепно-мозговой травмы на МРТ in vivo
На Т2-взвешенных изображениях были выявлены гипо- или гиперинтенсивные области в гиппокампе (Hippo), внешней капсуле (EC), внутренней капсуле (IC), мозолистом теле (CC) и стриатуме (Str) у мышей, подвергшихся операции ABCS, что указывает на повреждение головного мозга (рис. 4A). Структурные повреждения наблюдались на картах направленно кодируемых цветов (DEC) DTI мышей ABCS по сравнению с имитацией (рис. 4B).
Количественный анализ показал, что мыши ABCS показали значительно более низкую фракционную анизотропию (FA) в левом бегемоте, IC, передней спайке (AC), цингулуме (Cg) и Fimbria (Fi) по сравнению с симуляцией (P < 0,05 по сравнению с симуляцией), что указывает на нарушение микроструктуры белого вещества в левом полушарии (верхняя левая панель, рисунок 4C). FA в правой Cg и Fi у мышей ABCS также были снижены (P < 0,05 против фикции). FA в левой IC и Fi были значительно ниже, чем у правых мышей ABCS (P < 0,05, левая против правой).
Аналогичным образом, значительно более низкая осевая диффузия (AD) была продемонстрирована в левой EC, IC, Str и Fi у мышей ABCS по сравнению с симуляцией, что указывает на повреждение аксонов (верхняя правая панель, рисунок 4C (P < 0,05 против симуляции)). Только левая Str показала снижение средней диффузии (MD) у мышей ABCS по сравнению с симуляцией (нижняя левая панель, рисунок 4C). Разница в радиальной диффузии (RD) наблюдалась в левом CC, Str и Fi у мышей ABCS (нижняя правая панель, рисунок 4C), что свидетельствует о воспалении и увеличении клеточности в этих областях13.
Асимметричное повреждение головного мозга в двух полушариях и повреждение областей белого вещества в левом полушарии
Черепно-мозговую травму дополнительно анализировали с помощью окрашивания LFB с использованием процедуры, описанной ранее14 (рис. 5). Изображения с более низкой мощностью показали более светло-голубое окрашивание в EC и Str, что указывает на демиелинизацию в этих областях. Изображения высокой четкости показали, что у фиктивных мышей наблюдались хорошо организованные и миелинизированные аксоны с линейно-ориентированными олигодендроцитами в ЭК; однако аксоны исчезли, и в ЭК у мышей ABCS наблюдались повсеместные, окрашенные в синий цвет клетки. У фиктивных мышей были обнаружены глубоко окрашенные в синий цвет и хорошо организованные структуры пучков волокон в Str. Однако пучки волокон окрашивались светлее и мельче, и их целостность была нарушена; некоторые пучки волокон были вакуумированы у мышей ABCS. Пучки волокон были искажены, а межпучковая матрица была значительно утолщена в АК у мышей ABCS. Таким образом, хирургия ABCS вызывает демиелинизацию и повреждение аксонов; Повреждение белого вещества происходит в основном в левом полушарии.
Дисфункция обучения и памяти
Операция с использованием иглы ABCS привела к значительной неспособности к обучению, о чем свидетельствует увеличенное время нахождения погруженной платформы (задержка для побега) во время испытания водного лабиринта Морриса (Рисунок 6). Эта инвалидность сохранялась в течение как минимум 24 недель после операции. Память также была значительно затронута, о чем свидетельствует уменьшение времени, проведенного в целевом квадранте после удаления платформы.
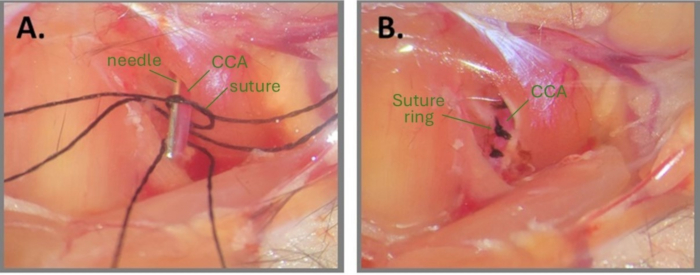
Рисунок 1: Этапы игольчатой хирургии для создания ABCS. (A) Левая ОСА обнажается, и под ОСА продеваются три шелковых шва. На одном из фрагментов шовной нити натягивается свободный узел, и игла располагается параллельно ОСА. (B) Три шовных кольца расположены на расстоянии примерно 1 мм друг от друга. Сокращения: ABCS = асимметричный двусторонний стеноз общей сонной артерии; CCA = общая сонная артерия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Стойкая асимметричная церебральная гипоперфузия в модели ABCS иглой. Динамический мониторинг мозгового кровотока после операции. Стойкая церебральная гипоперфузия может наблюдаться в обоих полушариях, будучи более глубокой в левом полушарии. Черными звездочками обозначены участки гипоперфузии. Аббревиатура: ABCS = асимметричный двусторонний стеноз общей сонной артерии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Выживаемость после операции с помощью иглы ABCS. Операция привела к выживаемости 81,6% в течение 6 недель; Смерть наступила в основном в течение первой недели после операции. Аббревиатура: ABCS = асимметричный двусторонний стеноз общей сонной артерии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
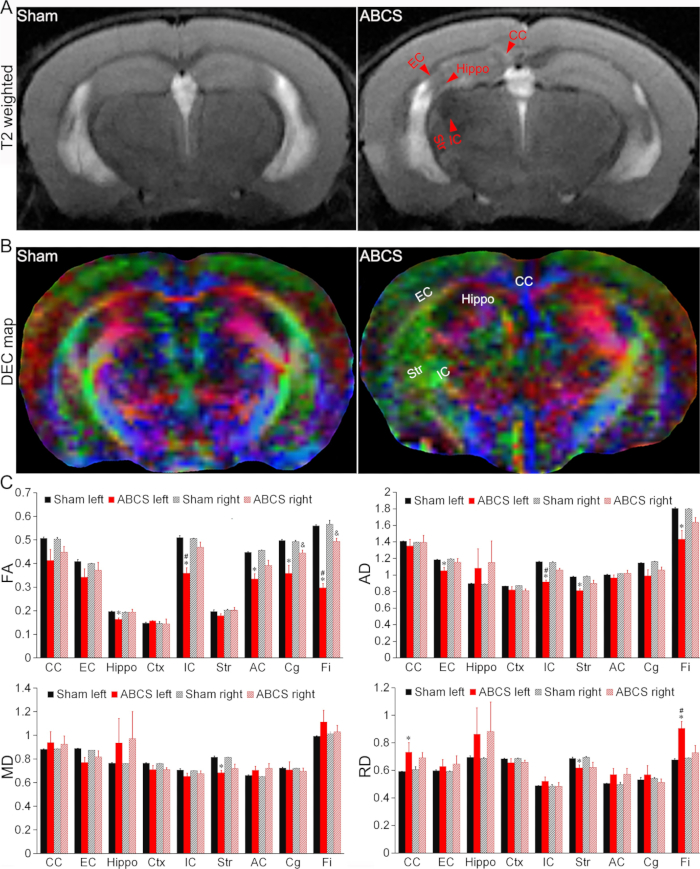
Рисунок 4: Обнаружение повреждения головного мозга на МРТ in vivo в модели игольчатой ABCS. (A) Репрезентативные Т2-взвешенные изображения от фиктивных мышей и мышей ABCS. Красными стрелками обозначены гипо- или гиперинтенсивные области. (B) Репрезентативная карта DEC in vivo DTI через 2 недели после операции с помощью иглы ABCS. Цвета указывают направленность главной оси диффузии (красный = левый/правый, зеленый = дорсальный/вентральный, а синий = ростральный/каудальный). (C) Количественный анализ на мышах с фиктивной и ABCS (односторонняя ANOVA). * представляет p < 0,05 ABCS по сравнению с симуляцией (левое полушарие). # представляет p < 0.05 влево против правых. & представляет p < 0,05 ABCS по сравнению с симуляцией (правое полушарие). Данные представлены в виде среднего значения ± SEM; n = 4 для фиктивных, n = 4 для мышей ABCS. Сокращения: ABCS = асимметричный двусторонний стеноз общей сонной артерии; Гиппотамп = гиппокамп; EC = внешняя капсула; IC = внутренняя капсула; CC = мозолистое тело; Str = стриатум; DEC = направленно закодированный цвет; DTI = диффузионно-тензорная визуализация; FA = дробная анизотропия; MD = средняя диффузионность; AD = осевая диффузия; RD = радиальная диффузия. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
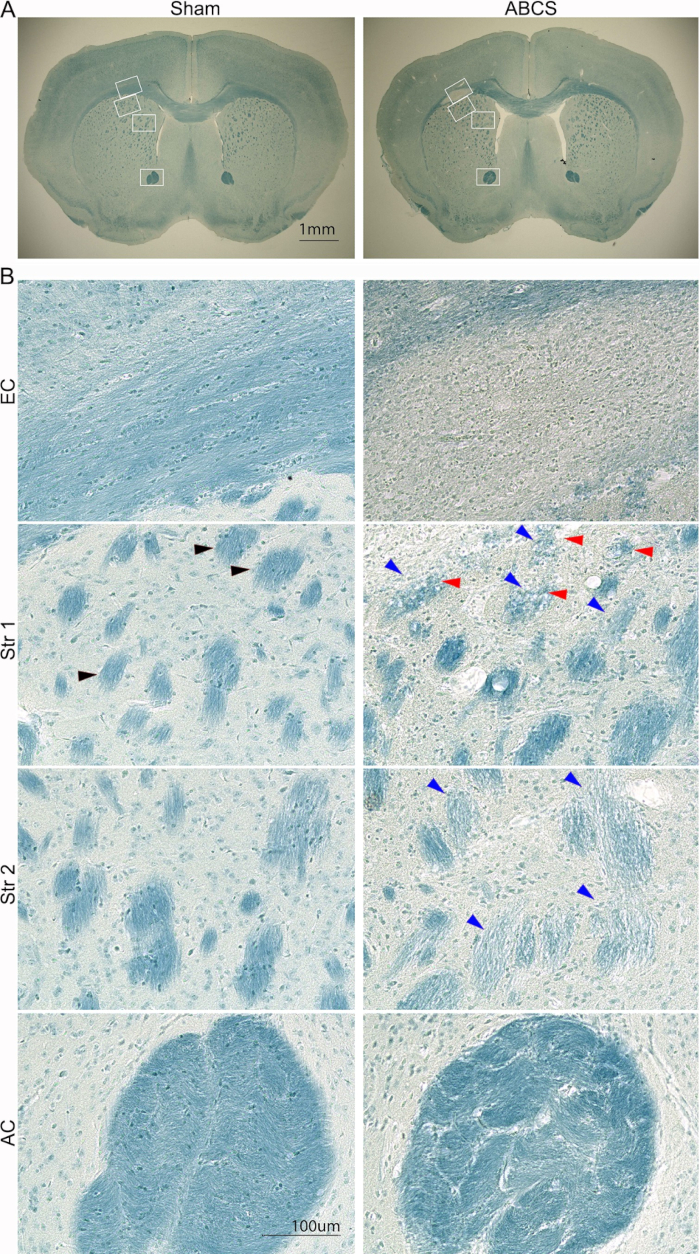
Рисунок 5: Типичное окрашивание LFB срезов мозга через 6 недель после операции с помощью иглы ABCS. (A) Маломощные изображения окрашивания LFB от фиктивных мышей и мышей ABCS. Белые прямоугольники обозначают расположение, соответствующее изображениям более высокой четкости в B. (B) Изображения высокой четкости (200x) из EC (верхняя панель) и Str позиций 1 и 2 (средняя панель) и AC (нижняя панель). Черная стрелка показывает нормальный пучок волокон. Синие стрелки указывают на поврежденный пучок волокон. Красные стрелки обозначают вакуолизированные волокна. Масштабные линейки = 1 мм (А), 100 мкм (В). Сокращения: ABCS = асимметричный двусторонний стеноз общей сонной артерии; LFB = Luxol быстрый синий; EC = внешняя капсула; Str = стриатум; AC = передняя спаечная масса. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
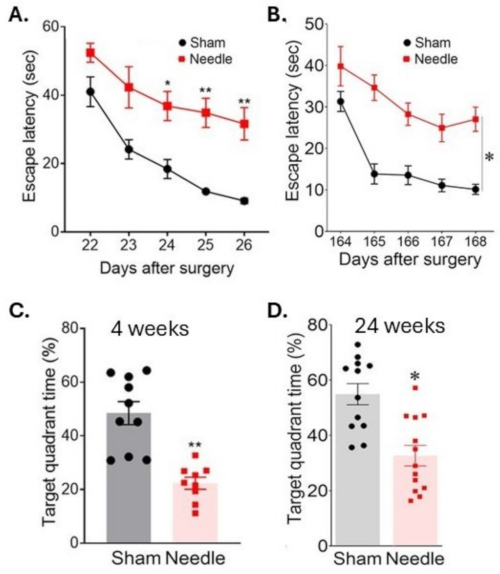
Рисунок 6: Пространственное обучение и оценка памяти в тесте водного лабиринта. Пространственное обучение оценивалось (А) через 3 недели и (В) через 24 недели после операции путем измерения времени определения местоположения платформы в течение нескольких дней подряд. Память оценивали (C) через 4 недели и (D) через 24 недели после операции путем измерения времени, проведенного в целевом квадранте после удаления платформы. Операция привела к долговременному нарушению когнитивных функций. Данные были выражены как среднее значение ± SEM, *p < 0,05 иглы по сравнению с фикцией; **p < 0,01 против фикции; двухсторонняя ANOVA и Neuman-Keuls post hoc. n = 10 для фиктивных, n = 10 для игольчатых групп. Эта цифра была изменена по Weng et al.11. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Обсуждение
Было описано несколько методов индукции VCID с использованием асимметричного стеноза CCA, и все они имеют важное и решающее хирургическое вмешательство в изоляцию CCA от блуждающего нерва, а также оболочку и обнажение CCA для обеспечения его доступности для стеноза. Несмотря на то, что мы предоставляем высококачественные визуальные рекомендации по хирургическому воздействию ОСА перед лигированием, мы также хотели бы порекомендовать исследователям посмотреть дополнительные видеоролики об изоляции ОСА, которые доступны в Интернете в контексте других операций на мышах и крысах 15,16,17,18. Следует соблюдать особую осторожность, чтобы не сдавить или не разорвать ОСА, так как это основная артерия, снабжающая мозг насыщенной кислородом кровью.
Еще одним важным этапом операции, который необходимо освоить, является затягивание свободного узла и дальнейшее затягивание его вокруг ОСА с помощью иглы с последующим удалением иглы. Мы настоятельно рекомендуем практиковать этот шаг только с иглой, прежде чем пытаться выполнить его на мышах под наркозом. Это позволит освоить тонкие движения щипцами и отточить манипуляции со швами без риска поранить мышь. Узел должен быть хорошо закреплен, не разваливаться во время извлечения иглы, достаточно тугим, чтобы удерживать иглу, но достаточно свободным, чтобы иглу можно было отодвинуть от завязанного шва с помощью щипцов.
Важно отметить, что мы обнаружили, что одного лигирования каждого ОСА недостаточно для надежного снижения кровотока и поддержания долгосрочной церебральной гипоперфузии11. Одним из возможных объяснений может быть то, что однократное лигирование вызывает точечный стеноз, который, вероятно, вызовет локальное повышение давления, что приведет к увеличению скорости кровотока, чтобы компенсировать снижение кровотока. Мы рекомендуем выполнять три лигации на расстоянии ~1 мм друг от друга, чтобы создать фрагмент стеноза. Дополнительным преимуществом использования трех лигаторов является то, что узлы служат в качестве защитного механизма на случай, если один из узлов ослабнет во время дополнительного удаления иглы. Действительно, фрагмент стеноза, вызванный тремя отдельными лигациями одного и того же CCA, увеличивает согласованность модели, что приводит к стойкой гипоперфузии головного мозга примерно у 90% мышей. Более того, фрагментный стеноз более точно имитирует стеноз CCA, вызванный атеросклерозом у пациентов по сравнению со стенозом фокальной точки, что повышает клиническую значимость игольчатой модели.
Мы настоятельно рекомендуем незамедлительно удалить иглу после окончания первой лигации, чтобы убедиться, что кровоток ОСА частично восстановился, и только после этого последовательно переходить ко второй и третьей лигациям. Не рекомендуется заканчивать все три лигирования иглой внутри всех трех узлов, так как это значительно увеличит время полного обструкции кровотока. Как правило, мы не рекомендуем проводить более 1 минуты полной окклюзии CCA перед удалением иглы. Эта рекомендация основана на сообщении о том, что у мышей не было признаков каких-либо функциональных нарушений после 3 сеансов 60-секундной окклюзии обоих CCA19. В нашей модели хирург работает над одним ОСА за раз, что более щадяще, чем одновременная окклюзия обоих ОЦА, но мы все же рекомендуем следовать этому графику, чтобы исключить любые артефакты, вызванные длительной окклюзией, а не хронической гипоперфузией с обеих сторон.
В то время как эта модель иглы позволяет регулировать диаметры узловатых швов с помощью игл различного диаметра (в зависимости от массы тела или конкретных требований к ограничению кровотока), по нашему опыту, мыши имели более высокие показатели выживаемости, когда гипоперфузия в правом полушарии была умеренной, а не тяжелой. С другой стороны, стойкая тяжелая гипоперфузия в левом полушарии приводила к долгосрочным патологическим и неврологическим исходам. Таким образом, мы рекомендуем выполнять асимметричное лигирование с использованием более толстой иглы для перевязки правой ОСА (вызывающей умеренную гипоперфузию в правом полушарии) и более тонкой иглы для перевязки левой ОСА (вызывающей сильную гипоперфузию в левом полушарии).
Наконец, исследователи должны знать, что различные линии мышей могут вызывать различные исходы ишемического или травматического повреждения, в основном из-за различий в анатомии сосудов головного мозга 20,21. Поскольку многие исследования в настоящее время требуют создания новых трансгенных мышей, фоновая деформация должна быть тщательно рассмотрена, если требуется хирургическое вмешательство BCAO на любой стадии экспериментального плана. Например, штаммы C57BL/6 и SV129 являются распространенным фоновым выбором для создания трансгенных животных для исследований инсульта21. Тем не менее, было хорошо задокументировано, что мыши C57BL/6 гораздо более чувствительны к ишемии по сравнению с другими протестированными штаммами, включая мышей SV129 20,21. На самом деле, есть доказательства того, что эффект мышиного штамма может быть даже более важным, чем эффект метода, используемого для индукции VCID21. Таким образом, становится критически важным поддерживать постоянный фон мыши на протяжении всех экспериментов, связанных с индуцированием ишемического повреждения мозга у грызунов. Важно отметить, что исследователи могут оценить эффективность результатов операции у живых животных, используя неврологические системы оценки22 с оценкой 0,5 в качестве критерия включения. Повреждение головного мозга может быть дополнительно подтверждено с помощью иммуноокрашивания Iba1, который очень чувствителен к повреждению мозга даже после незначительного очагового повреждения.
Подводя итог, важно помнить, что СКИ — это сложный термин, объединяющий множество клинических представлений и причин под одним зонтиком. Поэтому исследователи всегда должны помнить о том, какую модель следует выбирать, исходя из тех аспектов VCI, которые они хотели бы изучить. Никогда не может быть единой универсальной модели для всех проявлений ЛИК. Модели стеноза CCA сильно ограничивают кровоток от основных артерий, тем самым имитируя пациентов с атеросклеротическим стенозом. Новый игольчатый метод создания асимметричных BCAS у мышей C57BL/6J является надежным методом имитации VCID, который имеет ряд преимуществ по сравнению с ранее описанными методами (в частности, высокая гибкость, низкая смертность, долгосрочные результаты, минимальная стоимость и мониторинг МРТ в реальном времени). Благодаря своим преимуществам по сравнению с другими моделями, он может быть использован для дальнейшего углубления наших знаний о прогрессировании ВКИД, а также служить основой для скрининга потенциальных терапевтических агентов для лечения или замедления прогрессирования ВКИД. Как и другие описанные методы BCAS, модель иглы требует продвинутых хирургических навыков, которые могут быть освоены со временем, используя эту визуальную демонстрацию в качестве руководства.
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Этот проект был поддержан грантами Национальных институтов здравоохранения/NINDS RF1NS117509 (Г. Цао) и грантами VA Merit Review BX003923 и BX006454 (Г. Цао).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
Ссылки
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49 (2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92 (2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472 (2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124 (2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены