Method Article
Идентификация инфицированных EcoHIV клеток у трансгенных мышей, манипулируемых микроглией
В этой статье
Резюме
В этом протоколе описывается, как комбинация инфекции EcoHIV с мышами Tmem119-EGFP предлагает ценную биологическую систему для исследования изменений микроглии и вирусных резервуаров в моделях нейрокогнитивных расстройств, ассоциированных с ВИЧ, у грызунов.
Аннотация
Комбинированная антиретровирусная терапия (АРТ) значительно улучшила качество жизни людей, живущих с ВИЧ (ЛЖВ). Тем не менее, более 4 миллионов ЛЖВ старше пятидесяти лет сталкиваются с ВИЧ-ассоциированными нейрокогнитивными расстройствами (РУК). Чтобы понять, как ВИЧ влияет на центральную нервную систему, необходима надежная и осуществимая модель ВИЧ. Ранее на модели крысы была разработана новая биологическая система с использованием химерной инокуляции ВИЧ (EcoHIV) для исследования нейрокогнитивных нарушений и синаптической дисфункции. Тем не менее, остается серьезной проблемой прояснение нейроанатомического распределения EcoHIV, в частности, его дифференциальной экспрессии в различных типах клеток мозга. В текущем исследовании EcoHIV с флуоресцентным мечением mScarlet был модифицирован и ретроорбитально введен мышам Tmem119-EGFP (которые экспрессируют усиленный зеленый флуоресцентный белок в основном в микроглии), чтобы определить, являются ли микроглии основным типом клеток, ответственным за экспрессию вируса и резервуары ВИЧ в мозге. Текущие данные показывают, что: (1) in vitro флуоресцентные сигналы EcoHIV-mScarlet были преимущественно локализованы в микроглиеподобных клетках среди первичных клеток мозга грызунов; (2) in vivo инъекция EcoHIV-mScarlet мышам Tmem119-EGFP индуцировала значительную экспрессию ВИЧ в мозге мыши. Ко-локализация сигналов mScarlet и EGFP позволяет предположить, что микроглия является основным типом клеток, несущих ВИЧ в мозге. В целом, EcoHIV у грызунов предлагает ценную биологическую систему для изучения изменений микроглии, вирусных резервуаров в мозге и неврологических механизмов нейрокогнитивных расстройств, связанных с ВИЧ.
Введение
Несмотря на огромную пользу от антиретровирусной терапии, люди, живущие с ВИЧ (ЛЖВ), по-прежнему испытывают нейрокогнитивные расстройства. Чтобы лучше понять нейронные механизмы ВИЧ-ассоциированного нейрокогнитивного расстройства (РУК), существует острая потребность в моделях ВИЧ для дальнейшего выяснения участия конкретных типов клеток в NeuroHIV.
Трансгенная крыса с ВИЧ-1, которая подвергается конститутивному воздействию вирусных белков ВИЧ-1, является популярной моделью грызунов, используемой для исследования нейрокогнитивных расстройств 1,2,3,4 и нейроанатомических изменений 5,6,7, связанных с КИЛД. Функциональная делеция доменов gag и pol предотвращает репликацию вируса, что делает трансгенную крысу с ВИЧ-1 незаразной 8,9. Недавно Potash et al. 10 сообщили о модели химерной инфекции ВИЧ (EcoHIV) у мышей, а затем распространили ее на крыс, что может быть полезно для дальнейших исследованийрасстройств, связанных с употреблением психоактивных веществ. В этой новой биологической системе наблюдалась системная инфекция ВИЧ-1 наряду со многими клиническими особенностями ВИЧ-1 у людей, включая вовлечение лимфоцитов и макрофагов, противовирусные иммунные реакции, нейроинвазивность и воспаление мозга.
Микроглия играет важную роль в поддержании функции мозга и гомеостаза в качестве специализированных макрофагов мозга. Чтобы отличить микроглию от близкородственных типов клеток (например, моноцитов крови, периваскулярных макрофагов, менингеальных макрофагов), в текущем исследовании использовалась линия мышей Tmem119-EGFP. В предыдущих исследованиях сообщалось, что трансмембранный белок 119 (Tmem119) проявляет исключительно специфичный для микроглии паттерн экспрессии в тканях мозга грызунов и человека 12,13,14,15. Сигнал EGFP у мышей Tmem119-EGFP наблюдался по всему мозгу и локализовался специфически в клетках микроглии.
В настоящем исследовании мышам Tmem119-EGFP были инокулированы вирус EcoHIV-mScarlet, и были идентифицированы клетки, положительные на EcoHIV в центральной нервной системе. В данной статье мы представляем протокол инокуляции EcoHIV-mScarlet у мышей Tmem119-EGFP , обеспечивающий надежную модель терапевтического воздействия на микроглиальные изменения при ВИЧ.
протокол
Комитет по уходу за животными и их использованию при Университете Южной Каролины утвердил все протоколы для животных (федеральный номер гарантии: D16-00028). Все эксперименты строго следовали рекомендациям, установленным Национальными институтами здравоохранения в Руководстве по уходу за лабораторными животными и их использованию. Мышей Tmem119-EGFP (возраст 30 дней, самец, масса тела 23-26 г) были получены из коммерческого источника и размещены в помещениях, аккредитованных AAALAC. Все животные содержались по 12-12-часовому циклу свет-темнота со свободным доступом к пище и воде. Подробная информация о животных, реагентах и оборудовании, использованных в этом исследовании, приведена в Таблице материалов.
1. Упаковка EcoHIV-mScarlet в ячейки 293FT
- Инкубируйте ячейки размером 293 фута в колбе 75 см2 с желатиновым покрытием. Поддерживайте рост клеток до 30% сливаемости при трансфекции.
- Проводят трансфекцию плазмидной ДНК (15 мкг) EcoHIV-mScarlet (Дополнительный файл 1) с использованием Липофектамина 3000 (22,5 мкл) в соответствии с инструкциями производителя (см. Таблицу материалов).
- Культивируют клетки в среде DMEM с 10% сывороткой FBS в течение 3 суток при 37 °С.
- Собирают условную среду с вирусной суспензией. Центрифуга при 500 × г в течение 10 мин при 4 °C. Перенесите надосадочную жидкость с помощью пипетки объемом 10 мл в стерильную пробирку объемом 50 мл.
- Добавьте в вирусную смесь определенное количество концентратора Lenti-x (в соотношении 1:3) (например, 8 мл концентратора на 24 мл вирусной смеси). Аккуратно переверните трубку пять раз.
- Смесь концентратора вирус-ленти выдерживают при температуре 4 °C в течение 2 дней. Центрифуга при 1 500 × г, 45 мин, 4 °C. Осторожно удалите надосадочную жидкость как можно больше с помощью пипетки.
- Повторно суспендируйте гранулу с предварительно охлажденным 200 мкл 100 мМ PBS. Храните вирус при температуре -80 °C.
Примечание: Детали упаковки EcoHIV-mScarlet в клетках размером 293FT были описаны в нашем предыдущем исследовании16. Не делайте вихрей и не вводите пузырьки воздуха в вирусный раствор.
2. Инфекция EcoHIV-mScarlet в первичных клетках мозга крыс
- Провести первичную изоляцию клеток мозга из плодов крыс (18 дней) в соответствии с ранее опубликованным отчетом16.
- Перенесите диссоциированные клетки в 12-луночные планшеты с предварительно покрытым поли-L-лизином покрытием со стеклянными вставками, содержащими 1 мл среды DMEM/F12 плюс 10% FBS. Замените среду на следующий день на нейробазальную среду добавкой B27.
- Культивируйте первичные клетки мозга плода в инкубаторе с 5% содержаниемCO2 в течение 3 недель.
- Добавьте в питательную среду EcoHIV-mScarlet (60 μл, 1,26 ×10 6 ТЕ/мл). Инкубируйте культивируемые клетки мозга с помощью EcoHIV-mScarlet в течение 6 дней.
- Зафиксируйте клетки 4% PFA и выполните иммуноокрашивание инфицированных клеток мозга с использованием специфических первичных антител (CD11b/c, Iba1).
- Получение изображений с использованием объектива 40× в системе конфокальной микроскопии.
3. Инфекция вируса EcoHIV-mScarlet в первичных клетках глии взрослых мышей
- Обезболить взрослых мышей 5% севофлураном в течение 5 минут (в соответствии с утвержденными в учрежденном учреждении протоколами). Простерилизовать кожу головы с помощью 70% EtOH.
- Убедившись, что мышь больше не реагирует на вредные раздражители, используйте стерилизованные заточенные ножницы для обезглавливания. Переложите голову в новую чашку Петри, наполненную 5 мл HBSS.
- Вскрыть кожу головы и перенести мозговую ткань в другую чашку Петри, содержащую 5 мл стерилизованного HBSS. Снимите мозговые оболочки и перенесите лобную кору в 2 мл HBSS.
- Добавьте в смесь 20 мкл 0,25% трипсина-ЭДТА. Выдерживать в течение 15 мин при комнатной температуре; Аккуратно поворачивайте трубку каждые несколько минут.
- Диссоциированные клетки перенесите в колбу 75 см2 с предварительно покрытым поли-L-лизином, содержащую 10 мл среды DMEM/F12 и 10% FBS.
- Культивирование клеток при 37 °C, 5%CO2 в инкубаторе, до 90% конфлюенции. Расщепляйте клетки мозга с помощью 2 мл 0,25% трипсина-ЭДТА.
- Субкультивировать клетки мозга в чашки со стеклянным дном диаметром 35 мм, содержащие 5 мл питательной среды DMEM/F12 до 80% конфлюенции.
- Добавьте в питательную среду EcoHIV-mScarlet (8 μл, 1,26 ×10 6 МЕ/мл). Инкубируйте глиальные клетки мыши в течение 2 дней.
- Ежедневно проверяйте красные (mScarlet) флуоресцентные сигналы под флуоресцентным микроскопом.
4. Ретроорбитальная инъекция вируса EcoHIV-mScarlet мышам Tmem119-EGFP
- Используйте 3% севофлуран для обезболивания мышей Tmem119-EGFP (как самцов, так и самок в возрасте 30 дней) до тех пор, пока они не перестанут реагировать на вредные раздражители.
- Закрепите мышей в боковом положении так, чтобы глаз для инъекции был направлен вверх, а дыхание осуществлялось через носовой конус, который подключен к системе анестезии. Используйте носовой конус соответствующего размера для обеспечения непрерывной анестезии.
- Разморозьте EcoHIV-mScarlet на льду. Залейте вирусный раствор во внутриглазной инъекторный шприц с тупой иглой 33 G.
- Поместите мышь в правое боковое положение лежа и держите ее голову лицом влево. Определите расположение медиального кантуса в качестве места инъекции.
- После проптозации глаза медленно и осторожно введите иглу (под углом 45 градусов) в медиальный кантус глаза. Осторожно введите иглу вперед в сосуды за глазным яблоком (ретроорбитальный синус).
- Осторожно введите 6,5 мкл EcoHIV-mScarlet (1,26 ×10 6 TU/мл, двусторонняя инокуляция глаза) в ретроорбитальный синус. Осторожно извлеките иглу из ретроорбитального синуса и аккуратно надавите на веки, чтобы обеспечить гемостаз.
- Нанесите лубрикант на глаз, чтобы предотвратить высыхание роговицы или травмирование.
- Дайте мышам прийти в себя в камере восстановления с грелкой, пока они не проснутся.
ПРИМЕЧАНИЕ: Скос иглы не должен располагаться слишком глубоко, чтобы не разорвать артерии или не сломать кости. Время инфузии вируса зависит от множества факторов (например, объема инъекции, титра, размера животного). Для инфузии вируса EcoHIV значительная экспрессия наблюдалась через неделю после ретроорбитальных инъекций 11,16,17.
5. Визуализация срезов тканей мозга
- Глубоко обезболить мышей с помощью 5% севофлурана. Перейдем к шагу 5.2, когда мыши не проявляют никакой реакции на вредные раздражители и рефлексы отсутствуют.
- Держите мышей в лежачем положении внутри вытяжного шкафа для химикатов.
- Раскройте кожу вдоль средней линии грудной клетки. Отделите диафрагму и откройте грудную клетку ножницами.
- Введите иглу 22 G1 1/2 в левый желудочек. Откройте правое предсердие ножницами.
- Перфузируйте 50 мл предварительно охлажденного 100 мМ PBS. Проведите 100 мл предварительно охлажденного 4% параформальдегидного буфера16.
- Удаляем весь мозг мыши16.
- Закрепите на ночь с 4% параформальдегидом.
- Закрепите мозговую ткань с помощью тканевого клея на металлической платформе вибратома. Вырезать коронковые участки толщиной 50 мкм лезвиями из углеродистой стали.
- Поместите срезы мозга на предметные стекла с помощью кисти. Немедленно добавьте 0,1 мл монтажной среды, предотвращающей выцветание, в каждую секцию.
- Наденьте покровное стекло размером 22 мм x 50 мм на мозговые секции. Просушите супер-морозные горки в темноте в течение 1 суток.
- Сконфигурируйте систему конфокального микроскопа с увеличением 60× (A/1,4, масло) и установите интервал в Z-плоскости 0,15 мкм с размером точечного отверстия 30 мкм и радиусом обратного проекции точечного отверстия 167 нм.
- Используйте длины волн 488 нм и 594 нм для получения многоканальных изображений интересующих областей мозга.
Результаты
Фрагмент mScarlet (1858.н.), содержащий энзимные сайты "Cla1" на 3'-конце и "Not1" на 5'-конце, был вставлен в лентивирусный вектор pNL4-3-EcoHIV (рис. 1). Для подтверждения экспрессии EcoHIV-mScarlet первичные клетки мозга, выделенные из коры эмбрионов E18 крыс, обрабатывали EcoHIV-mScarlet (60 μл, 1,26 × 106 TU/мл) в течение 6 дней in vitro. Данные на рисунке 2 показали, что красные флуоресцентные сигналы mScarlet в основном локализованы в глиальных типах клеток на основе различной морфологии клеток. Кроме того, мечение CD11b/c и Iba1 (клеточные маркеры микроглии) показало, что сигналы mScarlet были колокализованы с клетками CD11b/c + и/или Iba1+. Данные показали, что микроглия является основным типом клеток распределения EcoHIV-mScarlet in vitro. В культивируемых клетках не было выявлено значительной нейрональной инфекции (дополнительный рисунок 1).
Затем инфекция EcoHIV-mScarlet была протестирована на первичных смешанных глиальных клетках взрослых мышей. Для этого клетки смешанной глии сначала выделяли и очищали от взрослых мышей (2 месяца) и инфицировали EcoHIV-mScarlet (8 μл, 1,26 × 106 TU/мл) в течение 2 дней. Изображения на рисунке 3 показали, что EcoHIV-mScarlet успешно заразил взрослую мышиную глию.
Для дальнейшего изучения характера распределения EcoHIV-mScarlet в мозге мыши, в частности, для идентификации инфицированного типа клеток, EcoHIV-mScarlet вводили ретроорбитально в мышиную линию Tmem119-EGFP , в которой микроглия была специфически помечена сигналами EGFP без каких-либо других типов конфликтов макрофагов5. Результаты на рисунке 4 (также на дополнительном рисунке 2) показывают, что сигналы красной флуоресценции mScarlet наблюдались в EGFP-положительных клетках, что позволяет предположить, что микроглия является основным типом клеток экспрессии EcoHIV в мозге мышей.
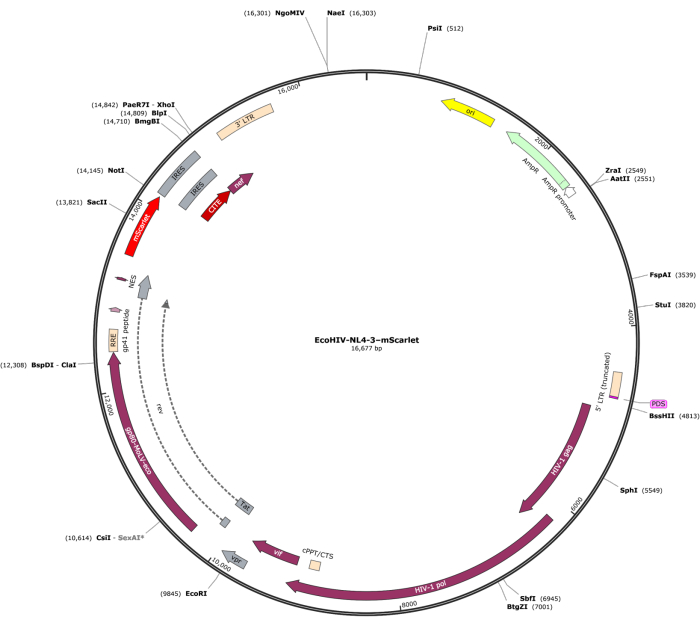
Рисунок 1: Векторная карта EcoHIV-NL-4-3-mScarlet. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
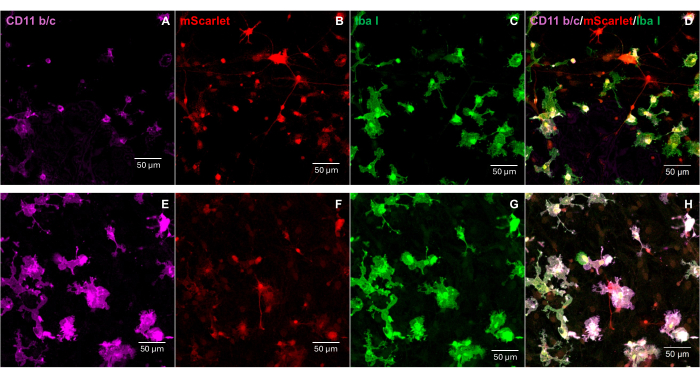
Рисунок 2: Инфекция EcoHIV-mScarlet в первичных клетках мозга крыс. (A,E) Репрезентативные изображения окрашивания CD11b/c в первичных клетках мозга. Клетки мозга были выделены из эмбрионов крыс E18 и инфицированы вирусом EcoHIV-mScarlet в течение 6 дней. (В,Ж) Репрезентативные изображения флуоресцентных сигналов mScarlet от клеток мозга in vitro . (С,Г) Репрезентативные изображения окрашивания Iba1 в первичных клетках мозга. (Д,Н) Объединены изображения тройной мечения CD11b/c, mScarlet и Iba1. Масштабные линейки: 50 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
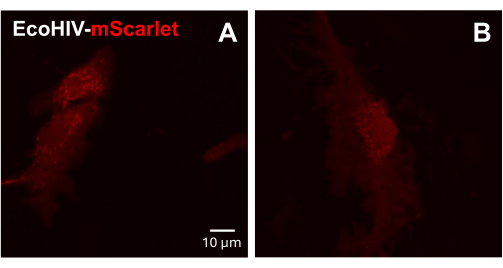
Рисунок 3: Инфекция EcoHIV-mScarlet в первичных смешанных глиальных клетках мыши. (A,B) Репрезентативные конфокальные изображения распределения mScarlet in vitro. Первичные клетки смешанной глии были выделены от взрослых мышей C57BL6 (2-месячного возраста) и культивировались в течение 2 недель до вирусной инфекции. EcoHIV-mScarlet добавляли в культуральную среду на два дня и делали снимки под объективом 60× конфокального микроскопа. Масштабная линейка: 10 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
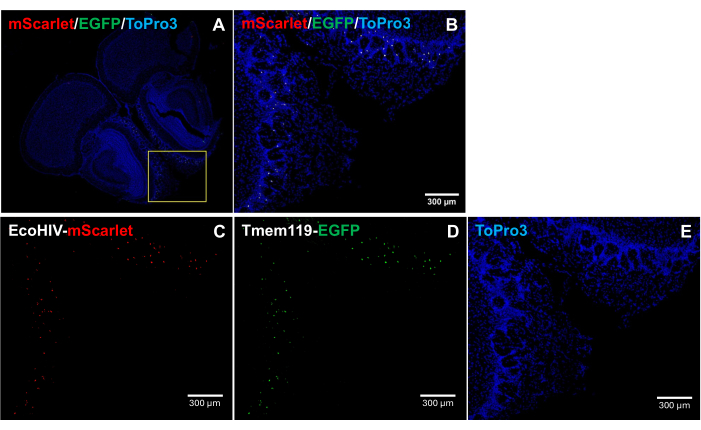
Рисунок 4: Распределение EcoHIV-mScarlet в линии мышей Tmem119-EGFP . (А,Б) Объединенные изображения сигналов mScarlet/EGFP/ToPro3 в срезах мозга. Желтая рамка обозначает целевую область (B). Масштабная линейка: 300 мкм. (C) Репрезентативное изображение распределения mScarlet во внешнем плексиформном слое обонятельной области линии мыши Tmem119-EGFP . (D) Репрезентативное изображение распределения EGFP. Флуоресцентные сигналы были локализованы в клетках микроглии в мышиной линии Tmem119-EGFP . (E) Репрезентативное изображение окрашивания ядра TO-PRO-3. Масштабные линейки: 300 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Окрашивание MAP2 и MOG первичных клеток мозга крыс, инфицированных вирусом EcoHIV-mScarlet. Масштабные линейки: 50 μм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный рисунок 2: Конфокальные изображения инфекции EcoHIV-mScarlet в мышиной линии Tmem119-EGFP . Масштабные линейки: 75 μм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 1: Последовательность плазмиды ДНК EcoHIV-mScarlet. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В настоящем исследовании было обнаружено, что (1) новый EcoHIV-mScarlet успешно инфицировал первичные клетки мозга крыс in vitro; (2) тройное мечение mScarlet, CD11b/c и Iba1 идентифицировало микроглию как преобладающий тип клеток для экспрессии EcoHIV в клетках мозга крыс in vitro; (3) первичные клетки мозга мышей от взрослых in vitro еще раз свидетельствуют об инфекции EcoHIV-mScarlet; (4) Распределение EcoHIV-mScarlet в линии мышей Tmem119-EGFP продемонстрировало специфичную для микроглии схему распределения инфекции EcoHIV.
Новые исследования показали, что различные типы клеток мозга, идентифицированных в центральной нервной системе (нейроны, астроциты, микроглии, олигодендроциты и т.д.), демонстрируют функциональные и транскриптомные изменения во время ВИЧ и ВИЧ-ассоциированных нейрокогнитивных расстройств18,19. Например, астроциты составляют 30-70% мозга и осуществляют наблюдение для поддержания гомеостазамозга20. Астроциты также модулируют иммунную функцию и регулируют секрецию мультицитокинов и хемокинов, особенно в ситуации воспаления мозга и нейродегенерации при ВИЧ 21,22. ВИЧ-инфекция микроглии не только приводит к непрерывному высвобождению вирусных белков и провоспалительных цитокинов и хемокинов, но и обеспечивает преобладающие источники вирусных резервуаров ВИЧ 23,24,25,26. Кроме того, активированная микроглия вносит свой вклад в важнейшую иммунологическую функцию в ЦНС; однако длительная активация может также усугубить нейродегенерацию в прогрессировании ВИЧ10,27. Олигодендроциты также играют важную функцию, в том числе высвобождают несколько нейротрофинов (таких как фактор роста нервов, нейротрофический фактор мозга и т. д.)28. Предыдущее исследование показало, что количество олигодендроцитов значительно снизилось в мозге больных СПИДом, что может свидетельствовать о прямом повреждении олигодендроцитов вирусными белками ВИЧ29. Таким образом, конкретный тип модели инфекции ВИЧ, управляемой клетками, должен обеспечить фундаментальные средства идентификации дифференциальных функций различных клеток мозга после инфицирования. В данном исследовании была разработана биологическая система, имитирующая особенности ВИЧ-1 путем химерной инокуляции ВИЧ (EcoHIV). Эта инокуляция ВИЧ также была объединена с линией мышей Tmem119-EGFP для создания и валидации модели ВИЧ у грызунов, манипулируемой микроглией.
Тем не менее, следует признать ограничения настоящего исследования. Было несколько негативных клеток Iba1/CD11b/c, которые представляли флуоресцентные сигналы mScarlet in vitro. Другие типы клеток мозга, такие как макрофаги мозга или перициты, могут быть вовлечены в инфекцию EcoHIV, или, наоборот, среда клеточной культуры может способствовать аберрантным паттернам инфекции по сравнению с инокуляцией in vivo . Будущие исследования на животных должны еще больше прояснить функцию микроглии mScarlet+ в процессе инфекции EcoHIV и определить региональное распределение микроглии mScarlet+EcoHIV в мозге. Кроме того, нейрокогнитивные изменения, возникающие в результате инфекций микроглии, также могут быть рассмотрены в этой модели грызунов. В целом, инокуляция EcoHIV-mScarlet мышей Tmem119-EGFP обеспечивает новую модель и исследовательскую стратегию для изучения микроглиальных механизмов нейрокогнитивных расстройств, связанных с ВИЧ.
Раскрытие информации
Ни у одного из авторов нет конфликта интересов, о котором можно было бы заявить.
Благодарности
Эта работа финансировалась грантами NIH DA059310, DA058586, AG082539 и GM109091. Мы высоко ценим щедрый дар EcoHIV-NL4-3-EGFP от доктора Поташа из Медицинской школы Икана на горе Синай.
Материалы
| Name | Company | Catalog Number | Comments |
| 293FT cells | ThermoFisher Scientific | R70007 | |
| 33 G, Small Hub RN Needle, (Point Style: 3, Needle Length: 19.25 mm) | Hamilton | 7803-05 | |
| Antibiotic-Antimycotic solution | Cellgro | 30004CI | 100x |
| C57BL/6-Tmem119em2Gfng/J | The Jackson Laboratory | Strain #:031823 | |
| Corning BioCoat Gelatin 75cm² Rectangular Canted Neck Cell Culture Flask with Vented Cap | Life Technologies | 354488 | |
| Corning DMEM with L-Glutamine, 4.5 g/L Glucose and Sodium Pyruvate | Life Technologies | 10013CV | |
| Cover glass | VWR | 637-137 | |
| Dumont #5 Forceps | World Precision Instruments | 14095 | |
| Dumont #7 Forceps | World Precision Instruments | 14097 | |
| EndoFree Plasmid Maxi Kit (10) | Qiagen | 12362 | |
| Eppendorf Snap-Cap Microcentrifuge Biopur Safe-Lock Tubes | Life Technologies | 22600028 | |
| Feather Double Edge Carbon Steel Blades | Ted Pella, inc. | 121-9 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher Scientific | BP1426-500 | |
| Human recombinant anti-CD11b antibody | Miltenyi Biotec | 130-120-214 | 1:50 dilution |
| Intraocular Injector Syringe (6.5 µL), Removable Needle | Hamilton | 6609071-01 | |
| Invitrogen Lipofectamine 3000 Transfection Reagent | Life Technologies | L3000015 | |
| Invitrogen One Shot TOP10 Electrocomp E. coli | Fisher Scientific | C404052 | |
| Iris Forceps | World Precision Instruments | 15914 | |
| Iris Scissors | World Precision Instruments | 500216 | |
| Lentivirus-Associated p24 ELISA Kit | Cell Biolabs, inc. | VPK-107-5 | |
| Lenti-X Concentrator | Takara | PT4421-2 | |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 11058021 | |
| Paraformaldehyde | Sigma-Aldrich | 158127-500G | |
| Paraformaldehyde | Sigma | P6148 | |
| PELCO easiSlicer Vibratory Tissue Slicer | Ted Pella, inc. | 11000 | |
| PELCO Pro CA44 Tissue Adhesive | Ted Pella, inc. | 10033 | |
| PELCO Pro Specimen Retrievers | Ted Pella, inc. | 101-33 | |
| ProLong Gold | Fisher Scientific | P36930 | |
| Rabbit monoclonal anti-Iba1 antibody | Abcam | ab178847 | 1:500 dilution |
| RN Compression Fitting 1 mm | Hamilton | 55750-01 | |
| Sevoflurane | Merritt Veterinary Supply | 347075 | |
| Sprague Dawley pregnant rat | Inotiv | ||
| SuperFrost Plus Slides | Fisher Scientific | 12-550-154% | |
| To-Pro-3 | ThermoFisher Scientific | T3605 | Nucleus staining kit |
| Trypsin-EDTA (0.25%), phenol red | ThermoFisher Scientific | 25200-056 | |
| Vannas Scissors | World Precision Instruments | 500086 |
Ссылки
- Vigorito, M., Lashomb, A. L., Chang, S. L. Spatial learning and memory in HIV-1 transgenic rats. J Neuroimmune Pharmacol. 2, 319-328 (2007).
- Moran, L. M., Booze, R. M., Mactutus, C. F. Time and time again: Temporal processing demands implicate perceptual and gating deficits in the HIV-1 transgenic rat. J. Neuroimmune Pharmacol. 8 (4), 988-997 (2013).
- Repunte-Canonigo,, et al. Gene expression changes consistent with neuroAIDS and impaired working memory in HIV-1 transgenic rats. Mol Neurodegener. 9, 26(2014).
- Reid, W., et al. An HIV-1 transgenic rat that develops HIV-related pathology and immunologic dysfunction. Proc Natl Acad Sci USA. 98 (16), 9271-9276 (2001).
- McLaurin, K. A., Li, H., Booze, R. M., Mactutus, C. F. Disruption of timing: NeuroHIV progression in the post-cART era. Sci Rep. 9, 827(2019).
- Roscoe, R. F., Mactutus, C. F., Booze, R. M. HIV-1 transgenic female rat: Synaptodendritic alterations of medium spiny neurons in the nucleus accumbens. J Neuroimmune Pharmacol. 9 (5), 642-653 (2014).
- Denton, A. R., et al. Selective monoaminergic and histaminergic circuit dysregulation following long-term HIV-1 protein exposure. J NeuroVirol. 25 (4), 540-550 (2019).
- Peng, J., et al. The HIV-1 transgenic rat as a model for HIV-1 infected individuals on HAART. J Neuroimmunol. 218 (1-2), 94-101 (2010).
- Abbondanzo, S. J., Chang, S. L. HIV-1 transgenic rats display alterations in immunophenotype and cellular responses associated with aging. PLoS ONE. 9, e105256(2014).
- Potash, M. J., et al. A mouse model for study of systemic HIV-1 infection, antiviral immune responses, and neuroinvasiveness. Proc Natl Acad Sci USA. 102 (10), 3760-3765 (2005).
- Li, H., McLaurin, K. A., Illenberger, J. M., Mactutus, C. F., Booze, R. M. Microglial HIV-1 expression: Role in HIV-1 associated neurocognitive disorders. Viruses. 13 (5), 924(2021).
- Kaiser, T., Feng, G. Tmem119-EGFP and Tmem119-CreERT2 transgenic mice for labeling and manipulating microglia. eNeuro. 6 (4), (2019).
- Bennett, M. L., et al. New tools for studying microglia in the mouse and human CNS. Proc Natl Acad Sci. USA. 113 (12), E1738-E1746 (2016).
- Satoh, J., et al. TMEM119 marks a subset of microglia in the human brain. Neuropathology. 36 (1), 39-49 (2016).
- Li, H., Aksenova, M., Bertrand, S. J., Mactutus, C. F., Booze, R. M. Quantification of filamentous actin (F-actin) puncta in rat cortical neurons. J Vis Exp. (108), e53697(2016).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. A rat model of EcoHIV brain infection. J Vis Exp. (167), e62137(2021).
- Alfar, H. R., et al. Protocol for optimizing production and quality control of infective EcoHIV virions. STAR Protoc. 4 (3), 102368(2023).
- Malatesta, P., Hartfuss, E., Götz, M. Isolation of radial glial cells by fluorescent-activated cell sorting reveals a neuronal lineage. Development. 127 (24), 5253-5263 (2000).
- Parpura, V., et al. Glutamate-mediated astrocyte-neuron signaling. Nature. 369 (6483), 744-747 (1994).
- Wahl, A., Al-Harthi, L. HIV infection of non-classical cells in the brain. Retrovirology. 20 (1), 1(2023).
- Pandey, H. S., Seth, P. Friends turn foe-astrocytes contribute to neuronal damage in NeuroAIDS. J. Mol. Neurosci. 69 (2), 286-297 (2019).
- Minagar, A., et al. The role of macrophage/microglia and astrocytes in the pathogenesis of three neurologic disorders: HIV-associated dementia, Alzheimer's disease, and multiple sclerosis. J Neurol Sci. 202 (1-2), 13-23 (2002).
- Borrajo, A., Spuch, C., Penedo, M. A., Olivares, J. M., Agís-Balboa, R. C. Important role of microglia in HIV-1 associated neurocognitive disorders and the molecular pathways implicated in its pathogenesis. Ann Med. 53 (1), 43-69 (2021).
- González-Scarano, F., Martín-García, J. The neuropathogenesis of AIDS. Nat Rev Immunol. 5 (1), 69-81 (2005).
- Li, H., McLaurin, K. A., Mactutus, C. F., Booze, R. M. Microglia proliferation underlies synaptic dysfunction in the prefrontal cortex: Implications for the pathogenesis of HIV-1-associated neurocognitive and affective alterations. J. Neurovirol. 29 (4), 460-471 (2023).
- Kim, B. H., et al. EcoHIV infection of primary murine brain cell cultures to model HIV replication and neuropathogenesis. Viruses. 16 (5), 693(2024).
- Réu, P., et al. The lifespan and turnover of microglia in the human brain. Cell Rep. 20 (4), 779-784 (2017).
- Jones, J. D. Potential of glial cell modulators in the management of substance use disorders. CNS Drugs. 34 (7), 697-722 (2020).
- Kaalund, S. S., Johansen, A., Fabricius, K., Pakkenberg, B. Untreated patients dying with aids have loss of neocortical neurons and glial cells. Front Neurosci. 13, 1398(2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены