Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Микробиота садов муравьёв Аттина: визуализация микробного ландшафта с помощью сканирующей электронной микроскопии
В этой статье
Резюме
Мы предлагаем оптимизированный протокол сканирующей электронной микроскопии для визуализации высокогетерогенных и хрупких образцов, содержащих растительную и грибковую биомассу, а также микробиоту и биопленку. Этот протокол позволяет описать пространственные размеры организации микробиоты.
Аннотация
В макромасштабных экосистемах, таких как тропические леса или коралловые рифы, пространственная локализация организмов является основой нашего понимания экологии сообществ. В микробном мире микромасштабные экосистемы также далеки от случайной и однородной смеси организмов и сред обитания. Доступ к пространственному распределению микробов имеет основополагающее значение для понимания функционирования и экологии микробиоты, поскольку соживущие виды с большей вероятностью взаимодействуют и влияют на физиологию друг друга.
Межцарственная микробная экосистема лежит в основе колоний муравьев, выращивающих грибы, которые выращивают базидиомицеты в качестве пищевого ресурса. Муравьи Аттин питаются разнообразными субстратами (в основном растительного происхождения), метаболизируемыми культивируемым грибом, образуя губчатую структуру, «микробный сад», который действует как внешний кишечник. Сад представляет собой переплетенную сетку гиф грибов, растущих путем метаболизма субстрата, открывая ниши для создания характерной и адаптированной микробиоты. Считается, что микробиота способствует деградации субстрата и росту грибков, хотя ее пространственная организация еще не определена.
В этой статье мы опишем, как мы используем сканирующую электронную микроскопию (СЭМ) для исследования с беспрецедентной детализацией микробиоты и пространственной организации биопленки в различных системах выращивания грибов у муравьев, выращивающих грибы. Визуализация СЭМ позволила описать пространственную структуру и организацию микробиоты. СЭМ показала, что микробиота обычно собирается в биопленки, что является широко распространенной структурой микробных ландшафтов в грибоводстве. Мы представляем протоколы, используемые для фиксации, обезвоживания, сушки, распыления покрытия и визуализации такого сложного сообщества. Эти протоколы были оптимизированы для работы с деликатными и неоднородными образцами, содержащими биомассу растений и грибов, а также микробиоту и биопленку.
Введение
Экосистемы состоят из организмов, связанных между собой процессами в определенном географическом месте (т.е. в окружающей среде). Организмы взаимодействуют с окружающей средой с течением времени, из чего возникают сложные и неоднородные пространственные структуры. Пространственная структура определяет экологическое разнообразие и стабильность и, в конечном счете, функционирование экосистемы 1,2,3,4. В макромасштабных экосистемах, таких как водно-болотные угодья, саванны, коралловые рифы и засушливые экосистемы, пространственные закономерности коррелируют с потоком и концентрацией ресурсов. Обеспечение оптимизации ресурсов, пространственной неоднородности и структурированности приводит к созданию более устойчивых экосистем, чем однородные2. Пространственная локализация организмов, лежащая в основе экологии сообщества, транслируется и в микробный мир.
Микробные экосистемы, далекие от организмов, хаотично и равномерно перемешанных в микросредах обитания, демонстрируют пространственные закономерности, определяющие большую часть их функционирования 5,6,7. От колонн Виноградского до микробиоты, связанной с окружающей средой и хозяином, эти экосистемы неоднородно организованы в пространстве, при этом пространственное расположение вызывает различные фенотипические реакции. Сожительствующие виды с большей вероятностью будут взаимодействовать и влиять на физиологию друг друга. Таким образом, пространственная организация сообщества, в большей степени, чем его состав как таковой, ограничивает свойства экосистем и экологические ниши 5,7,8. Иллюстрируя эти концепции, изменения в пространственной структуре, по-видимому, коррелируют с патологическим прогрессированием зубных налетов, кариеса, заболеваний десен 9,10, воспалительных заболеваний кишечника11, инфекций легких муковисцидоза, хронических раневых инфекций12,13, колоректального рака и аденом14.
В рамках микробной биогеографии (изучение распределения и структуры биоразнообразия в пространстве и времени в микромасштабе) знания о микробных экосистемах получают огромную пользу от понимания их пространственных закономерностей 6,13,15,16,17. Мы изучили пространственные закономерности микробной экосистемы, созданной насекомыми, обнаруженной в ядре колоний харизматичных муравьев-аттинов (Hymenoptera: Formicidae: Myrmicinae: Attini: Attina). Здесь находится «микробный сад», сосредоточенный вокруг базидиомицетного гриба из трибы Leucocoprinae (Basidiomycota: Agaricaceae) или из семейства Pterulaceae (Basidiomycota: Agaricales)18,19,20,21,22. Сад представляет собой губчатую структуру, возникающую из переплетенной сетки гиф, которая растет за счет метаболизма в основном растительного субстрата, используемого муравьями (Рисунок 1). Они могут включать, в зависимости от родов аттине: сухие части растений, обломки и туши насекомых, свежесрезанные листья, семена и части цветов23,24. Подобно внешнему травоядному кишечнику, сад ферментативно и химически преобразует неподатливые полимеры в лабильные питательные ресурсы, обеспечивая муравьев незаменимыми аминокислотами, липидами и растворимыми сахарами 21,25,26,27,28.
Ультраструктурный, ферментативный и транскриптомный анализы, проведенные для садов родов листорезов Atta и Acromyrmex, показывают, что эти среды структурируют континуум деградации субстрата и питательных пятен 26,29,30,31,32. Молодые участки сада, как правило, темнее из-за свежезасыпанного субстрата после фрагментации. Эти недавно добавленные субстраты часто колонизируются с краев, которые были разрезаны муравьиными рабочими и инокулированы мицелиальными сгустками. Расходясь от краев среза, грибковые гифы распространяются по субстрату 29,32,33. Обилие гиф увеличивается по мере прогрессирования деградации субстрата, что приводит к образованию беловатых и метаболически активных областей 30,31,32. Более старые регионы, с более деградированным субстратом и обильной микробиотой29,32, как правило, имеют коричневатые тона и более высокую влажность. Рабочие удаляют фрагменты этого участка, разделяя их в кучи отходов, где также берут субстраты, наносящие вред грибковому симбионту 34,35,36. Кучи отходов, хотя и физически отделены от сада, являются местом непрерывной деградации субстрата и круговорота питательных веществ из-за обильной микробиоты обитателей 29,32,37,38,39.
Микробиота, состоящая в основном из Enterobacter, Klebsiella, Pantoea, Pseudomonas и Serratia, также населяет сад, по-видимому, являясь общей для различных систем выращивания грибов. Кодируя метаболические пути, которые могут дополнять метаболизм грибков, микробиота потенциально участвует в физиологических реакциях сада 40,41,42,43,44. Не только метагеномные данные показали, что микробиота присутствовала41,42, но и анализ грибов муравьев-листорезов с помощью сканирующей электронной микроскопии (СЭМ) показал в основном палочковидные бактерии над растительным субстратом32. Хотя бактерии (в том числе целлюлолитические штаммы) были выделены из всего сада, они были визуализированы только в старых частях сада и в кучах отходов, а также в первоначальной грануле, которую несли королевы основательниц 29,32. Кроме того, было неясно, может ли микробиота образовывать биопленки in vivo (т.е. в саду и отходах), о чем свидетельствует их метаболическая способность42 и наблюдается in vitro44.
В данной работе мы использовали SEM для дальнейшего понимания пространственной организации микробиоты в районах сада, детализируя физические взаимодействия микробиоты и субстрата и микробиоты и гиф. Предоставляя изображения с большей фокусной глубиной, SEM позволяет наблюдать трехмерные микроскопические структуры с высоким разрешением, что позволяет тщательно анализировать пространственные структуры микробиоты сада. Мы подробно описываем шаги по фиксации, обезвоживанию, сушке, распылению шерсти и визуализации таких неоднородных и хрупких грибковых образцов. Убрав стадию постфиксации с помощью тетраоксида осмия (OsO4) и сократив время обезвоживания, мы упростили протоколы 32,33,45 по подготовке садовых проб и образцов отходов для СЭМ-анализа. Этот адаптированный протокол сохраняет структурные структуры гиф, а также микробиоту и пространственную организацию биопленки и может быть применен к другим хрупким микробным экосистемам и биопленкам.
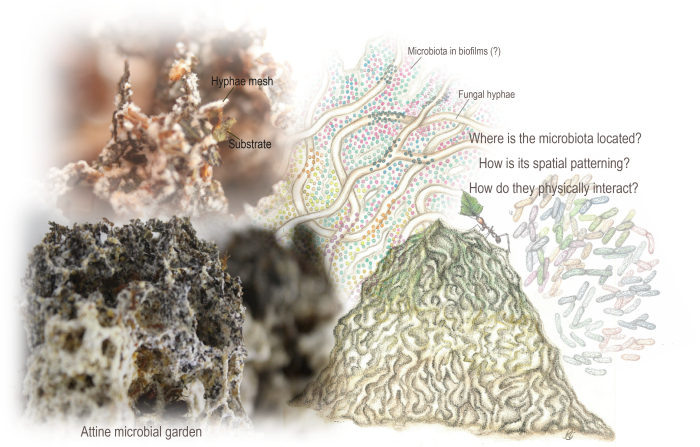
Рисунок 1: Микробные сады Аттина. Сад представляет собой губчатую структуру, возникшую в результате переплетенной сетки гиф, которая растет путем метаболизма в основном растительного субстрата, используемого муравьями. Также в саду обитает микробиота, которая кодирует метаболические пути, которые могут дополнять метаболизм грибков. Метагеномные данные и предыдущий анализ с помощью сканирующей электронной микроскопии указывали на его присутствие, хотя у нас было мало знаний о его пространственной организации и физическом взаимодействии с субстратом и гифами грибов. Мы использовали SEM для выявления пространственной организации и структуры микробиоты и биопленки. Иллюстрации Марианы Баркото (сад и микробиота адаптированы из Barcoto and Rodrigues 94), а фотографии Марианы Баркото и Энцо Соррентино. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
протокол
1. Отбор проб полевых колоний
ПРИМЕЧАНИЕ: При сборе колоний муравьев убедитесь, что перед сбором получены все разрешения, требуемые местным законодательством. В нашем случае разрешение на сбор #74585 было выдано Instituto Chico Mendes de Conservação e Biodiversidade (ICMBio). Когда образцы будут получены из лабораторной колонии, перейдите к разделу 2.
- Найдите и отметьте колонию. Выкопайте траншею вокруг гнезда до тех пор, пока садовая камера не обнажится (Рисунок 2А).
ПРИМЕЧАНИЕ: Некоторые виды аттинов могут строить свои колонии под опавшей листвой или внутри гнилых бревен. В таких случаях аккуратно вращайте подстилку или аккуратно ломайте бревна для сбора образцов. Для получения подробной информации о поиске, сборе и поддержании живых колоний различных видов муравьев см. Sosa-Calvo et al.46. - Откройте садовую камеру сбоку, чтобы почва не упала на поверхность сада. Тщательно соберите садовые образцы с помощью энтомологических щипцов, ложки или кухонного шумовника, в зависимости от размера сада.
ПРИМЕЧАНИЕ: Обязательно простерилизуйте инструменты перед сбором. При сборе садов муравьев-листорезов надевайте плотные тканевые перчатки, чтобы предотвратить (или, по крайней мере, смягчить) укусы рабочих. Для других видов аттин тканевые перчатки не являются обязательными. - Перенесите садовые образцы в чистую пластиковую упаковку, содержащую слой штукатурки для балансировки влажности в саду. После переноса садовых и муравьиных тружеников герметично закройте реципиент, чтобы избежать высыхания образца. Храните садовые образцы при температуре 23-25 °С до обработки.
- Закройте траншею с предварительно удаленным грунтом.
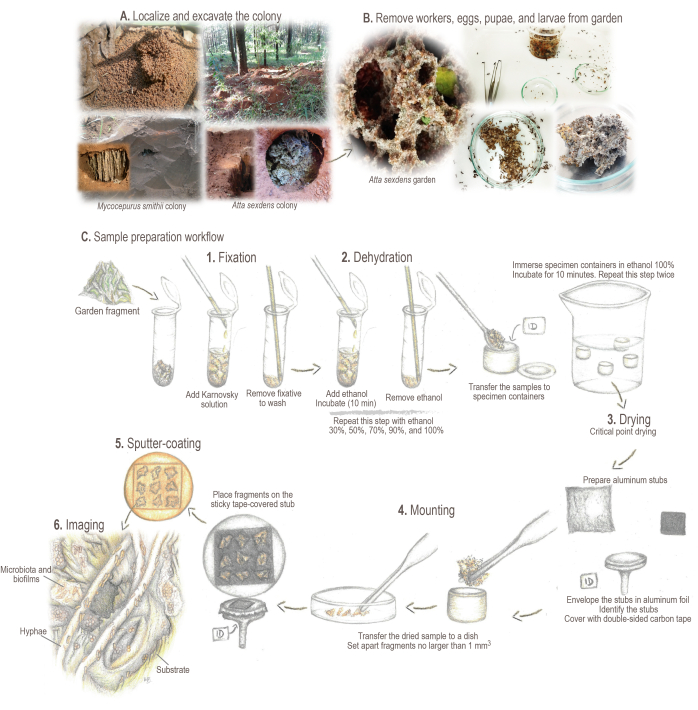
Рисунок 2: Протокол пробоподготовки. (А) Отбор проб из полевых колоний. (B) Обработка образцов. (C) Краткие основы и рабочий процесс для подготовки образцов: 1. Фиксация: для укрепления и сохранения структуры образца. 2. Обезвоживание: содержание воды в образцах обменивается на этанол. 3. Сушка в критической точке: жидкийCO2 заменяет этанол и испаряется. 4. Монтаж: образец отображается для анализа. 5. Напыление-покрытие золотом: предотвращение загрузки пробы. 6. Визуализация. Иллюстрации и фотографии Марианы Баркото. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
2. Реактивы
ПРИМЕЧАНИЕ: Имейте в виду, что следующие растворы должны быть приготовлены заранее.
- Приготовьте 0,2 М буфера из какодилата натрия. Для этого 42,8 г какодилата натрия растворить в 800 мл дистиллированной воды, помешивая до растворения и стабилизации рН на уровне 7,2 (при необходимости отрегулировать рН с помощью соляной кислоты). Доведите объем раствора до 1 л, добавив дистиллированную воду. Хранить раствор при температуре 4 °C (~1 месяц).
ВНИМАНИЕ: Глутаральдегид и параформальдегид токсичны, и их следует обрабатывать в вытяжном шкафу. При работе с такими реактивами постоянно надевайте нитриловые перчатки и защитные очки. - Приготовьте фиксатор Карновского (модифицированный из Карновского)47. Для этого добавьте 10 мл 25% водного раствора глутаральдегида и 10 мл 20% водного раствора параформальдегида в 25 мл 0,2 М буфера для какодилата натрия и перемешайте. Добавьте 1 мл 0,1 М хлорида кальция (CaCl2) и доведите объем до 100 мл, добавив дистиллированную воду. Хранить раствор при температуре 4 °C (до 1 месяца).
ВНИМАНИЕ: Фиксатор Карновского вреден при вдыхании и может вызвать раздражение кожи и глаз. Таким образом, избегайте вдыхания паров, используя только на открытом воздухе или в хорошо проветриваемом помещении. При работе с раствором постоянно надевайте нитриловые перчатки и защитные очки. - Используя абсолютный этанол (аналитический класс), приготовьте 30%, 50%, 70% и 90% растворы этанола в дистиллированной воде; Также требуется 100% этанол.
3. Фиксация образца
ПРИМЕЧАНИЕ: Фиксаторы затвердевают и сохраняют образцы, сохраняя морфологические особенности. Альдегиды (такие как параформальдегид и глутаральдегид) представляют собой некоагулянтные фиксаторы сшивающего типа, индуцирующие перекрестные связи внутри и между белками и нуклеиновыми кислотами48.
- Удалите рабочих, яйца, куколки и личинки из садовых образцов с помощью энтомологических щипцов (рисунок 2B). Отложите садовые фрагменты размером не более 5 мм3. Добавьте фрагменты в пробирку объемом 2 мл (рисунок 2C).
- В пробирки, содержащие образцы, с помощью стеклянной пипетки Пастера добавьте ~1 мл фиксирующего раствора Карновского (убедитесь, что образец полностью покрыт). Перемешайте путем осторожного перемешивания, чтобы образец пропитался и инкубировался при 4 °C в течение не менее 24 часов, прежде чем продолжить обработку образца (Рисунок 2C.1).
ПРИМЕЧАНИЕ: Если следующие этапы обезвоживания не будут проведены сразу после фиксации, протокол может быть приостановлен на этом этапе, и образцы могут храниться в течение ~1 года при температуре 4 °C.
Мы рекомендуем использовать стеклянную пипетку Пастера, так как она состоит из инертного материала и ее легче чистить для последующего повторного использования. Садовый материал обладает высокой гидрофобностью, имеет тенденцию плавать по поверхности фиксирующего раствора. Обычно требуется до 5 минут, чтобы полностью пропитаться фиксатором. Убедитесь, что фиксатор покрывает садовые фрагменты, так как его объем имеет тенденцию уменьшаться при попадании в поры образца. Мы опытным путем убедились, что после того, как образец размокал и становился влажным, его компоненты (в частности, нежный мицелий гриба) становились восприимчивыми к разрушению при дальнейшем перемешивании. Таким образом, мы рекомендуем по возможности избегать встряхивания образцов.
4. Обезвоживание образца
ПРИМЕЧАНИЕ: Серия промывки этанолом постепенно заменяет воду в образцах на этанол. Важно начинать с раствора этанола в низкой концентрации (см. ниже), чтобы избежать чрезмерного повреждения или разрушения таких хрупких образцов49.
- Полностью удалите фиксирующий раствор Карновского с помощью стеклянной пипетки, стараясь не нарушить работу образца (рисунок 2C.1).
ПРИМЕЧАНИЕ: Выбросьте фиксатор Карновского в реципиент, правильно маркированный для обработки токсичных химических остатков. - Сразу после снятия фиксатора добавьте 1 мл 30% этанола, стараясь не нарушить образец, и инкубируйте в течение 10 минут при комнатной температуре (рис. 2C.2).
ПРИМЕЧАНИЕ: Образцы всегда должны быть замочены в растворе. Обязательно быстро заменяйте растворы во время серии постепенной стирки этанолом. Поскольку сад теряет свой пористый вид и накапливается на дне трубки, 1 мл этанола, как правило, достаточно, чтобы покрыть образец (когда размер образца не превышает 5мм3). Однако, если образцы не полностью покрыты, добавляйте этанол до тех пор, пока образец не будет полностью покрыт. - Полностью удалите 30% этанол стеклянной пипеткой, стараясь не нарушить образец. Тщательно выбросьте 30% этанол.
ПРИМЕЧАНИЕ: Для всей серии постепенной стирки этанола выбросьте этанол в контейнер с соответствующей маркировкой для удаления остатков токсичных химических веществ. - Добавьте 1 мл 50% этанола и инкубируйте в течение 10 минут при комнатной температуре. Полностью удалите 50% этанол стеклянной пипеткой, стараясь не нарушить образец. Правильно выбросьте 50% этанол.
- Добавьте 1 мл 70% этанола и инкубируйте в течение 10 минут при комнатной температуре. Полностью удалите 70% этанол стеклянной пипеткой, стараясь не нарушить образец. Тщательно выбросьте 70% этанол.
ПРИМЕЧАНИЕ: На этапе промывки этанолом на 70% пользователь может приостановить протокол, если это необходимо, так как пробирки с образцами могут храниться в течение ночи при температуре 4 °C, когда материал не будет немедленно обработан. - Добавьте 1 мл 90% этанола и инкубируйте в течение 10 минут при комнатной температуре. Полностью удалите 90% этанола стеклянной пипеткой, стараясь не нарушить образец. Правильно выбросьте 90% этанол.
- Добавьте 1 мл 100% этанола и инкубируйте в течение 10 минут при комнатной температуре. Полностью удалите 100% этанол стеклянной пипеткой, стараясь не нарушить образец. Правильно выбросьте 100% этанол.
- С помощью щипцов и/или шпателя осторожно переложите образцы в контейнеры для образцов для сушилки для критических точек (CPD), содержащие идентификационные этикетки образцов (предварительно выполненные на бумаге и карандаше). Во избежание высыхания образцов этот перенос осуществляется с контейнером, помещенным в чашку Петри, покрытую 100% этанолом.
- Накройте контейнеры крышками и погрузите их в стакан из градуированного стекла, содержащий 100% этанол в количестве, достаточном для погружения контейнеров. Накройте стеклянный стакан крышкой и выдерживайте 10 минут при комнатной температуре; Затем правильно выбросьте 100% этанол.
- Переложите контейнеры с образцами в другой стакан из градуированного стекла, содержащий достаточное количество 100% этанола для погружения контейнеров. Накройте стеклянный стакан крышкой и выдерживайте 10 минут при комнатной температуре; Затем переместите контейнеры с образцами в сушилку для критических точек.
ПРИМЕЧАНИЕ: После серии мытья стеклянные пипетки и стаканы следует обильно промыть дистиллированной водой, а эту остаточную воду следует сбросить в реципиент с соответствующей маркировкой для удаления остатков токсичных химических веществ. После ополаскивания стеклянные изделия можно мыть нейтральным моющим средством, ополаскивать водопроводной водой и сушить на воздухе.
5. Сушка в критических точках
ПРИМЕЧАНИЕ: Осушитель для критических точек заменяет этанол в образцах на жидкий углекислый газ (CO2), который испаряется из образца при более высокой температуре и давлении. Пожалуйста, следуйте инструкциям производителя для таких процедур.
- Включите оборудование.
- Откройте камеру, поместите внутрь контейнеры с образцами и добавьте 100% этанол, пока он не покроет контейнеры. Закройте камеру.
- Активируйте опцию Cool , и дождитесь, пока температура достигнет 10 °C.
- Откройте клапан баллона CO2 и активируйте опцию «Мешалка ».
- Активируйте опцию CO2 в, всегда проверяя камеру, чтобы убедиться, насколько CO2 уже заполнил ее. Когда камера почти заполнится, отключите опцию CO2 in и активируйте опцию Exchange , продолжая ее активировать до тех пор, пока CO2 не будет достаточно только для покрытия контейнеров. Убедитесь, что контейнеры всегда покрыты CO2 (т. е. отключите опцию «Обмен» до того, как весь CO2 покинет камеру). Повторите шаг 5.5 6 раз.
- Активируйте CO2 в последний раз и заполните камеру до тех пор, пока контейнеры не будут закрыты.
- Активируйте опцию «Нагрев » и выключите опцию «Мешалка ». Закройте вентиль баллона CO2.
- Дождитесь, пока температура поднимется до 35 °C; затем активируйте опцию Gas out.
ПРИМЕЧАНИЕ: При температуре около 30 °C камера достигает давления 70-80 бар, достигая критической точки, где жидкость исчезает. - Когда давление в камере достигает 1 бар, все содержимое газа удаляется. Откройте камеру и извлеките емкости.
- Выключите оборудование.
6. Монтаж
- Подготовьте держатели образцов SEM (т.е. алюминиевые заглушки; Рисунок 2C.4).
- Оберните корешки куском алюминиевой фольги, накрыв только верх, чтобы облегчить очистку корешков после анализа.
- Определите заглушки, написав код/номер образца на нижней части держателя, гарантируя идентификацию того, что размещено сверху.
- Верхнюю часть накройте двусторонним углеродным скотчом. Поместите огрызки в держатель для образцов.
- Откройте крышку контейнера для образцов и осторожно переложите высушенный образец в стеклянную чашку Петри с помощью щипцов и шпателя.
ПРИМЕЧАНИЕ: Сады критической точечной сушки имеют тенденцию к агломерации, образуя плотно упакованные образцы, которые должны быть аккуратно разделены на фрагменты размером не более 1мм3. - Аккуратно поместите фрагменты на липкую поверхность обтянутого скотчем огрызка. Как только садовый фрагмент соприкоснется с лентой, его очень трудно (пере)переместить, поэтому будьте осторожны, чтобы не разместить его в нежелательных местах или положениях. Добавляйте до девяти фрагментов на заготовку.
- Повторите шаги 6.2 и 6.3 для каждого образца.
7. Напыление с золотом
ПРИМЕЧАНИЕ: Для предотвращения зарядки образца необходимо покрыть его. Следуйте инструкциям производителя по регулировке таких параметров, как давление рабочего газа (0,5 × 10-1 мм рт.ст. давления газа в этом протоколе), время распыления (220 с), толщина слоя золота (~120 Å), ток (50 мА) и напряжение питания. Распыление, как правило, происходит по общему рабочему процессу, хотя оборудование разных производителей может работать немного по-разному.
- Откройте шарнирный рычаг мишени и положите заглушки на стол для образцов.
- Закройте шарнирный кронштейн мишени и проверьте, правильно ли встроен противоосколочный экран стеклянной вакуумной камеры.
- Откройте клапан баллона с аргоном и включите главный выключатель питания.
- Следите за повышением вакуума на дисплее оборудования до тех пор, пока он не достигнет отметки 0,5 × 10-1 мм рт.ст. на дисплее; затем активируйте Полоскание. Повторите операцию 5 раз.
- Включите систему циркуляции воды, активируйте опцию HV On и откройте крышку с золотой пленкой. Убедитесь, что цвет плазмы розоватый. Чтобы следовать этому протоколу, настройте 220 с распыления с напряжением 50 мА, что приведет к нанесению золотого слоя ~120 Å (12 нм).
- Функция HV On автоматически отключается. Выключите систему циркуляции воды и закройте крышку с золотой пленкой.
- Выключите главный выключатель питания, дав возможность воздуху поступать в вакуумную камеру. Для садовых образцов и образцов отходов повторите шаги 7.1-7.7 3 раза.
ПРИМЕЧАНИЕ: Если визуализация не будет выполнена сразу после подготовки образца, храните заглушки в герметичном контейнере, заполненном слоем диоксида кремния, чтобы избежать регидратации образцов.
8. Визуализация
ПРИМЕЧАНИЕ: Следуйте инструкциям производителя по регулировке настроек СЭМ, таких как диаметр объективной апертуры, рабочее напряжение, юстировка электронно-лучевой системы, осевое выравнивание и стигматоры.
- Поместите корешки в держатель для образцов, делая заметки о положении каждого образца.
ПРИМЕЧАНИЕ: Надевайте перчатки при установке или снятии держателя для образцов и следите за тем, чтобы держатель был как можно более чистым. - Запустите операционное программное обеспечение с рабочего стола.
- Выберите настройки прибора. Визуализируйте садовые образцы с диаметром апертуры объектива 30 мкм (т.е. во второй ступени), работающие в высоком вакууме, регистрирующие сигналы от вторичных электронов (СЭД), ускоряющее напряжение 20 кВ, рабочее расстояние 15 - 20 мм, ток зонда 40,0 (в режиме большого тока) и варьирующие увеличение в зависимости от образца.
- Следуя инструкциям по навигации, нажмите значок вентиляционного отверстия и подождите, пока камера для образцов будет проветрена. Индикатор выполнения показывает состояние очистки.
- Когда атмосферное давление будет достигнуто, откройте камеру для образцов и осторожно вставьте держатель для образцов.
- Осторожно закройте дверцу камеры и нажмите значок эвакуации , чтобы эвакуировать прибор, отслеживая состояние вакуума через индикатор выполнения. Навигационная система покажет положение движущейся сцены и предоставит график держателя, когда перемещение будет завершено. Нажмите значок камеры , чтобы записать фотографию держателя, чтобы получить вид сверху, который поможет перемещаться между образцами во время визуализации.
- Нажмите на значок наблюдения , чтобы включить электронную пушку, и дождитесь формирования изображения. Используйте ручной пользовательский интерфейс (ручное управление) для ручного перемещения оси Z на нужную высоту (в зависимости от высоты образца и определенного рабочего расстояния).
ПРИМЕЧАНИЕ: Чтобы продлить срок службы вольфрамовой нити накала, приостанавливайте функцию наблюдения , когда она не ведет активную визуализацию. - Используйте либо параметры, показанные на экране, либо ручное управление, чтобы изменить скорость растра и положение изображения. Перемещайте рабочую область, чтобы получить полное представление о образце, используя функцию RDC , чтобы сосредоточиться на определенных областях. При наблюдении за целевой (или интересной) структурой отрегулируйте увеличение, фокусировку, яркость, контраст и стигмацию соответственно. Исправьте стигмацию, используя ручной пользовательский интерфейс , чтобы переместить сцену в направлениях X и Y.
- Отрегулируйте увеличение в диапазоне от 100x до 700x, чтобы визуализировать общие аспекты сада (такие как плотность гиф, субстрат и узоры колонизации).
- Отрегулируйте увеличение в диапазоне от 700x до 1 500x, чтобы визуализировать пространственные паттерны микробиоты.
- Отрегулируйте увеличение в диапазоне от 1 500x до 3 000x, чтобы наблюдать за физическим взаимодействием микробиоты и биопленки.
- Отрегулируйте увеличение в диапазоне от 3 000x до 4 000x, чтобы сфокусироваться на определенных микробных кластерах.
- Чтобы сохранить изображение, воспользуйтесь функцией «Заморозить », нажмите на значок «Фото » и настройте путь к файлу. Как правило, проанализируйте как минимум три фрагмента сада, визуализируя каждый из них во всех диапазонах увеличения, упомянутых в шаге 8.8. В результате получается не менее 12 изображений на выборку, хотя большее количество изображений может поддерживать более подробные описания. Мы предполагаем, что 15-25 изображений на образец, ранжируя все увеличения на шаге 8.8, как правило, обеспечивают мелкие детали для описания образца.
ПРИМЕЧАНИЕ: Растрирование и сохранение изображения занимает несколько секунд, в течение которых следует избегать любой вибрации на плавающем столе SEM. - После завершения визуализации нажмите опцию «Вентиляция », чтобы прокачать камеру, отслеживая состояние вакуума через индикатор выполнения. Осторожно снимите держатель, осторожно закройте дверцу камеры и нажмите кнопку Evac для эвакуации из камеры.
- Как только эвакуация будет завершена, выйдите из программного обеспечения операции.
- Отрегулируйте яркость и контрастность для улучшения визуализации с помощью редактора изображений.
Результаты
В этой статье мы представили упрощенный протокол для визуализации компонентов садовых образцов и образцов отходов, таких как гифы грибов, субстрат, микробиота и биопленки. СЭМ улучшила наше понимание того, как сад и отходы формируют структурные структуры микробиоты (...
Обсуждение
СЭМ использует электронный пучок для сканирования образца, генерируя его увеличенное изображение, чтобы можно было визуализировать трехмерные микроструктуры в высоком разрешении. Поскольку SEM работает в условиях высокого вакуума, требуется удаление до или более 99% ?...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Авторы хотели бы поблагодарить Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP) за предоставление финансовой поддержки (Грант #2019/03746-0). MOB благодарит за стипендию доктора философии, полученную от FAPESP (процесс 2021/08013-0) и Coordenação de Aperfeiçoamento de Pessoal de Nível Superior - Brazil (CAPES) - Финансовый код 001. AR также благодарит Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) за исследовательскую стипендию (#305269/2018). Авторы хотели бы поблагодарить Марсию Регину де Моура Ауада и Антонио Теруёси Ябуки за помощь в проведении пилотных испытаний для подготовки образцов, Ренато Барбоза Салароли за техническую помощь и Энцо Соррентино за помощь в фотосъемке. Данное исследование проводилось в рамках разрешения на доступ к генетическому наследию #SISGen AA39A6D.
Материалы
| Name | Company | Catalog Number | Comments |
| 2 mL tube | Axygen | MCT-200-C-BRA | To fix and dehydrate samples |
| Calcium chloride anhydrous | Merck | C4901 | CaCl2 anhydrous to prepare Karnovsky’s fixative |
| Critical point dryer | Leica | EM CPD 300 | For critical point drying |
| Double Sided Carbon Conductive Tape, 12 mm (W) X 5 M (L) | Electron Microscopy Sciences | 77819-12 | For mounting samples |
| Entomological forceps | No specific supplier | To manipulate garden samples | |
| Ethyl alcohol (=ethanol), pure (≥99.5%) | Sigma-Aldrich | 459836 | For dehydration |
| Forceps | No specific supplier | To manipulate garden samples | |
| Glass beaker | No specific supplier | For dehydration | |
| Glass Petri dish | No specific supplier | To manipulate garden samples | |
| Glass pipette | No specific supplier | To fix and dehydrate samples | |
| Glutaraldehyde (Aqueous Glutaraldehyde EM Grade 25%) | Electron Microscopy Sciences | 16220 | To prepare Karnovsky’s fixative |
| Gold target | Ted Pella, Inc. | 8071 | To sputter coat with gold |
| Hydrochloric acid | Sigma-Aldrich | 320331 | For adjusting solutions pH |
| Image editor | Photoshop | any version | To adjust images |
| Paraformaldehyde (Paraformaldehyde 20% Aqueous Solution EM Grade) | Electron Microscopy Sciences | 15713 | To prepare Karnovsky’s fixative |
| Propilene recipient | No specific supplier | For maintaining alive ant colonies | |
| Scanning Electron Microscope | JEOL | IT300 SEM | For sample imaging |
| Sodium cacodylate trihydrate | Sigma-Aldrich | C0250 | For preparing sodium cacodylate buffer |
| Spatula | No specific supplier | To manipulate garden samples | |
| Specimen containers with 15 mm dia. x 10 mm high | Ted Pella, Inc. | 4591 | For critical point drying |
| Sputter coater | Baltec | SCD 050 | To coat with gold |
| Stub (Aluminium mount, flat end pin) 12.7 mm x 8 mm | Electron Microscopy Sciences | 75520 | For mounting samples |
Ссылки
- Turner, M. G. Landscape ecology: the effect of pattern on process. Annu Rev Ecol Evol Syst. 20 (1), 171-197 (1989).
- Rietkerk, M., Van de Koppel, J. Regular pattern formation in real ecosystems. Trends Ecol Evol. 23 (3), 169-175 (2008).
- Schmitz, O. J. Spatial dynamics and ecosystem functioning. PLOS Biol. 8 (5), e1000378 (2010).
- Pringle, R. M., Doak, D. F., Brody, A. K., Jocqué, R., Palmer, T. M. Spatial pattern enhances ecosystem functioning in an African savanna. PLOS Biol. 8 (5), e1000377 (2010).
- Wimpenny, J. W. Spatial order in microbial ecosystems. Biol Rev. 56 (3), 295-342 (1981).
- Martiny, J. B. H., et al. Microbial biogeography: putting microorganisms on the map. Nat Rev. Microbiol. 4 (2), 102-112 (2006).
- McCallum, G., Tropini, C. The gut microbiota and its biogeography. Nat Rev Microbiol. 22 (2), 105-118 (2024).
- Lamont, R. J., Hajishengallis, G., Koo, H. Social networking at the microbiome-host interface. Infec Immun. 91 (9), e00124-e00223 (2023).
- Welch, J. L. M., Rossetti, B. J., Rieken, C. W., Dewhirst, F. E., Borisy, G. G. Biogeography of a human oral microbiome at the micron scale. Proc Natl Acad Sci USA. 113 (6), E791-E800 (2016).
- Kim, D., et al. Spatial mapping of polymicrobial communities reveals a precise biogeography associated with human dental caries. Proc Natl Acad Sci USA. 117 (22), 12375-12386 (2020).
- Swidsinski, A., Weber, J., Loening-Baucke, V., Hale, L. P., Lochs, H. Spatial organization and composition of the mucosal flora in patients with inflammatory bowel disease. J Clin Microbiol. 43 (7), 3380-3389 (2005).
- Ibberson, C. B., Barraza, J. P., Holmes, A. L., Cao, P., Whiteley, M. Precise spatial structure impacts antimicrobial susceptibility of S. aureus in polymicrobial wound infections. Proc Natl Acad Sci USA. 119 (51), e2212340119 (2022).
- Azimi, S., Lewin, G. R., Whiteley, M. The biogeography of infection revisited. Nat Rev Microbiol. 20 (10), 579-592 (2022).
- Dejea, C. M., et al. Microbiota organization is a distinct feature of proximal colorectal cancers. Proc Natl Acad Sci USA. 111 (51), 18321-18326 (2014).
- Hanson, C. A., Fuhrman, J. A., Horner-Devine, M. C., Martiny, J. B. Beyond biogeographic patterns: processes shaping the microbial landscape. Nat Rev Microbiol. 10 (7), 497-506 (2012).
- Adade, E. E., Al Lakhen, K., Lemus, A. A., Valm, A. M. Recent progress in analyzing the spatial structure of the human microbiome: Distinguishing biogeography and architecture in the oral and gut communities. Curr Opin Endocr. 18, 275-283 (2021).
- Mony, C., Bohannan, B. J., Leibold, M. A., Peay, K., Vandenkoornhuyse, P. Microbial landscape ecology: Highlights on the invisible corridors. Front Ecol Evol. 9, 753213 (2021).
- Hölldobler, B., Wilson, E. O. . The Ants. , (1990).
- Chapela, I. H., Rehner, S. A., Schultz, T. R., Mueller, U. G. Evolutionary history of the symbiosis between fungus-growing ants and their fungi. Science. 266 (5191), 1691-1694 (1994).
- Mueller, U. G., Rehner, S. A., Schultz, T. R. The evolution of agriculture in ants. Science. 281 (5385), 2034-2038 (1998).
- Mueller, U. G., Gerardo, N. M., Aanen, D. K., Six, D. L., Schultz, T. R. The evolution of agriculture in insects. Annu Rev Ecol Evol Syst. 36, 563-595 (2005).
- Dentinger, B. T., Lodge, D. J., Munkacsi, A. B., Desjardin, D. E., McLaughlin, D. J. Phylogenetic placement of an unusual coral mushroom challenges the classic hypothesis of strict coevolution in the Apterostigma pilosum group ant-fungus mutualism. Evolution. 63 (8), 2172-2178 (2009).
- Schultz, T. R., Brady, S. G. Major evolutionary transitions in ant agriculture. Proc Natl Acad Sci USA. 105, 5435-5440 (2008).
- de Fine Licht, H. H., Boomsma, J. J. Forage collection, substrate preparation, and diet composition in fungus-growing ants. Ecol Entomol. 35 (3), 259-269 (2010).
- Martin, M. M. The biochemical basis of the fungus-attine ant symbiosis: A complex symbiosis is based upon integration of the carbon and nitrogen metabolisms of the two organisms. Science. 169 (3940), 16-20 (1970).
- Grell, M. N., et al. The fungal symbiont of Acromyrmex leaf-cutting ants expresses the full spectrum of genes to degrade cellulose and other plant cell wall polysaccharides. BMC Genomics. 14, 928 (2013).
- Lange, L., Grell, M. N. The prominent role of fungi and fungal enzymes in the ant-fungus biomass conversion symbiosis. Appl Microbiol Biotechnol. 98, 4839-4851 (2014).
- Huang, E. L., et al. The fungus gardens of leaf-cutter ants undergo a distinct physiological transition during biomass degradation. Environ Microbiol Rep. 6 (4), 389-395 (2014).
- Craven, S. E., Dix, M. W., Michaels, G. E. Attine fungus gardens contain yeasts. Science. 169 (3941), 184-186 (1970).
- De Fine Licht, H. H., Boomsma, J. J., Tunlid, A. Symbiotic adaptations in the fungal cultivar of leaf-cutting ants. Nat Commun. 5 (1), 5675 (2014).
- Aylward, F. O., et al. Enrichment and broad representation of plant biomass-degrading enzymes in the specialized hyphal swellings of Leucoagaricus gongylophorus, the fungal symbiont of leaf-cutter ants. PLoS One. 10 (8), e0134752 (2015).
- Moreira-Soto, R. D., Sanchez, E., Currie, C. R., Pinto-Tomás, A. A. Ultrastructural and microbial analyses of cellulose degradation in leaf-cutter ant colonies. Microbiology. 163 (11), 1578-1589 (2017).
- Erthal Jr, M., Silva, C. P., Cooper, R. M., Samuels, R. I. Hydrolytic enzymes of leaf-cutting ant fungi. Comp Biochem. 152 (1), 54-59 (2009).
- North, R. D., Jackson, C. W., Howse, P. E. Communication between the fungus garden and workers of the leaf-cutting ant, Atta sexdens rubropilosa, regarding choice of substrate for the fungus. Physiol Entomol. 24 (2), 127-133 (1999).
- Herz, H., Hölldobler, B., Roces, F. Delayed rejection in a leaf-cutting ant after foraging on plants unsuitable for the symbiotic fungus. Behav Ecol. 19 (3), 575-582 (2008).
- Schiøtt, M., De Fine Licht, H. H., Lange, L., Boomsma, J. J. Towards a molecular understanding of symbiont function: identification of a fungal gene for the degradation of xylan in the fungus gardens of leaf-cutting ants. BMC Microbiol. 8, 40 (2008).
- Bot, A. N., Currie, C. R., Hart, A. G., Boomsma, J. J. Waste management in leaf-cutting ants. Ethol Ecol Evol. 13 (3), 225-237 (2001).
- Scott, J. J., et al. Microbial community structure of leaf-cutter ant fungus gardens and refuse dumps. PLOS One. 5 (3), e9922 (2010).
- Lewin, G. R., et al. Cellulose-enriched microbial communities from leaf-cutter ant (Atta colombica) refuse dumps vary in taxonomic composition and degradation ability. PLOS One. 11 (3), e0151840 (2016).
- Suen, G., et al. An insect herbivore microbiome with high plant biomass-degrading capacity. PLOS Genet. 6 (9), e1001129 (2010).
- Aylward, F. O., et al. Convergent bacterial microbiotas in the fungal agricultural systems of insects. MBio. 5 (6), e02077 (2014).
- Barcoto, M. O., et al. Fungus-growing insects host a distinctive microbiota apparently adapted to the fungiculture environment. Sci Rep. 10 (1), 12384 (2020).
- Francoeur, C. B., et al. Bacteria contribute to plant secondary compound degradation in a generalist herbivore system. mBio. 11, e02146-e02220 (2020).
- Martiarena, M. J. S., Deveau, A., Montoya, Q. V., Flórez, L. V., Rodrigues, A. The hyphosphere of leaf-cutting ant cultivars is enriched with helper bacteria. Microb Ecol. 86 (3), 1773-1788 (2023).
- Leal-Dutra, C. A., et al. Evidence that the domesticated fungus Leucoagaricus gongylophorus recycles its cytoplasmic contents as nutritional rewards to feed its leafcutter ant farmers. IMA Fungus. 14 (1), 19 (2023).
- Sosa-Calvo, J., Jesovnik, A., Okonski, E., Schultz, T. R. Locating, collecting, and maintaining colonies of fungus-farming ants (Hymenoptera: Myrmicinae: Attini). Sociobiology. 62 (2), 300-320 (2015).
- Karnovsky, M. J. A formaldehyde glutaraldehyde fixative of high osmolality for use in electron microscopy. J Cell Biol. 27, 137-138 (1965).
- Eltoum, I., Fredenburgh, J., Myers, R. B., Grizzle, W. E. Introduction to the theory and practice of fixation of tissues. J Histotechnol. 24 (3), 173-190 (2001).
- Gusnard, D., Kirschner, R. H. Cell and organelle shrinkage during preparation for scanning electron microscopy: effects of fixation, dehydration and critical point drying. J Microsc. 110 (1), 51-57 (1977).
- Surman, S. B., et al. Comparison of microscope techniques for the examination of biofilms. J Microbiol Methods. 25 (1), 57-70 (1996).
- Augustin, J. O., et al. Yet more "weeds" in the garden: fungal novelties from nests of leaf-cutting ants. PLOS One. 8 (12), e82265 (2013).
- Montoya, Q. V., Martiarena, M. J. S., Polezel, D. A., Rodrigues, A. More pieces to a huge puzzle: Two new Escovopsis species from fungus gardens of attine ants. MycoKeys. 46, 97 (2019).
- Varanda-Haifig, S. S., et al. Nature of the interactions between hypocrealean fungi and the mutualistic fungus of leaf-cutter ants. Antonie van Leeuwenhoek. 110, 593-605 (2017).
- Custodio, B. C., Rodrigues, A. Escovopsis kreiselii specialization to its native hosts in the fungiculture of the lower attine ant Mycetophylax morschi. Antonie van Leeuwenhoek. 112, 305-317 (2019).
- Schröttner, H., Schmied, M., Scherer, S. Comparison of 3D surface reconstruction data from certified depth standards obtained by SEM and an Infinite Focus Measurement Machine (IFM). Microchim Acta. 155, 279-284 (2006).
- Zhou, W., Apkarian, R., Wang, Z. L., Joy, D., Zhou, W., Wang, Z. L. Fundamentals of scanning electron microscopy (SEM). Scanning microscopy for nanotechnology: Techniques and applications. , 1-40 (2007).
- Kannan, M., Raja, K., Subramanian, K. S., Kannan, M. Scanning electron microscopy: Principle, components and applications. A Textbook on Fundamentals and Applications of Nanotechnology. , 81-92 (2018).
- Ruffolo, J. J. Critical point drying of protozoan cells and other biological specimens for scanning electron microscopy: apparatus and methods of specimen preparation. Trans Am Microsc. 93 (1), 124-131 (1974).
- Echlin, P. Recent advances in specimen coating techniques for electron microscopy. Scanning Electron Microscopy 1981/1. , 79-90 (1981).
- Ris, H. The cytoplasmic filament system in critical point-dried whole mounts and plastic-embedded sections. J Cell Biol. 100 (5), 1474-1487 (1985).
- Bray, D. F., Bagu, J., Koegler, P. Comparison of hexamethyldisilazane (HMDS), Peldri II, and critical-point drying methods for scanning electron microscopy of biological specimens. Microsc Res Tech. 26 (6), 489-495 (1993).
- Bergmans, L., Moisiadis, P., Van Meerbeek, B., Quirynen, M., Lambrechts, P. Microscopic observation of bacteria: review highlighting the use of environmental SEM. Int Endod J. 38 (11), 775-788 (2005).
- Kirk, S. E., Skepper, J. N., Donald, A. M. Application of environmental scanning electron microscopy to determine biological surface structure. J Microsc. 233 (2), 205-224 (2009).
- Kemmenoe, B. H., Bullock, G. R. Structure analysis of sputter-coated and ion-beam sputter-coated films: a comparative study. J Microsc. 132 (2), 153-163 (1983).
- Kinden, D. A., Brown, M. F. Technique for scanning electron microscopy of fungal structures within plant cells. Phytopathology. 65, 74-76 (1975).
- Masaphy, S., Levanon, D., Tchelet, R., Henis, Y. Scanning electron microscope studies of interactions between Agaricus bisporus (Lang) Sing hyphae and bacteria in casing soil. Appl Environ Microbiol. 53 (5), 1132-1137 (1987).
- Massicotte, H. B., Melville, L. H., Peterson, R. L. Scanning electron microscopy of ectomycorrhizae potential and limitations. Scanning Microsc. 1 (3), 58 (1987).
- Visen, A., Singh, P. N., Chakraborty, B., Singh, A., Bisht, T. S. Scanning electron microscopy indicates Pseudomonad strains facilitate AMF mycorrhization in litchi (Litchi chinensis Sonn.) air-layers and improving survivability, growth and leaf nutrient status. Curr Res Microb Sci. 2, 100063 (2021).
- Fleeman, R. M., Mikesh, M., Davies, B. W. Investigating Klebsiella pneumoniae biofilm preservation for scanning electron microscopy. Access Microbiol. 5 (2), 000470-000473 (2023).
- Wells, M., Mikesh, M., Gordon, V. Structure-preserving fixation allows scanning electron microscopy to reveal biofilm microstructure and interactions with immune cells. J Microsc. 293 (1), 59-68 (2024).
- Nadell, C. D., Drescher, K., Foster, K. R. Spatial structure, cooperation and competition in biofilms. Nat Rev Microbiol. 14 (9), 589-600 (2016).
- Madsen, J. S., et al. Coexistence facilitates interspecific biofilm formation in complex microbial communities. Environ Microbiol. 18 (8), 2565-2574 (2016).
- Madsen, J. S., Sørensen, S. J., Burmølle, M. Bacterial social interactions and the emergence of community-intrinsic properties. Curr Opin Microbiol. 42, 104-109 (2018).
- Flemming, H. C., Wuertz, S. Bacteria and archaea on Earth and their abundance in biofilms. Nat Rev Microbiol. 17 (4), 247-260 (2019).
- Bringhurst, B., Allert, M., Greenwold, M., Kellner, K., Seal, J. N. Environments and hosts structure the bacterial microbiomes of fungus-gardening ants and their symbiotic fungus gardens. Microb Ecol. 86 (2), 1374-1392 (2023).
- Bringhurst, B., Greenwold, M., Kellner, K., Seal, J. N. Symbiosis, dysbiosis and the impact of horizontal exchange on bacterial microbiomes in higher fungus-gardening ants. Sci Rep. 14 (1), 3231 (2024).
- Vargas, S., et al. Body-plan reorganization in a sponge correlates with microbiome change. Mol Biol Evol. 40 (6), msad138 (2023).
- Apprill, A., et al. Humpback whale populations share a core skin bacterial community: towards a health index for marine mammals. PLOS One. 9 (3), e90785 (2014).
- Fraune, S., et al. Bacteria-bacteria interactions within the microbiota of the ancestral metazoan Hydra contribute to fungal resistance. ISME J. 9 (7), 1543-1556 (2015).
- Gowen, R., Gamal, A., Di Martino, L., McCormick, T. S., Ghannoum, M. A. Modulating the microbiome for Crohn's disease treatment. Gastroenterology. 164 (5), 828-840 (2023).
- Moya, P., et al. Molecular phylogeny and ultrastructure of the lichen microalga Asterochloris mediterranea sp. nov. from Mediterranean and Canary Islands ecosystems. Int J Syst Evol Microbiol. 65 (6), 1838-1854 (2015).
- Zettler, E. R., Mincer, T. J., Amaral-Zettler, L. A. Life in the "plastisphere": microbial communities on plastic marine debris. Environ Sci Technol. 47 (13), 7137-7146 (2013).
- Porter, K. R., Kallman, F. The properties and effects of osmium tetroxide as a tissue fixative with special reference to its use for electron microscopy. Exp Cell Res. 4 (1), 127-141 (1953).
- Ligon, J. J., Abraham, J. L., Boyd, A. S. Traumatic osmium tetroxide inoculation. J Am Acad Dermatol. 45 (6), 949-952 (2001).
- Friedova, N., et al. Osmium absorption after osmium tetroxide skin and eye exposure. Basic Clin Pharmacol Toxicol. 127 (5), 429-433 (2020).
- Fratesi, S. E., Lynch, F. L., Kirkland, B. L., Brown, L. R. Effects of SEM preparation techniques on the appearance of bacteria and biofilms in the Carter Sandstone. J Sediment. 74 (6), 858-867 (2004).
- Dassanayake, R. P., et al. Identification of a reliable fixative solution to preserve the complex architecture of bacterial biofilms for scanning electron microscopy evaluation. PLOS One. 15 (5), e0233973 (2020).
- Desiro, A., et al. Detection of a novel intracellular microbiome hosted in arbuscular mycorrhizal fungi. ISME J. 8 (2), 257-270 (2014).
- Morales, D. P., et al. Advances and challenges in fluorescence in situ hybridization for visualizing fungal endobacteria. Front Microbiol. 13, 892227 (2022).
- Shi, H., et al. Highly multiplexed spatial mapping of microbial communities. Nature. 588 (7839), 676-681 (2020).
- Valm, A. M., Welch, J. L. M., Borisy, G. G. CLASI-FISH: principles of combinatorial labeling and spectral imaging. Syst Appl Microbiol. 35 (8), 496-502 (2012).
- Fernandez-Brime, S., Muggia, L., Maier, S., Grube, M., Wedin, M. Bacterial communities in an optional lichen symbiosis are determined by substrate, not algal photobionts. FEMS Microbiol Ecol. 95 (3), fiz012 (2019).
- Schluter, S., Eickhorst, T., Mueller, C. W. Correlative imaging reveals holistic view of soil microenvironments. Environ Sci Technol. 53 (2), 829-837 (2018).
- Barcoto, M. O., Rodrigues, A. Lessons from insect fungiculture: from microbial ecology to plastics degradation. Front Microbiol. 13, 812143 (2022).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены