Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстрый и простой рабочий процесс для количественной оценки внешних структур взрослой дрозофилы
В этой статье
Резюме
В этой статье мы представляем быстрый, недорогой рабочий процесс визуализации глаз взрослых дрозофил с высоким разрешением для количественной оценки паттернов и дефектов роста. Мы описываем наш протокол подготовки образцов путем точечного монтажа, получения изображений с высоким разрешением и анализа изображений.
Аннотация
Сложный глаз дрозофилы представляет собой точно структурированную ткань, которая выявила молекулярные механизмы и биологические процессы, управляющие морфогенезом. Это простая структура повторяющихся единичных глаз, называемая омматидией, которая используется для характеристики генетических взаимодействий и функций генов. Мутации, влияющие на архитектуру глаза, могут быть легко обнаружены и проанализированы; Следовательно, эта система часто используется в учреждениях с ограниченными ресурсами. Дальнейший фенотипический анализ часто включает в себя сканирующий электронный микроскоп (СЭМ) для получения изображений с большим увеличением, пригодных для количественного анализа. Тем не менее, СЭМ дороги и требуют дорогостоящих реагентов; пробоподготовка занимает дни; И, зачастую, им нужен штатный персонал для подготовки образцов и обслуживания приборов. Это ограничивает их полезность в учреждениях с ограниченными ресурсами или во время жесткой бюджетной экономии. В энтомологии использование технологии цифровой визуализации с высоким разрешением является обычной практикой для идентификации и характеристики видов. В данной статье описывается метод, который сочетает в себе стратегии и позволяет получать цифровую визуализацию структур взрослых дрозофил с высоким разрешением и количественный анализ с использованием открытого программного обеспечения ImageJ. Рабочий процесс представляет собой быструю и удобную для студентов альтернативу, которая устраняет ограничения недостаточно финансируемых и необеспеченных ресурсами исследовательских учреждений с помощью экономически эффективного и быстрого подхода к количественному фенотипическому анализу.
Введение
Drosophila melanogaster является мощным генетическим модельным организмом, который десятилетиями использовался для выяснения молекулярных сигнальных путей и клеточного поведения. Многие из эволюционно консервативных сигнальных путей, которые необходимы для многоклеточного развития, были впервые идентифицированы, а механизм их действия определен у дрозофилы. Около 65-75% всех генов, ассоциированных с заболеванием человека, имеют ортологи у дрозофил 1,2. Глаз взрослой дрозофилы является важной моделью, которая позволила провести беспристрастный генетический скрининг, способствовавший открытию важных консервативных генов, вовлеченных в заболевания человека, включая рак 3,4,нейродегенерацию 5 и метаболическиерасстройства.
Глаз дрозофилы состоит из ~800 единичных глаз, называемых омматидиями, которые точно расположены в гексагональном узоре по всейповерхности глаза взрослого человека. Каждый омматидий состоит из восьми фоторецепторных нейронов, которые занимают определенное место в асимметричной трапеции. Они поддерживаются четырьмя ненейральными колбочками и двумя первичными пигментными клетками, которые выделяют хрусталик и псевдоколбочку для фокусировки света на светочувствительные рабдомеры фоторецепторных нейронов. Соседние омматидии разделены одним рядом интеромматидиальных решетчатых клеток, состоящих из вторичных пигментных клеток, третичных пигментных клеток и механосенсорных щетинных комплексов 8,9,10.
Нарушения в развитии глаз у взрослых людей проявляются в виде увеличения или уменьшения размера глаз, аномального количества или структуры хрусталиков или щетины, или в виде «шершавого глаза», при котором обычно инвариантный гексагональный узор нарушается таким образом, что ряд омматидий больше не может быть прослежен по поверхности глаза. Эти фенотипы могут быть оценены на уровне валовой ткани с помощью препарирующих микроскопов. Детальный анализ фенотипов традиционно включает в себя сканирующую электронную микроскопию с последующим количественным анализом изображений11. Тем не менее, сканирующая электронная микроскопия требует дорогостоящих инструментов, дорогостоящих реагентов, подготовки образцов, которая занимает несколько дней, и часто для обслуживания штатного персонала.
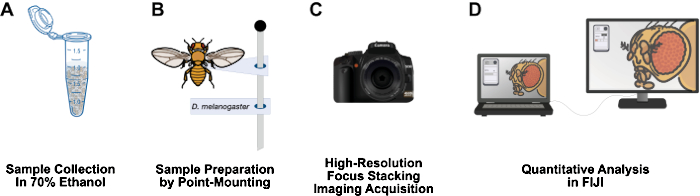
Рисунок 1: Рабочий процесс визуализации структур взрослой дрозофилы . (А) Соберите и закрепите взрослых дрозофил в 70% этаноле. (B) Подготовьте образцы для визуализации путем точечного монтажа и крепления к штифтам. (C) Получение изображений с высоким разрешением с помощью фокус-стекинга и интеграции. (D) Количественная оценка изображений с использованием ФИДЖИ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
В этой статье представлен рабочий процесс, который относительно недорогой, имеет короткое время подготовки образца, может быть легко установлен на 3-футовом лабораторном столе, не требует опасных материалов и может стать долгоживущим дополнением к исследовательским лабораториям дрозофил (Рисунок 1). Точечный монтаж — это энтомологический метод, используемый для сушки на воздухе и сохранения мелких мягкотелых насекомых, таких как дрозофила12. Этот метод основан на сочетании объективов микроскопа с цифровыми зеркальными камерами высокого разрешения для эффективного увеличения от 10x до 1000x. Ограниченная глубина резкости, присущая макрофотографии, преодолевается с помощью фокусного стекинга: сшивания серии изображений с фокальной плоскостью, проходящей через интересующий образец13. Этот метод дает изображения с высоким разрешением, пригодные для количественной оценки фенотипов, и может быть легко адаптирован для других представляющих интерес структур, таких как крыло, нога, грудная клетка и брюшная полость. Для анализа изображений используется бесплатная программа анализа изображений FIJI (NIH ImageJ). Эта методология делает подготовку образцов, визуализацию и анализ с высоким разрешением доступными для студентов бакалавриата и ученых в учреждениях с ограниченными ресурсами.
протокол
1. Сбор и фиксация взрослых дрозофил
- Установите скрещивание дрозофил или выберите штаммы и поместите их во флаконы с кормом для мух. Инкубируйте флаконы при желаемой температуре (обычно 25 °C) до тех пор, пока мухи не разовьются, а взрослые особи не приблизятся (~10-14 дней при 25 °C).
- Обезболите мух CO2 и поместите их на подушечку CO2 .
- Отсортируйте мух по перышку и выберите особей с желаемым фенотипом (например, с прямыми крыльями). Сделайте сортировщик перьевых мух, обрезав гусиное перо так, чтобы оно поместилось на коническом конце серологической пипетки объемом 1 мл.
- Приготовьте микроцентрифужную пробирку объемом 1,7 мл с 1 мл 70% этанола. Поместите выбранных мушек в микроцентрифужную пробирку и положите на лед. Храните микроцентрифужные пробирки при температуре 4 °C в течение ночи (Рисунок 2A).
ПРИМЕЧАНИЕ: Не храните мух в этаноле более 24 часов. Длительное хранение мух в 70% этаноле приведет к потере пигмента глаз и тела.
2. Пробоподготовка методом точечного монтажа
ПРИМЕЧАНИЕ: Дрозофилы - это мягкотелые насекомые, которые становятся хрупкими и разрушаются при сушке на воздухе; Таким образом, этот протокол требует, чтобы образцы были сфотографированы в тот же день, когда они были смонтированы. Работайте небольшими группами по ~5 мушек за раз, чтобы предотвратить потерю пробы. Увеличивайте количество образцов в наборе в зависимости от эффективности. Образцы, которым требуется больше времени перед визуализацией, могут быть обезвожены за счет увеличения концентрации гексаметилдисилазана (HMDS)14.
- Вырежьте небольшие треугольные точки (7,1 мм x 2,7 мм) из архивного картона весом 65 фунтов с помощью специализированного точечного дырокола. Подготовьте точки, согнув наконечник (самый узкий 25%) под углом 90° с помощью щипцов Dumont #5 с тонким наконечником (Рисунок 2B).
- С помощью щипцов Dumont #5 с тонким наконечником удалите мух из микроцентрифужных пробирок (шаг 1.4). Аккуратно промокните мух безворсовой лабораторной салфеткой, чтобы удалить излишки этанола. Расположите каждую муху с левой стороны на карточке под микроскопом для препарирования.
ПРИМЕЧАНИЕ: Удалите мух из трубки, держась за анатомическую структуру, которая не является областью интереса - при визуализации головы мы держим образцы за крыло или ногу. Не держите образцы за брюшную полость, так как эта структура используется для приклеивания мушки к точке карты. - Приготовьте клей для кожи, доведя его консистенцию до нужной вязкости. Смешайте 1-2 капли клея для кожи с 1-2 каплями деионизированной (DI) воды и смешайте с помощью пипетки для переноса на карточке. Возьмите подготовленную картонную точку на широком конце щипцами и нанесите небольшое количество разбавленного клея на согнутый кончик острия, смочив его в смеси клея и воды (рисунок 2C).
ПРИМЕЧАНИЕ: Клей должен быть растекающимся, но не жидким. - Приложите согнутый кончик точки к передней стороне правой брюшной полости вокруг сегментов живота 2-3 (рисунок 2В). Прежде чем клей высохнет, внесите небольшие коррективы в ширинку так, чтобы передняя и задняя ось мушки была перпендикулярна изогнутому кончику острия.
- Вставьте монтажный штифт No 3 в широкий конец точки для карты (Рисунок 2D) и закрепите его на блоке для прикалывания насекомых (Рисунок 2E). Пометьте каждый контакт или ряд контактов соответствующим генотипом.

Рисунок 2: Подготовка образцов. (A) Взрослые дрозофилы сортируются на основе фенотипических маркеров и собираются в помеченные микроцентрифужные пробирки, содержащие 70% этанола на льду. Мух хранят при температуре 4°C в течение ночи. (B) Бумажные точки для карт подготавливаются путем сгибания узкого конца на 90° от остальной части карты с помощью пары щипцов #5. (C) Мухи извлекаются из трубок и на короткое время дают высохнуть на воздухе. Клей для шкуры наносят на маленький, загнутый конец подготовленной картонной точки и приклеивают к взрослой мухе по 2-3 брюшных сегмента. (D) Образцы крепятся с идентификационной этикеткой на штифт из нержавеющей стали #3 из нержавеющей стали. (E) Закрепленные образцы хранятся на доске образца до тех пор, пока они не будут готовы к получению изображения. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
3. Получение изображений с высоким разрешением с фокусным стекированием
- Получайте фотографии глаз мух с высоким разрешением с помощью собранной и настроенной системы визуализации с фокусным стекированием, собранной и настроенной.
- Снимайте фотографии с помощью корпуса цифровой зеркальной камеры с телеобъективом 70–200 мм, подключенным к объективу 20-кратного микроскопа Apo с помощью адаптера для объектива 77 мм.
- Следите за тем, чтобы образец освещался вспышкой через рассеиватель (рис. 3).
- Управляйте позиционированием по оси Z с помощью контроллера Stackshot и Macro Rail.
- Подключите камеру, вспышку и моторизованную сцену к сверхпрочному штативу из анодированного алюминия.
- Расположите каждый точечный образец на универсальном сценическом подвесе так, чтобы голова была направлена так, чтобы глаз был обращен к линзе. Отрегулируйте положение головы, осторожно перемещая голову с помощью щипцов.
ВНИМАНИЕ: Большие и быстрые регулировки могут привести к случайному обезглавливанию. - Когда камера подключена к ноутбуку, отрегулируйте параметры съемки в программном обеспечении. Фотографируйте образцы с 20-кратным увеличением со следующими настройками: мощность вспышки 1/32, выдержка 1/200, диафрагма F2.8 и ISO 400. Убедитесь, что все функции автофокусировки и стабилизации изображения отключены.
ПРИМЕЧАНИЕ: Эти настройки уравновешивают оптимальную освещенность вспышки, выдержку и глубину резкости. Их нужно будет настроить для других увеличений и/или комбинаций линз. - Задайте место для сохранения полученной стопки изображений (10-50 изображений) в нужную папку с файлами. Убедитесь, что объем хранилища достаточен для изображений (~8,5 МБ на изображение).
- Отрегулируйте параметры стека фокусировки на блоке управления Stackshot в режиме «Автоматическое расстояние ».
- Установите размер шага на 5 μм и рассчитайте количество шагов, установив начальное и конечное положения стека фокусировки.
- Просмотрите образец в режиме LiveView и с помощью фотокамеры в режиме автоматической съемки, чтобы определить начальное и конечное положения.
- Переместите рельс так, чтобы ближайшая часть образца оказалась в фокусе (установите начальное положение), затем переместите туда, где в фокусе находится самый дальний интересующий объект (установите конечное положение).
- Вернитесь в режим ручной съемки и начните получение изображения с блока управления Stackshot.
ПРИМЕЧАНИЕ: Время получения изображения зависит от размера образца. Чем больше глубина резкости, необходимая для больших образцов, тем больше срезов включается в стек изображений, что продлевает общее время съемки. - Откройте файлы в указанном программном обеспечении для совмещения фокуса. Сгенерируйте сложенное изображение, нажав «Сложить» | Align & Stack All (PMax).
- Сохраните итоговое изображение на жестком диске компьютера в виде файла .tif, нажав Файл | Сохраните выходное изображение.
ПРИМЕЧАНИЕ: В зависимости от разрешения файла образа и количества отображаемых образцов для резервного копирования образа могут потребоваться внешние жесткие диски большого размера (1 ТБ). В этом протоколе размер стековых образов составляет примерно 100 МБ каждый до сжатия.

Рисунок 3: Получение изображений. (A) Устройство обработки изображений с частями со следующей маркировкой: a) Корпус цифровой зеркальной камеры; б) телеобъектив; в) 20-кратный объектив и адаптер для микроскопа Apo; г) Вспышка; д) линзовые и купольные рассеиватели; f) Stackshot Controller, Macro Rail и Rotary Stage; ж) Универсальный сценический кардан; з) Штатив. (B) Аппарат визуализации с установленным рассеивателем света. (C) Крупный план установленного образца в положении для визуализации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
4. Рабочий процесс анализа FIJI для расчета площади глаз взрослого человека
- Для анализа изображений можно приобрести программное обеспечение FIJI15 на веб-сайте ImageJ.net.
- Выбирайте изображения для анализа, на которых глаз центрирован и выровнен с достаточным освещением и минимальным размытием по периферии, что указывает на правильное выравнивание по камере.
- Откалибруйте шкалу изображения.
- Загрузите изображение масштабной линейки для 20-кратного увеличения, которое коррелирует с 500 мкм. В качестве альтернативы, во время получения изображения, фотографируйте линейку с теми же настройками. Откройте изображение в программе FIJI.
- Измерьте длину масштабной линейки (рис. 4A). Используйте инструмент Прямая линия (Straight Line Tool ), чтобы точно обвести линию. Нажмите «Анализировать» | Измерьте. Это расстояние в пикселях эквивалентно 500 мкм (рис. 4B).
- Рассчитайте пиксели на микрон. Используйте его для преобразования измерений в пикселях в микрометрические измерения.
- Откройте файл изображения в стеке в FIJI (Рисунок 4C).
- Выберите «Лупа» на панели инструментов, чтобы увеличить область фокусировки. Постарайтесь заполнить экран глазом и непосредственной кутикулой вокруг головы (Рисунок 4D).
- Выберите инструмент «Выбор от руки » на панели инструментов. Очертите область сетчатки как можно точнее, следуя контурам самого дальнего ряда омматидий (рисунок 4E). Чтобы удалить часть выделенной области, удерживайте нажатой кнопку выбора и выберите пиксели для удаления. Чтобы добавить к выделению, удерживайте нажатыми кнопки Option и Shift и выберите пиксели для добавления.
- Чтобы рассчитать площадь, выберите Анализ | Измерьте в верхнем меню (рис. 4F). Появится новое окно с параметрами площади, среднего, минимума и максимума . Скопируйте и вставьте эти данные в электронную таблицу для документирования и преобразования из пикселей в микрометрические измерения.
- Выполняйте соответствующий статистический анализ.
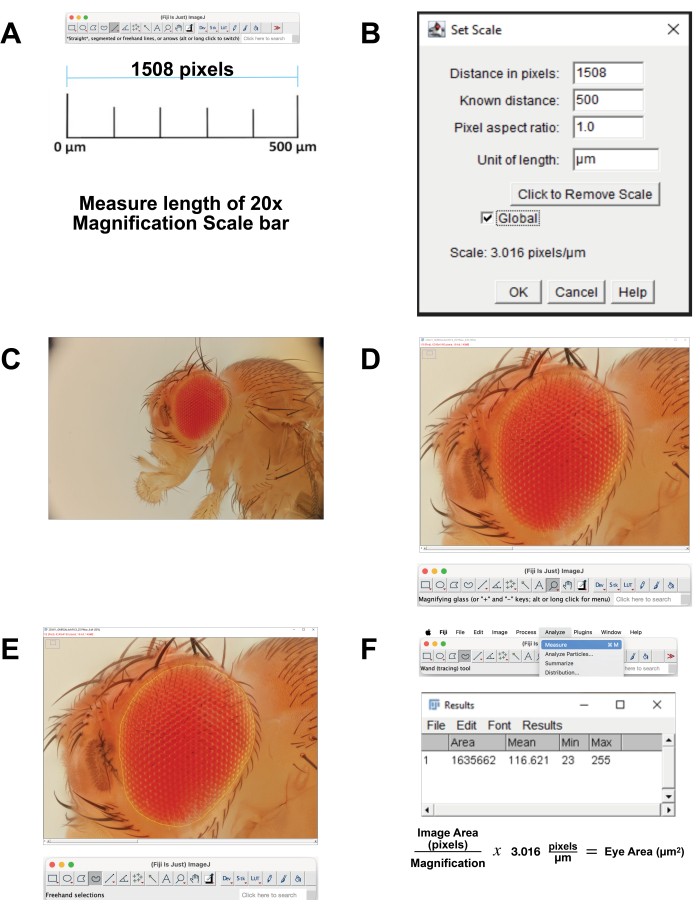
Рисунок 4: Анализ изображения на Фиджи. (A) Масштабирование исходного изображения. Загрузите калибровочное изображение и измерьте длину стержня 500 мкм. (B) Отрегулируйте масштабирование с помощью функции «Установить масштаб ». (C) Откройте сложенное изображение. (D) Увеличьте изображение так, чтобы глаз был центрирован и почти на весь экран. (E) С помощью инструмента «Выделение от руки » обведите контуром глаз на границе между крайним рядом омматидий и окружающей кутикулой. (F) Измерьте площадь в пределах выбранной области, рассчитанную нажатием кнопки Анализ | Мера | Площадь. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Результаты
Глаз дрозофилы является отличной модельной системой для изучения структуры тканей, контроля роста и гибели клеток. Недавно мы опубликовали исследование, в котором изучалось, как внутриклеточный pH (pHi) влияет на рост тканей. Во-первых, мы создали генетическую сист?...
Обсуждение
Здесь мы опишем метод подготовки образцов, визуализации с высоким разрешением и анализа структур взрослых дрозофил. Глаз дрозофилы представляет собой генетически управляемую модельную систему, которая позволила получить важнейшее представление о молеку?...
Раскрытие информации
У авторов нет конфликта интересов, который можно было бы раскрыть.
Благодарности
Авторы хотели бы поблагодарить сотрудников лаборатории pHly в Грилло-Хилле за обсуждения и поддержку. Мы благодарим Тима Андриезе, Рэнди Киршнера, Китти (Нгок-Хыонг) Нгуен, Марко Парента, Джонни Шалуба и Либрадо Велиза за отличную техническую поддержку. Эта работа была поддержана премиями NIH SC3GM132049 и 1R16GM153640 (BKGH), премией CSU за биотехнологические исследования для студентов (LM и BKGH), а также стартовыми фондами от Научного колледжа и факультета биологических наук Государственного университета Сан-Хосе (FJL). Особого упоминания заслуживает компания Bernd Becker за их находчивость и помощь в этом процессе. Мы благодарим сообщество BioIcons (https://bioicons.com/) за предоставление высококачественных иконок для наших фигур и особенно компании Serviere за иконку пипетки, а также DBCLS за иконки дрозофилы, щипцов и настольных электронных микроскопов, используемые на рисунках 1 и 2, которые лицензированы под лицензией CC-BY 4.0 Unported. Мы также благодарим сообщество SciDraw (https://scidraw.io/) за предоставление высококачественных иконок для наших фигурок, особенно Diogo Losch De Oliveira (doi.org/10.5281/zenodo.3925953), которые лицензированы по лицензии Creative Commons 4.0 (CC-BY).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL serological pipette | ThermoFisher Scientific | 170353N | |
| 1.7 mL microcentrifuge tubes | Genesee Scientific | 24-282LR | |
| 20x Apo Microscope Objective | Mitutoyo Corp. | 378-804-3 | |
| Archival 65 lb cardstock | Neenah, Inc. | 91901 | |
| Canon EF 70-200 mm USM II telephoto lens | Canon | 3044C002 | |
| Canon EOS 6D Mark II DSLR Camera Body | Canon | 1897C002 | |
| Diffuser Dome | Macroscopic Solutions | PA-DIF-GIM-SM | |
| Diffuser for Mitutoyo M Plan APO Objectives | Macroscopic Solutions | mitutoyo-diffusers | |
| Drosophila vials and plugs | Genesee Scientific | 32-117BF | |
| Dumont #5 fine-tip forceps | Fisher Scientific | NC9889584 | |
| Goose feathers | Amazon | B01CMMJI6U | |
| Heavy-Duty Anodized Aluminum Tripod | Really Right Stuff, LLC | TFA-32G | |
| Kimwipes | Fisher Scientific | 06-666A | lint-free lab tissue |
| Levenhuk M1000 Plus Digital Camera | Levenhuk | 70358 | |
| No. 3 mounting pin | Indigo Instruments | 33414-3 | |
| Nutri-Fly Bloomington Drosophila media | Genesee Scientific | 66-113 | fly food |
| Point-Punch | M.C. Mieth Manufacturing, Inc. | 448Detail | |
| Screwknob Clamp | Really Right Stuff, LLC | SK-Clamp | For attaching the macro rail to the tripod |
| Stackshot Controller and Macro Rail | Cognisys Inc. | ST3X_100_BUNDLE | |
| Step-down Ring Adapter | RAF Camera | 763461174207 | Lens adapter to connect the microscope objective to the camera lens |
| Titebond Glue | Franklin International | 5013 | |
| Yongnuo YN-24-EX Macro Twin Lite Flash | Shenzhen Yongnuo Photographic Equipment Co. | YN-24EX | |
| Software | |||
| Canon EOS Utility (v. 3.16.1). | Canon | acquisition software | |
| FIJI | National Institutes of Health | Fiji is released as open source under the GNU General Public License. FIJI Version 2.14.0/1.54f | |
| GraphPad Prism | GraphPad Software, Boston, Massachusetts USA | Prism Version 10.3.1 | |
| Zerene Stacker (v.1.04) | Zerene Systems, LLC | Focus Stacking Software |
Ссылки
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287 (5461), 2204-2215 (2000).
- Ugur, B., Chen, K., Bellen, H. J. Drosophila tools and assays for the study of human diseases. Dis Model Mech. 9 (3), 235-244 (2016).
- Hodgson, J. A., Parvy, J. -. P., Yu, Y., Vidal, M., Cordero, J. B. Drosophila larval models of invasive tumorigenesis for in vivo studies on tumour/peripheral host tssue interactions during cancer cachexia. Int J Mol Sci. 22 (15), 8317 (2021).
- Lam Wong, K. K., Verheyen, E. M. Metabolic reprogramming in cancer: mechanistic insights from Drosophila. Dis Model Mech. 14 (7), dmm048934 (2021).
- Bonini, N. M. A perspective on Drosophila genetics and its insight into human neurodegenerative disease. Front Mol Biosci. 9, e1060796 (2022).
- Drummond-Barbosa, D., Tennessen, J. M. Reclaiming Warburg: using developmental biology to gain insight into human metabolic diseases. Development. 147 (11), dev189340 (2020).
- Ready, D. F., Hanson, T. E., Benzer, S. Development of the Drosophila retina, a neurocrystalline lattice. Dev Biol. 53 (2), 217-240 (1976).
- Johnson, R. I. Hexagonal patterning of the Drosophila eye. Dev Biol. 478, 173-182 (2021).
- Weasner, B. P., Kumar, J. P. The early history of the eye-antennal disc of Drosophila melanogaster. Genetics. 221 (1), iyac041 (2022).
- Pichaud, F., Casares, F. Shaping an optical dome: The size and shape of the insect compound eye. Semin Cell Dev Biol. 130, 37-44 (2022).
- Oster, I. I., Crang, R. E. Scanning electron microscopy of Drosophila mutant and wild type eyes. Trans Am Microsc Soc. 91 (4), 600-602 (1972).
- Gibb, T. J., Oseto, C. . Insect collection and identification: Techniques for the field and laboratory. , (2019).
- Mertens, J., Roie, M. V., Merckx, J., Dekoninck, W. The use of low cost compact cameras with focus stacking functionality in entomological digitization projects. ZooKeys. 712, 141-154 (2017).
- Brown, B. V. A further chemical alternative to critical-point-drying for preparing small (or large) flies. Fly Times. 11, 10 (1993).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Method. 9 (7), 676-682 (2012).
- Grillo-Hill, B. K., Choi, C., Jimenez-Vidal, M., Barber, D. L. Increased H+ efflux is sufficient to induce dysplasia and necessary for viability with oncogene expression. eLife. 4, e03270 (2015).
- White, K. A., Grillo-Hill, B. K., Barber, D. L. Cancer cell behaviors mediated by dysregulated pH dynamics at a glance. J Cell Sci. 130 (4), 663-669 (2017).
- Peralta, J., et al. Drosophila Nhe2 overexpression induces autophagic cell death. Mol Biol Cell. 35 (7), br13 (2024).
- Munnik, C., Xaba, M. P., Malindisa, S. T., Russell, B. L., Sooklal, S. A. Drosophila melanogaster: A platform for anticancer drug discovery and personalized therapies. Front Genet. 13, 949241 (2022).
- Nitta, Y., Sugie, A. Studies of neurodegenerative diseases using Drosophila and the development of novel approaches for their analysis. Fly. 16 (1), 275-298 (2022).
- Pletcher, R. C., et al. A genetic screen using the Drosophila melanogaster TRiP RNAi collection to identify metabolic enzymes required for eye development. G3: Genes|Genomes|Genetics. 9 (7), 2061-2070 (2019).
- Bangi, E., et al. A personalized platform identifies trametinib plus zoledronate for a patient with KRAS-mutant metastatic colorectal cancer. Sci Adv. 5 (5), eaav6528 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены