Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Метод культуры раннего куриных эмбрионов исключая виво (Новая Культура)
Резюме
Это видео демонстрирует новую культуру, метод, которым куриные эмбрионы культивируются вне яйца на срок до 24 час. Этот метод позволяет исследовать раннего развития (первичной полоски до 14 сом.), Период, соответствующий E7-9 в мышь. Применение этого метода относятся электропорация, на месте гибридизации и иммуногистохимии.
Аннотация
Куриного эмбриона является ценным инструментом для изучения раннего эмбрионального развития. Его прозрачность, доступность и легкость манипуляций, делают его идеальным инструментом для изучения формирования и структурирования головного мозга, нервной трубки, сомитов и сердце зачатков. Применение куриных эмбрионов культуры включают электропорации ДНК или РНК конструкций для анализа функции гена, трансплантаты фактора роста покрыты бисером, таких как FGFs и БМП, а также целые горы на месте гибридизации и иммуногистохимии. Это видео демонстрирует различные этапы на куриных эмбрионов культуры; Во-первых, эмбрион эксплантированных в солевом растворе. Затем эмбрион сосредоточена на стеклянное кольцо. Мембраны, окружающие эмбрион поднимаются вдоль стенок кольца. Кольцо затем помещены в культуре блюдо с пулом альбуминовой. Культуры блюдо закрывают и помещают во влажную камеру, где эмбрион культивировали в течение до 24 часов. Наконец, эмбрион удаляется из кольца, фиксированная и обработаны для дальнейшего применения. Руководство по устранению неисправностей также представлен.
протокол
Часть 1: Скамья создана
- Влажной камере готовится путем размещения Kimwipe / DDH 2 O в пластиковой камере.
- Трубки Сокол собирать альбумина, посуда для культуры, кольца, препаратного стекла и удаление отходов размещаются на скамейке.
- Pyrex блюдо заполняется 1,4 л физиологического раствора (см. примечания []).
Часть 2: эмбрион эксплантированных в физиологическом растворе
- Яйца будут удалены из инкубатора после 16 часов (этап 4). Яйцо opene, нажав оболочки щипцами. Shell части удаляются.
- Тонкие альбумина собирается в трубке Falcon. Толстый альбумина удаляется пинцетом.
- Эмбрион помещается в пластиковый блюда внутри солевого блюдо. Остальные альбумина удаляется пинцетом.
Часть 3: Эмбрион сосредоточена на кольце
- Желточного мешка наклонена щипцами, чтобы эмбрион лица вверх.
- Желточного мешка разрезается на уровне или ниже экватора.
- Использование тонких щипцов, желточной оболочки стремительно очищенные. Желточной оболочки ориентирован так, что его гранулированных стороне (не детский хоккей) сталкивается вверх.
- Использование тонких щипцов, желточной оболочки находится на часовое стекло.
- Использование тонких щипцов, стеклянное кольцо наносится на верхней части желточной оболочки и зародыша по центру.
- Желточной оболочки поднимается вокруг краев стекла кольцо. Сборки удалено от солевых блюдо.
Часть 4: культура настроена под микроскопом
- Желточной оболочки поднимается над стеклянное кольцо с использованием тонких щипцов под микроскопом.
- Использование пипетки Пастера солевой снимается с внешнего края кольца.
- Использование тонких ножниц, избыток желточной оболочки удаляется из внутренней кромки стекла кольцо. Забота, чтобы не проколоть мембрану с пипеткой или щипцами.
- Эмбрион осторожно промыть физиологическим раствором, чтобы удалить свободные мембраны и желтком клеток.
- 200 мкл солевого добавляется к внешнему краю кольца (это будет способствовать последующей передачи).
- Сборка покрыты перевернутой блюдо пластика.
Часть 5: культура передается в инкубаторе
- Блюдо Сокол культура маркированы.
- 2,5 мл тонких альбумина добавляется в нижней части блюда Falcon.
- 200 мкл тонких альбумина добавляется к внутреннему краю крышки блюдо Falcon.
- Перевернутый блюдо будет удален из сборки.
- Использование тонких щипцов, стеклянные кольца скользили по краю часовым стеклом и переносят на блюдо Falcon.
- Все остальные солевые удаляется из внутренней поверхности кольца.
- Блюдо Сокол покрыта крышкой и опломбированы.
- Сборка помещается в влажной камере, а затем в инкубаторе.
- Эмбрионы культивировали в течение до 24 часов при 38 ° C.
Часть 6: После культуре, эмбрион является фиксированной, культура передается в инкубаторе
- Фиксация блюдо заполнено ледяным PBS (или DEPC-би-эс, если эмбрионы для переработки с целью на месте гибридизация).
- Культуры удаляется из инкубатора и сразу же помещают на лед. Культуры блюдо сразу же заполнено ледяным PBS / DEPC-би-эс.
- Эмбрион отделяется от желточной оболочки. Эмбрион переносится в фиксации блюдо, используя тупой конец пипетки Пастера.
- Эмбрион придавленный использованием тупыми концами тонкой щипцами. PBS покрытия фиксации блюдо будет удален. Fixative добавляется (см. примечания [б]).
- В зависимости от приложения, эмбрион является фиксированным в течение 6-8 ч при 4 ° С (криостата), O / N при температуре 4 ° С (в места нахождения имущества), или на 1 час при комнатной температуре в течение целого иммуногистохимии монтирования.
- Фиксатором удаляется и заменяется ледяным PBS / DEPC PBS.
- Для вниз по течению таких приложений, как на месте гибридизации или immantibody окрашивания: нервной системы и сердца, перфорированные использованием тупым концом иглы или микрокапиллярных микродиссекции нож, это будет препятствовать захвату зонд / антитела в последующих действиях.
Примечания: [] Saline состоит из: раствор (на 1 л): 121,0 г хлористого натрия, 15,5 г хлорида калия, 10,4 г CaCl 2 · 2H 2 O, 12,7 г MgCl 2 6H 2 O; решение B (на 1 л) : 2,4 г Na 2 HPO 4 · 2H 2 O, 0,2 г NaH 2 PO 4 · 2H 2 O; Автоклав; Перед использованием смешайте 120 мл с 2700 мл H 2 O; Добавить 180 мл B. Mix [1]; [б] Fixative готовят непосредственно перед использованием (4% PFA в ФБР или DEPC-би-эс ибо в места нахождения имущества).
Часть 7: Представитель Результаты
До культуры, эмбрион на примитивной стадии полоски (HH4). В конце периода культуры, эмбрион развилась до HH10 (длина 2-3 мм) и отображается в центре культуры блюдо. Вполне возможно, для обозначения группы клеток с флуоресцентными карбоцианиновых DIIкак раз перед культурой (0ч) и следовать их передвижения по всей территории культуры периода. В этом случае клетки ниже узла Гензена (HN) были помечены DII. Эти клетки показали внести свой вклад в последовательное развитие сомитов (сом) и хорды (п). 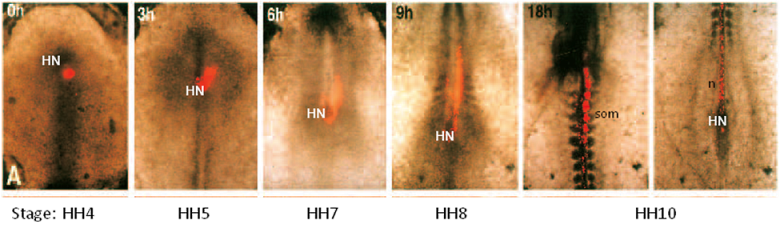
Часть 8: Поиск и устранение неисправностей
| Проблема | Вызывать | Средство |
|---|---|---|
| Эмбрион остается с желтком, а не сходит с мембраной (шаг 2) | Бедные качество яйца | Запрос свеже производства яиц, яйца Магазин при 13 ° C при получении. Инкубировать яйца тот же день, в день приезда. |
| Желточный мембраны слайд от стекла часовой следующее размещение кольцо (шаг 3) | Альбумин остатки | В шаге 2, чтобы убедиться, что все альбумина удаляется, потянув его от мембраны с наклоном щипцы |
| Эмбрион недоступно: лежит под мембраной (этап 4) | Неправильно стороне мембраны вверх | На шаге 3, убедитесь, что стороны мембраны содержащих желток гранул вверх. Блестящей, полированной стороной должна быть обращена вниз. |
| Эмбрион погружен в соленых / альбумина следующие культуры (шаг 6) | Соленые / альбумина остается внутри кольца до культуры; отверстие в мембранной | В шаге 5, убедитесь, что все альбумин / солевой удаляется из внутри кольца; На шаге 4, убедитесь, что вы не прокалывают мембрану с пинцетом (использование тупыми концами пинцета) |
| Эмбрион распался следующие культуры | Бактериальная инфекция | Стерилизуйте все инструменты и посуда; Использование антибиотиков / противогрибковым |
Обсуждение
Новый метод культуры 2 может быть использован для широкого спектра применений, начиная от прививок фактора роста содержащие бисером 3, для установки в целом гибридизация и целые горы иммуногистохимии 4. Культуры в течение 24 ч позволяет периода непрерывного контроля эмб?...
Благодарности
Эта работа была поддержана Маргарет М. Alkek Фонда РГНФ.
Материалы
| Name | Company | Catalog Number | Comments | |
| Eggs | Animal | Charles River Laboratories | Premium Fertile | |
| Stereomicroscope | Microscope | Leica Microsystems | MZ9.5 or similar | |
| Marsh Automatic Incubator | Tool | Lyon | RX | |
| Hybridization Incubator | Tool | Robbins Scientific, SciGene | M1000 | |
| Pyrex dish (2) | Tool | |||
| Watchmaker’s glass 50mm | Tool | VWR international | 66112-060 | |
| Glass rings | Tool | Physical Plant facility | cut 4 mm thick sections of glass tubing (27 mm outer diam, 25 mm inner diam). Do not fine polish. | |
| Curved Forceps (1) | Surgery | Electron Microscopy Sciences | 72991-4C | |
| Forceps (2) | Surgery | Fine Science Tools | 11002-13 | blunt ended using sharpening Stone and 100ul mineral oil |
| Sharpening Stone Dan’s Black Arkansas | Surgery | Electron Microscopy Sciences | 62082-00 | |
| Fine scissors | Surgery | Fine Science Tools | 14161-10 | |
| Plastic dishes | Tool | Falcon BD | 353001 | |
| Rubber Bulb | Tool | Electron Microscopy Sciences | 70980 | |
| Pasteur Capillary Pipette | Tool | Electron Microscopy Sciences | 70950-12 | round edge under flame |
| Microcapillary tube | Surgery | Sigma-Aldrich | P1049-1PAK | Pull using vertical micropipette puller; blunt end with fine forceps |
| Microdissecting knife | Surgery | Fine Science Tools | 10056-12 | Use to puncture cavities prior to in situ hybridization |
| Minuten pins 0.2mm diam | Surgery | Fine Science Tools | 26002-20 | |
| Sylgard 184 Silicon Elastomer Curing Agent and Base | Reagent | Dow Corning | 0001986475 | Mix 1 part Curing Agent, 9 parts Base; set O/N at 37C |
| Diethylpyrocarbonate (depc) | Reagent | Acros Organics | 10025025 | Add 1ml depc to 1l PBS; shake; autoclave |
Ссылки
- Pannett, P. A., Compton, C. A. The cultivation of tissues in saline. Lancet. 206, 381-384 (1924).
- New, D. T. A new technique for the cultivation of the chick embryo in vitro. J. Embryol. Exp. Morph. 3, 326-331 (1955).
- Alvarez, I. S., Araujo, M., Nieto, M. A. Neural induction in whole chick embryo cultures by FGF. Dev. Biol. 199, 42-54 (1998).
- Psychoyos, D., Stern, C. D. Restoration of the organizer after radical ablation of Hensen's node and the anterior primitive streak in the chick embryo. Development. 122, 3263-3273 (1996).
- Psychoyos, D., Stern, C. D. Fates and migratory routes of primitive streak cells in the chick embryo. Development. 122, 1523-1534 (1996).
- Voiculescu, O., Papanayotou, C., Stern, C. D. Spatially and temporally controlled electroporation of early chick embryos. Nature Protoc. 3, 419-426 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены