Abstract
Protocol
Representative Results
Discussion
References
Immunology
ELISA Asas :间接、三明治和竞争
Published: April 30th, 2023
资料来源:惠特尼·斯旺森1,2,弗朗西斯·萨亚斯塔德2,3和托马斯·格里菲斯1,2,3,4
1明尼苏达大学泌尿科,明尼阿波利斯,MN 55455
2明尼苏达大学明尼阿波利斯分校免疫学中心,MN 55455
3明尼苏达大学明尼阿波利斯分校微生物学、免疫学和癌症生物学研究生课程,MN 55455
4共济会癌症中心,明尼苏达大学明尼阿波利斯分校,MN 55455
酶相关免疫吸附测定 (ELISA) 通常用于测量生物样品中抗原、抗体、肽、蛋白质、激素或其他生物分子的存在和/或浓度。它极其敏感,能够检测低抗原浓度。ELISA 的敏感性归因于其检测单个抗原-抗体复合物 (1) 之间的相互作用的能力。此外,加入酶结合的抗原特异性抗体,可以将无色基质转化为色化或荧光产物,由板读取器检测并轻松定量。与已知感兴趣的抗原的定子量生成值相比,可以确定实验样品中相同抗原的浓度。不同的ELISA方案已经适应了测量各种实验样品中的抗原浓度,但它们都具有相同的基本概念(2)。选择 ELISA 的类型执行,间接,三明治,或竞争,取决于许多因素,包括要测试的样品的复杂性和可用的抗原特异性抗体。间接 ELISA 通常用于确定免疫反应的结果,例如测量样品中抗体的浓度。三明治ELISA最适合分析复杂样品,如组织培养上生或组织解液,其中分析物或感兴趣的抗原是混合样品的一部分。最后,当只有一种抗体可用于检测感兴趣的抗原时,竞争ELISA最常使用。竞争的 ELISA 也可用于检测只有单个抗体表位的小型抗原,该表位由于阻抗而无法容纳两种不同的抗体。该协议将描述间接、三明治和竞争性ELISA检测的基本程序。
间接ELISA测定通常用于测量血清或杂交瘤培养液中抗体的含量。间接 ELISA 测定的一般程序是:
- 涂有抗原的油井
- 添加含有抗体的血清或杂交瘤培养上清液(原发性或1°抗体)
- 孵育和洗涤
- 添加二次(或2°)酶结合抗体
- 孵育和洗涤
- 添加基板
三明治ELISA测定法与间接ELISA测定不同,该方法不涉及涂覆纯化抗原的板。相反,"捕获"抗体用于涂覆板的孔。抗原被"夹在"捕获抗体和第二个"检测"酶结合抗体之间 - 两种抗体对同一抗原是特定的,但在不同的表位 (3)。通过与捕获抗体/抗原复合物结合,检测抗体留在板中。单克隆抗体或多克隆抗血清可用作捕获和检测抗体。三明治ELISA的主要优点是,样品在分析前不必经过纯化。此外,测定可能相当敏感 (4)。许多市售ELISA试剂盒都是三明治品种,并使用经过测试的匹配抗体对。三明治 ELISA 测定的一般程序是:
- 用捕获抗体涂井
- 添加含有抗原的测试样品
- 孵育和洗涤
- 添加酶结合检测抗体。
- 孵育和洗涤
- 添加基板
大多数市售三明治ELISA试剂盒都带有酶结合检测抗体。在无酶结合检测抗体的情况下,可以使用二次酶结合抗体,用于检测抗体。二次抗体上的酶的作用相同,即将无色基质转化为致色或荧光产物。例如,上述二次酶结合抗体更希望用于由一名已经产生自己单克隆抗体的调查员开发的"自制"三明治ELISA。使用二级酶结合抗体的一个缺点是,确保它只与检测抗体结合,而不是捕获抗体与板结合。这将导致在所有井中产生可测量的产品,无论是否存在抗原或检测抗体。
最后,利用竞争的ELISA检测检测可溶性抗原。它执行简单,但只有当纯化抗原有相对大量的可用时,它才适用。竞争 ELISA 测定的一般程序是:
- 涂有抗原的油井
- 孵育和洗涤
- 带酶结合原抗体的预孵化试验样品
- 将混合物加入好
- 孵育并洗去任何未结合的酶结合原抗体
- 添加基板
此检测中的"竞争"来自以下事实:步骤 3 中使用的测试样本中更多的抗原将导致可用于与油井抗原涂层结合的抗体较少。因此,测定结束时井中致色/含氟产物的强度与测试样品中存在的抗原量成反比。
任何类型的 ELISA 中的关键组成部分是已知浓度的定子标准,该标准将允许用户确定测试样品中存在的抗原浓度。通常,一系列水井被指定为创建标准曲线,其中已知数量的纯化重组蛋白以递减量添加到井中。当这些孔与测试样品同时处理时,用户可以从微板读取器获得一组已知蛋白质浓度的吸收率值参考集,以便与测试样品的吸光值一致。然后,用户可以计算一个标准曲线,测试样本可以进行比较,以确定感兴趣的蛋白质数量。标准曲线还可以确定用户稀释的精度。
最后,上面列出的每种 ELISA 类型中的最后一步要求添加基板。基材转化为产物的程度与井中酶的含量直接相关。马萝卜过氧化物酶 (HRP) 和碱性磷酸酶 (AP) 是发现与抗体结合的最常见酶。正如所料,有许多基质可用于产生色化或荧光产物的酶。此外,基材具有一系列灵敏度,可提高测定的整体灵敏度。在选择要使用的基板类型时,用户还必须考虑到在实验结束时可用于读取板的仪器类型,以及相应的酶结合抗体。
HRP常用的致色基质包括2,2'-Azinobis [3-乙苯甲酰胺-6-硫酸]-二氧化硅盐(ABTS)和3,3',5,5'四甲基苯甲胺(TMB),而p-硝基磷酸(PNPP)用于AP。分别生产水溶性绿色和蓝色反应产物。绿色 ABTS 产品具有两个主要吸光峰值,410 和 650 nm,而蓝色 TMB 产品在 370 和 652 nm 时最佳检测。ABTS 和 TMB 的颜色在添加酸性停止溶液后变为黄色,最好在 450 nm 处读取。ABTS 的颜色开发速度很慢,而 TMB 的颜色开发速度很快。TMB 比 ABTS 更敏感,如果酶反应过长,可能会产生更高的背景信号。PNPP 在 AP 转换后产生黄色水溶性产品,在 405 nm 处吸收光线。
1. 间接ELISA
间接ELISA是一种由二次结合抗体识别的主要抗原特异性抗体。以下协议是间接 ELISA 方法的示例,其中对受甲型流感病毒 (IAV) 感染的小鼠的血清样本进行 IAV 特异性 IgG 抗体测试。此示例的一个优势是,可以使用不同的二级抗体来识别所有抗体等型或特定等型(例如 IgG)。
将抗原涂覆到微孔板
- 将纯化抗原50μL(2mg/mL的纯化A/PR/8流感病毒在0.05M Tris-HCl缓冲液(pH 9.5)中移液,将96孔ELISA板的孔与纯化抗原一起移入板中的每口井。
- 用胶粘剂盖盖住板,并在 4°C 下孵育,使抗原与板结合。
- 孵育完成后,通过在水槽上轻拂板来去除涂层溶液。
阻塞
- 通过加入200μL阻断缓冲液,阻断涂布井中剩余的蛋白质结合位点,1X PBS中的5%驴血清在这里使用,每孔。替代阻断试剂包括PBS中的5%脱脂干牛奶或BSA或产生二级抗体的动物的正常血清。
- 在室温下孵育至少2小时,或在4°C孵育过夜。
- 孵育后,通过轻拂板,然后用含有1%补间-20的PBS洗涤板,取出阻塞缓冲液。
使用原抗体孵育
- 使用 1X PBS,制备含有原抗体的血清样本的连续稀释,以获得 1 到 204,800 的稀释范围。为此,首先稀释血清1:12.5,然后执行4倍稀释(稀释范围 - 1:12.5至1:204,800)。
- 将100μL的序列稀释血清样品加入井中。
- 带胶粘剂盖盖的盖板,在室温下孵育1-2小时。
- 孵育后,将盘子轻拂在水槽上,用含有1%补间-20的PBS洗涤板。
用二次抗体孵育
- 在本实验中,将100μL的酶结合二级抗体、马萝卜过氧化物酶、HRP偶联驴抗鼠次生添加到每个孔中。
- 在室温下孵育板1小时。
- 孵育后,将板轻拂在水槽上,然后用含有1%补间-20的PBS洗涤板。
检测
- 在每个井中添加100 μL的指标基板(3,3',5,5'-四甲基苯甲二苯(TMB))。每口井的浓度为1mg/mL。
- 在室温下用基板孵育5-10分钟。
- 10分钟后,加入100μL 2N硫酸(H2SO4),停止酶反应。
在添加停止溶液的 30 分钟内,使用 405 nm 的微孔板读取板以确定孔的吸光度。
2. 三明治ELISA
在此 ELISA 版本中,实验样本被"夹在"未结合的捕获抗体和结合检测抗体之间,这两种抗体都特定于同一蛋白质,但位于不同的表位上。在下面的三明治 ELISA 示例中,使用从已知标准重组人 TNF® (在浓度为 75 pg/mL) 的 2.5X 序列稀释中生成的标准曲线在未知样本中确定人类 TNF® 的浓度。
涂层捕获抗体到微孔板
- 在 96 孔 ELISA 板的孔中涂上纯化捕获抗体,在板的每个孔中加入 100 μL 捕获抗体(1-10 μg/mL 范围)。
- 用粘合板盖盖板,在 4°C 下孵育过夜。
- 孵育后,将板片轻拂在水槽上,将涂层溶液从板中取出。
阻塞
- 在涂布的井中加入200μL阻断溶液,5%含有PBS的脱脂干牛奶,阻断抗体涂层井中剩余的蛋白质结合位点。
- 在室温下孵育至少2小时,或在4°C孵育过夜。
- 孵育后,通过轻拂板,然后用含有1%补间-20的PBS洗涤板,取出阻塞缓冲液。
添加含有测试样品的抗原
- 将100 μL的测试样品添加到井中。用粘合剂盖密封板。
- 在室温下孵育1-2小时,或在4°C孵育过夜。
- 孵育后,通过轻拂水槽上的板,然后用含有1%补间-20的200μL 1X PBS清洗孔。因此,将样品取出。
添加酶结合检测抗体
- 在预优化浓度下向井中加入100 μL酶结合检测抗体。
- 用胶粘剂盖密封板,并在室温下孵育 2 小时。
- 将板轻拂在水槽上,用含有 1% 补间-20 的 200 μL 1X PBS 清洗孔,取出未结合的检测抗体。
检测
- 以1mg/mL的浓度添加100 μL的指标基板。任何结合酶结合检测抗体都会将基质转换为可检测信号。
- 在室温下孵育板5-10分钟。
- 5-10分钟后,向井中加入100μL 2N H2SO4,停止酶反应。在添加停止溶液的 30 分钟内,使用微孔板读取器读取板以确定孔的吸光度。
3. 有竞争力的ELISA
竞争 ELISA 的步骤不同于间接和三明治 ELISA 中使用的步骤,主要区别是样品抗原和"外接"抗原之间的竞争结合步骤。样品抗原与未标记的原抗体一起孵育。然后,这些抗体抗原复合物被添加到ELISA板中,ELISA板已经预涂了相同的抗原。潜伏期后,任何未结合的抗体被冲走。可用于结合井中抗原的游取抗体量与原始样品中的抗原量之间存在反比相关性。例如,具有丰富抗原的样品将具有更多的抗原原抗体复合物,留下很少未结合的抗体与ELISA板结合。然后,将原抗体特有的酶结合二级抗体添加到孔中,然后加入基质。
将抗原涂覆到微孔板
- 用100μL的纯化抗原涂覆96孔ELISA板的孔,浓度为1-10微克/mL。
- 盖板,盖上胶板盖,在 4°C 下孵育板过夜。
- 孵育后,通过在水槽上轻拂板,从井中取出未结合的抗原溶液。
阻塞
- 通过在每个井中加入200μL的阻断缓冲液,阻断涂布井中剩余的蛋白质结合位点,在PBS中可以是5%的脱脂干牛奶或BSA。
- 在室温下孵育板至少2小时,或在4°C下孵育过夜。
与原抗体的孵育样品(抗原)
- 在阻断油井时,通过混合测定中每口井的150μL样品抗原和150μL原抗体来制备抗原抗体混合物。
- 在37°C下孵育这种混合物1小时。
向井中加入抗原抗体混合物
- 现在,通过在水槽上轻拂板,从井中取出阻塞缓冲液。
- 然后,用含有补间-20的1X PBS清洗水井。
- 加入100μL的样品抗原原抗体混合物。
- 在 37°C 下孵育板 1 小时。
- 将板子轻拂在水槽上,取出样品混合物。
- 然后,用含有1%补间-20的1X PBS清洗水井,以去除任何未结合的抗体。
添加二级抗体
- 在每个孔中加入100μL的酶结合二级抗体,在这种情况下,该抗体是AP结合抗体。
- 在 37°C 下孵育板 1 小时。
- 孵育后,用含有1%补间-20的1X PBS清洗板。
检测
- 在每个井中加入100 μL的基板溶液。
- 等待 5-10 分钟。
- 10分钟后,向井中加入100μL 2N硫酸,停止酶反应。然后,在添加停止溶液后 30 分钟内测量微孔板读取器中的吸光度
在以下间接ELISA示例中,确定了IAV感染小鼠血清中甲型流感病毒(IAV)特异性IgG的存在。C57Bl/6小鼠感染了甲型流感病毒(A/PR/8;105 PFU在100μL PBS i.p.),血清在28天后收集。为了量化血清中IAV特异性IgG的含量,96孔ELISA板在4°C下涂有纯化的A/PR/8流感病毒(50μL/孔2毫克/毫升PBS病毒)。在室温下,涂层板被阻断1小时,在PBS中含有5%的正常驴血清,随后在4°C下用IAV挑战小鼠稀释的血清样本孵育。血清最初稀释1:12.5,然后稀释1:4(稀释范围 - 1:12.5至1:204,800)。洗涤后,用碱性磷酸酶(AP)-偶联的驴抗小鼠IgG孵育1小时。对板进行洗涤,然后加入p-硝基磷酸盐(PNPP;1mg/mL,100μL/孔)。当 AP 存在时,无色 PNPP 解决方案变为黄色。5-10分钟后,通过加入100μL/井2N H2SO4停止酶反应。在 405 nm 的微孔板读取器上读取该板。所得结果如图1和图1所示。
| 样品 | 井 | OD405 | 意味 着 |
| 血清 1:12.5 | A1 | 2.163 | 2.194 |
| B1 | 2.214 | ||
| C1 | 2.204 | ||
| 血清 1:50 | A1 | 1.712 | 1.894 |
| B1 | 2.345 | ||
| C1 | 1.624 | ||
| 血清 1:200 | A1 | 1.437 | 1.541 |
| B1 | 1.73 | ||
| C1 | 1.456 | ||
| 血清 1:800 | A1 | 1.036 | 0.957 |
| B1 | 0.912 | ||
| C1 | 0.923 | ||
| 血清 1:3200 | A1 | 0.579 | 0.48 |
| B1 | 0.431 | ||
| C1 | 0.429 | ||
| 血清 1:12800 | A1 | 0.296 | 0.281 |
| B1 | 0.312 | ||
| C1 | 0.236 | ||
| 血清 1:51200 | A1 | 0.308 | 0.283 |
| B1 | 0.299 | ||
| C1 | 0.243 | ||
| 血清 1:204800 | A1 | 0.315 | 0.303 |
| B1 | 0.298 | ||
| C1 | 0.297 |
表1:间接ELISA测定数据。血清稀释(从1:12.5到1:204,800),流感病毒(IAV)感染的小鼠含有IAV特异性IgG,光学密度(OD)(405纳米)值和平均OD405值。
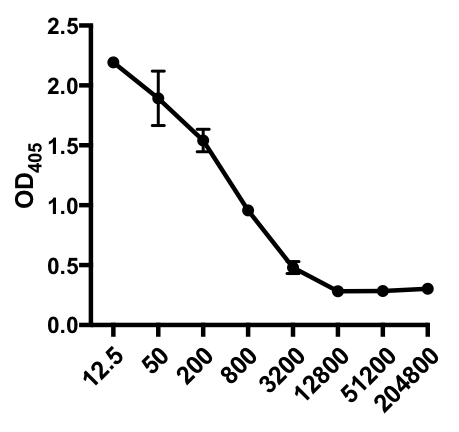
图1:IAV感染小鼠血清中甲型流感病毒(IAV)特异性IgG的间接ELISA测定散射图的平均OD405值(+ S.D.)和血清稀释(从1:12.5至1:204,800)。OD405值可能与血清稀释成反比。
在下面的三明治 ELISA 示例中,在 96 孔平底板的指定井中添加了 1:2.5 稀释重组的人类 TNF® 标准(从浓度为 75 pg/mL 开始)。这些标准导致吸收读数相应变化 2.5 倍。
| 样品 | 浓度(皮克/升) | 井 | 值 | 平均值 | 回浓度计算 | 平均 |
| 标准 1 | 75 | A1 | 1.187 | 1.169 | 76.376 | 75.01 |
| A2 | 1.152 | 73.644 | ||||
| 标准 2 | 30 | B1 | 0.534 | 0.52 | 30.827 | 29.962 |
| B2 | 0.506 | 29.098 | ||||
| 标准 3 | 12 | C1 | 0.23 | 0.217 | 12.838 | 12.105 |
| C2 | 0.204 | 11.372 | ||||
| 标准 4 | 4.8 | D1 | 0.09 | 0.084 | 5.055 | 4.726 |
| D2 | 0.078 | 4.398 | ||||
| 标准 5 | 1.92 | E1 | 0.033 | 0.031 | 1.941 | 1.86 |
| E2 | 0.03 | 1.778 | ||||
| 标准 6 | 0.768 | F1 | 0.009 | 0.011 | 0.626 | 0.764 |
| F2 | 0.014 | 0.901 | ||||
| 标准 7 | 0.307 | G1 | 0.002 | 0.004 | 0.238 | 0.377 |
| G2 | 0.007 | 0.516 |
表2:TNF+三明治ELISA标准曲线数据。1:2.5 稀释重组人类 TNF® 标准 (75 至 0.3 pg/mL)、OD (450 nm) 值、均值 OD450值、回浓度计算及其平均值。
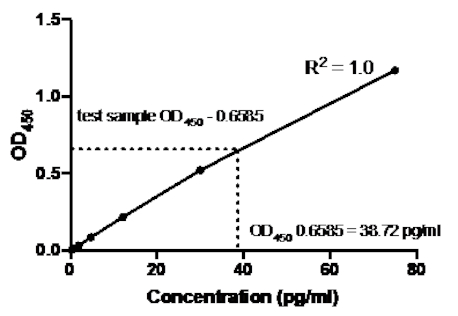
图2:TNF®三明治ELISA的标准曲线。使用三明治ELISA分析重组人TNF®标准的1:2.5稀释(75至0.3皮克/mL)。OD450值可与标准稀释浓度直接相关。测试样品中的TNF®蛋白量是使用标准曲线确定的,该曲线对应于38.72皮克/mL的浓度。
一旦生成标准曲线,测定测试样品中的TNF®蛋白量。在这个三明治ELISA示例中,测试样本给出OD450读数为0.636和0.681,平均读数为0.6585。在上图上绘制此 OD450 读数时,这对应于 TNF® 浓度为 38.72 pg/ml。
如所演示的,一系列免疫测定(协议略有变化)属于ELISA技术系列。确定使用 ELISA 的哪个版本取决于许多因素,包括检测到的抗原、可用于特定抗原的单克隆抗体以及测定 (5) 的预期灵敏度。此处所述的不同 ELISA 的一些优点和弱点包括:
| Elisa | 优势 | 弱点 |
| 间接 | 1) 高灵敏度,因为多个酶结合的二级抗体可以结合到原抗体 | 1) 高背景信号可能发生,因为对板感兴趣的抗原的涂层不特定(即样品中的所有蛋白质将涂覆板) |
| 2) 许多不同的原抗体可以通过单个酶结合的二级抗体识别,使用户能够灵活地在许多不同的 ELISA 中使用相同的酶结合二级抗体(无论检测到的抗原如何) | ||
| 3) 当只有一种抗体用于感兴趣的抗原时,最佳选择 | ||
| 三明治 | 1) 使用抗原特异性捕获和检测单克隆抗体可提高检测的敏感性和特异性(与间接ELISA相比) | 1) 优化捕获和检测单克隆抗体的浓度可能很困难(尤其是对于非商业试剂盒) |
| 2) 检测具有多个表位的大型蛋白质(如细胞因子)的最佳选择 | ||
| 竞争 | 1) 可以使用不纯样品 | 1) 需要大量的高纯度抗原来涂覆板 |
| 2) 对试剂稀释效果的敏感性较低 | ||
| 3) 是检测小分子的理想选择( 如 hapten) |
表 3:摘要。概述不同ELISA技术的长处和短处。
虽然这是一种简单而有用的技术,但任何ELISA也有一些缺点。一是测试样品中感兴趣的蛋白质量的不确定性。如果量过高或过低,微孔板读取器获得的吸收值可能分别低于或低于标准曲线的极限。这将使得很难准确确定测试样品中的蛋白质含量。如果值过高,可以在添加到板的孔之前稀释测试样品。然后,最终值需要根据稀释系数进行调整。如前所述,自制试剂盒通常需要仔细优化抗体浓度,以产生高信噪比。
- Porstmann, T. and Kiessig S.T. Enzyme immunoassay techniques. An overview. Journal of Immunological Methods. 150 (1-2), 5-21 (1992).
- Suleyman Aydin. A short history, principles, and types of ELISA, and our laboratory experience with peptide/protein analyses using ELISA. Peptides, 72, 4-15 (2015).
- Gan. S. D. and Patel K. R. Enzyme Immunoassay and Enzyme-Linked Immunosorbent Assay. Journal of Investigative Dermatology, 133 (9), 1-3 (2013).
- Kohl, T. O. and Ascoli C.A. Immunometric Antibody Sandwich Enzyme-Linked Immunosorbent Assay. Cold Spring Harbor Protocols, 1 (6), (2017).
- Sakamoto, S., Putalun, W., Vimolmangkang, S., Phoolcharoen, W., Shoyama, Y., Tanaka, H., and Morimoto S. Enzyme-linked immunosorbent assay for the quantitative/qualitative analysis of plant secondary metabolites. Journal of natural medicines, 72 (1), 32-42 (2018).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved