Abstract
Protocol
Representative Results
Discussion
References
Immunology
Tests ELISA : Indirect, en sandwich et par compétition
Published: April 30th, 2023
Source : Whitney Swanson1,2, Frances V. Sjaastad2,3, et Thomas S. Griffith1,2,3,4
1 Département d'urologie, Université du Minnesota, Minneapolis, MN 55455
2 Center for Immunology, Université du Minnesota, Minneapolis, MN 55455
3 Microbiologie, Immunologie, et programme d'études supérieures de biologie de cancer, université du Minnesota, Minneapolis, MN 55455
4 Centre du cancer maçonnique, Université du Minnesota, Minneapolis, MN 55455
L'analyse immunosorbent enzymatique (ELISA) est fréquemment utilisée pour mesurer la présence et/ou la concentration d'un antigène, d'un anticorps, d'un peptide, d'une protéine, d'une hormone ou d'une autre biomolécule dans un échantillon biologique. Il est extrêmement sensible, capable de détecter de faibles concentrations d'antigènes. La sensibilité de l'ELISA est attribuée à sa capacité à détecter les interactions entre un seul complexe antigène-anticorps (1). De plus, l'inclusion d'un anticorps spécifique à l'antigène conjugué en zymatique permet la conversion d'un substrat incolore en un produit chromogénique ou fluorescent qui peut être détecté et facilement quanti par un lecteur de plaques. Par rapport aux valeurs générées par les quantités titrated d'un antigène connu d'intérêt, la concentration du même antigène dans les échantillons expérimentaux peut être déterminée. Différents protocoles ELISA ont été adaptés pour mesurer les concentrations d'antigènes dans une variété d'échantillons expérimentaux, mais ils ont tous le même concept de base (2). Le choix du type d'ELISA à effectuer, indirect, sandwich, ou compétitif, dépend d'un certain nombre de facteurs, y compris la complexité des échantillons à tester et les anticorps spécifiques à l'antigène disponibles à utiliser. L'ELISA indirecte est fréquemment utilisée pour déterminer les résultats d'une réponse immunologique, comme mesurer la concentration d'un anticorps dans un échantillon. Le sandwich ELISA est le mieux adapté pour analyser des échantillons complexes, tels que les supernatants de culture tissulaire ou les lysates tissulaires, où l'analyte, ou antigène d'intérêt, fait partie d'un échantillon mixte. Enfin, l'ELISA compétitif est le plus souvent utilisé lorsqu'il n'y a qu'un seul anticorps disponible pour détecter l'antigène d'intérêt. Les ELISA compétitifs sont également utiles pour détecter un petit antigène avec seulement un seul épitope d'anticorps qui ne peut pas accueillir deux anticorps différents en raison de l'entrave stérique. Le protocole décrira les procédures de base pour les essais indirects, sandwich, et compétitifs ELISA.
L'analyse indirecte ELISA est couramment utilisée pour mesurer la quantité d'anticorps dans le sérum ou dans le supernatant d'une culture hybridoma. La procédure générale pour l'action indirecte ELISA est la suivante :
- Enrober les puits d'antigènes
- Ajouter le supernatant de culture de sérum ou d'hybridome contenant des anticorps (anticorps primaires ou 1 '
- Incuber et laver
- Ajouter des anticorps secondaires (ou 2 degrés) conjugués à des enzymes
- Incuber et laver
- Ajouter le substrat
L'extrait du sandwich ELISA diffère de l'extrait indirect ELISA en ce que la méthode n'implique pas d'enduire les plaques d'un antigène purifié. Au lieu de cela, un anticorps "capture" est utilisé pour enrober les puits de la plaque. L'antigène est "sandwiché" entre l'anticorps de capture et un deuxième anticorps conjugué enzymatique -- où les deux anticorps sont spécifiques pour le même antigène, mais à des épitopes différents (3). En se liant au complexe anticorps/antigène de capture, l'anticorps de détection reste dans la plaque. Les anticorps monoclonaux ou les antiseras polyclonal peuvent être utilisés comme anticorps de capture et de détection. Le principal avantage du sandwich ELISA est que l'échantillon n'a pas besoin d'être purifié avant l'analyse. De plus, l'analyse peut être assez sensible (4). Beaucoup de kits ELISA disponibles dans le commerce sont de la variété de sandwich et l'utilisation testée, paires appariées d'anticorps. La procédure générale pour l'assay sandwich ELISA est:
- Puits de manteau avec anticorps de capture
- Ajouter des échantillons d'essai contenant de l'antigène
- Incuber et laver
- Ajouter un anticorps de détection conjugué aux enzymes.
- Incuber et laver
- Ajouter le substrat
La plupart des kits ELISA de sandwich disponibles dans le commerce sont livrés avec des anticorps de détection enzymatiques. Dans les cas où un anticorps de détection conjugué en zymatique n'est pas disponible, un anticorps secondaire conjugué enzymatique spécifique à l'anticorps de détection peut être utilisé. L'enzyme sur l'anticorps secondaire joue le même rôle, qui est de convertir le substrat incolore en un produit chromogénique ou fluorescent. L'anticorps secondaire conjugué aux enzymes mentionné ci-dessus aimerait plus être utilisé dans un sandwich « fait maison » ELISA développé par un chercheur qui a généré leurs propres anticorps monoclonaux, par exemple. Un inconvénient à l'utilisation d'un anticorps secondaire enzymatique conjugué est de s'assurer qu'il ne se lie qu'à l'anticorps de détection, et non pas l'anticorps de capture lié à la plaque. Cela se traduirait par un produit mesurable dans tous les puits, indépendamment de la présence ou l'absence d'antigène ou d'anticorps de détection.
Enfin, l'analyse ELISA compétitive est utilisée pour détecter les antigènes solubles. Il est simple à réaliser, mais il n'est approprié que lorsque l'antigène purifié est disponible dans une quantité relativement importante. La procédure générale pour l'analyse ELISA compétitive est la suivante :
- Enrober les puits d'antigène
- Incuber et laver
- Échantillon d'essai de préincubate avec des anticorps primaires enzymatiques
- Ajouter le mélange au bien
- Incuber et laver tout anticorps primaire non lié conjugué à l'enzyme
- Ajouter le substrat
La «concurrence» dans cet essai vient du fait que plus d'antigène dans l'échantillon d'essai utilisé à l'étape 3 se traduira par moins d'anticorps disponibles pour se lier à l'antigène revêtement du puits. Ainsi, l'intensité du produit chromogénique/fluorogénique dans le puits à la fin de l'essai est inversement liée à la quantité d'antigène présente dans l'échantillon d'essai.
Un composant clé dans tout type d'ELISA est les normes titrated des concentrations connues qui permettront à l'utilisateur de déterminer la concentration d'antigène présente dans les échantillons d'essai. Typiquement, une série de puits sont désignés pour créer une courbe standard, où des quantités connues d'une protéine recombinante purifiée sont ajoutées aux puits en quantités décroissantes. Lorsque ces puits sont traités en même temps que les échantillons d'essai, l'utilisateur peut alors disposer d'un ensemble de valeurs d'absorption de référence obtenues auprès d'un lecteur de microplaques pour des concentrations de protéines connues pour aller de pair avec les valeurs d'absorption pour les échantillons d'essai. L'utilisateur peut ensuite calculer une courbe standard à laquelle les échantillons d'essai peuvent être comparés pour déterminer la quantité de protéines d'intérêt présente. La courbe standard peut également déterminer le degré de précision de la fabrication de dilution de l'utilisateur.
Enfin, la dernière étape de chacun des types ELISA énumérés ci-dessus prévoit l'ajout d'un substrat. Le degré de conversion du substrat en produit est directement lié à la quantité d'enzymes présente dans le puits. La peroxidase de raifort (HRP) et la phosphatase alcaline (AP) sont les enzymes les plus communes trouvées conjuguées aux anticorps. Comme prévu, il existe un certain nombre de substrats disponibles spécifiques pour l'une ou l'autre enzyme qui produisent un produit chromogénique ou fluorescent. En outre, les substrats sont disponibles dans une gamme de sensibilités qui peuvent augmenter la sensibilité globale de l'analyse. L'utilisateur doit également prendre en considération le type d'instrumentation disponible pour la lecture de la plaque à la fin de l'expérience lors de la sélection du type de substrat à utiliser, ainsi que son anticorps correspondant enzymatique.
Les substrats chromogéniques couramment utilisés pour hrP incluent 2,2'-Azinobis [3-ethylbenzothiazoline-6-sulfonic acid]-diammonium salt (ABTS) et 3,3',5'-tetramethylbenzidine (TMB), tandis que p-Nitrophenyl produire des produits de réaction verts et bleus solubles dans l'eau, respectivement. Le produit vert ABTS a deux pics d'absorption majeurs, 410 et 650 nm, tandis que le produit tMB bleu est mieux détecté à 370 et 652 nm. Les couleurs de L'ABTS et du TMB changent en jaune à l'ajout d'une solution d'arrêt acide, qui est mieux lue à 450 nm. Le développement des couleurs pour ABTS est lent, alors qu'il est rapide pour TMB. TMB est plus sensible que ABTS, et peut produire un signal de fond plus élevé si la réaction enzymatique se produit trop longtemps. PNPP produit un produit jaune soluble dans l'eau après la conversion AP qui absorbe la lumière à 405 nm.
1. ELISA indirect
Un ELISA indirect est celui où l'anticorps antigène-spécifique primaire est identifié par un anticorps conjugué secondaire. Le protocole suivant est un exemple d'une méthode eLISA indirecte, où les échantillons sériques de souris infectées par le virus de la grippe A (IAV) sont testés pour la présence d'anticorps IgG spécifiques au IAV. Une force de cet exemple est que différents anticorps secondaires peuvent être utilisés qui reconnaissent tous les isotypes d'anticorps ou des isotypes spécifiques (par exemple, IgG).
Enrobage d'antigène à la microplaque
- Enrober les puits d'une plaque ELISA de 96 puits d'antigène purifié en piétine50 ll d'antigène purifié (2 mg/mL de virus purifié A/PR/8 de la grippe A dans un tampon Tris-HCl de 0,05 M (pH 9,5)) dans chaque puits de la plaque.
- Couvrir la plaque d'un couvercle adhésif et l'incuber toute la nuit à 4 oC pour permettre à l'antigène de se lier à la plaque.
- À l'achèvement de l'incubation, retirez la solution de revêtement en faisant glisser la plaque sur un évier.
Blocage
- Bloquez les autres sites de liaison protéique dans les puits enduits en ajoutant un tampon de blocage de 200 l, 5 % de sérum d'âne dans 1X PBS est utilisé ici, par puits. Les réactifs de blocage alternatifs incluent 5% de lait sec non gras ou BSA en PBS ou sérum normal d'un animal dans lequel l'anticorps secondaire a été généré.
- Incuber pendant au moins 2 heures à température ambiante ou toute la nuit à 4 oC.
- Après l'incubation, retirez le tampon de blocage en faisant glisser la plaque, puis lavez la plaque avec du PBS contenant 1 % de Tween-20.
Incubation avec l'anticorps primaire
- Préparer une dilution en série de l'échantillon de sérum, qui contient l'anticorps primaire, pour obtenir une plage de dilution de 1 à 204 800, en utilisant 1X PBS. Pour ce faire, diluer d'abord le sérum 1:12.5, puis effectuer une dilution 4X (plage de dilution - 1:12.5 à 1:204,800).
- Ajouter 100 l d'échantillons de sérum dilués en série aux puits.
- Couvrir la plaque d'un couvercle adhésif et incuber à température ambiante pendant 1 à 2 h.
- Après l'incubation, faire glisser la plaque sur un évier et laver la plaque avec du PBS contenant 1% De Tween-20.
Incubation avec l'anticorps secondaire
- Ajouter 100 L d'un anticorps secondaire conjugué en zymatique, peroxidase de raifort, anti-souris à âne satisme hrP secondaire dans cette expérience, à chaque puits.
- Incuber la plaque pendant 1 heure à température ambiante.
- Après l'incubation, faire glisser la plaque sur un évier, puis laver la plaque avec DU PBS contenant 1% Tween-20.
découverte
- Ajouter 100 l de substrat indicateur (3,3',5,5'-tetramethylbenzidine (TMB)) à une concentration de 1 mg/mL à chaque puits.
- Incuber la plaque avec le substrat pendant 5-10 min à température ambiante.
- Après 10 min, arrêtez la réaction enzymatique en ajoutant 100 'L 2N acide sulfurique (H2SO4).
Dans les 30 minutes suivant l'ajout de la solution d'arrêt, lisez la plaque à l'aide d'un lecteur microplaque à 405 nm pour déterminer l'absorption des puits.
2. Sandwich ELISA
Dans cette version ELISA, l'échantillon expérimental est "sandwiché" entre un anticorps de capture non conjugué et un anticorps de détection conjugué, qui sont tous deux spécifiques à la même protéine, mais à des épitopes différents. Dans l'exemple suivant d'ELISA sandwich, la concentration de TNFmD humain a été déterminée dans l'échantillon inconnu à l'aide d'une courbe standard générée à partir de la dilution sérielle 2.5X d'une norme connue, la TNF humaine recombinante (indiquant à la concentration de 75 pg/mL).
Anticorps de capture de revêtement à la microplaque
- Enrober les puits d'une plaque ELISA de 96 puits d'anticorps de capture purifiés en ajoutant 100 ll d'anticorps de capture (1-10 g/mL) à chaque puits de la plaque.
- Couvrir la plaque d'un couvercle de plaque adhésif et l'incuber toute la nuit à 4 oC.
- Après l'incubation, retirer la solution de revêtement de la plaque en faisant glisser la plaque sur un évier.
Blocage
- Bloquer les autres sites de liaison protéinée dans les puits enduits d'anticorps en ajoutant une solution de blocage de 200 L, 5 % de lait sec non gras contenant du PBS, aux puits.
- Incuber pendant au moins 2 h à température ambiante ou toute la nuit à 4 oC.
- Après l'incubation, retirez le tampon de blocage en faisant glisser la plaque, puis lavez la plaque avec du PBS contenant 1 % de Tween-20.
Ajouter des échantillons d'essai contenant de l'antigène
- Ajouter 100 l'échantillon d'essai aux puits. Sceller la plaque avec un couvercle adhésif.
- Incuber de 1 à 2 h à température ambiante ou pendant la nuit à 4 oC.
- Après l'incubation, retirer les échantillons en faisant glisser la plaque sur l'évier, puis laver les puits avec 200 L 1X PBS contenant 1% Tween-20.
Ajouter un anticorps de détection conjugué aux enzymes
- Ajouter 100 l d'anticorps de détection conjugués aux enzymes dans les puits à une concentration préoptimisée.
- Sceller la plaque avec un couvercle adhésif et incuber à température ambiante pendant 2 h.
- Retirez l'anticorps de détection non lié en faisant glisser la plaque sur un évier et lavez les puits avec un PBS de 200 L 1X contenant 1 % de Tween-20.
découverte
- Ajouter 100 l de substrat indicateur à une concentration de 1 mg/mL. Tout anticorps de détection enzymatique lié convertira le substrat en un signal détectable.
- Incuber la plaque de 5 à 10 min à température ambiante.
- Après 5-10 min, arrêtez la réaction enzymatique en ajoutant 100 'L 2N H2SO4 aux puits. Dans les 30 minutes suivant l'ajout de la solution d'arrêt, lisez la plaque à l'aide d'un lecteur de microplaques pour déterminer l'absorption des puits.
3. ELISA compétitif
Les étapes d'un ELISA compétitif sont différentes de celles utilisées dans l'ELISA indirect et sandwich, la principale différence étant l'étape de liaison concurrentielle entre l'antigène de l'échantillon et l'antigène " add-in ". L'antigène de l'échantillon est incubé avec l'anticorps primaire non étiqueté. Ces complexes anticorps-antigènes sont ensuite ajoutés à la plaque ELISA, qui a été pré-enduite avec le même antigène. Après une période d'incubation, tout anticorps non lié est emporté. Il existe une corrélation inverse entre la quantité d'anticorps libres disponibles pour lier l'antigène dans le puits et la quantité d'antigène dans l'échantillon d'origine. Par exemple, un échantillon avec l'antigène abondant aurait plus de complexes d'anticorps antigène-primaires, laissant peu d'anticorps non liés pour se lier à la plaque ELISA. Un anticorps secondaire conjugué à l'enzyme spécifique à l'anticorps primaire est ensuite ajouté aux puits, suivi du substrat.
Enrobage d'antigène à la microplaque
- Enrober les puits d'une plaque ELISA de 96 puits de 100 l d'antigène purifié à une concentration de 1-10 g/mL.
- Couvrir la plaque d'un couvercle adhésif et incuber la plaque pendant la nuit à 4 oC.
- Après l'incubation, retirer la solution antigène non liée des puits en faisant glisser la plaque sur un évier.
Blocage
- Bloquer les autres sites de liaison protéinée dans les puits enduits en ajoutant 200 l de tampon de blocage à chaque puits, qui peut être soit 5% de lait sec non gras ou BSA dans PBS.
- Incuber la plaque pendant au moins 2 h à température ambiante ou pendant la nuit à 4 oC.
Échantillon d'incubation (antigène) avec l'anticorps primaire
- Tout en bloquant les puits, préparer le mélange antigène-anticorps en mélangeant 150 oL d'antigène échantillon et 150 L d'anticorps primaires pour chaque puits dans l'assay.
- Incuber ce mélange pendant 1 h à 37oC.
Ajouter le mélange antigène-anticorps au puits
- Maintenant, retirez le tampon de blocage des puits en faisant glisser la plaque sur un évier.
- Ensuite, lavez les puits avec 1X PBS contenant Tween-20.
- Ajouter 100 l l de l'échantillon d'anticorps antigènes primaires.
- Incuber la plaque à 37oC pendant 1 h.
- Retirer le mélange d'échantillons en faisant glisser la plaque sur un évier.
- Ensuite, lavez les puits avec 1X PBS contenant 1% Tween-20 pour enlever tout anticorps non lié.
Ajouter l'anticorps secondaire
- Ajoutez 100 L d'un anticorps secondaire conjugué enzymatique, qui dans ce cas est l'anticorps AP-conjugué, à chaque puits.
- Incuber la plaque pendant 1 h à 37oC.
- Après l'incubation, laver la plaque avec 1X PBS contenant 1% Tween-20.
découverte
- Ajouter 100 l de la solution de substrat à chaque puits.
- Attendez 5-10 min.
- Après 10 min, arrêtez la réaction enzymatique en ajoutant 100 acide sulfurique L 2N aux puits. Ensuite, mesurez l'absorption dans un lecteur de microplaque dans les 30 minutes suivant l'ajout de la solution d'arrêt
Dans l'exemple suivant d'un ELISA indirect, la présence d'IgG spécifique au virus de la grippe A (IAV) dans le sérum des souris infectées par le VI a été déterminée. Les souris C57Bl/6 ont été infectées par le virus de l'influenza A (A/PR/8; 105 PFU dans 100 L PBS i.p.) et le sérum a été recueilli 28 jours plus tard. Pour quantifier la quantité d'IgG spécifique au IAV dans le sérum, des plaques ELISA de 96 puits ont été recouvertes du virus purifié A/PR/8 de la grippe A (50 oL/puits de 2 mg/ml de virus PBS) pendant la nuit à 4 oC. Les plaques enduites ont été bloquées pendant 1 heure à température ambiante avec 5 % de sérum d'âne normal en PBS, suivie d'une incubation avec des échantillons de sérum dilués de souris à défi iAV pendant la nuit à 4 oC. Le sérum a d'abord été dilué 1:12.5, suivi de 1:4 dilutions (gamme de dilution - 1:12.5 à 1:204,800). Après lavage, les plaques ont été incubées avec un alcalin phosphatase (AP)-conjugué âne anti-souris IgG pendant 1 h. Les plaques ont été lavées, puis p-Nitrophenyl Phosphate (PNPP; 1 mg/mL, 100 l/puits) a été ajouté. La solution Incolore PNPP se transforme en une couleur jaune lorsque AP est présent. Après 5-10 min, la réaction enzymatique a été arrêtée en ajoutant 100 l/bien 2N H2SO4. La plaque a été lue sur un lecteur de microplaques à 405 nm. Les résultats obtenus sont indiqués dans le tableau 1 et la figure 1.
| échantillon | Puits | OD405 | signifier |
| Sérum 1:12.5 | A1 Annonces | 2.163 | 2.194 |
| B1 (en) | 2.214 | ||
| C1 (en) | 2.204 | ||
| Sérum 1:50 | A1 Annonces | 1.712 | 1.894 |
| B1 (en) | 2.345 | ||
| C1 (en) | 1.624 | ||
| Sérum 1:200 | A1 Annonces | 1.437 | 1.541 |
| B1 (en) | 1.73 | ||
| C1 (en) | 1.456 | ||
| Sérum 1:800 | A1 Annonces | 1.036 | 0.957 |
| B1 (en) | 0.912 | ||
| C1 (en) | 0.923 | ||
| Sérum 1:3200 | A1 Annonces | 0.579 | 0.48 |
| B1 (en) | 0.431 | ||
| C1 (en) | 0.429 | ||
| Sérum 1:12800 | A1 Annonces | 0.296 | 0.281 |
| B1 (en) | 0.312 | ||
| C1 (en) | 0.236 | ||
| Sérum 1:51200 | A1 Annonces | 0.308 | 0.283 |
| B1 (en) | 0.299 | ||
| C1 (en) | 0.243 | ||
| Sérum 1:204800 | A1 Annonces | 0.315 | 0.303 |
| B1 (en) | 0.298 | ||
| C1 (en) | 0.297 |
Tableau 1 : Données d'analyse ELISA indirectes. Dilutions sériques (de 1:12.5 à 1:204,800), de souris infectées par le virus de la grippe A (IAV) contenant des IgG spécifiques au IAV, des valeurs de densité optique (OD) (405 nm) et des valeurs moyennes oD405.
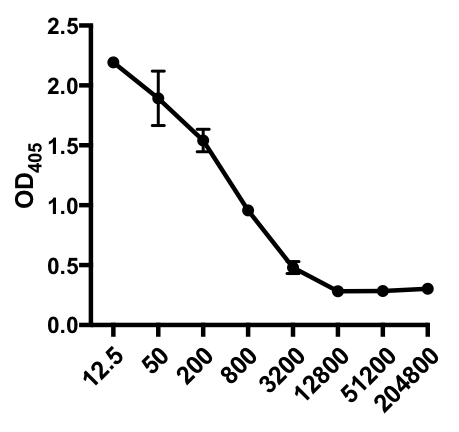
Figure 1 : Diagramme indirect d'analyse ELISA de la parcelle de valeur moyenne de l'OD405 (S. D.) et des dilutions sériques (de 1:12,5 à 1:204 800), de l'IgG spécifique au virus de la grippe A (IAV) dans le sérum des souris infectées par le IAV. Les valeurs OD405 peuvent être inversement corrélées aux dilutions sériques.
Dans l'exemple suivant d'un sandwich ELISA, une dilution de 1:2.5 des normes recombinantes de TNMD humain (à partir d'une concentration de 75 pg/mL) a été ajoutée aux puits indiqués d'une plaque à fond plat de 96 puits. Ces normes ont conduit à un changement correspondant de 2,5 fois dans les lectures d'absorption.
| échantillon | Concentration (pg/mL) | Puits | valeurs | Valeur moyenne | Calcul de la concentration de retour | moyenne |
| Norme 1 | 75 | A1 Annonces | 1.187 | 1.169 | 76.376 | 75.01 |
| A2 Annonces | 1.152 | 73.644 | ||||
| Norme 2 | 30 | B1 (en) | 0.534 | 0.52 | 30.827 | 29.962 |
| B2 | 0.506 | 29.098 | ||||
| Norme 3 | 12 | C1 (en) | 0.23 | 0.217 | 12.838 | 12.105 |
| C2 (en) | 0.204 | 11.372 | ||||
| Norme 4 | 4.8 | D1 Annonces | 0.09 | 0.084 | 5.055 | 4.726 |
| D2 Annonces | 0.078 | 4.398 | ||||
| Norme 5 | 1.92 | E1 (en) | 0.033 | 0.031 | 1.941 | 1.86 |
| E2 (en) | 0.03 | 1.778 | ||||
| Norme 6 | 0.768 | F1 (F1) | 0.009 | 0.011 | 0.626 | 0.764 |
| F2 (en) | 0.014 | 0.901 | ||||
| Norme 7 | 0.307 | G1 (en) | 0.002 | 0.004 | 0.238 | 0.377 |
| G2 (en) | 0.007 | 0.516 |
Tableau 2 : Données de courbe standard TNFMD Sandwich ELISA. Une dilution de 1:2.5 des normes tNFMD humaines recombinantes (75 à 0,3 pg/mL), des valeurs OD (450 nm), des valeurs moyennes oD450, des calculs de concentration de dos et leurs moyennes.
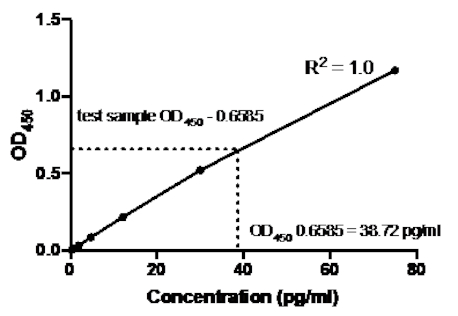
Figure 2 : Courbe standard pour le sandwich TNFMD ELISA. Une dilution de 1:2.5 des normes humaines recombinantes de TNFMD (75 à 0.3 pg/mL) a été analysée à l'aide du sandwich ELISA. Les valeurs OD450 peuvent être directement corrélées aux concentrations de dilution standard. La quantité de protéine TNMD dans l'échantillon d'essai a été déterminée à l'aide de la courbe standard, ce qui correspond à une concentration de 38,72 pg/mL.
Une fois la courbe standard générée, la quantité de protéine TNMD dans l'échantillon d'essai a été déterminée. Dans cet exemple de sandwich ELISA, les échantillons d'essai ont donné des lectures oD450 de 0.636 et 0.681, qui donnent une moyenne de 0.6585. Lors de l'traçage de cette lecture OD450 sur le graphique ci-dessus, cela correspond à une concentration de TNF de 38,72 pg/ml.
Comme démontré, une gamme d'immuno-tests (avec une légère variation dans les protocoles) relèvent de la famille de la technique ELISA. Déterminer quelle version d'ELISA utiliser dépend d'un certain nombre de facteurs, y compris l'antigène détecté, l'anticorps monoclonal disponible pour un antigène particulier et la sensibilité souhaitée de l'analyse (5). Voici quelques points forts et points faibles des différents ELISA décrits ci-contre :
| Elisa | Forces | Faiblesses |
| indirect | 1) Sensibilité élevée due au fait que plusieurs anticorps secondaires conjugués à l'enzyme peuvent se lier à l'anticorps primaire | 1) Le signal de fond élevé peut se produire parce que le revêtement de l'antigène d'intérêt à la plaque n'est pas spécifique (c.-à-d., toutes les protéines dans l'échantillon enduiront la plaque) |
| 2) Beaucoup d'anticorps primaires différents peuvent être identifiés par un anticorps secondaire enzymatique simple donnant à l'utilisateur la flexibilité d'utiliser le même anticorps secondaire enzymatique-conjugué dans beaucoup d'ELISA différents (indépendamment de l'antigène étant détecté) | ||
| 3) Meilleur choix quand seulement un seul anticorps pour l'antigène d'intérêt est disponible | ||
| sandwich | 1) L'utilisation d'anticorps monoclonaux de capture et de détection spécifiques à l'antigène augmente la sensibilité et la spécificité de l'analyse (par rapport à l'ELISA indirecte) | 1) Optimiser les concentrations des anticorps monoclonaux de capture et de détection peut être difficile (en particulier pour les kits non commerciaux) |
| 2) Meilleur choix pour détecter une grande protéine avec des épitopes multiples (comme une cytokine) | ||
| concurrentiel | 1) Des échantillons impurs peuvent être utilisés | 1) nécessite une grande quantité d'antigène très pur pour être utilisé pour enrober la plaque |
| 2) Moins de sensibilité aux effets de dilution de réactif | ||
| 3) Idéal pour détecter de petites molécules (comme un hapten) |
Tableau 3 : Sommaire. Un résumé des forces et des faiblesses des différentes techniques ELISA.
Bien qu'il s'agit d'une technique simple et utile, il ya aussi quelques inconvénients à toute ELISA. La première est l'incertitude quant à la quantité de protéines d'intérêt dans les échantillons d'essai. Si la quantité est trop élevée ou trop faible, les valeurs d'absorption obtenues par le lecteur de microplaque peuvent tomber au-dessus ou en dessous des limites de la courbe standard, respectivement. Il sera ainsi difficile de déterminer avec précision la quantité de protéines présentes dans les échantillons d'essai. Si les valeurs sont trop élevées, l'échantillon d'essai peut être dilué avant d'ajouter aux puits de la plaque. Les valeurs finales devraient alors être ajustées en fonction du facteur de dilution. Comme mentionné, les kits faits maison nécessitent souvent une optimisation minutieuse des concentrations d'anticorps utilisées pour produire un rapport signal-bruit élevé.
- Porstmann, T. and Kiessig S.T. Enzyme immunoassay techniques. An overview. Journal of Immunological Methods. 150 (1-2), 5-21 (1992).
- Suleyman Aydin. A short history, principles, and types of ELISA, and our laboratory experience with peptide/protein analyses using ELISA. Peptides, 72, 4-15 (2015).
- Gan. S. D. and Patel K. R. Enzyme Immunoassay and Enzyme-Linked Immunosorbent Assay. Journal of Investigative Dermatology, 133 (9), 1-3 (2013).
- Kohl, T. O. and Ascoli C.A. Immunometric Antibody Sandwich Enzyme-Linked Immunosorbent Assay. Cold Spring Harbor Protocols, 1 (6), (2017).
- Sakamoto, S., Putalun, W., Vimolmangkang, S., Phoolcharoen, W., Shoyama, Y., Tanaka, H., and Morimoto S. Enzyme-linked immunosorbent assay for the quantitative/qualitative analysis of plant secondary metabolites. Journal of natural medicines, 72 (1), 32-42 (2018).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved