Abstract
Protocol
Representative Results
Discussion
References
Immunology
ELISA-Test: Indirekt, Sandwich und kompetitiv
Published: April 30th, 2023
Quelle: Whitney Swanson1,2, Frances V. Sjaastad2,3, und Thomas S. Griffith1,2,3,4
1 Department of Urology, University of Minnesota, Minneapolis, MN 55455
2 Zentrum für Immunologie, University of Minnesota, Minneapolis, MN 55455
3 Mikrobiologie, Immunologie und Krebsbiologie Graduate Program, University of Minnesota, Minneapolis, MN 55455
4 Freimaurerkrebszentrum, University of Minnesota, Minneapolis, MN 55455
Enzymgebundener Immunsorbent-Assay (ELISA) wird häufig verwendet, um das Vorhandensein und/oder die Konzentration eines Antigens, Antikörpers, Peptids, Proteins, Hormons oder eines anderen Biomoleküls in einer biologischen Probe zu messen. Es ist extrem empfindlich, in der Lage, niedrige Antigenkonzentrationen zu erkennen. Die Empfindlichkeit von ELISA wird auf seine Fähigkeit zurückgeführt, die Wechselwirkungen zwischen einem einzelnen Antigen-Antikörper-Komplex zu erkennen (1). Darüber hinaus ermöglicht die Aufnahme eines enzymkonjugierten antigenspezifischen Antikörpers die Umwandlung eines farblosen Substrats in ein chromogenes oder fluoreszierendes Produkt, das von einem Plattenleser erkannt und leicht quantisiert werden kann. Im Vergleich zu den Werten, die durch titrated Mengen eines bekannten Antigens von Interesse erzeugt werden, kann die Konzentration des gleichen Antigens in den experimentellen Proben bestimmt werden. Verschiedene ELISA-Protokolle wurden angepasst, um Antigenkonzentrationen in einer Vielzahl von Versuchsproben zu messen, aber sie alle haben das gleiche Grundkonzept (2). Die Wahl des Typs von ELISA, der indirekt, Sandwich oder wettbewerbsfähig ist, hängt von einer Reihe von Faktoren ab, einschließlich der Komplexität der zu testenden Proben und der antigenspezifischen Antikörper, die zur Verwendung zur Verfügung stehen. Der indirekte ELISA wird häufig verwendet, um das Ergebnis einer immunologischen Reaktion zu bestimmen, wie z. B. die Messung der Konzentration eines Antikörpers in einer Probe. Der Sandwich-ELISA eignet sich am besten zur Analyse komplexer Proben, wie Gewebekulturüberstand oder Gewebelysate, bei denen der Analyt oder Antigen von Interesse Teil einer gemischten Probe ist. Schließlich wird der wettbewerbsfähige ELISA am häufigsten verwendet, wenn nur ein Antikörper zur Verfügung steht, um das Antigen von Interesse zu erkennen. Wettbewerbsfähige ELISAs sind auch nützlich, um ein kleines Antigen mit nur einem einzigen Antikörper-Epitop zu erkennen, das aufgrund von sterischer Behinderung zwei verschiedene Antikörper nicht aufnehmen kann. Das Protokoll wird die grundlegenden Verfahren für die indirekten, Sandwich- und wettbewerbsfähigen ELISA-Assays beschreiben.
Der indirekte ELISA-Assay wird häufig verwendet, um die Menge an Antikörpern im Serum oder im Überstand einer Hybridomkultur zu messen. Das allgemeine Verfahren für den indirekten ELISA-Test ist:
- Mantelbrunnen mit Antigenen
- Hinzufügen von Serum- oder Hybridomkultur-Überstand-Antikörpern (Primär- oder 1°-Antikörper)
- Inkubieren und waschen
- Sekundärer (oder 2°) enzymkonjugierter Antikörper hinzufügen
- Inkubieren und waschen
- Substrat hinzufügen
Der Sandwich-ELISA-Assay unterscheidet sich vom indirekten ELISA-Assay dadurch, dass das Verfahren keine Beschichtung der Platten mit einem gereinigten Antigen beinhaltet. Stattdessen wird ein "Capture"-Antikörper verwendet, um die Brunnen der Platte zu beschichten. Das Antigen wird zwischen dem Capture-Antikörper und einem zweiten "detektions"-Enzymkonjugatierten Antikörper "sandwiched" - wobei beide Antikörper spezifisch für das gleiche Antigen sind, jedoch an unterschiedlichen Epitopen (3). Durch Bindung an den Capture-Antikörper/Antigen-Komplex verbleibt der Detektionsantikörper in der Platte. Als Aufnahme- und Nachweisantikörper können entweder monoklonale Antikörper oder polyklonale Antisera verwendet werden. Der Hauptvorteil des Sandwich-ELISA besteht darin, dass die Probe nicht vor der Analyse gereinigt werden muss. Darüber hinaus kann der Test sehr empfindlich sein (4). Viele handelsübliche ELISA-Kits sind von der Sandwich-Vielfalt und verwenden getestete, abgestimmte Paare von Antikörpern. Das allgemeine Verfahren für den Sandwich ELISA Assay ist:
- Mantelbrunnen mit Capture-Antikörper
- Hinzufügen von Testproben mit Antigen
- Inkubieren und waschen
- Fügen Sie enzymkonjugierten Detektionsantikörper hinzu.
- Inkubieren und waschen
- Substrat hinzufügen
Die meisten handelsüblichen Sandwich-ELISA-Kits sind mit enzymkonjugierten Nachweisantikörpern ausgestattet. In Fällen, in denen kein enzymkonjugierter Detektionsantikörper verfügbar ist, kann ein sekundärer enzymkonjugierter Antikörper verwendet werden, der speziell für den Nachweisantikörper ist. Das Enzym auf dem sekundären Antikörper erfüllt die gleiche Rolle, d.h. das farblose Substrat in ein chromogenes oder fluoreszierendes Produkt umzuwandeln. Der oben erwähnte sekundäre enzymkonjugierte Antikörper würde eher in einem "hausgemachten" Sandwich-ELISA verwendet werden, das von einem Forscher entwickelt wurde, der beispielsweise eigene monoklonale Antikörper erzeugt hat. Ein Nachteil bei der Verwendung eines sekundären enzymkonjugierten Antikörpers besteht darin, sicher zu sein, dass er nur an den Nachweisantikörper bindet und nicht an den an die Platte gebundenen Capture-Antikörper. Dies würde zu einem messbaren Produkt in allen Brunnen führen, unabhängig vom Vorhandensein oder Fehlen von Antigen oder Detektionsantikörper.
Schließlich wird der wettbewerbsfähige ELISA-Test verwendet, um lösliche Antigene zu erkennen. Es ist einfach durchzuführen, aber es ist nur geeignet, wenn das gereinigte Antigen in einer relativ großen Menge verfügbar ist. Das allgemeine Verfahren für den wettbewerbsfähigen ELISA-Test ist:
- Mantelbrunnen mit Antigen
- Inkubieren und waschen
- Präinkubent-Testprobe mit enzymkonjugierten Primärantikörpern
- Mischung gut hinzufügen
- Inkubieren und waschen Sie alle ungebundenen enzymkonjugierten Primärantikörper
- Substrat hinzufügen
Der "Wettbewerb" in diesem Test kommt aus der Tatsache, dass mehr Antigen in der Testprobe in Schritt 3 verwendet wird in weniger Antikörper zur Verfügung, um an die Antigenbeschichtung des Brunnens zu binden führen. Somit hängt die Intensität des chromogenen/fluorogenen Produkts im Brunnen am Ende des Tests umgekehrt mit der in der Testprobe vorhandenen Antigenmenge zusammen.
Eine Schlüsselkomponente in jeder Art von ELISA sind die titrierten Standards bekannter Konzentrationen, die es dem Benutzer ermöglichen, die antigenische Konzentration in den Testproben zu bestimmen. Typischerweise sind eine Reihe von Brunnen für die Erstellung einer Standardkurve vorgesehen, bei der bekannte Mengen eines gereinigten rekombinanten Proteins in abnehmenden Mengen zu den Brunnen hinzugefügt werden. Wenn diese Brunnen gleichzeitig mit den Testproben verarbeitet werden, kann der Anwender einen Referenzsatz von Absorptionswerten erhalten, die von einem Mikroplattenleser für bekannte Proteinkonzentrationen erhalten werden, um mit den Absorptionswerten für die Testproben zu gehen. Der Anwender kann dann eine Standardkurve berechnen, mit der die Testproben verglichen werden können, um die Menge des vorhandenen Proteins zu bestimmen. Die Standardkurve kann auch den Grad der Präzision der Verdünnungsherstellung des Benutzers bestimmen.
Schließlich erfordert der letzte Schritt in jedem der oben aufgeführten ELISA-Typen die Zugabe eines Substrats. Der Grad der Umwandlung des Substrats in das Produkt steht in direktem Zusammenhang mit der Menge des Enzyms, das im Brunnen vorhanden ist. Meerrettichperoxidase (HRP) und alkalische Phosphatase (AP) sind die häufigsten Enzyme, die konjugiert mit Antikörpern gefunden werden. Wie erwartet, gibt es eine Reihe von Substraten, die spezifisch für Enzyme verfügbar sind, die ein chromogenes oder fluoreszierendes Produkt produzieren. Darüber hinaus sind Substrate in einer Reihe von Empfindlichkeiten erhältlich, die die Gesamtempfindlichkeit des Assays erhöhen können. Der Anwender muss auch die Art der Instrumentierung berücksichtigen, die für das Ablesen der Platte am Ende des Experiments zur Verfügung steht, wenn er den zu verwendenden Substrattyp sowie den entsprechenden enzymkonjugierten Antikörper wählt.
Häufig verwendete chromogene Substrate für HRP umfassen 2,2'-Azinobis [3-Ethylbenzothiazolin-6-Sulfonsäure]-Diammoniumsalz (ABTS) und 3,3',5,5'-Tetramethylbenzidin (TMB), während p-Nitrophenylphosphat (PNPP) für AP verwendet wird. ABTS und TMB wasserlösliche grüne bzw. blau gefärbte Reaktionsprodukte herstellen. Das grüne ABTS-Produkt hat zwei Hauptabsorptionsspitzen, 410 und 650 nm, während das blaue TMB-Produkt am besten bei 370 und 652 nm nachgewiesen wird. Die Farben von ABTS und TMB ändern sich nach Zugabe einer sauren Stop-Lösung in Gelb, die am besten bei 450 nm gelesen wird. Die Farbentwicklung für ABTS ist langsam, während sie für TMB schnell ist. TMB ist empfindlicher als ABTS und kann ein höheres Hintergrundsignal erzeugen, wenn die enzymatische Reaktion zu lange dauert. PNPP produziert ein gelbes wasserlösliches Produkt nach DER AP-Umwandlung, das Licht bei 405 nm absorbiert.
1. Indirekter ELISA
Ein indirekter ELISA ist einer, bei dem der primäre antigenspezifische Antikörper von einem sekundären konjugierten Antikörper erkannt wird. Das folgende Protokoll ist ein Beispiel für eine indirekte ELISA-Methode, bei der die Serumproben von Mit infizierten Mäusen des Influenza-A-Virus (IAV) auf das Vorhandensein von IAV-spezifischen IgG-Antikörpern getestet werden. Eine Stärke dieses Beispiels besteht darin, dass verschiedene sekundäre Antikörper verwendet werden können, die alle Antikörper-Isotypen oder bestimmte Isotypen (z. B. IgG) erkennen.
Beschichtungsantigen auf die Mikroplatte
- Beschichten Sie die Bohrungen einer 96-Well-ELISA-Platte mit gereinigtem Antigen, indem Sie 50 l gereinigtes Antigen (2 mg/ml gereinigtes A/PR/8 Influenza-A-Virus im 0,05M Tris-HCl-Puffer (pH 9,5)) in jeden Bohrgut der Platte einleiten.
- Bedecken Sie die Platte mit einer Klebeabdeckung und inkubieren Sie sie über Nacht bei 4°C, damit sich das Antigen an die Platte bindet.
- Entfernen Sie nach der Inkubationsvervollständigung die Beschichtungslösung, indem Sie die Platte über ein Waschbecken schieben.
Blockieren
- Blockieren Sie die verbleibenden Proteinbindungsstellen in den beschichteten Brunnen durch Zugabe von 200 l Sperrpuffer, 5% Eselserum in 1X PBS wird hier pro Brunnen verwendet. Alternative Blockierreagenzien sind 5 % fettfreie Trockenmilch oder BSA in PBS oder normales Serum von einem Tier, bei dem der sekundäre Antikörper erzeugt wurde.
- Mindestens 2 Stunden bei Raumtemperatur oder über Nacht bei 4°C inkubieren.
- Entfernen Sie nach der Inkubation den Sperrpuffer, indem Sie die Platte flicken, und waschen Sie dann die Platte mit PBS, die 1% Tween-20 enthält.
Inkubation mit dem primären Antikörper
- Bereiten Sie eine serielle Verdünnung der Serumprobe vor, die den primären Antikörper enthält, um einen Verdünnungsbereich von 1 bis 204.800 zu erhalten, indem Sie 1X PBS verwenden. Dazu verdünnen Sie zuerst das Serum 1:12,5 und führen Sie dann eine 4X Verdünnung (Verdünnungsbereich - 1:12,5 bis 1:204,800) durch.
- Fügen Sie 100 l der seriell verdünnten Serumproben in die Brunnen.
- Abdeckplatte mit Klebeabdeckung und inkubieren bei Raumtemperatur für 1-2 h.
- Nach der Inkubation die Platte über ein Waschbecken und eine Waschplatte mit PBS mit 1% Tween-20 streichen.
Inkubation mit dem sekundären Antikörper
- Fügen Sie in diesem Experiment 100 L eines enzymkonjugierten Sekundärantikörpers, Der Meerrettichperoxidase, der HRP-konjugierten Esel-Anti-Maus-Sekundärinstand in diesem Experiment, zu jedem Brunnen hinzu.
- Inkubieren Sie die Platte für 1 Stunde bei Raumtemperatur.
- Nach der Inkubation die Platte über ein Waschbecken ziehen und dann die Platte mit PBS mit 1% Tween-20 waschen.
entdeckung
- Fügen Sie 100 l des Indikatorsubstrats (3,3',5,5'-Tetramethylbenzidin (TMB)) in einer Konzentration von 1 mg/ml zu jedem Brunnen hinzu.
- Inkubieren Sie die Platte mit dem Substrat für 5-10 min bei Raumtemperatur.
- Nach 10 min stoppen Sie die enzymatische Reaktion, indem Sie 100 l 2N Schwefelsäure (H2SO4) hinzufügen.
Innerhalb von 30 min nach Zugabe der Stop-Lösung, lesen Sie die Platte mit einem Mikroplattenleser bei 405 nm, um die Absorption der Brunnen zu bestimmen.
2. Sandwich ELISA
In dieser ELISA-Version wird die Versuchsprobe zwischen einem unkonjugierten Capture-Antikörper und einem konjugierten Detektionsantikörper "sandwichiert", die beide spezifisch für dasselbe Protein, aber an unterschiedlichen Epitopen sind. Im folgenden Sandwich-ELISA-Beispiel wurde die Konzentration von humanem TNF in unbekannter Probe anhand einer Standardkurve ermittelt, die aus der 2,5-fachen seriellen Verdünnung eines bekannten, rekombinanten menschlichen TNFs (mit einer Konzentration von 75 pg/ml) erzeugt wurde.
Beschichtungs-Capture-Antikörper an die Mikroplatte
- Beschichten Sie die Bohrungen einer 96-Well-ELISA-Platte mit gereinigtem Capture-Antikörper, indem Sie jedem Bohrkörper der Platte 100 l Aufnahmeantikörper (1-10 g/ml-Bereich) hinzufügen.
- Deckplatte mit Klebeplattenabdeckung abdecken und bei 4°C über Nacht bebrüten.
- Nach der Inkubation entfernen Sie die Beschichtungslösung von der Platte, indem Sie die Platte über ein Waschbecken flicken.
Blockieren
- Blockieren Sie die verbleibenden Proteinbindungsstellen in den Antikörper-beschichteten Brunnen, indem Sie den Brunnen eine Blockierlösung von 200 l, 5 % fettfreie Trockenmilch, die PBS enthält, hinzufügen.
- Mindestens 2 h bei Raumtemperatur oder über Nacht bei 4°C inkubieren.
- Entfernen Sie nach der Inkubation den Sperrpuffer, indem Sie die Platte flicken, und waschen Sie dann die Platte mit PBS, die 1% Tween-20 enthält.
Hinzufügen von Antigen-haltigen Testproben
- Fügen Sie 100 l der Testprobe zu den Bohrungen hinzu. Versiegeln Sie die Platte mit einer Klebeabdeckung.
- 1-2 h bei Raumtemperatur oder über Nacht bei 4°C inkubieren.
- Nach der Inkubation entfernen Sie die Proben, indem Sie die Platte über das Waschbecken streichen, und waschen Sie dann die Brunnen mit 200 l 1X PBS, die 1% Tween-20 enthalten.
Enzymkonjugierte Detektionsantikörper hinzufügen
- Fügen Sie 100 L enzymkonjugierten Detektionsantikörper in einer voroptimierten Konzentration in die Brunnen ein.
- Versiegeln Sie die Platte mit einer Klebeabdeckung und brüten Bei Raumtemperatur für 2 h.
- Entfernen Sie den ungebundenen Detektionsantikörper, indem Sie die Platte über ein Waschbecken streichen, und waschen Sie die Brunnen mit 200 l 1X PBS, die 1% Tween-20 enthalten.
entdeckung
- Fügen Sie 100 l des Indikatorsubstrats bei einer Konzentration von 1 mg/ml hinzu. Jeder gebundene enzymkonjugierte Detektionsantikörper wandelt das Substrat in ein nachweisbares Signal um.
- Inkubieren Sie die Platte für 5-10 min bei Raumtemperatur.
- Beenden Sie nach 5-10 min die enzymatische Reaktion, indem Sie den Brunnen 100 l 2N H2SO4 hinzufügen. Innerhalb von 30 min nach Zugabe der Stop-Lösung, lesen Sie die Platte mit einem Mikroplattenleser, um die Absorption der Brunnen zu bestimmen.
3. Wettbewerbsfähiger ELISA
Die Schritte eines wettbewerbsfähigen ELISA unterscheiden sich von denen, die in indirekt und Sandwich-ELISA verwendet werden, wobei der Hauptunterschied der wettbewerbsfähige Bindungsschritt zwischen dem Probenantigen und dem "Add-in"-Antigen ist. Das Probenantigen wird mit dem nicht beschrifteten Primärantikörper inkubiert. Diese Antikörper-Antigen-Komplexe werden dann der ELISA-Platte zugesetzt, die mit dem gleichen Antigen vorbeschichtet wurde. Nach einer Inkubationszeit wird jeder ungebundene Antikörper weggespült. Es besteht eine umgekehrte Korrelation zwischen der Menge an freiem Antikörper, die zur Bindung des Antigens im Brunnen zur Verfügung steht, und der Menge an Antigen in der ursprünglichen Probe. Zum Beispiel würde eine Probe mit reichlich Antigen mehr Antigen-Primär-Antikörper-Komplexe haben, so dass wenig ungebundener Antikörper an die ELISA-Platte zu binden. Anschließend wird den Brunnen ein enzymkonjugierter Sekundärantikörper zugesetzt, gefolgt vom Substrat.
Beschichtungsantigen auf die Mikroplatte
- Beschichten Sie die Bohrungen einer 96-Well-ELISA-Platte mit 100 l gereinigtem Antigen in einer Konzentration von 1-10 g/ml.
- Deckplatte mit Klebeplattenabdeckung abdecken und über Nacht bei 4°C bebrüten.
- Entfernen Sie nach der Inkubation die ungebundene Antigenlösung aus den Brunnen, indem Sie die Platte über ein Waschbecken schieben.
Blockieren
- Blockieren Sie die verbleibenden Proteinbindungsstellen in den beschichteten Brunnen, indem Sie jedem Bohrgut 200 L Sperrpuffer hinzufügen, der entweder 5 % fettfreie Trockenmilch oder BSA in PBS sein kann.
- Inkubieren Sie die Platte für mindestens 2 h bei Raumtemperatur oder über Nacht bei 4°C.
Inkubationsprobe (Antigen) mit dem primären Antikörper
- Während der Blockierung der Brunnen, bereiten Sie die Antigen-Antikörper-Mischung durch Mischen 150 l Probe Antigen und 150 l primären Antikörper für jeden Brunnen in den Test.
- Inkubieren Sie diese Mischung für 1 h bei 37°C.
Antigen-Antikörper-Mischung in den Brunnen geben
- Entfernen Sie nun den Sperrpuffer aus den Brunnen, indem Sie die Platte über eine Spüle schieben.
- Dann waschen Sie die Brunnen mit 1X PBS enthalten Tween-20.
- Fügen Sie 100 l der Probe Antigen-Primär-Antikörper-Mischung.
- Inkubieren Sie die Platte bei 37°C für 1 h.
- Entfernen Sie die Probenmischung, indem Sie die Platte über ein Waschbecken schieben.
- Waschen Sie dann die Brunnen mit 1X PBS, die 1% Tween-20 enthalten, um alle ungebundenen Antikörper zu entfernen.
Hinzufügen des sekundären Antikörpers
- Fügen Sie jedem Brunnen 100 l eines enzymkonjugierten Sekundärantikörpers, der in diesem Fall AP-konjugierter Antikörper ist, hinzu.
- Inkubieren Sie die Platte für 1 h bei 37°C.
- Waschen Sie die Platte nach der Inkubation mit 1X PBS, die 1% Tween-20 enthält.
entdeckung
- Fügen Sie jedem Brunnen 100 l der Substratlösung hinzu.
- Warten Sie auf 5-10 min.
- Nach 10 min beenden Sie die enzymatische Reaktion, indem Sie den Brunnen 100 l 2N Schwefelsäure zusetzen. Messen Sie dann die Absorption in einem Mikroplattenleser innerhalb von 30 min nach Zugabe der Stop-Lösung
Im folgenden Beispiel eines indirekten ELISA wurde das Vorhandensein eines Influenza-A-Virus (IAV)-spezifischen IgG im Serum von IAV-infizierten Mäusen bestimmt. C57Bl/6-Mäuse wurden mit dem Influenza-A-Virus infiziert (A/PR/8; 105 PFU in 100 L PBS i.p.) und Serum wurde 28 Tage später gesammelt. Um die Menge an IAV-spezifischem IgG im Serum zu quantifizieren, wurden 96-Well-ELISA-Platten über Nacht bei 4°C mit dem gereinigten A/PR/8 Influenza-A-Virus (50 l/well von 2 mg/ml PBS-Virus) beschichtet. Beschichtete Platten wurden für 1 Stunde bei Raumtemperatur mit 5% normalem Eselserum in PBS blockiert, gefolgt von einer Inkubation mit verdünnten Serumproben von IAV-herausgeforderten Mäusen über Nacht bei 4°C. Das Serum wurde zunächst 1:12,5 verdünnt, gefolgt von 1:4 Verdünnungen (Verdünnungsbereich - 1:12,5 bis 1:204,800). Nach dem Waschen wurden die Teller mit einer alkalischen Phosphatase (AP)-konjugierten Esel Anti-Maus-IgG für 1 h inkubiert. Die Platten wurden gewaschen und dann p-Nitrophenylphosphat (PNPP; 1 mg/ml, 100 l/well) zugegeben. Die farblose PNPP-Lösung wird gelb, wenn AP vorhanden ist. Nach 5-10 min wurde die enzymatische Reaktion durch Zugabe von 100 l/well 2N H2SO4gestoppt. Die Platte wurde auf einem Mikroplattenleser bei 405 nm gelesen. Die erzielten Ergebnisse sind in Tabelle 1 und Abbildung 1 dargestellt.
| probe | Wells | OD405 | knauserig |
| Serum 1:12,5 | A1 | 2.163 | 2.194 |
| B1 | 2.214 | ||
| C1 | 2.204 | ||
| Serum 1:50 | A1 | 1.712 | 1.894 |
| B1 | 2.345 | ||
| C1 | 1.624 | ||
| Serum 1:200 | A1 | 1.437 | 1.541 |
| B1 | 1.73 | ||
| C1 | 1.456 | ||
| Serum 1:800 | A1 | 1.036 | 0.957 |
| B1 | 0.912 | ||
| C1 | 0.923 | ||
| Serum 1:3200 | A1 | 0.579 | 0.48 |
| B1 | 0.431 | ||
| C1 | 0.429 | ||
| Serum 1:12800 | A1 | 0.296 | 0.281 |
| B1 | 0.312 | ||
| C1 | 0.236 | ||
| Serum 1:51200 | A1 | 0.308 | 0.283 |
| B1 | 0.299 | ||
| C1 | 0.243 | ||
| Serum 1:204800 | A1 | 0.315 | 0.303 |
| B1 | 0.298 | ||
| C1 | 0.297 |
Tabelle 1: Indirekte ELISA-Assay-Daten. Serumverdünnungen (von 1:12,5 bis 1:204.800), von Influenza-A-Virus (IAV)-infizierten Mäusen, die IAV-spezifische IgG-Werte, optische Dichtewerte (OD) (405 nm) und mittlere OD405-Werte enthalten.
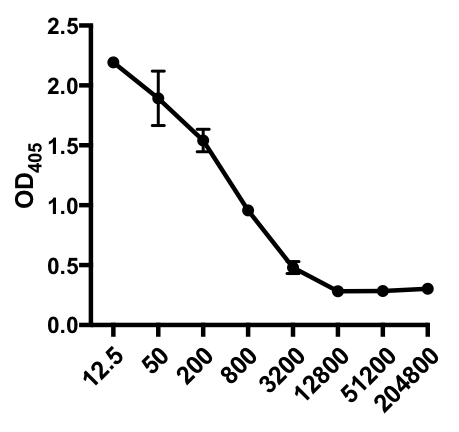
Abbildung 1: Indirekte ELISA-Assay-Streuungsdiagramm egrinieren von mittleren OD405-Werten (+ S. D.) und Serumverdünnungen (von 1:12,5 bis 1:204.800), des Influenza-A-Virus (IAV)-spezifischen IgG im Serum von IAV-infizierten Mäusen. Die OD405-Werte können umgekehrt mit den Serumverdünnungen korreliert werden.
Im folgenden Beispiel eines Sandwich-ELISA wurde den angegebenen Bohrungen einer 96-Well-Flachbodenplatte eine Verdünnung der rekombinanten menschlichen TNF-Standards (ab einer Konzentration von 75 pg/ml) hinzugefügt. Diese Standards führten zu einer entsprechenden 2,5-fachen Veränderung der Absorptionswerte.
| probe | Konzentration (pg/ml) | Wells | Werte | Mittelwert | Zurück-Konzentrationsberechnung | durchschnitt |
| Standard 1 | 75 | A1 | 1.187 | 1.169 | 76.376 | 75.01 |
| A2 | 1.152 | 73.644 | ||||
| Standard 2 | 30 | B1 | 0.534 | 0.52 | 30.827 | 29.962 |
| B2 | 0.506 | 29.098 | ||||
| Standard 3 | 12 | C1 | 0.23 | 0.217 | 12.838 | 12.105 |
| C2 | 0.204 | 11.372 | ||||
| Standard 4 | 4.8 | D1 | 0.09 | 0.084 | 5.055 | 4.726 |
| D2 | 0.078 | 4.398 | ||||
| Standard 5 | 1.92 | E1 | 0.033 | 0.031 | 1.941 | 1.86 |
| E2 | 0.03 | 1.778 | ||||
| Standard 6 | 0.768 | F1 | 0.009 | 0.011 | 0.626 | 0.764 |
| F2 | 0.014 | 0.901 | ||||
| Standard 7 | 0.307 | G1 | 0.002 | 0.004 | 0.238 | 0.377 |
| G2 | 0.007 | 0.516 |
Tabelle 2: TNF-Sandwich-ELISA-Standardkurvendaten. Eine Verdünnung der rekombinanten menschlichen TNF-Normen (75 bis 0,3 pg/ml), OD-Werte (450 nm), mittlere OD450-Werte, Rückkonzentrationsberechnungen und deren Durchschnittswerte.
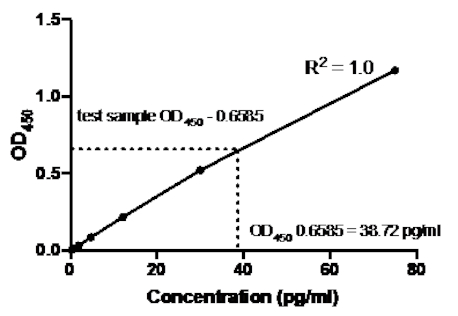
Abbildung 2: Standardkurve für TNF-Sandwich-ELISA. Eine Verdünnung der rekombinanten menschlichen TNF-Normen (75 bis 0,3 pg/ml) wurde mit Sandwich-ELISA analysiert. Die OD450-Werte können direkt mit den Standardverdünnungskonzentrationen korreliert werden. Anhand der Standardkurve, die einer Konzentration von 38,72 pg/ml entspricht, wurde die Menge des TNF-Proteins in der Testprobe ermittelt.
Sobald die Standardkurve erzeugt wurde, wurde die Menge des TNF-Proteins in der Testprobe bestimmt. In diesem Sandwich-ELISA-Beispiel ergaben die Testproben OD450 Messwerte von 0,636 und 0,681, was einem Durchschnitt von 0,6585 entspricht. Bei der Darstellung dieses OD450-Messwerts auf dem obigen Diagramm entspricht dies einer TNF-Konzentration von 38,72 pg/ml.
Wie gezeigt, fällt eine Reihe von Immunoassays (mit leichten Variationen in den Protokollen) in die ELISA-Technikfamilie. Die Bestimmung, welche Version von ELISA verwendet werden soll, hängt von einer Reihe von Faktoren ab, einschließlich des Antigens, des monoklonalen Antikörpers, der für ein bestimmtes Antigen verfügbar ist, und der gewünschten Empfindlichkeit des Assays (5). Einige Stärken und Schwächen der verschiedenen hier beschriebenen ELISAs sind:
| Elisa | Stärken | Schwächen |
| nicht direkt | 1) Hohe Empfindlichkeit aufgrund der Tatsache, dass mehrere enzymkonjugierte sekundäre Antikörper an den primären Antikörper binden können | 1) Hohes Hintergrundsignal kann auftreten, weil die Beschichtung des Antigens, das für die Platte von Interesse ist, nicht spezifisch ist (d. h., alle Proteine in der Probe werden die Platte beschichten) |
| 2) Viele verschiedene primäre Antikörper können von einem einzigen enzymkonjugierten sekundären Antikörper erkannt werden, der dem Anwender die Flexibilität gibt, denselben enzymkonjugierten sekundären Antikörper in vielen verschiedenen ELISA zu verwenden (unabhängig vom antigen, das nachgewiesen wird) | ||
| 3) Beste Wahl, wenn nur ein einziger Antikörper für das Antigen von Interesse zur Verfügung steht | ||
| sandwich | 1) Die Verwendung von antigenspezifischen Erfassungs- und Detektions-Monoklonen verstärkt die Empfindlichkeit und Spezifität des Assays (im Vergleich zum indirekten ELISA) | 1) Die Optimierung der Konzentrationen der monoklonalen Antikörper zur Erfassung und Detektion kann schwierig sein (besonders bei nicht-kommerziellen Kits) |
| 2) Beste Wahl für den Nachweis eines großen Proteins mit mehreren Epitopen (wie z. B. Zytokin) | ||
| kämpferisch | 1) Unreine Proben können verwendet werden | 1) Erfordert eine große Menge an hochreinem Antigen verwendet werden, um Platte zu beschichten |
| 2) Geringere Empfindlichkeit gegenüber Reagenzienverdünnungseffekten | ||
| 3) Ideal zum Nachweis kleiner Moleküle (z. B. Hapten) |
Tabelle 3: Zusammenfassung. Eine Zusammenfassung der Stärken und Schwächen der verschiedenen ELISA-Techniken.
Während eine einfache und nützliche Technik, gibt es auch einige Nachteile zu jedem ELISA. Eine davon ist die Ungewissheit über die Menge des Proteins, das für die Testproben von Interesse ist. Ist die Menge zu hoch oder zu niedrig, können die vom Mikroplattenleser ermittelten Absorptionswerte über bzw. unter die Grenzen der Standardkurve fallen. Dies wird es schwierig, die Menge des Proteins in den Testproben genau zu bestimmen. Wenn die Werte zu hoch sind, kann die Probe vor dem Hinzufügen zu den Plattenbrunnen verdünnt werden. Die Endwerte müssten dann entsprechend dem Verdünnungsfaktor angepasst werden. Wie bereits erwähnt, erfordern hausgemachte Kits oft eine sorgfältige Optimierung der Antikörperkonzentrationen, die verwendet werden, um ein hohes Signal-Rausch-Verhältnis zu erzielen.
- Porstmann, T. and Kiessig S.T. Enzyme immunoassay techniques. An overview. Journal of Immunological Methods. 150 (1-2), 5-21 (1992).
- Suleyman Aydin. A short history, principles, and types of ELISA, and our laboratory experience with peptide/protein analyses using ELISA. Peptides, 72, 4-15 (2015).
- Gan. S. D. and Patel K. R. Enzyme Immunoassay and Enzyme-Linked Immunosorbent Assay. Journal of Investigative Dermatology, 133 (9), 1-3 (2013).
- Kohl, T. O. and Ascoli C.A. Immunometric Antibody Sandwich Enzyme-Linked Immunosorbent Assay. Cold Spring Harbor Protocols, 1 (6), (2017).
- Sakamoto, S., Putalun, W., Vimolmangkang, S., Phoolcharoen, W., Shoyama, Y., Tanaka, H., and Morimoto S. Enzyme-linked immunosorbent assay for the quantitative/qualitative analysis of plant secondary metabolites. Journal of natural medicines, 72 (1), 32-42 (2018).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved