Abstract
Protocol
Representative Results
Discussion
References
Immunology
אליסה אסייס: עקיפה, כריך ותחרותי
Published: April 30th, 2023
מקור: ויטני סוונסון1,2, פרנסס נגד Sjaastad2,3, ותומאס ס גריפית1,2,3,4
המחלקה לאורולוגיה, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
2 המרכז לאימונולוגיה, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
3 מיקרוביולוגיה, אימונולוגיה, ותוכנית לתואר שני בביולוגיה של סרטן, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
4 מרכז הסרטן הבונים החופשיים, אוניברסיטת מינסוטה, מיניאפוליס, MN 55455
בדיקות חיסוניות הקשורות לאנזימים (ELISA) משמשות לעתים קרובות למדידת נוכחות ו/או ריכוז של אנטיגן, נוגדן, פפטיד, חלבון, הורמון או ביומולקול אחר במדגם ביולוגי. הוא רגיש ביותר, מסוגל לזהות ריכוזי אנטיגן נמוכים. הרגישות של ELISA מיוחסת ליכולתה לזהות את האינטראקציות בין קומפלקס אנטיגן-נוגדנים יחיד (1). יתר על כן, הכללה של נוגדן אנטיגן מצומד באנזים מאפשרת המרה של מצע חסר צבע למוצר כרומוגני או פלואורסצנטי שניתן לזהות ולהו כמות בקלות על ידי קורא לוחות. בהשוואה לערכים שנוצרו על ידי כמויות titrated של אנטיגן ידוע של עניין, הריכוז של אותו אנטיגן בדגימות ניסיוניות ניתן לקבוע. פרוטוקולי ELISA שונים הותאמו למדידת ריכוזי אנטיגן במגוון דגימות ניסיוניות, אך לכולם יש את אותו מושג בסיסי (2). בחירת סוג ELISA לביצוע, עקיף, כריך, או תחרותי, תלוי במספר גורמים, כולל המורכבות של הדגימות להיבדק ואת נוגדנים ספציפיים אנטיגן זמין לשימוש. ELISA העקיף משמש לעתים קרובות כדי לקבוע את התוצאה של תגובה חיסונית, כגון מדידת הריכוז של נוגדן במדגם. הכריך ELISA מתאים ביותר לניתוח דגימות מורכבות, כגון תרבית רקמות supernatants או lysates רקמה, שבו ניתוח, או אנטיגן של עניין, הוא חלק מדגם מעורב. לבסוף, ELISA התחרותי משמש לרוב כאשר יש רק נוגדן אחד זמין כדי לזהות את האנטיגן של עניין. ELISAs תחרותיים שימושיים גם לאיתור אנטיגן קטן עם אפיטופ נוגדן אחד בלבד שאינו יכול להכיל שני נוגדנים שונים עקב הפרעה סטרית. הפרוטוקול יתאר את ההליכים הבסיסיים לבדיקות עקיפות, כריך ותחרותיות של ELISA.
בדיקת ELISA העקיפה משמשת בדרך כלל למדידת כמות הנוגדנים בסרום או בסופרנטור של תרבות היברידית. ההליך הכללי לבדיקת אליסה העקיפה הוא:
- מעיל בארות עם אנטיגנים
- הוסף סרום או תרבית היברידית המכילה נוגדן (נוגדן ראשוני או 1° )
- דגירה ושטיפה
- הוסף נוגדן משני (או 2°) מצומד באנזים
- דגירה ושטיפה
- הוספת מצע
סנדוויץ ' ELISA מנסח שונה מבדיקת ELISA העקיפה בכך שהשיטה אינה כרוכה בציפוי הצלחות באנטיגן מטוהר. במקום זאת, נוגדן "ללכוד" משמש לציפוי בארות של הצלחת. האנטיגן "תקוע" בין נוגדן הלכידה לנוגדן "זיהוי" שני - שבו שני הנוגדנים ספציפיים לאותו אנטיגן, אך באפיטופים שונים (3). על ידי קשירה לתסביך הנוגדן/אנטיגן, נוגדן האיתור נשאר בצלחת. נוגדנים חד שבטיים או אנטיזרים פוליקלונליים יכולים לשמש כנוגדנים ללכידה וזיהוי. היתרון העיקרי של כריך ELISA הוא כי המדגם לא צריך להיות מטוהר לפני הניתוח. יתר על כן, ההסתה יכולה להיות רגישה למדי (4). ערכות ELISA רבות הזמינות מסחרית הן ממגוון הכריכים ומשתמשות בזוגות נוגדנים תואמים שנבדקו. ההליך הכללי עבור כריך אליסה אסאי הוא:
- מעיל בארות עם נוגדן לכידה
- הוספת דגימות בדיקה המכילות אנטיגן
- דגירה ושטיפה
- הוסיפו נוגדן לזיהוי מצומד באנזים.
- דגירה ושטיפה
- הוספת מצע
רוב ערכות הסנדוויץ' ELISA הזמינות מסחרית מגיעות עם נוגדני זיהוי מצומדים באנזים. במקרים בהם נוגדן זיהוי מצומד באנזים אינו זמין, ניתן להשתמש בנוגדן משני מצומד באנזים הספציפי לנוגדן האיתור. האנזים בנוגדן המשני מבצע את אותו תפקיד, שהוא להמיר את המצע חסר הצבע למוצר כרומוגני או פלואורסצנטי. הנוגדן המשני הנ"ל מצומד באנזים ירצה יותר לשמש בכריך "תוצרת בית" ELISA שפותח על ידי חוקר שיצר נוגדנים חד שבטיים משלהם, למשל. חיסרון אחד בשימוש בנוגדן מצומד משני הוא לוודא שהוא נקשר רק לנוגדן האיתור, ולא לנוגדן הלכידה הקשור לצלחת. התוצאה תהיה מוצר מדיד בכל בארות, ללא קשר לנוכחות או היעדר נוגדן אנטיגן או זיהוי.
לבסוף, ההסתייגות התחרותית של ELISA משמשת לזיהוי אנטיגנים מסיסים. זה פשוט לבצע, אבל זה מתאים רק כאשר האנטיגן המטוהר זמין בכמות גדולה יחסית. ההליך הכללי לבדיקת אליסה התחרותית הוא:
- בארות מעיל עם אנטיגן
- דגירה ושטיפה
- דגימת בדיקה לפני הדגמה עם נוגדנים ראשוניים מצומדים באנזים
- מוסיפים את התערובת היטב
- לדגור ולשטוף כל נוגדן ראשוני מצומד עם אנזים
- הוספת מצע
"התחרות" בבדיקה זו נובעת מהעובדה שיותר אנטיגן בדגימת הבדיקה המשמשת בשלב 3 תגרום לפחות נוגדנים זמינים להיקשר לציפוי האנטיגן של הבאר. לכן, עוצמת המוצר כרומוגגני/פלואורוגניים בבאר בסוף הבדיקה קשורה הפוך לכמות האנטיגן הקיימת במדגם הבדיקה.
מרכיב מרכזי בכל סוג של ELISA הוא הסטנדרטים titrated של ריכוזים ידועים שיאפשרו למשתמש לקבוע את ריכוז אנטיגן נוכח בדגימות הבדיקה. בדרך כלל, סדרה של בארות מיועדות ליצירת עקומה סטנדרטית, שבה כמויות ידועות של חלבון רקומביננטי מטוהר מתווספות לבארות בכמויות יורדות. כאשר בארות אלה מעובדות באותו זמן כמו דגימות הבדיקה, המשתמש יכול לקבל ערכת התייחסות של ערכי ספיגה המתקבלים מקורא מיקרו-לוח עבור ריכוזי חלבון ידועים ללכת יחד עם ערכי הספיגה עבור דגימות הבדיקה. לאחר מכן המשתמש יכול לחשב עקומה סטנדרטית שאליה ניתן להשוות את דגימות הבדיקה לקביעת כמות החלבון של עניין נוכח. העקומה הסטנדרטית יכולה גם לקבוע את מידת הדיוק של יצירת הדילול של המשתמש.
לבסוף, השלב האחרון בכל אחד מסוגי ELISA המפורטים לעיל דורש הוספת מצע. מידת ההמרה של המצע למוצר קשורה ישירות לכמות האנזים הקיימת בבאר. פרוקסידאז חזרת (HRP) ואלקליין פוספטאז (AP) הם האנזימים הנפוצים ביותר שנמצאו מצומדים לנוגדנים. כצפוי, ישנם מספר מצעים זמינים ספציפית עבור אנזים המייצרים מוצר כרומוגני או פלואורסצנטי. יתר על כן, מצעים זמינים במגוון רגישויות שיכולות להגביר את הרגישות הכוללת של ההסתה. המשתמש חייב גם לקחת בחשבון את סוג המכשור הזמין לקריאת הצלחת בסוף הניסוי בעת בחירת סוג המצע לשימוש, יחד עם הנוגדן המתאים לו מצומד באנזים.
מצעים כרומוגניים נפוצים עבור HRP כוללים 2,2'-אזינוביס [3-אתילבזותיאזולין-6-חומצה גופרתית]-מלח דיאמוניום (ABTS) ו-3,3',5,5'-tetramethylbenzidine (TMB), ואילו p-Nitrophenyl פוספט (PNPP) משמש עבור AP. ABTS ו- TMB מייצרים מוצרי תגובה בצבע ירוק וכחול מסיסים במים, בהתאמה. מוצר ABTS הירוק יש שתי פסגות ספיגה עיקריות, 410 ו 650 ננומטר, בעוד המוצר הכחול TMB מזוהה בצורה הטובה ביותר ב 370 ו 652 ננומטר. הצבעים של ABTS ו- TMB משתנים לצהוב בתוספת פתרון עצירה חומצי, אשר מומלץ לקרוא ב 450 ננומטר. פיתוח צבע עבור ABTS הוא איטי, בעוד הוא מהיר עבור TMB. TMB רגיש יותר מ- ABTS, ועשוי לייצר אות רקע גבוה יותר אם התגובה אנזימטית ממשיכה זמן רב מדי. PNPP מייצרת מוצר צהוב מסיס במים לאחר המרת AP שסופג אור ב-405 ננומטר.
1. אליסה עקיפה
ELISA עקיף הוא אחד שבו הנוגדן העיקרי אנטיגן ספציפי מזוהה על ידי נוגדן מצומד משני. הפרוטוקול הבא הוא דוגמה לשיטת ELISA עקיפה, שבה נבדקות דגימות הסרום של עכברים נגועים בשפעת A (IAV) לנוכחות נוגדן IgG ספציפי ל- IAV. כוח אחד של דוגמה זו הוא כי נוגדנים משניים שונים ניתן להשתמש המזהים את כל איזוטיפים נוגדנים או איזוטיפים ספציפיים (למשל, IgG).
ציפוי אנטיגן למיקרו-לוחית
- מצופים את בארות של צלחת ELISA 96-well עם אנטיגן מטוהר על ידי צנרת 50 μL של אנטיגן מטוהר (2 מ"ג / מ"ל של A מטוהר A / PR / 8 שפעת וירוס ב 0.05M חוצץ Tris-HCl (pH 9.5)) לתוך כל באר של הצלחת.
- מכסים את הצלחת בכיסוי דבק ודגר אותה למשך הלילה ב-4 מעלות צלזיוס כדי לאפשר לאנטיגן להיקשר לצלחת.
- עם השלמת הדגירה, להסיר את פתרון הציפוי על ידי הבהוב הצלחת מעל כיור.
חסימת
- חסמו את האתרים הנותרים של כריכת חלבונים בבארות המצולפות על ידי הוספת מאגר חסימה של 200 μL, נעשה שימוש בסרום חמור 5% ב-1X PBS, לבאר. ריאגנטים חלופיים לחסימה כוללים 5% חלב יבש ללא שומן או BSA ב- PBS או סרום רגיל מבעל חיים שבו נוצר הנוגדן המשני.
- יש לדגור לפחות שעתיים בטמפרטורת החדר או בלילה בטמפרטורה של 4 מעלות צלזיוס.
- לאחר הדגירה, להסיר את חוצץ חסימה על ידי הבהוב הצלחת ולאחר מכן לשטוף צלחת עם PBS המכיל 1% Tween-20.
דגירה עם הנוגדן העיקרי
- הכן דילול סדרתי של דגימת הסרום, המכילה את הנוגדן העיקרי, כדי להשיג טווח דילול של 1 עד 204,800, באמצעות 1X PBS. כדי לעשות זאת, תחילה לדלל את הסרום 1:12.5 ולאחר מכן לבצע דילול 4X (טווח דילול - 1:12.5 עד 1:204,800).
- הוסף 100 μL של דגימות סרום מדולל באופן סדרתי לבארות.
- מכסים את הצלחת עם כיסוי דבק ודגרה בטמפרטורת החדר במשך 1-2 שעות.
- לאחר הדגירה, להעיף את הצלחת מעל כיור לשטוף צלחת עם PBS המכיל 1% Tween-20.
דגירה עם הנוגדן המשני
- הוסף 100 μL של נוגדן משני מצומד אנזים, peroxidase חזרת, חומר מצומד HRP אנטי עכבר משני בניסוי זה, לכל באר.
- לדגור על הצלחת במשך שעה בטמפרטורת החדר.
- לאחר הדגירה, להעיף את הצלחת מעל כיור ולאחר מכן לשטוף צלחת עם PBS המכיל 1% Tween-20.
זיהוי
- הוסף 100 μL של מצע המחוון (3,3',5,5'-tetramethylbenzidine (TMB)) בריכוז של 1 מ"ג / מ"ל לכל באר.
- לדגור על הצלחת עם המצע במשך 5 - 10 דקות בטמפרטורת החדר.
- לאחר 10 דקות, לעצור את התגובה אנזימטית על ידי הוספת 100 μL 2N חומצה גופרתית (H2SO4).
בתוך 30 דקות של הוספת פתרון העצירה, לקרוא את הצלחת באמצעות קורא microplate ב 405 ננומטר כדי לקבוע את ספיגת בארות.
2. כריך אליסה
בגרסת ELISA זו, המדגם הניסיוני "נדחף" בין נוגדן לכידה ללא מעצורים לנוגדן זיהוי מצומד, שניהם ספציפיים לאותו חלבון אך באפיטופים שונים. בדוגמה הבאה של ELISA, ריכוז TNFα אנושי נקבע במדגם לא ידוע באמצעות עקומה סטנדרטית שנוצרה מדילול סדרתי פי 2.5 של TNFα אנושי סטנדרטי ידוע (המציין בריכוז של 75 pg/mL).
ציפוי ללכוד נוגדן למיקרו-לוחית
- יש לצפות את בארות של צלחת ELISA 96-באר עם נוגדן לכידה מטוהר על ידי הוספת 100 μL של נוגדן לכידה (1-10 מיקרוגרם / mL טווח) לכל באר של הצלחת.
- מכסים צלחת עם כיסוי צלחת דבק ודגרה אותו לילה ב 4°C.
- לאחר הדגירה, להסיר את פתרון הציפוי מהצלחת על ידי הבהוב הצלחת מעל כיור.
חסימת
- חסמו את האתרים הנותרים של כריכת חלבונים בבארות מצופות הנוגדנים על ידי הוספת פתרון חסימת 200 μL, 5% חלב יבש ללא שומן המכיל PBS, לבארות.
- דגירה של לפחות 2 שעות בטמפרטורת החדר או בלילה בטמפרטורה של 4°C.
- לאחר הדגירה, להסיר את חוצץ חסימה על ידי הבהוב הצלחת ולאחר מכן לשטוף צלחת עם PBS המכיל 1% Tween-20.
הוספת אנטיגן המכיל דגימות בדיקה
- הוסף 100 μL של מדגם הבדיקה לבארות. אוטמים את הצלחת עם כיסוי דבק.
- דגירה במשך 1-2 שעות בטמפרטורת החדר או לילה ב 4°C.
- לאחר הדגירה, להסיר את הדגימות על ידי הבהוב הצלחת מעל הכיור ולאחר מכן לשטוף את הבארות עם 200 μL 1X PBS המכיל 1% Tween-20.
הוסף נוגדן זיהוי מצומד באנזים
- הוסף 100 μL של נוגדן זיהוי מצומד אנזים לבארות בריכוז preoptimized.
- אוטמים את הצלחת בכיסוי דבק ודגר בטמפרטורת החדר למשך 2 שעות.
- הסר את נוגדן הזיהוי הלא מאוגד על ידי הבהוב הצלחת מעל כיור ולשטוף את בארות עם 200 μL 1X PBS המכיל 1% Tween-20.
זיהוי
- הוסף 100 μL של מצע המחוון בריכוז של 1 מ"ג / מ"ל. כל נוגדן זיהוי מצומד באנזים ימיר את המצע לאות שניתן לזהותו.
- לדגור על הצלחת במשך 5 - 10 דקות בטמפרטורת החדר.
- לאחר 5-10 דקות, לעצור את התגובה אנזימטית על ידי הוספת 100 μL 2N H2SO4 לבארות. בתוך 30 דקות של הוספת פתרון העצירה, לקרוא את הצלחת באמצעות קורא microplate כדי לקבוע את ספיגת בארות.
3. אליסה התחרותית
השלבים של ELISA תחרותי שונים מאלה המשמשים עקיפה ו כריך ELISA, עם ההבדל העיקרי להיות שלב מחייב תחרותי בין אנטיגן מדגם ו אנטיגן "תוספת". האנטיגן מדגם הוא דגירה עם הנוגדן העיקרי ללא תווית. מתחמי נוגדנים אנטיגן אלה מתווספים לאחר מכן לצלחת ELISA, אשר כבר מצופה מראש עם אותו אנטיגן. לאחר תקופת דגירה, כל נוגדן לא מאוגד נשטף. יש מתאם הפוך בין כמות הנוגדן החינמית הזמינה לאגד את האנטיגן בבאר לבין כמות האנטיגן במדגם המקורי. לדוגמה, מדגם עם אנטיגן בשפע יהיה יותר אנטיגן ראשוני קומפלקסים נוגדנים, משאיר נוגדן לא מאוגד קטן להיקשר לצלחת ELISA. נוגדן משני מצומד באנזים הספציפי לנוגדן העיקרי מתווסף לאחר מכן לבארות, ואחריו המצע.
ציפוי אנטיגן למיקרו-לוחית
- מצופים את בארות של צלחת ELISA 96-well עם 100 μL של אנטיגן מטוהר בריכוז של 1-10 מיקרוגרם / מ"ל.
- מכסים צלחת עם כיסוי צלחת דבק ודגרה הצלחת לילה ב 4°C.
- לאחר הדגירה, להסיר את פתרון אנטיגן מאוגד מן הבארות על ידי הבהוב הצלחת מעל כיור.
חסימת
- לחסום את האתרים הנותרים כריכת חלבון בבארות מצופות על ידי הוספת 200 μL של חוצץ חסימה לכל באר, אשר יכול להיות גם 5% חלב יבש ללא שומן או BSA ב PBS.
- לדגור על הצלחת לפחות 2 שעות בטמפרטורת החדר או לילה ב 4°C.
דגימת דגירה (אנטיגן) עם הנוגדן העיקרי
- תוך כדי חסימת הבארות, להכין את תערובת אנטיגן נוגדנים על ידי ערבוב 150 אנטיגן מדגם μL ו 150 μL של נוגדן ראשוני עבור כל באר בבחינה.
- לדגור תערובת זו במשך 1 שעה ב 37°C.
הוסיפו לבאר תערובת אנטיגן-נוגדנים
- עכשיו, להסיר את מאגר חסימה מן בארות על ידי הבהוב הצלחת מעל כיור.
- לאחר מכן, לשטוף את בארות עם 1X PBS המכיל Tween-20.
- הוסף 100 μL של תערובת נוגדנים אנטיגן-ראשוני מדגם.
- לדגור על הצלחת ב 37°C במשך 1 שעה.
- הסר את התערובת לדוגמה על ידי הבהוב הצלחת מעל כיור.
- לאחר מכן, לשטוף את בארות עם 1X PBS המכיל 1% Tween-20 כדי להסיר כל נוגדן לא מאוגד.
הוסף את הנוגדן המשני
- הוסף 100 μL של נוגדן משני מצומד אנזים, אשר במקרה זה הוא נוגדן מצומד AP, לכל באר.
- לדגור על הצלחת במשך 1 שעה ב 37°C.
- לאחר הדגירה, לשטוף את הצלחת עם 1X PBS המכיל 1% Tween-20.
זיהוי
- הוסף 100 μL של פתרון המצע לכל באר.
- המתן 5-10 דקות.
- לאחר 10 דקות, לעצור את התגובה אנזימטית על ידי הוספת 100 μL 2N חומצה גופרתית לבארות. לאחר מכן, למדוד את הספיגה בקורא מיקרו-לוח בתוך 30 דקות מהוספת פתרון העצירה
בדוגמה הבאה של ELISA עקיף, נוכחות של וירוס שפעת A (IAV) ספציפי IgG בסרום של עכברים נגועים IAV נקבע. עכברי C57Bl/6 נדבקו בנגיף שפעת A (A/PR/8; 105 PFU ב-100 μL PBS i.p. ) והנסיוב נאסף 28 ימים לאחר מכן. כדי כמות IgG ספציפית IAV בסרום, 96-טוב צלחות ELISA היו מצופים עם A מטוהר A / PR / 8 שפעת וירוס (50 μL / טוב של 2 מ"ג / מיליליטר וירוס PBS) לילה ב 4 ° C. לוחות מצופים נחסמו למשך שעה בטמפרטורת החדר עם סרום חמורים רגיל של 5% ב- PBS, ואחריו דגירה עם דגימות סרום מדוללות מעכברים מאותגרים על ידי IAV במהלך הלילה בטמפרטורה של 4 מעלות צלזיוס. הנסיוב היה מדולל בתחילה 1:12.5, ואחריו 1:4 דילול (טווח דילול - 1:12.5 עד 1:204,800). לאחר הכביסה, הצלחות היו דגירה עם פוספטאז אלקליין (AP) - חמור מצומד נגד עכבר IgG במשך 1 שעה. הצלחות נשטפו, ואז נוספה p-Nitrophenyl פוספט (PNPP; 1 מ"ג/מ"ל, 100 μL/well). פתרון PNPP חסר הצבע הופך לצבע צהוב כאשר AP קיים. לאחר 5- 10 דקות, התגובה אנזימטית נעצרה על ידי הוספת 100 μL / well 2N H2SO4. הלוחית נקראה על קורא מיקרו-לוח ב-405 ננומטר. התוצאות המתקבלות מוצגות בטבלה 1 ובאיור 1.
| לדוגמה | וולס | מנת יתר405 | התכוון |
| סרום 1:12.5 | A1 | 2.163 | 2.194 |
| B1 | 2.214 | ||
| C1 | 2.204 | ||
| סרום 1:50 | A1 | 1.712 | 1.894 |
| B1 | 2.345 | ||
| C1 | 1.624 | ||
| סרום 1:200 | A1 | 1.437 | 1.541 |
| B1 | 1.73 | ||
| C1 | 1.456 | ||
| סרום 1:800 | A1 | 1.036 | 0.957 |
| B1 | 0.912 | ||
| C1 | 0.923 | ||
| סרום 1:3200 | A1 | 0.579 | 0.48 |
| B1 | 0.431 | ||
| C1 | 0.429 | ||
| סרום 1:12800 | A1 | 0.296 | 0.281 |
| B1 | 0.312 | ||
| C1 | 0.236 | ||
| סרום 1:51200 | A1 | 0.308 | 0.283 |
| B1 | 0.299 | ||
| C1 | 0.243 | ||
| סרום 1:204800 | A1 | 0.315 | 0.303 |
| B1 | 0.298 | ||
| C1 | 0.297 |
טבלה 1: נתוני אימות עקיפים של אליסה. דילול סרום (מ- 1:12.5 עד 1:204,800), של עכברים נגועים בשפעת A (IAV) המכילים IgG ספציפי ל- IAV, ערכי צפיפות אופטית (OD) (405 ננומטר) וערכי OD405 ממוצעים.
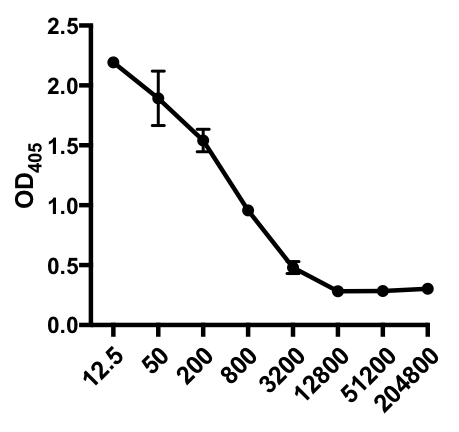
איור 1: עלילת פיזור עקיפה של ערכי OD405 ממוצעים(+ S. D. ) ודילול סרום (מ- 1:12.5 עד 1:204,800), של נגיף שפעת A (IAV) ספציפי IgG בסרום של עכברים נגועים ב- IAV. ערכי OD405 יכולים להיות מתואמים באופן הפוך לדילול הסרום.
בדוגמה הבאה של כריך ELISA, דילול 1:2.5 של תקני TNFα אנושיים רקומביננטיים (החל בריכוז של 75 pg/mL) נוספה לבארות המצוינות של צלחת שטוחה-תחתונה 96 היטב. תקנים אלה הובילו לשינוי מקביל של פי 2.5 בקריאות הספיגה.
| לדוגמה | ריכוז (pg/mL) | וולס | ערכים | ערך ממוצע | חישוב ריכוז גב | ממוצע |
| תקן 1 | 75 | A1 | 1.187 | 1.169 | 76.376 | 75.01 |
| A2 | 1.152 | 73.644 | ||||
| רגיל 2 | 30 | B1 | 0.534 | 0.52 | 30.827 | 29.962 |
| B2 | 0.506 | 29.098 | ||||
| תקן 3 | 12 | C1 | 0.23 | 0.217 | 12.838 | 12.105 |
| C2 | 0.204 | 11.372 | ||||
| תקן 4 | 4.8 | D1 | 0.09 | 0.084 | 5.055 | 4.726 |
| D2 | 0.078 | 4.398 | ||||
| תקן 5 | 1.92 | E1 | 0.033 | 0.031 | 1.941 | 1.86 |
| E2 | 0.03 | 1.778 | ||||
| תקן 6 | 0.768 | F1 | 0.009 | 0.011 | 0.626 | 0.764 |
| F2 | 0.014 | 0.901 | ||||
| תקן 7 | 0.307 | G1 | 0.002 | 0.004 | 0.238 | 0.377 |
| G2 | 0.007 | 0.516 |
טבלה 2: נתוני העקומה הסטנדרטיים של כריך TNFα ELISA. דילול של 1:2.5 של תקני TNFα אנושיים רקומביננטיים (75 עד 0.3 pg/mL), ערכי OD (450 ננומטר), ערכי OD450, חישובי ריכוז אחוריים והממוצעים שלהם.
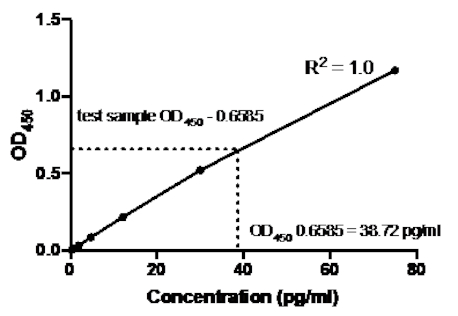
איור 2: עקומה סטנדרטית עבור כריך TNFα ELISA. דילול 1:2.5 של תקני TNFα אנושיים רקומביננטיים (75 עד 0.3 pg/mL) נותח באמצעות כריך ELISA. ניתן לתאם ישירות את ערכי OD450 לריכוז הדילול הסטנדרטי. כמות חלבון TNFα במדגם הבדיקה נקבעה באמצעות העקומה הסטנדרטית, המתאימה לריכוז של 38.72 pg/mL.
לאחר יצירת העקומה הסטנדרטית, נקבעה כמות חלבון TNFα במדגם הבדיקה. בדוגמה זו של ELISA, דגימות הבדיקה נתנו OD450 קריאות של 0.636 ו 0.681, אשר נותנים בממוצע של 0.6585. בעת התוויית קריאת OD450 זו בתרשים לעיל, זה מתאים לריכוז TNFα של 38.72 pg/ml.
כפי שהוכח, מגוון של חיסונים (עם שונות קלה בפרוטוקולים) נופלים בתוך משפחת טכניקת ELISA. קביעת הגרסה של ELISA להשתמש תלויה במספר גורמים, כולל מה אנטיגן מזוהה, נוגדן חד שבטי זמין עבור אנטיגן מסוים, ואת הרגישות הרצויה של בדיקת (5). כמה נקודות חוזק וחולשה של ELISAs השונים המתוארים להלן הם:
| אליסה | החוזק | חולשות |
| עקיפה | 1) רגישות גבוהה בשל העובדה כי נוגדנים משניים מצומדים אנזים מרובים יכולים להיקשר לנוגדן העיקרי | 1) אות רקע גבוה עלול להתרחש מכיוון שציפוי האנטיגן שמעניין את הצלחת אינו ספציפי (כלומר, כל החלבונים במדגם יספו את הצלחת) |
| 2) נוגדנים ראשוניים רבים ושונים ניתן לזהות על ידי נוגדן משני מצומד אנזים יחיד נותן למשתמש את הגמישות של שימוש באותו נוגדן משני מצומד אנזים ב ELISA רבים ושונים (ללא קשר אנטיגן שזוהה) | ||
| 3) הבחירה הטובה ביותר כאשר רק נוגדן אחד עבור אנטיגן של עניין זמין | ||
| כריך | 1) השימוש בנוגדן חד שבטי ייחודי לאנטיגן מגביר את הרגישות והסיחודיות של ה- ASSAY (בהשוואה ל- ELISA העקיף) | 1) אופטימיזציה של ריכוזי הנוגדנים המונוקלונליים ללכידה וזיהוי יכולה להיות קשה (במיוחד עבור ערכות לא מסחריות) |
| 2) הבחירה הטובה ביותר לאיתור חלבון גדול עם אפיטופים מרובים (כגון ציטוקינים) | ||
| תחרותי | 1) ניתן להשתמש בדגימות לא בטוחות | 1) דורש כמות גדולה של אנטיגן טהור מאוד לשמש לציפוי צלחת |
| 2) פחות רגישות לאפקטי דילול ריאגנט | ||
| 3) אידיאלי לאיתור מולקולות קטנות (כגון hapten) |
טבלה 3: סיכום. סיכום של נקודות החוזק והחולשה של טכניקות ELISA השונות.
בעוד טכניקה פשוטה ושימושית, יש גם כמה חסרונות לכל ELISA. האחת היא חוסר הוודאות לגבי כמות החלבון העניין בדגימות הבדיקה. אם הסכום גבוה מדי או נמוך מדי, ערכי הספיגה המתקבלים על ידי קורא המיקרו-לוח עשויים ליפול מעל או מתחת לגבולות העקומה הסטנדרטית, בהתאמה. זה יקשה על קביעת כמות החלבון הקיימת בדגימות הבדיקה. אם הערכים גבוהים מדי, ניתן לדלל את דגימת הבדיקה לפני הוספת בארות הצלחת. לאחר מכן יהיה צורך להתאים את הערכים הסופיים בהתאם לגורם הדילול. כאמור, ערכות תוצרת בית דורשות לעתים קרובות אופטימיזציה זהירה של ריכוזי הנוגדנים המשמשים להניב יחס אות לרעש גבוה.
- Porstmann, T. and Kiessig S.T. Enzyme immunoassay techniques. An overview. Journal of Immunological Methods. 150 (1-2), 5-21 (1992).
- Suleyman Aydin. A short history, principles, and types of ELISA, and our laboratory experience with peptide/protein analyses using ELISA. Peptides, 72, 4-15 (2015).
- Gan. S. D. and Patel K. R. Enzyme Immunoassay and Enzyme-Linked Immunosorbent Assay. Journal of Investigative Dermatology, 133 (9), 1-3 (2013).
- Kohl, T. O. and Ascoli C.A. Immunometric Antibody Sandwich Enzyme-Linked Immunosorbent Assay. Cold Spring Harbor Protocols, 1 (6), (2017).
- Sakamoto, S., Putalun, W., Vimolmangkang, S., Phoolcharoen, W., Shoyama, Y., Tanaka, H., and Morimoto S. Enzyme-linked immunosorbent assay for the quantitative/qualitative analysis of plant secondary metabolites. Journal of natural medicines, 72 (1), 32-42 (2018).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved