Abstract
Protocol
Representative Results
Discussion
References
Immunology
ELISAアッセイ:間接、サンドイッチ、競争力
Published: April 30th, 2023
ソース: ホイットニー・スワンソン1,2, フランシス V. シャアスタッド2,3,トーマス・S・グリフィス1,2,3,4
ミネソタ大学泌尿器科1ミネアポリス、MN 55455
2ミネソタ大学免疫学センター,ミネアポリス,MN 55455
3ミネソタ大学、ミネアポリス、MN 55455
4ミネソタ大学、ミネアポリス、MN 55455
酵素結合免疫吸着アッセイ(ELISA)は、生体試料中の抗原、抗体、ペプチド、タンパク質、ホルモン、または他の生体分子の存在および/または濃度を測定するために頻繁に使用される。それは非常に敏感であり、低い抗原濃度を検出することができる。ELISAの感度は、単一の抗原抗体複合体(1)間の相互作用を検出する能力に起因する。さらに、酵素共役抗原特異的抗体を含めることで、無色基板を、プレートリーダーで検出して容易に定量できる発色または蛍光産物に変換することができます。目的の既知の抗原のツトレート量によって生成された値と比較すると、実験試料中の同じ抗原の濃度を決定することができる。異なるELISAプロトコルは、様々な実験サンプルで抗原濃度を測定するように適応されていますが、それらはすべて同じ基本的な概念を持っています(2)。実行するELISAの種類、間接的、サンドイッチ、または競争力のあるものを選択することは、試験対象のサンプルの複雑さや使用可能な抗原特異的抗体など、多くの要因に依存します。間接ELISAは、サンプル中の抗体の濃度を測定するなど、免疫学的応答の結果を決定するために頻繁に使用されます。サンドイッチELISAは、組織培養上清や組織リザーゼなどの複雑なサンプルの分析に最適です。最後に、競合するELISAは、目的の抗原を検出するために利用可能な抗体が1つしかない場合に最も頻繁に使用されます。競争力のあるELISAは、立体的なヒンサーのために2つの異なる抗体を収容できない単一の抗体エピトープのみを持つ小さな抗原を検出するのにも役立ちます。このプロトコルは、間接的、サンドイッチ、および競合するELISAアッセイの基本的な手順を説明します。
間接ELISAアッセイは、一般的に血清中またはハイブリドーマ培養の上清中の抗体の量を測定するために使用されます。間接 ELISA アッセイの一般的な手順は次のとおりです。
- 抗原で井戸を塗る
- 血清またはハイブリドーマ培養用上清を含有する抗体(原発性または1°抗体)を添加する
- インキュベートと洗浄
- 二次(または2°)酵素共役抗体を追加する
- インキュベートと洗浄
- 基板の追加
サンドイッチELISAアッセイは、この方法が精製抗原でプレートをコーティングすることを伴わないという点で間接的なELISAアッセイとは異なる。代わりに、「捕捉」抗体は、プレートの井戸をコーティングするために使用されます。抗原は、捕捉抗体と第2の「検出」酵素共役抗体との間に「挟まれた」ものであり、両方の抗体は同じ抗原に特異的であるが、異なるエピトープ(3)で行われる。捕捉抗体/抗原複合体に結合することにより、検出抗体はプレート内に残る。モノクローナル抗体またはポリクローナル抗セラのいずれかを捕捉および検出抗体として使用することができる。サンドイッチELISAの主な利点は、サンプルが分析前に精製される必要がない場合です。また、アッセイは非常に敏感になりうる(4)。多くの市販のELISAキットは、サンドイッチの品種であり、テストされた、一致した抗体のペアを使用しています。サンドイッチELISAアッセイの一般的な手順は次のとおりです。
- 捕獲抗体が付いているコート井戸
- 抗原を含む試験サンプルを追加する
- インキュベートと洗浄
- 酵素共役検出抗体を追加します。
- インキュベートと洗浄
- 基板の追加
ほとんどの市販のサンドイッチELISAキットには、酵素共役検出抗体が付属しています。酵素共役検出抗体が利用できない場合には、検出抗体に特異的な二次酵素共役抗体を使用することができます。二次抗体上の酵素は、無色基板を発色性または蛍光産物に変換するのと同じ役割を果たす。上記の二次酵素共役抗体は、例えば、独自のモノクローナル抗体を生成した研究者によって開発された「自家製」サンドイッチELISAに使用されることをより望むでしょう。二次酵素共役抗体を使用する場合の欠点の1つは、プレートに結合した捕捉抗体ではなく、検出抗体に結合することを確認することです。これは、抗原または検出抗体の有無にかかわらず、すべてのウェルで測定可能な製品をもたらすでしょう。
最後に、競合するELISAアッセイは可溶性抗原を検出するために使用される。実行するのは簡単ですが、精製抗原が比較的多量に利用可能な場合にのみ適しています。競争力のあるELISAアッセイの一般的な手順は次のとおりです。
- 抗原で井戸を塗る
- インキュベートと洗浄
- 酵素共役一次抗体を使用したプインキュベート試験試料
- よく混合物を追加
- 結合性のない酵素結合一次抗体をインキュベートして洗い流す
- 基板の追加
このアッセイにおける「競合」は、ステップ3で使用される試験試料中の抗原が多いほど、ウェルをコーティングする抗原に結合するために利用できる抗体が少なくなるという事実から来ている。したがって、アッセイの末端にあるウェル内の発色性/フルオロゲン生成物の強度は、試験試料中に存在する抗原の量に反比例する。
ELISAの任意のタイプの重要なコンポーネントは、ユーザーが試験サンプルに存在する抗原濃度を決定することを可能にする既知の濃度の一値化された基準です。通常、一連のウェルは標準曲線を作成するために指定され、そこでは精製された組換えタンパク質の既知の量が減少量でウェルに添加されます。これらのウェルが試験試料と同時に処理されると、ユーザーは、マイクロプレートリーダーから得られた吸光度値の基準セットを持ち、既知のタンパク質濃度が試験試料の吸光度値と一緒に行くことができる。ユーザーは、存在するタンパク質の量を決定するために試験サンプルを比較できる標準曲線を計算することができます。標準曲線は、ユーザーの希釈作成の精度の程度を決定することもできます。
最後に、上記の各 ELISA タイプの最後のステップでは、基板の追加が必要です。基板から製品への変換の程度は、ウェル内に存在する酵素の量に直接関係する。ホースラディッシュペルオキシダーゼ(HRP)およびアルカリホスファターゼ(AP)は、抗体に結合して見つかった最も一般的な酵素である。予想通り、発色性または蛍光産物を産生する酵素に特異的に利用可能な基板が多数存在する。さらに、基板はアッセイの全体的な感受性を高めることができる感度の範囲で利用できる。ユーザはまた、使用する基板の種類を選択する際に実験の最後にプレートを読み取るために利用可能な器械使用の種類と、対応する酵素共役抗体を考慮する必要があります。
HRPで一般的に使用される発色基質には、2,2'-アジノビス[3-エチルベンゾアゾリン-6-スルホン酸]-ジアモニウム塩(ABTS)および3,3',5'-テトラメチルベンジジン(TMB)が含まれますが、P-ニトロフェニルホスフェース(PN)はApBTに使用されます。水溶性の緑と青色の反応製品をそれぞれ製造します。緑色のABTSプロダクトに2つの主要な吸光度のピークがある、青いTMBプロダクトは370および652 nmで最もよく検出される間、410および650 nm。ABTSとTMBの色は、450 nmで読み取るのに最適な酸性停止溶液を添加すると黄色に変化します。ABTS の色の開発は遅いですが、TMB では高速です。TMBはABTSよりも敏感であり、酵素反応が長すぎると、より高いバックグラウンド信号が生成されることがあります。PNPPは、405 nmで光を吸収するAP変換後に黄色の水溶性製品を生成します。
1. 間接エリサ
間接ELISAは、一次抗原特異的抗体が二次共役抗体によって認識されるものです。以下のプロトコルは、インフルエンザAウイルス(IAV)感染マウスの血清サンプルがIAV特異的IgG抗体の存在について試験される間接ELISA法の一例である。この実施例の1つの強みは、すべての抗体アイソタイプまたは特異的アイソタイプ(例えば、IgG)を認識する異なる二次抗体を使用することができることです。
マイクロプレートへのコーティング抗原
- 精製抗原の50μL(精製A/PR/8インフルエンザA型ウイルスの2mg/mL)を0.05Mトリス-HClバッファー(pH 9.5))でプレートの各ウェルに配管することにより、精製抗原を精製した96ウェルELISAプレートのウェルをコーティングします。
- 粘着カバーでプレートを覆い、4°Cで一晩インキュベートし、抗原がプレートに結合できるようにします。
- インキュベーション完了時に、プレートをシンクの上にフリックしてコーティング溶液を取り除きます。
ブロック
- 200 μLブロッキングバッファーを添加して被覆ウェル内の残りのタンパク質結合部位を遮断し、1X PBSで5%のロバ血清がここで使用され、ウェル当たりである。代替ブロッキング試薬は、二次抗体が生成された動物からのPBSまたは正常血清中の5%非脂肪ドライミルクまたはBSAを含む。
- 室温で少なくとも2時間、または4°Cで一晩インキュベートします。
- インキュベーションに続いて、プレートをフリックしてブロッキングバッファを取り出し、1%Tween-20を含むPBSでプレートを洗浄する。
一次抗体を用いたインキュベーション
- 一次抗体を含む血清試料の連続希釈を調べ、1X PBSを用いて1~204,800の希釈範囲を得た。これを行うには、まず血清1:12.5を希釈し、次に4X希釈(希釈範囲 - 1:12.5〜1:204,800)を実行します。
- 連続希釈血清サンプルの100 μLをウェルに追加します。
- 接着剤カバー付きカバープレート、室温で1-2時間インキュベート。
- インキュベーションに続いて、シンクの上にプレートをフリックし、1%のTween-20を含むPBSでプレートを洗浄します。
二次抗体を用いたインキュベーション
- 酵素共役二次抗体の100μLを加え、ホースラディッシュペルオキシダーゼ、HRP結合ロバ抗マウス二次二次を各ウェルに添加する。
- プレートを室温で1時間インキュベートします。
- インキュベーションに続いて、シンクの上にプレートをフリックし、1%のTween-20を含むPBSでプレートを洗浄します。
検出
- 各ウェルに1mg/mLの濃度で指標基板(3,3',5,5'-テトラメチルベンジジン(TMB))の100 μLを追加します。
- 室温で5〜10分間基板でプレートをインキュベートします。
- 10分後、100 μL 2N硫酸(H2SO4)を加えて酵素反応を停止する。
停止溶液を添加してから30分以内に、405nmのマイクロプレートリーダーを使用してプレートを読み取り、ウェルの吸光度を決定します。
2. サンドイッチエリサ
このELISAバージョンでは、実験サンプルは、非共役捕捉抗体と共役検出抗体の間に「挟まれる」もので、どちらも同じタンパク質に特異的であるが、異なるエピトープで行われる。以下のサンドイッチELISAの例では、ヒトTNFαの濃度は、既知の標準の2.5倍のシリアル希釈から生成された標準曲線を用いて未知の試料中で決定した、組換えヒトTNFα(75pg/mLの濃度で記載)。
マイクロプレートへのコーティングキャプチャ抗体
- 96ウェルELISAプレートのウェルを精製捕捉抗体でコーティングし、100 μLの捕捉抗体(1-10 μg/mL範囲)をプレートの各ウェルに加えます。
- 粘着板カバーでプレートをカバーし、4°Cで一晩インキュベートします。
- インキュベーション後、プレートをシンクの上にフリックして、プレートからコーティング溶液を取り出します。
ブロック
- 200 μL遮断溶液、PBSを含む5%の非脂肪ドライミルクをウェルに添加することにより、抗体被覆ウェル内の残りのタンパク質結合部位をブロックする。
- 室温で少なくとも2時間、または4°Cで一晩インキュベートします。
- インキュベーションに続いて、プレートをフリックしてブロッキングバッファを取り出し、1%Tween-20を含むPBSでプレートを洗浄する。
試験サンプルを含む抗原を追加する
- 試験サンプルの100 μLをウェルに追加します。粘着カバーでプレートを密封します。
- 室温で1~2時間、または4°Cで一晩インキュベートします。
- インキュベーション後、シンクの上にプレートをフリックしてサンプルを取り出し、1%のTween-20を含む200 μL 1X PBSでウェルを洗浄します。
酵素共役検出抗体を追加
- あらかじめ最適化された濃度でウェルに100 μLの酵素共役検出抗体を追加します。
- 粘着カバーでプレートを密封し、室温で2時間インキュベートします。
- プレートをシンクの上にフリックして非結合検出抗体を取り外し、1% Tween-20を含む200 μL 1X PBSでウェルを洗浄します。
検出
- 1 mg/mL の濃度でインジケーター基板の 100 μL を追加します。結合酵素共役検出抗体は、基板を検出可能なシグナルに変換します。
- 室温で5〜10分間プレートをインキュベートします。
- 5-10分後、ウェルに100 μL 2N 2N H2SO4を加えて酵素反応を停止します。停止溶液を添加してから30分以内に、マイクロプレートリーダーを使用してプレートを読み取り、ウェルの吸光度を決定します。
3. 競争力のあるエリサ
競争力のあるELISAのステップは、間接的およびサンドイッチELISAで使用されるものとは異なり、主な違いは、サンプル抗原と「アドイン」抗原との間の競合結合ステップです。試料抗原は、標識されていない一次抗体でインキュベートされる。これらの抗体抗原複合体は、次いで、同じ抗原で事前にコーティングされたELISAプレートに添加されます。インキュベーション期間の後、任意の結合されていない抗体が洗い流されます。ウェル内の抗原に結合するために利用可能な自由抗体の量と元のサンプル中の抗原の量との間には逆相関があります。例えば、豊富な抗原を有するサンプルは、より多くの抗原一次抗体複合体を有し、ELISAプレートに結合する非結合抗体をほとんど残さずにする。一次抗体に特異的な酵素共役二次抗体をウェルに添加し、その後基板を続ける。
マイクロプレートへのコーティング抗原
- 96ウェルELISAプレートのウェルを1-10 μg/mLの濃度で精製抗原の100 μLでコーティングします。
- 粘着板カバーでプレートをカバーし、4°Cで一晩プレートをインキュベートします。
- インキュベーションの後、プレートをシンクの上にフリックして、ウェルから結合されていない抗原溶液を取り除きます。
ブロック
- 各ウェルに200 μLのブロッキングバッファーを追加して被覆ウェル内の残りのタンパク質結合部位をブロックします。
- プレートを室温で少なくとも2時間、または4°Cで一晩インキュベートします。
一次抗体を用いたインキュベーションサンプル(抗原)
- ウェルを遮断しながら、アッセイ中の各ウェルに対して150μLサンプル抗原及び150μLの一次抗体を混合して抗原抗体混合物を調製する。
- この混合物を37°Cで1時間インキュベートします。
抗原抗体混合物をウェルに添加する
- 次に、プレートをシンクの上にフリックして、ウェルからブロッキング バッファを取り外します。
- 次に、Tween-20を含む1X PBSで井戸を洗浄します。
- 試料抗原一次抗体混合物の100μLを添加する。
- プレートを37°Cで1時間インキュベートします。
- プレートをシンクの上にフリックして、サンプル混合物を取り除きます。
- 次に、1%のTween-20を含む1X PBSでウェルを洗浄し、任意の非結合抗体を除去する。
二次抗体を追加する
- この場合、AP結合抗体である酵素共役二次抗体の100 μLを各ウェルに添加する。
- プレートを37°Cで1時間インキュベートします。
- インキュベーションに続いて、1%のTween-20を含む1X PBSでプレートを洗浄します。
検出
- 基板溶液の100 μLを各ウェルに追加します。
- 5~10分待ちます。
- 10分後、井戸に100μL 2N硫酸を加えて酵素反応を停止します。次いで、停止液を添加してから30分以内にマイクロプレートリーダー内の吸光度を測定する
間接的なELISAの次の例では、IAV感染マウスの血清中のインフルエンザA型ウイルス(IAV)特異的IgGの存在が決定された。C57Bl/6マウスをインフルエンザA型ウイルス(A/PR/8;100μL PBS i.p.で105 PFU)に感染させ、28日後に血清を採取した。血清中のIAV特異的IgGの量を定量するために、96ウェルELISAプレートを精製A/PR/8インフルエンザA型ウイルス(50μL/ウェル2mg/ml PBSウイルス)で一晩4°Cでコーティングした。コーティングされたプレートを室温で1時間ブロックし、PBSで5%正常なロバ血清を用いて、続いてIAVチャレンジマウスからの希釈血清サンプルを4°Cで一晩インキュベーションした。血清は最初に1:12.5を希釈し、続いて1:4希釈(希釈範囲- 1:12.5〜1:204,800)を続けた。洗浄後、プレートをアルカリホスファターゼ(AP)結合ロバ抗マウスIgGで1時間インキュベートした。プレートを洗浄し、次にp-ニトロフェニルホスフェート(PNPP;1mg/mL、100 μL/ウェル)を添加した。無色の PNPP ソリューションは、AP が存在すると黄色に変わります。5-10分後、酵素反応は100 μL/ウェル2NH2SO4を加えることによって停止した。プレートは405nmのマイクロプレートリーダー上で読み取られた。得られた結果を表1および図1に示す。
| サンプル | 井戸 | OD405 | 意味 |
| 血清1:12.5 | A1 | 2.163 | 2.194 |
| B1 | 2.214 | ||
| C1 | 2.204 | ||
| 血清 1:50 | A1 | 1.712 | 1.894 |
| B1 | 2.345 | ||
| C1 | 1.624 | ||
| 血清1:200 | A1 | 1.437 | 1.541 |
| B1 | 1.73 | ||
| C1 | 1.456 | ||
| 血清1:800 | A1 | 1.036 | 0.957 |
| B1 | 0.912 | ||
| C1 | 0.923 | ||
| 血清 1:3200 | A1 | 0.579 | 0.48 |
| B1 | 0.431 | ||
| C1 | 0.429 | ||
| 血清1:12800 | A1 | 0.296 | 0.281 |
| B1 | 0.312 | ||
| C1 | 0.236 | ||
| 血清1:51200 | A1 | 0.308 | 0.283 |
| B1 | 0.299 | ||
| C1 | 0.243 | ||
| 血清1:204800 | A1 | 0.315 | 0.303 |
| B1 | 0.298 | ||
| C1 | 0.297 |
表 1: 間接 ELISA アッセイ データ。血清希釈(1:12.5から1:204,800)、IAV特異的IgGを含むインフルエンザA型ウイルス(IAV)感染マウスの、光学密度(OD)(405nm)値および平均OD405値。
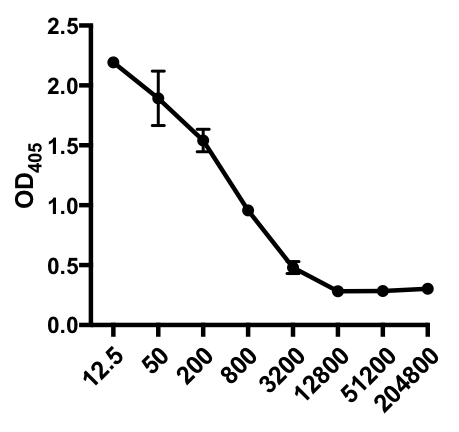
図1:IAV感染マウスの血清中のインフルエンザA型ウイルス(IAV)特異的IgGの平均OD405値(+S.D.)および血清希釈(1:12.5~1:204,800)の間接ELISAアッセイ散乱プロット。OD405値は、血清希釈と逆相関させることができる。
サンドイッチELISAの次の例では、組換えヒトTNFα基準の1:2.5希釈(75 pg/mLの濃度から始まる)を96ウェル平底板の示された井戸に加えた。これらの標準は、吸光度測定値の対応する2.5倍の変化につながった。
| サンプル | 濃度(pg/mL) | 井戸 | 値 | 平均値 | 戻濃度計算 | 平均 |
| 標準 1 | 75 | A1 | 1.187 | 1.169 | 76.376 | 75.01 |
| A2 | 1.152 | 73.644 | ||||
| 標準 2 | 30 | B1 | 0.534 | 0.52 | 30.827 | 29.962 |
| B2 | 0.506 | 29.098 | ||||
| スタンダード3 | 12 | C1 | 0.23 | 0.217 | 12.838 | 12.105 |
| C2 | 0.204 | 11.372 | ||||
| スタンダード 4 | 4.8 | D1 | 0.09 | 0.084 | 5.055 | 4.726 |
| D2 | 0.078 | 4.398 | ||||
| 標準 5 | 1.92 | E1 | 0.033 | 0.031 | 1.941 | 1.86 |
| E2 | 0.03 | 1.778 | ||||
| スタンダード 6 | 0.768 | F1 | 0.009 | 0.011 | 0.626 | 0.764 |
| F2 | 0.014 | 0.901 | ||||
| スタンダード 7 | 0.307 | G1 | 0.002 | 0.004 | 0.238 | 0.377 |
| G2 | 0.007 | 0.516 |
表2:TNFαサンドイッチELISA標準曲線データ。組換えヒトTNFα規格(75~0.3 pg/mL)、OD(450nm)値、平均OD450値、背部濃度計算およびその平均の1:2.5希釈。
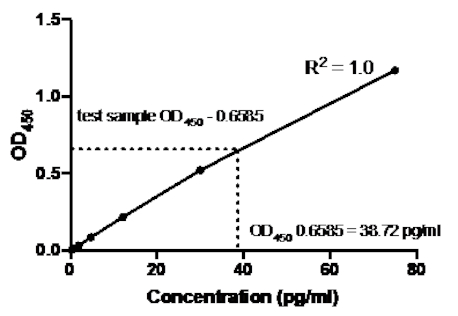
図2:TNFαサンドイッチELISAの標準曲線。組換えヒトTNFα基準(75~0.3pg/mL)の1:2.5希釈をサンドイッチELISAを用いて分析した。OD450値は、標準希釈濃度に直接相関させることができます。試験試料中のTNFαタンパク質の量は、38.72 pg/mLの濃度に相当する標準曲線を用いて決定した。
標準曲線が生成されると、試験試料中のTNFαタンパク質の量が決定された。このサンドイッチELISAの例では、試験サンプルは0.636と0.681のOD450の読み取り値を与え、平均0.6585を与えました。上記のチャートでこのOD450の読み取りをプロットする場合、これは38.72 pg/mlのTNFα濃度に相当します。
実証されているように、一連の免疫アッセイ(プロトコルのわずかな変動を伴う)は、ELISA技術ファミリー内に収まる。どのバージョンのELISAを使用するかは、検出されている抗原、特定の抗原に対して利用可能なモノクローナル抗体、およびアッセイの所望の感度(5)を含む多くの要因に依存する。ここに記載されている異なるELISAのいくつかの長所と短所は次のとおりです。
| Elisa | 強み | 弱点 |
| 間接 | 1)複数の酵素共役二次抗体が一次抗体に結合できるという事実による高い感受性 | 1)プレートに対する目的の抗原のコーティングが特異的ではないために高いバックグラウンド信号が発生する可能性があります(すなわち、試料中のすべてのタンパク質がプレートをコーティングします) |
| 2)多くの異なる一次抗体は、単一の酵素共役二次抗体によって認識され、多くの異なるELISAで同じ酵素共役二次抗体を使用する柔軟性をユーザーに与えることができます(検出された抗原にかかわらず) | ||
| 3)目的の抗原に対して1つの抗体のみが利用可能な場合の最良の選択 | ||
| サンドイッチ | 1)抗原特異的捕捉および検出モノクローナル抗体の使用は、アッセイの感度および特異性を増加させる(間接ELISAと比較して) | 1)モノクローナル抗体の捕捉および検出の濃度の最適化は困難な場合があります(特に非商用キットの場合) |
| 2)複数のエピトープ(サイトカインなど)を持つ大きなタンパク質を検出するための最良の選択 | ||
| 競争 | 1)不純なサンプルを使用することができます | 1)プレートをコーティングするために使用される非常に純粋な抗原を大量に必要とします |
| 2) 試薬希釈効果に対する感度が低い | ||
| 3)小分子(ハプテンなど)の検出に最適 |
表 3: 概要。異なるELISA技術の長所と短所の概要。
シンプルで便利なテクニックですが、ELISAにはいくつかの欠点もあります。1つは、試験サンプル中の目的のタンパク質の量の不確実性です。量が高すぎるか低すぎる場合、マイクロプレートリーダーによって得られる吸光度値は、それぞれ標準曲線の限界を上回るか下回る可能性があります。これにより、試験サンプルに存在するタンパク質の量を正確に決定することが困難になります。値が高すぎる場合は、プレートの井戸に追加する前にテストサンプルを希釈できます。最終的な値は、希釈係数に応じて調整する必要があります。前述したように、自家製キットは、多くの場合、高い信号対雑音比を生み出すために使用される抗体濃度の慎重な最適化を必要とします。
- Porstmann, T. and Kiessig S.T. Enzyme immunoassay techniques. An overview. Journal of Immunological Methods. 150 (1-2), 5-21 (1992).
- Suleyman Aydin. A short history, principles, and types of ELISA, and our laboratory experience with peptide/protein analyses using ELISA. Peptides, 72, 4-15 (2015).
- Gan. S. D. and Patel K. R. Enzyme Immunoassay and Enzyme-Linked Immunosorbent Assay. Journal of Investigative Dermatology, 133 (9), 1-3 (2013).
- Kohl, T. O. and Ascoli C.A. Immunometric Antibody Sandwich Enzyme-Linked Immunosorbent Assay. Cold Spring Harbor Protocols, 1 (6), (2017).
- Sakamoto, S., Putalun, W., Vimolmangkang, S., Phoolcharoen, W., Shoyama, Y., Tanaka, H., and Morimoto S. Enzyme-linked immunosorbent assay for the quantitative/qualitative analysis of plant secondary metabolites. Journal of natural medicines, 72 (1), 32-42 (2018).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved