Method Article
Визуализация и генетических манипуляций дендритов и шипы в мышь коры головного мозга и гиппокамп использования
В этой статье
Резюме
Эта статья подробно описывает протокол electroporate внутриутробно коры головного мозга и гиппокампа в E14.5 у мышей. Мы также показываем, что это ценный метод изучения дендритов и игл в этих двух мозговой регионах.
Аннотация
In utero electroporation (IUE) has become a powerful technique to study the development of different regions of the embryonic nervous system 1-5. To date this tool has been widely used to study the regulation of cellular proliferation, differentiation and neuronal migration especially in the developing cerebral cortex 6-8. Here we detail our protocol to electroporate in utero the cerebral cortex and the hippocampus and provide evidence that this approach can be used to study dendrites and spines in these two cerebral regions.
Visualization and manipulation of neurons in primary cultures have contributed to a better understanding of the processes involved in dendrite, spine and synapse development. However neurons growing in vitro are not exposed to all the physiological cues that can affect dendrite and/or spine formation and maintenance during normal development. Our knowledge of dendrite and spine structures in vivo in wild-type or mutant mice comes mostly from observations using the Golgi-Cox method 9. However, Golgi staining is considered to be unpredictable. Indeed, groups of nerve cells and fiber tracts are labeled randomly, with particular areas often appearing completely stained while adjacent areas are devoid of staining. Recent studies have shown that IUE of fluorescent constructs represents an attractive alternative method to study dendrites, spines as well as synapses in mutant / wild-type mice 10-11 (Figure 1A). Moreover in comparison to the generation of mouse knockouts, IUE represents a rapid approach to perform gain and loss of function studies in specific population of cells during a specific time window. In addition, IUE has been successfully used with inducible gene expression or inducible RNAi approaches to refine the temporal control over the expression of a gene or shRNA 12. These advantages of IUE have thus opened new dimensions to study the effect of gene expression/suppression on dendrites and spines not only in specific cerebral structures (Figure 1B) but also at a specific time point of development (Figure 1C).
Finally, IUE provides a useful tool to identify functional interactions between genes involved in dendrite, spine and/or synapse development. Indeed, in contrast to other gene transfer methods such as virus, it is straightforward to combine multiple RNAi or transgenes in the same population of cells.
In summary, IUE is a powerful method that has already contributed to the characterization of molecular mechanisms underlying brain function and disease and it should also be useful in the study of dendrites and spines.
протокол
В Соединенном Королевстве, мыши расположены, воспитанные и лечение в соответствии с руководящими принципами, утвержденными Министерством внутренних дел в соответствии с животными (Научно процедуры) Закона 1986 года.
1. Приготовление: Решение ДНК и иглы
- Очищение ДНК плазмиды с эндотоксина бесплатно Макси-подготовительную комплект. Подготовить решение ДНК плазмиды для инъекций до желаемой концентрации в воде и добавить Быстрый зеленый (конечной концентрации 0,05%) к себе инъекции. Эффективность электропорации очень сильно зависит от концентрации ДНК. Концентрации 1 мкг / мкл, как правило, используется. Эта концентрация является достаточной для визуализации электропорации нейронов без ущерба для их развития. Однако, по словам промоутера, используемые в плазмиды вектор (низкий уровень экспрессии с промоутером цитомегаловирус / усилитель, сильный уровень экспрессии с цитомегаловирусом немедленно рано усилитель и куриные β-актина промоутер синтеза (CAG) промоутер), а также размер и стабильность белка выражается, эта концентрация может быть скорректирована (0,25 мкг / мкл до 5 мкг / мкл).
- Потяните стекло иглы помощью съемника микропипетки.
2. Подготовка хирургии
- Автоклав хирургических инструментов и фосфатный буфер солевом растворе (PBS).
- Подготовить анальгетик решение в PBS (бупренорфин, Vetergesic, конечной концентрации 30 мкг / мл). Взвешивание беременной мыши и ввести подкожно 0,1 мг / кг Vetergesic по крайней мере за 30 минут до операции. За это время подготовить хирургической области. Включите электрогрелки и восстановления камеры. Поместите стерильной PBS в теплой ванне и все стерильные инструменты и материалы на стерильной драпировки. Поместите платиновыми электродами в PBS заполненный стакан и подключиться к электропоратора. Заполните иглу с ДНК решения с использованием microloader совет, подключение иглу капиллярной держатель и отщипывать кончике иглы с щипцами.
- Анестезировать беременных мышей (E14.5-E15.5) с ИФ кислорода носителя (кислород 2 л / мин) с использованием анестезии камеры индукции. Подождите, пока животное теряет рефлекса.
- Передача животного "до операции" маску. Поместите каплю глаз гель на каждый глаз, чтобы предотвратить изъязвление роговицы в глаза, а мать находится под общим наркозом. Использование электрической бритвой брить волосы на животе. Очистите бритой области сразу с clorhexidine собирать летающие волосы.
- Передача животных на вторую маску в хирургической области. Наведите его обратно на грелку. Начало операции, когда педаль рефлекс был потерян.
- Наденьте маску и стерильные перчатки. Накройте животных стерильной драпировки (с небольшим отверстием в брюшной полости), чтобы предотвратить тканей и инструменты от загрязнения участков кожи, которые не были бритые и продезинфицированы. Очистите бритой областиПо меньшей мере 3 раза clorhexidine. Используйте другой стерильный ватный тампон каждый раз. Используйте скальпель, чтобы сделать вертикальный разрез по средней линии (~ 1 мм в длину), через кожу. Используя ножницы, сделать подобный разрез мышц живота вдоль белой линии (белая линия состоит в основном из коллагена соединительной ткани).
- Выберите наиболее доступных эмбрионов и положите кольцо щипцы между двумя эмбрионами и осторожно вытащите эмбриональной цепочки из брюшной полости. С этого момента, держите эмбрионов гидратированных стерильной подогретого PBS.
Нет микроскопа, необходимые для визуализации.
4. Введение ДНК и Электропорация
- Начнем с одной из самых боковых эмбрионы, что делает его легче отслеживать, какие эмбрионы электропорации. Не тяните слишком много эмбрионов, так как это повышает риск кровотечения. Манипулирование положение плода в амниотической полости с помощью кольца и щипцыстабилизировать глава эмбрионов между кольцами. Сожмите мягко нажать на эмбрион ближе к стенке матки.
- С другой стороны, принимать капиллярные держатель и вставить иглу тщательно в середине полушарии целевой бокового желудочка. Нажмите на педаль, чтобы вводить около 1 мкл раствора ДНК смешивается с быстрой Грин (менее 1 мкл для изучения дендритов). Вы должны наблюдать за зеленый краситель заполнения бокового желудочка. Критические шаги: - острота иглы важно правильно проколоть стенку матки. Важно, чтобы свести к минимуму движение иглы на поверхности стенки матки и после введения в желудочек, потому что расширение отверстия приведет к утечке амниотической жидкости и зародыш смерти. Избегайте пирсинга кровеносные сосуды в стенке матки, так как это может привести к кровотечению и смерти эмбриона.
- Важно, чтобы не вводить слишком большого объема ДНК в боковой желудочек, потому что такое действие будет побуждатьгидроцефалия (не более 2 мкл на E14.5). Объем ДНК регулируется в зависимости от целей эксперимента. Если 1 мкл, как правило, используется для большинства экспериментов, меньший объем ДНК (приблизительно 0,5 мкл) требуется для дендритов и позвоночника анализа. В самом деле несколько изолированных клеток должны быть ориентированы для визуализации и измерения дендритных беседки из электропорации нейронов. - Установите электроды по бокам головы эмбриона с положительным (+) веслом на той же стороне, вводится желудочка для электропорации коре или на противоположной стороне желудочка вводили в гиппокамп электропорации (рис. 2). Затем нанесите пять 30V электрические импульсы (50 мсек), с интервалом в 1 сек. Важный шаг: Избегайте применения тока через плаценту, так как это может привести к смерти эмбриона.
Все эмбрионы у беременной мыши может быть электропорации, как правило, с таким же ДНК-конструкции, чтобы избежать путаницы. Тем не менее, долгое снижение хирургии х годов выживаемость эмбрионов. Брюшной полости не должно быть открыто более 30 мин.
5. Хирургия после электропорации
- После electroporating эмбрионов, добавить PBS в брюшную полость и использовать кольцо щипцы для замены рога матки в своем первоначальном месте. Сшивать стене живота и кожу Викрил рассасывающиеся швы.
- Поместите животных в восстановлении камеру, пока он проснется (обычно 5-10 мин), а затем передать в клетку помещают на грелку.
6. После операции
Проверить поведение мышей для оценки боли, страданий или бедствия и весят животные 24 ч и 48 ч после операции. При необходимости, анальгетики могут быть введены, чтобы минимизировать боль и дискомфорт.
7. Обработка тканей
Соберите электропорации эмбрионов или щенков в эмбриональном или постнатальном этапах, необходимых для эксперимента.
ove_content "> - Для анализа на эмбриональной стадии (например, для изучения клеточной пролиферации и миграции):Усыпить мать через шейный дислокации и собрать эмбрионы. После того, как обезглавливание, выберите мозга, которые были должным образом электропорации, о чем свидетельствует количество и расположение флуоресцентный сигнал, визуализируется через череп помощью флуоресцентных бинокль. Проанализируйте мозг из черепа и закрепить на ночь в 4% PFA и то место в 20% сахарозы / PBS в течение ночи. Вставить в октябре соединение, замораживание при температуре -80 ° C и раздел помощи криостата.
- Для анализа на этапах постнатального (например, для изучения дендритов и игл):
Обезболить щенков или взрослых мышей при внутрибрюшинном введении pentobarbitone (40-60 мг / кг) и выполнять transcardial перфузии с PBS, а затем на 4% PFA в PBS. Проанализируйте мозг из черепа и после исправления в 4% PFA в одночасье. После промывки в PBS, раздел мозга помощью vibratome (100 мкм разделы для гendrite анализ). Установите разделы Аква Poly / крепление использованием 0.16-0.19 мм покровные имиджу дендритов и игл.
8. Представитель результаты
На рисунке 3 показаны примеры электропорации клеток в коре головного мозга (рис. 3А, Б), в СА1 (рис. 3C, D) и в зубчатой извилине гиппокампа (рис. 3E, F). Дикого типа мышей электропорации в E14.5 с GFP конструкции (СПС-би-EGFPm5 глушитель 3) и мозги были собраны в послеродовой день (P) 14. Вводя малый объем раствора ДНК (0,5 мкл или менее решение на 1 мкг / мкл), несколько клеток помечены, которая позволяет визуализировать дендритных разветвление изолированных GFP + клеток (рис. 3), а также их шипами при большем увеличении (рис. 4).
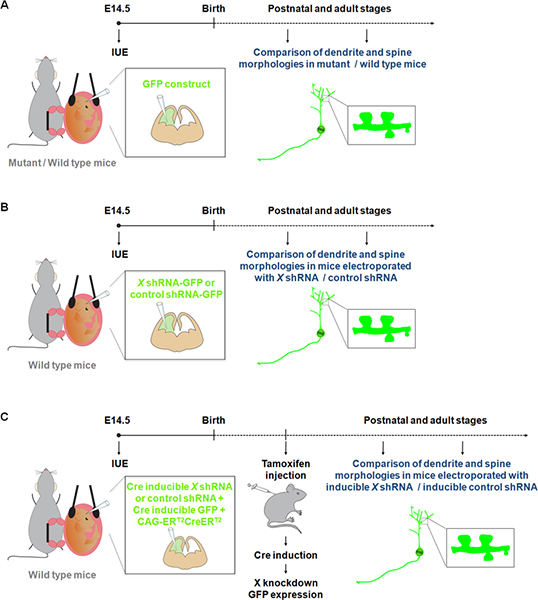
<сильный> Рисунок 1. Схематическое изображение электропорации протоколов, которые могут быть использованы для изучения дендритов и игл. (A) электропорации GFP построить для сравнения дендритов и игл в дикого типа и мутантных мышей. (B) электропорации GFP-ShRNA (GFP выражается с той же конструкции) для сравнения дендритов и игл у мышей электропорации с ShRNA строить специфичные для гена (X) или контроль ShRNA. (C) ИЭГ может использоваться совместно с системой индуцибельной Cre для того, чтобы ограничить выражение ShRNA к желательным период времени. В этом эксперименте, вектор выражения формы рекомбиназы Cre, которые могут быть активированы на 4-hydroxytamoxifen (CAG-ER T2 CreER Т2, 1 мкг / мкл), 10, электропорации вместе с вектором выражения конкретных ShRNA в Cre зависимость образом (1 мкг / мл, и с рекомбинацией индикатор (CALNL-GFP конструкции, GFP выражение индуцибельной по Cre;. 1 мкг / мкл) 10 эффексу из нокдауна может быть улучшено за счет увеличения концентрации ShRNA а также увеличение CAG-ER T2 T2 CreER концентрации.
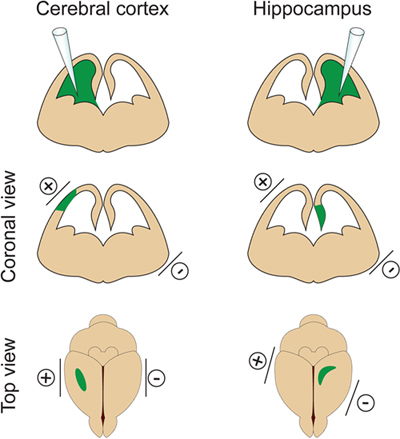
Рисунок 2. Пространственное управление электропорации. Эта цифра показывает, где расположить весла электродов в зависимости от места инъекции ДНК в целях выявления коры головного мозга и гиппокампа.
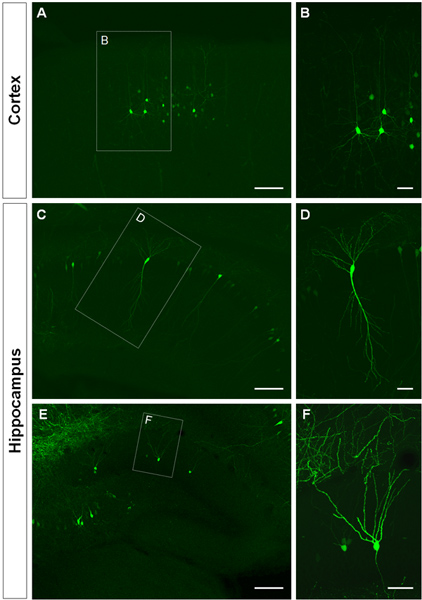
Рисунок 3. Визуализация дендритных беседки внутриутробного электропорации клеток в коре головного мозга и гиппокампа. (A, B) корональные разделы показывает GFP + пирамидальных клеток в коре головного мозга (CD) пирамидальные клетки СА1 гиппокампа и (E, F), гранулярных клеток в зубчатой извилине на P14. GFP конструкции (СПС-би-EGFPm5 глушитель 3) электропорации в E14.5. Высшее увеличения изображения (B, D, F) показывают, что ИЭГ является эффективным методом для визуализации дендритов. Масштаб барах составляют 50 мкм (B, D и F), 150 мкм (A, C, E).
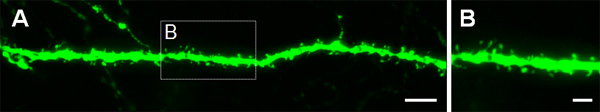
Рисунок 4. Визуализация дендритных шипиков в P14 нейронов, которые были электропорации внутриутробно на E14.5 с GFP выражения построить. (A, B) Изображения высокого увеличения шипов из базальных дендритах пирамидных нейронов гиппокампа. Масштаб барах составляют 5 мкм (А) и 2 мкм (Б).
Обсуждение
Институт экономики города является мощным инструментом для манипулирования экспрессии генов не только в пространстве, но и во времени. Здесь мы показываем, что этот метод может быть использован для визуализации и генетически манипулировать дендритов и игл в коре головного мозга и гиппокампа мышей. Кроме того, преимущества ранее упомянул, стоит отметить, что ИЭГ, в отличие от метода Гольджи, могут быть объединены с иммуногистохимии или гибридизация, которая позволяет, например, фенотип электропорации клеток. Важно также отметить, что эта процедура не вызывает пороки развития мозга очевидна, несмотря на его относительную инвазивности. Кроме того, на клеточном уровне, ИЭГ не изменяет электрофизиологические свойства нейронов электропорации 13. В то время как наша демонстрация посвящена визуализации дендритов и позвоночника морфологии, Институт экономики города корковых нейронов гиппокампа или в E14.5 также может быть использована для изучения других развитием событий, таких как формирование аксонов и руководства. В добавлениеition, такой же протокол может быть реализован и на других стадиях эмбрионального развития ориентированы на различные группы населения. Например, умственно очень поздно коры электропорации парадигмы в E18.5 могут быть выполнены, чтобы управлять экспрессией в астроцитарных предшественников 1. Кроме того, в то время как электропорации гиппокампа в E14.5 позволяет целевой СА1-пирамидальных CA3 предшественников нейронов и клеток-предшественников зубчатой гранул в то же время, поздно гиппокампа электропорации (E18.5 или раннем послеродовом) позволит ориентированы на различные зубчатой гранул предшественников 14. В этом случае вводится объем ДНК может быть увеличен, а также интенсивности тока.
Трансгенов введен ИЭГ, кажется, остаются эписомной и поэтому потерял из клеток после последовательных клеточных делений. В постмитотических клетки, такие как нейроны, однако, эписомной трансгенов остаются активными в течение месяца после электропорации позволяет долгосрочные исследования 13, 15. В нашем исследовании мы наблюдали яркий GFP + клеток до 7 недель после рождения (последнее момент времени мы проанализировали) о том, что эмбриональные ориентации корковых нейронов гиппокампа или прекурсоров использованием ИЭГ результатов в упорном выражение трансгена от раннего развития до момента времени к взрослой жизни.
Ограничение тока техники является то, что трудно оказывать точный контроль над общего числа электропорации клеток. Тем не менее, за счет уменьшения объема вводят раствор ДНК, мы показали, что можно пометить несколько клетки и визуализировать дендритных разветвление изолированных GFP + клеток, а также их шипами. Размерность трансфицированных области могут быть скорректированы путем изменения параметров электропорации, таких как силы тока и количества импульсов или диаметр электропорации весла.
Всего ИЭГ является методом, который прост в реализации, быстрым иэффективное изучение дендритов и игл в естественных условиях.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Авторы хотели бы поблагодарить д-ра Кэтлин Mathers, д-р Жан-Филипп Mocho и д-р Иоланда Сааведра Торреса за их помощь для выполнения внутриутробно электропорации в асептических процедур и Хейли дерево за помощь в подготовке рисунков.
EP был поддержан долгосрочных Федерации европейских биохимических обществ (FEBS) общения и Medical Research Council (MRC), развитие карьеры общения, MAH по Wellcome Trust грант Элизабет Фишер и Виктор ФИЗИЧЕСКИХ НАУК (080174/B/06/Z) , HW по EMBO длительных стажировок и РА студенческие MRC. Эта работа была поддержана грантом проекта Wellcome Trust (086947/Z/08/Z) и дотация из Медицинского исследовательского совета (U117570528) для FG
Материалы
| Name | Company | Catalog Number | Comments | |||
| Название реагента | Компания | Номер по каталогу | Комментарии | |||
| Подготовка иглы и ДНК, раствор для инъекций | ||||||
| EndoFree плазмиды Комплект Maxi | Qiagen | 12362 | ||||
| Быстрый зеленый | Сигма | F-7258 | ||||
| Боросиликатного стекла капилляров 1,0 мм диаметр х 0,58 мм ID | Гарвардский аппарата | 30-0016 | ||||
| Microloader советы | Эппендорф | 5242956003 | Для Эппендорф пипетки 0,5 мкл, 10 мкл / 2-20 мкл | |||
| И яBSP; | Материалы для хирургии | |||||
| Дополнительные тонкие ножницы Iris | Изобразительных средств наук | 14088-10 | ||||
| Изогнутый зажим | Изобразительных средств наук | 91197-00 | ||||
| Кольцо щипцы | Изобразительных средств наук | 11103-09 | ||||
| Иглодержатель | Изобразительных средств наук | 12002-12 | ||||
| Грефе пинцет | Изобразительных средств наук | 11050-10 | ||||
| Викрил рассасывающиеся нити | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Стерильные шторы 30 см х 45 см | Попойка | 141765 | ||||
| Стерильные тампоны | Shermond | Huby-340 | ||||
| Ватные палочки | Чистая Креста, ООО | 1860 | ||||
| Бупренорфин (Vetergesic) | Alstoe здоровья животных | |||||
| Clorhexidine | Vetasept | XHG007 | ||||
| Viscotears Глазной гель | Novartis | |||||
| Изофлюран | Abbott Laboratories | B506 | ||||
| Pentoject, Pentobarbitone натрия 20% | Animalcare | |||||
| Электропорация | ||||||
| Электропоратора | BTX | ECM830 | ||||
| Платиновый Tweezertrodэлектронной 5мм | BTX, Гарвардский аппарата | 45-0489 | ||||
| Femtojet microinjector | Эппендорф | 5247000030 | ||||
| Педаль управления для Femtojet Microinjector | Эппендорф | 5247623002 | ||||
| Капиллярная держатель | Эппендорф | 5176190002 | ||||
| Ткань обработки | ||||||
| Параформальдегид | Сигма | P6148 | ||||
| Сахароза | VWR (Prolabo) | 27480.294 | ||||
| Микроскопа | ThermoScientific (Menzel-Glaser) | J1800AMNZ | ||||
| Покровные | Menzel-Glaser | 22 х 50 мм # 1,5 | ||||
| Аква Poly / крепление | Polysciences, Inc | 18606 | ||||
Ссылки
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены