Method Article
マイクロ波支援ポリの機能化(エチレングリコール)と連鎖重合で使用するためには樹脂ペプチドおよびヒドロゲル形成
要約
このビデオは、連鎖重合ヒドロゲル合成を可能にする、ポリ(エチレングリコール)メタクリレートするための迅速、効率的な方法を説明します。それは同様に、機能化効率を評価、トラブルシューティングや高度な修正のための提案を提供し、典型的なハイドロゲルの特性評価技術を実証するために、ペプチド、詳細一般的な分析方法にメタクリルの機能を導入する方法を紹介します。
要約
ヒドロゲル形成にポリ(エチレングリコール)(PEG)マクロマーを使用する主な利点の1つは、合成汎用性である。 PEGの分子量及び構成の多種多様から描く能力(アーム数が、長アームと、分枝パターン)がヒドロゲル構造とヤング率とメッシュサイズを含む特性を得られる上に研究者が厳密な制御を与える。このビデオは、ポリ(エチレングリコール)ジメタクリレート(PEGDM)中にPEG前駆メタクリレートための迅速、効率的、無溶媒の、マイクロ波支援方法を示すであろう。この合成法は、薬物送達や再生医療への応用のための非常に必要な出発材料を提供しています。それが試薬および溶媒より少量を使用して、大幅に高速で簡単なだけでなく、より経済的かつ環境にやさしいことが実証メタクリル化方法は、従来法よりも優れている。また、樹脂上methacrためこの技術の適応を紹介しますペプチドのイルアミド機能化。この樹脂上の方法は、ペプチドのN末端が前の樹脂からの脱保護および開裂メタクリルアミド基で官能化することができる。反応性側基(リジンの例えば第一級アミン、セリンの第一級アルコール、スレオニンの第二級アルコール、およびチロシンのフェノール)を有するアミノ酸が官能化を防止し、保護されたままで、これは、ペプチドのN末端 にメタクリル基の選択的付加を可能にする複数のサイトで。この資料を詳述一般的な分析方法、官能化の効率を評価するために(プロトン核磁気共鳴分光法(H-NMR)およびマトリックスは飛行型質量分析レーザー脱離イオン化時間(MALDI-TOF)をアシスト)。一般的な落とし穴やトラブルシューティング方法を提案し、さらに調整するマクロ機能に使用することができる技術および得られたヒドロゲルの意志の変更として、解決される予定の物理的および化学プロパティ。薬物送達のためのヒドロゲルの形成のために合成された製品の使用および細胞 - 材料相互作用の研究は、ヒドロゲル剛性と薬物放出を制御する、メッシュのサイズに影響を与えるために、ヒドロゲル組成物を修飾に着目特に注意して、実証される。
概要
ポリ(エチレングリコール)(PEG)ヒドロゲルは、再生医療および薬物送達用途1-3で使用される一般的な生体材料である。これらのヒドロゲルは、他の生体材料上の重要な利点を提供します。 PEGヒドロゲルは、例えば、それらの天然の生体材料の対応物1と比較して弾性及び分解速度の係数として工学的特性に対する高度な制御を提供し、合成である。これらは合成的に誘導されるように、PEGは、天然由来の材料4に対して有意に少ないバッチ間のばらつきがあります。 PEGの化学的組成のために、これらのヒドロゲルは、高度に親水性のタンパク質吸着に耐性であり、3生体適合性である。タンパク質吸着に対するこの抵抗は、これらの事実上の特定の生物学的または化学的因子(薬物、生体分子、細胞接着ペプチド等 )、特定の役割を問い合わせし、研究するための研究を可能にする、PEGヒドロゲルは、「白紙状態」として作用することを可能にするrsは、細胞および/または組織の挙動を制御する役割を果たす。
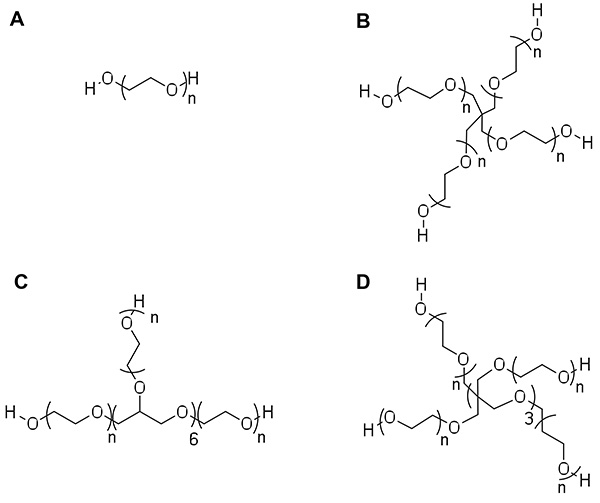
図1:。ポリ(エチレングリコール)(PEG)アーキテクチャとヘキサグリセロールコアD)8アームPEGペンタエリスリトールコアC)8アームPEGとA)リニアPEG B)4 -アームPEG の例トリペンタエリスリトールコア。 nはPEGの数は各アームに繰り返す。各繰り返しは、したがって、44 g /モルの分子量を有し、nは全体の分子量および構造/腕位から計算することができる。
PEG前駆体は、アーキテクチャや、種々の分子量( 図1で利用できます )。アーキテクチャ(アーム#)を変化させ、PEGのエチレングリコール反復(n)は、これらのマクロマーから形成されたハイドロゲルネットワークの特性を制御するために使用することができる。未修飾PEGはハイドロゲルネットワークの形成に先立って重合を介して共有結合性の架橋を促進するための別の機能に置き換えられる必要があり、末端ヒドロキシル基、PEGヒドロゲルのために最も一般的に用いられる架橋戦略を含有する。重合および架橋ネットワーク(アクリレート、メタクリレート、ビニルエーテル、ノルボルネンなど ) を容易にするためにPEGマクロマーに組み込むことができる化学基には様々なものがある。ステップ·アンド連鎖成長(または2、混合モードの混合物):架橋を促進するために利用できるターミナル様々な機能にもかかわらず、重合が起こることのできる唯一の2つのメカニズムがあります。
g2.jpg "幅=" 600PX "/>
拡大画像を表示するには、ここをクリックしてください 。
図2:地域やループ、未反応の前駆体、および恒久的なもつれなどの増加のネットワーク非理想架橋密度の高いポリ(メタクリル酸)を含む異種ネットワークにおける理論ハイドロゲルネットワークの回路図A)従来の連鎖成長重合の結果b)工程成長重合結果かなり多くの均質なネットワーク構造(原寸大ではありません)。
連鎖成長重合により架橋する機能が追加架橋剤の存在を必要としない。しかしながら、鎖重合ヒドロゲルは、緻密な架橋領域( 図2A)1 を含む異種ネットワーク構造を作り出す。一方、ステップ成長重合requiPEGマクロマーの末端官能基と反応性の架橋剤または共単量体の使用解像度。 PEG上の末端官能基のみと反応し得る架橋剤と架橋剤のみPEG上の末端官能基と反応することができるように、これは、より大きなネットワーク構造の均一性( 図2B)をもたらす1。ステップ成長重合はまた、典型的には、可溶性、取り込まれなかったマクロマー1による免疫/炎症応答のための未反応の前駆体および電位の量を減らす、官能基の高い変換をもたらす。混合モードの重合方法はまた、(連鎖成長)、自己反応し、架橋剤(段階成長)の両方と反応することができるマクロマーの使用を介して両方のステップと連鎖成長重合を組み合わせることが開発されている。これは、各重合機構の特性にヒドロゲルを生成し、いずれかよりもより複雑な、多様なネットワーク構造を生成するために使用することができるステップ·単独連鎖成長ネットワーク1。
PEGの官能化およびハイドロゲル形成を促進するために使用することができる官能基の過多があるが、メタクリレート及びノルボルネンは、それぞれ、最も一般的な鎖と、ステップ成長重合部分の一部である。これらの機能はいずれも、ネットワークの重合に対して優れた時空間制御を提供し、細胞をカプセル化するために使用する場合、これらのネットワークは全体的に高い細胞生存5-7をサポートしています。連鎖重合によって官能化されたPEG(PEGDM)架橋をメタクリレートとアクリレート、メタクリレート、または同様に官能化生体分子5,6との共同重合して生体分子またはその他の要因の取り込みが可能になります。 PEGDMヒドロゲルは、アクリレート官能化PEG(PEGDA)のような代替の鎖成長重合システムに勝る大きな利点を有する。従来の方法を用いて、PEGDAはPEGDMよりも迅速に合成することができる。ホweverは、マイクロ波支援合成を用いて、PEGDM合成がより一層効率的である。 PEGDAは、しばしば、一晩8または24時間9反応で合成されるが、高温で4時間10で合成することができる。 PEGDMはまた、伝統的に4日〜12反応時間を延長するいくつかの方法で、一晩、11又は24時間5で反応させることによって合成される。ここで示すマイクロ波アシスト法を用いて、PEGDM 5分間反応で製造することができる。 PEGDMがPEGDA 13よりも遅い反応速度を有するが、PEGDMの架橋反応は数分で起こる、依然として迅速であり、およびメタクリレート基の疎水性の増加は、溶液中の官能基凝集を増加させるようにPEGDAを超えるマクロマー転化率を達成することにより、確率を増加させるラジカル移動およびメタクリレート換算14。 PEGDMハイドロゲルも、増加した細胞生存率および成長などに関連しているラジカル濃度および14に存在する未反応マクロマーを低減により、任意の時点で、反応速度の低下する可能性が高いPEGDAヒドロゲル、、と比較。このような段階成長重合によりノルボルネン官能化PEG(PEGN)フォームヒドロゲルを使用しているようなチオール - エン重合、およびPEGNの使用およびより大きい2の官能基の平均が含まれている架橋剤を必要とする。チイルラジカルノルボルネン炭素-炭素二重結合、マルチチオール含有架橋剤と反応するので、一般的にシステインアミノ酸官能7を有するペプチドの容易な組み込みを可能にする、PEGNヒドロゲルを架橋するために使用される。ステップ成長重合を経由して反応し、他の多くの化学的性質がありますが(例えば、チオール-アクリレート15とチオールビニルスルホン16として、マイケル付加反応は、このようなアルキン-アジド17 等の反応を「クリック」)、チオール-ノルボルネンヒドロゲルはあるからの株として、非常に一般的なノルボルネン環が著しく反応速度を増加させ、連鎖重合を受ける7ノルボルネンの二重結合の機会を減少させる。
ヒドロゲルの形成を容易にするメタクリレート、ノルボルネン、または代替官能間の決定は、主としてアプローチに基づいている。例えば、連鎖成長重合したPEGDMネットワークも同様に実証組織工学骨膜18,19の開発に細胞局在を制御するために適してきた。ステップ成長重合したPEGネットワークは、チオール(システイン)含有ペプチドを用いた酵素基質配列の組み込みを容易にするために、酵素的に応答性ヒドロゲルの分解を容易にするペプチド配列の組み込みに適しており、官能化マクロマー20ノルボルネン 。研究課題は、最高の段階成長ハイドロゲルを使用することによって対処される場合は、フェアバンクスら norborの詳細な説明を提供していますPEG 7のためのネネ機能化戦略。 PEGおよびペプチド配列は、連鎖重合反応のために(PEGためのメタクリル酸、およびペプチドのためのメタクリルで)機能化することができるか、この紙の意志のディテール。
伝統的に、PEGDMジクロロメタン中メタクリロイルクロライドおよびトリエチルアミンとPEGとを反応させることにより製造される。反応物を濾過し、ジエチルエーテルで沈殿し、収集の前に4日〜12反応時間を延長するいくつかの方法を用いて、室温で一晩で11または24時間、5進行させている。このアプローチの多くの変形が存在するが、全ては、時間がかかる化学合成装置の大きなアレイを必要とし、それらは、高純度の試薬及び溶媒の比較的大量の使用を伴うような、環境に優しいものではない。これらの制限を回避するために、リン-ギブソンらテにPEGを官能化するためのマイクロ波支援、溶媒を含まない方法を開発 rminalメタクリレート基( 図3A)12。この反応において、PEGの末端アルコール基がカルボキシルを形成するために、メタクリル酸無水物のカルボニル原子の一つと反応する。これは、副生成物としてのメタクリル酸と、PEGDM生成物を生成する。この合成は、反応時間の短縮及び無溶媒合成法21を含むマイクロ波合成の特性の利点の多くを有する。マイクロ波合成は、それが大幅に高速であるように、前に説明した方法よりも好ましい少ない大規模な合成装置( 例えばガラス製品、反応プレート)を必要とし、溶媒をのみ生成物の精製/収集としないために必要とされるように少なく、全体的な試薬、溶媒量を使用しています合成、それがより経済的で環境に優しい作り。
いただき "/>
拡大画像を表示するには、ここをクリックしてください 。
図3:官能回路図A)ポリ(エチレングリコール)、ポリ(エチレングリコール)メタクリレートBを生成するために10倍モル過剰のメタクリル酸無水物と反応させて)、この同じ方法は、成形、ペプチド配列のN末端 を官能化するために使用することができる官能化されたペプチドをメタクリルアミド。従来、樹脂からペプチドを切断し、この手順を行うことにより、N-末端の選択的官能化は、アミノ酸側基が保護されたままであるように行うことができる。 nはPEGの数はマクロマーで繰り返す(2用のn = 45.5、227および455は、それぞれ、10および20kDaの線状PEGを用いる)。 RNへR1:アミノ酸側鎖。 PGNにPG1:側鎖保護基。 TFA:トリフルオロ酢酸。 TIPS:トリイソプロピルシラン。 DODT:3,6 - ジオキサ-1,8 - octanedithiol。 H 2 O:水。
マイクロ波アシストメタクリル化法は、最近のポリマーおよびポリマーネットワーク内に種々のペプチドの取り込みを促進するためにメタクリル基( 図3B)を有するペプチドのN-末端を官能化する我々のグループによって適合されている。この反応において、ペプチドのN-末端の第一級アミンは、アミドを形成するメタクリル酸無水物上のカルボニル原子と反応する。これは、副生成物として生成したメタクリル酸と、メタクリル官能化ペプチドを生成する。ペプチド配列のN末端を官能化するためにこの手順を使用する場合は、反応性側鎖(第一級アミン(リジン)、アルコール(セリン、スレオニン)、フェノール類(チロシン))を含有するアミノ酸は、官能化中に保護されることが重要である、と保護基のみメタクリル取り込み後に切断されています。
この記事では、これらのマイクロWの両方を紹介します一般的な落とし穴を強調表示して、トラブルシューティングの方法を示唆し、PEGDMを合成し、樹脂上のペプチド配列を官能化するAVE支援方法。この記事では、製品の官能性を評価するために一般的に用いられる分析的化学技術を実行するための方法について詳細に説明する、より高度な修飾を行うための提案とリソース説明する。典型的な結果は、ハイドロゲルネットワークを形成するために合成PEGDMを使用してモデル薬物の放出を制御するために形成されたヒドロゲルを利用して、細胞 - ヒドロゲルの相互作用を容易にするために官能化されたペプチドを使用することを含み、これ実証される。特別な注意がヒドロゲルのメッシュサイズを特徴づける、ひいてはそのような剛性および薬物放出プロファイルのようなバルク材料特性を制御するこの基礎となる物理的特性に影響を与えるように調整することができる方法をヒドロゲル組成質問に支払われる。
プロトコル
1。 PEGDMのマイクロ波支援合成
- 水による汚染を防止するために、予め乾燥全てのガラス器具を1時間オーブン(> 60℃)で使用されている。
注意:必要なガラス製品が含まれています:2 100ミリリットルのビーカー、250mlのビーカー、3へら、250mlのブフナーフラスコ、7 cmのブフナー漏斗、10cmの時計皿を。 - その後、ビーカーに注ぐ時計皿でビーカーをカバーし、氷で満たされた再結晶皿にビーカーを置くことによって、ステップ1.6で実行沈殿のための事前チル100〜150ミリリットルの無水ジエチルエーテル(74.12グラム/モル)。化学ヒュームフード内にマイクロ波とボルテックスを移動します。
注:ジエチルエーテル、化学冷凍庫にビーカーを置くことによって予備冷却されてもよい。冷凍庫で冷却することにより達成さ低級ジエチルエーテル温度は沈殿速度と効率を向上させるであろう。 - 小さな量るボートに、molecuのポリ5グラム(エチレングリコール)(PEG)を秤量あなたの選択(1,000〜100,000 Da)でのLAR重量。
- 存在する場合には、シンチレーションバイアルの蓋からプラスチック片を取り除く。風袋バイアル、フードの式1バイアル当たり(MA、154.16グラム/モル)にメタクリル酸無水物の10モル過剰を分注する。シンチレーションバイアルにPEGを追加します。
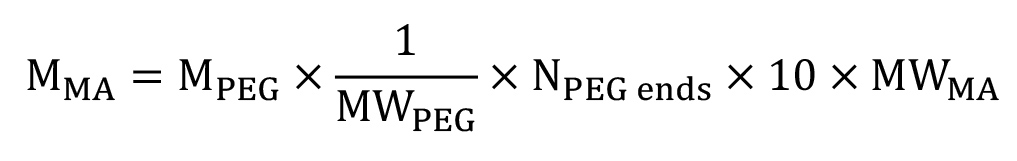 (1)
(1)
どこ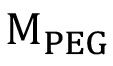 G中のPEGの質量は、
G中のPEGの質量は、  PEGの分子量はg /モルであり、
PEGの分子量はg /モルであり、 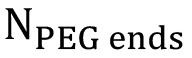 PEG上の末端OH基の数であり、そして
PEG上の末端OH基の数であり、そして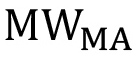 molecuですg /モルでのMAのLAR重量。
molecuですg /モルでのMAのLAR重量。
- 存在する場合には、シンチレーションバイアルの蓋からプラスチック片を取り除く。風袋バイアル、フードの式1バイアル当たり(MA、154.16グラム/モル)にメタクリル酸無水物の10モル過剰を分注する。シンチレーションバイアルにPEGを追加します。
- ゆるくシンチレーションバイアルにキャップをねじる。最大電力で5分間マイクロ波を設定します。耐熱手袋を着用して、電子レンジで30秒毎にバイアルを取り外します。
- 完全に30秒間キャップと渦を締めます。ソリューションは、完全な5分間レンジ加熱されるまで繰り返します。キャップは割れによる手順の間に交換する必要があります。
- キャップ付きPEGDMを室温まで冷却させ、緩め。ジクロロメタン(DCM、84.93グラム/モル)を少量(10〜15)中PEGDMを溶かす。
メモ:PEGDMが原因で余熱し、DCM(疑いのある物質)の沸騰を防ぐために、大幅に(約5分)前のDCMのほかに放冷することをお勧めします。 PEGDM、スパチュラを用いて小さなチャンクに分割し、溶解を助けるためにボルテックスされ得る。 - 20分間、10倍過剰の氷冷ジエチルエーテルにPEGDMを沈殿させる。
注意:これは、SCへの必要な場合があります低分子量のPEG(2500 DA)を沈殿させるために結晶形成を開始するためにスパチュラでビーカー側ラッチ起しますが、千ダ未満の分子量を有するPEGは、引っかき傷にもかかわらず、沈殿しない。 - ブフナー漏斗及びフラスコを用いて、真空濾過によりPEGDMを収集します。これはPEGDMに水の吸着を促進するように、乾燥を完了するためにフィルターをかけません。
注:使用中の特定の真空システムに必要な場合は、真空トラップは溶媒蒸気による損傷から真空ポンプを保護するために、濾過のセットアップと真空源との間に配置することができる。 - 換気用のキャップを貫通大ゲージの針で50ミリリットルコニカルチューブにフィルターPEGDMを転送します。乾燥させるために、真空チャンバー内で一晩保管してください。
- DCMおよび再析出における再溶解PEGDM未反応のMAを除去するための最後のステップとして(ステップ1.5〜1.7のように)。ステップ1.8のように、再び乾燥させます。
2。 PEGDM機能化のキャラクタリゼーション
- 溶媒として重水素化クロロホルム(120.38グラム/モル)を使用して、1 H-NMRのためのサンプルを準備します。溶剤(≈1.0ミリリットル)を少量のシンチレーションバイアルにPEGDM(≈10 mg)を少量のサンプルを置きます。標的濃度は10 mg / mlである。
- 試料が溶解されると、きれいなNMR管に移す。サンプルは、NMR管の底4〜5センチメートルを埋める必要があります。
- プロトンNMRスペクトルを収集します。我々のデータは、400MHz分光計を用いて収集される。十分なデータ分解能を得るために、少なくとも64スキャン室温でサンプルを実行する。
- NMR分析( 図4)は PEGDM官能90%未満であることを示す場合には、メタクリル化手順が繰り返されるべきである。 MAの質量を調整することは非官能化PEGの減少量を考慮するために使用される。
注:ターミナルmethacrの理論比:PEGDMに官能化PEGの割合が観察さから計算することができますプロトンキシレート(a、b及びc)は、中央PEGプロトン(d)は( 図4)である。線状PEGは、中央のPEGプロトンの理論数は、式2により算出される。
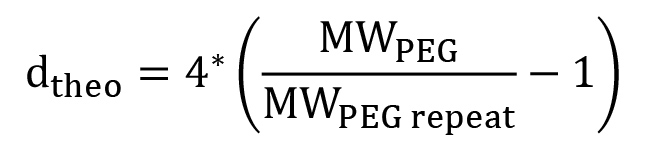 (2)
(2)
どこ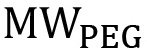 PEGの分子量はg /モルであり、
PEGの分子量はg /モルであり、 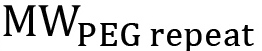 単一のPEG反復(44 g /モル)の分子量である。非線形のPEGの場合、この式は、特定の分岐構造( 図1)を反映するように変更する必要があります。パーセントの官能化は、方程式3を用いて計算することができる。
単一のPEG反復(44 g /モル)の分子量である。非線形のPEGの場合、この式は、特定の分岐構造( 図1)を反映するように変更する必要があります。パーセントの官能化は、方程式3を用いて計算することができる。 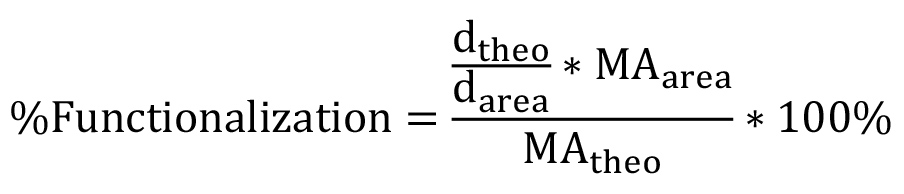 (3)
(3)
どこ は、ピークD(δ= 6.63 ppm)の下で観察した面積である
は、ピークD(δ= 6.63 ppm)の下で観察した面積である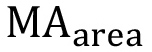 メタクリル酸のプロトンピーク下の観察領域(δ= 1.94 ppmであり、b及びc、δ= 5.57および6.12 ppm)であり、そして
メタクリル酸のプロトンピーク下の観察領域(δ= 1.94 ppmであり、b及びc、δ= 5.57および6.12 ppm)であり、そして メタクリル酸プロトンの理論数(= 3は*
メタクリル酸プロトンの理論数(= 3は* 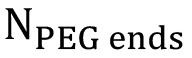 、b = 1で*
、b = 1で* 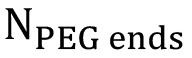 そして、C = 1 *
そして、C = 1 * 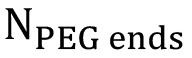 - 直鎖状PEGのために、それぞれ6,2および2)。 %の官能化の計算は、a、bおよびcは別々のピークを使用して実施し、その後アベレージされるべきである全体的なパーセントの官能化を得るために、編。
- 直鎖状PEGのために、それぞれ6,2および2)。 %の官能化の計算は、a、bおよびcは別々のピークを使用して実施し、その後アベレージされるべきである全体的なパーセントの官能化を得るために、編。
注:十分に官能化PEGDM次いで(水に対して、水中で)透析し、残留無水メタクリル酸およびメタクリル酸を除去し、凍結乾燥によって回収することができる。最終生成物は、クエン酸またはビタミンCのような阻害剤の少量(0.01重量%)と混合し、使用するまで-20℃で乾燥剤と共に保存されるべきである。最終生成物はPEGDM Khetanとバーディック22によってJoveの資料に詳述されるように、ヒドロゲルを生成するために使用することができる。
3。オン樹脂ペプチドのマイクロ波支援機能化
注:ここペプチドがUV監視で自動化ペプチド合成機を用いて、Fmoc-Gly-Wang樹脂を使用して合成され、N-メチルピロリドン(NMP 99.1 g /モル)中の0.2Mのアミノ酸溶液。ジメチルホルムアミド中5%ピペラジン(86.1グラム/モル)(DMF 73.1 g /モル)を0.5 M O-ベンゾトリアゾール-N、N、N '、N'-テトラメチルウロニウムヘキサフルオロ、脱保護のために使用されるDMF中uoro - ホスフェート(HBTU、379.3グラム/モル)を、活性化剤として使用し、NMP中の2Mジイソプロピルエチルアミン(DIEA、129.3グラム/モル)アクチベースとして使用される。ペプチドはまた、市販のペプチド供給業者から得ることができる。商業的供給源を使用する場合には、ペプチドは、標準的なように、無傷ではなく、完全に切断された保護基はアミノ酸側鎖とで樹脂調達することが重要である。
注:これは、反応性側鎖を有する任意のアミノ酸がそのアミド官能のみ配列のN-末端の第一級アミンで生じる保証するために保護されることが重要である。アミノ反応性側鎖基を有する酸、および一般的な保護基については、表1を参照してください。保護基を有するアミノ酸は、非保護アミノ酸と同様に、ペプチド合成の間に組み込まれた配列およびそのアミノ酸の製造業者から入手可能であることが多い。
| アミノ酸 | 反応基 | 保護基 |
| リジン | 1級アミン | tert-ブチルオキシカルボニル(Boc) |
| セリン | 第一級アルコール | tert-ブチル(tBuで) |
| スレオニン | 第2級アルコール | tBuの |
| チロシン | フェノール | tBuの |
表1:反応性アミノ酸は、典型的な保護基。
- 標準固相ペプチド合成を用いてペプチドを合成し、使用するまでDMF中で、4℃で樹脂上に格納する。
- 濾紙および250mlのフラスコと7cmのブフナー漏斗を用いて濾過を介してDMFからペプチド樹脂を収集する。
- 現在は、シンチレーションバイアルの蓋からプラスチックのピースを削除した場合。シンチレーションバイアルに樹脂を転送します。使い捨てピペットを用いて、シンチレーションバイアル中の樹脂をカバーするだけの十分なMAを追加します。
- ゆるくシンチレーションバイアルにキャップを配置します。最大電力での3分の電子レンジを設定します。耐熱手袋を着用して、電子レンジからのすべての15から20秒のバイアルを取り外します。
- 完全に15秒間キャップと渦を締めます。ソリューションはFUマイクロ波処理されるまで繰り返しLL 3分。
- キャップが緩んで、室温にペプチド溶液を冷ます。少量のDMFと濾紙とフラスコとのブフナー漏斗を使用して、バイアルからペプチド樹脂を集める。
- 新鮮なシンチレーションバイアルにペプチド樹脂を転送し、ペプチドを切断し、脱保護。
- 樹脂の0.25ミリモルあたり、我々は、0.5ミリリットルイソプロピルシランのそれぞれ(TIPS、158.36グラム/モル)18.5ミリリットルのトリフルオロ酢酸(TFA、114.02グラム/モル)の切断カクテルを使用して、回転させながら2時間の室温での反応を利用3,6 - ジオキサ-1,8 - オクタンジチオール(DODT、182.30グラム/モル)および脱イオン水(18.02グラム/モル)。
注:このカクテルは、ほとんどのペプチドのために十分であるが、2,2,4,6,7 - ペンタメチル - ジヒドロベンゾフラン-5 - スルホニル(一般にアルギニン側鎖を保護するために使用される)(にPbf)保護アミノ酸を脱保護しないであろう。シーケンスにPbfを保護されたグループが含まれている場合は、TFAを0.5ミリリットルを0.5ミリリットルチオアニソール(124に置き換える必要があります。は20g /モル)および切断時間は4時間に増加した。
注:切断カクテル中曇り、結晶性物質が形成した場合、ペプチドは、おそらく、溶液からクラッシュされ、切断カクテルの量を2倍にする必要があります。
- 樹脂の0.25ミリモルあたり、我々は、0.5ミリリットルイソプロピルシランのそれぞれ(TIPS、158.36グラム/モル)18.5ミリリットルのトリフルオロ酢酸(TFA、114.02グラム/モル)の切断カクテルを使用して、回転させながら2時間の室温での反応を利用3,6 - ジオキサ-1,8 - オクタンジチオール(DODT、182.30グラム/モル)および脱イオン水(18.02グラム/モル)。
- 時計皿で覆ったビーカーに氷の上で400ミリリットルの無水ジエチルエーテルを冷やす。
- 10倍過剰のジエチルエーテルにペプチドを沈殿させ、四の50mlコニカルチューブの中に均一に溶液を分割する。ペプチドを収集するための10分間3200×gで遠心します。
- エーテルをデカントし、新鮮なジエチルエーテル二50メートルの円錐管に分け100mlにペプチドを再懸濁する。 4エーテル洗浄、計二回の新鮮なエーテル50mlに再懸濁、遠心分離プロセスを繰り返します。
注:これは、切断カクテルに使用される化学物質を除去し、固体のペプチドから保護基を切断した。
- エーテルをデカントし、新鮮なジエチルエーテル二50メートルの円錐管に分け100mlにペプチドを再懸濁する。 4エーテル洗浄、計二回の新鮮なエーテル50mlに再懸濁、遠心分離プロセスを繰り返します。
- 最後の遠心分離工程の後、廃棄物等をデカント彼女の、真空下で一晩ペプチドを乾燥させます。
4。ペプチド機能化のキャラクタリゼーション
- ペプチドサンプルのMALDI-ToF型分析のための溶媒としてアセトニトリル(41.05グラム/モル)+ 0.1%TFA:50:50 H 2 Oを使用する。少量のサンプル置き - 1.5mlのエッペンドルフチューブ中のペプチドの(1,2 mg)をMALDIおよび溶媒1mlの試料を溶解する。
- マトリックス溶液を調製する。一般的に用いられるマトリックスは、マトリックスとしてα-シアノ-4 - ヒドロキシ桂皮酸(CHCA、189.2グラム/モル)である。ストック基質溶液を形成し、MALDI溶媒中の10 mg / mlのマトリックスを溶解する。
注意:マトリックスストック溶液は、追加の分析のために最大1週間室温で保存することができる。 - 1:1の比率で、ペプチドとマトリックス溶液を兼ね備えています。 1μL/スポットを追加し、MALDIサンプルプレート上の3つの別々の場所に、この統合ソリューションを見つける。
- 空気乾燥により、またはヒートガンを使用するか、スポットを乾燥する。 Respotとドライそれぞれサンプル。
注意:Respotting、より均一なペプチド/マトリックス試料を生成し、明確な信号を得るのに役立つ。標準的なペプチド混合物は、また1:1の比でマトリックス溶液と組み合わせることとMALDIプレート上に(一度だけ)スポッティングする必要があります。
- 空気乾燥により、またはヒートガンを使用するか、スポットを乾燥する。 Respotとドライそれぞれサンプル。
- MALDI-TOFデータを収集。によりペプチドのN末端にメタクリル基の付加に、ペプチド単独分子のそれ以上の分子量が68グラム/モルの増加があるはずです。
注:PEGDM合成とは異なり、反応性側鎖を有するアミノ酸上の保護基が除去されるように、切断時のペプチドは、refunctionalizedすることができず、N-末端の選択的官能化はもはや保証することができない。- MALDI分析( 図5)は 、ペプチドが正しく官能化されたことを示し、全ての保護基が適切に切断された場合、ペプチドは、(水に対して、水中で)透析し、リムーバブル凍結乾燥によって回収することができるE残留汚染物(切断カクテル、エーテルなどの保護基切断される)。固体ペプチドは、小エッペンドルフチューブに移し、-20℃で使用するまで保存すべきである。
結果
各スペクトルのピークの下の面積は、製品及び反応物の比率の決定を可能にする、試料中のプロトンの相対的なレベルに比例するように、プロトン核磁気共鳴は、化学反応の効率を評価するための最も一般的な分析技術の一つであるサンプル中に。末端メタクリレートプロトンの理論比(a、b及びc)(d)の中央のPEGプロトンた:この反応のために、1 H-NMR分析( 図4)から観察%の官能化を計算するために使用することができる。 図4に示すPEGDMは、従来官能2,000 Daであったのではn = 2,000 Daの/(44ダ/ PEGリピート)= 45.5、これはd = 4 *(n-1)個= 178、プロトンを製造する:NMRユニット比178 / 102.16 = 1.74。試料中の水の存在は人為的にピーク下の面積を増加させるように、この場合、%の官能評価に使用することができないピーク。ピークbを用い、%の官能化は1.00 * 1.74 / 2 * 100%= 87.1%であり;ボイジャーグラムピークcは、%の官能化は94.1%= 1.08 * 1.74 / 2 * 100%である。したがって、全体の%の官能化は91%であり、これは十分にPEGDMハイドロゲル合成における使用のために官能化される。一般的には、約90%の官能化はメタクリル化の単一のラウンド後に達成される。
によるペプチドの1 H-NMR分析で発生するプロトンピークの多数のために、ペプチドの官能化はより容易にMALDI-ToF型質量分析法を用いて調べた。これは、ペプチドを合成しGKRGDSG官能化メタクリルアミドに供した図5に示されている。ペプチドの小部分は、ペプチド配列の正確な合成を示す、ペプチドの予想される分子量676 g /モルで発生する観察された分子量のピークを示したprefunctionalization分子量の評価( 図5A)、のために切断した。ペプチドの残りの部分は、メタクリル機能受け前切断にブリダイゼーション。このペプチドはPbfでは、Rの保護アミノ酸を含んでいるので、切断は、4時間チオアニソールを含有するカクテルで行った。メタクリルアミド官能化した後、観察された分子量ピーク744 g /モル( 図5B)で起こる、メタクリル官能化ペプチド(676 68グラム/モル)との予想される量は、官能化されていないペプチドの予想分子量で、正しい示していない機能化。
PEGおよびメタクリル官能化ペプチドの両方の機能性を実証するために、PEGDMハイドロゲルはmmとし、0.5なしで生産されたGKRGDSG( 図6)官能基化メタクリル。ヒドロゲルは光開始剤として0.05重量%のリチウムフェニル-2,4,6 - trimethylbenzoylphosphinate(LAP)と、PBS中の10重量%の直鎖10kDaのPEGDMで製造した。ヒドロゲル前駆体溶液をスライドガラススペーサーによって分離され、バインダークリップで一緒に保持2枚のスライドガラスの間に注入した。前駆体溶液は、その後、8mm直径ゲルを円筒形のパンチを用いて収集した後、架橋を誘導するために10分間、2ミリワット/ cmで365nmのUV光に露光した。ゲルをPBSでリンスし、平衡膨潤条件が達成された16,20を確実にするために2日間膨潤させた。ヒトMSC(継代3)を80%コンフルエントまで増殖させ、15,000細胞/ cm 2でのヒドロゲルに播種した。細胞は、使用して10倍の倍率で0.5μL/ mlのカルセインAMおよび2μL/ mlのエチホモ二量体(Invitrogen社からの生/死生存率キット)を含む新鮮な培地に移して、位相コントラストおよび蛍光の下で画像化される前に48時間付着させたニコンエクリプスTiの2000。 MSCは、官能化されていないのPEGヒドロゲル( 図6A)に付着することができませんでしたが、細胞接着ペプチドRGDを含める際に、彼らはに付着し、ハイドロゲルの表面( 図6B)上に展開することができました。生/死のイメージMSCは、死亡時のゲル表面から剥離し、播種し、細胞生存率の人工的な膨張を生じ、メディア転送プロセスの間に除去される接着依存性細胞であるように、播種されたMSC集団の生存度を表すものではない提示。むしろ、蛍光画像を単独で位相コントラスト下では困難であることができるヒドロゲルトポロジで接着細胞との間の小さな変動画定することを意図している。興味深いことに、nonspread細胞は、細胞が撮影時に死んでされたことを示す、カルセインAMおよびエチジウムホモ両方に陽性に染色PEG専用ゲル上に播種。
PEGヒドロゲルの多くの利点の1つは、高度に調整可能な性質である。 PEGヒドロゲルの具体的な構成を変更すると、研究者にこのような弾性率などの特性を高度に制御を与える。 図7に示すように、PEG分子量( 図7A)および重量百分率(両図7B)は、ヒドロゲルのメッシュサイズ(ξ)と、得られたヒドロゲルの剛性を制御し、カプセル化された薬物の放出速度が知られている。これは、様々な分子量のPEGDMでヒドロゲルを製造し、得られたヒドロゲルの弾性率およびメッシュサイズ( 図8)を調べることにより実証された。すべてのヒドロゲルは光開始剤として0.05重量%のLAPで、PBS中の10重量%の直鎖PEGDMで製造した。ヒドロゲル前駆体溶液40μlを、円筒状の幾何学的形状、直径約5mm、高さ2mmの製造、ヒドロゲルを形成するためのヒント遮断し、10分間、2ミリワット/ cm 2で少なくとも365nmのUV光に暴露で1mlシリンジにあっ。ゲルは、機械的試験の前に2日間、PBS中で膨潤させた。ヒドロゲルの弾性率は、0.1 [mm] /秒の速度で初期のヒドロゲルの高さの5〜10%を圧縮しながら5 Nロードセルを備えMTS QT / 5を用いて決定した。機械的試験が完了した後、メッシュサイズは、ヒドロゲルMASを測定することによって決定したS前(M S)と後(M D)MATLABで実行される計算で、議論のセクションで説明するようフローリー·Rehner方程式を経由して、凍結乾燥の24時間。仮説として、ヒドロゲルのメッシュサイズの増大( 図8A)およびヒドロゲル剛性の低下( 図8B)を起しPEGマクロマーの分子量を増加させる。ヒドロゲルのメッシュサイズおよび得られたゲルの剛性はまた、重量百分率PEGを変えることによって制御することができる。ヒドロゲルは、直鎖状の10kDaのPEGDM重量%、ヒドロゲル剛性とメッシュの大きさを、以前に記載( 図9)のように決定された変化させて作製した。 図7Bに示されたように、増加する重量%PEGはメッシュサイズの有意な減少( 図9A)を引き起こし、ハイドロゲル剛性( 図9B)の増加。
カプセル化されたウシ血清アルブミン(BSA)を含有するヒドロゲルを変えるmoleculaを用いて形成したrは、重量PEG(2,10、および20)を有する。 図6について記載したように、すべてのヒドロゲルは、50μg/ mlのBSAを含有するPBS中の10重量%PEGDMで製造した。ゲルを37℃で1 mlのPBS中でインキュベートし、各時点で新鮮なPBSに移した。リリースBSAは、サーモサイエンティフィックのブラッドフォードアッセイを用いて定量化した。ヒドロゲルのメッシュサイズは、 図8について記載したように決定した。 図7(a)に示すように、BSA放出はヒドロゲル内の大きなメッシュサイズ( 図10)の結果として、より高い分子量のPEGDMを用いて形成されたヒドロゲルからより急速に起こる。
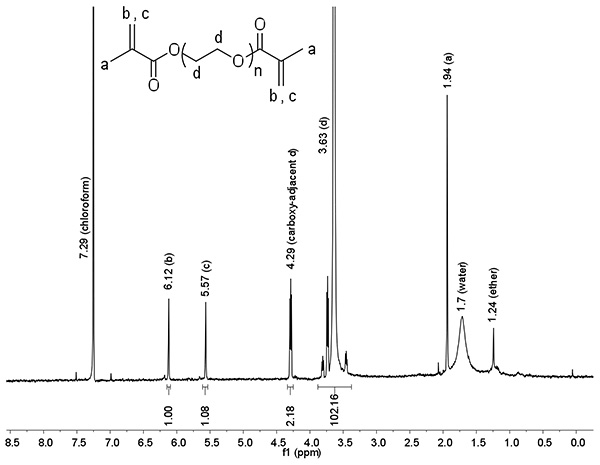
図4。 2 kDaの線形PEGDMの代表的な1 H-NMRは、マイクロ波支援の方法を使用して官能基化。パーセント機能化は、CA可能観察に基づくlculated:中央のPEG陽子(d)の末端メタクリレートプロトン(a、b及びc)の理論比拡大画像を表示するには、ここをクリックしてください 。
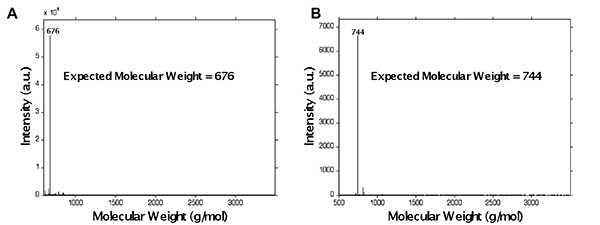
図5。マイクロ波アシスト法を用いて代表的なペプチドGKRGDSG(A)のMALDI-ToF型の前および(B)官能化後 、官能化後の観察された分子量ピーク744 g /モルで起こることメタクリル官能化ペプチドの予想される量を注(676 68グラム/ mol)としない非官能ペプチド(676グラム/モル)の予想される分子量で。 拡大画像を表示するには、ここをクリックしてください 。
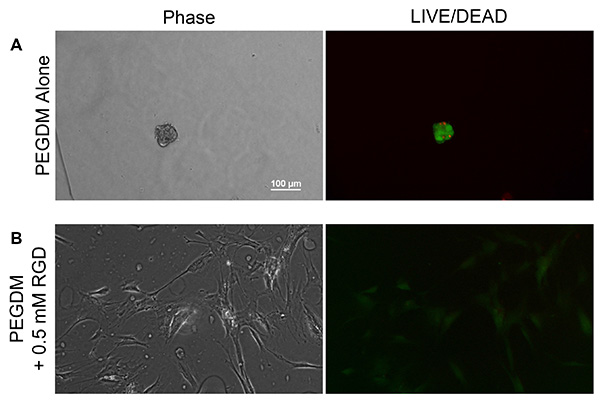
図6。代表位相コントラスト(左)と(緑/赤)DEAD /一人暮らしとB、A)、PEGゲル上で培養MSCの蛍光像(右))0.5ミリ含有するPEGゲルは官能化GKRGDSGをメタクリルアミド。MSCはに付着することができないと上に広げ、一人でPEGDAジェルが、細胞接着ペプチドRGDの取り込みの際に付着し、ハイドロゲルの表面上に広げすることができます。 拡大画像を表示するには、ここをクリックしてください 。
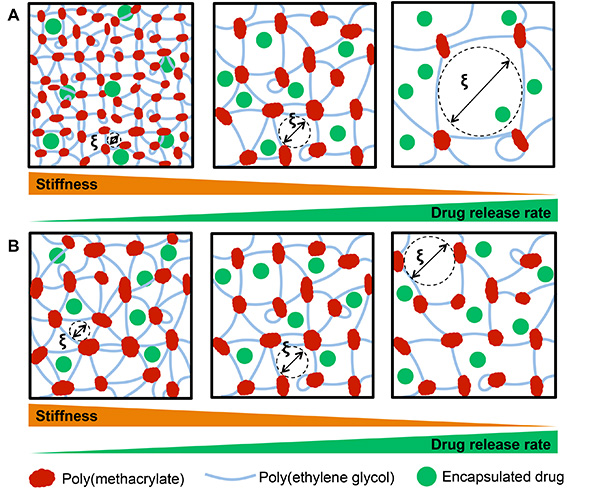
図7。 A)PEGは、ヒドロゲルのネットワークを形成するために使用されるPEGの分子量及びB)の重量百分率は、ヒドロゲルのメッシュサイズに影響を与える(_8 ;)得られたヒドロゲル剛性と封入された薬物の放出速度。A)、一定の重量百分率が増加するヒドロゲルのメッシュサイズで左から右にPEG分子量()の増加ヒドロゲルの剛性を減少させ、薬物放出速度を増加させる。B)の重量を減らす(左から右)PEGの割合はハイドロゲルを形成するために使用され、同様に(正確な縮尺ではない)ハイドロゲルの剛性を減少させ、薬物放出の速度を高め、ハイドロゲルのメッシュサイズが大きくなります。 拡大画像を表示するには、ここをクリックしてください 。

図8。 A)メッシュの大きさが増加し、B)ヒドロゲル剛性がPEGマクロマーの分子量の増加とともに減少する。はn = 10、エラーバー= SEM、*** P<、一方向ANOVAによって0.001 TukeyのHSD事後テストで。すべての統計分析は、プリズム5を用いて行った。 拡大画像を表示するには、ここをクリックしてください 。

図9。 A)増大重量%のPEGを含む)ヒドロゲルの剛性が増加するサイズは減少し、Bメッシュあり、n = 9-10、エラーバー= SEM、**はp <0.01、***はp <0.001テューキーのHSDを有する、一方向ANOVAによる後処理ホックテスト。 拡大画像を表示するには、ここをクリックしてください 。
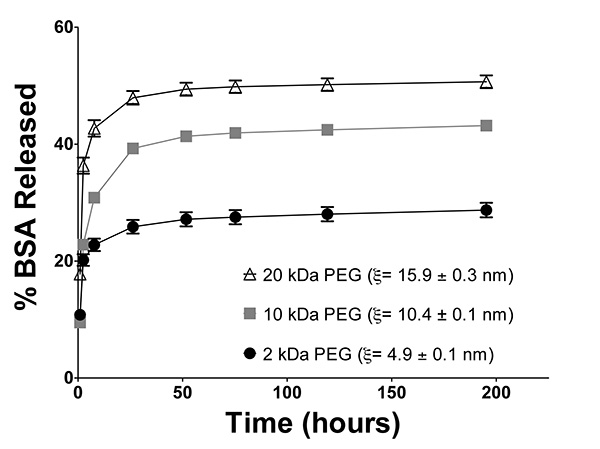
図10。 encaのリリース2 kDaの、10kDaの、20kDaの分子量のPEGを用いて形成されたヒドロゲルからpsulatedモデル薬物ウシ血清アルブミン(BSA)BSAの放出は、ヒドロゲル内の大きなメッシュサイズの結果として、より高い分子量PEGDMを用いて形成されたヒドロゲルからより迅速に起こる。 N = 6、エラーバー= SEM。 2および10 kDaのゲルからの放出は、双方向反復対策ボンフェローニでANOVAにより、同等であるときに放出%のBSAは、T = 1および2.5時間を除く全ての時点で全ての3つの群の間に(p <0.0001)有意に異なる事後テスト。 拡大画像を表示するには、ここをクリックしてください 。
ディスカッション
以前に示された方法は、PEGDMの合成およびペプチドまたは他のアミン含有化合物のメタクリル官能のための非常に貴重である。これらの材料は、次いで、再生医療および薬物送達用途に使用することができる。によるPEGの親水性の性質のために、PEGマクロマーから形成されるヒドロゲルは、本体2内の多くの組織と同様の高い含水量を有する。この品質は、本体3内のPEGがタンパク質吸着に非常に耐性、したがって、不活性になります。しかし、PEGの吸湿性は、機能化の際に面倒な証明することができます。水はメタクリル化手順の間にPEG試料中に存在する場合、無水メタクリル酸、メタクリル酸を生成する水と優先的に反応し、PEGの乏しい官能化をもたらす。
したがって、PEGまたはペプチドの正常なメタクリル化を確実にするために取ることができる最も重要なステップの一つは、無水性を維持することであるラウス反応条件。使用前に、すべてのガラス製品を乾燥させる工程が推奨される水の汚染を防止することを意図している。試料中の水の存在は、1.7 ppmのブロードなピーク( 図4)のように、NMR分析に見ることができる。貧弱なメタクリル化があっても、すべてのガラス容器を乾燥した後に観察される場合、化学物質は、硫酸ナトリウム、又は使用前に他の乾燥剤(モレキュラーシーブなど )で乾燥してもよい。蒸留はまた、使用前に水を除去し、無水メタクリル酸を精製するために使用することができ、共沸蒸留は、PEG 23を乾燥させるために使用することができる。極端な場合には、合成はさらに十分に無水条件を確保するためにグローブボックス中で行うことができる。同じ手順に従い、メタクリル化の第二ラウンドもまた、官能化を高めるために行うことができる。機能化の追加のラウンドが必要になる可能性が常にあるので、お手入れはすぐに真空濾過によってPEGDMを収集するためにステップ1.7および1.9に注意が必要です。絶対に必要以上に長くするための真空ろ過は水の吸着のための機会を増やし、空気にPEGの露出を増加します。
ヒドロキシル官能基へのメタクリル酸無水物のパーセント過剰のPEG前駆体上のPEG官能基化( 例えば腕#)を増加させる、変更されないままにもかかわらず、一般的に達成パーセント官能の減少(未発表の結果、ブノワ·ラボ)に関連付けられています。特定の難しさが十分に高機能を達成発生した場合先制官能化効率のこの減少に対処するために、又は、マイクロ波反応の持続時間を増加させることができる、マイクロ波間隔は30秒に維持されることを条件とする。 10モル過剰は、典型的には十分であるが、反応に使用されるメタクリル酸無水物の量はまた、12パーセントを達成した官能化を高めるために増加させることができる。
ことが重要である追加の沈殿工程(1.9)良いNMRシグナルを達成するために実施さ。それは合成と同じ日2回目の沈殿を行うために魅力的である一方で、再沈殿の前に一晩試料を乾燥して過剰の無水メタクリル酸およびメタクリル酸の除去を助けることが見出されている。サンプル調製はまた、きれいなNMRスペクトルを達成するために重要であるため、サンプルは推奨条件を用いて調製されるべきである。 図4を正しく官能化PEGDMための代表的な1 H-NMRの結果を示す。中央PEGプロトンに末端メタクリレートプロトンの比を分析することによって、PEGDMを十分に官能化することが決定された。 MALDIサンプル調製は、透明読み取りを達成するために同様に重要である。 MALDIは、塩および高いサンプル濃度の存在に特に敏感である。 (高信号と50任意単位(AU)上記強度:ノイズ比)を読み取る明確なMALDIは、IF、試料Sを得ることができないolution、マトリックス溶液と混合し、再分析される前に、MALDI溶媒中で1:100に希釈されるべきである。5が正しいペプチド官能化、切断、およびサンプル調製後の代表的なMALDI-ToF型結果を示す図 。前の官能化( 図5A)に対する樹脂の小さいサンプルの切断は、 図5Bに示されるペプチドの正確なアミド官能有するペプチドGKRGDSGの正確な合成を示す。
樹脂上のペプチドの機能化は比較的堅牢な手順ですが、各シーケンスに必要な切断条件は、多くの場合、チューニングを必要とします。多くのアミノ酸は、側鎖(長> 30アミノ酸、または保護基を有する> 15アミノ酸)を保護している長いシーケンスについては、切断の継続時間が1時間増加されるべきである。切断時間がすぎて延長された場合は、ペプチド結合の切断は、長期的な酸性暴露する可能性があります。 MALDI ANA溶解は、ペプチド合成や分解の際に発生したエラーを明らかにすることに非常に役立ちます。期待分子量以下に観測された減少は、アミノ酸(S)が正常に夫婦、またはそのペプチド分画しなかったことを示すことができます(分子量で一般的に観察された変化の原因については表2を参照)が発生しました。観察された分子量は、使用される保護基の重量の予想よりも高い場合には、切断および脱保護は不十分であり、ペプチドは付加的な時間のために再切断されるべきであると考えられる。
MW変化(g /モル) 24| アミノ酸削除 | MW変化(g /モル) | 切断されていない保護基 | 一般的に存在するイオン | MW変化(g /モル) | |
| 翼 | -71 | アセチル | 42 | CL - | 35 |
| のArg | -158 | アリル | 40 | K + | 39 |
| ASN | -114 | alloc命令 | 85 | の Mg 2 + | |
| ASP | -115 | BOC | 100 | + NA | 23 |
| システイン | -103 | のFmoc | 223 | ||
| GLN | -128 | OtBuを | +56 | ||
| Gluの | -129 | PBF | 252 | ||
| グリシン | -57 | tBuの | +56 | ||
| 彼の | -137 | TRT | 242 | ||
| パリ | -113 | ||||
| レイ | |||||
| リス | -128 | ||||
| MET | -131 | ||||
| 現象 | -147 | ||||
| -97 | |||||
| のSer | -87 | ||||
| THR | -101 | ||||
| TRP | -186 | ||||
| -147 | |||||
| ヴァル | -99 |
表2は、一般的に、ペプチド分子量の変化を観察した。
マイクロ波アシストメタクリル化方法を用いて製造さマクロマーは、再生医療や薬物送達用途で使用することができる。ここで合成された官能化ペプチドおよびPEGDMはまた、ニトロキシド媒介重合(NMP)、原子移動ラジカル重合(ATRP)または可逆ADDIを用いてポリマーに組み込まれ得るのTiONフラグメンテーション移動(RAFT)法24。予めKhetanとバーディック22によってJoveの資料に示されているように、ヒドロゲルのネットワークはまた、細胞の存在下で製造することができる。単独PEGは、いくつかの細胞型25の生存および機能に重要な細胞-材料相互作用を提供しないので、これは多くの場合、例えば、RGDまたは細胞外マトリックス分子としての細胞接着ペプチドの組み込みを必要とする。ペプチドは、例えば、従来の固相ペプチド合成を用いて合成し、ハイドロゲルネットワークへの組み込みを可能にするために、ここに記載されるように官能化することができる。 図6に見られるように、ヒドロゲル中のメタクリル官能化細胞接着ペプチドGK RGDS Gの包含(0.5 mM)を付着し、拡散細胞の数を増加させる、PEGヒドロゲル表面にヒト間葉系幹細胞(MSC)の接着を容易にする( 図6B )、PEGヒドロゲルと比較して細胞接着ペプチドなし( 図6A)。しかし、これまでの研究は、物質 - 細胞間相互作用をさらにペプチド - インテグリン立体障害を低減するために、接着剤ペプチドおよびハイドロゲルネットワークの間の3,400 DaのPEGスペーサーを含めることによって強化されていることを実証した。スペーサーを含むことなく、細胞がなく、ペプチド26とインテグリン仲介相互作用を介してではなく、ペプチドに吸着非特異的タンパク質を介したPEGヒドロゲルと対話することができる。鷺とハッベル26で説明したように、このPEGスペーサーを組み込み、非特異的な相互作用を避けるために、ペプチドは、N-ヒドロキシスクシンイミジルエステルを介して活性化されたPEGの単官能化するためにコンジュゲートさせることができる。
ハイドロゲルネットワークのアプリケーションでは、材料特性を厳密に制御を必要とする。 PEGヒドロゲルへの重要な利点は、これらの特性を高度に制御される。例えば、分子量、アーム番号、およびPEGの重量%のヒドロゲルネットワークの形成に用いられる微酒樽に変更することができる特定のアプリケーションのための電子特性。これはハイドロゲル膨潤率(Q)と剛性(弾性率、E)を制御ハイドロメッシュサイズ(ξ)、を厳格に管理することができます。これは、 図7Aに示され、 図8に定量化されるヒドロゲルのメッシュサイズの増大( 図8A)およびハイドロゲル剛性( 図8B)の減少をPEGマクロマーの分子量を増加させる結果。
これらのヒドロゲルのネットワーク内のバルク動作を制御し、基礎となる物理的特性は、メッシュサイズは、フローリー-Rehnerの式16を使用して計算される。この計算を実行するには、体積膨潤率(Q)は、まず、式4から計算される。  (4)
(4)
ρsは水の密度(1グラム/ ml)であり、ρpは PEGの密度である(1.12グラム/ミリリットル)、M、Sは、ヒドロゲルの腫れ質量であり、M Dは 、多くの場合、凍結およびハイドロゲルの凍結乾燥後に測定された含水ゲル()の乾燥質量である。架橋間分子量(g /モルでM c は 、)次いで、式5から計算される。  (5)
(5)
M はN(g /モル)でPEGの数平均MWであり、  ポリマーの比体積である
ポリマーの比体積である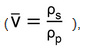 、V 1、V 2は、ヒドロゲルの平衡ポリマー体積分の水のモル体積(18ミリリットル/モル)である
、V 1、V 2は、ヒドロゲルの平衡ポリマー体積分の水のモル体積(18ミリリットル/モル)である
( 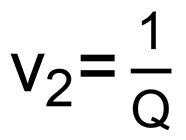 )であり、X 1 PEGおよび水(0.426)16用のポリマー-溶媒相互作用パラメータである。架橋間の結合の数(n)は次いで、式(6)から計算される。
)であり、X 1 PEGおよび水(0.426)16用のポリマー-溶媒相互作用パラメータである。架橋間の結合の数(n)は次いで、式(6)から計算される。 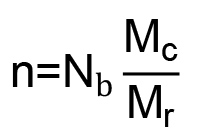 (6)
(6)
N bは PEG反復における結合の数である(3)およびM rは PEG反復(44 g /モル)の27 MWである。これは、ポリマー鎖の二乗平均平方根のエンドツーエンドの距離ができ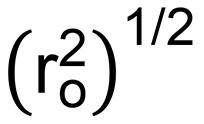 (NMに)式(7)から計算される:
(NMに)式(7)から計算される:  (7)
(7)
Lは、(C-CとCO結合長に基づいて計算さ0.146ナノメートル)の平均結合長であり、C nは、ポリマー(PEG用4.0)28の特徴的な比である。 Fiのナリー、ハイドロゲルの網目の大きさは、式(8)から計算することができます。 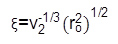 (8)
(8)
ヒドロゲルの特性は、同様に、ヒドロゲルの形成に使用されるPEGの量を調整することによって調整することができる。続いてヒドロゲルの剛性を低下させるヒドロゲルのメッシュサイズの増加PEGマクロマー結果の重量百分率を減少させる。 図7Bに示し、 図9は、PEGの重量パーセントは、メッシュサイズを制御するために使用することができるヒドロゲルの形成に用いられる方法の定量化( 図9A)そして得られたハイドロゲル剛性( 図9(b))。基板の剛性は、幹細胞の分化29などの細胞挙動に影響を及ぼすことが示されているように、しっかりと剛性を制御する能力は、ヒドロゲルの製造において重要な特性である。
ヒドロゲルはまたCONTRに使用することができるOL薬物送達。 図7Aに示され、 図10に示すように、PEGマクロマーの分子量を増加させると、その後にカプセル化されたモデル薬物、ウシ血清アルブミン(BSA)の放出を増加させる、ヒドロゲル網状のメッシュサイズを増大させる。この研究におけるヒドロゲルサンプルを、メッシュサイズ計算のためのヒドロゲル湿潤および乾燥質量の測定を可能にするためにはt = 195時間で破壊されたが、試料は、より長い時間にわたってインキュベートしたBSAの放出が起こる続け我々の経験である。他の基はまた、BSAはPEGヒドロゲルネットワーク30内の拡散に対する耐性があることを報告しているように、図10で観察されたBSAの不完全な放出は、予想外ではない。カプセル化された蛋白質の不完全な放出は、タンパク質およびPEGマクロマー、又はPEG BSA及び31のリジン残基上の一級アミン基上のメタクリレート基の間の共有結合間の水素結合に発生することができ。また、BSAはその有効ストークス半径を大きくし、ヒドロゲルからのその放出を妨げることができ、経時的な凝集およびジスルフィド結合形成する傾向がある。これらのようPEGDMヒドロゲル等の鎖成長ヒドロゲルは、ネットワーク非理想および異種ヒドロゲルのメッシュサイズ( 図2A)の傾向があるように、カプセル化されたBSAの画分は有意に小さいメッシュを有するヒドロゲルの領域に含まれていることも可能であるその放出を防ぐゲル内全体の平均よりもサイズ。カプセル化されたBSAの不完全、nonFickian放出が(データは示さず)、この場合に観察されたが、インスリンおよびオボアルブミンを含む多数の他のモデル薬物の制御されたフィックの放出は、同様のPEGDM 30ヒドロゲルを用いて実証されている。さらに、ワトキンスとAnsethは、同様のハイドロゲルからの蛍光分子の放出を実証するために、共焦点レーザー走査顕微鏡を使用していたフィックの拡散私と一緒に許容可能にモデル化されているthods 32。
本研究で形成されたヒドロゲルは非分解性である一方、ネットワークの性能低下はに組み込まれ、これらのネットワーク内で調整することができ、別のパラメータである。制御されたヒドロゲルの分解のために提供することは、細胞の挙動33、組織成長または宿主組織の内部成長の促進、又は外植34の必要性の排除の変化をもたらすことができる。分解性PEGヒドロゲルは、一般に35をメタクリル化する前にPEG内のヒドロキシル基への開環加水分解的に分解のd、l-ラクチド、グリコリドまたはε-カプロラクトン基により合成される。これらの3つのグループがグリコエステルは、それらの様々な疎水性のため、最大のラクチド続い劣化に対する感受性、およびカプロラクトンエステルを持つ、エステル官能の加水分解によって劣化する。加水分解により分解可能な基の導入後は、PEGはさらにメタクリル化手順detaileを使用して官能化することができるその後のラジカル開始連鎖重合36,37を通してハイドロゲルネットワークの形成を可能にするこの記事のD、。ヒドロゲルネットワークの分解速度は、加水分解性基(グリコリド、ラクチド等 )の同一性を変化させることにより、構造体35,38に組み込まれた分解性リピートの数を変えることによって制御することができる。
理論的には、ここで示す方法は、それぞれステップ1.3および3.3に無水アクリル酸とメタクリル酸無水物を置き換えることによりPEGおよびペプチドのアクリル化を使用することができる。しかし、アクリル酸無水物は、マイクロ波支援メタクリル化よりもマイクロ波支援アクリル化が大幅に少なく魅力、メタクリル酸無水物39,40の20倍以上のコストである。
我々は、この手順の効率を評価する方法を、PEGおよびペプチドを官能化する、シンプルで迅速な方法を実証し、そしてUのためのリソースを与えているハイドロゲルネットワークを形成するために合成された材料を歌う。これらの合成ツールは、その用途において非常に汎用性があり、薬物送達や材料研究所、任意の数のステープルを証明する必要があります。
開示事項
著者は、彼らが競合する経済的利益を持っていないことを宣言します。
謝辞
この作品は、ロチェスター大学や整形外科研究教育財団/筋骨格系移植財団(OREF /博士ダニエルブノワに提供スタートアップ資金によって、ハワード·ヒューズマックへ - グラッドフェローシップ(AVH)によって部分的に資金を供給されたMTF)。著者は彼の設備の使用のために博士ジェームズ·L·マクグラスに感謝したいと思います。
資料
| Name | Company | Catalog Number | Comments |
| 3,6-Dioxa-1,8-octanedithiol | Tokyo Chemical Industry Co, LTD | D2649 | CAS 14970-87-7 |
| Acetonitrile | J.T. Baker | UN1648 | CAS 75-05-8 |
| Amino Acids | AAPPTech | Glycine: AFG101 | CAS 29022-11-5 |
| Arginine: AFR105 | CAS 154445-77-9 | ||
| Asparagine: AFD105 | CAS 71989-14-5 | ||
| Serine: AFS105 | CAS 71989-33-8 | ||
| Anhydrous diethyl ether | Fisher Scientific | UN1155 | CAS 60-29-7 |
| Citric acid | Sigma Aldrich | C1857 | CAS 77-92-9 |
| Deuterated chloroform | Cambridge Isotope Laboratories Inc. | DLM-7-100 | CAS 865-49-6 |
| Dichloromethane | Fisher Scientific | UN1593 | CAS 75-09-2 |
| Diisopropylethylamine | Alfa Aesar | A1181 | CAS 7087-68-5 |
| Dimethylformamide | Fisher Scientific | D119-4 | CAS 68-12-2 |
| Fmoc-Gly-Wang resin | Peptides International | RGF-1301-PI | 100-200 mesh size |
| Methacrylic anhydride | Alfa Aesar | L14357 | CAS 760-93-0 |
| N-Methylpyrrolidone | VWR | BDH1141-4LG | CAS 872-80-4 |
| On-resin peptides | Synthesized in-house | On-resin peptides can also be purchased from Peptides International, GenScript, AAPPTec, etc. | |
| O-Benzotriazole-N,N,N’,N’-tetramethyl-uronium-hexafluoro-phosphate | AnaSpec Inc | 510/791-9560 | CAS 94790-37-1 |
| Peptide Calibration Standard | Care | 206195 | |
| Piperazine | Alfa Aesar | A15019 | CAS 11-85-0 |
| Poly(ethylene glycol) 2 kDa linear | Alfa Aesar | B22181 | CAS 25322-68-3 |
| Poly(ethylene glycol) 10 kDa linear | Alfa Aesar | B21955 | |
| Poly(ethylene glycol) 20 kDa linear | Sigma Aldrich | 81300 | JenKem Technologies USA is an alternate supplier of linear and multi-arm PEG |
| Thioanisole | Alfa Aesar | L5464 | CAS 100-68-5 |
| Trifluoroacetic acid | Alfa Aesar | A12198 | CAS 76-05-1 |
| Triisopropylsilane | Alfa Aesar | L09585 | CAS 6485-79-6 |
| α-Cyano-4-hydroxycinnamic acid | Tokyo Chemical Industry Co, LTD | C1768 | CAS 28166-41-8 |
参考文献
- Lin, C. C., Anseth, K. S. PEG Hydrogels for the Controlled Release of Biomolecules in Regenerative Medicine. Pharm. Res. 26, 631-643 (2009).
- Ifkovits, J. L., Burdick, J. A. Review: Photopolymerizable and degradable biomaterials for tissue engineering applications. Tissue Eng. 13, 2369-2385 (2007).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in biology and medicine: From molecular principles to bionanotechnology. Adv. Mater. 18, 1345-1360 (2006).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat. Biotechnol. 23, 47-55 (2005).
- Benoit, D. S., Durney, A. R., Anseth, K. S. The effect of heparin-functionalized PEG hydrogels on three-dimensional human mesenchymal stem cell osteogenic differentiation. Biomaterials. 28, 66-77 (2007).
- Benoit, D. S., Collins, S. D., Anseth, K. S. Multifunctional hydrogels that promote osteogenic human mesenchymal stem cell differentiation through stimulation and sequestering of bone morphogenic protein 2. Adv. Funct. Mater. 17, 2085-2093 (2007).
- Fairbanks, B. D., et al. A Versatile Synthetic Extracellular Matrix Mimic via Thiol-Norbornene Photopolymerization. Adv. Mater. 21, 5005 (2009).
- Moon, J. J., Hahn, M. S., Kim, I., Nsiah, B. A., West, J. L. Micropatterning of Poly(Ethylene Glycol) Diacrylate Hydrogels with Biomolecules to Regulate and Guide Endothelial Morphogenesis. Tissue Eng. A. 15, 579-585 (2009).
- Burdick, J. A., Anseth, K. S. Photoencapsulation of osteoblasts in injectable RGD-modified PEG hydrogels for bone tissue engineering. Biomaterials. 23, 4315-4323 (2002).
- Yanez-Soto, B., Liliensiek, S. J., Murphy, C. J., Nealey, P. F. Biochemically and topographically engineered poly(ethylene glycol) diacrylate hydrogels with biomimetic characteristics as substrates for human corneal epithelial cells. J. Biomed. Mater. Res. A. 101A, 1184-1194 (2013).
- Benoit, D. S. W., Anseth, K. S. Heparin functionalized PEG gels that modulate protein adsorption for hMSC adhesion and differentiation. Acta Biomater. 1, 461-470 (2005).
- Lin-Gibson, S., et al. Synthesis and characterization of PEG dimethacrylates and their hydrogels. Biomacromolecules. 5, 1280-1287 (2004).
- Anseth, K. S., Wang, C. M., Bowman, C. N. Reaction Behavior and Kinetic Constants for Photopolymerizations of Multi(Meth)Acrylate Monomers. Polymer. 35 (94), 3243-3250 (1994).
- Bencherif, S. A., et al. End-group effects on the properties of PEG-co-PGA hydrogels. Acta Biomater. 5, 1872-1883 (1016).
- Rydholm, A. E., Bowman, C. N., Anseth, K. S. Degradable thiol-acrylate photopolymers: polymerization and degradation behavior of an in situ forming biomaterial. Biomaterials. 26, 4495-4506 (2005).
- Zustiak, S. P., Leach, J. B. Hydrolytically Degradable Poly(Ethylene Glycol) Hydrogel Scaffolds with Tunable Degradation and Mechanical Properties. Biomacromolecules. 11, 1348-1357 (2010).
- Malkoch, M., et al. Synthesis of well-defined hydrogel networks using Click chemistry. Chem. Commun. , 2774-2776 (2006).
- Hoffman, M. D., Benoit, D. S. Emerging Ideas: Engineering the Periosteum: Revitalizing Allografts by Mimicking Autograft. , (2012).
- Hoffman, M. D., Xie, C., Zhang, X., Benoit, D. S. The effect of mesenchymal stem cells delivered via hydrogel-based tissue engineered periosteum on bone allograft healing. Biomaterials. , (2013).
- Hubbell, J. A., Lutolf, M. P., Raeber, G. P., Zisch, A. H., Tirelli, N. Cell-responsive synthetic hydrogels. Adv. Mater. 15, 888-892 (2003).
- Lidstrom, P., Tierney, J., Wathey, B., Westman, J. Microwave assisted organic synthesis - a review. Tetrahedron. 57, 9225-9283 (2001).
- Khetan, S., Burdick, J. Cellular encapsulation in 3D hydrogels for tissue engineering. J. Vis. Exp. (32), e1590 (2009).
- Antonios, M., Kurtis, K., Lucas, K. Drying poly(ethylene glycol). Nat. Protoc. Exchange. , (2012).
- Nicolas, J., Mantovani, G., Haddleton, D. M. Living radical polymerization as a tool for the synthesis of polymer-protein/peptide bioconjugates. Macromol. Rapid Comm. 28, 1083-1111 (2007).
- Nuttelman, C. R., Benoit, D. S. W., Tripodi, M. C., Anseth, K. S. The effect of ethylene glycol methacrylate phosphate in PEG hydrogels on mineralization and viability of encapsulated hMSCs. Biomaterials. 27, 1377-1386 (2006).
- Hern, D. L., Hubbell, J. A. Incorporation of adhesion peptides into nonadhesive hydrogels useful for tissue resurfacing. J. Biomed. Mater. Res. 39, 266-276 (1998).
- Andreopoulos, F. M., Beckman, E. J., Russell, A. J. Light-induced tailoring of PEG-hydrogel properties. Biomaterials. 19, 1343-1352 (1998).
- Merrill, E. W., Dennison, K. A., Sung, C. Partitioning and Diffusion of Solutes in Hydrogels of Poly(Ethylene Oxide). Biomaterials. 14, 1117-1126 (1993).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126, 677-689 (2006).
- Weber, L. M., Lopez, C. G., Anseth, K. S. Effects of PEG hydrogel crosslinking density on protein diffusion and encapsulated islet survival and function. J. Biomed. Mater. Res. A. 90A, 720-729 (2009).
- Mellott, M. B., Searcy, K., Pishko, M. V. Release of protein from highly cross-linked hydrogels of poly(ethylene glycol) diacrylate fabricated by UV polymerization. Biomaterials. 22, 929-941 (2001).
- Watkins, A. W., Anseth, K. S. Investigation of molecular transport and distributions in poly(ethylene glycol) hydrogels with confocal laser scanning microscopy. Macromolecules. 38, 1326-1334 (2005).
- Anseth, K. S., Benoit, D. S. W., Durney, A. R. Manipulations in hydrogel degradation behavior enhance osteoblast function and mineralized tissue formation. Tissue Eng. 12, 1663-1673 (2006).
- Hillwest, J. L., et al. Prevention of Postoperative Adhesions in the Rat by in-Situ Photopolymerization of Bioresorbable Hydrogel Barriers. Obstet. Gynecol. 83, 59-64 (1994).
- Sawhney, A. S., Pathak, C. P., Hubbell, J. A. Bioerodible Hydrogels Based on Photopolymerized Poly(Ethylene Glycol)-Co-Poly(Alpha-Hydroxy Acid) Diacrylate Macromers. Macromolecules. 26, 581-587 (1993).
- Skaalure, S. C., Milligan, I. L., Bryant, S. J. Age impacts extracellular matrix metabolism in chondrocytes encapsulated in degradable hydrogels. Biomed. Mater. 7, 024111-0210 (2012).
- Hoffman, M. D., Benoit, D. S. Agonism of Wnt-beta-catenin signalling promotes mesenchymal stem cell (MSC) expansion. J. Tissue. Eng. Regen. Med. , (2013).
- Sawhney, A. S., Pathak, C. P., Vanrensburg, J. J., Dunn, R. C., Hubbell, J. A. Optimization of Photopolymerized Bioerodible Hydrogel Properties for Adhesion Prevention. J. Biomed. Mater. Res. 28, 831-838 (1994).
- . Methacrylic Anhydride [Internet] Available from: https://us.vwr.com/store/catalog/product.jsp?catalog_number=AAAL14357-18 (2013)
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved