Method Article
Микроволновая печь-помощь Функционализация поли (этиленгликоль) и On-смолы пептиды для использования в цепных полимеризации и гидрогеля формирования
В этой статье
Резюме
Это видео будет показан быстрый, эффективный метод диметакрилатные поли (этиленгликоль), что позволяет цепи полимеризации и синтеза гидрогеля. Это продемонстрирует, как же ввести метакриламида функциональные в пептиды, подробно общих аналитических методов для оценки эффективности функционализирующее, представить предложения по устранению неполадок и усовершенствованных модификаций, а также продемонстрировать типичные методы гидрогель характеризации.
Аннотация
Одним из основных преимуществ в использовании поли (этиленгликоль) (ПЭГ) макромеров в формировании гидрогель синтетический универсальность. Способность использовать с большим разнообразием ПЭГ молекулярными весами и конфигураций (количество рука, рука длину и шаблон ветвления) дает исследователей жесткий контроль над Полученный гидрогель структуры и свойств, в том числе модуля Юнга и размером ячеек. Это видео будет показан быстрый, эффективный, без растворителя, с помощью микроволн метод диметакрилатные предшественники колышек в поли (этиленгликоль) диметакрилата (PEGDM). Этот синтетический метод обеспечивает столь необходимые исходные материалы для приложений для доставки лекарств и регенеративной медицины. Продемонстрировал метод лучше с традиционными методами methacrylation как это значительно быстрее и проще, а также более экономичным и экологически чистым, использование меньших количеств реагентов и растворителей. Мы также демонстрируют адаптацию этой техники для по-смолы methacrиламид функционализации пептидов. Этот метод на-смолы позволяет N-конец пептидов, которые будут функционализирован метакриламида групп до снятия защиты и отщепления от смолы. Это позволяет для селективного добавлением метакриламид групп на N-концах пептидов в то время как аминокислоты с реакционноспособными боковыми группами (например, первичным амином лизина, первичного спирта серина, вторичных спиртов треонина и тирозина фенола) остаются защищенными, предотвращая функционализации на нескольких площадках. В этой статье мы подробно общие аналитические методы (протон спектроскопии ядерного магнитного резонанса (, H-ЯМР) и Матрица лазерной десорбцией ионизации Время полета масс-спектрометрии (MALDI-TOF)) для оценки эффективности функционализации. Общие ловушки и предложил способы устранения неполадок будет решаться, как будет модификаций техники, которая может быть использована для дальнейшего функциональности настроиться макромера и в результате гидрогеля физические и химическиесвойства. Использование синтезированных продуктов для формирования гидрогелей для доставки лекарств и исследований взаимодействия клеток-материал будет продемонстрировано, при этом особое внимание уделяется модификации композиции гидрогеля повлиять ячеи, контролируя гидрогеля жесткость и высвобождение лекарственного средства.
Введение
Поли (этиленгликоль) (ПЭГ) гидрогели являются общими биоматериалы, используемые в регенеративной медицине и доставки лекарственных применений 1-3. Эти гидрогели имеют значительные преимущества по сравнению с другими биоматериалов. PEG гидрогели являются синтетическими, предлагая высокую степень контроля над инженерных свойств, таких как модуль упругости и скорости деградации по сравнению с их природными биоматериала коллегами 1. Как они синтетическим путем, ПЭГ имеет значительно меньше от партии к партии изменчивость по сравнению естественно-производных материалов 4. Вследствие химического состава ПЭГ, эти гидрогели высокой гидрофильностью, устойчивый к адсорбции белка, и биосовместимый 3. Это сопротивление адсорбции белка позволяет ПЭГ гидрогели выступать в качестве "чистого листа", что позволит исследователям допросить и изучать специфические биологические или химические факторы (лекарства, биомолекулы, клеточной адгезии пептиды и т.д.) и конкретные роли этих фактоRS играть в борьбе ячейку и / или поведение ткани.
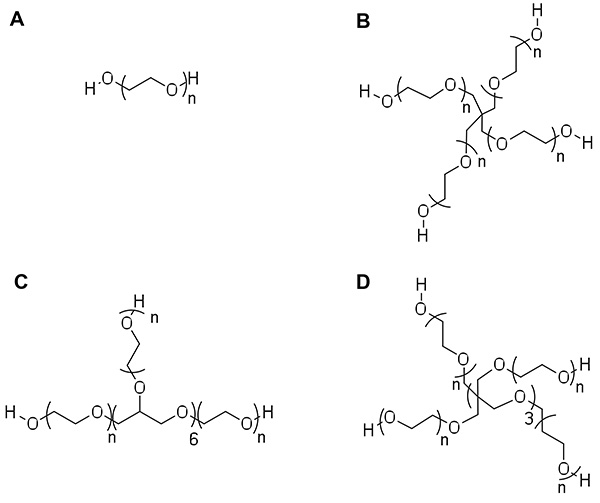
Нажмите здесь, чтобы увеличить изображение .
Рисунок 1: Примеры поли (этиленгликоль) (ПЭГ) архитектур) Линейный ПЭГ B) 4-рука ПЭГ с пентаэритрита сердечник C) 8-рука ПЭГ с ядром гексаглицерин D) 8-рука ПЭГ с.... трипентаэритрит ядро. п-число ПЭГ повторяется на каждой руке. Каждый повтор имеет молекулярную массу 44 г / моль, поэтому п могут быть рассчитаны от общего молекулярного веса и структура / ARM #.
Предшественники ПЭГ доступны с различными архитектурами и молекулярных масс (Рисунок 1 ). Варьирование архитектуры (рука #) и этиленгликоль повторы (п) ПЭГ может быть использована для контроля свойств гидрогеля сетей, образованные из этих макромеров. Немодифицированного ПЭГ содержит концевыми гидроксильными группами, которые должны быть заменены альтернативном функциональности, чтобы облегчить ковалентной сшивки с помощью полимеризации, наиболее часто используемого сшивающего стратегии ПЭГ гидрогелей, до образования гидрогеля сетей. Существуют разнообразные химические группы, которые могут быть включены в ПЭГ макромеров, чтобы облегчить полимеризации и сшивки сети (акрилат, метакрилат, виниловый эфир, норборнен и т.д.). Несмотря на разнообразие терминальных функциональных групп, доступных для облегчения сшивания, есть только две механизмы, посредством которых могут возникнуть полимеризация: шаг и с ростом цепи (или смесь из двух, смешанном режиме).
g2.jpg "ширина =" 600px "/>
Нажмите здесь, чтобы увеличить изображение .
Результаты Теоретическая гидрогель сеть схематическое A) Традиционные Результаты полимеризации с ростом цепи в гетерогенных сетях, содержащих плотный поли (метакрил) сшивания регионы и увеличение сети неидеальностей например циклы, не вступивших в реакцию прекурсоров, а также постоянных заграждений B) Шаг роста полимеризации в: Рисунок 2.. значительно более однородные сетевые структуры (не в масштабе).
Функциональные которая затвердевает через полимеризации с ростом цепи не требуют присутствия дополнительного сшивающего агента. Тем не менее, цепные-полимеризации гидрогели производить гетерогенные сетевые структуры, содержащие плотные сшивания регионы (рис. 2A) 1. В противоположность этому, ступенчатой полимеризации requiотс использование сшивающего агента или со-мономера, который может вступать в реакцию с концевыми функциональными группами макромеров ПЭГ. Как концевые функциональные группы на ПЭГ может реагировать только с сшивающего агента и сшивающий агент могут реагировать только с концевыми функциональными группами на вешалке, это приводит к большей однородности структуры сети (рис. 2В) 1. Полимеризацию ступенчатой также обычно приводит к более высокой конверсии функциональных групп, уменьшая количество непрореагировавших предшественников и потенциал для иммунных / воспалительных реакций за счет растворимых некорпорированных макромеров 1. Способы полимеризации смешанном режиме были также разработаны, что сочетать полимеризации шаг и цепи роста за счет использования макромеров, которые могут как самостоятельно реагировать (цепной рост) и вступают в реакцию с сшивающего агента (ступенчатой). Это приводит гидрогели с характеристиками каждого механизма полимеризации, и может быть использован для получения более сложные, разнообразные сетевые структуры, чем любойшаг или в одиночку 1 сети с ростом цепи.
Хотя существует множество функциональных групп, которые могут быть использованы для функционализации ПЭГ и способствовать образованию гидрогеля, метакрилаты и норборнены некоторые из наиболее распространенных фрагментов полимеризации цепи и шаг роста, соответственно. Оба эти функциональные возможности обеспечивают превосходную пространственно-временной контроль над сетевой полимеризации, и, когда используется для инкапсуляции клеток, эти сети поддерживают высокий общий живучести клетка 5-7. Диметакрилат функционализованный ПЭГ (PEGDM) поперечных связей через цепной полимеризации и позволяет вносить биомолекул или других факторов через сополимеризации с акрилата-, метакрилатных-или же функциональными биомолекул 5,6. PEGDM гидрогели имеют значительные преимущества по сравнению с альтернативными системами полимеризации с ростом цепи, такие как акрилат функционализированного ПЭГ (PEGDA). Использование традиционных методов, PEGDA могут быть синтезированы быстрее, чем PEGDM; хогим, используя с помощью микроволн синтез, синтез PEGDM является еще более эффективным. PEGDA часто синтезированы в течение ночи 8 или 24-часовой 9 реакций, но также могут быть синтезированы в течение четырех часов при повышенных температурах 10. PEGDM также традиционно синтезированы путем взаимодействия в течение ночи 11 или в течение 24 ч 5, при этом некоторые методы увеличении продолжительности времени реакции 4 суток 12. Использование с помощью микроволн метод продемонстрировали здесь, PEGDM могут быть получены в реакции 5 мин. В то время как PEGDM имеет более медленную кинетику реакции, чем PEGDA 13, реакция сшивания для PEGDM по-прежнему быстро, происходит в течение нескольких минут, а конверсии достигает большей, чем макромера PEGDA как увеличение гидрофобности метакрилата группы увеличивает функциональную группу агрегации в растворе, тем самым увеличивая вероятность радикальная передача и метакрилат преобразования 14. PEGDM гидрогели также связаны с повышенным жизнеспособности клеток и роста, каксравнению с PEGDA гидрогели, вероятно, связано с уменьшением скорости реакции в любой момент времени, что снижает концентрацию радикала и непрореагировавший макромеры, присутствующих 14. Тиол-ен полимеризации, такие как те, которые используют норборнен с функциональными ПЭГ (PEGN) Форма гидрогели с помощью ступенчатой полимеризации, и требуют использования PEGN и сшивающий агент, которые содержат в среднем более двух функциональных групп. Поскольку тиильных радикалы реагируют с норборнена углерод-углеродных двойных связей, мульти-тиолсодержащие сшивающие агенты обычно используются для сшивания PEGN гидрогели, что позволяет легкому включения пептидов с цистеин аминокислоты функциональными 7. Хотя существуют многочисленные другие химические которые реагируют с помощью ступенчатой полимеризации (Michael-аддитивные реакции, такие как тиол-акрилата 15 и тиол-винилсульфона 16, "нажмите кнопку" реакции, такие как азид алкина-17 и т.д.), тиол-норборнен гидрогели очень часто, так как из штамманорборнен кольцо значительно увеличивает скорость реакции и уменьшает шансы на норборненового двойной цепи Проходят облигаций полимеризации 7.
Решение между метакрилат, норборнен, или альтернативной функционализации для облегчения гидрогеля образование в значительной степени основана на подходе. Например, с ростом цепи полимеризованный PEGDM сети были продемонстрированы также подходит для контроля локализации клеток в развитии тканевой инженерии надкостницы 18,19. Ступенчатой полимеризуют ПЭГ сети лучше подходят для включения пептидных последовательностей, чтобы облегчить ферментативно аспекты деградации гидрогеля, из-за легкости включения ферментный субстрат последовательностей с использованием тиол (цистеин), содержащие пептиды и норборнен с функциональными группами макромеры 20. Если вопрос исследования будет лучше всего решать путем использования гидрогелей ступенчатого роста, Фэрбенкс и др.. Дает подробное описание norborСтратегия функционализацию Нене для ПЭГ 7. Эта деталь бумага воля, как ПЭГ и пептидные последовательности могут быть функциональными (с метакрилата для PEG, и метакриламида для пептидов) для реакций полимеризации цепи.
Традиционно, PEGDM получают взаимодействием ПЭГ с метакрилоилхлоридом и триэтиламина в дихлорметане. Реакционной смеси дают прогрессировать ночи при комнатной температуре 11 или в течение 24 ч 5, с некоторыми методами, простирающихся времени реакции до 4 дней до 12 фильтрации, осаждения в диэтиловом эфире, и сбора. Хотя многие вариации этого подхода существует, все отнимают много времени, требует большой массив химического синтеза оборудования, а не для окружающей среды, так как они предусматривают использование относительно больших количеств реагентов высокой чистоты и растворитель. Чтобы обойти эти ограничения, Лин-Гибсон и др.. Разработал СВЧ-помощь без растворителей метод функционализировать ПЭГ с тэ rminal группы метакрилатные (рис. 3А) 12. В этой реакции, терминал спиртовые группы ПЭГ вступает в реакцию с одним из атомов карбонилом ангидрида метакриловой кислоты с образованием карбоксильных. Это создает продукт PEGDM, с метакриловой кислоты в качестве побочного продукта. Этот синтез имеет много характерных преимуществ микроволновой синтеза, включая сокращение времени реакции и растворителя методов синтеза 21. Микроволновая синтез предпочтительнее рассмотренных выше методов, как это значительно быстрее, требуется меньше обширную оборудование синтезе (например изделия из стекла, реакции пластины), и использует меньше общего реагента и количество растворителя, как растворители требуются только для очистки продукта / сбора и не для синтез, что делает его более экономичным и экологически чистым.
0px "/>
Нажмите здесь, чтобы увеличить изображение .
Фигура 3:. Функционализации схемы) поли (этиленгликоль) подвергают взаимодействию с 10-кратным мольным избытком ангидрида метакриловой кислоты с получением поли (этиленгликоль) метакрилата B) Этот же метод может быть использован для функционализации N-конец пептидных последовательностей, образуя. метакриламида функционализованный пептид. При выполнении этой процедуры до расщепления пептида от смолы, селективный функционализации N-конца может быть выполнена как аминокислотные боковые группы остаются защищенными. н: количество PEG повторяет в макромера (п = 45,5, 227 и 455, соответственно, для 2, 10 и 20 кДа линейный ПЭГ используются). R1-RN: аминокислоты в боковых цепях. PG1 в PGN: Защитные группы боковой цепи. TFA: трифторуксусная кислота. СОВЕТЫ: триизопропилсилана. Dodt: 3,6-диокса-1 ,8-octanedithiol. H 2 O: вода.
Способ methacrylation с помощью микроволн недавно был адаптирован к нашей группе функциональных групп в N-конец пептидов с метакриламид групп (рис. 3б), чтобы облегчить пептида включение в различных полимеров и полимерных сетей. В этой реакции первичного амина с N-конца пептида реагирует с карбонильным атомом на ангидрида метакриловой кислоты с образованием амида. Это создает метакриламид функционализированного пептид, с метакриловой кислоты, полученного в качестве побочного продукта. При использовании этой процедуры для функционализации N-конец пептидных последовательностей, важно, что аминокислоты, содержащие реакционноспособные боковые цепи (первичные амины (лизин), спирты (серин, треонин) и фенолов (тирозин)) защищены во время функционализации и защитные группы отщепляют только после включения метакриламид.
В этой статье будут продемонстрировать оба эти микпр. при содействии методы синтеза PEGDM и функционализировать пептидные последовательности по-смолы, подчеркивая распространенных ошибок и предлагая способы устранения неполадок. В этой статье, методы для выполнения аналитических химических методов, обычно используемые для оценки продукта функционализацию будут подробно и предложения и ресурсы для выполнения более сложных модификаций будет дано. Типичные результаты будут продемонстрированы, которые включают в себя использование синтезированного PEGDM сформировать гидрогеля сетей, используя сформированные гидрогели контролировать выпуск модельного лекарственного средства, а также используя функциональными пептиды для облегчения клеток-гидрогель взаимодействия. Особое внимание будет уделено характеризующие гидрогеля размер ячеек и обсуждали, как композиция гидрогеля может быть настроен на влияет на этот основной физическое свойство, которое в свою очередь управляет характеристиками объемного материала, такие как жесткость и профиль высвобождения лекарственного средства.
протокол
1. Микроволновая печь-помощь Синтез PEGDM
- Для предотвращения загрязнения водой, предварительно сухой все посуда используется в печи (> 60 º C) в течение 1 часа.
Примечание: Требуется посуда включает в себя: два 100-мл стаканы, 250-мл химический стакан, 3 шпатели, 250 мл Бюхнера колбу, 7-см воронку Бюхнера, в 10 см часового стекла. - Предварительно холод 100-150 мл безводного диэтилового эфира (74,12 г / моль) для осаждения впоследствии, выполненной на этапе 1,6 путем заливки его в химический стакан, охватывающий стакан часовым стеклом, и размещение стакан в перекристаллизации тарелки со льдом. Перемещение микроволновая печь и Вортекс в химическом вытяжном шкафу.
Примечание: диэтиловый эфир может быть также prechilled, помещая стакан в химической морозильной камеры. Чем ниже температура диэтиловый эфир достигается за счет того, чтобы охладить в холодильнике увеличивает скорость и эффективность осаждения. - В небольшой взвешивания лодки, отвесить 5 г поли (этиленгликоль) (ПЭГ) от молекулярногоЛар вес вашего выбора (1,000-100,000 Da).
- Если присутствует, снять пластиковый кусок от крышке сцинтилляционный флакон. Тара пузырек, и обойтись 10 молярного избытка ангидрида метакриловой кислоты в пробирку (MA, 154,16 г / моль) в уравнении 1 в капотом. Добавить ПЭГ к сцинтилляционный флакон.
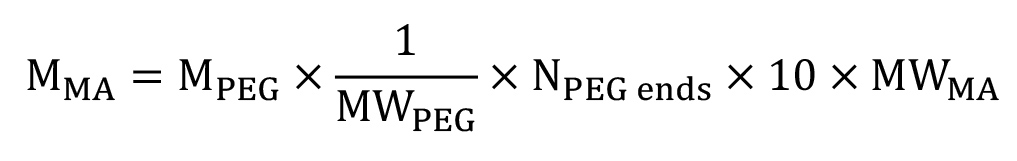 (1)
(1)
где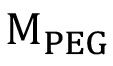 масса PEG в г,
масса PEG в г, 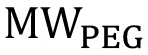 является молекулярная масса ПЭГ в г / моль,
является молекулярная масса ПЭГ в г / моль, 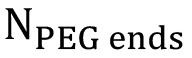 это количество концевых групп ОН на вешалке, и
это количество концевых групп ОН на вешалке, и 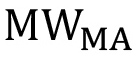 является молеЛар вес магистра в г / моль.
является молеЛар вес магистра в г / моль.
- Если присутствует, снять пластиковый кусок от крышке сцинтилляционный флакон. Тара пузырек, и обойтись 10 молярного избытка ангидрида метакриловой кислоты в пробирку (MA, 154,16 г / моль) в уравнении 1 в капотом. Добавить ПЭГ к сцинтилляционный флакон.
- Свободно крутить крышку на сцинтилляционный флакон. Включите микроволновую печь до 5 мин на максимальной мощности. Ношение термостойкие перчатки, снимите флакон из микроволновой печи каждые 30 сек.
- Полностью затяните крышку и вихрь в течение 30 сек. Повторите, пока раствор не был в микроволновой печи в течение всего 5 мин. Колпачок возможно, должны быть заменены в течение процедуры вследствие растрескивания.
- С колпачок ослаблены, пусть PEGDM остыть до комнатной температуры. Растворить PEGDM в небольшом количестве (10-15 мл) в дихлорметане (ДХМ, 84,93 г / моль).
Примечание: Рекомендуется PEGDM остыть значительно (~ 5 мин) до DCM того, чтобы предотвратить кипение DCM (канцероген) из-за остаточного тепла. PEGDM можно разбить на мелкие куски с помощью шпателя и встряхивали, чтобы помочь в ликвидации. - Осадить PEGDM в 10-кратным избытком охлажденного льдом диэтилового эфира в течение 20 мин.
Примечание: Это может быть необходимо, чтобы подкожнохраповик мензурку сторону с шпателем, чтобы инициировать образование кристаллов для осаждения более низкие ПЭГ молекулярной массой (2500 Да), однако ПЭГ с молекулярной массой ниже 1000 дальтон не будет выпадать в осадок несмотря царапин. - С использованием воронки Бюхнера и колбы, собирают PEGDM путем вакуумной фильтрации. Не фильтровать, чтобы завершить сухость, так как это будет способствовать адсорбции воды на PEGDM.
Примечание: При необходимости для конкретного вакуумной системы в использовании, вакуумный ловушка может быть помещен между установки фильтрации и вакуумного источника для защиты вакуумного насоса от повреждения паров растворителей. - Передача отфильтрованный PEGDM в 50 мл коническую пробирку с большой иглы пирсинг через крышку для вентиляции. Храните в течение ночи в вакуумной камере, чтобы высохнуть.
- Растворяться PEGDM в DCM и reprecipitate (как в шагах 1,5-1,7) В качестве последнего шага для удаления непрореагировавшего MA. Высушите снова, как в пункте 1.8.
2. Характеристика PEGDM функционализации
- Использование дейтерированном хлороформе (120,38 г / моль) в качестве растворителя, для получения образцов 1 Н-ЯМР. Поместите небольшое образец PEGDM (≈ 10 мг) в сцинтилляционный флакон с небольшим количеством растворителя (≈ 1,0 мл). Целевая концентрация 10 мг / мл.
- После того, как образец растворяется, перенести его в чистую пробирку ЯМР. Образец должен заполнить нижние 4-5 см ЯМР трубы.
- Сбор спектров ЯМР протонов. Наша данные собираются с использованием 400 МГц спектрометр с. Запустите образцы при комнатной температуре не менее 64 сканирований для получения достаточного разрешения данных.
- Если ЯМР-анализ (рис. 4) показывает, PEGDM функционализации меньше 90%, то процедура methacrylation следует повторить. Отрегулируйте масса MA используется для учета уменьшенного количества нефункционализованного ПЭГ.
Примечание: Процент ПЭГ функционализированный в PEGDM может быть рассчитана из наблюдаемое: теоретическое отношение концевых methacrylate протоны (а, б, в) в центральные ПЭГ протонов (D) (рис. 4). Для линейного PEG, теоретическое число центральных протонов PEG рассчитывается по формуле 2:
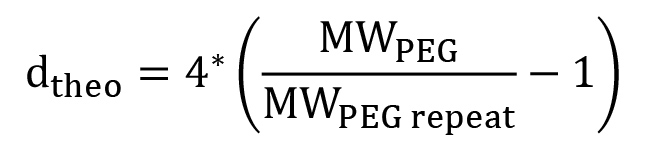 (2)
(2)
где 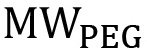 является молекулярная масса ПЭГ в г / моль и
является молекулярная масса ПЭГ в г / моль и 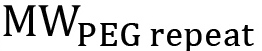 молекулярный вес от одного повтора ПЭГ (44 г / моль). Для нелинейной PEG, это уравнение должно быть изменено, чтобы отразить конкретные ветвления структуру (рис. 1). Процент функционализации может быть вычислена с использованием уравнения 3:
молекулярный вес от одного повтора ПЭГ (44 г / моль). Для нелинейной PEG, это уравнение должно быть изменено, чтобы отразить конкретные ветвления структуру (рис. 1). Процент функционализации может быть вычислена с использованием уравнения 3: 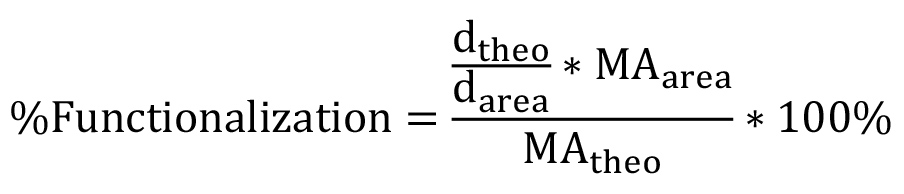 (3)
(3)
где  является наблюдаемая площадь под пиковой г (δ = 6,63 м.д.),
является наблюдаемая площадь под пиковой г (δ = 6,63 м.д.), 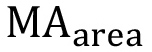 это наблюдалось площадь под метакрилат протонных пиков (а, δ = 1,94 м.д.; В и С, δ = 5,57 и 6,12 м.д.), и
это наблюдалось площадь под метакрилат протонных пиков (а, δ = 1,94 м.д.; В и С, δ = 5,57 и 6,12 м.д.), и  это теоретическое число протонов метакрилата (а = 3 *
это теоретическое число протонов метакрилата (а = 3 * 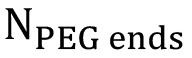 , B = 1 *
, B = 1 * 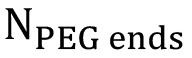 и с = 1 *
и с = 1 * 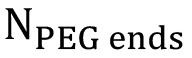 - 6, 2 и 2, соответственно, для линейного PEG). Расчет функционализацию процентов должны быть выполнены с использованием пиков А, В и С по отдельности, а затем усреднениеред чтобы получить общее процентное функционализации.
- 6, 2 и 2, соответственно, для линейного PEG). Расчет функционализацию процентов должны быть выполнены с использованием пиков А, В и С по отдельности, а затем усреднениеред чтобы получить общее процентное функционализации.
Примечание: Достаточно функционализированного PEGDM может быть затем диализовали (в воде, от воды) и собирают путем лиофилизации для удаления остаточного ангидрида метакриловой кислоты и метакриловой кислоты. Конечный продукт должен быть смешан с небольшим количеством (0,01% по весу) ингибитор, такой как лимонная кислота или витамин С и хранили вместе с осушителем при -20 ° С до использования. Окончательный PEGDM продукт может быть использован для получения гидрогелей, как описано в статье Юпитер по Khetan и Burdick 22.
3. Микроволновая печь-помощь Функционализация На-смолы пептидов
Примечание: Наши пептиды синтезировали с использованием Fmoc-Gly-смолы Wang, с использованием автоматического пептидного синтезатора с УФ-мониторинг, и растворы 0,2 М аминокислотных N-метилпирролидон (NMP, 99,1 г / моль). 5% пиперазина (86,1 г / моль) в диметилформамиде (ДМФ, 73,1 г / моль) используется для снятия защиты, 0,5 М O-бензотриазол-N, N, N ', N'-тетраметил-урони-hexafluoro-фосфат (HBTU, 379,3 г / моль) в ДМФА используется в качестве активатора, и 2 М диизопропилэтиламина (DIEA, 129,3 г / моль) в NMP используется в качестве активатора базы. Пептиды также могут быть получены из коммерческих поставщиков пептидов. При использовании коммерческих источников очень важно, чтобы пептиды закупаются на-смолы с боковой цепи аминокислоты защитные группы нетронутыми, а не полностью расщепляется, что является обычной практикой.
Примечание: Важно, чтобы любые аминокислоты с реакционноспособными боковыми цепями защищены, чтобы обеспечить метакриламид функционализации происходит только на первичного амина на N-конце последовательности. См. таблицу 1 для аминокислот с реакционноспособными боковыми группами, и типичные защитные группы. Аминокислоты с защитными группами включены в последовательности во врем пептидного синтеза таким же образом, как незащищенные аминокислот, и часто доступны от тех же поставщиков аминокислот.
| Аминокислота | Реактивная группа | Защитная группа |
| Лизин | Первичный амин | трет-бутилоксикарбонил (Boc) |
| Серин | Первичная Алкоголь | трет-бутил (TBU) |
| Треонин | Вторичный спирт | TBU |
| Тирозин | Фенол | TBU |
Таблица 1: Реактивные аминокислоты и типичные защитные группы.
- Синтезируют пептиды с использованием стандартного твердофазного пептидного синтеза, и хранить на смоле при 4 ° С в ДМФА до готовности к использованию.
- Использование 7 см бюхнеровскую воронку с фильтровальной бумаги и 250 мл колбу, собирать пептидной смолы из ДМФ путем фильтрации.
- Если присутствует снять пластиковый кусок от крышке сцинтилляционный флакон. Передача смолы в сцинтилляционный флакон. Пипеткой, добавить достаточно просто MA для покрытия смолы в сцинтилляционный флакон.
- Свободно разместить крышку на сцинтилляционный флакон. Включите микроволновую печь до 3 мин на максимальной мощности. Ношение жаропрочных перчатки, снимите флакон из микроволновой печи каждые 15-20 сек.
- Полностью затяните крышку и вихрь на 15 сек. Повторите, пока раствор не был в микроволновой печи в течение фуLL 3 мин.
- С колпачок ослаблены, пусть пептидный раствор охлаждают до комнатной температуры. Использование небольшого количества диметилформамида и воронку Бюхнера с фильтровальной бумаги и колбы, собирают пептидной смолы из флакона.
- Передача пептидной смолы на свежую сцинтилляционный флакон и расщеплять и снятия защиты с пептида.
- За 0,25 ммоль смолы, мы используем реакцию при комнатной температуре 2 ч с вращением, используя коктейль расщепления 18,5 мл трифторуксусной кислоты (TFA, 114,02 г / моль) с 0,5 мл каждого из триизопропилсилана (TIPS, 158,36 г / моль), 3,6-Диокса-1 ,8-octanedithiol (Dodt, 182,30 г / моль) и деионизированную воду (18,02 г / моль).
Примечание: Этот коктейль является достаточным для большинства пептидов, но не снятия защиты с 2,2,4,6,7-пентаметил-дигидробензофуран-5-сульфонил (Pbf)-защищенных аминокислот (обычно используются для защиты боковых цепей аргинина). Если последовательность содержит любые Pbf-защищенных групп, 0,5 мл TFA должен быть заменен 0,5 мл тиоанизола (124.20 г / моль) и расщепление время увеличилась до 4 часов.
Примечание: Если в облачный, кристаллическое вещество образуется в коктейль расщепления, пептид, вероятно сбой из раствора и объема коктейля расщепления должна быть удвоена.
- За 0,25 ммоль смолы, мы используем реакцию при комнатной температуре 2 ч с вращением, используя коктейль расщепления 18,5 мл трифторуксусной кислоты (TFA, 114,02 г / моль) с 0,5 мл каждого из триизопропилсилана (TIPS, 158,36 г / моль), 3,6-Диокса-1 ,8-octanedithiol (Dodt, 182,30 г / моль) и деионизированную воду (18,02 г / моль).
- Охладить 400 мл безводного диэтилового эфира на льду в химический стакан накрывали часовым стеклом.
- Осаждения пептида в 10-кратным избытком диэтилового эфира и раствор разделить поровну между четырьмя 50 мл конические пробирки. Центрифуга при 3200 мкг в течение 10 мин для сбора пептид.
- Слейте от эфира, и ресуспендируют пептид в 100 мл свежего диэтиловый эфир разделенных между двумя 50 м конических труб. Повторите процесс центрифугирования ресуспендирования в 50 мл свежей порцией эфира дважды в общей сложности четыре эфира стирок.
Примечание: Это удаляет химические вещества, используемые в коктейле расщепления и расщепляется защитных групп из твердого пептида.
- Слейте от эфира, и ресуспендируют пептид в 100 мл свежего диэтиловый эфир разделенных между двумя 50 м конических труб. Повторите процесс центрифугирования ресуспендирования в 50 мл свежей порцией эфира дважды в общей сложности четыре эфира стирок.
- После последнего центрифугирования, переливать эт отходовее и высушите пептид течение ночи под вакуумом.
4. Характеристика пептидных функционализации
- Использование 50:50 H 2 O: ацетонитрил (41,05 г / моль) + 0,1% TFA в качестве растворителя для MALDI-TOF анализа образцов пептида. Поместите небольшой образец (1 - 2 мг) пептида в 1,5 мл пробирку Эппендорфа и растворения образца в 1 мл растворителя MALDI.
- Подготовьте матрицу решение. Обычно используют матрица α-циано-4-гидроксикоричной кислоты (CHCA, 189,2 г / моль) в качестве матрицы. Растворите 10 мг / мл матрицы в MALDI растворителе, образуя запас матричный раствор.
Примечание: Матрица раствор можно хранить при комнатной температуре в течение до одной недели для дополнительных анализов. - Смешайте пептид и матричный раствор в соотношении 1:1. Найди эту универсальное решение на трех отдельных местах на MALDI образец стекла, добавляя 1 мкл / место.
- Высушите пятна, либо от воздушной сушки или с помощью тепловой пушки. Respot и сухой каждыйобразец.
Примечание: Respotting производит более равномерное образец пептид / матрицу, и помогает в получении четкого сигнала. Стандартный пептид смесь также должны быть объединены с матрицей раствора в соотношении 1:1 и пятнистый (только один раз) на MALDI пластины.
- Высушите пятна, либо от воздушной сушки или с помощью тепловой пушки. Respot и сухой каждыйобразец.
- Сбор данных MALDI-TOF. В связи с добавлением метакриламид группы в N-конце пептида, должно быть увеличение 68 г / моль молекулярной массы выше, чем в пептидной молекулярной массой в одиночку.
Примечание: В отличие от синтеза PEGDM, пептиды не могут быть refunctionalized, как при расщеплении защищающие группы на аминокислот с реакционноспособных боковых цепей удаляются, и селективный функционализации N-концов не может больше не обеспечивается.- Если MALDI анализ (рис. 5) показывает, что пептид был правильно функционализированные и все защитные группы отщепляют соответствующим образом, пептид может быть диализу (в воде, от воды) и собирают путем лиофилизации, убре остаточные загрязняющие вещества (коктейль декольте, эфир, расщепляется защитных групп и т.д.). Твердое вещество пептид должны быть переданы в небольшом пробирку Эппендорфа и хранили при -20 ° С до использования.
Результаты
Протонного ядерного магнитного резонанса является одним из наиболее распространенных методов анализа для оценки эффективности химической реакции, так как площадь под каждым пиком спектров пропорционально относительных уровней этой протона в образце, что позволяет определение соотношения продукта и реагента в образце. Для этой реакции 1 Анализ Н-ЯМР (рис. 4) можно использовать для вычисления% функционализацию от наблюдаемая: теоретическое отношение терминальных протонов метакрилатных (а, б, в) в центральные протонов ПЭГ (г). PEGDM показано на рисунке 4 был 2000 Da до функционализации, поэтому п = 2000 Da / (44 Da / ПЭГ повтор) = 45,5, так что г = 4 * (п-1) = 178, что делает протон: соотношение ЯМР блок 178 / 102.16 = 1.74. В этом случае пик не может быть использована при оценке% функционализации, как присутствие воды в образце искусственно увеличивает площадь под пиком. Использование пик В,% функционализацию составляет 1.00 * 1.74 / 2 * 100% = 87,1%; Усинг пик с,% функционализацию составляет 1,08 * 1,74 / 2 * 100% = 94,1%. Таким образом, общий% функционализации составляет 91%, и это PEGDM надлежащим образом функционализированных для использования в синтезе гидрогеля. Как правило, около 90% функционализации достигается после одного раунда methacrylation.
В связи с множеством пиков протонов, которые возникают в 1 H-ЯМР анализа пептидов, пептид функционализации легче исследованы с помощью MALDI-TOF масс-спектрометрии. Это показано на фиг.5, где пептид синтезировали GKRGDSG и подвергают функционализации метакриламид. Небольшая часть Пептид расщепл ют на prefunctionalization молекулярной оценки веса (фигура 5А), который показал, наблюдается пик молекулярного веса происходит на 676 г / моль, ожидаемой молекулярной массы пептида, показывающее корректный синтез пептидной последовательности. Остальная часть пептида прошли метакриламид функциональныйзации до расщепления. В этот пептид содержит Pbf защищенных аминокислот R, расщепление проводили в коктейле, содержащем тиоанизола течение 4 часов. После метакриламид функционализации, наблюдается пик молекулярного веса происходит на 744 г / моль (фиг.5В), ожидаемый вес метакриламид функционализированные пептида (676 +68 г / моль) и не в ожидаемой молекулярной массы нефункционализованного пептида, с указанием правильной функционализации.
Чтобы продемонстрировать функциональность как ПЭГ и метакриламида функционализованный пептида, PEGDM гидрогели были произведены с учетом и без 0,5 мМ метакриламида функционализованный GKRGDSG (рис. 6). Гидрогели были получены с 10% по весу линейного 10 кДа PEGDM в PBS, 0,05% по весу литий фенил-2 ,4,6-trimethylbenzoylphosphinate (LAP) в качестве фотоинициатора. Решение гидрогель предшественник вводили между двумя предметными стеклами, разделенными стекло прокладки и скрепленных зажимы. Предшественник раствор затем подвергали воздействию 365 нм УФ-света на 2 мВт / см 2 в течение 10 мин, чтобы вызвать сшивание, после чего гели диаметром 8 мм были собраны с использованием цилиндрического штампа. Гели промывали в PBS и оставляют для набухания в течение 2 дней, чтобы обеспечить условия равновесия отек были достигнуты 16,20. Человека МСК (прохождение 3) выращивали до 80% слияния и высевали на гидрогели на 15000 клеток / см 2. Клеткам давали придерживаться в течение 48 ч до перевода в свежей среде, содержащей 0,5 мкл / мл кальцеина AM и 2 мкл / мл этидий гомодимер (LIVE / DEAD Жизнеспособность комплект из Invitrogen) и отображается в соответствии фазового контраста и флуоресценции при 10-кратным увеличением с помощью Nikon Eclipse Ti 2000. МСК не смогли придерживаться нефункционализованного ПЭГ гидрогелей (рис. 6А), но при включении клеточной адгезии пептидов RGD они смогли придерживаться и распространять на гидрогеля поверхности (рис. 6, б). В ОНЛАЙН / DEAD изображенияпредставлены не представляют жизнеспособность сеяной населения MSC, как МСК являются адгезии зависит от клетки, которые отделяются от поверхности геля после смерти и будут удалены в процессе переноса СМИ, в результате искусственного раздувания семенами жизнеспособности клеток. Скорее, флуоресцентные изображения предназначены для разграничения между прилипшие клетки и небольшими вариациями в гидрогеля топологии, который может быть трудно под фазового контраста в одиночку. Интересно, что nonspread клетки высевают на PEG-гели окрашивают только положительный и для кальцеина AM и этидием гомодимера, указывая, что клетки умирают в момент съемки.
Одна из многих преимуществ ПЭГ гидрогелей является их тонкой настройке природа. Изменение конкретный состав гидрогеля ПЭГ дает исследователям высокую степень контроля над свойств, таких как модуль упругости. Как показано на фиг.7, и молекулярная масса ПЭГ (7А) и весовой процент ( 7В), как известно, контролируют гидрогеля размер ячейки (ξ) и полученную гидрогеля жесткость и скорости высвобождения инкапсулированных препаратов. Это было продемонстрировано производство гидрогели с различной молекулярной массой PEGDM, и расследование результирующий модуль гидрогеля и размер ячейки (рис. 8). Все гидрогели были получены с 10% по весу линейного PEGDM в PBS, 0,05% мас LAP в качестве фотоинициатора. 40 мкл раствора гидрогеля предшественника было по 1 мл шприцы с кончиков отрезанными, и подвергающихся 365 нм УФ-излучения на 2 мВт / см 2 в течение 10 мин, чтобы сформировать гидрогели, производя цилиндрические геометрии около 5 мм в диаметре и 2 мм в высоту . Гели дают набухнуть в PBS в течение 2 дней до механических испытаний. Гидрогель модуль определяли с использованием QT MTS / 5 с датчиком нагрузки 5н при сжатии от 5 до 10% от первоначальной высоты гидрогеля со скоростью 0,1 мм / с. После механических испытаний была завершена, размер ячейки определяют путем измерения гидрогелевых масс предварительно (М ы) и после (М Д) 24 часа в сутки из лиофилизации через уравнения Флори-Rehner как подробно в разделе обсуждения, с расчетами, выполненными в MATLAB. Как и предполагалось, увеличения молекулярной массы ПЭГ макромер привело к увеличению гидрогеля размером отверстий (фиг.8А) и уменьшение жесткости гидрогеля (рис. 8b). Гидрогель размер ячейки и жесткость Полученный гель можно управлять путем изменения процентного PEG вес. Гидрогели были получены с переменным% по весу линейного 10 кДа PEGDM, и гидрогель жесткость и размер ячейки были определены, как описано ранее (рис. 9). Как показано на фиг.7В, увеличивая мас.% PEG вызывает значительное уменьшение размера сетки (фиг. 9A) и увеличение жесткости гидрогеля (рис. 9b).
Гидрогелей, содержащих инкапсулированный бычьего сывороточного альбумина (BSA) были сформированы с использованием изменяющегося молекулаR Вес ПЭГ (2, 10, и 20 кДа). Все гидрогели были получены с 10%-PEGDM в PBS, содержащем 50 мкг / мл BSA, как описано в рисунке 6. Гели инкубировали в 1 мл PBS при 37 ° С, и переносили в свежую PBS в каждый момент времени. Год выхода БСА количественно, используя Бредфорда от Thermo Scientific. Гидрогель размер ячейки определяли, как описано в рисунке 8. Как показано на фиг.7А, BSA высвобождение происходит более быстро из гидрогелей, образованных с использованием более высокой молекулярной массой PEGDM, в результате большего размера сетки в гидрогеле (рисунок 10).
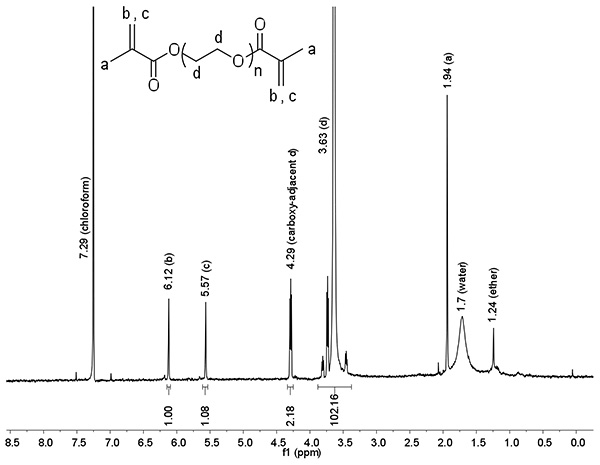
Рисунок 4. Представитель 1 H-ЯМР 2 кДа линейной PEGDM функционализированные с помощью метода с помощью микроволн. Процент функционализации может быть приблизительноlculated на основе наблюдается:. теоретическая отношение концевых протонов метакрилатных (а, б, в) в центральные ПЭГ протонов (D) Нажмите здесь, чтобы увеличить изображение .
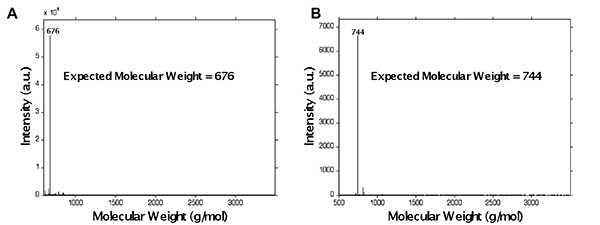
Рисунок 5. Представитель MALDI-TOF пептида GKRGDSG (А) до (В) после функционализации с использованием метода с помощью микроволн. Следует отметить, что наблюдается пик молекулярного веса после функционализации происходит при 744 г / моль, ожидаемый вес метакриламид функционализированные пептида (676 +68 г / моль), а не на ожидаемой молекулярной массы ООН функциональными пептида (676 г / моль). Нажмите здесь, чтобы увеличить изображение .
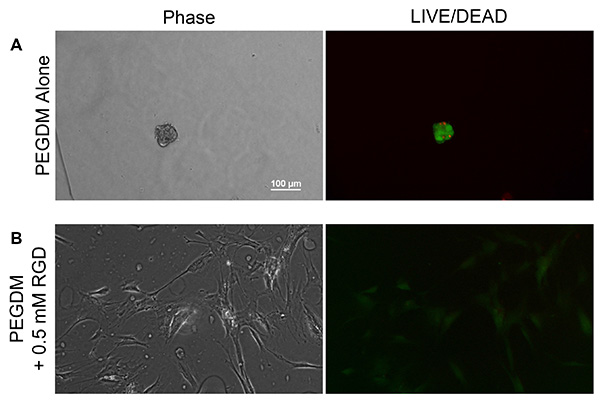
Рисунок 6. Представитель фазового контраста (слева) и ЖИТЬ / DEAD (зеленый / красный) флуоресцентные изображения (справа) из МСК культивируемых на одних и В) PEG гелей) PEG гели, содержащие 0,5 мм метакриламида функционализованный GKRGDSG. МСК не могут придерживаться и распространять на одни только гели PEGDA, но после включения в клеточной адгезии пептидов RGD, способны придерживаться и распространять на поверхности гидрогеля. Нажмите здесь, чтобы увеличить изображение .
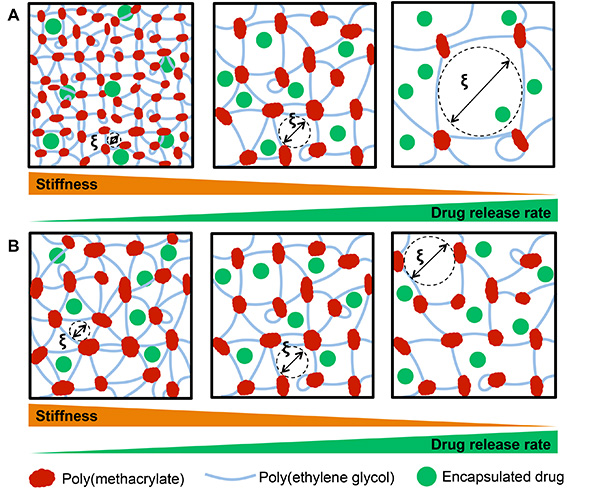
Рисунок 7. А) ПЭГ молекулярной массой и Б) Массовая доля ПЭГ используются для формирования гидрогеля сетей влияет гидрогеля размер ячейки (_8 ;) и полученный гидрогель жесткость и скорости высвобождения инкапсулированных препаратов.) Увеличение молекулярной массы ПЭГ (слева направо) при постоянном массовых процентах увеличивает размер гидрогель сетки, уменьшая жесткость гидрогеля и увеличения скорости высвобождения лекарственного средства. B) Уменьшение веса процент ПЭГ (слева направо) используется для формирования гидрогели увеличивает размер гидрогель сетки, так же снижается гидрогеля жесткость и увеличения скорости высвобождения лекарственного средства (не в масштабе). Нажмите здесь, чтобы увеличить изображение .

Рисунок 8. A) размером отверстий увеличивается и B) гидрогель жесткость уменьшается с увеличением молекулярной массы ПЭГ макромера. П = 10, планки погрешностей = SEM, *** р и# 60; 0,001 на одну сторону ANOVA с HSD теста после специальной Тьюки. Все статистические анализы проводились с использованием Prism 5. Нажмите здесь, чтобы увеличить изображение .

Рисунок 9. A) Сетка позволяет уменьшить размер и б) гидрогелевых жесткости увеличивается с увеличением мас% PEG. П = 9-10, планки погрешностей = SEM, ** р <0,01, *** р <0,001 по однофакторного дисперсионного анализа с HSD Тьюки-сообщению Тест специальной. Нажмите здесь, чтобы увеличить изображение .
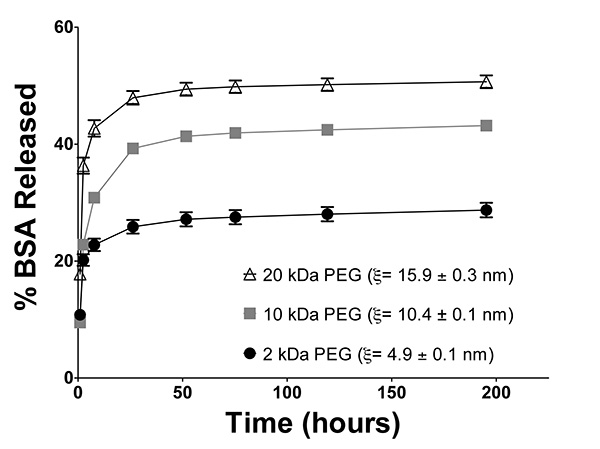
Рисунок 10. Выпуск ENCApsulated модель препарат бычьего сывороточного альбумина (BSA) из гидрогелей, образованных с использованием 2 кДа, 10 кДа, 20 кДа ПЭГ молекулярной массой. выпуск BSA происходит более быстро из гидрогелей, образованных с использованием более высокой молекулярной массой PEGDM, в результате большего размера сетки в гидрогеле . п = 6, планки погрешностей = SEM. % БСА выпущен значительно отличается (р <0,0001) между всеми тремя группами на каждый момент времени, кроме т = 1 и 2,5 ч., когда освобождение от 2 до 10 кДа гелей эквивалентны, по двухсторонней повторные-мер ANOVA с Бонферрони после специальной тест. Нажмите здесь, чтобы увеличить изображение .
Обсуждение
Методы ранее показанные имеет огромное значение для синтеза PEGDM и метакриламид функционализации пептидов или других аминовых соединений. Эти материалы затем могут быть использованы для регенеративной медицины и приложений доставки лекарств. Благодаря гидрофильной природы ПЭГ, гидрогели, полученные из ПЭГ макромеров имеют высокое содержание воды, похожий на многих тканей в организме 2. Это качество делает ПЭГ очень устойчивы к адсорбции белка и поэтому инертны в организме 3. Тем не менее, гигроскопичности ПЭГ может оказаться беспокойство в течение функционализации. Если вода присутствует в образце ПЭГ во время процедуры methacrylation, метакриловой ангидрид реагирует преимущественно с водой для получения метакриловой кислоты и плохой функционализации ПЭГ приведет.
Таким образом, одним из самых важных шагов, которые можно предпринять, чтобы обеспечить успешное methacrylation ПЭГ или пептида является поддержание безводн.Rous условия реакции. Рекомендуемый стадию сушки всю посуду перед использованием предназначена для предотвращения загрязнения воды. Присутствие воды в образце можно видеть при анализе ЯМР в виде широкого пика при 1,7 м.д. (рис. 4). Если бедный methacrylation наблюдается даже после сушки всю стеклянную посуду, химикаты могут быть сушили над сульфатом натрия или другие сушильные средства (молекулярные сита и т.д.) перед использованием. Перегонка может также использоваться, чтобы удалить воду и очистить ангидрида метакриловой кислоты перед использованием, и азеотропной перегонки могут быть использованы для сухой ПЭГ 23. В крайнем случае, синтез можно проводить в перчаточной камере для дальнейшего обеспечения адекватного безводных условиях. Второй раунд methacrylation, в том же порядке, также может быть выполнена для увеличения функционализацию. Потому что всегда есть шанс, что потребуются дополнительные раунды функционализации, следует позаботиться на стадии 1.7 и 1.9 для быстрого сбора PEGDM путем вакуумной фильтрации. Вакуумная фильтрация дольше, чем это абсолютно необходимые увеличивается воздействие ПЭГ в воздухе, увеличивая возможность для адсорбции воды.
Даже несмотря на то процентов избыток ангидрида метакриловой кислоты гидроксильных функциональных групп остается неизменным, увеличивая функционализацию PEG (например рука #) на предшественника ПЭГ обычно ассоциируется с уменьшением процента функционализации достигнутых (неопубликованные результаты, Бенуа лабораторных). Для решения этой превентивно снижение эффективности функционализации, или если определенные трудности возникают достижении достаточно высокой функционализации, длительность СВЧ реакции может быть увеличена при условии, что микроволновая печь интервал поддерживают на уровне 30 сек. В то время как 10 молярный избыток, обычно достаточно, количество ангидрида метакриловой кислоты, используемого в реакции, также может быть увеличена, чтобы увеличить процентную функционализации, достигнутый 12.
Важно, чтобыДополнительный этап осадков (1.9) быть выполнены, чтобы достичь хороших сигналы ЯМР. Хотя заманчиво, чтобы выполнить второе осаждение в тот же день синтеза, высушивание образца в течение ночи перед переосаждением было найдено, чтобы помочь удаление избытка ангидрида метакриловой кислоты и метакриловой кислоты. Подготовка образца также важно для достижения спектры чистой ЯМР, и поэтому образцы должны быть получены с использованием рекомендованных условий. Рисунок 4 показывает репрезентативные 1 результаты H-ЯМР для правильно функционализованного PEGDM. Анализируя соотношение количества терминальных метакрилата протонов до центральных протонов ПЭГ, PEGDM была определена надлежащим образом функционализированных. MALDI пробоподготовки является так же важно для достижения четкое чтение. MALDI особенно чувствительны к присутствию солей и высокой концентрации образца. Если ясно, MALDI чтения (интенсивность выше 50 условных единиц (AU) с высоким отношением сигнал: шум) не могут быть получены, образец сЕШЕНИЕ следует разбавить 1:100 в MALDI растворителе перед объединением с матричным раствором и проанализировать повторно. 5 показаны репрезентативные результаты MALDI-TOF после правильного пептида функционализации, расщепление и пробоподготовки. Расщепление небольшой выборке смолы до функционализации (Рисунок 5А) показывает правильный синтез пептидной GKRGDSG, с правильной метакриламида функционализации пептида, показанной на рисунке 5В.
В то время как функционализацию на-смолы пептидов является относительно надежной процедура, условия расщепления, необходимые для каждой последовательности часто требуется коррекция. Для длинных последовательностей, где многие аминокислоты охраняемых боковые цепи (> 30 аминокислот, или> 15 аминокислот с защитными группами), продолжительность расщепления должна быть увеличена на один час. Однако, если время расщепления распространяется слишком много, расщепление пептидной связи может привести из-за долгосрочного кислой экспозиции. MALDI ана лизис может быть очень полезно в выявлении любых ошибок, которые имели место в синтезе пептидов или расщепления. Наблюдаемое снижение ниже ожидаемых молекулярных весов может указывать, что аминокислота (ы), не правильно пара, или пептид фракционирование происходит (см. таблицу 2 для источников, обычно наблюдаемых изменений в молекулярной массы). Если наблюдаемый молекулярный вес выше, чем ожидалось от массы используемой защитной группы, вполне вероятно, что расщепление и удаление защитной группы была недостаточной и пептид следует recleaved в течение дополнительного времени.
изменение МВт (г / моль)| Аминокислоты Удаление | Изменение МВт (г / моль) | Нерасщепленного защитные группы | Обычно присутствуют ионы | Изменение МВт (г / моль) | |
| Ала | -71 | Ацетил | +42 | Cl - | +35 |
| Арг | -158 | Аллил | +40 | К + | +39 |
| Асн | -114 | Alloc | +85 | Mg 2 + | +24 |
| Гадюка | -115 | Бок | +100 | Na +, | +23 |
| Cys | -103 | Фмок | +223 | ||
| Глн | -128 | OtBu | +56 | ||
| Glu | -129 | Pbf | +252 | ||
| Gly | -57 | TBU | +56 | ||
| Его | -137 | Trt | +242 | ||
| Иль | -113 | ||||
| Лей | |||||
| Lys | -128 | ||||
| Встретил | -131 | ||||
| Phe | -147 | ||||
| -97 | |||||
| Ser | -87 | ||||
| Тре | -101 | ||||
| Trp | -186 | ||||
| -147 | |||||
| Вал | -99 |
Таблица 2. Обычно наблюдается изменения в пептидной молекулярной массой.
Макромеры, полученные с использованием с помощью микроволн методы methacrylation могут быть использованы в ряде регенеративной медицины или применения доставки лекарств. Функционализированные пептиды и PEGDM синтезированные здесь также могут быть включены в полимеры с использованием нитроксильных-опосредованной полимеризации (NMP), с переносом атома радикальной полимеризации (ATRP) или Реверсивный КромеТион-Фрагментация Передача (RAFT) методы 24. Гидрогелевые сети также могут быть получены в присутствии клеток, как было показано ранее в статье Юпитер по Khetan и Burdick 22. Это часто требует включение клеточной адгезии пептидов, таких как RGD или внеклеточных матричных молекул, как в одиночку ПЭГ не обеспечивает клеток-материальных взаимодействий критические для выживания и функции некоторых типов клеток 25. Пептиды, например, могут быть синтезированы с использованием традиционных твердофазного пептидного синтеза и функционализированного, как описано здесь, чтобы позволить для включения в гидрогелевых сетей. Как видно на рисунке 6, включение метакриламида функциональными клеточной адгезии пептида ГК УВАЖЕНИЕМ G в гидрогели (0,5 мм) облегчает адгезию мезенхимальных стволовых клеток (МСК), чтобы ПЭГ гидрогеля поверхностей, увеличивая число прикрепленный и распространение клеток (Рисунок 6B ), по сравнению с ПЭГ гидрогелей без клеточной адгезии пептида ( 6А). Тем не менее, предыдущая работа показала, что клеточно-материал взаимодействия усиливается благодаря включению 3400 Da ПЭГ прокладками между клеевых пептидов и гидрогеля сетей, снизить пептид-интегрину пространственное затруднение. Без включения спейсера, клетки могут взаимодействовать с ПЭГ гидрогелей с помощью неспецифических белков, которые адсорбируют к пептиду, а не через интегрин-опосредованную взаимодействия с пептидами 26. Чтобы включить эту ПЭГ спейсер и избежать неспецифических взаимодействий, пептиды могут быть конъюгированы с ПЭГ monofunctionalized через N-гидроксисукцинимидным-активированных сложных эфиров, как описано Hern и Hubbell 26.
Применение гидрогеля сетей требуют жесткого контроля над свойств материала. Существенным преимуществом для ПЭГ гидрогелей является высокая степень контроля над этими свойствами. Например, молекулярная масса, рука число, и мас.% ПЭГ используется при формировании гидрогелевых сетей могут быть изменены, чтобы точно TUNе свойства для конкретных областей применения. Это позволяет жесткий контроль над гидрогеля размером ячейки (ξ), которая контролирует гидрогеля набухания (Q) и жесткость (модуль упругости, Е). Это проиллюстрировано на фиг.7А и количественно на фиг.8, где растет ПЭГ макромера результаты молекулярной массой в увеличении гидрогеля размером отверстий (фиг.8А) и уменьшением жесткости гидрогеля (рис. 8b).
Основной физической характеристикой, которая контролирует объемную поведение в этих гидрогеля сетей, размер ячеек, рассчитывается с помощью уравнения Флори-Rehner 16. Для выполнения этого вычисления, объемная опухоль отношение (Q) сначала рассчитывается по формуле 4:  (4)
(4)
где ρ ы является плотность воды (1 г / мл), ρ плотность р ПЭГ (1,12 г / мл), М ы опухает масса гидрогеля и M D является сухая масса гидрогеля (часто измеряется после замораживания и лиофилизации гидрогелей). Молекулярная масса между сшивок (М С, в г / моль), рассчитывается по формуле 5:  (5)
(5)
где М Н является среднечисловая МВт ПЭГ (в г / моль),  удельный объем полимера
удельный объем полимера 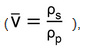 , V 1 мольный объем воды (18 мл / моль), V 2 представляет собой равновесный объем полимерных фракций из гидрогеля
, V 1 мольный объем воды (18 мл / моль), V 2 представляет собой равновесный объем полимерных фракций из гидрогеля
( 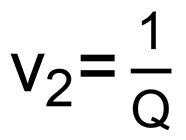 ), И X 1 является параметр взаимодействия полимер-растворитель для ПЭГ и воды (0,426) 16. Число связей между сшивок (п), рассчитывается по формуле 6:
), И X 1 является параметр взаимодействия полимер-растворитель для ПЭГ и воды (0,426) 16. Число связей между сшивок (п), рассчитывается по формуле 6: 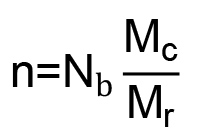 (6)
(6)
где N б это количество облигаций в повторе ПЭГ (3) и М г МВт ПЭГ повтора (44 г / моль) 27. Это позволяет корень среднеквадратичное конца в конец расстояние от полимерной цепи 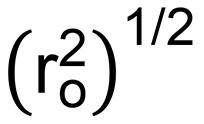 (В нм) должны быть рассчитаны по формуле 7:
(В нм) должны быть рассчитаны по формуле 7:  (7)
(7)
где л средняя длина связи (0,146 нм, вычисленный на основе CC и длины связей СО) и C п характеристическое отношение полимера (4,0 для ПЭГ) 28. FiНаконец, размер ячейки из гидрогеля можно рассчитать из уравнения 8: 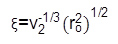 (8)
(8)
Гидрогелевые свойства аналогично могут быть настроены путем регулировки количества PEG, используемого в образовании гидрогелей. Уменьшение веса процент ПЭГ результатов макромера к увеличению размера сетки гидрогель, который впоследствии уменьшает жесткость гидрогеля. Фиг.7В иллюстрирует фиг.9 количественно как массовое процентное содержание ПЭГ используют в формировании гидрогель может быть использован для управления размером ячеек (рис. 9А) и результирующая гидрогель жесткость (рис. 9Б). Как субстрат жесткость уже было показано, влияют сотовые поведения, такие как стволовых клеток дифференциации 29, возможность жестко контролировать жесткость является важной характеристикой в гидрогеля изготовления.
Гидрогели также могут быть использованы для контрол доставки лекарств. Как показано на фиг.7А и показано на рисунке 10, увеличения молекулярной массы ПЭГ макромеров увеличивает размер ячейки гидрогеля сети, затем увеличивается высвобождение инкапсулированного модельного лекарственного средства, бычий сывороточный альбумин (БСА). В то время как образцы гидрогелевые в этом исследовании были уничтожены при Т = 195 часов, что позволяет измерения гидрогеля влажных и сухих масс для расчета размера сетки, это наш опыт, что по-прежнему БСА релиз произойдет уже образцы инкубировали в течение более длительных периодов времени. Неполный выброс BSA наблюдается на рисунке 10 не является неожиданным, так как другие группы также сообщили, что BSA устойчив к диффузии внутри ПЭГ гидрогелей сетей 30. Неполное высвобождение инкапсулированного белка может произойти из-за водородных связей между белками и ПЭГ макромеров или ковалентного связывания между метакрилата группы по ПЭГ и первичных аминогрупп лизиновых остатков на БСА в 31 . Кроме того, BSA является склонным к агрегации и образованию дисульфидных связей с течением времени, что может повысить свою эффективный радиус Стокса и препятствовать его освобождения из гидрогелей. Как гидрогели с ростом цепи, такие как этих PEGDM гидрогелей, склонны к сети неидеальности и гетерогенный гидрогель размером отверстий (рис. 2А), возможно также, что часть инкапсулированного BSA содержится в регионах гидрогеля, которые имеют значительно меньшие сетки Размер, чем общий средний внутри геля, предотвращая его освобождения. В то время как неполная, nonFickian релиз (данные не представлены) инкапсулированного BSA наблюдалось в данном случае, под контролем Фика выпуск многих других модельных лекарственных препаратов, в том числе инсулина и овальбумином, было продемонстрировано с использованием аналогичной PEGDM гидрогели 30. Кроме того, Уоткинс и Anseth использовали конфокальной лазерной сканирующей микроскопии, чтобы продемонстрировать, что высвобождение флуоресцентных молекул из аналогичных гидрогели моделируется приемлемо с диффузии Фика меняthods 32.
В то время как гидрогели, образованные в этом исследовании, разрушается, деградация сеть является еще одним параметром, который может быть включен в настройке и в этих сетях. Обеспечение контролируемого деградации гидрогеля может привести к изменению клеточного поведения 33, поощрение роста тканей или врастание тканей хозяина, или ликвидации необходимости эксплантации 34. Разложению ПЭГ гидрогели обычно синтезируют раскрытия цикла гидролитически разложению D, L-лактида, гликолида или ε-капролактона групп на гидроксильных групп в ПЭГ предшествующих methacrylation 35. Эти три группы деградируют в процессе гидролиза сложноэфирных функциональных возможностей, при этом гликолида эфиры, имеющие наибольшую чувствительность к деградации, а затем лактида, капролактона и эфира, в силу их различной гидрофобности. После включения гидролитически разлагаемых групп, ПЭГ может быть дополнительно функционализированный используя процедуру detaile methacrylationд в этой статье, позволяя формирование гидрогеля сетей через последующего радикального инициативе цепи полимеризации 36,37. Скорость деградации гидрогелевых сетей можно регулировать путем изменения личности гидролитически разложению группы (гликолида, лактида и т.д.) и путем изменения количества разлагаемых повторов, включенных в структуру 35,38.
Теоретически, методы продемонстрировали здесь могут быть использованы для акрилирования ПЭГ и пептидов заменой ангидрида метакриловой кислоты с акриловой ангидрида с шагом 1,3 и 3,3, соответственно. Тем не менее, акриловым ангидридом более чем в 20 раз превышает стоимость ангидрида метакриловой кислоты 39,40, значительно менее привлекательным, чем СВЧ-помощь methacrylation делает с помощью микроволн акрилирования.
Мы показали, простой, быстрый метод функционализировать ПЭГ и пептиды, как оценить эффективность этой процедуры, а также учитывая ресурсы для ипеть синтезированные материалы для формирования гидрогеля сетей. Эти синтетические инструменты очень универсальны в своих приложениях, и должны доказать главный продукт в любом количестве доставки лекарств и материалов научно-исследовательских лабораторий.
Раскрытие информации
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Благодарности
Эта работа финансировалась частично за счет Говард Хьюз Мед-в-Град общения (AVH), на начальных средств, предоставленных доктором Даниэль Бенуа из Университета Рочестера и Научно-образовательный фонд Ортопедическая / костно-мышечной трансплантации Foundation (OREF / MTF). Авторы хотели бы поблагодарить д-р Джеймс Л. McGrath для использования его оборудования.
Материалы
| Name | Company | Catalog Number | Comments |
| 3,6-Dioxa-1,8-octanedithiol | Tokyo Chemical Industry Co, LTD | D2649 | CAS 14970-87-7 |
| Acetonitrile | J.T. Baker | UN1648 | CAS 75-05-8 |
| Amino Acids | AAPPTech | Glycine: AFG101 | CAS 29022-11-5 |
| Arginine: AFR105 | CAS 154445-77-9 | ||
| Asparagine: AFD105 | CAS 71989-14-5 | ||
| Serine: AFS105 | CAS 71989-33-8 | ||
| Anhydrous diethyl ether | Fisher Scientific | UN1155 | CAS 60-29-7 |
| Citric acid | Sigma Aldrich | C1857 | CAS 77-92-9 |
| Deuterated chloroform | Cambridge Isotope Laboratories Inc. | DLM-7-100 | CAS 865-49-6 |
| Dichloromethane | Fisher Scientific | UN1593 | CAS 75-09-2 |
| Diisopropylethylamine | Alfa Aesar | A1181 | CAS 7087-68-5 |
| Dimethylformamide | Fisher Scientific | D119-4 | CAS 68-12-2 |
| Fmoc-Gly-Wang resin | Peptides International | RGF-1301-PI | 100-200 mesh size |
| Methacrylic anhydride | Alfa Aesar | L14357 | CAS 760-93-0 |
| N-Methylpyrrolidone | VWR | BDH1141-4LG | CAS 872-80-4 |
| On-resin peptides | Synthesized in-house | On-resin peptides can also be purchased from Peptides International, GenScript, AAPPTec, etc. | |
| O-Benzotriazole-N,N,N’,N’-tetramethyl-uronium-hexafluoro-phosphate | AnaSpec Inc | 510/791-9560 | CAS 94790-37-1 |
| Peptide Calibration Standard | Care | 206195 | |
| Piperazine | Alfa Aesar | A15019 | CAS 11-85-0 |
| Poly(ethylene glycol) 2 kDa linear | Alfa Aesar | B22181 | CAS 25322-68-3 |
| Poly(ethylene glycol) 10 kDa linear | Alfa Aesar | B21955 | |
| Poly(ethylene glycol) 20 kDa linear | Sigma Aldrich | 81300 | JenKem Technologies USA is an alternate supplier of linear and multi-arm PEG |
| Thioanisole | Alfa Aesar | L5464 | CAS 100-68-5 |
| Trifluoroacetic acid | Alfa Aesar | A12198 | CAS 76-05-1 |
| Triisopropylsilane | Alfa Aesar | L09585 | CAS 6485-79-6 |
| α-Cyano-4-hydroxycinnamic acid | Tokyo Chemical Industry Co, LTD | C1768 | CAS 28166-41-8 |
Ссылки
- Lin, C. C., Anseth, K. S. PEG Hydrogels for the Controlled Release of Biomolecules in Regenerative Medicine. Pharm. Res. 26, 631-643 (2009).
- Ifkovits, J. L., Burdick, J. A. Review: Photopolymerizable and degradable biomaterials for tissue engineering applications. Tissue Eng. 13, 2369-2385 (2007).
- Peppas, N. A., Hilt, J. Z., Khademhosseini, A., Langer, R. Hydrogels in biology and medicine: From molecular principles to bionanotechnology. Adv. Mater. 18, 1345-1360 (2006).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat. Biotechnol. 23, 47-55 (2005).
- Benoit, D. S., Durney, A. R., Anseth, K. S. The effect of heparin-functionalized PEG hydrogels on three-dimensional human mesenchymal stem cell osteogenic differentiation. Biomaterials. 28, 66-77 (2007).
- Benoit, D. S., Collins, S. D., Anseth, K. S. Multifunctional hydrogels that promote osteogenic human mesenchymal stem cell differentiation through stimulation and sequestering of bone morphogenic protein 2. Adv. Funct. Mater. 17, 2085-2093 (2007).
- Fairbanks, B. D., et al. A Versatile Synthetic Extracellular Matrix Mimic via Thiol-Norbornene Photopolymerization. Adv. Mater. 21, 5005 (2009).
- Moon, J. J., Hahn, M. S., Kim, I., Nsiah, B. A., West, J. L. Micropatterning of Poly(Ethylene Glycol) Diacrylate Hydrogels with Biomolecules to Regulate and Guide Endothelial Morphogenesis. Tissue Eng. A. 15, 579-585 (2009).
- Burdick, J. A., Anseth, K. S. Photoencapsulation of osteoblasts in injectable RGD-modified PEG hydrogels for bone tissue engineering. Biomaterials. 23, 4315-4323 (2002).
- Yanez-Soto, B., Liliensiek, S. J., Murphy, C. J., Nealey, P. F. Biochemically and topographically engineered poly(ethylene glycol) diacrylate hydrogels with biomimetic characteristics as substrates for human corneal epithelial cells. J. Biomed. Mater. Res. A. 101A, 1184-1194 (2013).
- Benoit, D. S. W., Anseth, K. S. Heparin functionalized PEG gels that modulate protein adsorption for hMSC adhesion and differentiation. Acta Biomater. 1, 461-470 (2005).
- Lin-Gibson, S., et al. Synthesis and characterization of PEG dimethacrylates and their hydrogels. Biomacromolecules. 5, 1280-1287 (2004).
- Anseth, K. S., Wang, C. M., Bowman, C. N. Reaction Behavior and Kinetic Constants for Photopolymerizations of Multi(Meth)Acrylate Monomers. Polymer. 35 (94), 3243-3250 (1994).
- Bencherif, S. A., et al. End-group effects on the properties of PEG-co-PGA hydrogels. Acta Biomater. 5, 1872-1883 (1016).
- Rydholm, A. E., Bowman, C. N., Anseth, K. S. Degradable thiol-acrylate photopolymers: polymerization and degradation behavior of an in situ forming biomaterial. Biomaterials. 26, 4495-4506 (2005).
- Zustiak, S. P., Leach, J. B. Hydrolytically Degradable Poly(Ethylene Glycol) Hydrogel Scaffolds with Tunable Degradation and Mechanical Properties. Biomacromolecules. 11, 1348-1357 (2010).
- Malkoch, M., et al. Synthesis of well-defined hydrogel networks using Click chemistry. Chem. Commun. , 2774-2776 (2006).
- Hoffman, M. D., Benoit, D. S. Emerging Ideas: Engineering the Periosteum: Revitalizing Allografts by Mimicking Autograft. , (2012).
- Hoffman, M. D., Xie, C., Zhang, X., Benoit, D. S. The effect of mesenchymal stem cells delivered via hydrogel-based tissue engineered periosteum on bone allograft healing. Biomaterials. , (2013).
- Hubbell, J. A., Lutolf, M. P., Raeber, G. P., Zisch, A. H., Tirelli, N. Cell-responsive synthetic hydrogels. Adv. Mater. 15, 888-892 (2003).
- Lidstrom, P., Tierney, J., Wathey, B., Westman, J. Microwave assisted organic synthesis - a review. Tetrahedron. 57, 9225-9283 (2001).
- Khetan, S., Burdick, J. Cellular encapsulation in 3D hydrogels for tissue engineering. J. Vis. Exp. (32), e1590 (2009).
- Antonios, M., Kurtis, K., Lucas, K. Drying poly(ethylene glycol). Nat. Protoc. Exchange. , (2012).
- Nicolas, J., Mantovani, G., Haddleton, D. M. Living radical polymerization as a tool for the synthesis of polymer-protein/peptide bioconjugates. Macromol. Rapid Comm. 28, 1083-1111 (2007).
- Nuttelman, C. R., Benoit, D. S. W., Tripodi, M. C., Anseth, K. S. The effect of ethylene glycol methacrylate phosphate in PEG hydrogels on mineralization and viability of encapsulated hMSCs. Biomaterials. 27, 1377-1386 (2006).
- Hern, D. L., Hubbell, J. A. Incorporation of adhesion peptides into nonadhesive hydrogels useful for tissue resurfacing. J. Biomed. Mater. Res. 39, 266-276 (1998).
- Andreopoulos, F. M., Beckman, E. J., Russell, A. J. Light-induced tailoring of PEG-hydrogel properties. Biomaterials. 19, 1343-1352 (1998).
- Merrill, E. W., Dennison, K. A., Sung, C. Partitioning and Diffusion of Solutes in Hydrogels of Poly(Ethylene Oxide). Biomaterials. 14, 1117-1126 (1993).
- Engler, A. J., Sen, S., Sweeney, H. L., Discher, D. E. Matrix elasticity directs stem cell lineage specification. Cell. 126, 677-689 (2006).
- Weber, L. M., Lopez, C. G., Anseth, K. S. Effects of PEG hydrogel crosslinking density on protein diffusion and encapsulated islet survival and function. J. Biomed. Mater. Res. A. 90A, 720-729 (2009).
- Mellott, M. B., Searcy, K., Pishko, M. V. Release of protein from highly cross-linked hydrogels of poly(ethylene glycol) diacrylate fabricated by UV polymerization. Biomaterials. 22, 929-941 (2001).
- Watkins, A. W., Anseth, K. S. Investigation of molecular transport and distributions in poly(ethylene glycol) hydrogels with confocal laser scanning microscopy. Macromolecules. 38, 1326-1334 (2005).
- Anseth, K. S., Benoit, D. S. W., Durney, A. R. Manipulations in hydrogel degradation behavior enhance osteoblast function and mineralized tissue formation. Tissue Eng. 12, 1663-1673 (2006).
- Hillwest, J. L., et al. Prevention of Postoperative Adhesions in the Rat by in-Situ Photopolymerization of Bioresorbable Hydrogel Barriers. Obstet. Gynecol. 83, 59-64 (1994).
- Sawhney, A. S., Pathak, C. P., Hubbell, J. A. Bioerodible Hydrogels Based on Photopolymerized Poly(Ethylene Glycol)-Co-Poly(Alpha-Hydroxy Acid) Diacrylate Macromers. Macromolecules. 26, 581-587 (1993).
- Skaalure, S. C., Milligan, I. L., Bryant, S. J. Age impacts extracellular matrix metabolism in chondrocytes encapsulated in degradable hydrogels. Biomed. Mater. 7, 024111-0210 (2012).
- Hoffman, M. D., Benoit, D. S. Agonism of Wnt-beta-catenin signalling promotes mesenchymal stem cell (MSC) expansion. J. Tissue. Eng. Regen. Med. , (2013).
- Sawhney, A. S., Pathak, C. P., Vanrensburg, J. J., Dunn, R. C., Hubbell, J. A. Optimization of Photopolymerized Bioerodible Hydrogel Properties for Adhesion Prevention. J. Biomed. Mater. Res. 28, 831-838 (1994).
- . Methacrylic Anhydride [Internet] Available from: https://us.vwr.com/store/catalog/product.jsp?catalog_number=AAAL14357-18 (2013)
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены