Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Dépôts de tissus humains adipeux brun segmentés automatiquement par tomographie par émission de positons / informatisée et la résonance magnétique images enregistrées
Dans cet article
Résumé
La méthode présentée ici utilise 18 F-fluorodésoxyglucose (18 F-FDG) par émission de positons / tomodensitométrie (TEP-TDM) et l'imagerie graisse eau séparée résonance magnétique (IRM), chaque numérisé suivante 2 exposition h à thermoneutre (24 ° C ) et froid (17 ° C) dans le but de cartographier le tissu adipeux brun (BAT) chez des sujets humains adultes.
Résumé
Fiable différencier le tissu adipeux brun (BAT) d'autres tissus en utilisant une méthode d'imagerie non-invasive est une étape importante vers l'étude BAT chez les humains. Détecter BAT est généralement confirmée par l'absorption du traceur radioactif injecté 18 F-fluorodésoxyglucose (18F-FDG) dans les dépôts de tissus adipeux, telle que mesurée par tomographie par émission de positons / tomodensitométrie (TEP-TDM) après l'exposition du sujet à un stimulus froid . Imagerie Fat-eau séparé par résonance magnétique (IRM) a la capacité de distinguer BAT sans l'utilisation d'un traceur radioactif. À ce jour, l'IRM des MTD dans l'homme adulte n'a pas été co-enregistré avec le PET-CT froid activé. Par conséquent, ce protocole utilise 18 scans F-FDG PET-CT pour générer automatiquement un masque de BAT, qui est ensuite appliqué à co-enregistrées IRM du même sujet. Cette approche permet de mesurer les propriétés d'IRM quantitatives de BAT sans segmentation manuelle. masques de MTD sont créés à partir de deux PEScans CT-T: après une exposition de 2 h soit thermoneutre (TN) (24 ° C) ou à froid activé (CA) (17 ° C). Les TN et CA PET-CT scans sont enregistrés, et les valeurs d'absorption PET standard et CT Hounsfield sont utilisés pour créer un masque ne contenant que BAT. CA et TN IRM sont également acquis sur le même sujet et enregistrés aux TEP-CT afin d'établir propriétés quantitatives d'IRM dans le masque de BAT défini automatiquement. Un avantage de cette approche est que la segmentation est entièrement automatisé et est basée sur des méthodes largement acceptées pour l'identification des MTD activé (PET-CT). Les propriétés d'IRM quantitatives de BAT établies en utilisant ce protocole peut servir de base pour une IRM seul examen de BAT qui évite le rayonnement associé à PET-CT.
Introduction
En raison de la hausse marquée de l'obésité dans le monde entier, il ya un intérêt accru dans les zones de recherche visant à comprendre l'équilibre énergétique. L'obésité peut entraîner des conditions médicales coûteuses et dévastatrices telles que le diabète, les maladies du foie, les maladies cardiovasculaires et le cancer, qui en fait une source de préoccupation importante pour la santé publique 1. Un domaine de recherche visant à comprendre l'équilibre de l'apport énergétique par rapport dépense énergétique est l'étude du tissu adipeux brun ou BAT. Bien appelle un tissu adipeux, BAT diffère du tissu adipeux blanc plus commun (WAT) à bien des égards 2. La fonction des adipocytes blancs est de stocker des triglycérides dans une seule grande vacuole lipidique par cellule, et de libérer ces triglycérides comme source d'énergie dans le flux sanguin en cas de besoin. D'une manière très différente, la fonction des adipocytes bruns est de produire de la chaleur. Un mécanisme par lequel cela se produit est l'exposition au froid. Cela provoque une augmentation de la sympathetic activité du système nerveux, qui à son tour active BAT. Lorsqu'il est activé, les adipocytes bruns génèrent de la chaleur. Pour ce faire, ils utilisent les triglycérides contenus dans les nombreuses petites vacuoles lipidiques par cellule, et par la présence de la protéine de découplage 1 (UCP1) dans les mitochondries abondante, convertissent les triglycérides à des substrats métaboliques sans la production d'ATP, résultant en une perte de entropique que la génération de chaleur. Les triglycérides stockés dans les petites vacuoles de lipides sont épuisées, l'adipocyte prend à la fois du glucose et des triglycérides présents dans le courant sanguin 3.
Intérêt pour l'étude BAT a considérablement augmenté au cours des dernières années en raison de sa contribution à la non-frissons thermogenèse, son rôle dans la modulation de la dépense énergétique de l'organisme, et la relation inverse potentiel entre BAT et l'obésité 3-9. En outre, des études animales récentes indiquent BAT joue un rôle essentiel dans les triglycérides et de glucose de compensation fepuis le sang, en particulier après l'ingestion d'un repas riche en graisses 10,11. Cependant, la plupart de ce que nous savons à propos de BAT est le résultat de la recherche chez les petits mammifères, qui contiennent de nombreux dépôts de BAT 4,9,12 - 15. Malgré quelques études au début de 16 à 18, la présence de BAT chez l'homme a été largement pensé pour diminuer avec l'âge, jusqu'à récemment, où l'intérêt pour l'étude de BAT humaine a été renouvelé. Des recherches récentes suggèrent que des quantités relativement faibles de BAT persistent à l'âge adulte de 19 à 24. Un facteur limitant supplémentaire pour étudier BAT est qu'en dehors de biopsie et coloration histologique, la méthode actuellement acceptée sans équivoque pour détecter BAT est de 18 F-fluorodésoxyglucose (18 F-FDG) la tomographie par émission de positons (PET). Scanners TEP modernes sont généralement combinés avec un scanner tomodensitométrie (TDM). Lorsqu'il est activé par l'exposition au froid, BAT reprend le 18 radiotraceur F-FDG, qui est un analogue du métabolisme du glucose, et devient visible sur les images en PET, par rapport au niveau beaucoup plus faible de 18 F-FDG lorsque BAT est 20,21,23,25 inactive. CT images acquises lors d'un examen de PET sur un PET-CT scanner aider à différencier entre les tissus à haute 18 F-FDG en fournissant des informations anatomiques. Cette utilisation de l'imagerie PET-CT expose le sujet à des rayonnements ionisants (principalement à partir de PET, si la dose du scanner ne est pas négligeable), et est donc une méthode souhaitable pour la détection de BAT.
Bien que le nombre d'études sur les MTD chez les humains adultes en bonne santé augmente, des études récentes de BAT humaine ont été principalement limité à rétrospective PET-CT études de 19,25, les cadavres de nourrissons humains 26,27, les adolescents humains qui ont déjà été admis à l'hôpital pour d'autres raisons 27 à 30, et quelques études humaines des adultes en bonne santé31-35. Un des défis avec les deux études des enfants et des études rétrospectives est la possibilité de résultats modifiés lorsque l'on étudie une population de patients qui est malade, ce qui peut affecter BAT. En outre, parce que le glucose ne est pas la source des MTD 36 de carburant préféré, études de PET ne peuvent pas toujours détecter BAT activé, et peuvent donc sous-représenter la présence de BAT. Une autre difficulté dans l'étude de BAT avec l'imagerie biomédicale est lié à exécuter la segmentation d'image pour définir les limites de dépôts de tissus. Actuellement, la segmentation des MTD dans les études humaines se appuie souvent sur un certain degré de segmentation d'image manuelle et est donc vulnérable à une mauvaise identification des dépôts de MTD, ainsi que la variabilité inter-évaluateur.
En raison de ces défis, les techniques de cartographie spatiale fiables qui peuvent distinguer BAT des distributions de WAT, ainsi que des méthodes de segmentation automatique, permettraient aux enquêteurs une nouvelle et puissante àol avec lequel pour étudier BAT. Imagerie par résonance magnétique (IRM) a la capacité pour l'identification, la cartographie spatiale, et la quantification volumétrique des MTD, et contrairement aux approches d'imagerie existants hybrides PET-CT qui comprennent une dose radioactive pour le sujet imagé, IRM implique pas de rayonnement ionisant et peut être utilisé en toute sécurité et de manière répétée. La capacité d'identifier et de quantifier les MTD en utilisant l'IRM peut avoir un impact positif considérable sur l'endocrinologie clinique et la recherche de nouvelles avenues de recherche sur l'obésité. Eau-graisse précédente IRM (FWMRI) des études de BAT dans les deux souris et les humains montrent que la graisse signal-fraction (FSF) des MTD est de l'ordre de 40 à 80% de matières grasses, alors que WAT est supérieure à 90% de matières grasses 15,26 , 27. Nous émettons l'hypothèse donc que cette quantitative FWMRI métrique, en conjonction avec d'autres mesures quantitatives d'IRM, peut être utilisé dans les travaux futurs de visualiser et de quantifier les dépôts de MTD chez les humains. Cela permettrait à la communauté de la recherche d'un outil puissant pour étudier l'influence de BAT sur rencontréabolism et la dépense énergétique sans l'utilisation des rayonnements ionisants.
Notre groupe de recherche a étudié BAT chez les humains adultes pour les trois dernières années. Notre première présentation publique sur l'utilisation de l'IRM pour étudier soupçonnée MTD dans un adulte sujet humain a eu lieu en Février 2012 à la Société internationale pour la résonance magnétique en médecine (ISMRM) Séparation Fat-eau Atelier à Long Beach, en Californie 37. Deux mois plus tard, notre groupe a présenté des valeurs de la FSF en cas de suspicion MTD dans deux adultes à la 20 e réunion annuelle de la ISMRM en Avril 2012 à Melbourne, en Australie 38. Un an plus tard à la 21 e réunion annuelle de la ISMRM en Avril 2013 à Salt Lake City, Utah, le protocole décrit dans ce manuscrit a été utilisé pour la première (au meilleur de notre connaissance) présentation publique de l'IRM quantification de PET confirmés MTD dans un adulte humain soumet 39. Plus précisément, nous avons présenté des preuves montrant que le previously soupçonnée BAT a été confirmé comme MTD activable utilisant à la fois l'imagerie 18 F-FDG PET-CT froid activé et thermoneutre. Depuis 2013, notre cohorte d'adultes sujets humains sains imagée avec l'IRM et TEP / CT dans des conditions thermiquement neutres et froides activé a étendu à plus de 20 sujets avec des résultats présentés plus récemment en Février 2014 lors de l'atelier "Découverte du rôle de Brown Fat chez les humains », parrainé par le NIH NIDDK 40. Plus précisément, nous avons signalé FWMRI FSF et R 2 * propriétés de relaxation dans les régions de BAT-claviculaire confirmées par 18 F-FDG PET-CT chez les humains adultes, avec les ROI MTD délimitées en utilisant des algorithmes de segmentation automatique en fonction de la TEP-TDM froid activé et thermoneutre scans. Plus récemment, nous avons présenté les résultats de la cartographie de la température à 18 F-FDG PET-CT confirmé BAT chez les humains adultes en utilisant avancée FWMRI thermométrie 41,42.
La procédure présentée ici acquérirs l'IRM et 18 scans F-FDG PET-CT sur le même sujet, chacun après l'exposition à deux conditions froides activées et thermoneutres. Les 18 analyses F-FDG PET-CT froid activé et thermoneutres sont utilisés pour créer des régions segmentées automatiquement MTD d'intérêt (ROI), sur une base spécifique de sujet. Ces ROI MTD sont ensuite appliqués aux IRM co-enregistré pour mesurer les propriétés IRM dans le PET-CT confirmé BAT.
Une limitation de ce protocole est que la température de l'air utilisé lors de l'exposition des sujets soit le stimulus chaud ou froid est conforme pour chaque sujet. Ce est une limitation, car la température à laquelle chacune des expériences soumises sensation de chaleur ou réfrigéré peut être différente. Par conséquent, en exécutant une session d'essai pendant laquelle la température de l'air est ajustée à la réponse de l'individu, puis en utilisant ces températures pendant les protocoles thermoneutres et froid activation, il pourrait être possible d'obtenir de meilleures réponsesà partir du tissu adipeux brun.
Protocole
NOTE: Le comité d'éthique local de cet institut a approuvé cette étude, et tous les sujets ont donné par écrit le consentement éclairé avant la participation. Pour être admissible à l'étude, les sujets doivent remplir les conditions suivantes: pas connu le diabète sucré; pas d'utilisation de bêta-bloquants ou médicaments contre l'anxiété, actuellement ou dans le passé; ne pas fumer ou de mâcher des produits du tabac, actuellement ou dans le passé; pas plus de quatre tasses de caféine par jour; pas plus de deux verres d'alcool par jour; et si féminine, pas enceinte ou qui allaite.
NOTE: Dans cette étude, chaque participant subit quatre examens: deux IRM et deux PET-CT. Chaque examen est acquise sur un autre jour, à chaque modalité d'imagerie réalisée sous deux thermoneutre 24,5 ± 0,7 ° C (76,2 ± 1,3 ° F), et le froid 17,4 ± 0,5 ° C (63,4 ± 0,9 ° F) conditions. Les scans ne sont pas programmées dans un ordre particulier, en aidant à minimiser tout biais potentiel aux données en raison de chauffage ou de refroidissementle sujet dans un ordre spécifique. La dose de rayonnement effective totale pour une TEP-CT est de 6,4 mSv (millisievert), et le radiologue sur le personnel recommande une période de sevrage d'au moins 24 heures entre chaque balayage.
1. Généralités IRM sécurité et l'imagerie préoccupations
- Parce que le champ magnétique principal dans les machines IRM est toujours, prendre soin d'assurer la sécurité du patient et l'ensemble du personnel travaillant dans le domaine de MR. Effacez tous les objets magnétiques du sujet et des personnes travaillant dans le domaine.
- Demandez sujets au cours de la phase de recrutement se ils ont ne importe quel métal dans leur corps 43. En outre, ont fait l'objet de compléter un processus de sélection de sécurité magnétique 44 pour se assurer que ne importe quel métal dans le corps est approuvé pour l'IRM. Cette vérification initiale peut aider à éliminer la possibilité de consentir un sujet qui ne peut pas terminer l'IRM.
- En outre, se il existe ne importe quel métal dans le corps du sujet, qui est compatible avec MR, assurer thau métal ne est pas à proximité du tissu d'intérêt. Ce est parce que le métal peut provoquer des artefacts de distorsion d'image, ce qui rendra l'analyse difficile, voire impossible.
2. obtention du consentement éclairé
- Rencontre avec le sujet d'obtenir le consentement éclairé écrit. Lors de cette réunion, couvrir tous les détails de l'étude, par exemple: le nombre de visites, l'engagement de temps par visite, quelles sont les exigences du sujet concernant les limitations à l'exercice et / ou de la nourriture, ce que le sujet peut et ne peut pas faire au cours de la visite (comme le sommeil), et tous les autres détails. Utilisez cette réunion pour planifier les visites pour le balayage, car il est généralement plus facile de planifier ces en personne plutôt que d'utiliser plusieurs emails.
3. Procédures avant la visite
- Instructions pour l'Objet
- Pendant 24 heures avant d'arriver à l'étude, ont fait l'objet de se abstenir de l'alcool, la caféine, des médicaments ou tout exercice intense ou d'un acteivité.
- Demandez au sujet de jeûner et d'éviter toute apport calorique pendant 8 heures avant d'arriver à l'étude. Les sujets sont autorisés à boire de l'eau.
- Contacter bénévoles
- Rappelez volontaire des instructions spécifiques de la journée avant le début de leur préparation 24 heures. Ce est à la fois un rappel de l'analyse, ainsi que cela aide à se assurer que le sujet se souvient leurs restrictions, (ie., Ne pas manger, pas d'exercice, pas d'alcool, etc.).
4. Procédure lors de la Journée d'étude - pour l'IRM
- Température contrôlée Préparation de la salle
- Utilisation d'une petite pièce en tant que pièce à température contrôlée où le sujet est exposé à la température désirée.
NOTE: En utilisant une petite pièce, il est possible de réduire au minimum les gradients de température dans la chambre. Par exemple, la taille de la pièce utilisée ici est 7 'x 6' 8 "x 8, (373,33 pieds cubes) 'de hauteur. - Préparer lechambre au moins 60 min avant l'objet entrant dans la chambre pour permettre un temps suffisant pour la chambre pour atteindre une température stable.
- Maintenir la RT soit avec une unité de climatisation portable et un ventilateur de plancher tournant pour garder l'air frais de circulation, ou en utilisant un appareil de chauffage portatif programmable, qui oscille pour faire circuler l'air chaud dans la pièce.
- Désactiver ou minimiser tout thermostat existant contrôle de l'air conditionné ou le chauffage de la pièce pour éviter les conflits avec la cible RT souhaitée des appareils portables.
- Utilisation d'une petite pièce en tant que pièce à température contrôlée où le sujet est exposé à la température désirée.
- Avant d'entrer dans la chambre à température contrôlée
- Avoir le changement de l'objet en short et chemise médicaux standard. Retirer chaussettes et des chaussures. Si le sujet est une femme, permettre le port d'un soutien-gorge de sport qui ne contient aucun métal.
- Mesurer la hauteur, le poids et mesures tour de taille du sujet après avoir changé dans les vêtements standard.
- Mesurer la température du corps de l'usin du sujetga thermomètre sublinguale.
- Dans la chambre à température contrôlée
- Diriger l'objet d'entrer dans la salle à température contrôlée. Demandez au sujet de se asseoir tranquillement et non à une quelconque activité qui pourrait changer la température du corps, par exemple., L'exercice, la dactylographie, ou à l'endormissement.
- Après s'être assis dans la salle pendant 1 heure, mesurer la température du corps à nouveau en utilisant un thermomètre sublinguale.
- Après la deuxième h de assis dans la salle à température contrôlée, mesurer la température du corps à nouveau en utilisant un thermomètre sublinguale.
- Le jour IRM lorsque le sujet est assis dans la chambre froide, utiliser un gilet froid pour maintenir un environnement froid pendant que l'objet est transporté à l'appareil d'IRM. Placer le gilet froid sur le sujet avant l'objet de quitter la chambre à température contrôlée.
- Après 2 h dans la salle à température contrôlée, transporter le sujet dans un fauteuil roulant pour le scanner IRM. Utilisez le fauteuil roulant pour maintenir le sujet dans un relaxed, état sédentaire, et de minimiser les "réchauffement" qui pourrait se produire de la marche. En outre, utiliser le fauteuil roulant permet d'éviter toute absorption du traceur PET dans les muscles squelettiques, mais il serait probablement minimes.
- IRM Protocole Acquisition
- Acquérir IRM en utilisant un scanner IRM 3T équipée avec une capacité de transmission en parallèle à deux canaux, un extra-large torse 16 canaux bobine réceptrice, et une table modifiée.
- Accrochez la partie antérieure du torse bobine de réception à partir du haut de l'alésage du scanner dans une écharpe de tissu. Laisser la fronde pour accrocher suffisamment bas pour glisser contre le corps de l'objet afin de maximiser le rapport signal-bruit (SNR).
- Passer la partie postérieure du torse bobine réceptrice dans un roulement "wagon de bobine" en sandwich entre deux couches de la table. Comme la table se déplace à travers l'alésage du scanner, maintenez le wagon de la bobine à l'isocentre par des sangles attachées au scanner couvre à l'avant et l'arrière du til scanner alésage de sorte que l'élément de bobine postérieure reste stationnaire.
- Placez le sujet sur le lit pour entrer dans les pieds de scanner la première fois en position couchée.
- Si le sujet porte la veste froid, retirer le gilet avant le sujet couché.
- Une fois couché, ont fait l'objet lieu les deux bras dans un sac semblable à une taie d'oreiller, et abaisser les bras de chaque côté du corps. Cela permet de se assurer que les épaulements sont positionnés d'une manière similaire à la fois pendant l'IRM et la TEP / CT examens, ce qui rend l'image plus facile co-enregistrement.
REMARQUE: permettant au sujet de se allonger sur le lit du scanner naturelle, en utilisant la même quantité de rembourrage sous la tête pendant chaque balayage, et en utilisant le sac de taie d'oreiller pour soutenir les bras, tout contribue à minimiser les différences entre le sujet positionnement entre les balayages. Tout support utilisé pour le sujet pendant un balayage, par exemple un oreiller sous les genoux ou le bas du dos, doit toujours être utilisé de la même manière pour les eau sujet, à la fois pendant l'IRM et la TEP / TDM. - Acquérir IRM eau graisses (FWMRI) en utilisant un multi-pile, multi-coupes, multiple rapide sur le terrain écho (MFFE) acquisition avec sept piles de 20 coupes axiales, couvrant de la couronne de la tête à la cuisse. Tranches sont contigus avec un écart de 0 mm entre les tranches.
- Recueillir FWMRI scanne en utilisant un logiciel personnalisé pour permettre l'acquisition de huit échos acquis que deux ensembles entrelacés de quatre échos avec TR = 83 ms, TE 1 = 1,024 ms et ΔTE efficace = 0,779 ms. Autres détails du protocole d'acquisition comprennent: angle de bascule = 20º, changement de la graisse de l'eau = 0,323 pixels, la bande passante d'échantillonnage de lecture = 1346,1 Hz / pixel, axiale champ dans le plan de vue = 520 mm × 408 mm, taille de voxel acquis = 2 mm x 2 mm x 7,5 mm, et l'encodage de sensibilité (SENS) parallèle facteur d'imagerie = 3 (direction antéro-postérieur). phases de préparation pour chaque station comprennent la fréquence centrale (F 0) optimisation et calage premier ordre linéaire. Acquisitil'heure est de 27,8 s pour 20 tranches.
- Effectuer souffle détient pour les stations couvrant le bassin pour les épaules avec deux souffle détient par station, ce est à dire., Pas de souffle attente est plus longue de 14 secondes. A chaque position de la table, d'acquérir un double angle B une analyse d'étalonnage (temps d'acquisition de 15,1 sec) pour permettre RF optimisée calage (par rapport amplitude RF et des ajustements de phase) pour la capacité de transmission à deux canaux du scanner.
- Acquérir un balayage de référence SENSE à chaque position de la table avec un temps d'acquisition de 12,1 sec. FWMRI paramètres recommandés sont indiqués dans le tableau 1.
5. Procédure lors de la Journée d'étude - pour le PET-CT
- Température contrôlée Préparation de la salle
- Utilisation d'une petite pièce en tant que pièce à température contrôlée où le sujet est exposé à la température désirée.
NOTE: En utilisant une petite pièce, il est possible de réduire au minimum les gradients de température dans la chambre. Faou par exemple, la taille de la pièce utilisée ici est 7 'x 6' 8 "x 8, (373,33 pieds cubes) 'de hauteur. - Préparer la chambre au moins 60 minutes avant le sujet entrant dans la salle à laisser suffisamment de temps pour la chambre pour atteindre une température stable.
- Maintenir la RT soit avec une unité de climatisation portable et d'un ventilateur tournant au sol pour garder l'air frais circulant pour atteindre la température de relance à froid, ou en utilisant un appareil de chauffage portatif de oscaillating pour maintenir la température thermoneutre.
- Désactiver ou minimiser tout thermostat existant contrôle de l'air conditionné ou le chauffage de la pièce pour éviter les conflits avec la cible RT souhaitée des appareils portables.
- Utilisation d'une petite pièce en tant que pièce à température contrôlée où le sujet est exposé à la température désirée.
- Préparation Objet
- Dirigez le sujet à la suite de l'imagerie TEP d'avoir un port IV placé dans une veine de la main ou du bras. Ce port IV permet au technicien de radiologie pour injecter le traceur radioactif plus tard, lorsque le sujet est assis dans la salle à température contrôlée.
- Jef le sujet est une femme, effectuer un test de grossesse de sérum de sang pour se assurer qu'elle ne est pas enceinte.
NOTE: Pour cette étude, la commission d'examen interne nécessite un test de grossesse à moins de 24 heures avant le balayage TEP / CT en cours d'acquisition.
- Avant d'entrer dans la chambre à température contrôlée
- Avoir le changement de l'objet en short et chemise médicaux standard. Retirer chaussettes et des chaussures. Si le sujet est une femme, permettre le port d'un soutien-gorge de sport qui ne contient aucun métal.
- Mesurer la hauteur, le poids et mesures tour de taille du sujet après avoir changé dans les vêtements standard.
- Mesurer la température du corps du sujet en utilisant un thermomètre sublinguale.
- Dans la chambre à température contrôlée
- Diriger l'objet d'entrer dans la salle à température contrôlée. Demandez au sujet de se asseoir tranquillement et non à une quelconque activité qui pourrait changer la température du corps, par exemple, l'exercice, la dactylographie, ou à l'endormissement.
- Après s'être assis dans la salle pendant 1 heure, mesurer la température du corps à nouveau en utilisant un thermomètre sublinguale.
- Sur les PET-CT scan jours après la première heure dans la salle à température contrôlée, demandez à un technicien de radiologie administrer l'injection de Fluorodéoxyglucose (18 F-FDG) via le port IV. Injecter 0,14 mCi / kg (environ 10 mCi pour un sujet de 70 kg) de 18 F-FDG. Calculer la dose exacte basée sur le sujet poids spécifique.
- Après la deuxième h de assis dans la salle à température contrôlée, mesurer la température du corps à nouveau en utilisant un thermomètre sublinguale.
NOTE: Contrairement aux jours d'IRM froides, l'utilisation de la veste froid est inutile jours froids PET-CT, car le traceur 18 F-FDG est repris dans le BAT activé pendant la post-injection de traceur heures. Le traceur ne laissera pas le tissu même si le sujet devient chaud comme il / elle est transportée au scanner. Par conséquent, comme il est possible de détecter la présence de activé deed BAT sur les images PET-CT, même si la BAT ne reste pas actif pendant la TEP-CT, la veste à froid ne est pas nécessaire. - Après 2 h dans la salle à température contrôlée, transporter le sujet dans un fauteuil roulant pour le scanner PET-CT. Utilisez le fauteuil roulant pour maintenir le sujet dans un état sédentaire détendu, et de minimiser tout "réchauffement" qui pourrait se produire de la marche. En outre, utiliser le fauteuil roulant permet d'éviter toute absorption du traceur PET dans les muscles squelettiques, mais il serait probablement minimes.
- PET-CT Protocole Acquisition
- Acquérir TEP-CT sur un scanner Discovery STE PET / CT (STE signifie examiner et traiter Elite).
- Placez le sujet sur le lit pour entrer dans la tête de scanner la première fois en position couchée.
- Une fois couché, ont fait l'objet lieu les deux bras dans un sac semblable à une taie d'oreiller, et abaisser les bras de chaque côté du corps. Cela permet de se assurer que les épaulements sont positionnés d'une manière similaire à la fois pendantIRM et TEP / TDM, ce qui rend l'image de co-enregistrement plus facile.
NOTE: Le champ de vision imagerie PET / CT couvre de la couronne de la tête à la mi-cuisse à 7-9 positions de lit, selon le sujet hauteur (2 min par position de lit). Paramètres PET-CT recommandées sont listées dans le tableau 2.
6. IRM post-traitement
- Enregistrer des images réelles et imaginaires MR pour hors ligne signal de processing.The mesurée par IRM est une grandeur vectorielle avec à la fois l'ampleur et la direction qui peut être représenté comme un nombre complexe avec des parties réelles et imaginaires. Dans le contexte clinique, les images d'amplitude sont généralement affichées. Cependant, l'information complexe est nécessaire pour le traitement dans les images de graisse et d'eau.
- Effectuer trois dimensions de l'eau / séparation des graisses et R 2 * estimation basée sur un multi-échelle toute image algorithme d'optimisation 45 implémenté en C ++ pour chaque pile de tranche individuelle. Fat est modélisée en utilisant neuf sommets jusqu'à> 46.
- Jeter le premier écho de chaque train 4 écho pour éviter toute contamination du courant de Foucault dans le modèle complexe de signal de l'eau en matières grasses.
7. PET-CT Post Processing
- Charger des données CT DICOM dans MATLAB et convertir en unités Hounsfield (HU) en appliquant la valeur de normalisation scanner fourni aux valeurs de données.
- Charger des données PET DICOM dans MATLAB et les convertir en valeurs normalisées absorption (SUV) à l'aide de la formule suivante:
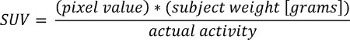
où "valeur de pixel" est la valeur stockée dans le fichier DICOM pour cet emplacement de pixel.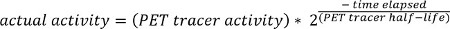
NOTE: L'activité de traceur PET est la dose totale de radionucléide, et peut être lu à partir de l'image de méta-données (DICOM de fichiers d'en-tête).
.jpg "/> - Interpoler les données de PET d'avoir les mêmes dimensions que les données de CT.
- Parce que PET et CT images sont acquises avec la même épaisseur de coupe, effectuer une interpolation en utilisant une fonction spline deux dimensions dans le plan XY.
8. Les données post-traitement
- Pour analyser les images, co-enregistrer toutes les quatre images-volumes pour chaque sujet en utilisant un algorithme d'enregistrement de corps rigide 47 par une méthode semi-automatisée avec développé en interne vue trois-plan logiciel pour vérifier l'inscription dans les trois dimensions.
- En raison de difficultés avec l'enregistrement de l'ensemble du volume d'image dans l'ensemble des quatre points dans le temps, se concentrer sur la région enregistrement recouvrant le cou jusqu'au sommet des poumons. Utilisez uniquement la région enregistré avec succès dans la transformation des données.
- Après l'enregistrement de l'image, charger FWMRI, CT HU et des données PET SUV dans MATLAB et utiliser pour définir des régions de MTD d'intérêt.
NOTE: Comme précédemment publduire les méthodes 19,25,48 de distinguer BAT utilisant des valeurs PET SUV et CT HU, être considérés comme faisant partie du masque de BAT, chaque voxel dans l'image doit remplir les conditions suivantes: (1) la valeur HU tombe dans la gamme de: -200 2.0 sur le PET scan froide; (3) la fraction de signal de SUV [(Cold SUV) / (+ SUV SUV froide Chaud)]> 0,55, soit le TEP froid doit produire plus de 55% du total observé par le fait que le signal SUV voxel; et (4) ne contenir que pixels de premier plan de l'IRM, où la méthode d'Otsu 49 est utilisé pour classer les pixels de premier plan. - Si un voxel remplit tous ces critères, inclure le voxel dans le masque binaire de l'identité de BAT.
- Appliquer les étapes de la morphologie binaires suivants.
- Créer une matrice de la même taille que les images en cours de traitement. Chaque emplacement spatial dans la nouvelle matrice est la somme 3D de l'ensemble de ses voisins adjacents dans le masque binaire de BAT, dont les diagonales. Le maximum sum est 26.
- Seuil cette nouvelle matrice d'inclure seuls endroits avec 15 ou plusieurs voisins 3D. Cette matrice forme alors la finale masque de BAT binaire.
NOTE: Ces règles sont suffisantes pour tissus segment de BAT, et aucune autre modification du masque est nécessaire pour éliminer voxels non-BAT. Cela forme un masque tranche par tranche de TEP-TDM a confirmé BAT dans la région de l'épaule co-enregistré.
- Appliquer le masque à toutes les images de co-enregistré pour acquérir la fraction SUV, HU, la graisse signal (FSF) et R 2 * valeurs dans les régions de chauve-souris, tant pour les analyses froides et chaudes.
Résultats
L'acquisition de deux IRM et PET-CT scans sur le même sujet, et la réalisation de co-enregistrement sur tous les scans permet une mesure fiable de mesures IRM quantitatives de BAT. La figure 1 montre l'échauffement non transformés (TN) et le froid (CA) TEP-TDM et l'IRM scans d'un sujet. Par l'acquisition de données à la fois TN et CA PET-CT, il est possible de distinguer clairement les dépôts sur les MTD froid activé par l'augmentation de l'absorption 18
Discussion
Le protocole d'étude décrit est conçu pour utiliser à la fois thermoneutre et à froid activé PET / CT automatiquement segments MTD dépôts sur une base spécifique de sujet. Ces régions générés automatiquement d'intérêt peuvent ensuite être appliquées aux deux IRM thermoneutres et à froid activé qui ont été co-inscrits aux TEP / CT du même sujet. Au meilleur de notre connaissance, ce est la première recherche pour effectuer l'IRM et TEP / CT après conditions thermiquement et à froid ac...
Déclarations de divulgation
The authors declare that they have no competing financial interests or other conflicts of interests.
Remerciements
We would like to thank the Vanderbilt University Institute of Imaging Science MRI technologists David Pennell, Leslie McIntosh, and Kristen George-Durrett, and the team of Vanderbilt University Medical Center PET/CT technologists led by Martha D. Shone. This work was supported by the following grants from the NIH: NCATS/NIH UL1 RR024975, NIDDK/NIH R21DK096282, NCI/NIH R25CA136440, and NIBIB/NIH T32EB014841.
matériels
| Name | Company | Catalog Number | Comments |
| Name of Material/ Equipment | Company | Catalog Number | |
| MRI | Philips | Achieva 3T | |
| MRI Torso-XL coil | Philips | Philips SENSE XL Torso coil 16-elements | |
| MRI X-tend Table | X-Tend | X-tend table, Acieva 3T compatible | |
| X-tend armsupport | X-Tend | X-tend, accessories | |
| X-tend fabricsling | X-Tend | X-tend, accessories | |
| PET/CT | GE | Discovery STE | |
| Portable A/C Unit | Soleus Air | XL-140, 14000 BTU | |
| Floor fan | Lasko Pedestal Fan | 2527 | |
| Portable Heater | Lasko Ceramic Air | 5536 | |
| Chair | Winco Lifecare Recliner | 585 | |
| Sublingual Thermometer | WelchAllyn | SureTemp Plus 690 | |
| Cold vest | Polar Products | Cool58 #PCVZ | |
| Thermal IR Camera | FLUKE | TIR-125 |
Références
- Eckel, R. H., Alberti, K. G. M. M., Grundy, S. M., Zimmet, P. Z. The metabolic syndrome. Lancet. 375 (9710), 181-183 (2010).
- Cinti, S. Between brown and white: novel aspects of adipocyte differentiation. Annals of Medicine. 43 (2), 104-115 (2011).
- Stephens, M., Ludgate, M., Rees, D. A. Brown fat and obesity: the next big thing. Clinical Endocrinology. 74 (6), 661-670 (2011).
- Cannon, B., Brown Nedergaard, J. adipose tissue: function and physiological significance. Physiological Reviews. 84 (1), 277-359 (2004).
- Yoneshiro, T. Age-related decrease in cold-activated brown adipose tissue and accumulation of body fat in healthy humans. Obesity (Silver Spring, Md). 19 (9), 1755-1760 (2011).
- Seale, P., Lazar, M. a Brown fat in humans: turning up the heat on obesity). Diabetes. 58 (7), 1482-1484 (2009).
- Van Marken Lichtenbelt, W. Human brown fat +and obesity: methodological aspects. Frontiers In Endocrinology. 2 (October), 52 (2011).
- Frühbeck, G., Becerril, S., Sáinz, N., Garrastachu, P., García-Velloso, M. J. BAT: a new target for human obesity. Trends in Pharmacological Sciences. 30 (8), 387-396 (2009).
- Himms-Hagen, J. Thermogenesis in brown adipose tissue as an energy buffer. Implications for obesity. New England Journal of Medicine. 311 (24), 1549-1558 (1984).
- Bartelt, A. Brown adipose tissue activity controls triglyceride clearance. Nature Medicine. 17 (2), 200-205 (2011).
- Nedergaard, J., Bengtsson, T., Cannon, B. New powers of brown fat: fighting the metabolic syndrome. Cell Metabolism. 13 (3), 238-240 (2011).
- Kirov, S. A., Talan, M. I., Engel, B. T. Sympathetic outflow to interscapular brown adipose tissue in cold acclimated mice. Physiology & Behavior. 59 (2), 231-235 (1996).
- Guerra, C., Koza, R. A., Yamashita, H., Walsh, K., Kozak, L. P. Emergence of brown adipocytes in white fat in mice is under genetic control. Effects on body weight and adiposity. Journal of Clinical Investigation. 102 (2), 412-420 (1998).
- Kawate, R., Talan, M. I., Engel, B. T. Sympathetic nervous activity to brown adipose tissue increases in cold-tolerant mice. Physiology & Behavior. 55 (5), 921-925 (1994).
- Hu, H. H., Smith, D. L., Nayak, K. S., Goran, M. I., Nagy, T. R. Identification of brown adipose tissue in mice with fat-water IDEAL-MRI. Journal of Magnetic Resonance Imaging. 31 (5), 1195-1202 (2010).
- Heaton, J. M. The distribution of brown adipose tissue in the human. Journal of Anatomy. 112 (Pt 1), 35-39 (1972).
- Tanuma, Y., Tamamoto, M., Ito, T., Yokochi, C. The occurrence of brown adipose tissue in perirenal fat in Japanese). Archivum histologicum Japonicum = Nihon soshikigaku kiroku. 38 (1), 43-70 (1975).
- Huttunen, P., Hirvonen, J., Kinnula, V. The occurrence of brown adipose tissue in outdoor workers. European Journal Of Applied Physiology And Occupational Physiology. 46 (4), 339-345 (1981).
- Cohade, C., Osman, M., Pannu, H. K., Wahl, R. L. Uptake in supraclavicular area fat (“USA-Fat”): description on 18F-FDG PET/CT. Journal of Nuclear Medicine Official Publication, Society Of Nuclear Medicine. 44 (2), 170-176 (2003).
- Virtanen, K. A. Functional brown adipose tissue in healthy adults. New England Journal of Medicine. 360 (15), 1518-1525 (2009).
- Van Marken Lichtenbelt, W. D. Cold-activated brown adipose tissue in healthy men. New England Journal of Medicine. 360 (15), 1500-1508 (2009).
- Zingaretti, M. C., Crosta, F., Vitali, A., Guerrieri, M., Frontini, A., Cannon, B. The presence of UCP1 demonstrates that metabolically active adipose tissue in the neck of adult humans truly represents brown adipose tissue. Journal of the Federation of American Societies for Experimental Biology. 23 (9), 3113-3120 (2009).
- Saito, M. High incidence of metabolically active brown adipose tissue in healthy adult humans: effects of cold exposure and adiposity. Diabetes. 58 (7), 1526-1531 (2009).
- Nedergaard, J., Bengtsson, T., Cannon, B. Unexpected evidence for active brown adipose tissue in adult humans. American Journal of Physiology. Endocrinology and Metabolism. 293 (2), E444-E452 (2007).
- Cypess, A. M. Identification and importance of brown adipose tissue in adult humans. New England Journal of Medicine. 360 (15), 1509-1517 (2009).
- Hu, H. H., Tovar, J. P., Pavlova, Z., Smith, M. L., Gilsanz, V. Unequivocal identification of brown adipose tissue in a human infant. Journal of Magnetic Resonance Imaging. 35 (4), 938-942 (2012).
- Hu, H. H., Perkins, T. G., Chia, J. M., Gilsanz, V. Characterization of human brown adipose tissue by chemical-shift water-fat MRI. AJR. American Journal Of Roentgenology. 200 (1), 177-183 (2013).
- Ponrartana, S., Hu, H. H., Gilsanz, V. On the relevance of brown adipose tissue in children. Annals of the New York Academy of Sciences. , 1-6 (2013).
- Chalfant, J. S. Inverse association between brown adipose tissue activation and white adipose tissue accumulation in successfully treated pediatric malignancy. The American Journal Of Clinical Nutrition. 95 (5), 1144-1149 (2012).
- Gilsanz, V., Smith, M. L., Goodarzian, F., Kim, M., Wren, T. a. L., Hu, H. H. Changes in Brown Adipose Tissue in Boys and Girls during Childhood and Puberty. Journal of Pediatrics. , 1-7 (2011).
- Chen, Y. -. C. I. Measurement of human brown adipose tissue volume and activity using anatomic MR imaging and functional MR imaging. Journal Of Nuclear Medicine Official Publication, Society Of Nuclear Medicine. 54 (9), 1584-1587 (2013).
- Van Rooijen, B. D. Imaging Cold-Activated Brown Adipose Tissue Using Dynamic T2*-Weighted Magnetic Resonance Imaging and 2-Deoxy-2-[18F]fluoro-D-glucose Positron Emission Tomography. Investigative Radiology. 48 (10), 1-7 (2013).
- Vosselman, M. J. Brown adipose tissue activity after a high-calorie meal in humans. The American Journal Of Clinical Nutrition. 98 (1), 57-64 (2013).
- Chen, K. Y. Brown fat activation mediates cold-induced thermogenesis in adult humans in response to a mild decrease in ambient temperature. The Journal of Clinical Endocrinology And Metabolism. 98 (7), E1218-E1223 (2013).
- Van der Lans, A. A. J. J., et al. Cold acclimation recruits human brown fat and increases nonshivering thermogenesis. The Journal Of Clinical Investigation. 123 (8), 3395-3403 (2013).
- Ma, S. W., Foster, D. O. Uptake of glucose and release of fatty acids and glycerol by rat brown adipose tissue in vivo. Canadian Journal Of Physiology And Pharmacology. 64 (5), 609-614 (1986).
- Gifford, A. T1 and Fat-Water Fraction Measurements in an Adult Human: Possible Markers for Brown Adipose Tissue. Proceedings of the International Society for Magnetic Resonance in Medicine: Workshop on Fat-Water Separation. 20 (1269), (2012).
- Gifford, A. Preliminary Indication of Brown Adipose Tissue in Adult Humans Using Fat-Water MRI. Proceedings of the International Society for Magnetic Resonance in Medicine. 21 (1520), (2013).
- Gifford, A. Detection of Brown Adipose Tissue in an Adult Human Using Fat-Water MRI with Validation by Cold-activated PET. Proceedings of the International Society for Magnetic Resonance in Medicine. 21 (1520), (2013).
- Gifford, A., Welch, E. B. Fat-Water MRI Properties of Brown Adipose Tissue in Adult Humans Using Automated Depot Segmentation Based on Cold-Activated and Thermoneutral PET-CT. NIH NIDDK Workshop on Exploring the Role of Brown Fat in Humans. 15, (2014).
- Welch, E. B., Gifford, A., Towse, T. F. Phantom validation of temperature mapping using fat-water MRI with explicit fitting of water peak location. Proceedings of the International Society for Magnetic Resonance in Medicine. 22 (3065), (2014).
- Gifford, A., Towse, T. F., Avison, M. J., Welch, E. B. Temperature mapping in Human Brown Adipose Tissue Using Fat-Water MRI with Explicit Fitting of Water Peak Location. Proceedings of the International Society for Magnetic Resonance in Medicine. 22 (275), (2014).
- Shellock, F. G. . Reference Manual for Magnetic Resonance Safety, Implants and Devices 2014. , (2014).
- Berglund, a. t., Ahlström, J., H, J., Kullberg, Model-based mapping of fat unsaturation and chain length by chemical shift imaging--phantom validation and in vivo feasibility. Magnetic resonance in medicine official journal of the Society of Magnetic Resonance in Medicine / Society of Magnetic Resonance in Medicine. 68 (6), 1815-1827 (2012).
- Hamilton, G. In vivo characterization of the liver fat 1H MR spectrum. NMR in Biomedicine. 24 (7), 784-790 (2011).
- Maes, F., Collignon, a., Vandermeulen, D., Marchal, G., Suetens, P. Multimodality image registration by maximization of mutual information. IEEE Transactions On Medical Imaging. 16 (2), 187-198 (1997).
- Ouellet, V. Outdoor temperature, age, sex, body mass index, and diabetic status determine the prevalence, mass, and glucose-uptake activity of 18F-FDG-detected BAT in humans. Journal of Clinical Endocrinology and Metabolism. 96 (1), 192-199 (2011).
- Otsu, N. A Threshold Selection Method from Gray-Level Histograms. IEEE Transactions on Systems, Man, and Cybernetics. 9 (1), 62-66 (1979).
- Yoneshiro, T. Recruited brown adipose tissue as an antiobesity agent in humans. The Journal of Clinical Investigation. 123 (8), 3404-3408 (2013).
- Farmer, S. R. Obesity: Be cool, lose weight. Nature. 458 (7240), 839-840 (2009).
- Van der Lans, A. a. J. J., et al. Cold-Activated Brown Adipose Tissue In Human Adults - Methodological Issues. American Journal Of Physiology. Regulatory, Integrative And Comparative Physiology. 31, (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon