Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
بوساطة فج تسليم المستهدف الحمض الريبي النووي الذواب يبني لاسقاط التعبير الجيني في
We describe a method to knock down gene expression in a growing population of E. coli cells using sequence-targeted sRNA expression cassettes delivered by an M13 phagemid vector.
وتستخدم على نطاق واسع knockdowns بوساطة الحمض النووي الريبي للسيطرة على التعبير الجيني. هذه العائلة تنوعا من تقنيات يجعل من استخدام الحمض النووي الريبي قصيرة (الحمض الريبي النووي الذواب) التي يمكن توليفها مع أي تسلسل والمصممة لتكمل أي الجينات المستهدفة لإسكات. لأنه لا يمكن إدخالها إلى العديد من أنواع الخلايا مباشرة أو باستخدام مجموعة متنوعة من ناقلات الحمض الريبي النووي الذواب يبني، التعبير الجيني يمكن قمعها في الخلايا الحية دون التعديل الوراثي شاقة. الحمض النووي الريبي الأكثر شيوعا التكنولوجيا ضربة قاضية، تدخل الحمض النووي الريبي (رني)، يستفيد من إسكات المعقدة (RISC) الناجم عن الحمض النووي الريبي للتوسط الذاتية تسلسل الاعتراف والانقسام من مرنا الهدف. لذا تقتصر تطبيقات هذه التقنية إلى RISC، معربا عن الكائنات الحية، في المقام الأول حقيقيات النوى. في الآونة الأخيرة، جيل جديد من التكنولوجيا الحيوية RNA وضعت آليات بديلة للسيطرة على التعبير الجيني عن طريق الحمض النووي الريبي، وهكذا أصبح ممكنا knockdowns الجينات بوساطة الحمض النووي الريبي في البكتيريا. نحن هنا تصف طريقة لإسكات الجينات اكسبريسسيون في E. القولونية يشبه وظيفيا رني. في هذا النظام تم تصميم phagemid الاصطناعية للتعبير عن الحمض الريبي النووي الذواب، والذي قد صمم لاستهداف أي تسلسل. يتم تسليم بناء التعبير لسكان E. خلايا القولونية مع فج M13 غير التحللي، وبعد ذلك أنها قادرة على تكرار مستقر كما البلازميد. وتوسطت الاعتراف العقاقير وإسكات مرنا الهدف من البروتين Hfq، الذاتية لE. القولونية. ويشمل هذا البروتوكول طرق لتصميم الحمض الريبي النووي الذواب العقاقير، وبناء ناقلات phagemid، التعبئة والتغليف وphagemid إلى M13 الجراثيم، وإعداد السكان الخلية الحية للعدوى، وأداء العدوى نفسها. وتستهدف بروتين فلوري mKate2 والكلورامفينيكول أسيتيل المقاومة للمضادات الحيوية الجين (CAT) لتوليد البيانات تمثيلا ولقياس فعالية ضربة قاضية.
knockdowns الجينات بوساطة الحمض النووي الريبي المضي قدما في مرحلتين. أولا، يتم إدخال جزيء RNA إلى خط الخلية أو الكائن الحي من الدراسة. ثانيا، البروتينات ملزم RNA الذاتية تسهل الاعتراف الحمض النووي الريبي الهدف وتنتج تأثير إسكات. تستفيد جميع التكنولوجيات RNA ضربة قاضية من طبيعة قابلة للتخصيص من sRNAs الاصطناعية، والتي يمكن أن تنتج بسهولة لتتناسب مع هدف محدد من الفائدة. ومع ذلك، فإن التفاصيل الجزيئية امتصاص الحمض النووي الريبي وإسكات تختلف على نطاق واسع عبر نظام نموذجي، تقييد أين وكيف يمكن تطبيقها knockdowns الحمض النووي الريبي.
في الديدان الخيطية، RNA المزدوج تقطعت بهم السبل (الرنا المزدوج الجديلة) جزيئات يمكن إدخالها مباشرة في وسائل الإعلام أو عن طريق تغذية الديدان التي يبلغ عدد سكانها الرنا المزدوج الجديلة، معربا عن E. خلايا القولونية 1،2. في ذبابة الفاكهة، رني يمكن أن يتحقق عن طريق microinjecting الأجنة مع الرنا المزدوج الجديلة 3، أو ينفذ في خطوط الخلايا ببساطة عن طريق إضافة الرنا المزدوج الجديلة إلى مستنبت 4. في خطوط خلايا الثدييات،قد يتم تسليم الاصطناعية الرنا التدخل الصغيرة (الرناوات siRNAs) إلى الخلايا الحية التي Electroporation لل1،2،5، وتعبئتها في الجسيمات الشحمية 3،6، أو أعرب من ناقلات البلازميد 4،7. وبمجرد وصول الأنواع RNA العصارة الخلوية، يعتمد مسار رني على مجمع RISC لمعالجة الرنا المزدوج الجديلة، تسهيل التعرف العقاقير من الهدف، وتحفيز القمع متعدية، وتدهور مرنا، أو تشكيل المغاير، اعتمادا على المضيف.
وبسبب هذه المتطلبات، الكلاسيكية رني يمكن القيام بها إلا في الكائنات الحية التي تتناول RNA خارجي بكفاءة والتعبير عن RISC أو نشاط RISC مثل. والجدير بالذكر أن هذا يستبعد نموذج بكتيريا E. القولونية، التي تفتقر إلى مسار رني. ومع ذلك، التطورات الحديثة في علم الأحياء الاصطناعية توفر الأدوات اللازمة للحل على حد سواء مشكلة تسليم ومشكلة إسكات.
في هذا البروتوكول، ويتم التعبير عن ثوابت الحمض الريبي النووي الذواب في E. القولونية من ناقلات الحمض النووي تسليمها للىفينج الخلايا باستخدام نظام phagemid / المساعد M13. وphagemid هو أي البلازميد مع الأصل المشتقة فج F1 النسخ المتماثل. البلازميد المساعد، في هذه الحالة M13KO، يحمل كل المعدات اللازمة لإنتاج جزيئات فيروسية، ولكن ليس في حد ذاته المختصة للنسخ المتماثل والتعبئة والتغليف. عندما شارك في حولت phagemid والبلازميد المساعد، يتم نسخ phagemid وحدها في أصل F1، وتعبئتها ويفرز. وphagemid vectorized هو ثم المختصة لتصيب الحية E. القولونية عن طريق شعرة F.
في هذا النظام، وينتج تأثير إسكات بواسطة أشرطة الحمض الريبي النووي الذواب مخصصة الجمع بين تسلسل سقالة مع تسلسل ملزم الهدف. تسلسل ملزم الهدف هو 24 زوجا قاعدة العقاقير إلى الهدف مرنا، وعادة في موقع ملزمة الريبوسوم (RBS). تسلسل سقالة، التي وضعتها نا وزملاؤه 8، يحتوي على عزر ملزم Hfq المستخرجة من MICC، وهو RNA التنظيمي صغير الذاتية لE. القولونية. البروتين Hfq يحفز الحمض النووي الريبي RNA المربوطة ز وتدهور مرنا، يقضي دور في هذا النظام مشابه لRISC في رني الشكل 1 يصور المخطط الكامل لknockdowns الحمض الريبي النووي الذواب بوساطة فج، بما في ذلك بنية الحمض الريبي النووي الذواب كاسيت، كمية موجهة phagemid، وإسكات الآلية.
كوسيلة لتعديل الجينات في هاء القولونية، الحمض الريبي النووي الذواب إسكات بسيط وسريع وتنوعا. هاء المستهدفة لا مثقلة القولونية وراء الترويج لphagemid والتعبير عن الحمض الريبي النووي الذواب. وقد يكون ذلك مناسبا في سياق البيولوجيا التركيبية أو البحوث الأساسية حيث التعبير عن ثوابت مغاير أكبر يمكن أن يجهد موارد الخلوية 9. Phagemids مع أهداف جديدة يمكن أن تنتج مع PCR واحد وحصاد يوم واحد بعد التحول phagemid. وأخيرا، أي ما يقرب من مرنا يمكن أن تكون مستهدفة. وقد تبين اللائحة كاسيت الحمض الريبي النووي الذواب (على البلازميد قياسي) للعمل على مجموعة متنوعة من الأهداف في التمثيل الغذائي لديهم مستويات القمع النموذجية> 90٪ 8.
SS = "jove_content"> هذا البروتوكول يستنسخ ويوسع على العمل في وقت سابق باستخدام phagemid المولد الحمض الريبي النووي الذواب أشرطة 10. أولا، يتم إدخال phagemid تعبئتها إلى ثقافة دفعة من E. خلايا القولونية وتستخدم لإسكات التعبير عن بروتين فلوري mKate2. ويتم رصد التغيرات مضان اللاحقة في الوقت الحقيقي. ثانيا، هدمت الجينات CAT يظهر للحد من مقاومة الكلورامفينيكول المظهرية على لوحات أجار. في كلتا الحالتين، فإن phagemid نفسه يحمل علامة GFP، مما يسمح معدل الإصابة إلى أن تقاس بشكل مستقل عن كفاءة ضربة قاضية.
1. تصميم وبناء Phagemid ناقلات تحمل الحمض الريبي النووي الذواب إسكات كاسيت
- دي نوفو تصميم الحمض الريبي النووي الذواب إسكات كاسيت 8
- تحديد التسلسل الكامل للمرنا لإسكات باستخدام قاعدة بيانات تسلسل الحمض النووي. لإنشاء تسلسل الهدف، لاحظ 24 بي بي الأول من تسلسل الترميز، من موقف 1-24 بدءا من كودون بداية (على سبيل المثال، ATG).
ملاحظة: إسكات هو أقل كفاءة عندما يتم استهداف مواقع أو شرائح مرنا أخرى 8. - اتخاذ تكملة العكسي من تسلسل الهدف لإنتاج سلسلة دليل للكاسيت الحمض الريبي النووي الذواب. انظر الجدول رقم 1 للحصول على أمثلة من الهدف ودليل تسلسل للأسيتيل الكلورامفينيكول (CAT).
- لتصميم 292 نقطة أساس التعبير الحمض الريبي النووي الذواب كامل كاسيت، وترتيب العلاقات العامة المروج، تسلسل دليل، Hfq البروتين نطاق ملزمة وT1 / TE تسلسل فاصل النسخي في سلسلة (الجدول 2).
- إضافة مواقع الاستنساخ إضافية من خيار لتسهيل استنساخ الكاسيت الحمض الريبي النووي الذواب في ناقلات الهدف.
- الحصول على كاسيت الحمض الريبي النووي الذواب الكامل من خلال التوليف الجيني تجاري أو طريقة مماثلة واستنساخ عليه في أي ناقلات phagemid مع F1 الوظيفي أصل تكرار 11. انظر المعلومات الداعمة لتسلسل كامل للناقلات phagemid النهائي.
- تحديد التسلسل الكامل للمرنا لإسكات باستخدام قاعدة بيانات تسلسل الحمض النووي. لإنشاء تسلسل الهدف، لاحظ 24 بي بي الأول من تسلسل الترميز، من موقف 1-24 بدءا من كودون بداية (على سبيل المثال، ATG).
- تغيير تسلسل المستهدفة من قبل كاسيت الحمض الريبي النووي الذواب التعبير الحالية باستخدام الموقع PCR القائم إخراج الطفرات 12
- تحديد تسلسل دليل 24 نقطة أساس في الكاسيت التعبير الحمض الريبي النووي الذواب القائمة. ملاحظة: pAB.001 البلازميد المشروح، وتستخدم في هذا العمل، يتوفر كملف تسلسل التكميلي.
- تصميم الأمام وعكس الاشعال مع المناطق قصيرة من التماثل إلى الكاسيت الحمض الريبي النووي الذواب القائمة المرافقة 24 نقطة أساس تسلسل جديد دليل. الحصول على الاشعال من خلال التوليف النوكليوتيد التجاري.
ملاحظة: التصميم التمهيدي لالطفرات الموجهة الموقع depicتيد في الشكل 2. يتم توفير تسلسل قالب التمهيدي بالضبط في الجدول 3. - إعداد ثقافة 5 مل من E. كولاي تحمل phagemid قالب التعبير الحمض الريبي النووي الذواب. تنمو الخلايا بين عشية وضحاها في 37 درجة مئوية مع الهز، في وسائل الإعلام LB مع المضادات الحيوية المناسبة.
- استخراج وتنقية قالب الحمض الريبي النووي الذواب التعبير phagemid من 5 مل ثقافة البكتيرية باستخدام طقم الحمض النووي miniprep أو طريقة مماثلة (12).
- إعداد اثنين من ردود الفعل PCR باستخدام phagemid قالب التعبير الحمض الريبي النووي الذواب وارتفاع البلمرة الإخلاص، واحدة مع الأمام واحد مع التمهيدي العكسي (الجدول 4). استخدام شروط PCR على النحو الموصى به من قبل المورد البلمرة (الجدول 5). زيادة تركيز قالب ل10-50x أعلى من رد فعل قياسي لحساب الحقيقة أن رد الفعل التمهيدي واحد لا ينتج التضخيم الهائل.
- الجمع بين اثنين من ردود الفعل PCR المذكورة أعلاه في أنبوب microcentrifuge. Anneaل المنتجات عن طريق التسخين إلى 98 درجة مئوية في حمام ماء يغلي. مباشرة بعد وضع أنبوب microcentrifuge في حمام مائي، وإزالة مصدر الحرارة، والسماح للحمام للعودة ببطء إلى درجة حرارة الغرفة خلال 1-2 ساعة.
- للقضاء على unmutated قالب الحمض الريبي النووي الذواب التعبير phagemid، إضافة 1 ميكرولتر. DpnI تقييد انزيم إلى الخليط واحتضان عند 37 درجة مئوية لمدة 1 ساعة، أو الوقت الموصى به من قبل الشركة المصنعة للهضم الكامل.
ملاحظة: DpnI يساعد على هضم المواقع المستهدفة فقط مثيلة، والتي هي موجودة على phagemids منسوخة المضيف لكن ليس المنتجات PCR. - تحويل شراؤها أو إعداد 13 المختصة كيميائيا E. القولونية مع 1-5 ميكرولتر من الناتج PCR صلب. عزل المستعمرات واحد من سلالة تحولت بواسطة الطلاء الانتقائي على لوحات أجار LB التي تحتوي على المضادات الحيوية المناسبة.
- للتحقق من إدراج تسلسل دليل الصحيح، وشاشة المستعمرات الناجم عن مستعمرة PCR. باستخدام 200 ميكرولتر ماصة، وشاركllect كمية صغيرة من الخلايا من مستعمرة تحولت واحدة. مارك والحفاظ على مستعمرة الأصلي للاستخدام في مجرى النهر بعد التحقق.
- إضافة الخلايا التي تم جمعها إلى 50 ميكرولتر من nuclease خالية من المياه في أنبوب microcentrifuge. مزيج من قبل pipetting صعودا وهبوطا.
- باستخدام thermocycler المقعد العلوي أو حمام ماء يغلي، ليز الخلايا عن طريق التسخين إلى 95 درجة مئوية لمدة 2 دقيقة.
- PCR-تضخيم المنطقة phagemid باستخدام 1 ميكرولتر من الخلايا هي lysed الحرارة كقالب الحمض النووي. يتم توفير الظروف PCR والبروتوكولات thermocycler في الجدولين 6 و 7. رؤية التكميلي pAB.001 ملف تسلسل تسلسل التحقق التمهيدي.
- تسلسل المنتج PCR للتحقق من إدراج تسلسل دليل الصحيح.
- تطعيم ثقافة 5 مل من E. استنساخ القولونية تحمل التعبير الحمض الريبي النووي الذواب phagemid-التحقق من التسلسل. تنمو الخلايا بين عشية وضحاها في 37 درجة مئوية مع الهز، في وسائل الإعلام LB انتقائية.
- إعداد المخزون الجلسرينمن استنساخ-التحقق من التسلسل. إضافة 750 ميكرولتر من الثقافة بين عشية وضحاها إلى 250 ميكرولتر من 60٪ الجلسرين في أنبوب البرد المسمار الحد الأقصى.
- تخزين الأوراق المالية الجلسرين في -80 درجة مئوية إلى أجل غير مسمى. ما تبقى من الثقافة بين عشية وضحاها يمكن أن تستخدم كمصدر للphagemid التعبير الحمض الريبي النووي الذواب في الخطوة 2.
2. الإنتاج والحصاد الأرصدة Phagemid تعبئتها M13-
- إعداد ثقافة 5 مل من E. كولاي تحمل التعبير phagemid الحمض الريبي النووي الذواب. تنمو الخلايا بين عشية وضحاها في 37 درجة مئوية مع الهز، في وسائل الإعلام LB مع المضادات الحيوية المناسبة. ملاحظة: يمكن الحصول على التعبير phagemid الحمض الريبي النووي الذواب عن طريق دي نوفو الاستنساخ كما هو موضح في الخطوة 1.1.5 أو تعديلها من phagemid القائمة وتحصد في الخطوة 1.2.16.
- وبالمثل إعداد ثقافة 5 مل من E. كولاي تحمل المساعد البلازميد M13KO7. تنمو الخلايا بين عشية وضحاها في 37 درجة مئوية مع الهز، في وسائل الإعلام LB انتقائية.
- استخراج وتنقية expressio الحمض الريبي النووي الذوابن phagemid والمساعد البلازميد باستخدام طقم استخراج الحمض النووي أو طريقة مماثلة (12).
- Cotransform شراء أو إعداد 13 كولاي المختصة كيميائيا مع 1 ميكرولتر كل من الحمض الريبي النووي الذواب phagemid التعبير والبلازميد المساعد. اختر لcotransformants من الطلاء على LB أجار مع المضادات الحيوية الانتقائية لكل من يبني.
- إعداد ثقافة 10 مل من مستعمرة واحدة من سلالة cotransformed في LB مع المضادات الحيوية الانتقائية. احتضان عند 37 درجة مئوية مع الهز لمدة 8-12 ساعة أو بين عشية وضحاها.
- أجهزة الطرد المركزي ثقافة في 3300 x ج لمدة 10 دقيقة. جمع طاف ومرشح من خلال مرشح 0.2 ميكرون. تحذير: في حالة تسرب سائل الإعلام، وتنظيف المنطقة مع التبييض المخفف (0.5٪) لتدمير جزيئات فج المعدية.
- تخزين الترشيح phagemid تعبئتها في 4 درجات مئوية. ملاحظة: يمكن الحفاظ على عينات لعدة أيام أو أسابيع دون فقدان النشاط.
3. إعداد خلايا F + الهدف لإسكات
- تحديد ما إذا كانت الخلايا لتكون مستهدفة لإسكات تعبر عن شعرة F 14. إذا كان شعرة F موجودة بالفعل، انتقل إلى الخطوة 4.
ملاحظة: سلالات مختبر الشائعة E. والمشروح القولونية كما F + أو F "للإشارة إلى وجود شعرة F في الجينوم أو على البلازميد. - الحصول على سلالة F + من E. القولونية مثل TOP10F ".
ملاحظة: تأكد من أن سلالة الهدف يحمل علامة مقاومة فريدة من نوعها من أجل فصلها عن المانحة F-البلازميد بعد الاقتران. - لإدخال F شعرة عن طريق الاقتران مع سلالة F +، وإعداد 5 مل الثقافات من كل من سلالة المستهدفة والجهات المانحة F-البلازميد 14. تنمو الخلايا بين عشية وضحاها في 37 درجة مئوية مع الهز، في وسائل الإعلام LB مع المضادات الحيوية المناسبة.
- في اليوم التالي، وتمييع كل من السلالات 1: 100 في 5 مل من LB انتقائية ومواصلة زراعة عند 37 درجة مئوية مع الهز.
- تحديد مرحلة نمو الخلايا عن طريق قياس التقيدكثافة كال للثقافة في 600 نانومتر (OD 600) باستخدام معمل الفوق. ثقافة الخلايا لمدة 2 ساعة حتى على OD 600 من 0.3 يتم تحقيق، مشيرا إلى نمو سجل في المرحلة 15.
- إعداد ردود الفعل 3 الاقتران في أنابيب microcentrifuge: 0.5 مل F-البلازميد سلالة المانحة + 0.5 مل الهدف، 0.5 مل F-البلازميد المانحة + 0.5 مل LB وسائل الإعلام (مراقبة سلبية) و 0.5 مل الهدف سلالة + 0.5 مل LB وسائل الإعلام (مراقبة سلبية). السماح للاقتران المضي قدما لمدة 2 ساعة على 37 درجة مئوية مع الهز.
- لوحة 100 ميكرولتر من كل رد فعل تصريف الافعال على انتقائية أجار LB مع المضادات الحيوية محددة إلى F-البلازميد (عادة التتراسيكلين) وسلالة الهدف. لوحة ردود الفعل سيطرة سلبية للتأكد من أن لا المانحة أو سلالة المتلقي التعبير عن كل من المقاومة للمضادات الحيوية.
4. العدوى مع Phagemids تعبئتها لإسكات
- تلقيح مستعمرة واحدة من الخلايا المستهدفة F + إلى ثقافة 5 مل من LB ميديومع المضادات الحيوية المناسبة. احتضان ليلا 37 درجة مئوية مع الهز.
- في اليوم التالي، وتمييع الخلايا المستهدفة F + 1: 100 في 5 مل من وسائل الاعلام LB انتقائية والاستمرار في الثقافة عند 37 درجة مئوية مع الهز.
- تحديد مرحلة نمو الخلايا عن طريق قياس الكثافة البصرية للثقافة في 600 نانومتر (OD 600) باستخدام معمل الفوق. ثقافة الخلايا لمدة 2 ساعة حتى على OD 600 من 0.3 يتم تحقيق، مشيرا إلى نمو سجل في المرحلة 15. ملاحظة: التعبير عن شعرة والعدوى كفاءة F هو الأعلى في مرحلة السجل.
- إضافة phagemids تعبئتها M13 (من الخطوة 2.6) إلى الخلايا المستهدفة في نسبة حجم 1: 100 إلى تحقيق عدوى ما يقرب من 99٪ من السكان المستهدفين. السماح للعدوى والمضي قدما عند 37 درجة مئوية مع الهز لمدة 30-60 دقيقة.
- مقايسة النمط الظاهري الحمض الريبي النووي الذواب-إسكات وفقا لطريقة الاختيار.
ملاحظة: للحصول على الهدف بروتين فلوري، وأثر إسكات يمكن قياسها كميامباشرة من التألق 10. بدلا من ذلك، يمكن استخدام فحوصات المظهري لمراقبة عواقب المظهري من الجينات ضربة قاضية 8. - إعداد المخزون الجلسرين للمضيف phagemid الحمض الريبي النووي الذواب، معربا عن الخطوات التالية 1.2.14-1.2.16. ملاحظة: سوف phagemid نشر في سلالة المضيف إلى أجل غير مسمى، ويمكن أن يستمر مع المضادات الحيوية مشابهة لالبلازميد التقليدية.
إسكات mKate2 الإسفار في وسائل الإعلام السائل
الشكل 1 يصور المخطط لknockdowns بوساطة الحمض الريبي النووي الذواب وصفها في هذا العمل، بما في ذلك تصميم الحمض الريبي النووي الذواب كاسيت، كمية موجهة phagemid، وآلية إسكات. بعد بروتوكول 1.2، تم تغيير الكاسيت إسكات الحمض الريبي النووي الذواب البلازميد pAB.001 لاستهداف mKate. وقد synthetized الكاسيت الحمض الريبي النووي الذواب والمستنسخة في phagemid Litmus28i_J23115-B0032-GFP، هدية من مونيكا أورتيز ودرو ENDY 11. هذا phagemid يحمل علامات للتعبير GFP والمقاومة كانامايسين، مما يسمح للالتهابات ناجحة لتعقبها. أعدت الأسهم phagemid تعبئتها بعد بروتوكول 2.
مشتق من E. وقد أعد القولونية K12 MG1655 يحمل أعرب جوهري، علامة mKate2 متكاملة صبغويا للعدوى فج عن طريق الاقتران مع سلالة البلازميد المانحة F بعد بروتوكول 3. الخلايا ونمت لمرحلة سجل منتصف وphagemid قدم بعد بروتوكول 4. بعد الإصابة phagemid، تم نقل 200 ميكرولتر الثقافات إلى قارئ لوحة مضان وتم رصد مضان بشكل مستمر لمدة 24 ساعة.
ويبين الشكل 3 أثر إسكات بوساطة الحمض الريبي النووي الذواب على التعبير mKate2. أظهرت السلالة المصابين مع وجود phagemid مكافحة mKate2 لا مضان mKate2 للكشف على الخلفية. في المقابل، لم هذه السلالة تعبير عن علامة GFP، مشيرا إلى امتصاص الناجح لphagemid. الخلايا السيطرة المعافين أنتجت mKate2 مضان ولكن ليس GFP. عنصر تحكم إضافية، والتي تم استبدال النطاق تستهدف مكافحة mKate2 مع استهداف تسلسل اتفاقية مناهضة التعذيب، لم يكن لها تأثير على mKate2 مضان.
إسكات الكلورامفينيكول المقاومة على لوحات أجار
محتوى "FO: المحافظة على together.within الصفحات =" 1 "> بعد بروتوكول 1.1، تم إنتاج الكاسيت إسكات الحمض الريبي النووي الذواب لاستهداف CAT مشتق من كولاي K12 MG1655 يحمل أعرب جوهري، تم إعداد صبغويا علامة CAT متكاملة ل. عدوى فج عن طريق الاقتران مع سلالة المانحة F-البلازميد بعد بروتوكول 3. الخلايا ونمت إلى مرحلة سجل منتصف وphagemid قدم بعد بروتوكول 4. بعد 1 ساعة من الحضانة عند 37 درجة مئوية، والخلايا المصابة المخفف متسلسل ومطلي في وحضنت مجموعة من تركيزات الكلورامفينيكول. وحات بين عشية وضحاها، وتم تحديد نسبة الخلايا المقاومة في كل تركيز الكلورامفينيكول عن طريق عد مستعمرة (CFUs) في اليوم التالي.ويبين الشكل 4 تأثير إسكات بوساطة الحمض الريبي النووي الذواب على النمط الظاهري المقاومة الكلورامفينيكول. الخلايا غير المصابة، أو الخلايا المصابة مع phagemid تستهدف mKate2، كانت مقاومة للالكلورامفينيكول في جميع التركيزات التي تم اختبارها. في المقابل، الخلايا المصابة مع phagemid تستهدف CAT أظهرت انخفاض البقاء على قيد الحياة في تركيزات منخفضة الكلورامفينيكول، وما يقرب من 99٪ يقتلون في تركيزات أعلى. إضافة الأمبيسلين، لتحديد للبكتيريا الوحيدة التي تحمل phagemid، خفضت بقاء الكلورامفينيكول إلى مستويات غير قابلة للكشف. وهذا يتفق مع العمل في وقت سابق تبين أن الهروب من الإصابة فج هو الطريق الشائع للهروب إسكات 10.
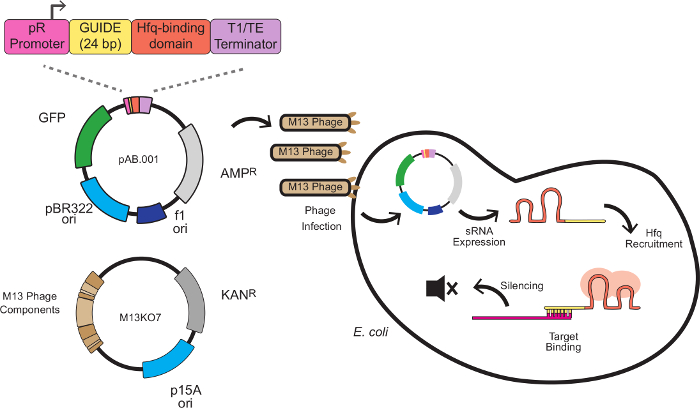
الشكل 1: إسكات الجينات في هاء القولونية مع الحمض الريبي النووي الذواب التعبير كاسيت يلقيها M13 فج يتكون كاسيت الحمض الريبي النووي الذواب من 4 وحدات: المروج العلاقات العامة (مروج التأسيسي المستمدة من امدا عاثية)، 24 سنة مضت تستهدف المجال مجال الربط Hfq المستخرجة من MICC وفاصل النسخي 8 E. القولونية التعبير عن شعرة F، حيث يبدأ الحمض الريبي النووي الذواب التعبير. والحمض الريبي النووي الذواب ثم تجند البروتين Hfq (يصور في الحمراء)، ويربط مرنا الهدف العقاقير بالقرب من موقع الريبوسوم ملزمة، مما أدى إلى قمع متعدية وتدهور مرنا. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
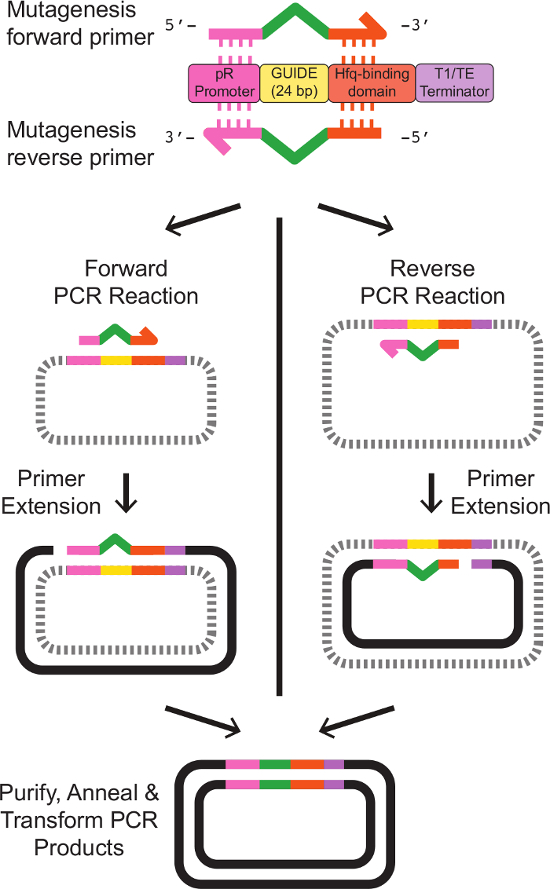
الشكل 2: التصميم التمهيدي والموقع الموجه الطفرات في الموقع الهدف الحمض الريبي النووي الذواب صممت اثنين الاشعال تناظر مع جزئي إلى شريط الحمض الريبي النووي الذواب القائمة. يحتوي التمهيدي إلى الأمام 20 نقطة أساس مثلي إلى المروج العلاقات العامة في نهاية 5 '، يليه24 شركة بريتيش بتروليوم يمثل تسلسل دليل جديد، ثم 18 نقطة أساس مثلي إلى المجال ملزم Hfq في نهاية 3 '. التمهيدي العكسي هو مكملا العكس تماما من التمهيدي إلى الأمام، مع مناطق تناظر إلى الكاسيت الحمض الريبي النووي الذواب القائمة المرافقة تكملة العكسي لسلسلة دليل جديد. يتم إعطاء تسلسل التمهيدي بالضبط في الجدول 3. منفصلة التمهيدي واحد PCR ردود الفعل مع الأمام والاشعال عكس إنتاج الخطية، والحمض النووي واحد الذين تقطعت بهم السبل مع تسلسل المعدل المطلوب. الصلب وإلى الأمام وعكس منتجات التفاعل والمتابعة نظيفة كما هو موضح في البروتوكول، والنتائج في الذين تقطعت بهم السبل المزدوج DNA البلازميد تحمل المرجوة كاسيت الحمض الريبي النووي الذواب تعديلها. الرجاء النقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
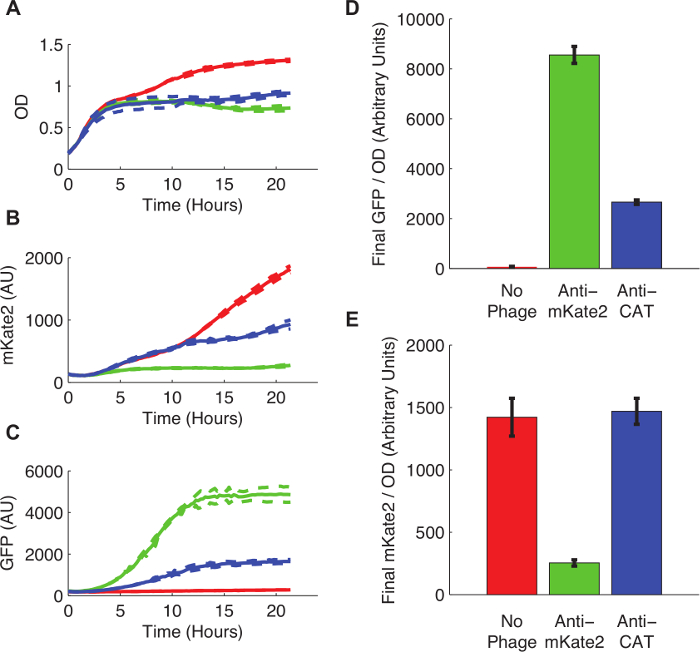
الشكل (3): Knockdown لمراسل صبغويا المتكاملة mKate2 نيون. E. القولونية MG1655 K12 معربا عن mKate2 إما تركت دون علاج (خطوط حمراء والقضبان)، المصابة مع phagemid مكافحة mKate2 (خطوط خضراء والقضبان)، أو مصابا السيطرة phagemid تستهدف CAT (خطوط زرقاء والقضبان). (A) غير المعالجة E. نمت القولونية إلى كثافة تشبع أعلى، مما يدل على أن تكلفة التمثيل الغذائي للإصابة فج. الخطوط المنقطة تشير الانحرافات المعيارية من 3 مكررات. (ب) تم تخفيض إشارة mKate2 إلى مستويات الخلفية القريب في مكافحة mKate2 تعامل سلالة، ولكن ليس في سلالات السيطرة. كان (C) GFP مضان، قامت أيضا phagemid، يمكن كشفها إلا في ضوابط phagemid المعالجة. (D، E) قراءات مضان النهائية بعد تطبيع 24 ساعة من النمو إلى OD. إشارة GFP، مشيرا إلى إصابة phagemid، كان غائبا في علاج الضوابط، ولكن أيضا انخفاض كبير التالية مكافحة CAT صالعلاج hagemid. قد يشير هذا إلى آثار خارج الهدف من phagemid. تم تخفيض إشارة mKate2 عن طريق العلاج phagemid مكافحة mKate2 مقارنة مع الضوابط غير المعالجة. أظهرت phagemid ضبط المستهدفة CAT أي تأثير على mKate2 مضان. أشرطة الخطأ تمثل الانحراف المعياري من 3 مكررات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
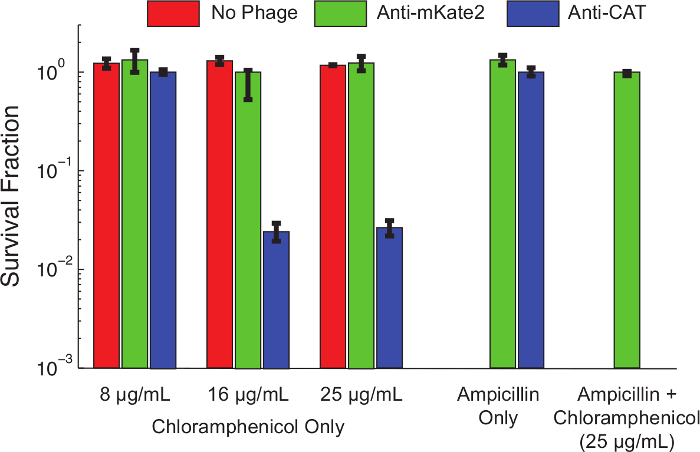
الشكل 4: ضربة قاضية من اتفاقية مناهضة التعذيب يعيد الكلورامفينيكول الحساسية لسكان مقاومة وراثيا هاء. تركت القولونية MG1655 K12 التعبير عن الجينات CAT متكاملة صبغويا غير المعالجة (الحانات الحمراء)، وتعامل مع phagemid تحكم تستهدف mKate2 (أشرطة خضراء)، أو تعامل مع phagemid إبداء مكافحة CAT الحمض الريبي النووي الذواب (أشرطة زرقاء). بعد 1 ساعة من العدوى، والسلامة على النمل المشار إليهاوجرى تقييم ibiotics من التخفيفات المسلسل والطلاء. تم سلالات تعامل مع phagemid مكافحة CAT قتل بشكل كبير (> 90٪) من الكلورامفينيكول في تركيزات أعلى، في حين أن العلاجات السيطرة تتأثر. مضيفا الأمبيسلين إلى لوحات ثقافة يختار إيجابيا للعدوى phagemid ويزيل الخلايا غير المصابة. في ظل هذه الظروف، لم يلاحظ أي مستعمرات مقاومة الكلورامفينيكول بعد العلاج المضاد لاتفاقية مناهضة التعذيب. هذا يشير إلى أن معظم الناجين يمثل فشلا للعدوى، وليس فشلا للإسكات. أشرطة الخطأ تمثل الانحراف المعياري من 3 مكررات. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
| CAT تسلسل الهدف | 5 "- ATGGAGAAAAAAATCACTGGATAT - 3" |
| تسلسل CAT دليل | 5 "- ATATCCAGTGATTTTTTTCTCCAT - 3" |
الجدول 1: مثال الهدف ودليل تسلسل لجنة مناهضة التعذيب جين ملاحظة العلاقة تكملة العكسية.
| العلاقات العامة المروج | TAACACCGTGCGTGTTGACTATTTTACCTCTGGCGGTGATAATGGTTGC | ||||
| تسلسل دليل | ATATCCAGTGATTTTTTTCTCCAT | ||||
| نطاق ملزم Hfq | TTTCTGTTGGGCCATTGCATTGCCACTGATTTTCCAACATATAAAAAGACAAGCCCGAACAGTCGTCCGGGCTTTTTT TCTCGAG | ||||
| T1 / TE فاصل | CTCGAGCCAGGCATCAAATAAAACGAAAGGCTCAGTCGAAAGACTGGGCCTTTCGTTTTATCTGTTTTTGTCGGTGAA CGCTCTCTACTAGAGTCACACTGGCTCACCTTCGGGTGGGCCTTTCTGCGTTTATA | ||||
ether.within الصفحات = "1"> الجدول 2: مكونات تسلسل من الحمض الريبي النووي الذواب كاسيت يتم كتابة كل تسلسل 5'-3 ". الكاسيت الكامل هو سلسلة من هذه العناصر 4 في النظام، ويضم 292 شركة بريتيش بتروليوم.
| إلى الأمام التمهيدي | 5 "- CTGGCGGTGATAATGGTTGC [دليل] TTTCTGTTGGGCCATTGC - 3" |
| التمهيدي عكسي | 5 "- GCAATGGCCCAACAGAAA [الهدف] GCAACCATTATCACCGCCAG - 3" |
الجدول 3: التمهيدي تصميم على تغيير عناصر دليل الموجودة حاليا ويشمل التمهيدي إلى الأمام في بي بي الماضي 20 من المروج العلاقات العامة، وتسلسل دليل جديد، وأول شركة بريتيش بتروليوم 18 من المجال ملزم Hfq. تسلسل الهدف هو مكملا العكسي الدقيق للتسلسل دليل. التمهيدي العكسي هو مكملا العكس تماما من التمهيدي إلى الأمام.
الجدول 4: اقترح شروط لوحيد التمهيدي الطفري PCR.
| خطوة | مؤقت | مرة |
| تمسخ الأولي | 98 ° C | 30 ثانية |
| 30 دورات | 98 ° C | 10 ثانية |
| 55 ° C | 30 ثانية | |
| 72 ° C | 120 ثانية | |
| تمديد النهائي | 72 ° C | 300 ثانية |
| تخزين | 10 ° C |
الجدول 5: مقترح بروتوكول Thermocycler لوحيد التمهيدي الطفري PCR.
| مكون | الصوت |
| قالب الحمض النووي | 1 ميكرولتر |
| 10 ميكرومتر إلى الأمام التمهيدي | 0.5 ميكرولتر |
| 10 ميكرومتر التمهيدي العكسي | 0.5 ميكرولتر |
| طق 2X ميكس ماستر | 25 ميكرولتر |
| توفير المياه Nuclease خالية منص | 23 ميكرولتر |
| الحجم الكلي | 50 ميكرولتر |
الجدول 6: مقترح شروط لPCR التأكيد تسلسل.
| خطوة | مؤقت | مرة |
| تمسخ الأولي | 95 ° C | 30 ثانية |
| 30 دورات | 95 ° C | 30 ثانية |
| 55 ° C | 30 ثانية | |
| 68 ° C | 30 ثانية | |
| تمديد النهائي | 68 ° C | 300 ثانية |
| تخزين | 10 ° C |
الجدول 7: مقترح Thermocycler بروtocol لPCR التأكيد تسلسل.
حقق الأسلوب الحالي 80٪ تخفيض في مستويات مضان mKate مقارنة مع الضوابط غير مستهدفة. وهذا يتماشى مع أساليب ضربة قاضية RNA الأخرى، حيث لا يلاحظ إسكات والكفاءة الكاملة 50-90٪ نموذجية 16،17. وعلى المستوى المظهري، تمكنت كبير في التخفيف من مقاومة الكلورامفينيكول، والقضاء عليه في ظل بعض الظروف knockdowns المستهدفة اتفاقية مناهضة التعذيب.
كان النمط الظاهري ضربة قاضية للكشف على مستوى السكان بعد بضع ساعات فقط بعد الإصابة (الشكل 3B). وهذا يوضح سمة هامة من سمات الولادة في فج: تردد ضربة قاضية عالية يمكن الحصول عليها مباشرة في ثقافة دفعة دون تعديل وراثي مسبق. على عكس التعديلات الوراثية التقليدية باستخدام التحول البلازميد أو التكامل الجيني، لا يتطلب عدوى الفيروس التي يبلغ عدد سكانها إعادة نمت-من مستعمرة معزولة واحدة. وهذا يسمح للآثار العدوى فج ليكون EXPLORإد في السكان مع ديناميات المكانية المعقدة 11، مع الهياكل المكانية موجودة مسبقا مثل الأغشية الحيوية 18، أو في السكان الطبيعية مختلطة وراثيا 19.
خطوة حاسمة في هذه الطريقة هو إنتاج phagemid تعبئتها في عيار عالية. عبء الأيض المرتبطة بإنتاج فج الجسيمات قد يؤدي إلى ارتفاع معدلات الطفرة أو فقدان البلازميد في سلالة إنتاج phagemid. فمن المستحسن أن سلالة إنتاج phagemid يمكن تربيتها مباشرة من مستعمرة cotransformed واحدة وليس المبردة والمجمدة أو دون مثقف، قبل الحصاد فج. ويمكن أيضا أن لوحظ انخفاض كفاءة شارك في التحول عند تقديم phagemid والمساعد البلازميد E. القولونية في وقت واحد. في هذه الحالة، يمكن الحصول على زيادة الكفاءة عن طريق تحويل البلازميد المساعد الأول، ثم إعداد الخلايا المختصة تحمل البلازميد المساعد للتحول لاحقا مع phagemid.
فاعدوى gemid أو التعبير الحمض الريبي النووي الذواب أيضا يفرض عبئا التمثيل الغذائي للكشف على الخلايا المستهدفة، ويمكن أن يؤدي في بعض الاضطراب المظهري. على سبيل المثال، لوحظ وجود انخفاض في mKate2 مضان حتى عندما كانت الخلايا المصابة مع phagemid تستهدف CAT (الشكل 3). ولا يعتقد العدوى مع M13 لتحريك استجابات التوتر النظامية في E. القولونية 20، ولكن قد يغير أنماط النسخي بشكل غير مباشر. بالتناوب، وGFP أو مقاومة الأمبيسلين علامات المدرجة على phagemid قد تنافس على الموارد الخلوية، والحد من التعبير mKate2 و 9 النمو. وأخيرا، فإن كاسيت الحمض الريبي النووي الذواب في حد ذاته قد يغير عالميا ملامح التعبير الجيني عن طريق المعايرة البروتين Hfq، أو من خلال بعيدا عن الهدف مرنا إسكات. آثار الهدف خارج شائعة في المجراة رني استهداف 21-23، لكنها حتى الآن لم يتم التحقيق بشكل منهجي لهذا النظام.
واحد الحد من هذا الأسلوب هو أن ايفي العدوىالمشمول أقل من 100٪، والسماح لبعض البكتيريا غير المصابة لتستمر في عدد السكان. وتشير نتائج هذا العمل وعمل في وقت سابق 10 أن الخلايا غير مصاب تمثل 1-10٪ من السكان النهائي، وهي المسؤولة عن معظم الظواهر nonsilenced ملاحظتها. ومن المعروف أن العديد من الطرق المؤدية إلى M13-المقاومة، مع كونها خسارة طفرية الأكثر شيوعا من شعرة التعبير 24. في ضوء هذه القيود، يجب استخدام الضوابط لتأكيد معدلات الإصابة العالية والكفاءة ضربة قاضية.
الحد محتمل آخر لبعض الطلبات هو نقل عرضية من تلويث المساعد فج. على الرغم من أن M13K07 يحتوي على إشارة التعبئة والتغليف متحولة، ويمكن تعبئتها في القفيصة فج في التردد المنخفض ونقلها إلى السكان المصابين، مما أدى إلى خلايا مختصة لإنتاج فج واستمرار انتشار فج ما وراء الحدث الإصابة الأولية 25. وقد أثبتت تعديلات على فج المساعد الفعالفي خفض التعبئة والتغليف غير محددة، على الرغم من أن في بعض الأحيان على حساب الإنتاج انخفاض فج 26.
أصبحت الجراثيم المهندسة أداة لا غنى عنها لE. علم الأحياء الاصطناعية القولونية، مما يتيح تسليم سريع للجينات جديدة لتزايد عدد السكان. وقد أنتجت العمل مؤخرا الدوائر الاتصالات بين الخلايا 11 أو عبر عوامل النسخ لقمع المقاومة للمضادات الحيوية الممرات 27. بروتوكول المعروضة هنا يضيف إلى مجموعة متزايدة من الأدوات التي تسمح السيطرة على علم وظائف الأعضاء البكتيرية من خلال الرنا المبرمجة. nucleases كريسبر-CAS، عندما تحور للقضاء على النشاط نوكلياز، وقد ثبت أن قمع النسخ على أهداف الجينات الموجهة RNA 17،28. في المقابل، الحمض الريبي النووي الذواب إسكات يعمل على مستوى متعدية ولا يحتاج بروتين تعبير خارجي. التكنولوجيا الحيوية الجيل القادم قد توحد السيطرة النسخي ومتعدية مع تسليم بوساطة فج لبرنامج pheno معقدةأنواع في الوقت الحقيقي.
The authors have nothing to disclose.
تم توفير التمويل لهذا العمل من قبل مؤسسة بيتنكور Schueller في دعم فريق باريس بيتنكور iGEM. نشكر وحدة INSERM بحث U1001 وشانتال Lotton للحصول على المساعدة الفنية والمشورة. وقدمت Phagemid Litmus28i_J23115-B0032-GFP التي كتبها مونيكا أورتيز ودرو ENDY من جامعة ستانفورد.
| Name | Company | Catalog Number | Comments |
| Plasmid Miniprep Kit | Qiagen | 27104 | |
| DpnI Enzyme | NEB | R0176S | |
| Phusion High Fidelity Polymerase | NEB | M0530S | |
| Taq 2x Master Mix | NEB | M0270L | |
| M13KO7 Helper Phage | NEB | N0315S | |
| DH5α Competent Cells | Life Technologies | 18265-017 | |
| TOP10F' Cells | Life Technologies | C3030-03 | |
| LB Broth | Sigma | L3022-250G | |
| Ampicillin | Sigma | A9393-5G | |
| Kanamycin | Sigma | 60615-5G | |
| Chloramphenicol | Sigma | C0378-5G | |
| Tetracycline | Sigma | 87128-25G |
- Ohkumo, T., Masutani, C., Eki, T., Hanaoka, F. Use of RNAi in C. elegans. RNAi. , 129-137 (2008).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Iordanou, E., Chandran, R. R., Blackstone, N., Jiang, L. RNAi interference by dsRNA injection into Drosophila embryos. J Vis Exp. (50), e2477 (2011).
- Ramadan, N., Flockhart, I., Booker, M., Perrimon, N., Mathey-Prevot, B. Design and implementation of high-throughput RNAi screens in cultured Drosophila cells. Nat Protoc. 2 (9), 2245-2264 (2007).
- Tsong, T. Y. Electroporation of cell membranes. Biophys J. 60 (2), 297-306 (1991).
- Kim, W. J., Chang, C. -. W., Lee, M., Kim, S. W. Efficient siRNA delivery using water soluble lipopolymer for anti-angiogenic gene therapy. J Control Release. 118 (3), 357-363 (2007).
- Shi, Y. Mammalian RNAi for the masses. Trends Genet. 19 (1), 9-12 (2003).
- Na, D., Yoo, S. M., Chung, H., Park, H., Park, J. H., Lee, S. Y. Metabolic engineering of Escherichia coli using synthetic small regulatory RNAs. Nat Biotechnol. 31 (2), 170-174 (2013).
- Ceroni, F., Algar, R., Stan, G. -. B., Ellis, T. Quantifying cellular capacity identifies gene expression designs with reduced burden. Nat Methods. 12 (5), 415-418 (2015).
- Libis, V. K., Bernheim, A. G., et al. Silencing of Antibiotic Resistance in E. coli with Engineered Phage Bearing Small Regulatory RNAs. ACS Synth Biol. 3 (12), 1003-1006 (2014).
- Ortiz, M. E., Endy, D. Engineered cell-cell communication via DNA messaging. J Biol Eng. 6 (1), 16 (2012).
- Edelheit, O., Hanukoglu, A., Hanukoglu, I. Simple and efficient site-directed mutagenesis using two single-primer reactions in parallel to generate mutants for protein structure-function studies. BMC Biotechnol. 9 (1), 61 (2009).
- Chung, C. T., Miller, R. H. Preparation and storage of competent Escherichia coli cells. Recombinant DNA Part I. , 621-627 (1993).
- Phornphisutthimas, S., Thamchaipenet, A., Panijpan, B. Conjugation in Escherichia coli. Biochem Mol Biol Educ. 35 (6), 440-445 (2007).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli Physiology in Luria-Bertani Broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Mittal, V. Improving the efficiency of RNA interference in mammals. Nat Rev Genet. 5 (5), 355-365 (2004).
- Qi, L. S., Larson, M. H., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152 (5), 1173-1183 (2013).
- Lu, T. K., Collins, J. J. Dispersing biofilms with engineered enzymatic bacteriophage. Proc Natl Acad Sci USA. 104 (27), 11197-11202 (2007).
- Yosef, I., Manor, M., Kiro, R., Qimron, U. Temperate and lytic bacteriophages programmed to sensitize and kill antibiotic-resistant bacteria. Proc Natl Acad Sci USA. 112 (23), 7267-7272 (2015).
- Karlsson, F., Malmborg-Hager, A. -. C., Albrekt, A. -. S., Borrebaeck, C. A. K. Genome-wide comparison of phage M13-infected vs. uninfected Escherichia coli. Can J Microbiol. 51 (1), 29-35 (2005).
- Senthil-Kumar, M., Mysore, K. S. Caveat of RNAi in plants: the off-target effect. Methods in molecular biology. 744, 13-25 (2011).
- Jackson, A. L., Linsley, P. S. Recognizing and avoiding siRNA off-target effects for target identification and therapeutic application. Nat Rev Drug Discov. 9 (1), 57-67 (2010).
- Cho, S. W., Kim, S., et al. Analysis of off-target effects of CRISPR/Cas-derived RNA-guided endonucleases and nickases. Genome Res. 24 (1), 132-141 (2014).
- Hagens, S., Blasi, U. Genetically modified filamentous phage as bactericidal agents: a pilot study. Lett Appl Microbiol. 37 (4), 318-323 (2003).
- Kasman, L. M., Kasman, A., Westwater, C., Dolan, J., Schmidt, M. G., Norris, J. S. Overcoming the phage replication threshold: a mathematical model with implications for phage therapy. J Virol. 76 (11), 5557-5564 (2002).
- Chasteen, L., Ayriss, J., Pavlik, P., Bradbury, A. R. M. Eliminating helper phage from phage display. Nucleic Acids Res. 34 (21), e145 (2006).
- Lu, T. K., Collins, J. J. Engineered bacteriophage targeting gene networks as adjuvants for antibiotic therapy. Proc Natl Acad Sci USA. 106 (12), 4629-4634 (2009).
- Bikard, D., Jiang, W., Samai, P., Hochschild, A., Zhang, F., Marraffini, L. A. Programmable repression and activation of bacterial gene expression using an engineered CRISPR-Cas system. Nucleic Acids Res. 41 (15), 7429-7437 (2013).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved