Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Biology
Фаг-опосредованной доставки целевых рРНК Создаёт к нокдауна экспрессии генов в
We describe a method to knock down gene expression in a growing population of E. coli cells using sequence-targeted sRNA expression cassettes delivered by an M13 phagemid vector.
РНК-опосредованный нокдаун широко используются для контроля экспрессии генов. Этот универсальный семейство методов использует короткие РНК (рРНК), которые могут быть синтезированы с любой последовательностью и предназначенной для дополнения любого гена, предназначенные для глушителей. Поскольку рРНК конструкции могут быть введены для многих типов клеток непосредственно или с использованием различных векторов, экспрессия генов может быть подавлено в живых клетках без трудоемкого генетической модификации. Наиболее распространенной РНК нокдаун технологии, РНК-интерференции (RNAi), использует распознавания эндогенных РНК-индуцированного глушителей комплекса (RISC), чтобы опосредовать последовательности и расщепление мРНК-мишени. Применение данной методики поэтому ограничены к РИСКовским экспрессирующих организмов, в первую очередь эукариот. В последнее время новое поколение РНК биотехнологов разработали альтернативные механизмы для контроля экспрессии генов с помощью РНК, и таким образом стало возможным РНК-опосредованного нокдауна генов у бактерий. Здесь мы опишем метод для глушителей генов ExpresSion в Е. палочка , которая функционально напоминает RNAi. В этой системе синтетический Фагмидную предназначен для выражения Срна, который может нацеленная на любой последовательности. Выражение конструкция доставляется к популяции E. Клетки палочки с не литического фага М13, после чего он способен стабильно репликации в качестве плазмиды. Распознавание Антисенс и глушение мРНК - мишени опосредуется белком Hfq, эндогенной по отношению к E. палочки. Этот протокол включает в себя методы проектирования антисмысловую Срна, построения фагмидных вектора, упаковки фагмиду в M13 бактериофага, готовя население живых клеток для инфекции, а также выполнение самой инфекции. Флуоресцентный белок mKate2 и хлорамфениколацетилтрансферазу ген устойчивости к антибиотику (CAT) предназначены для создания репрезентативных данных и количественной оценки эффективности нокдаун.
РНК-опосредованных генов нокдаунов проходить в два этапа. Во-первых, молекула РНК вводят в линию или организма исследования клеток. Во-вторых, эндогенные РНК-связывающие белки облегчают распознавание РНК-мишени и производят эффект глушения. Все РНК нокдаун технологии выгоду от настраиваемой природы синтетических sRNAs, которые могут быть легко получены в соответствии конкретной цели интереса. Однако молекулярные детали поглощения РНК и глушителей широко варьироваться в зависимости от модели системы, сдерживая где и как РНК нокдаун могут быть применены.
У нематод, двухцепочечной РНК (дцРНК) молекулы могут быть введены непосредственно в средствах массовой информации или путем кормления червей с населением дцРНК-экспрессирующие E. палочка клеток в 1,2 раза . У Drosophila, РНК - интерференция может быть достигнуто за счет microinjecting эмбрионов с дцРНК 3, или реализованы в клеточных линиях, просто добавляя дсРНК к культуральной среде 4. В клеточных линий млекопитающих,синтетические малые интерферирующие РНК (киРНК) , могут быть доставлены в живые клетки с помощью электропорации 1,2,5, упаковывают в липосомах 3,6, или экспрессированы из плазмидных ДНК - векторов 4,7. После того, как вид РНК достигает цитозоле, путь RNAi, опирается на комплекс RISC для обработки дцРНК, облегчить антисмысловую распознавание цели, и катализировать поступательную репрессии, деградацию мРНК, или формировании гетерохроматина, в зависимости от хоста.
Из-за этих требований, классическая RNAi может быть выполнена только в организмах, которые занимают экзогенной РНК эффективно и выражающих RISC или RISC-подобную активность. Примечательно, что это исключает модель бактерии E. палочка, которая испытывает недостаток в пути RNAi. Тем не менее, последние достижения в области синтетической биологии предоставляют инструменты для решения как проблемы доставки и проблему глушения.
В этом протоколе Srna конструкции экспрессируется в E. палочка из вектора ДНК доставляется LiВинг клетки с помощью Фагмидную / помощника системы M13. Фагмидную является любая плазмида с фаговой происхождения f1 начала репликации. Помощник плазмида, в этом случае M13KO, несет все оборудование, необходимое для производства вирусных частиц, но сама по себе не компетентны для репликации и упаковки. Когда Фагмидную и помощник плазмиды котрансформированы, в одиночку Фагмидную реплицируется на f1 происхождения, упаковывают и секретируется. Векторизованных Фагмидную затем компетентны , чтобы заразить живой E. палочки через пилуса F.
В этой системе, эффект глушение производится на заказ Srna кассет, сочетающих последовательность подмостков с целевой-связывающей последовательностью. Мишень-связывающий последовательность 24 пар оснований антисмысловые к мРНК-мишени, как правило, на месте связывания рибосомы (RBS). Последовательность строительных лесов, разработанная Na и коллегами 8, содержит Hfq-связывающий мотив , извлеченный из MICC, небольшой регуляторной РНК эндогенного Е. палочки. Белок Hfq стимулирует РНК-РНК bindinг и деградации мРНК, выступающей роль в этой системе , подобной RISC в RNAi. На рисунке 1 представлена полная схема для фагов опосредованной Срна нокдаунов, в том числе структуры Срна кассеты, фагмидного векторизации и глушителей механизма.
В качестве способа для модулирования экспрессии гена в E. палочка, рРНК глушителей является простым, быстрым и универсальным. Целенаправленное E. палочка не обременены за распространяющейся фагмиды и выражая Срна. Это может иметь важное значение в контексте синтетической биологии или фундаментальных исследований , где экспрессия гетерологичных больших конструкций может напрягать клеточные ресурсы 9. Фагмиды с новыми целями могут быть получены с помощью одного ПЦР и собирали через один день после фагмидного трансформации. Наконец, практически любой мРНК могут быть направлены. Регулирование кассета Срна (на стандартной плазмиды) было показано , что работать на различных целей в обмене веществ с типичными уровнями репрессии> 90% 8.
10. Во- первых, упакованный Фагмидную вводят в периодической культуре Е. клетки палочки и использовали для подавления экспрессии флуоресцентного белка mKate2. Последующие изменения флуоресценции контролируются в режиме реального времени. Во-вторых, сбивание ген CAT показано, чтобы уменьшить фенотипическую устойчивость к хлорамфениколу на чашках. В обоих случаях сама Фагмидную несет GFP маркер, позволяя зараженность быть измерена независимо от нокдауна эффективности.
1. Проектирование и строительство фагмидных векторов подшипника Срна Глушащий Кассеты
- De Novo Дизайн Срна Глушащий Кассеты 8
- Определить полную последовательность мРНК, чтобы быть отключен с использованием базы данных последовательностей ДНК. Для генерирования последовательности - мишени, обратите внимание , первые 24 п.н. кодирующей последовательности, с позиции +1 до +24 начиная со стартового кодона (например, ATG).
Примечание: шумопоглотительные менее эффективен , когда другие сайты или сегменты мРНК ориентированы 8. - Возьмите обратный комплемент последовательности TARGET для получения последовательности путеводителем на кассете Срна. В Таблице 1 приведены примеры TARGET и руководство по выбору последовательностей для хлорамфениколацетилтрансферазы (CAT).
- Для разработки 292 н.п. полное выражение рРНК кассету, организовать рк промотор, последовательность, GUIDE Hfq белка - связывающий домен и T1 / TE последовательности терминации транскрипции в серии (таблица 2).
- Добавьте дополнительные сайты клонирования выбора для облегчения клонирования кассеты Срна в целевой вектор.
- Получить полный Срна кассету посредством коммерческого синтеза генов или подобным способом и клонировать его в любой вектор фагмидного с начала репликации функционал f1 11. См вспомогательной информации для полной последовательности итогового вектора фагмидного.
- Определить полную последовательность мРНК, чтобы быть отключен с использованием базы данных последовательностей ДНК. Для генерирования последовательности - мишени, обратите внимание , первые 24 п.н. кодирующей последовательности, с позиции +1 до +24 начиная со стартового кодона (например, ATG).
- Изменение последовательности Целенаправленные существующим рРНК Expression Cassette с помощью ПЦР на основе сайт - направленного мутагенеза 12
- Определите последовательность GUIDE 24 пар оснований в существующем экспрессии рРНК кассете. Примечание: аннотированный pAB.001 плазмиду, используемый в данной работе, доступен в качестве дополнительного файла последовательности.
- Конструкция прямого и обратного праймеров с короткими областей гомологии к существующему Срна кассетой флангового новый 24 п.н. последовательность GUIDE. Получение праймеров посредством коммерческого синтеза олигонуклеотидов.
Примечание: Праймер дизайн для сайт-направленного мутагенеза depicTed на рисунке 2. Последовательности праймеров шаблон Целую представлены в таблице 3. - Приготовьте 5 мл культуры E. палочка проведения экспрессии рРНК шаблон фагмиду. Grow клеток в течение ночи при 37 ° C при встряхивании в LB среде с соответствующими антибиотиками.
- Извлечение и очистить выражение фагмиду шаблон Срна из 5 мл бактериальной культуры с использованием набора ДНК минипрепаративную или подобный метод 12.
- Приготовьте две реакции ПЦР с использованием экспрессии рРНК шаблон фагмиду и высокую точность полимеразу, один с вперед и один с обратным праймером (таблица 4). Использование условий ПЦР в соответствии с рекомендациями поставщика полимеразы (таблица 5). Увеличение концентрации матрицы для 10-50x выше стандартной реакции, чтобы учесть тот факт, что реакция одиночный праймер не производит экспоненциальное усиление.
- Объедините две вышеуказанные реакции ПЦР в микроцентрифужных трубки. Anneaл продукты путем нагревания до 98 ° С в водяной бане. Сразу после размещения микроцентрифужных трубки в ванну с водой, удалить источник тепла и экономичность ванны медленно нагреться до комнатной температуры в течение 1-2 ч.
- Для устранения немутированного шаблон Срна выражение фагмиду, добавить 1 мкл. DpnI ограничительного фермента к смеси, и инкубировали при 37 ° С в течение 1 ч, или время, рекомендованным производителем для полного переваривания.
Примечание: DpnI переваривает только метилированных целевые сайты, которые присутствуют на хост-репликации фагмид, но не продукты ПЦР. - Transform приобрели или подготовленные 13 химически компетентную E. палочка 1-5 мкл отожженного продукта ПЦР. Изолировать отдельных колоний трансформированного штамма с помощью селективного посева на чашках с LB, содержащих соответствующие антибиотики.
- Для проверки включения правильной последовательности GUIDE, экран полученных колоний ПЦР колоний. Использование 200 мкл пипетки, соllect небольшое количество клеток из одной трансформированной колонии. Марк и сохранить первоначальную колонию для дальнейшего использования после проверки.
- Добавьте собранные клетки в 50 мкл нуклеазы без воды в микроцентрифужных трубки. Смешайте с помощью пипетки вверх и вниз.
- Использование стендовом Термоциклер или бане с кипящей водой, лизиса клеток при нагревании до 95 ° С в течение 2 мин.
- ПЦР-амплификации с использованием Фагмидную область 1 мкл термически лизису клеток в качестве ДНК-матрицы. Условия ПЦР и протоколы Термоциклеры представлены в таблицах 6 и 7. Смотрите дополнительный файл последовательности pAB.001 для последовательностей проверки праймеров.
- Последовательность ПЦР-продукта для проверки включения правильной последовательности GUIDE.
- Инокуляции 5 мл культуры Е. палочка клон , несущий последовательность , подтвержденные экспрессии рРНК фагмиду. Grow клеток в течение ночи при 37 ° C при встряхивании, в селективной среде LB.
- Подготовить глицеринеклона-последовательности проверена. Добавьте 750 мкл ночной культуры в 250 мкл 60% глицерина в крио трубки с завинчивающейся крышкой.
- Храните глицерине при -80 ° С до бесконечности. Остальная часть ночной культуры, могут быть использованы в качестве источника для экспрессии фагемид Срна на шаге 2.
2. Производство и Урожай М13 упакованных запасов фагмидных
- Приготовьте 5 мл культуры E. палочка проведения экспрессии фагмиду Срна. Grow клеток в течение ночи при 37 ° C при встряхивании в LB среде с соответствующими антибиотиками. Примечание: Выражение Фагмидную рРНК , может быть получен путем клонирования De Novo , как описано в шаге 1.1.5, или модифицированный из существующего фагемид и собирают на этапе 1.2.16.
- Аналогичным образом готовят 5 мл культуры E. палочка проведения вспомогательной плазмиды M13KO7. Grow клеток в течение ночи при 37 ° C при встряхивании, в селективной среде LB.
- Извлечение и очистить expressio Срнап Фагмидную и помощник плазмида с использованием набора для экстракции ДНК или другим подобным способом 12.
- Cotransform приобрели или подготовленные 13 химически компетентные клетки Е.coli с 1 мкл каждого из выражения фагемид Срна и плазмиды - хелпера. Выберите для cotransformants при посеве на LB агар с селективными антибиотиками для обеих конструкций.
- Приготовьте 10 мл культуры из одной колонии штамма котрансформировали в LB с селективными антибиотиками. Инкубируют при 37 ° C при встряхивании в течение 8-12 ч или в течение ночи.
- Центрифуга культуру при 3,300 мкг в течение 10 мин. Собирают супернатант и фильтруют через фильтр с размером пор 0,2 мкм. Внимание: В случае разлива СМИ, очистить область с разбавленной хлорной извести (0,5%), чтобы уничтожить инфекционный фаговых частиц.
- Храните упакованную Фагмидную фильтрату при температуре 4 ° С. Примечание: Образцы могут быть сохранены в течение нескольких дней до нескольких недель без потери активности.
3. Получение F + клеток - мишеней для Глушащий
- Определите , могут ли клетки быть направлены для глушителей выразить F пилей 14. Если F пилуса уже присутствует, перейдите к шагу 4.
Примечание: обычные лабораторные штаммы E. палочка аннотируются , как F + или F ' , чтобы указать присутствие пилуса F в своем геноме или на плазмиде. - Получить штамм F + из E. палочки , такие как ТОР10F '.
Примечание: Убедитесь в том, что целевой штамм несет уникальный маркер устойчивости для того, чтобы отделить от F-плазмиды донора после конъюгации. - Для того, чтобы ввести F пилей сопряжением с штамма F +, готовить 5 мл культуры как целевого штамма и F-плазмиды донора 14. Grow клеток в течение ночи при 37 ° C при встряхивании в LB среде с соответствующими антибиотиками.
- На следующий день, развести оба штамма 1: 100 в 5 мл селективной LB и продолжают культивирование при 37 ° C при встряхивании.
- Определить фазу роста клеток путем измерения неавтоматическогоскую плотность культуры при 600 нм (OD 600) с использованием стендовых спектрофотометра. Культуры клеток в течение приблизительно 2 ч , пока OD 600 0,3 достигается, что указывает на рост 15 лог-фазы.
- Приготовьте 3 реакций конъюгации в микропробирок: 0,5 мл F-плазмида донор + 0,5 мл целевого штамма, 0,5 мл F-плазмида донор + 0,5 мл LB СМИ (отрицательный контроль) и 0,5 мл целевого штамма + 0,5 мл LB СМИ (отрицательный контроль). Разрешить конъюгация протекать в течение 2 ч при 37 ° C при встряхивании.
- Пластина 100 мкл каждой реакции конъюгации на селективном LB агар с антибиотиками, специфичными для F-плазмиды (как правило, тетрациклин) и целевой штамм. Пластина негативные реакции контроля, чтобы подтвердить, что ни один донор или штамм получатель выражают как антибиотик сопротивления.
4. Заражение Packaged Фагмиды для Глушащий
- Инокулируйте одну колонию клеток F + цель в 5 мл культуры LB MediА с соответствующими антибиотиками. Инкубируют в течение ночи при 37 ° C при встряхивании.
- На следующий день, разбавленные клетки - мишени 1 М +: 100 в 5 мл селективной среды LB и продолжают культуры при 37 ° C при встряхивании.
- Определяют фазу роста клеток путем измерения оптической плотности культуры при 600 нм (OD 600) с использованием стендовых спектрофотометра. Культуры клеток в течение приблизительно 2 ч , пока OD 600 0,3 достигается, что указывает на рост 15 лог-фазы. Примечание: Экспрессия пилей и инфекции эффективность F является самой высокой в лог-фазе.
- Добавьте М13-упакованные фагемиды (со стадии 2.6) в клетки-мишени в объемном соотношении от 1: 100 до достижения почти 99% инфицирование целевой группы населения. Позволить инфекции протекать при 37 ° С при встряхивании в течение 30-60 мин.
- Анализ на рРНК-заглушающие фенотип в соответствии с методом выбора.
Примечание: Для получения флуоресцентного белка-мишени, эффект глушителей может быть определена количественнонепосредственно флуориметрии 10. С другой стороны , фенотипические анализы могут быть использованы для наблюдения за фенотипические последствия гена бросовой 8. - Подготовка глицерина запас для рРНК-выражающей фагмидного хоста следующие шаги 1.2.14-1.2.16. Примечание: Фагмидную будет распространяться в штамме-хоз ине на неопределенный срок и может поддерживаться с антибиотиками подобно обычной плазмиды.
Сайленсинг mKate2 флюоресценции в жидких средах
На рисунке 1 представлена схема рРНК-опосредованных нокдаунов , описанных в этой работе, в том числе дизайн Срна кассеты, фагмидного векторизации и механизм глушителей. Следуя протоколу 1.2, рРНК глушителей кассета плазмиды pAB.001 была изменена целевой mKate. Кассета рРНК синтезировали и клонировали в фагмидного Litmus28i_J23115-B0032-GFP, подарок Моника Ortiz и Дрю Endy 11. Это Фагмидную несет маркеры для экспрессии GFP и устойчивости к канамицину, что позволяет успешно инфекции, которые необходимо отслеживать. Пакетированные запасы фагмидные были подготовлены в соответствии с протоколом 2.
Производная Е. палочки K12 MG1655 , несущий конститутивно, выраженное в хромосому интегрированный mKate2 маркер был готов к фаговой инфекции сопряжением с штамма плазмидой донора F следующий протокол 3. Клетки выращивали до середины логарифмической фазы и фагмиды введенного в соответствии с протоколом 4. После фагмидного инфекции, 200 мкл культуры переносили на флуоресцентном счетчике пластины и флуоресценции непрерывно контролировали в течение 24 часов.
На рисунке 3 показан эффект рРНК-опосредованного глушителей на экспрессию mKate2. Штамм инфицируют фагемид анти-mKate2 не показало заметных mKate2 флуоресценции над фоном. В отличие от этого, этот штамм сделал выразить GFP маркер, указывающий успешное поглощение фагмиды. Неинфицированных контрольных клеток производится mKate2 флуоресценции, но не GFP. Дополнительный контроль, в котором направляющий домен анти-mKate2 был заменен на КПП последовательности ориентации, не оказывает никакого влияния на mKate2 флуоресценции.
Глушащий хлорамфеникол сопротивления на чашках
Содержание "ВОК: Keep-together.within-странице =" 1 "> После протокола 1.1, глушителей кассета рРНК был получен целевой CAT производное E.coli К12 MG1655 , несущей конститутивно экспрессируется, хромосомным интегрированный CAT маркер был подготовлен. фаговой инфекции путем конъюгации с донорного штамма F-плазмида следующим протоколом 3. клетки выращивали до середины логарифмической фазы и Фагмидную введены в соответствии с протоколом 4. После 1 ч инкубации при 37 ° с, инфицированные клетки последовательно разводили и высевали при диапазон концентраций хлорамфеникола. Чашки инкубировали в течение ночи, а доля устойчивых клеток в каждой концентрации хлорамфеникола определяли путем подсчета колониеобразующих единиц (КОЕ) на следующий день.На рисунке 4 показан эффект рРНК-опосредованного глушителей на фенотип устойчивости к хлорамфениколу. Неинфицированные клетки или клетки, инфицированные Фагмидную нацеливание mKate2, были устойчивы кхлорамфениколу при всех испытанных концентрациях. В противоположность этому, клетки, инфицированные фагмидного нацеливание CAT, показали снижение выживаемости при низких концентрациях хлорамфеникол, и почти 99% погибли при более высоких концентрациях. Добавление ампициллина, чтобы выбрать только для бактерий, несущих фагмиды, снижение выживаемости хлорамфеникол до неопределимых уровней. Это согласуется с более ранней работе , показывая , что побег из фаговой инфекции является общим маршрут , чтобы избежать глушителей 10.
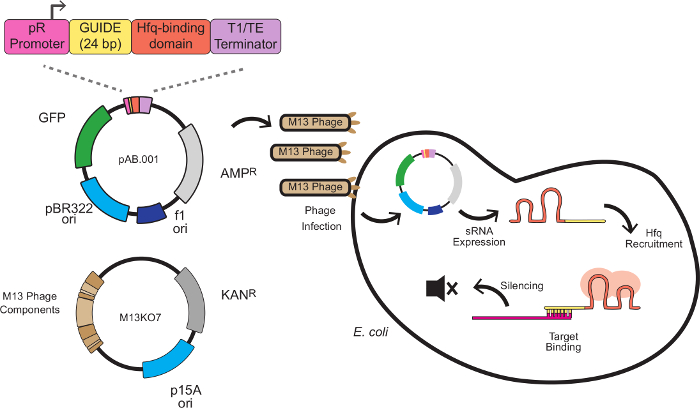
Рисунок 1: молчанием генов в E. палочки с Срна кассетах экспрессии Поставленный фага М13 Кассета рРНК состоит из 4 модулей:. Пиар промотор (конститутивный промотор , полученный из бактериофага лямбда), 24 пар оснований ориентации доменов, связывающий домен Hfq извлекается из MICC и терминатор транскрипции 8 E. палочка , выражающее пилей F, где начинается выражение рРНК. РРНК затем рекрутирует белок Hfq (изображенную в красном цвете) и связывается с мРНК - мишени антисмысловые вблизи места связывания рибосом, что приводит к репрессии трансляции и деградации мРНК. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
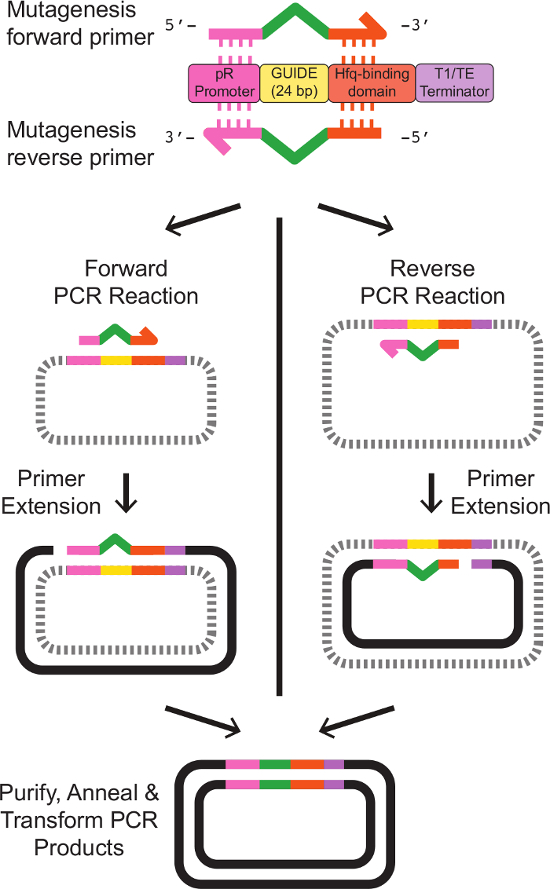
Рисунок 2:. Праймер Дизайн и сайт-направленного мутагенеза рРНК Target Site два праймера разработаны с частичной гомологией к существующей Srna кассете. Прямой праймер содержит 20 пар оснований, гомологичные промотора Pr на 5'-конце, а затем24 пар оснований, представляющий новую последовательность GUIDE, а затем 18 пар оснований гомологична Hfq-связывающий домен на 3'-конце. Обратный праймер является точным обратным комплементом прямого праймера, с областей гомологии к существующим Srna кассетой фланкирующих обратный комплемент новой последовательности GUIDE. Последовательности праймеров Точные приведены в таблице 3. Отдельные одной ПЦР - праймер реакции с носового и обратных праймеров производят линейные, одноцепочечной ДНК с нужной модифицированной последовательности. Отжиг прямого и обратного продуктов реакции, после очистки , как описано в протоколе, приводит к двухцепочечной ДНК плазмиды несущей желаемого модифицированного Срна кассеты. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
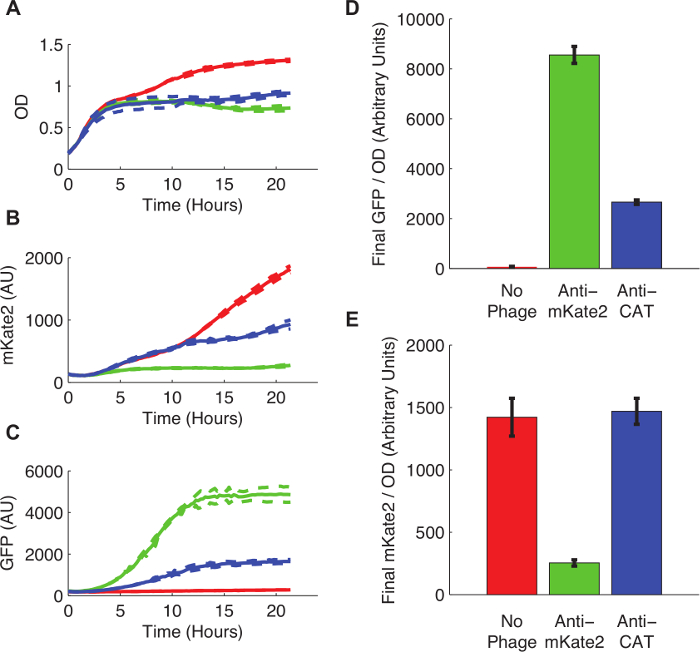
Рисунок 3: Кnockdown репортера хромосомой Интегрированный mKate2 Fluorescent. E. палочки 1655 K12 выражения mKate2 были либо не лечить (красные линии и бары), зараженный анти-mKate2 фагемид (зеленые линии и столбцы) или инфицировали управления фагмидного таргетирования CAT (синие линии) и баров. (A) Необработанные E. палочки вырос до более высокой плотности насыщения, что указывает на метаболическую стоимость для фаговой инфекции. Пунктирные линии указывают на стандартные отклонения 3 повторах. (B) Сигнал mKate2 был уменьшен почти до уровня фона в анти-mKate2 обработке штамма, но не в контрольных штаммов. (С) GFP флуоресценции, также несут фагмиды, был обнаружен только в фагмидных обработанных элементов управления. (D, E) Окончательные показания флуоресценции после 24 ч роста были нормированы на ОД. Сигнал GFP, что указывает на фагмидных инфекцию, отсутствовала в необработанных контрольных, но и существенно сократить следующие анти-CAT рhagemid лечение. Это может указывать на вне цели эффекты фагмиды. Сигнал mKate2 был уменьшен на анти-mKate2 лечения фагмидного по сравнению с необработанным контролем. CAT-целевой контроль Фагмидную не показал никакого эффекта на mKate2 флуоресценции. Столбики ошибок обозначают стандартное отклонение 3 повторах. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
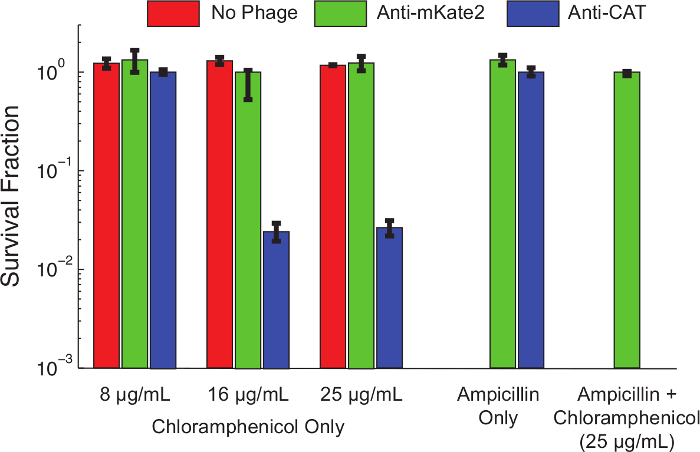
Рисунок 4: Нокдаун CAT Восстанавливает хлорамфеникол чувствительность к генетически резистентных населения E.. палочки 1655 K12 экспрессии гена в хромосоме интегрированный CAT оставляли необработанными (красные столбики), обрабатывали контрольным фагемид таргетирования mKate2 (зеленые столбики), или обрабатывают фагемид , выражающей анти-CAT Срна (синие столбики). После 1 часа инфекции, жизнеспособность на указанном муравейibiotics оценивали с помощью серийных разведений и обшивкой. Штаммы, обработанные анти-CAT фагемид были значительно убиты (> 90%) хлорамфениколом при более высоких концентрациях, в то время как процедуры контроля не были затронуты. Добавление к ампициллину в культуральные планшеты положительно выбирает для фагмидного инфекции и устраняет неинфицированные клетки. В этих условиях не наблюдалось никаких колоний, устойчивых к хлорамфениколу после лечения анти-CAT. Это указывает на то, что большинство выживших представляют собой провал инфекции, а не отказ глушителей. Столбики ошибок обозначают стандартное отклонение 3 повторах. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| Последовательность TARGET CAT | 5 '- ATGGAGAAAAAAATCACTGGATAT - 3' |
| Последовательность CAT РУКОВОДСТВО | 5 '- ATATCCAGTGATTTTTTTCTCCAT - 3' |
Таблица 1:. Последовательность пример TARGET и GUIDE для CAT Gene Обратите внимание на связь обратного комплемента.
| рк промотор | TAACACCGTGCGTGTTGACTATTTTACCTCTGGCGGTGATAATGGTTGC | ||||
| последовательность GUIDE | ATATCCAGTGATTTTTTTCTCCAT | ||||
| Hfq-связывающий домен | TTTCTGTTGGGCCATTGCATTGCCACTGATTTTCCAACATATAAAAAGACAAGCCCGAACAGTCGTCCGGGCTTTTTT TCTCGAG | ||||
| T1 / TE-терминатор | CTCGAGCCAGGCATCAAATAAAACGAAAGGCTCAGTCGAAAGACTGGGCCTTTCGTTTTATCTGTTTTTGTCGGTGAA CGCTCTCTACTAGAGTCACACTGGCTCACCTTCGGGTGGGCCTTTCTGCGTTTATA | ||||
Таблица 2:. Последовательность Компоненты кассеты Срна Каждая последовательность записывается 5'-3 '. Полная кассета конкатенация из этих 4-х элементов в порядке и содержит 292 пар оснований.
| Форвард Primer | 5 '- CTGGCGGTGATAATGGTTGC [GUIDE] TTTCTGTTGGGCCATTGC - 3' |
| Обратный праймер | 5 '- GCAATGGCCCAACAGAAA [TARGET] GCAACCATTATCACCGCCAG - 3' |
Таблица 3: Праймер Дизайн Альтер Существующие направляющие элементы Прямой праймер включает в себя последние 20 п.н. промотора Pr, новую последовательность руководства и первые 18 п.н. Hfq-связывающего домена.. Последовательность TARGET является точным обратным комплементом последовательности GUIDE. Обратный праймер является точным обратным комплементом прямого праймера.
Таблица 4: Предлагаемые условия для Single-Primer мутагенной ПЦР.
| шаг | температура | Время |
| Первоначальная денатурация | 98 ° C | 30 сек |
| 30 циклов | 98 ° C | 10 сек |
| 55 ° C | 30 сек | |
| 72 ° C | 120 сек | |
| Окончательный Extension | 72 ° C | 300 сек |
| Место хранения | 10 ° C |
Таблица 5: Предлагаемые Термоциклеры Протокол о монопольном Primer мутагенной ПЦР.
| Компонент | объем |
| Шаблон ДНК | 1 мкл |
| 10 мкМ прямого праймера | 0,5 мкл |
| 10 мкМ обратного праймера | 0,5 мкл |
| Taq 2X Master Mix | 25 мкл |
| Нуклеазы Wateр | 23 мкл |
| Общий объем | 50 мкл |
Таблица 6: Предлагаемые условия для ПЦР последовательности проверки.
| шаг | температура | Время |
| Первоначальная денатурация | 95 ° C | 30 сек |
| 30 циклов | 95 ° C | 30 сек |
| 55 ° C | 30 сек | |
| 68 ° C | 30 сек | |
| Окончательный Extension | 68 ° C | 300 сек |
| Место хранения | 10 ° C |
Таблица 7: Предлагаемые Термоциклеры Proтокола для ПЦР последовательности проверки.
Данный способ достичь 80 снижение уровня флуоресценции mKate% по сравнению с нецелевым управления. Это согласуется с другими методами нокдаун РНК, где полное глушение не наблюдается и эффективность 50-90% является типичным 16,17. На фенотипической уровне, CAT-целевой нокдаунов были способны значительно ослабить устойчивость к хлорамфениколу, и устранить ее при определенных условиях.
Нокдаун фенотип был обнаружен на уровне населения после того, как всего за несколько часов после инфицирования (рис 3B). Это иллюстрирует важную особенность фага на основе доставки: высокая нокдаун частота может быть получена непосредственно в периодической культуре без предварительного генетической модификации. В отличие от обычных генетических модификаций с использованием трансформации плазмидами или геномную интеграцию, фаговой инфекции не требует, чтобы популяция быть повторно выращены из одной изолированной колонии. Это позволяет эффекты фаговой инфекции быть Explorе изд в популяциях со сложной пространственной динамики 11, с ранее существовавших пространственных структур , как биопленки 18, или в генетически смешанных природных популяций 19.
Важным шагом в этом методе является производство фасованного фагемид на высоком титре. Метаболический бремя, связанное с производством фага частиц может привести к высокому уровню мутации или потери плазмиды в фагмидного производства штамма. Рекомендуется, чтобы Фагмидную производство штамма культивировать непосредственно из одной колонии котрансформировали и не охлажденный, замороженный или субкультивироваться до урожая фага. Низкая эффективность совместного преобразования также может наблюдаться при введении фагмидных и вспомогательной плазмиды Е. палочки одновременно. В этом случае более высокую эффективность, могут быть получены путем трансформации вспомогательной плазмиды, а затем готовит компетентных клеток, несущих плазмиду хелпер для последующей трансформации с фагмиды.
Пхаgemid инфекция или выражение рРНК также налагает выявляемой метаболический нагрузку на клетки-мишени, и может привести к некоторому фенотипической возмущения. Например, наблюдалось снижение mKate2 флуоресценции даже тогда , когда клетки были инфицированы фагмидного нацеливание CAT (рисунок 3). Заражение M13 не думал , чтобы вызвать системные ответные реакции на стресс в E. палочка 20, но может изменить транскрипционные паттерны косвенно. С другой стороны , маркеры или GFP устойчивости к ампициллину , включенные в фагмиды могут конкурировать за клеточных ресурсов, снижение экспрессии mKate2 и роста 9. Наконец, сама рРНК кассета может глобально изменить профили экспрессии генов титрованием белок Hfq, либо через офф-мРНК-мишени глушителей. Off целевые эффекты являются общими в в естественных условиях RNAi ориентации 21-23, но они до сих пор систематически исследованы для этой системы.
Одним из ограничений этого метода является то, что инфекция энергосбетивность составляет менее 100%, что позволило в некоторых неинфицированные бактерии сохраняться в популяции. Результаты этой работы и более ранней работе 10 показывают , что неинфицированные клетки представляют собой 1-10% от конечного населения, и несут ответственность за большинство nonsilenced фенотипов наблюдается. Разнообразие маршрутов к М13-сопротивления , как известно, с наиболее распространенными из которых являются мутационный потере экспрессии 24 пилей. В свете этих ограничений, контроль должен быть использован для подтверждения высоких показателей заболеваемости и эффективности нокдаун.
Другим потенциальным ограничением для некоторых приложений является случайный перенос загрязняющего фаг-хелпер. Хотя М13К07 содержит мутированный сигнал упаковки, она может быть упакована в фаг капсида при низкой частоте и переносится к зараженным популяции, в результате чего в клетках компетентных для фага производства и непрерывное распространение фага за пределы первоначального случае инфицирования 25. Модификации хелперного фага доказали свою эффективностьна снижение неспецифической упаковки, хотя иногда на себестоимость продукции пониженной фага 26.
Engineered бактериофага стали незаменимым инструментом для E. палочка синтетической биологии, что позволяет быструю доставку новых генов для растущего населения. Последние работы производятся межклеточные цепи 11 связи или выражены факторы транскрипции для подавления резистентности к антибиотикам 27 дорожками. Протокол, представленные здесь, добавляет к растущей коллекции инструментов, которые позволяют контролировать бактериальной физиологии через запрограммированные РНК. CRISPR-Cas нуклеазы, когда мутируют для устранения нуклеазы активности, было показано , что репрессировать транскрипцию РНК в наведением мишеней генов 17,28. В противоположность этому, рРНК глушителей работает на уровне поступательным и не требует экзогенных экспрессии белка. биотехнологии следующего поколения могут объединяться транскрипции и трансляции контроль фагом-опосредованной доставки программного комплекса Phenoтипы в режиме реального времени.
The authors have nothing to disclose.
Финансирование этой работы была предоставлена Fondation Бетанкур Schueller в поддержку команды Paris Бетанкур IGEM. Мы благодарим INSERM U1001 исследовательское подразделение и Шанталь Lotton для технической помощи и консультаций. Фагмидных Litmus28i_J23115-B0032-GFP была предоставлена Моника Ortiz и Дрю Endy Стэнфорда.
| Name | Company | Catalog Number | Comments |
| Plasmid Miniprep Kit | Qiagen | 27104 | |
| DpnI Enzyme | NEB | R0176S | |
| Phusion High Fidelity Polymerase | NEB | M0530S | |
| Taq 2x Master Mix | NEB | M0270L | |
| M13KO7 Helper Phage | NEB | N0315S | |
| DH5α Competent Cells | Life Technologies | 18265-017 | |
| TOP10F' Cells | Life Technologies | C3030-03 | |
| LB Broth | Sigma | L3022-250G | |
| Ampicillin | Sigma | A9393-5G | |
| Kanamycin | Sigma | 60615-5G | |
| Chloramphenicol | Sigma | C0378-5G | |
| Tetracycline | Sigma | 87128-25G |
- Ohkumo, T., Masutani, C., Eki, T., Hanaoka, F. Use of RNAi in C. elegans. RNAi. , 129-137 (2008).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391 (6669), 806-811 (1998).
- Iordanou, E., Chandran, R. R., Blackstone, N., Jiang, L. RNAi interference by dsRNA injection into Drosophila embryos. J Vis Exp. (50), e2477 (2011).
- Ramadan, N., Flockhart, I., Booker, M., Perrimon, N., Mathey-Prevot, B. Design and implementation of high-throughput RNAi screens in cultured Drosophila cells. Nat Protoc. 2 (9), 2245-2264 (2007).
- Tsong, T. Y. Electroporation of cell membranes. Biophys J. 60 (2), 297-306 (1991).
- Kim, W. J., Chang, C. -. W., Lee, M., Kim, S. W. Efficient siRNA delivery using water soluble lipopolymer for anti-angiogenic gene therapy. J Control Release. 118 (3), 357-363 (2007).
- Shi, Y. Mammalian RNAi for the masses. Trends Genet. 19 (1), 9-12 (2003).
- Na, D., Yoo, S. M., Chung, H., Park, H., Park, J. H., Lee, S. Y. Metabolic engineering of Escherichia coli using synthetic small regulatory RNAs. Nat Biotechnol. 31 (2), 170-174 (2013).
- Ceroni, F., Algar, R., Stan, G. -. B., Ellis, T. Quantifying cellular capacity identifies gene expression designs with reduced burden. Nat Methods. 12 (5), 415-418 (2015).
- Libis, V. K., Bernheim, A. G., et al. Silencing of Antibiotic Resistance in E. coli with Engineered Phage Bearing Small Regulatory RNAs. ACS Synth Biol. 3 (12), 1003-1006 (2014).
- Ortiz, M. E., Endy, D. Engineered cell-cell communication via DNA messaging. J Biol Eng. 6 (1), 16 (2012).
- Edelheit, O., Hanukoglu, A., Hanukoglu, I. Simple and efficient site-directed mutagenesis using two single-primer reactions in parallel to generate mutants for protein structure-function studies. BMC Biotechnol. 9 (1), 61 (2009).
- Chung, C. T., Miller, R. H. Preparation and storage of competent Escherichia coli cells. Recombinant DNA Part I. , 621-627 (1993).
- Phornphisutthimas, S., Thamchaipenet, A., Panijpan, B. Conjugation in Escherichia coli. Biochem Mol Biol Educ. 35 (6), 440-445 (2007).
- Sezonov, G., Joseleau-Petit, D., D'Ari, R. Escherichia coli Physiology in Luria-Bertani Broth. J Bacteriol. 189 (23), 8746-8749 (2007).
- Mittal, V. Improving the efficiency of RNA interference in mammals. Nat Rev Genet. 5 (5), 355-365 (2004).
- Qi, L. S., Larson, M. H., et al. Repurposing CRISPR as an RNA-guided platform for sequence-specific control of gene expression. Cell. 152 (5), 1173-1183 (2013).
- Lu, T. K., Collins, J. J. Dispersing biofilms with engineered enzymatic bacteriophage. Proc Natl Acad Sci USA. 104 (27), 11197-11202 (2007).
- Yosef, I., Manor, M., Kiro, R., Qimron, U. Temperate and lytic bacteriophages programmed to sensitize and kill antibiotic-resistant bacteria. Proc Natl Acad Sci USA. 112 (23), 7267-7272 (2015).
- Karlsson, F., Malmborg-Hager, A. -. C., Albrekt, A. -. S., Borrebaeck, C. A. K. Genome-wide comparison of phage M13-infected vs. uninfected Escherichia coli. Can J Microbiol. 51 (1), 29-35 (2005).
- Senthil-Kumar, M., Mysore, K. S. Caveat of RNAi in plants: the off-target effect. Methods in molecular biology. 744, 13-25 (2011).
- Jackson, A. L., Linsley, P. S. Recognizing and avoiding siRNA off-target effects for target identification and therapeutic application. Nat Rev Drug Discov. 9 (1), 57-67 (2010).
- Cho, S. W., Kim, S., et al. Analysis of off-target effects of CRISPR/Cas-derived RNA-guided endonucleases and nickases. Genome Res. 24 (1), 132-141 (2014).
- Hagens, S., Blasi, U. Genetically modified filamentous phage as bactericidal agents: a pilot study. Lett Appl Microbiol. 37 (4), 318-323 (2003).
- Kasman, L. M., Kasman, A., Westwater, C., Dolan, J., Schmidt, M. G., Norris, J. S. Overcoming the phage replication threshold: a mathematical model with implications for phage therapy. J Virol. 76 (11), 5557-5564 (2002).
- Chasteen, L., Ayriss, J., Pavlik, P., Bradbury, A. R. M. Eliminating helper phage from phage display. Nucleic Acids Res. 34 (21), e145 (2006).
- Lu, T. K., Collins, J. J. Engineered bacteriophage targeting gene networks as adjuvants for antibiotic therapy. Proc Natl Acad Sci USA. 106 (12), 4629-4634 (2009).
- Bikard, D., Jiang, W., Samai, P., Hochschild, A., Zhang, F., Marraffini, L. A. Programmable repression and activation of bacterial gene expression using an engineered CRISPR-Cas system. Nucleic Acids Res. 41 (15), 7429-7437 (2013).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved