Preparazione di fettine di cervello acuto utilizzando un' ottimizzata N-metilico-D-metodo di ripristino protettivo glucamine
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo viene illustrata l'implementazione di un ottimizzato N-metilico-D-glucamine (NMDG) protezione recupero metodo di preparazione di fetta di cervello. Una formulazione di singolo supporto viene utilizzata per ottenere in modo affidabile fette di cervello sano da animali di tutte le età e per diverse applicazioni sperimentali.
Abstract
Questo protocollo è una guida pratica per la N-metil-D-glucamine (NMDG) protezione recupero metodo di preparazione di fetta di cervello. Numerosi studi recenti hanno convalidato l'utilità di questo metodo per migliorare la conservazione di un neurone e complessiva vitalità di fetta di cervello. L'implementazione di questa tecnica di early adopter ha facilitato le indagini dettagliate in funzione del cervello utilizzando diverse applicazioni sperimentali e che abbracciano una vasta gamma di età degli animali, regioni del cervello e tipi di cellule. Passaggi sono descritti per effettuare la tecnica di fetta di cervello protettivo recupero utilizzando una procedura avanzata e formulazione di media di liquido cerebrospinale artificiale (aCSF) NMDG ottimizzata in modo affidabile ottenere fette di cervello sano per elettrofisiologia di patch clamp. Con questo approccio aggiornato, si osserva un miglioramento sostanziale nella velocità e affidabilità di gigaohm sigillare formazione durante mirati toppa morsetto esperimenti di registrazione mantenendo ottima conservazione neuronale, facilitando in tal modo impegnativo applicazioni sperimentali. Risultati rappresentativi sono forniti dal morsetto del multi-neurone patch registrazione esperimenti test connettività sinaptica nelle fette del cervello neocorticale preparato da giovani topi transgenici adulti e maturi adulti esemplari umani neurochirurgici. Inoltre, il metodo di recupero protettivo NMDG ottimizzato del cervello affettare è compatibile con gli animali sia giovani che adulti, risolvendo così una limitazione della metodologia originale. In sintesi, un singolo supporto formulazione e cervello affettare la procedura può essere implementate attraverso le varie specie ed età per ottenere ottima conservazione di attuabilità e tessuto.
Introduzione
La preparazione di fetta cerebrale acuto è un sistema di modello sperimentale essenziale nell'ambito delle neuroscienze. Circa la metà di un secolo, questa piattaforma ha permesso studi dinamici funzionali del cervello vivente in una vasta gamma di specie animali e regioni anatomiche del cervello. Se l'uso previsto è biochimica, imaging funzionale, morfologia o elettrofisiologia, è della massima importanza per garantire l'integrità ottima e la vitalità del tessuto affettato. È per questo motivo che la preparazione di fetta di cervello del roditore giovanile altamente resiliente (cioè, più giovane di postnatale giorno 30 per topi) è stato il più preferito fino ad oggi. La difficoltà nell'ottenere il cervello sufficientemente sano fette da adulto maturo e animali di invecchiamento ha dimostrato di essere una sfida formidabile per la maggior parte e ha imposto severe limitazioni per studiare l'architettura funzionale del cervello maturo. Ciò è particolarmente vero per il morsetto di patch di registrazione, una tecnica che richiede ottima conservazione morfologica e funzionale ed è indispensabile per la caratterizzazione di proprietà intrinseche e sinaptica dettagliate di singoli neuroni identificati. Per i parecchi decenni passati, la stragrande maggioranza di elettrofisiologi morsetto patch è affidati a un metodo di 'protezione taglio' utilizzando saccarosio-sostituiti basso Na+ aCSF1 per la preparazione di fettine di cervello sano da giovanile e in misura molto minore misura, giovani animali adulti. Questo metodo si basa sulla premessa che l'afflusso passivo Na+ e l'ingresso di acqua successive e cella gonfiore durante la fase di taglio fetta è l'insulto predominante che conduce alla scarsa sopravvivenza dei neuroni, specialmente per quei neuroni situato nella strati superficiali che hanno più probabilità di sostenere trauma diretto dal movimento della lama. Tuttavia, il metodo di protezione taglio lascia ancora molto a desiderare per la preparazione di fetta di cervello da animali adulti maturi indipendentemente dalla formulazione particolare aCSF implementato.
Una soluzione semplice ma efficace a questo problema è stato descritto2,3,4,5,6 e chiamato il metodo slice di cervello 'protettiva recupero'. La versione originale di questo metodo utilizza un aCSF NMDG-sostituiti, come NMDG è stato identificato come il più versatile ed efficace tra vari altri sostituti di ioni del sodio di candidato (tra cui saccarosio, glicerolo, colina e Tris). La formulazione di media è stata ulteriormente migliorata da aggiunta di HEPES resistere l'edema del cervello fetta e fornire più forte pH buffer7, così come l'aggiunta di integratori per contrastare gli effetti dannosi dello stress ossidativo (tabella 1). Empiricamente è stato determinato che un'incubazione di recupero iniziale passo in basso Na+, basso Ca2 +, e alta Mg2 + NMDG aCSF subito dopo cervello adulto tessuto affettare era necessario e sufficiente per migliorato neuronale conservazione su una vasta gamma di regioni del cervello, tipi cellulari e animali età3,5,6.
In particolare, precedenti incarnazioni di che cosa ora è doppiato il metodo di protezione si trovano nella letteratura1,8,9,10,11,12, 13, anche se il pieno potenziale per adulto in età matura e invecchiamento cervello animale fetta e patch clamp registrazione non era riconosciuto o ha dimostrato in queste opere precedenti. Inoltre, sfumate variazioni procedurali continuano ad emergere a sostegno di specifiche applicazioni sperimentali4,14,15,16. L'organo collegiale del lavoro di questi numerosi gruppi di ricerca conferisce elevata fiducia nella robustezza del metodo protettivo recupero per conservazione migliore del tessuto. Il metodo di ripristino protettivo NMDG ora è stata ampiamente adottato e implementato in numerosi studi di ricerca pubblicata utilizzando preparazioni di fetta di cervello animale adulto. Questi studi acuti fetta span neocortical3,17,18, hippocampal15,19,20,21, striatal22 , 23 , 24, mesencefalo25,26,27,28,29e hindbrain30,31,32, 33 , 34 regioni e una varietà di tipi del neurotrasmettitore e del neuromodulatore cui glutamatergic4,30, GABAergici18,20,31,35 ,36, dopaminergici24,29,37,38, colinergici14,37,38, 39, noradrenergico40e serotoninergici27,28 neurotrasmissione. Il metodo è anche adatto per optogenetica controllo dell'attività neuronale in fette derivato da animali transgenici3,39 o a seguito di in vivo iniezioni virale17,27, 28,40,41,42,43, come bene come Ca2 + imaging funzionale di attività neuronale2,44 ,45,46. Analisi di breve termine plasticità4,47,48 e di diverse forme di lungo termine plasticità16,35,48 sono state segnalato. Uno studio recente ha applicato il metodo di recupero protettivo NMDG per facilitare l'ampia e sistematica di sondaggio delle connessioni sinaptiche nella corteccia visiva in fettine di cervello di topo adulto maturo utilizzando la octopatch registrazione configurazione49 — un potente dimostrazione dell'utilità e robustezza di questo metodo. Il metodo di protezione è stato applicato con successo anche in contesti sperimentali precedentemente imprevisti, ad esempio, una migliore conservazione del sistema vascolare e periciti nel cervello adulto corticale fette50, toppa morsetto registrazione da trapiantato popolazioni Interneurone in 1 – 1,5 anni del morbo di Alzheimer del mouse modelli20e un cervello adulto fetta del ricevitore traffico saggio51.
Il seguente protocollo descrive le procedure dettagliate per l'implementazione di un metodo di recupero protettivo NMDG ottimizzato di preparazione di fetta di cervello per migliorare la redditività delle fette del cervello acuto. I principi per una migliore conservazione di un neurone sono discusse, così come dimostrazione dei chiari vantaggi di questa metodologia per complessi multi-neurone toppa morsetto registrazione esperimenti in fettine di cervello di topo transgenico adulto giovane e adulto maturo fette di cervello umano neurochirurgica. Il seguente protocollo è stato convalidato per i topi da 21 giorni a più anni, anche per quanto riguarda esemplari neurochirurgici umani derivati da pazienti adulti.
Protocollo
Procedure che coinvolgono topi transgenici sono state approvate dal istituzionale Animal Care e uso Committee (IACUC) presso l'Istituto di Allen per scienza del cervello. In questi esperimenti sono stati utilizzati topi C57BL/6 sia maschi che femminili (gamma 10-30 g di peso). Alcuni dei risultati rappresentativi descrivono i dati raccolti dalle fette di cervello umano vivente. Tessuto neocortical esemplari sono stati ottenuti durante neurochirurgia per la rimozione del tumore. Era necessario rimuovere il tessuto neocortical sovrastante per accedere al tessuto malato. Consenso informato del paziente è stata ottenuta in tutti i casi per l'uso del tessuto neurochirurgico per scopi di ricerca nell'ambito di un protocollo approvato dal comitato di revisione istituzionale del centro medico svedese.
1. preparazione dei terreni e reagenti (tabella 1)
Nota: Soluzioni devono essere fatto in acqua purificata che è priva di tracce di metalli e altre impurità. È consigliabile che soluzioni effettuato appena il giorno dell'esperimento, anche se soluzioni inutilizzati possono essere conservati a 4 ° C fino a 1 settimana, se lo si desidera. 1 L di ogni formulazione di cui sopra è sufficiente per 1 – 2 per affettare le procedure. Tutte le soluzioni di aCSF devono essere saturate con carbogen (95% O25% CO2) prima dell'uso per garantire buffering pH stabile e un'adeguata ossigenazione. Il pH di tutte le soluzioni deve essere regolato a 7,3-7,4 e osmolalità misurata e regolata a 300-310 mOsmol/kg.
- Preparare aCSF NMDG-HEPES (in mM): 92 NMDG, 2.5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, glucosio 25, tiourea 2, 5 Na-ascorbato, 3 Na-piruvato e 0,5 CaCl2·2H2O 10 MgSO4·7H2O. titolazione pH a 7,3 -7,4 con 17 mL + /-0,5 mL di acido cloridrico 5 M.
Nota: Questo passaggio di titolazione idealmente dovrebbe essere eseguita prima dell'aggiunta di cationi bivalenti per evitare la precipitazione; Tuttavia, la precipitazione può essere invertita su adeguamento del pH nell'intervallo fisiologico. - Preparare HEPES holding aCSF (in mM): 92 NaCl, 2.5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, glucosio 25, tiourea 2, 5 Na-ascorbato, 2 CaCl2·2H2O 3 Na-piruvato e 2 MgSO4·7H2O. titolazione pH a 7,3 – 7,4 con qualche goccia di concentrato 10 N NaOH.
- Preparare la registrazione aCSF (in mM): 124 NaCl, 2.5 KCl, 1,25 NaH2PO4, 24 NaHCO3, 12.5 glucosio, 5 HEPES, 2 CaCl2·2H2O e 2 MgSO4·7H2O. titolazione pH 7.3-7.4 con poche gocce di concentrato di NaOH 10 N.
- Preparare Na+ a spillo-in soluzione (2 M): 580 mg di NaCl disciolto in 5 mL di preparati NMDG-HEPES aCSF. Si tratta di una soluzione abbastanza per prep fetta un cervello.
- Preparare agarosio al 2% da utilizzare per l'inclusione di tessuti. Sciogliere 2 g di agarosio tipo 1B (Vedi Tabella materiali) in 100 mL di 1X PBS e forno a microonde fino a ebollizione appena. Agitare per mescolare, poi versare il composto in una capsule di Petri sterile 10cm e lasciare solidificare. Conservare la piastra di agarosio in un sacchetto di plastica a 4 ° C fino all'utilizzo.
- Preparare anestetico iniettabile soluzione madre di lavoro. Versare 2,5 g di 2,2,2-Tribromoethanol con 5 mL di 2-metil-2-butanolo e poi gradualmente dissolversi in 200 mL di PBS, pH 7.0-7.3. Filtrare la soluzione con un filtro da 0,22 µm prima dell'uso e conservare a 4 ° C al riparo dalla luce.
Nota: Consultare uso animale rispettivo Comitato linee guida e norme per determinare la procedura di scadenza e smaltimento per l'anestetico soluzione madre di lavoro.
2. installazione della stazione per affettare
- Impostare la stazione per affettare con l'affettatrice di tessuto e strumenti chirurgici (Vedi Tabella materiali). Per calibrare la macchina affettatrice, fissare una lama di ceramica iniettore di zirconio al braccio lama usando fast-adesivo colla, quindi inserire il portacampioni e allineare il bordo della lama fino all'orlo di titolare campione lasciando un piccolo divario per assicurarsi che la lama non graffi il metallo.
Nota: Se il filo della lama non è fisicamente danneggiato può essere riutilizzato per molte settimane o addirittura mesi senza sostituzione. Vari modelli di affettatrice di tessuto sono disponibili in commercio, molti dei quali in grado di fornire ottime prestazioni quando ottimamente calibrato. Lo strumento ideale dovrebbe avere deviazione asse z minima, misurata direttamente e sintonizzato o empiricamente osservati. - Impostare un becher da 250 mL riempito con 200 mL di NMDG-HEPES aCSF e pre-chill sul ghiaccio con costante carbogenation (applicato tramite un diffusore gas pietra immerso nei media) per > 10 min.
Nota: Questa soluzione sarà utilizzata per la perfusione perfusione e per il riempimento del serbatoio macchina affettatrice durante il sezionamento. - Istituire il cervello iniziale fetta recupero camera riempita con 150 mL di NMDG-HEPES aCSF (mantenere costante carbogenation) e posizionare la camera in un bagno di acqua riscaldata alla 32 – 34 ° C.
Nota: Una fetta camera dopo il disegno di Edwards e Konnerth (1992)52 è consigliato per questo passaggio. Queste camere possono essere realizzate con elementi del laboratorio prontamente disponibili (becher da 250 mL in nylon mesh netting, provetta conica da 50 mL, plastica piatto tondo 35 mm). Prestare la massima attenzione per garantire che la fetta rimane libero di aria di compensazione bolle, specialmente quelle continuamente prodotte dalle pietre di bolla di gas carbogen come questi possono causare fette galleggiare e danneggiarsi. La compensazione deve essere immersa all'incirca 1 cm sotto la superficie del liquido. - Impostare una fetta di cervello holding camera; un design con pozzi multipli indipendenti in un serbatoio più grande è consigliato (Vedi Tabella materiali). Riempire il serbatoio con 450 mL di HEPES aCSF e riscaldare a temperatura ambiente sotto carbogenation costante fino all'utilizzo.
Nota: Le fette di cervello verranno trasferite dalla camera di recupero iniziale di quest'Aula per immagazzinaggio a lungo termine prima di registrazioni elettrofisiologiche. Cura deve essere presa per assicurare che il fetta reticolato resti privo di bolle d'aria in ogni momento. - Preparare agarosio fuso per l'incorporamento del tessuto. Utilizzare l'estremità aperta un flacone da 50 mL conica come un cookie cutter per tagliare un blocco di agarosio al 2% dal piatto preparato in precedenza. Senza bloccare tappo del flacone conico, poi a microonde per 10-30 secondi fino a quando l'agarosio è appena sciolta. Non surriscaldare.
- Versare l'agarosio fuso in provette da 1,5 mL. Mantenere l'agarosio allo stato fuso usando un thermomixer impostata a 42 ° C con agitazione vigorosa. Verificare attentamente che l'agarosio fuso non solidificare prematuramente.
- Inserire l'accessorio agghiacciante blocco per l'affettatrice sul ghiaccio per pre-raffreddare in questo momento.
3. perfusione perfusione
Nota: La procedura di perfusione perfusione è un passo importante quando si lavora con animali adulti ed è importante per ottenere un raffreddamento rapido del cervello e rallentato metabolismo tramite infusione di cervello di basso Na+, basso Ca2 +/ alto Mg2 + aCSF soluzione. La perfusione perfusione serve anche a cancellare i globuli rossi dal sistema vascolare del cervello, che riduce l'autofluorescenza che potrebbe interferire con la visualizzazione e il targeting di popolazioni di cellule fluorescente contrassegnati in linee transgeniche. Non è consigliabile omettere perfusione perfusione.
- Profondamente anestetizzare topi tramite l'iniezione intraperitoneale di anestetico soluzione madre di lavoro (250 mg / kg: 0,2 mL 1,25% anestetico lavoro soluzione di riserva per peso corporeo di 10 g, vedere la Tabella materiali). Dopo ~ 2 – 3 min, verificare sufficiente profondità dell'anestesia valutando riflesso pizzico di punta. Se necessario, iniettare un volume aggiuntivo di anestetico lavoro stock e rivalutare il riflesso di pizzico di punta dopo un altro 2-3 min.
- Caricare una siringa da 30 mL con 25 mL di carbogenated NMDG-HEPES aCSF dal becher da mL 250 pre-refrigerati (2 – 4 ° C è ottimale, al contrario di soluzione fangosa o congelata). Inserire un ago di calibro 25 5/8.
- Con il mouse sul dorso, appuntare giù le zampe anteriori e le zampe posteriori per la stabilità. Un bicchiere di 15cm di Petri riempito con del silicone indurito opere bene come base.
- Usando un bisturi, fare un'incisione laterale per aprire la cassa toracica a livello del diaframma. USA forbice per tagliare attraverso la gabbia toracica su entrambi lato avendo cura di evitare il clipping il cuore ed i polmoni.
- Pin indietro la parte centrale della gabbia toracica per esporre il cuore. Inserire l'ago della siringa 30ml nel ventricolo sinistro e tagliare l'atrio destro con forbice per consentire sangue uscire il cuore.
- Premere lo stantuffo della siringa utilizzando manuale pressione costante e irrorare l'animale con il aCSF NMDG-HEPES refrigerate a una velocità di ~ 10 mL/min.
Nota: Se la perfusione è successo il fegato cambierà di colore dal rosso intenso al giallo pallido e in alcuni casi chiari fluidi possono essere osservati uscendo le narici verso la fine della procedura.
4. cervello dissezione e affettare
- Decapitare l'animale. Utilizzare un bisturi per aprire la pelle sulla testa ed esporre la protezione del cranio.
- Super-taglio fine di utilizzare le forbici per tagliare via la pelle sopra protezione del cranio e fare piccole incisioni lateralmente su entrambi i lati alla caudale/ventrali base del cranio. Fare ulteriori tagli poco profondi, a partire da funzione caudale/dorsale del cranio si muove in direzione rostrale fino la linea mediana dorsale facendo attenzione a non per danneggiare il cervello sottostante. Rendere un finale ' t ' tagliato perpendicolarmente alla linea mediana a livello dei bulbi olfattivi.
Nota: È necessario prestare attenzione affinché che nessun danno è fatto per le regioni del cervello di interesse. In particolare, in nessun momento ci dovrebbe essere alcuna forza di compressione applicata al cervello stesso. - Utilizzare il forcipe di turno-suggerimento per afferrare il cranio a partire dall'aspetto di rostrale mediale e buccia indietro verso la direzione caudale-laterale. Ripetere l'operazione per entrambi i lati di crack aprire e rimuovere le parti dorsali di protezione del cranio per esporre il cervello. Delicatamente scoop cervello intatto nel becher di pre-refrigerati NMDG-HEPES aCSF. Permettere al cervello di raffreddare uniformemente per ~ 1 min.
- Usare la spatola grande per sollevare il cervello fuori il becher e di Petri ricoperta di carta da filtro. Tagliare e bloccare il cervello secondo l'angolo preferito di affettare e desiderato la regione del cervello di interesse. Lavorare rapidamente per evitare la privazione dell'ossigeno prolungata durante la movimentazione.
Nota: Molti angoli per affettare sono possibili. L'angolo di metodo e affettare blocco esatto dipenderà la regione esatta del cervello, tipo di cella e circuito da studiare. - Apporre il blocco del cervello per il portacampioni con colla adesiva. Ritrarre la porzione interna del portapreparato abbastanza di ritirare il blocco di cervello completamente dentro. Versare l'agarosio fuso direttamente nel porta fino a quando il blocco di cervello è completamente rivestito in agarosio. Fissare l'accessorio pre-raffreddata agghiacciante blocco intorno il portacampioni per ~ 10 s fino all'agarosio ha solidificato.
- Inserire il portacampioni nella presa sulla macchina affettatrice e verificare il corretto allineamento. Riempire il serbatoio con restante pre-refrigerati, ossigenato NMDG-HEPES aCSF dal becher da 250 mL e spostare una pietra di bolla nel serbatoio per tutta la durata di taglio per garantire un'adeguata ossigenazione.
- Regolare il micrometro per iniziare avanzando l'esemplare del cervello dell'agarosi incorporato. Avviare l'affettatrice ed empiricamente regolare la frequenza di oscillazione e velocità di avanzamento al livello desiderato.
Nota: Entrambe le impostazioni dovrebbero essere nella gamma bassa. Per risultati ottimali, un singolo passaggio del braccio lama dovrebbe prendere circa 20 s e l'oscillazione dovrebbe produrre un ronzio molto liscio e delicato con nessun ronzio evidente. - Continuare a far avanzare e tagliare il tessuto in 300 µm incrementi (o altri spessore preferito) fino alla regione del cervello di interesse è completamente sezionato; il tempo totale per la procedura di taglio dovrebbe essere meno di 15 min.
5. procedura di recupero protettivo NMDG ottimizzato
- Passo di recupero NMDG iniziale (fase critica): al termine della procedura di sezionamento, raccogliere tutte le sezioni utilizzando un cut-off in plastica Pasteur tubo t e trasferirli in una camera di recupero iniziale pre-riscaldata (34 ° C) riempita con 150 mL di NMDG-HEPES aCSF. Trasferire tutte le fette in breve successione e avviare un timer non appena tutte le fette vengono spostate nella camera di recupero.
- Consultare la tabella 2 per determinare la Na+ a spillo-in programmazione ottimale secondo l'età del mouse.
Nota: Questa procedura è un metodo pratico per raggiungere un tasso controllato di reintroduzione del Na+ nella camera di fetta di cervello ed è ottimizzata per un cervello specifico fetta geometria e serbatoio di volume camera e tipo (Vedi Tabella materiali). - Eseguire la graduale Na+ a spillo-in procedura aggiungendo i volumi indicati di Na+ spike-in soluzione al indicato volte. Aggiungere la soluzione di punta del Na+ direttamente nel camino della vasca di gorgogliamento della sezione recupero iniziale per facilitare la miscelazione rapida.
- Trasferimento tutte le fette alla HEPES aCSF a lungo termine della holding della camera mantenuta a temperatura ambiente. Consentire fette di recuperare per un ulteriore 1 h in HEPES holding camera prima di iniziare esperimenti di patch clamp registrazione.
6. Patch Clamp registrazione
Nota: Le seguenti procedure di base semplicemente forniscono alcune considerazioni di ordine pratici e non sono destinate a rappresentare protocolli dettagliati per le registrazioni di patch clamp, come questi possono essere trovati altrove53,54. Un patch clamp Elettrofisiologia rig è richiesto per questa applicazione. Generalmente questo sarà composto di un microscopio verticale dotato di infrarossi interferenza differenziale contrasto (IR-DIC) ottiche e un sistema di illuminazione di fluorescenza, un amplificatore di patch clamp e dati digitalizzatore, motorizzata micromanipolatore e microscopio piattaforma, tabella di vibrazione isolamento, gabbia di Faraday e sistema di riscaldamento e di aspersione di soluzione. La camera del campione e la piattaforma dovrebbe essere progettati per la registrazione di fetta sommersa. Per le registrazioni di multi-neurone patch clamp, è richiesto un impianto dotato di più amplificatori, fasi testa e micromanipolatori di alta qualità. Inoltre, per ottenere risultati ottimali, un impianto dotato di un filtro passa-banda 900 nm IR e componenti ottici di corrispondenza è altamente raccomandato per assicurare una visualizzazione adeguata delle cellule situate > 50 µm nel profondo le fette di cervello. Corretto allineamento per l'illuminazione di Kӧhler è anche importante per visualizzazione libera.
- Preparare la soluzione di pipetta intracellulare (in mM): 130 K-gluconato, 4 10 HEPES, 0,3 EGTA, KCl, 10 fosfocreatina-Na2, 4 MgATP, Na 0,32-GTP e 13,4 biocitina. Regolare il pH a 7.35 con 1m KOH ed il osmolality a 285-290 mOsmol/kg utilizzando saccarosio come necessario.
- Preparare gli elettrodi del morsetto patch dai vasi capillari di vetro di borosilicato spesse; l'elettrodo del morsetto di toppa ideale ha una conicità relativamente corta e tozza con un ~ 3 – 6 MOhm riempito resistenza di punta nel bagno.
- Assicurarsi che i cavi degli elettrodi d'argento siano correttamente chlorided al fine di garantire registrazioni stabile. A tale scopo (tipico) immergendo gli ultimi 3-4 mm dell'argento filo in candeggina liquida per circa 30 minuti o fino a quando il filo diventa nero.
- Stabilire la perfusione di soluzione utilizzando una pompa peristaltica impostata su 3-4 mL/min Circulate carbogenated aCSF attraverso la camera di registrazione facendo attenzione ad per abbinare l'afflusso e il deflusso di registrazione per evitare l'overflow.
- Trasferisci una fetta di cervello singolo nella camera di registrazione di sommersione e sicuro in luogo utilizzando un ancoraggio di sezione a forma di U con nylon traversa stringhe. Identificare l'area del cervello di destinazione utilizzando un obiettivo 4x aria prima di passare a un obiettivo di potenza più elevato (ad esempio, obiettivi di immersione acqua alta apertura numerica 40x o 60 X).
- Identificare visivamente una cella obiettivo sano. L'aspetto della membrana neuronale al soma, come visualizzate da microscopia IR-DIC, è utilizzato per valutare l'idoneità di una cella del candidato per la registrazione di patch clamp.
Nota: I neuroni sani in genere presentano le seguenti caratteristiche: rattrappito né gonfio somata, molle di contrasto dei bordi di membrana e aspetto di membrana liscia. Inoltre, si trovano la maggior parte delle cellule sane > 30 µm nel profondo la fetta, come i neuroni superficiali sono suscettibili di essere danneggiati con reciso processi dentritici. I neuroni che presentano un aspetto increspato, chiaramente visibili nuclei o 'uovo fritto' aspetto o bordi a contrasto molto scuro o alta membrana dovrebbero essere evitati. - Retro-fill la patch pipetta con ~ 5 µ l di soluzione intracellulare e caricarlo nella pinza porta elettrodo. Spostare la pipetta nel bagno di registrazione sopra la fetta di cervello e applicare una leggera pressione positiva per eliminare tutte le ostruzioni nella punta. Azzerare l'offset di pipetta e monitorare la resistenza di punta con una funzione di test di membrana.
- Spostare la punta della pipetta in contatto con il corpo cellulare del neurone bersaglio; una piccola fossetta dovrebbe formare sulla superficie della membrana a causa della leggera pressione positiva.
- Non appena si osserva una fossetta di membrana, rapidamente rimuovere la pressione positiva e applicare aspirazione delicata per facilitare la formazione di sigillo. Una volta che la resistenza di pipetta aumenta a > 100 MOhm, girare su un comando di detenzione ad un livello che corrisponde alla membrana di riposa prevista potenziali per il tipo di cella mirati (-70 mV è un buon punto di partenza).
- Una volta che la resistenza di punta raggiunge ≥ 1 gigaohm, tenta di penetrare la cellula di rottura della membrana sotto la pipetta patch utilizzando brevi attacchi di forte aspirazione; la funzionalità 'zap' può essere utilizzata per facilitare il rodaggio come necessario.
Nota: Un partecipazione potenziale di -70 mV è suggerito per gli esperimenti di morsetto di tensione sui neuroni corticali. I neuroni sani avrà una perdita di corrente non più negativo di-100 pA per tutta la durata dell'esperimento, ma questo è in parte dipenda dal tipo di cella. Un neurone sarebbe essere esclusi dall'analisi se il potenziale di membrana di riposo era più depolarizzato di -50 mV, o se la resistenza di accesso modificato da più di 20%. -
Una volta ottenuta una registrazione di stabile intero-cellula patch clamp, destinazione neuroni supplementari per registrazione ripetendo i passaggi 6.6 – 6,10. Prestare attenzione per evitare disturbi meccanici che porterebbe a perdere la prima registrazione.
- Selezionare neuroni supplementari entro 100 µm dal primo neurone per garantire una ragionevole probabilità di trovare neuroni sinapticamente-accoppiato.
Nota: Potrebbe essere utile in alcuni casi per identificare più neuroni candidato davanti e per pre-caricare e pre-posizionare tutte le pipette è vicino alle varie cellule mirate prima di stabilire la prima registrazione di patch clamp.
- Selezionare neuroni supplementari entro 100 µm dal primo neurone per garantire una ragionevole probabilità di trovare neuroni sinapticamente-accoppiato.
Risultati
Questa sezione fornisce risultati rappresentativi per la preparazione di fetta di cervello sistematico ed esperimenti di patch clamp Elettrofisiologia utilizzando il metodo di recupero protettivo NMDG ottimizzato (cioè, NMDG protettivo recupero combinato con graduale Na+ Spike-in procedura). Conservazione in primo luogo, morfologica dei neuroni è stata valutata in varie regioni del cervello di fettine di cervello preparati con o senza implementare il metodo di recupero protettivo NMDG ottimizzato (Figura 1). Tre topi adulti mese vecchio sono stati selezionati per questi esperimenti, e abbiamo usato la microscopia IR-DIC per determinare la salute del neurone, basato sulla forma e l'aspetto generale del somata e dendriti prossimali. Si noti l'aspetto picnotici striminziti, della maggior parte dei neuroni nelle immagini rappresentative di fettine di cervello preparati senza il metodo di ripristino protettivo (tutte le immagini sono state ottenute 1 – 2 h dopo la fetta preparazione). Queste fette di controllo sono state preparate utilizzando NMDG aCSF per perfusione perfusione e affettare passi ma inizialmente sono state recuperate in alto Na+-contenente HEPES aCSF. Al contrario, le immagini rappresentative dalle fette preparate utilizzando il metodo di recupero protettivo NMDG ottimizzato rivelano i neuroni con morfologie migliorate (più liscia, più piena, meno pieghettato aspetto) che sono adatti per morsetto di patch (figura di registrazione 1). la conservazione di un neurone migliorata è stata osservata attraverso regioni multiple del cervello compreso neocortical strati II/III e V, subiculum e nucleo genicolato laterale dorsale (missilistico).
Successivamente, il metodo di recupero protettivo NMDG ottimizzato è stato confrontato con l'originale metodo di ripristino protettivo NMDG (cioè, senza la graduale procedura di spike in Na+ ). Il tempo medio per la formazione di guarnizione gigaohm in toppa morsetto tentativi di registrazione è stato drammaticamente e significativamente ridotto (9,9 s contro 33,3 s, * *p < 0,005, accoppiata t-test) quando è stata applicata la procedura graduale Na+ a spillo-in insieme con il passaggio di ripristino protettivo NMDG (Figura 2). La membrana più veloce e affidabile tenuta volte notevolmente migliorato la velocità effettiva del morsetto di toppa registrazione nelle fette del cervello adulto giovane. Il Na+ ottimale spike-nel programma è stato ulteriormente modificato secondo l'età dell'animale (tabella 2) ed era vantaggioso per tutte le età testate (3 settimane per 1 anno vecchi topi). Il profilo di elevazione di concentrazione di ioni sodio graduale durante tutto il corso della procedura spike-in viene fornito (Figura 3) per accompagnare gli orari riportati nella tabella 2.
Come parte del programma Allen Institute Cell tipi (http://celltypes.brain-map.org/) uno sforzo su larga scala è in corso per sistematicamente caratterizzano le intrinseche proprietà elettrofisiologiche dei singoli neuroni in giovane adulto (postnatale giorno 40-80) fette di cervello visivo corticale del topo derivano da linee transgeniche con espressione marcatore fluorescente specifico del tipo delle cellule in popolazioni neuronali geneticamente definita (strato corticale e il tipo di cella specifici Cre driver linee incrociate a un fluorescente Cre-dipendente Reporter linea55). La figura 4 Mostra tracce di esempio di schemi di attivazione registrati da parvalbumina (Pvalb)-esprimendo interneuroni di corticale fast-chiodare (FS) (Pvalb-IRES-Cre/Ai14 topi) in risposta a una serie di 1 s corrente passi iniezione che coprono la gamma dinamica di infornamento del neurone. il F-curva per un dataset di 22 corticale interneuroni di FS è mostrato a destra. Simile mirati sono stati eseguiti esperimenti di patch clamp registrazione per caratterizzare 23 Rorb-esprimendo i neuroni eccitatori nello strato IV da Rorb-IRES-Cre/Ai14 topi (Figura 4). Tipi di neurone sano diversi tra cui FS interneuroni e neuroni piramidali nelle regioni corticali e strati possono essere mirati regolarmente e in modo affidabile per toppa morsetto registrazione per almeno 6-8 h dopo ottimizzato fetta preparazione utilizzando questo protocollo.
Oltre a misurare le proprietà neuronali intrinseche, connettività sinaptica è stato sondato tra neuroni simultaneamente registrati multiple dei tipi definiti in visual microcircuiti corticali. Il morsetto di multi-neurone patch tecnica di registrazione è eccezionalmente esigente, come numerosi neuroni sani candidato di tipi definiti devono essere presenti all'interno di un campo relativamente piccolo della fetta del cervello al fine di garantire una ragionevole possibilità di ottenere alta qualità registrazioni simultanee e identificazione di connessioni sinaptiche bona fide . La figura 5 Mostra la registrazione accoppiata di due interneuroni tdTomato + FS nella corteccia visiva del cervello fette derivato da giovani topi adulti Pvalb-IRES-Cre/Ai14. Una forte connessione sinaptica inibitoria unidirezionale è stata rilevata (registrato con soluzione di cloruro di alta interna pipetta). Registrazioni di esempio e protocolli per misurare proprietà di plasticità sinaptica a breve termine sono presentati. Attacchi di stimolazione di treni ad alta frequenza (10 impulsi ogni 10, 50 e 100 Hz) sono stati seguiti da impulsi di prova singolo recupero a vari intervalli di tempo (1, 2 o 4 s) per misurare il corso di tempo di recupero da depressione sinaptica.
Eccellente successo è stato ottenuto anche per neuroni neocorticali umani in fettine di cervello maturo adulto ex vivo . Gli esemplari neurochirurgici sono ottenuti da pazienti sottoposti a interventi chirurgici pianificati per la rimozione del tumore di ospedali locali. Le procedure per la preparazione di fetta di collezione e cervello di tessuto umano neurochirurgica differiscono dalle procedure di fetta di cervello di topo in alcuni modi pratici. In breve, neocortical tessuto resecato (distale al luogo di patologia) è prelevato dalla sala operatoria e immerso nella gelida ossigenato NMDG-HEPES aCSF e trasportato con abbattimento continuo e ossigenazione da sala operatoria per la laboratorio entro 30 minuti o meno. Le fette di cervello sono preparate utilizzando la procedura di ripristino protettivo NMDG e ha permesso di recuperare per un tempo prolungato di circa 3 h prima di iniziare le registrazioni di patch clamp. Figura 6 Mostra un successo accoppiato registrazione esperimento e un esperimento di registrazione successo quadrupla patch clamp da umano ex vivo fettine di cervello preparato in questo modo dalla regione della corteccia frontale. La registrazione accoppiata dimostra input sinaptico eccitatorio unidirezionale da un neurone piramidale corticale su un interneurone corticale (registrato come eccitatori postsinaptiche correnti). Nella patch quad sperimentare due eccitatori e due neuroni inibitori sono stati registrati simultaneamente tre connessioni sinaptiche inibitorie sono state rilevate (registrato come potenziali postsinaptici inibitori) fuori dodici collegamenti totali sondati. Quindi, questa metodologia di fetta di cervello ottimizzato permette affidabile successo sperimentale nelle più impegnative del cervello fetta applicazioni, tra cui esperimenti di multi-neurone patch clamp per lo studio di connettività di circuito nel cervello umano adulto maturo acutamente resecato tessuto.
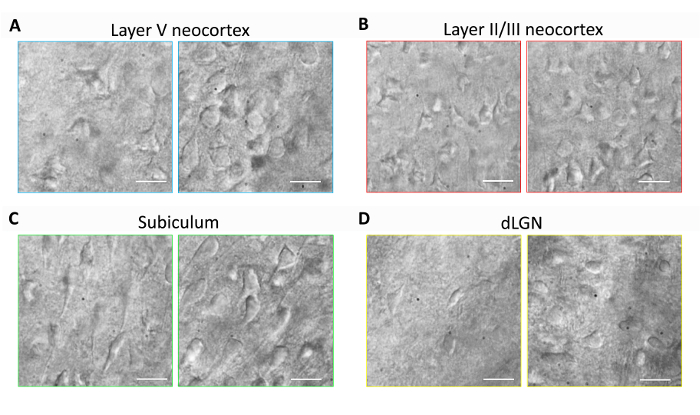
Figura 1: Migliorato la conservazione di un neurone con il metodo di recupero protettivo NMDG ottimizzato di preparazione di fetta di cervello. Rappresentante IR-DIC immagini sono state acquisite dalle regioni diverse del cervello in fettine acute da un mouse tre mesi di età. Controllare il metodo di protezione taglio NMDG senza un passaggio di ripristino protettivo (pannelli a sinistra) rispetto al metodo di recupero protettivo NMDG ottimizzato (pannelli di destra). (A) strato V della neocorteccia, (B) livello II/III della neocorteccia, subiculum (C) e (D) nucleo genicolato laterale dorsale (missilistico). Barre della scala in tutti i pannelli sono 20 µm. Clicca qui per visualizzare una versione più grande di questa figura.
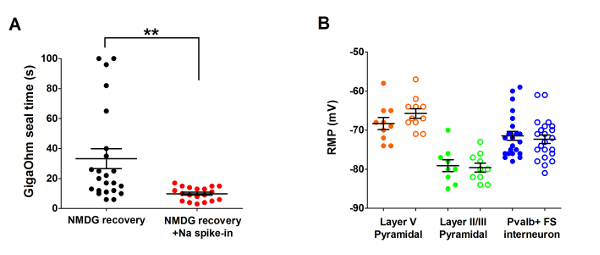
Figura 2: Accelerata velocità e maggiore affidabilità dei gigaohm sigillare formazione nella toppa morsetto registrazione esperimenti utilizzando il metodo di recupero protettivo NMDG con procedura di spike in Na+ . (A) terreno di formazione guarnizione gigaohm volte per recupero NMDG da solo (nero punti dati, n = 19) contro NMDG recupero plus procedura spike-in Na+ (punti di dati rosso, n = 23). Tutte le cellule registrate erano neuroni piramidali nel livello II/III o V della corteccia visiva. Notare che il tempo massimo è limitato a 100 s per tenere conto per le celle che mai formano gigaohm guarnizioni. Coppia t-prova, * *p < 0,005. (B) trama del potenziale di membrana (RMP) per neuroni piramidali strato V a riposo (punti dati arancione, n = 10/11), neuroni piramidali II/III (verde punti dati, n = 9/10), o corticale interneuroni Pvalb + FS (blu punti dati, n = 23/22). Cerchi pieni indicano condizioni di recupero NMDG e aprire cerchi NMDG recupero plus procedura spike-in Na+ . Ogni punto di dati rappresenta un neurone e la media di entrambi e + /-SEM vengono visualizzati. Non ci sono differenze significative nelle RMPs confrontando cervello fetta preparazione condizioni per tutti e tre tipi di cella (accoppiato t-test). Clicca qui per visualizzare una versione più grande di questa figura.
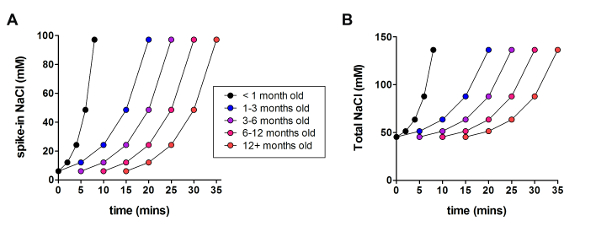
Figura 3 : Profilo di elevazione di concentrazione di ioni sodio graduale durante tutto il corso della procedura di spike-a. (A) appezzamento di spike-a concentrazione di NaCl rispetto al tempo. (B) diagramma di concentrazione di NaCl extracellulare totale rispetto al tempo. Clicca qui per visualizzare una versione più grande di questa figura.
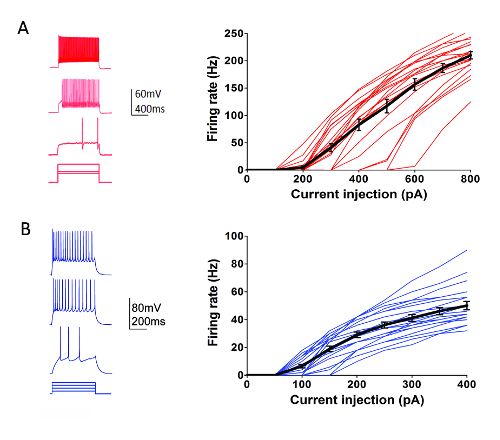
Figura 4 : Intrinseche proprietà elettrofisiologiche dei tipi delle cellule corticali geneticamente definiti. (A) esempio tracce di firing neuronale in risposta all'attuale procedura di iniezione per Pvalb + interneuroni corticali FS (pannello di sinistra). tdTomato + i neuroni sono stati mirati per le registrazioni nelle fette del cervello dai topi Pvalb-IRES-Cre/Ai14. Dati di riepilogo per rapporto di iniezione di corrente di tasso di infornamento (F-curva) vengono visualizzati a destra (n = 22). (B) esempio tracce di firing neuronale in risposta all'attuale procedura di iniezione per neuroni di esprimere Rorb strato corticale IV eccitatori (pannello di sinistra). tdTomato + i neuroni sono stati mirati per le registrazioni nelle fette del cervello dai topi Rorb-IRES-Cre/Ai14. Dati di riepilogo per rapporto di iniezione di corrente di tasso di infornamento (F-curva) vengono visualizzati a destra (n = 23). Ogni linea colorata sottile rappresenta la F-curva per un singolo neurone; considerando che, le spesse linee nere rappresenta la media per ogni gruppo di + /-SEM. Clicca qui per visualizzare una versione più grande di questa figura.
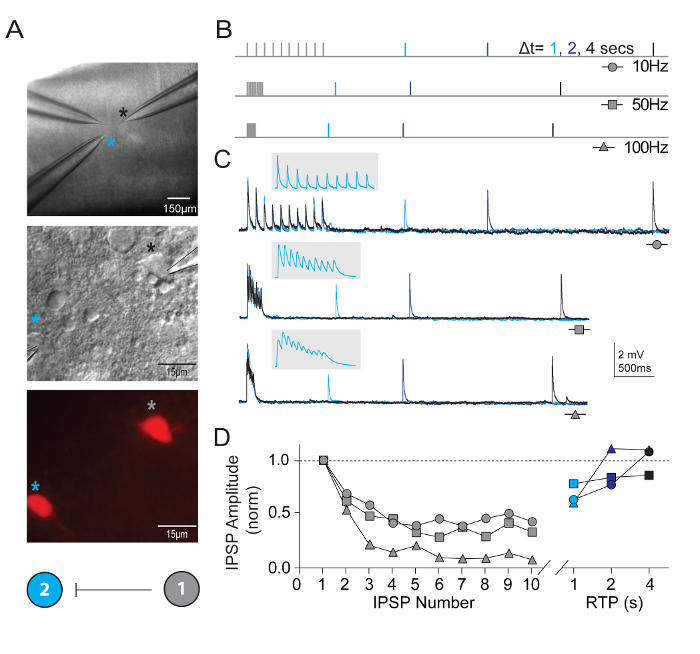
Figura 5: Plasticità a breve termine in sinapticamente connessi Pvalb-esprimendo interneuroni corticali FS. Contrasto differenziale di interferenza (A) ed epifluorescenza sono stati utilizzati per tdTomato-positiva, esprimendo Pvalb interneuroni FS della corteccia visiva primaria del mouse di destinazione. Un colore codificato diagramma schematico connettività dimostrando un'unilaterale connessione sinaptica tra i due interneuroni. (B) schema dei protocolli di stimolazione utilizzati per valutare le dinamiche a breve termine dei neuroni sinapticamente connessi. I treni di potenziali d'azione 10 (10, 50 e 100 Hz) sono evocati nel neurone presinaptico, seguito da un singolo potenziale d'azione (impulso di prova di recupero, RTP) consegnato con un ritardo di tempo diversi (1, 2 e 4 s) dopo che il treno è terminata. Ogni RTP sono colore codificato per chiarezza. (C) media tracce dei potenziali postsinaptici inibitori unilaterale corrispondente (uIPSPs) nella cella #2 in risposta ai treni di potenziali di azione evocati nella cella #1. Inserto grigio ha ampliato la scala di tempo per mostrare la delineazione del treno uIPSP. (D) normalizzato uIPSP ampiezze vengono tracciate in funzione della loro posizione durante i treni alle frequenze variabili. Depressione netto è chiaro attraverso tariffe di tutti gli input con un recupero sostanziale di uIPSP a 4 s. Clicca qui per visualizzare una versione più grande di questa figura.
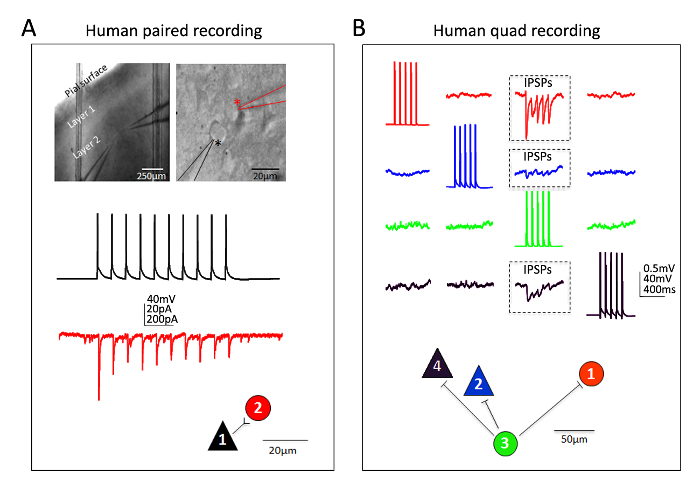
Figura 6: Multi-neurone patch morsetto registrazioni in umano adulto neurochirurgica fette del cervello. Immagini di basso e alto ingrandimento IR-DIC (A) che indica la posizione e l'identità dei neuroni registrati (pannello superiore). Un neurone piramidale (asterisco nero) e la vicina Interneurone (asterisco rosso) sono state registrate simultaneamente. Esempio di colori codificati tracce di una connessione sinaptica eccitatoria unidirezionale (ESPC) dalla cellula piramidale Interneurone (misurata come EPSC nel morsetto di tensione) e mappa corrispondente connessione fisica (pannello inferiore). Registrazione di (B) quadrupla patch clamp esperimento in una fetta di cervello umano adulto di neurochirurgica della corteccia prefrontal dorsolateral. Due neuroni piramidali e due interneuroni sono registrati simultaneamente, permettendo per sondare sequenziale di dodici possibili connessioni sinaptiche. Un treno di potenziali di azione evocati nella cella #3 (tracce verde) ha condotto a rilevazione dei potenziali post-sinaptici inibitori (IPSPs) in ciascuna delle altre tre neuroni simultaneamente registrate (tre regioni "in box", pannello superiore). Le risposte registrate da ogni singolo neurone sono colore codificato per chiarezza. La mappa di connessione fisica viene visualizzata nel pannello inferiore. Nota le tracce crude illustrate in (B) rappresentano le medie delle sweep almeno 20 consecutivi dati grezzi. Presunta identificazione del tipo di cella è stata basata sulla forma di soma, analisi della morfologia di tintura fluorescente riempimento durante le registrazioni e intrinseche proprietà elettrofisiologiche, tra cui gli schemi di attivazione in risposta all'attuale procedura di iniezione. Clicca qui per visualizzare una versione più grande di questa figura.
| NMDG-HEPES aCSF | HEPES holding aCSF | Registrazione aCSF | |||||||
| Componente | mM | MW | g/litro | mM | MW | g/litro | mM | MW | g/litro |
| NMDG | 92 | 195.22 | 17,96 | ||||||
| HCl | 92 | 36,46 | * | ||||||
| NaCl | 92 | 58,44 | 5,38 | 124 | 58,44 | 7,25 | |||
| KCl | 2.5 | 74.55 | 0,19 | 2.5 | 74.55 | 0,19 | 2.5 | 74.55 | 0,19 |
| NaH2PO4 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 |
| NaHCO3 | 30 | 84.01 | 2.52 | 30 | 84.01 | 2.52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| Glucosio | 25 | 180.20 | 4,51 | 25 | 180.20 | 4,51 | 12.5 | 180.20 | 2.25 |
| ascorbato di sodio | 5 | 198.00 | 0.99 | 5 | 198.00 | 0.99 | 0 | 198.00 | 0.00 |
| Tiourea | 2 | 76,12 | 0.15 | 2 | 76,12 | 0.15 | 0 | 76,12 | 0.00 |
| piruvato di sodio | 3 | 110.04 | 0,33 | 3 | 110.04 | 0,33 | 0 | 110.04 | 0.00 |
| MgSO4.7h2O | 10 | 246.48 | 5 mL | 2 | 246.48 | 1 mL | 2 | 246.48 | 1 mL (2m Stock) |
| CaCl2.2h2O | 0,5 | 147.01 | 0,25 mL | 2 | 147.01 | 1 mL | 2 | 147.01 | 1 mL (2m stock) |
| * titolo pH di NMDG-HEPES aCSF 7.3-7.4 utilizzando HCl concentrato | |||||||||
| Tutte le soluzioni dovrebbero essere nella gamma 300-310 mOsm/Kg | |||||||||
Tabella 1: Formulazioni Media.
| Età dell'animale | |||||
| Tempo (min) * | < 1 mese | 1-3 mesi | 3–6 mesi | 6–12 mesi | 12 + mesi |
| 0 | 250 Μ l | 250 Μ l | |||
| 1 | |||||
| 2 | 250 Μ l | ||||
| 3 | |||||
| 4 | 500 Μ l | ||||
| 5 | 250 Μ l | 250 Μ l | |||
| 6 | 1000 Μ l | ||||
| 7 | |||||
| 8 | Μ L 2000 | ||||
| 9 | |||||
| 10 | trasferimento | 500 Μ l | 250 Μ l | 250 Μ l | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000 Μ l | 500 Μ l | 250 Μ l | 250 Μ l | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | Μ L 2000 | 1000 Μ l | 500 Μ l | 250 Μ l | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | trasferimento | Μ L 2000 | 1000 Μ l | 500 Μ l | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | trasferimento | 2.000 Μ l | 1.000 Μ l | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | trasferimento | 2.000 Μ l | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | trasferimento | ||||
| * Tempo zero è che le fette di momento vengono trasferite nella camera di recupero iniziale | |||||
Tabella 2: Pianificazione consigliata per Na graduale + procedura di spike-in base all'età del mouse.
Discussione
Na + Spike-in migliora Gigaohm guarnizione formazione e Patch Clamp successo di registrazione
La versione iniziale del metodo protettivo recupero NMDG è stata progettata specificamente per gli animali di invecchiamento e dell'adulto2,5. Alcuni primi utilizzatori hanno anche cercato di applicare questa metodologia giovanile cervello animale per affettare (cioè, topi < 30 giorni di età). Tuttavia, è stato notato che in contrasto con l'eccezionale conservazione neuronale a confermato visivamente con il metodo di ripristino protettivo NMDG in questa fascia di età, formazione guarnizione gigaohm può frequentemente stallo fuori, che conduce al morsetto patch falliti tentativi di registrazione. Un'ipotesi è che NMDG cationi più prontamente sono intrappolati nelle fette del cervello giovanile rispetto a fette del cervello adulto e possono impedire la formazione di tenuta; Tuttavia, guarnizioni gigaohm possono formare prontamente mentre fette del cervello giovanile sono completamente sommerse in aCSF NMDG (dati non mostrati), indicando così che NMDG aCSF per sé non ostacola il gigaohm guarnizione formazione.
La rapida transizione dalla soluzione di Na+ di bassa-alta al completamento del passaggio di recupero del cervello iniziale fetta danneggia le membrane neuronali e perturba il processo di formazione di sigillo. Questo è intuitivo, dato che la transizione da basso a alto Na+, caldo-freddo temperatura e drammatica elevazione del Ca2 + a rapporto Mg2 + portare collettivamente ad una massiccia recrudescenza dell'attività sinaptica spontanea. Questa fase di rimbalzo inibitorio nel cervello affettare procedura rischia di riperfusione dopo un insulto ischemico a specchio. Così, attenuando ulteriormente danno della membrana neuronale nella fase di recupero iniziale che una graduale procedura di spike in Na+ è stata incorporata in cui l'elevazione della concentrazione di Na+ nella camera di incubazione di recupero protettivo NMDG sta lentamente e riproducibile elevato con una tempistica precisa. Come nella procedura di recupero protettivo originale, la dissociazione temporale di Na+ altezza da temperatura e Ca2 +/Mg2 + rapporto altezza è benefica. Ma inoltre, la procedura di spike in Na+ conduce a piccoli aumenti incrementali in concentrazione extracellulare di Na+ sopra i primi punti di tempo e grandi aumenti verso i punti di tempo tardo, che permette di avere il tessuto cerebrale un possibilità di ospitare meglio ai crescenti livelli di Na+ . Questa procedura è che un'alternativa a exchange soluzione graduale controllata da una pompa di perfusione o gravità linee di gocciolamento che portano ad un costante incremento nei livelli di Na+ e richiedono attenzione per afflusso e il deflusso per evitare l'overflow della camera fetta. In particolare, in questo Na+ a spillo-in procedura l'osmolarità della soluzione nella camera di fetta aumenta gradualmente in un periodo di diversi minuti prima che le fette vengono restituite al normale osmolalità soluzione, ma questo non ha influenzato negativamente la salute fetta o la toppa morsetto registrazione di successo. Una soluzione di taglio ad alta osmolalità è stata utilizzata in precedenza per le preparazioni di fetta del midbrain per meglio preservare i neuroni della dopamina per il patch clamp registrazioni57,58, dimostrando così che questo temporaneo iperosmolarità può essere utile in alcuni contesti.
Implementando una procedura ottimizzata che unisce il metodo di ripristino protettivo NMDG e graduale Na+ spike-nel passaggio l'utilità di questa metodologia di fetta di cervello è stato esteso per coprire giovanile attraverso secoli di animale adulti maturi. Questo protocollo aggiornato ora è adatto per una vasta gamma di età animale utilizzando una singola formulazione di aCSF NMDG ottimale e la procedura. Se necessario, la procedura di spike in Na+ può essere applicata con un ritardo progressivamente più e/o il corso di tempo più lento per migliorare la redditività delle fette del cervello dai più vecchi animali e abbiamo fornito una guida di base delle pianificazioni di spike consigliati secondo all'animale di età (Vedi tabella 2). Mentre abbiamo fornito un quadro di base adatto per una vasta gamma di applicazioni, ulteriori passaggi avanzati possono essere esplorati per rafforzare ulteriormente e vitalità e longevità delle fette di cervello da animali di invecchiamento e dell'adulti. Ad esempio, strategie di restauro di glutatione sono particolarmente efficaci in questo senso e possono essere implementate come descritto altrove2,6.
Migliorare la velocità effettiva per sfidare gli esperimenti
L'analisi delle connessioni sinaptiche registrando morsetto patch è un'applicazione esigente che richiede ottima conservazione della struttura di un neurone e la funzione al fine di raggiungere un'elevata affidabilità di successo. Come il numero di neuroni simultaneamente da registrare aumenta linearmente, il livello di difficoltà tecnica sale supra-linearmente. Esistono numerose modalità di guasto, e una delle cause più frequenti di errori è l'incapacità di guarnizioni adeguate gigaohm forma su uno o più delle cellule mirate. Questo può rallentare drammaticamente progressi, in particolare quando tre o più neuroni debbono essere effettuati simultaneamente. Coerente con l'individuazione del più veloce gigaohm guarnizione tempo di formazione con il metodo di recupero protettivo NMDG ottimizzato, c'era un netto miglioramento nel tasso di successo e throughput di registrazione morsetto multi-neurone patch esperimenti con sia adulto transgenici fette di cervello del topo e fette di cervello neurochirurgica umano adulto. Il miglioramento nell'efficienza è quasi certamente attribuibile sia alla formazione di sigillo di gigaohm più rapida e affidabile e la conservazione di un neurone migliorata delle fette con questo protocollo. Questo protocollo si concentra sui benefici in modo esplicito per toppa morsetto applicazioni di registrazione, guadagni simili sono previsti per altre applicazioni impegnative sperimentale dove la vitalità di fetta di cervello è fondamentale.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questo lavoro è stato finanziato dall'Istituto Allen for Brain Science. Gli autori desiderano ringraziare i fondatori di Allen Institute, Paul G. Allen e Jody Allen, per la loro visione, incoraggiamento e sostegno. Ringraziamo anche il personale del supporto tecnico di Allen Institute per l'esecuzione di genotipizzazione, allevamento e cura degli animali.
Materiali
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
Riferimenti
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon