Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Immunology and Infection
La visualización de la resazurina prueba de carbón en agar para semi-cuantitativa, Enumeración de mediano rendimiento de Micobacterias
The charcoal agar resazurin assay (CARA) is a semi-quantitative, medium-throughput method to assess activity of test agents against mycobacteria that are replicating, non-replicating, or both. The CARA permits rapid evaluation of time- and concentration-dependent activity and identifies parameters to pursue by colony forming unit (CFU) assays.
Hay una necesidad urgente de descubrir y progresar antiinfecciosos que acortan la duración del tratamiento de la tuberculosis (TB). Mycobacterium tuberculosis, el agente etiológico de la tuberculosis, es refractario a la quimioterapia rápida y duradera debido a la presencia de bacilos que exhiben resistencia fenotípica a fármacos. El c harcoal un gar o r esazurin un ssay (CARA) fue desarrollado como una herramienta para caracterizar moléculas activas descubiertas por las campañas de cribado de alto rendimiento contra la replicación y la no repetición de M. tuberculosis. La inclusión de carbón activado en medio de agar bacteriológico ayuda a mitigar el impacto de compuesto de remanentes, y elimina la necesidad de células antes de la detección en microplacas CARA pre-diluir. Después de un período de incubación de 7-10 días a 37 ° C, la reducción de la resazurina por microcolonias de micobacterias que crecen en la superficie de pocillos de la microplaca CARA permite semi-cuantitativa assessment del número de bacterias a través de fluorometría. La CARA detecta aproximadamente un 2-3 log10 diferencia en el número de bacterias y predice una concentración bactericida mínima que conduce a ≥99% bactericida (MBC ≥99). La CARA ayuda a determinar si una molécula es activa en bacilos que se replican, no replicante, o ambos. Los experimentos piloto utilizando el CARA facilitan la identificación de las cuales la concentración del agente de prueba y el tiempo de exposición al compuesto requiere una evaluación adicional por ensayos de unidades formadoras de colonias (UFC). Además, el CARA puede predecir si activos replicantes son bactericidas o bacteriostáticos.
Mycobacterium tuberculosis, el agente etiológico de la tuberculosis, puede sobrevivir en un host en un estado latente que es refractario a la erradicación de los antibióticos. Fenotípica (no genética) resistencia de M. tuberculosis durante la infección se cree que es debido, en parte, a las poblaciones de bacilos no replicantes 1,2. Persisters de clase I que muestran resistencia a los medicamentos fenotípica surgen a través de mecanismos estocásticos raras entre grandes poblaciones de células sensibles a fármacos 3,4. persisters Clase II se convierten en no replicante por factores de inmunidad del huésped, incluyendo las tensiones externas en microambientes encontrados durante la infección. Recientemente hemos desarrollado un modelo in vitro de Clase II no replicante persistencia para imitar las condiciones enfrentadas por M. tuberculosis en macrófagos activados y granulomas. El modelo multi-estrés de la categoría II incluye la persistencia condiciones que el crecimiento lento, tales como una fuente de carbono de ácidos grasos, y completamente halcrecimiento t, tales como acidez suave (pH 5,0), la hipoxia (1% O 2), y el óxido nítrico y otros productos intermedios de nitrógeno reactivos 5-9. El cribado a gran escala que emplean este modelo multi-estrés de no-replicación, y otros modelos de la no repetición de Clase II, ha producido diversas moléculas cuya actividad está dirigida contra el estado no replicante 5-7,9-18. Las mismas pantallas no replicantes también revelaron una categoría de moléculas que poseen actividad contra tanto replicantes y no replicantes bacilos, denominados "activos" de doble 7,10,12,19,20.
Descubrimiento de fármacos antibacterianos en la fase-hit-de plomo implica una amplia caracterización de moléculas candidatas para elegir clientes potenciales para la expansión exitosa, caracterización preliminar farmacológico, la identificación de objetivos, y los estudios preliminares de eficacia in vivo. Como un primer paso, antiinfecciosos se clasifican según su mecanismo bacteriostático o bactericida de la acción y, si es bactericida, wmuerte bacteriana hether es tiempo y / o dependiente de la concentración. La unidad formadora de colonias (UFC) de ensayo es el método estándar clásica, oro para abordar estas cuestiones. En el ensayo de CFU, las bacterias se exponen a un agente de ensayo, después de lo cual se retiran alícuotas, se diluyeron en serie, y las alícuotas de las diluciones se extienden sobre medio bacteriológico sólido y se incuban para permitir el crecimiento de células supervivientes. Por último, las colonias bacterianas se enumeran. El ensayo CFU requiere un gran número de placas de microtitulación para diluir las células y que contiene agar-petri placas para enumerar las colonias supervivientes. El ensayo CFU para micobacterias de crecimiento lento se ve obstaculizada por su tiempo lento de la generación (18 a 24 hr), que requiere aproximadamente 3 semanas para las colonias que aparezcan en los platos. Por otra parte, el espacio de la incubadora es a menudo limitada en establecimientos especializados bioseguridad de nivel 3-instalaciones.
Si bien engorroso, ensayos de CFU son el estándar de oro para caracterizar el impacto de las moléculas no replicante y de doble activas en mycobacterI a. Los ensayos no replicantes están sujetos a altas tasas de falsos positivos como muchos están acoplados a la replicación de ensayos para evaluar la viabilidad celular 6-8. Por ejemplo, un compuesto que tiene una potente actividad contra la replicación de M. tuberculosis (un "replicante activo") puede fallar para matar durante el ensayo no replicante, y aún así puede matar en virtud de transferencia a partir de la fase de la no repetición de la ensayo para la fase de recuperación del ensayo, que se llevó a cabo en condiciones que apoyan la replicación ( "condiciones replicar"). Compuesto llevar sobre complica aún más el análisis de moléculas activas duales, por lo que es difícil distinguir si la actividad se replica, no replicante, o dual.
Para hacer frente a los problemas descritos anteriormente, hemos desarrollado el c harcoal un gar esazurin un ssay (CARA) para una rápida enumeración, semi-cuantitativa de especies de micobacterias como M. r tal tuberculosis, M. bovis BCG y M. smegmatis 7 (figuras 1 y 2). En soluciones tampón in vitro, carbón activado secuestra rápidamente la mayor parte de los fármacos estándar utilizados para tratar la tuberculosis 7. Carbón activado y se une CARA microplacas de compuestos que pueden llevar más de una microplaca de ensayo, y esta característica de la CARA elimina la necesidad de diluir en serie contenido de los pocillos de ensayo antes del recuento 7,21,22. El número de microcolonias micobacterianas en la superficie de agar de CARA microplacas se estima mediante la adición de resazurina, un colorante azul, cuya forma reducida, resorufina, es una molécula de rosa cuya fluorescencia se mide por espectrofotometría a 23. CARA microplacas se incubaron durante 1-2 días para M. smegmatis y 7-10 días para micobacterias de crecimiento lento, tales como M. tuberculosis y M. bovis BCG. La CARA tiene un rango dinámico más estrecho del ~ 2-3 log10 diferencia en el UFC. Cuando se utiliza en lugar de un ensayo de UFC, una sola microplaca CARA reemplaza aproximadamente cinco placas de 96 pocillos utilizados para diluciones en serie y placas de agar 120 tri-estilo usados para el revestimiento. Interpretación de los datos CARA ayuda a guiar los estudios posteriores, determinando qué incubación tiempos y concentraciones del compuesto a probar en ensayos basados en UFC más laboriosas.
1. Preparación de microplacas CARA
- Autoclave a 900 ml de agar Middlebrook 7H11 que contiene 0,2% de glicerol y 0,4% de carbón activado en un matraz Erlenmeyer de 2, o de forma alternativa, a 450 ml en un vaso de precipitados de vidrio de 1 L. Incluir una gran barra de agitación en autoclave en el matraz o vaso de precipitados. Cubrir la abertura del frasco o recipiente con papel de aluminio y se unen a vidrio con cinta de autoclave.
- Fría al tacto (aproximadamente 55-65 ° C) en una placa de agitación magnética fijado a una velocidad baja para mantener el carbón en suspensión.
- Realizar todos los pasos subsiguientes asépticamente en una campana de bioseguridad que tiene una placa de agitación magnética.
- Retire el papel aluminio. Añadir 100 ml de suplemento de OADC (suplemento OADC, cuando se utiliza a 10%, los rendimientos de concentración de los medios finales de 0,2% de dextrosa, 0,5% de albúmina, 0,085% NaCl, ácido oleico 0,0005%, y 0,4 mg / ml de catalasa) al matraz 2 L Erlenmeyer o 50 ml OADC al 1 L vaso de precipitados, y continuar mezclando.
- Si se utiliza un matraz Erlenmeyer, vierta aproximadamente 25-40 ml de 7H11-OADC-carbón en un depósito de reactivo estéril. Si se utiliza el vaso de precipitados, no es necesario utilizar un depósito de reactivo.
- Llenar una microplaca de 96 pocillos con 200 l / pocillo de 7H11-OADC-carbón desde el depósito de reactivo o vaso de precipitados. Trabajar con rapidez para evitar la solidificación de agar y la introducción de burbujas. Evitar salpicaduras fuera de medio sólido de los pocillos, ya que puede ser una fuente de contaminación por hongos. Con una pipeta multicanal, utilice un conjunto de 12 puntas con filtro para la transferencia de 7H11-OADC carbón a las 8 filas (AH) de la placa de 96 pocillos.
NOTA: El medio se solidifica rápidamente. Para evitar la obstrucción de las puntas de pipeta, cambiar con frecuencia. - Como alternativa, se vierte CARA microplacas usando una pipeta multicanal electrónica p1000 con puntas con filtro para ayudar en la preparación de numerosos platos.
NOTA: Debido al bajo volumen de pocillos de la microplaca, el agar en microplacas CARA solidifica a pocos minutos de vertido. - Coloque pilas de Cara microplacas de plástico con cierre bags para evitar que se sequen.
- Tienda CARA microplacas a 4 ° C.
2. Configuración de Replicación y MIC no replicante 90 Ensayos
- Inocular M. tuberculosis, M. bovis BCG o M. smegmatis a una OD 580 de 0,01 hasta 0,1 y expandir a la fase semilogarítmica (OD 580 ~ 0,5) en Middlebrook 7H9-ADN (Middlebrook 7H9 que contiene 0,2% de glicerol, 0,2% de dextrosa , 0,5% de albúmina, y 0,085% de NaCl) o 7H9-OADC (Middlebrook 7H9 que contiene 0,2% de glicerol y 10% de suplemento OADC).
- Crecer M. tuberculosis y M. bovis BCG como ~ 20 ml de pie cultivos en frascos de cultivo celular y M. smegmatis con agitación en polipropileno de fondo redondo (cultivo de 4 ml) o 50 ml tubos de centrífuga cónico (10-20 ml de cultivo). Incubar micobacterias patógenas a 37 ° C con 20% de O 2 y CO 2 al 5%, y M. smegmatis a 37 ° C con 20% O 2.
- Configurar una mínima inhibidoraconcentración (MIC 90) experimento al estilo de bajo replicantes y no replicantes condiciones (Figura 2).
NOTA: Los agentes de ensayo se ensayan por lo general en los duplicados o quadruplicates para permitir la prueba 4, o 2 compuestos, respectivamente, por cada microplaca de 96 pocillos. Por ejemplo, en una placa de 96 pocillos, una agente de ensayo puede ensayarse en filas AD y otro en filas EH. El DMSO (vehículo) es en las columnas 1, 2 y 12, y la serie de dilución del agente de prueba se extiende desde la columna 3 (concentración más baja) a la columna 11 (concentración más alta). MIC 90 ensayos al estilo emplean típicamente serie de diluciones de 2 veces. Existen numerosos modelos que no se replican disponibles para micobacterias 14-16,18,24,25 y con fines ilustrativos, estamos utilizando un modelo multi-estrés de no-replicación 6,8,9.- Para el ensayo de replicación, distribuir 200 células mu l en 7H9-ADN a una OD 580 de 0,01 en todos los pocillos de una placa de 96 pocillos de fondo transparente, de cultivo de tejidos tratados. <li> Para el ensayo de no replicante, lavar las células dos veces en solución salina tamponada con fosfato (PBS) que contiene 0,02% de tiloxapol, y Resuspender las células en medio no replicante (0,05% KH 2 PO 4, 0,05% MgSO 4, 0,005% de citrato de amonio férrico , 0,0001% ZnCl 2, 0,1% NH 4 Cl, 0,5% de BSA, 0,085% de NaCl, 0,02% de tiloxapol, 0,05% de butirato; pH ajustado a 5,0 con NaOH 2 N).
- Diluir las células hasta una DO 580 de 0,1 en un medio no replicante y añadir NaNO2 de recién preparado un stock 1 M a una concentración final de 0,5 mM.
- Distribuir 200 células mu l a una DO 580 de 0,1 en todos los pocillos de una placa de 96 pocillos de fondo transparente, de cultivo de tejidos tratados.
NOTA: Preparar diluciones de los compuestos como soluciones de reserva de 100 veces en DMSO. Por lo tanto, una placa de MIC típico probar el impacto de una molécula a una concentración final 0,4 a 100 mg / ml requeriría soluciones madre de 0,04 a 10 mg / ml en DMSO.
- Añadir 2 l de diluciones de agente de prueba 1 en filas AE y 2 l de diluciones de agente de ensayo 2 en filas EH. Mezclar bien.
- Añadir 2 l de control del vehículo (normalmente DMSO) en los pocillos de control, las columnas 1, 2, 12 (filas AH). Mezclar bien.
- Para cada experimento, incluir al menos un control positivo como la rifampicina de 0,004 a 1 g / ml (ensayo de replicación) y / o 0,08 a 20 mg / ml (ensayo no replicante).
NOTA: El uso de 6-bromo-1H-indazol-3-amina 9 en 0,1 a 25 mg / ml se recomienda como un compuesto que tiene el control selectiva, NaNO2 actividad dependiente en el modelo multi-estrés de no-replicación. - Para la replicación de los ensayos, se incuban las microplacas a 37 ° C a 20% de O2 y 5% de CO2 durante 7 días (M. tuberculosis y M. bovis BCG) o 1-48 hr (M. smegmatis). Para el modelo multi-estrés de no-replicación, se incuban las microplacas durante 7 días a 37 ° C a 1% de O2 y 5% de CO 2 (<em> M. tuberculosis y M. bovis BCG).
3. Inoculación de Cara microplacas
- En los puntos de tiempo en el que se utilizará la CARA como de salida leer, resuspender cuidadosamente bien contenidos de la placa de ensayo al estilo de MIC 90 utilizando una pipeta multicanal p200 fijado en 50 a 75 l. Suavemente con la pipeta al menos 5-10 veces y agitar suavemente los contenidos así en un movimiento circular utilizando las puntas de pipeta.
- Transferencia de 10 l de contenido de los pocillos de ensayo a la microplaca CARA. Asegúrese de que el orden de los contenidos del pocillo en la placa de ensayo coincide con el orden de los contenidos del pocillo de la microplaca CARA. Evitar salpicaduras durante las transferencias y asegurarse de que los 10 l se manchan en el medio de los pocillos de la microplaca CARA. Confirmar los 10 l absorbe en la microplaca CARA.
NOTA: No hay diluciones requeridas antes de la detección de células de la CARA microplacas. - pilas de vinculación de CARA microplacas con cinta y la placaluego se coloca en una bolsa de plástico con cierre. Incubar CARA microplacas a 37 ° C con 20% de O 2 (M. smegmatis) o 1% de O2 y 5% de CO 2 (M. tuberculosis y M. bovis BCG).
- Para M. tuberculosis y M. bovis BCG, replicando ensayos: incubar durante 7 días; para M. tuberculosis y M. bovis BCG no repetición de los ensayos, se incuba durante 10 días; de M. smegmatis, replicando los ensayos, se incuban durante 1-2 días; de M. smegmatis, ensayos no replicante, se incuban 2-3 días.
NOTA: Los tiempos son estimados y pueden ser modificadas en consecuencia para diferentes replicante, no replicante, y las condiciones de estrés.
4. El desarrollo de microplacas CARA
- Desarrollar la CARA microplacas cuando una película del crecimiento bacteriano, o más grandes, colonias macroscópicas, son visibles en los pocillos de control negativo (vehículo).
NOTA: Después de la incubación prolongado, cara pocillos de la microplaca a menudoun aspecto seco y recomendamos pre-humectantes contenidos bien con PBS estéril. Esto sirve para evitar que el carbón de leña de la absorción de la resazurina, lo que puede conducir a una baja fluorescencia o la variación del pozo a pozo. - El uso de un único conjunto de 12 consejos p200 con una pipeta multicanal, dispense 40 l de PBS estéril a lo largo del lado de los pozos y permitir que el PBS para distribuir a través de la parte superior de las microcolonias de agar / bacterianas.
- Prepare CARA desarrollo de reactivo mezclando 5 mg de resazurina (0,01% final) y 50 ml de 5% Tween80 en PBS. Vortex y el filtro estéril.
NOTA: Un CARA reactivo de revelado alternativa se puede preparar mediante la mezcla preparada comercialmente resazurina solución líquida a 1: 1 (vol / vol) con 10% Tween80 en PBS. - Añadir 50 l de recién preparada reactivo de revelado CARA a cada pocillo de la microplaca CARA usando una pipeta de 12 canales. placas de roca de ida y vuelta un par de veces para ayudar a distribuir el reactivo a través de la estera de agar y bacteriana en cada pocillo.
- Colocar las placas ina bolsa de plástico y se incuba a 37 ° C durante al menos 30 minutos para M. smegmatis y 45-60 min para M. tuberculosis o M. bovis BCG.
NOTA: Si los pocillos de control de vehículo no pueden volverse de color rosado dentro de la primera hora, las placas pueden ser re-embolsados y se incubaron durante períodos de tiempo más largos. - Antes de la lectura de la fluorescencia, colocar CARA microplacas en una campana de bioseguridad durante 15 minutos a temperatura ambiente con sus tapas quitadas. Al utilizar espectrofotómetros BSL3 fuera de una cabina de bioseguridad, se adhieren una pegatina de PCR calidad óptica sobre la placa y sellar herméticamente presionando suavemente sobre la superficie de la etiqueta engomada con una toalla de papel suave.
- Determinar la fluorescencia a través de la parte superior leído con excitación a 530 nm y emisión a 590 nm. No es necesario en blanco de la placa.
Análisis 5. Datos
- Concentración de inhibidor Parcela en el eje X en una escala log 10 y la fluorescencia en el eje Y en una escala lineal. Utilice una dispersiónparcela empleando una curva de ajuste como "log inhibidor frente inclinación de respuesta variable (4 parámetros)". Terreno puntos de datos como media ± error estándar.
Resultados CARA previstos se describen en la Figura 2 y se resumen en la Tabla 1. Para la replicación de las células, la CARA se ejecuta en paralelo con un estándar de MIC 90 ensayos, y para ensayos no replicantes, la CARA se ejecuta en paralelo con un ensayo de MIC 90 adaptada que se acopla a una fase de extensión. La concentración del agente de prueba que provoca una insuficiencia de Cara-fluorescencia para elevarse por encima de los niveles de fondo es la CARA-MBC ≥99 (Figura 3a). El "≥99" subíndice indica que la CARA-MBC ofrece una concentración estimada de agente de ensayo que da lugar a ≥2 log10 muerte bacteriana (≥99% de muertes).
El ensayo de líquido caldo de MIC 90 es incapaz de discriminar entre bactericida y actividad bacteriostática y esta distinción tiene que ser resuelto mediante un ensayo de UFC. Porconvención, el umbral que distingue bactericida de la actividad bacteriostática para micobacterias de crecimiento lento es de aproximadamente 2-3 log10 matanza de más de 7 días 7,26. Puesto que el rango dinámico de la CARA es también 2-3 log 10 kill, la CARA puede proporcionar una estimación de actividad bactericida o bacteriostática. La CARA identifica fácilmente algunos principios activos que se replican como bacteriostático debido a un fallo de estos compuestos para disminuir CARA de fluorescencia a los niveles de fondo (Figura 2). Sin embargo, algunos compuestos con actividad bacteriostática contra la replicación de M. tuberculosis tienen un efecto post-antibiótico potente, lo que significa que siguen para inhibir el nuevo crecimiento de bacterias durante la fase de recuperación, incluso en ausencia de compuesto de arrastre. Este efecto puede ser difícil de reconocer en el ensayo CARA. Los compuestos son sospechosos de ejercer un efecto post-antibiótico si muestran una "ventana estática", que se define como un desplazamiento> 4 veces a la derecha entrn las curvas de MIC y Cara (Figura 3b). La ventana estática indica que una molécula activa contra la replicación de M. tuberculosis puede ser bacteriostática en vez de bactericida. En algunos casos, las ventanas estáticas son evidentes sólo después de la inspección de un eje Y ampliado para CARA fluorescencia (Figura 3c y 3d).
Cara y MIC 90 datos por lo general se trazan juntos (Figura 4). Los datos representativos para moléculas replicating- y no replicantes-activos ensayados por MIC 90 y CARA se muestran en la Figura 4. Hay 4 clases principales de actividad de las moléculas: 1) la replicación de bactericida (demostrado con la isoniazida, la figura 4a); 2) la replicación de bacteriostático (demostrado con linezolid, la figura 4b); 3) la no repetición de bactericida (demostrado con oxifenbutazona, Figura 4c); y, 4) representantebactericida licating-activa (bacteriostáticos o bactericidas) y no replicante (demostrado con el PA-824, Figura 4d). Es importante destacar que las figuras 4a y 4b demostrar que mientras que la isoniazida y linezolid parecen tener actividad contra bacterias que no se replican mediante el ensayo de MIC 90, el CARA sugiere que son inactivos en las condiciones no replicantes probadas. Para probar la utilidad de la CARA en la predicción de impacto tiempo y dependiente de la concentración de una molécula, la replicación de M. smegmatis se expuso a concentraciones crecientes de rifampicina (Figuras 5a - d), y en varios momentos entre 1 a 24 horas, fueron vistos alícuotas en placas de CARA. Estos datos indicaron que la rifampicina ejerce un impacto tan temprano como 1 hr (Figura 5a), representada aumento de la actividad bactericida entre 3 y 24 h (Figuras 5b-d), y mataron ≥2-3 registro 10 a ~ 10 mg / ml por 24 horas (Figura 5d). Un experimento similar probando quadruplicates de un vehículo de control y 9 las concentraciones de fármaco, y en 4 puntos de tiempo, sería prohibitivo por un ensayo basado en CFU estándar.
Por lo tanto, la CARA tiene un papel en el descubrimiento de fármacos como un medio de rendimiento, mecanismo rápido para identificar el perfil de actividad de una molécula. CARA predicciones se deben evaluar rigurosamente el uso de un ensayo de CFU estándar. La adición de 0,4% de carbón activado a las placas de Petri para el análisis de CFU puede ayudar a mejorar la correlación con datos de cara, y puede resultar en los recuentos de CFU más precisos, la magnitud de la corrección en general, siendo proporcional a la potencia del compuesto 21,22.
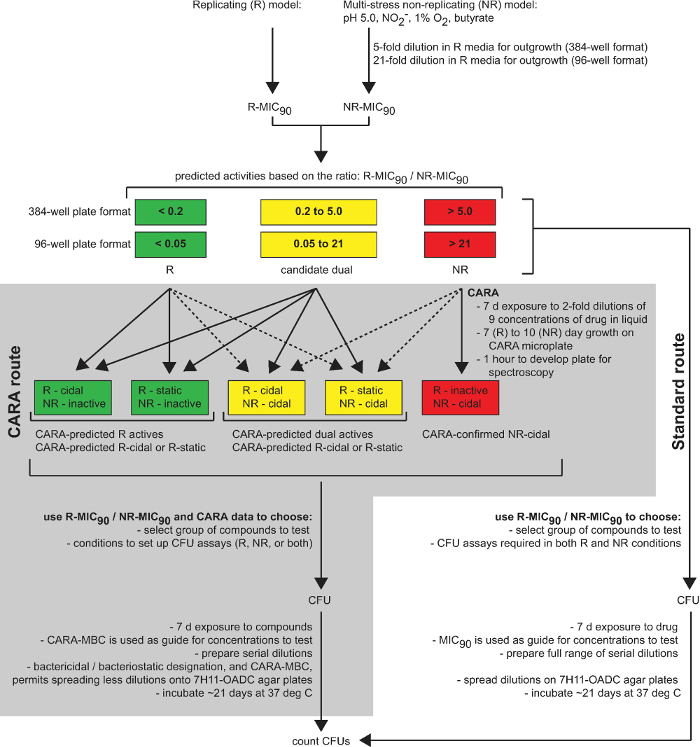
Figura 1: La CARA es una herramienta predictiva en el descubrimiento de fármacos. Este diagrama resume la utilidad de la CARA como unaetapa intermedia entre la detección de drogas (detección de un solo punto, picotear, y los ensayos de dosis-respuesta) y ensayos-hit-to-plomo que consumen mucho tiempo (ensayos de CFU y la identificación de objetivos). [Adaptado con permiso de Gold et al., Agentes Antimicrobianos y Quimioterapia, 2015 7] Por favor, haga clic aquí para ver una versión más grande de esta figura.
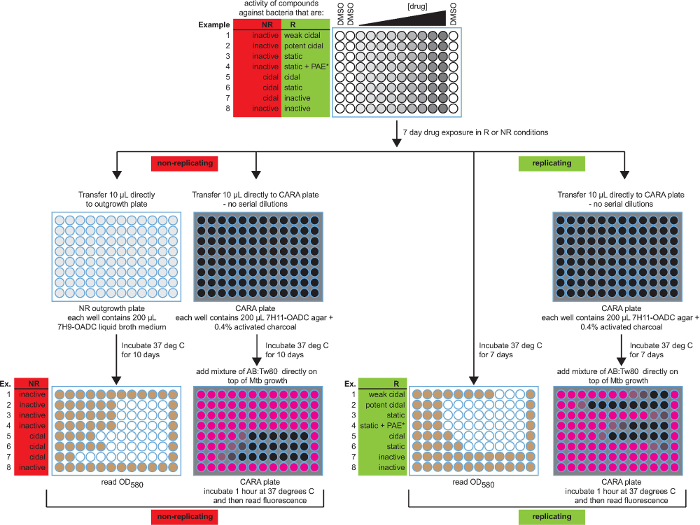
Figura 2: Representación esquemática del ensayo de caldo de MIC 90 y CARA con resultados esperados. Ambos MIC 90 y Cara resultados se presentan durante 8 actividades posibles. El código de colores para MIC 90 pocillos de la microplaca es de color blanco (sin crecimiento) y marrón (crecimiento), y para microplacas CARA es negro (sin fluorescencia) y rosa (fluorescencia resorufina). Los datos son hipotéticos. [Adaptado con permiso de Gold et al., Agentes Antimicrobianos y Quimioterapia, 2015 7] Haga clic aquí para ver una versión más grande de esta figura.
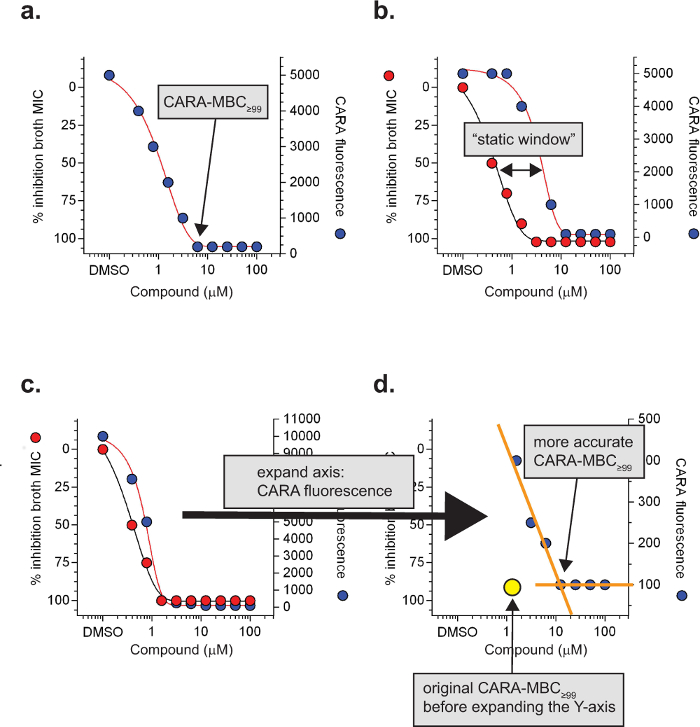
Figura 3: Especializado términos y definiciones de CARA. La concentración bactericida mínima de una molécula que resulta en niveles de fondo de fluorescencia es la CARA CARA-MBC ≥99 (a). En condiciones de replicación, un cambio ≥4 veces de la cara-MBC ≥99 a la derecha de la CIM 90 a menudo indica la actividad bacteriostática y se llama una "ventana estática" (b). Para moléculas con un efecto post-antibiótico potente, ventanas estáticas pueden ser difíciles de observar (c) y requierenexpansión del eje Y (CARA fluorescencia) para visualizar (d). Los datos son hipotéticos. [Adaptado con permiso de Gold et al., Agentes Antimicrobianos y Quimioterapia, 2015 7] Por favor, haga clic aquí para ver una versión más grande de esta figura.
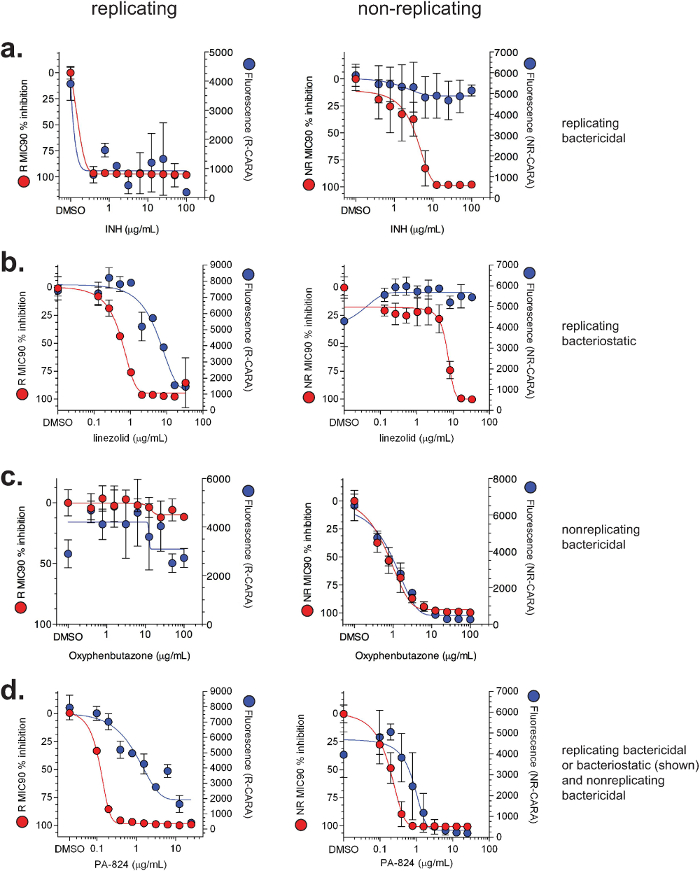
Figura 4: MIC ilustrativa 90 y Cara resultados para los compuestos seleccionados. Los datos de MIC 90 (rojo) y Cara (azul) se demuestran para (a) la isoniazida (INH), (b) linezolid, (c) oxifenbutazona, y (d) PA-824. De tipo silvestre M. tuberculosis H37Rv se expuso a los compuestos durante 7 días en condiciones normales de replicación o el modelo multi-estrés de no-replicación 7-9. Se llevaron a cabo ensayos de MIC 90 y Cara como se muestra en la Figura 2. [Adaptado con permiso de Gold et al., Agentes Antimicrobianos y Quimioterapia, 20157]Por favor, haga clic aquí para ver una versión más grande de esta figura.
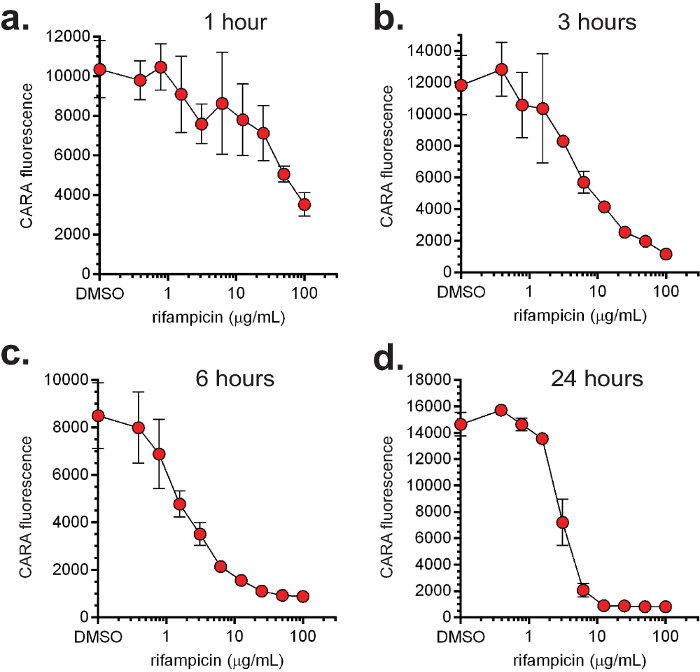
Figura 5: la dosis y de la actividad dependiente del tiempo de la rifampicina. El no patógena, de crecimiento rápido M. smegmatis se expuso a concentraciones crecientes de rifampicina en las condiciones que se replican y se muestrearon alícuotas de CARA en 1 (a), 3 (b), 6 (c) y 24 (d) hr. [Adaptado con permiso de Gold et al., Agentes Antimicrobianos y Quimioterapia, 2015 7].com / archivos / ftp_upload / 54690 / 54690fig5large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
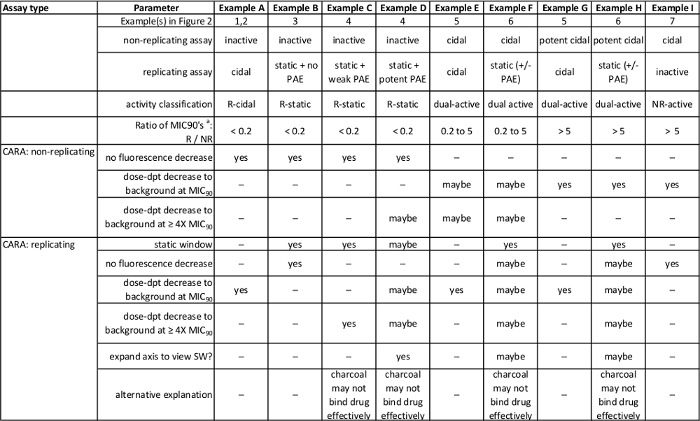
Tabla 1: Resumen de los resultados previstos en la Figura 2. [Adaptado con permiso de Gold et al., Agentes Antimicrobianos y Quimioterapia, 2015 7] Por favor, haga clic aquí para ver una versión más grande de esta tabla.
La CARA fue desarrollado originalmente para aliviar un cuello de botella en el progreso no replicante o moléculas de doble activos 7. La CARA sirve como un paso intermedio entre la confirmación de concentración-respuesta de los accesos de detección primaria y ensayos de CFU (Figura 1). Desde una sola placa CARA puede sustituir numerosas placas de microtitulación necesarias para preparar diluciones seriadas, y placas de Petri que contienen agar-empleados para contar las bacterias que sobreviven, la CARA proporciona un medio sencillo para evaluar rápidamente la actividad de una molécula y probar múltiples variables a la vez, incluyendo la concentración del compuesto y tiempo de exposición al compuesto.
En un ensayo de CFU, además de diluciones en serie que a menudo van hasta 10 6 -fold, la placa de agar típicamente diluye moléculas por un ~ 800 veces adicional (10 l Onto 8 ml en una placa de Petri de estilo tri). Nuestra de dos etapas, ensayo de exploración multi-estrés para compuestos activos en la no repetición de M. tuberculosis tiene un factor de arrastre de 5 veces, es decir, un compuesto presente en la fase no replicante del ensayo está presente a un quinto de la concentración original en la consecuencia de fase (replicación) del ensayo 6-9. Los mitiga CARA efectos de arrastre por el secuestro de moléculas pequeñas con carbón activado. La mayoría de los fármacos antituberculosos y candidatos clínicos liga el carbón activado rápida y completamente, con la excepción de la aminoglucósido estreptomicina 7. La inclusión de carbón activado y placas de agar para ensayos de CFU impidió la inhibición del crecimiento bacteriano o muerte bacteriana, por arrastrada del TMC207 y PA-824 7,21,22. Por lo tanto, en virtud de la incorporación de carbón activado en el agar bacteriológico, la CARA no depende de diluciones en serie de células y agente de ensayo.
La CARA puede ayudar a predecir el impacto bacteriostáticos o bactericidas de replicación activos y los efectos bactericidas de activos que no se replican. En general, la CARA se utiliza en paralelo con el MIC estándar de 90 ensayos. El poder predictivo de la CARA proviene de la comparación de los resultados MIC 90 y Cara (Figura 2 y Tabla 1). Cuando se usa para estudiar agentes anti-micobacterianas, la CARA puede predecir con precisión la actividad que se está replicando bactericida (Figura 4a), replicando, bactericida no replicante (Figura 4c) bacteriostático (Figura 4b), o doble activa (Figura 4d). La CARA también permite la evaluación sencilla de la actividad de un compuesto a través tanto de la dosis y el tiempo. Ensayos de CFU solo requieren una gran cantidad de esfuerzo y el material para evaluar la actividad de un compuesto en un amplio intervalo de dosis y tiempos, pero la tarea se hace manejable cuando los resultados de CARA reducir la gama de condiciones a aquellas en las que el compuesto es demostrable activa (Figura 5 ).
Mientras que la CARA tiene utilidad en el estudio de la acción de unanti-infecciosos en micobacterias, el ensayo tiene limitaciones. La CARA tiene un rango dinámico estrecho (2-3 log 10) y puede no ser apropiado para las condiciones en las que uno anticipa puede que no haya más de 2 a 3 log 10 muerte bacteriana. predicciones CARA requieren más estudios utilizando un método más riguroso y preciso para enumerar el número de bacterias, tales como un ensayo de CFU. El efecto post-antibiótico de algunos antiinfecciosos, tales como PAS, puede confundir la CARA como herramienta predictiva para distinguir entre compuestos con actividad bactericida y bacteriostática contra la replicación de M. tuberculosis 7.
Hay dos recomendaciones para mejorar la calidad de la CARA. En primer lugar, hay que verter CARA microplacas con rapidez antes de que se solidifique el agar, manteniendo la precisión volumétrica y evitar salpicaduras fuera de los pocillos. Independientemente del número de placas necesarias, se recomienda hacer 0,5 a 1 L de medio de lotes para ayudar a mantener la medio en forma líquida para la duración del tiempo requerido para verter en las placas. Cambiar las puntas con frecuencia mientras se llena con medio de microplacas evita el uso de puntas parcialmente obstruidos. En segundo lugar, hay que minimizar la variabilidad de artefactos en la fluorescencia entre repeticiones. Microcolonias micobacterianas, en particular para micobacterias patógenas tales como M. tuberculosis, a menudo crecen de forma errática. Por ejemplo, microcolonias que crecen en la superficie del agar pueden variar en tamaño, forma, altura, o pueden extenderse hasta las paredes interiores de pocillos de la microplaca. Uno de los retos es cubrir todas bacilos uniformemente con el reactivo de revelado. Otro obstáculo es que después de una incubación prolongada a 37 ° C, el medio bacteriológico sólida de la CARA microplacas puede volverse seca y propensa a absorber el reactivo de revelado. Dado que el carbón activado se puede unir resazurina y apagar la fluorescencia 7, puede haber una variación del pozo a pozo debido a la absorción de pozos secos resazurina solución de revelado y la Charcoa activadol temple resazurina fluorescencia. Pre-humedecer la superficie de todos los pocillos de la microplaca CARA con PBS inmediatamente antes de añadir el reactivo de revelado mitiga tanto de estos problemas - el reactivo de revelado alcanzará todas las colonias de micobacterias por igual, y la resazurina se mantiene de manera segura por encima de la de carbón activado. La CARA puede tener aplicaciones en la identificación y caracterización de fenotipos de los mutantes de micobacterias, o en medio de rendimiento ensayos de descubrimiento de fármacos para otras especies bacterianas.
No hay conflictos de interés que revelar.
Estamos muy agradecidos a Kristin Burns-Huang por expertos del manuscrito y David J. Warren (Weill Cornell Medical College) para obtener ayuda química, mientras que el desarrollo de la CARA. Este trabajo fue apoyado por el Programa Acelerador de Medicamentos contra la Tuberculosis de la Fundación Bill y Melinda Gates, el Programa de Abby y Milstein P. Howard en medicina de translación, y una Unidad de Investigación de la tuberculosis NIH (U19 AI111143). El Departamento de Microbiología e Inmunología es apoyado por la Fundación William Randolph Hearst. SSK fue apoyado por el NIH subvención K08AI108799.
| Name | Company | Catalog Number | Comments |
| Middlebrook 7H9 | Beckton Dickinson | 271310 | |
| Middlebrook 7H11 | Beckton Dickinson | 298810 | |
| Middlebrook OADC | Beckton Dickinson | 212351 | |
| BSA, heat shock | Roche | 3118958001 | |
| activated charcoal | Sigma | C5510 | |
| PBS, Dulbecco's Ca2+ and Mg2+ free | Life Technologies / Invitrogen | 14190-144 | |
| tween 80 | Sigma | P8074 | |
| tyloxapol | Sigma | T8761 | |
| sodium nitrite | Sigma | 2252 | |
| rifampicin | Sigma | R3501 | |
| 6-bromo-1H-indazol-3-amine | Alfa Aesar | H34095 | |
| potassium phosphate monobasic | Sigma | P0662 | |
| magnesium sulfate, heptahydrate | Sigma | M1880 | |
| ferric ammonium citrate | Sigma | F5879 | |
| zinc sulfate, heptahydrate | Sigma | Z0251 | |
| ammonium chloride | Sigma | A9434 | |
| butyric acid, liquid | Sigma | B103500 | |
| resazurin powder | Sigma | R7017 | |
| sodium chloride | J.T. Baker | 4058-01 | |
| prepared resazurin solution | Invitrogen | DAL1100 | |
| PCR stickers | Denville | B1212-5 | |
| spectrophotometer | Molecular Devices | M5 | |
| 96-well, tissue culture treated microplates | Corning | 3595 | |
| reagent reservoirs | VWR | 89094-678 | |
| resealable plastic bags | VWR | 395-94602 | |
| 14 mL Polypropylene round-bottom tubes | Corning | 352059 | |
| 50 mL conical centrifuge tube | Corning | 352070 | |
| 75 cm2 Cell culture flask | Corning | 431464U | |
| clear, flat bottom tissue culture treated 96-well microplate | Costar | 3595 | |
| Prism 6 for OS X | GraphPad | http://www.graphpad.com/scientific-software/prism/ |
- Nathan, C. Fresh approaches to anti-infective therapies. Sci. Transl. Medicine. 4 (140), 140-142 (2012).
- Gomez, J. E., McKinney, J. D. M. tuberculosis persistence, latency, and drug tolerance. Tuberculosis (Edinb). 84, 29-44 (2004).
- Balaban, N. Q., Merrin, J., Chait, R., Kowalik, L., Leibler, S. Bacterial persistence as a phenotypic switch. Science. 305, 1622-1625 (2004).
- Bigger, J. Treatment of staphylococcal infections with penicillin by intermittent sterilisation. Lancet. , 497-500 (1944).
- Bryk, R., et al. Selective killing of nonreplicating mycobacteria. Cell Host Microbe. 3, 137-145 (2008).
- Gold, B., et al. Nonsteroidal anti-inflammatory drug sensitizes Mycobacterium tuberculosis to endogenous and exogenous antimicrobials. Proc. Natl. Acad. Sci. U.S.A. 109, 16004-16011 (2012).
- Gold, B., et al. Rapid, semi-quantitative assay to discriminate among compounds with activity against replicating or non-replicating Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 59, 6521-6538 (2015).
- Gold, B., Warrier, T., Nathan, C., Parish, T., Roberts, D. . Mycobacteria Protocols, Methods in Molecular Biology. 1285, 293-315 (2015).
- Warrier, T., et al. Identification of Novel Anti-mycobacterial Compounds by Screening a Pharmaceutical Small-Molecule Library against Nonreplicating Mycobacterium tuberculosis. ACS Infect. Dis. , 580-585 (2015).
- Zheng, P., Chem, J. .. M. e. d. .., et al. Synthetic Calanolides with Bactericidal Activity Against Replicating and Nonreplicating Mycobacterium tuberculosis. J. Med. Chem. , (2014).
- Darby, C. M., et al. Whole cell screen for inhibitors of pH homeostasis in Mycobacterium tuberculosis. PLoS One. 8, e68942 (2013).
- Darby, C. M., Nathan, C. F. Killing of non-replicating Mycobacterium tuberculosis by 8-hydroxyquinoline. J. Antimicrob. Chemother. 65, 1424-1427 (2010).
- de Carvalho, L. P., Darby, C. M., Rhee, K., Nathan, C. Nitazoxanide Disrupts Membrane Potential and Intrabacterial pH Homeostasis of Mycobacterium tuberculosis. ACS Med. Chem. Lett. 2, 849-854 (2011).
- Xie, Z., Siddiqi, N., Rubin, E. J. Differential antibiotic susceptibilities of starved Mycobacterium tuberculosis isolates. Antimicrob. Agents Chemother. 49, 4778-4780 (2005).
- Grant, S. S., et al. Identification of novel inhibitors of nonreplicating Mycobacterium tuberculosis using a carbon starvation model. ACS Chem. Biol. 8, 2224-2234 (2013).
- Zhang, M., et al. Streptomycin-starved Mycobacterium tuberculosis 18b, a drug discovery tool for latent tuberculosis. Antimicrob. Agents Chemother. 56, 5782-5789 (2012).
- Mak, P. A., et al. A high-throughput screen to identify inhibitors of ATP homeostasis in non-replicating Mycobacterium tuberculosis. ACS Chem. Biol. 7, 1190-1197 (2012).
- Cho, S. H., et al. Low-oxygen-recovery assay for high-throughput screening of compounds against nonreplicating Mycobacterium tuberculosis. Antimicrob. Agents Chemother. 51, 1380-1385 (2007).
- Franzblau, S. G., et al. Comprehensive analysis of methods used for the evaluation of compounds against Mycobacterium tuberculosis. Tuberculosis (Edinb). 92, 453-488 (2012).
- Rebollo-Lopez, M. J., et al. Release of 50 new, drug-like compounds and their computational target predictions for open source anti-tubercular drug discovery. PLoS One. 10, e0142293 (2015).
- Tasneen, R., et al. Contribution of the nitroimidazoles PA-824 and TBA-354 to the activity of novel regimens in murine models of tuberculosis. Antimicrob. Agents Chemother. 59, 129-135 (2015).
- Grosset, J. H., et al. Assessment of clofazimine activity in a second-line regimen for tuberculosis in mice. Am. J. Respir. Crit. Care Med. 188, 608-612 (2013).
- Shiloh, M. U., Ruan, J., Nathan, C. Evaluation of bacterial survival and phagocyte function with a fluorescence-based microplate assay. Infect. Immun. 65, 3193-3198 (1997).
- Wang, F., et al. Identification of a small molecule with activity against drug-resistant and persistent tuberculosis. Proc. Natl. Acad. Sci. U.S.A. 110, E2510-E2517 (2013).
- Wayne, L. G., Hayes, L. G. An in vitro model for sequential study of shiftdown of Mycobacterium tuberculosis through two stages of nonreplicating persistence. Infect. Immun. 64, 2062-2069 (1996).
- Barry, A. L., et al. . Methods for determining bactericidal activity of antimicrobial agents: approved guideline. 19, (1999).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved