Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Immunology and Infection
Swab Méthode d'échantillonnage pour la détection des norovirus humains sur les surfaces
A macrofoam based sampling methodology was developed and evaluated for the detection and quantification of norovirus on environmental hard surfaces.
Les norovirus humains sont une cause majeure de l'épidémie et la gastro-entérite sporadique dans le monde entier. Parce que la plupart des infections sont soit répartis directement par la voie de personne à personne ou indirectement par l'intermédiaire de surfaces ou de la nourriture de l'environnement, matières contaminées et les surfaces inanimées sont des véhicules importants pour la propagation du virus au cours des flambées de norovirus.
Nous avons développé et évalué un protocole utilisant des tampons de macromousse pour la détection et le typage des norovirus humains des surfaces dures. Comparé avec des tampons de fibres à pointe ou des lingettes antistatiques, des tampons de macromousse permettent la récupération du virus (plage de 1,2 à 33,6%) des surfaces de siège de toilette jusqu'à 700 cm 2. Le protocole comporte les étapes d'extraction du virus à partir des tampons et une plus grande concentration de l'ARN viral en utilisant des colonnes de centrifugation. Au total, 127 (58,5%) des 217 échantillons de frottis qui avaient été recueillies à partir de surfaces à bord des navires de croisière et les établissements de soins de longue durée où norovirus gastro-entérite avait étérapporté testé positif pour GII norovirus par RT-qPCR. 29 d'entre eux (22,8%) pourrait être génotypés avec succès. En conclusion, la détection des norovirus sur des surfaces environnementales en utilisant le protocole que nous avons développé peut aider à déterminer le niveau de contamination de l'environnement pendant les épidémies, ainsi que la détection du virus lorsque les échantillons cliniques ne sont pas disponibles; il peut également faciliter le suivi de l'efficacité des stratégies d'assainissement.
Les norovirus humains sont une cause majeure de l' épidémie et de gastro - entérite aiguë sporadique dans le monde entier 1, 2, 3. Le virus est extrêmement contagieux et la transmission se fait par personne directement à l'interaction personne ou indirectement par le contact avec des aliments contaminés, l'eau ou des surfaces environnementales. Les norovirus peuvent être versées pour des périodes prolongées et prolongé la survie du virus sur des surfaces environnementales a été documentée 1, 2,....
1. Swab échantillonnage dans le domaine
- Porter une paire de gants propres.
- Mesurer la taille de la zone d'échantillonnage sans toucher la surface en utilisant un ruban à mesurer ou d'une règle. Essayez d'estimer la superficie aussi précisément que possible et de remplir un formulaire de rapport (tableau supplémentaire 1).
- Vérifiez le kit de prélèvement pour les fuites éventuelles et le transport des sacs de prélèvement de l'ét.......
La figure 1 présente un organigramme du protocole tampon d'échantillonnage. Ce protocole se compose de quatre étapes principales; 1) la collecte d'échantillon, 2) le stockage et le transport d'échantillons, 3) la purification de l'ARN viral et de la concentration, et 4) l'essai de RT-PCR quantitative et génotypage.
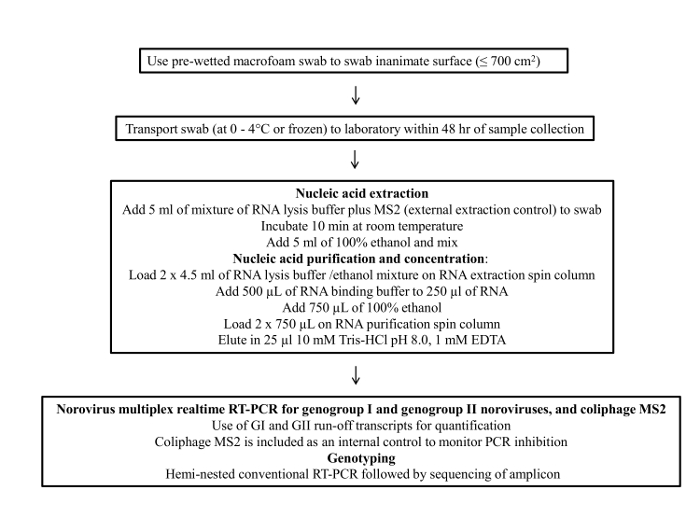
Les norovirus ont une dose infectieuse humaine de 50% entre 18 et 10 3 particules virales 20. Par conséquent, la contamination même de bas niveau des surfaces peut poser un risque pour la santé publique. Plusieurs aspects du protocole écouvillon d'échantillonnage ont été évalués, y compris: 1) différents matériaux écouvillon, 2) écouvillons de condition de stockage pendant le transport, 3) la concentration de l'ARN viral, et 4) coliphage MS2 que le contrôle de l&#.......
| Name | Company | Catalog Number | Comments | |
| Generic name for kits | ||||
| Macrofoam swab | Premoistened EnviroMax Swab kit | Puritan | 2588060PFUW | |
| RNA Lysis buffer | CDC UNEX buffer | Microbiologics | Cat No MR0501 | |
| RNA extraction spin column | Midi column | Omega Biotek | Cat No R6664-02 | |
| RNA purification spin column | Zymol RNA Clean and Concentrator kit | Zymo Research | Cat No R1016 | |
| Real time RT-PCR kit | AgPath kit One-Step RT-PCR Kit | Life Technologies | Cat No 4387391 | |
| Conventional RT-PCR kit | Qiagen one step RT-PCR kit | Qiagen kit | Cat No 210212 | |
| Gel extraction kit | Qiagen QIAquick gel extraction kit | Qiagen kit | Cat No 28704 or 28706 | |
| Coliphage MS2 | ATCC | Cat No 15597-B1 | ||
| RNA run-off transcripts | Bacteriophage MS2 (ATCC No. 15597-B1) can be cultivated using Escherichia coli (E.coli) Famp (ATCC No. 700891). | |||
| Realtime PCR platform | Applied Biosystems | Model ABI 7500 | GI and GII RNA run off transcripts were quantified spectrophotometrically at A260, diluted in diethyl pyrocarbonate-treated water to 1 × 106 copies/ μl, and stored at −80°C with 1.0 U /μl RNasin (Promega, Madison, WI). | |
| Optical 96-well reaction plate | Thermo Scientific | Cat No 4316813 | ||
| MicroAmp Clear Adhesive Film | Thermo Scientific | Cat No 4306311 |
- Isakbaeva, E. T., et al. Norovirus transmission on cruise ship. Emerg. Infect. Dis. 11, 154-158 (2005).
- Lopman, B. A., Gastañaduy, P., Park, G. W., Hall, A. J., Parashar, U. D., Vinjé, P. Environmental transmission of norovirus gastroenteritis. Curr. Opin. Virol. 2 (1), 1-7 (2011).
- Malek, M., et al. Outbreak of norovirus infection among river rafters associated with packaged delicatessen meat, Grand Canyon, 2005. Clin Infect Dis. 48 (1), 31-37 (2009).
- Atmar, R. L., et al. Norwalk virus shedding after experimental human infection. Emerg. Infect. Dis. 14 (10), 1553-1557 (2008).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N. Engl. J. Med. 361 (18), 1776-1785 (2009).
- Park, G. W., et al. Evaluation of a New Environmental Sampling Protocol for Detection of Human Norovirus on Inanimate Surfaces. Appl. Environ. Microbiol. 81 (17), 5987-5992 (2015).
- Barker, J., Jones, M. V. The potential spread of infection caused by aerosol contamination of surfaces after flushing a domestic toilet. J. Appl. Microbiol. 99, 339-347 (2005).
- Tung-Thompson, G., Libera, D. A., Koch, K. L., de Los Reyes, F. L., Jaykus, L. A. Aerosolization of a Human Norovirus Surrogate, Bacteriophage MS2, during Simulated Vomiting. PloS one. 10, 0134277 (2015).
- Atmar, R. L., et al. Determination of the 50% human infectious dose for Norwalk virus. J. Infect. Dis. 209 (7), 1016-1022 (2014).
- Petrignani, M., van Beek, J., Borsboom, G., Richardus, J. H., Koopmans, M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J. Hosp. Infect. 89 (3), 163-178 (2015).
- . Centers for Disease Control Prevention. Norovirus outbreak in an elementary school--District of Columbia, February 2007. MMWR. Morb. Mortal. Wkly. Rep. 56 (51-52), 1340-1343 (2008).
- Cheesbrough, J. S., Barkess-Jones, L., Brown, D. W. Possible prolonged environmental survival of small round structured viruses. J. Hosp. Infect. 35, 325-326 (1997).
- Julian, T. R., Tamayo, F. J., Leckie, J. O., Boehm, A. B. Comparison of surface sampling methods for virus recovery from fomites. Appl. Environ. Microbiol. 77, 6918-6925 (2011).
- Taku, A., et al. Concentration and detection of caliciviruses from food contact surfaces. J. Food. Prot. 65, 999-1004 (2002).
- Scherer, K., Ellerbroek, L., Schulenburg, J., Johne, R., Klein, G. Application of a swab sampling method for the detection of norovirus and rotavirus on artifically contaminated food and environmental surfaces. Food. Environ. Virol. 1 (42), 42-49 (2009).
- Herzog, A. B., et al. Evaluation of sample recovery efficiency for bacteriophage P22 on fomites. Appl. Environ. Microbiol. 78, 7915-7922 (2012).
- Vega, E., et al. CaliciNet: A Novel Surveillance Network for Norovirus Gastroenteritis Outbreaks in the United States. Emerging Infectious Diseases. 17 (8), 1389-1395 (2011).
- Rolfe, K. J., et al. An internally controlled, one-step, real-time RT-PCR assay for norovirus detection and genogrouping. J Clin Virol. 39 (4), 318-321 (2007).
- Kittigul, L., et al. Norovirus GII-4 2006b variant circulating in patients with acute Thailand during a 2006-2007 study. J. Med. Virol. 82 (5), 854-860 (2010).
- Teunis, P. F., et al. Norwalk virus: how infectious is it. J. Med. Virol. 80 (8), 1468-1476 (2008).
- Wollants, E., et al. Evaluation of a norovirus sampling method using sodium dodecyl sulfate/EDTA-pretreated chromatography paper strips. J. Virol. Methods. 122, 45-48 (2004).
- Weir, M. H., Shibata, T., Masago, Y., Cologgi, D., Rose, J. B. The Effect of Surface Sampling and Recovery of Viruses and Non-Spore Forming Bacteria on a QMRA Model for Fomites. Environ. Sci. Technol. 50 (11), 5945-5952 (2016).
- . Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR. International Organization for Standardization (ISO). , (2013).
- Huslage, K., Rutala, W. A., Sickbert-Bennett, E., Weber, D. J. A quantitative approach to defining "high-touch" surfaces in hospitals. Infect. Control. Hosp. Epidemiol. 31 (8), 850-853 (2010).
- Wu, H. M., et al. A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control. Hosp. Epidemiol. 26 (10), 802-810 (2005).
- Ikner, L. A., Gerba, C. P., Bright, K. R. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 4 (2), 41-67 (2012).
- Gallimore, C. I., et al. Environmental monitoring for gastroenteric viruses in a pediatric primary immunodeficiency unit. J. Clin. Microbiol. 44 (2), 395-399 (2006).
- Ganime, A. C., et al. Dissemination of human adenoviruses and rotavirus species A on fomites of hospital pediatric units. Am J Infect Control. , (2016).
- Verani, M., Bigazzi, R., Carducci, A. Viral contamination of aerosol and surfaces through toilet use in health care and other settings. Am J Infect Control. 42 (7), 758-762 (2014).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved