Summary
Abstract
Introduction
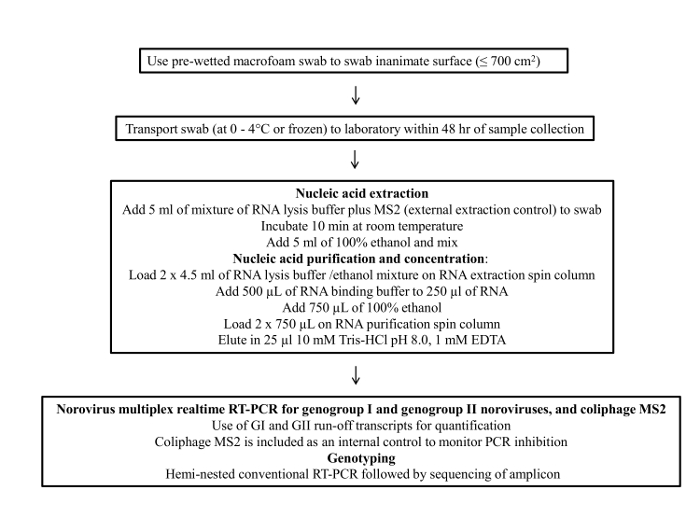
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Immunology and Infection
表面上のヒトノロウイルスの検出のためのスワブサンプリング方法
A macrofoam based sampling methodology was developed and evaluated for the detection and quantification of norovirus on environmental hard surfaces.
人間のノロウイルスは、世界的流行と散発的な胃腸炎の主要な原因です。ほとんどの感染はいずれかの環境表面や食品を介して間接的に個人対個人の経路を介して直接広がったりしているため、汚染された媒介物と無生物表面は、ノロウイルスの集団感染時のウイルスの拡散のための重要な媒体です。
私たちは、硬質表面からのヒトノロウイルスの検出およびタイピングのためのマクロフォームスワブを使用してプロトコルを開発し、評価しました。繊維が先端に付いた綿棒や帯電防止ワイプと比較すると、マクロフォームスワブは、最大700 cm 2の便座表面からのウイルス回収(範囲1.2から33.6パーセント)を許可します。プロトコルは、スピンカラムを用いてウイルスRNAのスワブからウイルスを抽出し、さらに濃縮するためのステップを含みます。ノロウイルス胃腸炎がされていたクルーズ船や介護施設での表面から収集された217スワブサンプルの合計で、127(58.5パーセント)RT-qPCRによりGIIのノロウイルス検査で陽性と報告しました。これらの29(22.8%)のうち、正常遺伝子型を決定することができました。結論として、私たちが開発したプロトコルを使用して、環境面でのノロウイルスの検出は、臨床試料が入手できないときに大流行中の環境汚染のレベルだけでなく、ウイルスの検出を判断する際に役立つかもしれ。それはまた、改善戦略の有効性の監視を容易にすることができます。
人間のノロウイルスは、世界的流行と散発的な急性胃腸炎の主要な原因1、2、3です。ウイルスは非常に伝染性であり、送信は、人との対話にまたは間接的に汚染された食物、水や環境表面との接触を介して直接人を介して行われます。ノロウイルスは、長時間流すことができ、環境表面上のウイルスの生存期間の延長は1、2、3に記載されています。ピークの排出時には、ウイルス粒子の数十億は糞便1g当たり放出される、および嘔吐はまた、感染4を引き起こすウイルス粒子の十分な数が含まれている5、6、7、8、EF "> 9、10。また、無生物表面と人間の皮膚と....
| Name | Company | Catalog Number | Comments | |
| Generic name for kits | ||||
| Macrofoam swab | Premoistened EnviroMax Swab kit | Puritan | 2588060PFUW | |
| RNA Lysis buffer | CDC UNEX buffer | Microbiologics | Cat No MR0501 | |
| RNA extraction spin column | Midi column | Omega Biotek | Cat No R6664-02 | |
| RNA purification spin column | Zymol RNA Clean and Concentrator kit | Zymo Research | Cat No R1016 | |
| Real time RT-PCR kit | AgPath kit One-Step RT-PCR Kit | Life Technologies | Cat No 4387391 | |
| Conventional RT-PCR kit | Qiagen one step RT-PCR kit | Qiagen kit | Cat No 210212 | |
| Gel extraction kit | Qiagen QIAquick gel extraction kit | Qiagen kit | Cat No 28704 or 28706 | |
| Coliphage MS2 | ATCC | Cat No 15597-B1 | ||
| RNA run-off transcripts | Bacteriophage MS2 (ATCC No. 15597-B1) can be cultivated using Escherichia coli (E.coli) Famp (ATCC No. 700891). | |||
| Realtime PCR platform | Applied Biosystems | Model ABI 7500 | GI and GII RNA run off transcripts were quantified spectrophotometrically at A260, diluted in diethyl pyrocarbonate-treated water to 1 × 106 copies/ μl, and stored at −80°C with 1.0 U /μl RNasin (Promega, Madison, WI). | |
| Optical 96-well reaction plate | Thermo Scientific | Cat No 4316813 | ||
| MicroAmp Clear Adhesive Film | Thermo Scientific | Cat No 4306311 |
- Isakbaeva, E. T., et al. Norovirus transmission on cruise ship. Emerg. Infect. Dis. 11, 154-158 (2005).
- Lopman, B. A., Gastañaduy, P., Park, G. W., Hall, A. J., Parashar, U. D., Vinjé, P. Environmental transmission of norovirus gastroenteritis. Curr. Opin. Virol. 2 (1), 1-7 (2011).
- Malek, M., et al. Outbreak of norovirus infection among river rafters associated with packaged delicatessen meat, Grand Canyon, 2005. Clin Infect Dis. 48 (1), 31-37 (2009).
- Atmar, R. L., et al. Norwalk virus shedding after experimental human infection. Emerg. Infect. Dis. 14 (10), 1553-1557 (2008).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N. Engl. J. Med. 361 (18), 1776-1785 (2009).
- Park, G. W., et al. Evaluation of a New Environmental Sampling Protocol for Detection of Human Norovirus on Inanimate Surfaces. Appl. Environ. Microbiol. 81 (17), 5987-5992 (2015).
- Barker, J., Jones, M. V. The potential spread of infection caused by aerosol contamination of surfaces after flushing a domestic toilet. J. Appl. Microbiol. 99, 339-347 (2005).
- Tung-Thompson, G., Libera, D. A., Koch, K. L., de Los Reyes, F. L., Jaykus, L. A. Aerosolization of a Human Norovirus Surrogate, Bacteriophage MS2, during Simulated Vomiting. PloS one. 10, 0134277 (2015).
- Atmar, R. L., et al. Determination of the 50% human infectious dose for Norwalk virus. J. Infect. Dis. 209 (7), 1016-1022 (2014).
- Petrignani, M., van Beek, J., Borsboom, G., Richardus, J. H., Koopmans, M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J. Hosp. Infect. 89 (3), 163-178 (2015).
- . Centers for Disease Control Prevention. Norovirus outbreak in an elementary school--District of Columbia, February 2007. MMWR. Morb. Mortal. Wkly. Rep. 56 (51-52), 1340-1343 (2008).
- Cheesbrough, J. S., Barkess-Jones, L., Brown, D. W. Possible prolonged environmental survival of small round structured viruses. J. Hosp. Infect. 35, 325-326 (1997).
- Julian, T. R., Tamayo, F. J., Leckie, J. O., Boehm, A. B. Comparison of surface sampling methods for virus recovery from fomites. Appl. Environ. Microbiol. 77, 6918-6925 (2011).
- Taku, A., et al. Concentration and detection of caliciviruses from food contact surfaces. J. Food. Prot. 65, 999-1004 (2002).
- Scherer, K., Ellerbroek, L., Schulenburg, J., Johne, R., Klein, G. Application of a swab sampling method for the detection of norovirus and rotavirus on artifically contaminated food and environmental surfaces. Food. Environ. Virol. 1 (42), 42-49 (2009).
- Herzog, A. B., et al. Evaluation of sample recovery efficiency for bacteriophage P22 on fomites. Appl. Environ. Microbiol. 78, 7915-7922 (2012).
- Vega, E., et al. CaliciNet: A Novel Surveillance Network for Norovirus Gastroenteritis Outbreaks in the United States. Emerging Infectious Diseases. 17 (8), 1389-1395 (2011).
- Rolfe, K. J., et al. An internally controlled, one-step, real-time RT-PCR assay for norovirus detection and genogrouping. J Clin Virol. 39 (4), 318-321 (2007).
- Kittigul, L., et al. Norovirus GII-4 2006b variant circulating in patients with acute Thailand during a 2006-2007 study. J. Med. Virol. 82 (5), 854-860 (2010).
- Teunis, P. F., et al. Norwalk virus: how infectious is it. J. Med. Virol. 80 (8), 1468-1476 (2008).
- Wollants, E., et al. Evaluation of a norovirus sampling method using sodium dodecyl sulfate/EDTA-pretreated chromatography paper strips. J. Virol. Methods. 122, 45-48 (2004).
- Weir, M. H., Shibata, T., Masago, Y., Cologgi, D., Rose, J. B. The Effect of Surface Sampling and Recovery of Viruses and Non-Spore Forming Bacteria on a QMRA Model for Fomites. Environ. Sci. Technol. 50 (11), 5945-5952 (2016).
- . Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR. International Organization for Standardization (ISO). , (2013).
- Huslage, K., Rutala, W. A., Sickbert-Bennett, E., Weber, D. J. A quantitative approach to defining "high-touch" surfaces in hospitals. Infect. Control. Hosp. Epidemiol. 31 (8), 850-853 (2010).
- Wu, H. M., et al. A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control. Hosp. Epidemiol. 26 (10), 802-810 (2005).
- Ikner, L. A., Gerba, C. P., Bright, K. R. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 4 (2), 41-67 (2012).
- Gallimore, C. I., et al. Environmental monitoring for gastroenteric viruses in a pediatric primary immunodeficiency unit. J. Clin. Microbiol. 44 (2), 395-399 (2006).
- Ganime, A. C., et al. Dissemination of human adenoviruses and rotavirus species A on fomites of hospital pediatric units. Am J Infect Control. , (2016).
- Verani, M., Bigazzi, R., Carducci, A. Viral contamination of aerosol and surfaces through toilet use in health care and other settings. Am J Infect Control. 42 (7), 758-762 (2014).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved