Summary
Abstract
Introduction
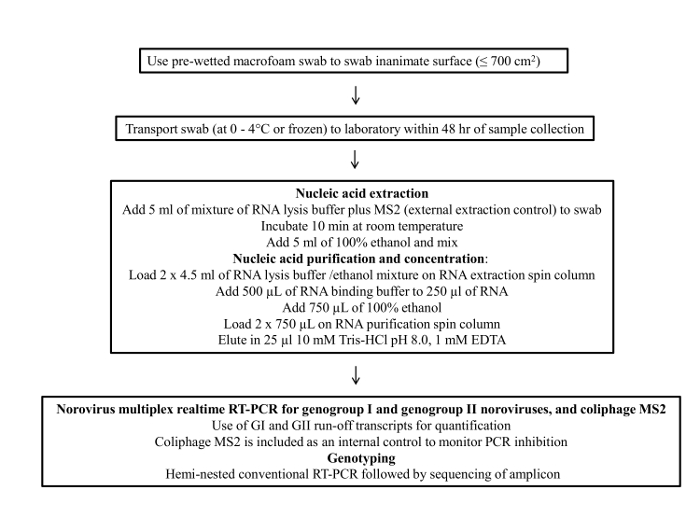
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Immunology and Infection
표면에 인간의 노로 바이러스의 검출을위한 면봉 표본 추출 방법
A macrofoam based sampling methodology was developed and evaluated for the detection and quantification of norovirus on environmental hard surfaces.
인간의 noroviruses는 전염병이 전 세계적으로 산발적 위장염의 주요 원인입니다. 대부분의 감염이 어느 환경 표면 또는 음식을 통해 간접적으로 개인 대 개인 경로를 통해 직접 전파 또는 때문에, 오염 fomites과 무생물 표면은 노로 바이러스의 발생시 바이러스의 확산을위한 중요한 차량이다.
우리는 개발 검출 및 하드 표면에서 인간의 noroviruses의 입력에 대한 macrofoam 면봉을 사용하여 프로토콜을 평가 하였다. 섬유로 만들어진 면봉 또는 정전기 방지 물티슈에 비해 macrofoam 면봉는 최대 700cm 2의 변기 표면에서 바이러스 복구 (범위 1.2-33.6 %)을 할 수 있습니다. 이 프로토콜은 스핀 열을 사용하여 바이러스 성 RNA의 면봉에서 바이러스의 추출과 더 집중하는 단계를 포함한다. 노로 바이러스 위장염이 있었다 유람선 및 장기 요양 시설의 표면에서 수집 한 217 면봉 샘플의 총, 127 (58.5 %)RT-qPCR에 의한 GII의 노로 바이러스 양성 반응보고했다. 이 29 (22.8 %)의 성공적 유전자형을 할 수있다. 결론적으로, 우리는 임상 샘플을 사용할 수없는 경우 바이러스의 검출뿐만 아니라 발생시 환경 오염의 수준을 결정하는데 도움이 될 수 개발 된 프로토콜을 사용하여 환경 표면 노로 바이러스의 검출; 또한 치료 전략의 효과의 모니터링을 용이하게 할 수있다.
인간의 noroviruses는 전염병과 산발적 급성 위장염 전 세계적으로 1, 2, 3의 주요 원인이다. 이 바이러스는 매우 전염성이 전송은 사람의 상호 작용으로 또는 간접적으로 오염 된 음식, 물 또는 환경 표면과 접촉을 통해 직접 사람을 통해 발생합니다. Noroviruses는 장시간 흘리고 연장 환경면에서의 바이러스 생존 1, 2, 3에 설명 된 수있다. 피크 흘리는 동안 바이러스 입자 수십억 대변 그램 당 방출하고, 구토 같은 감염 4, 5, 6, 7, 8 일으키는 바이러스 입자의 충분한 개수를 포함EF "> <....
필드 1. 면봉 샘플링
- 장갑의 깨끗한 쌍을 착용 할 것.
- 측정 테이프자를 사용하여 표면을 만지지 않고 샘플링 에리어의 크기를 측정한다. 가능한 한 정확하게 영역을 추정하고 보고서 양식 (보충 표 1)를 작성하려고합니다.
- 가능한 누출 및 라벨 샘플 수송 가방과 면봉 키트에 대한 면봉 키트를 확인합니다.
- 다음 샘플링 에리어 걸쳐 면봉 이동 : 수평 방향의.......
Noroviruses 18 10 3 바이러스 입자 20 ~ 50 %의 인간 감염 복용량을 가지고있다. 따라서, 표면도 낮은 수준의 오염은 공중 보건 위험을 초래할 수 있습니다. 내부 대조군으로서 추출 운송 중 1) 면봉 다른 재료, 2) 저장 조건 면봉 3) 바이러스 성 RNA 농도, 4) coliphage MS2 : 면봉 샘플링 프로토콜의 여러 측면을 포함하여 평가 하였다.
최근까지,면, 폴리 에스테르, .......
| Name | Company | Catalog Number | Comments | |
| Generic name for kits | ||||
| Macrofoam swab | Premoistened EnviroMax Swab kit | Puritan | 2588060PFUW | |
| RNA Lysis buffer | CDC UNEX buffer | Microbiologics | Cat No MR0501 | |
| RNA extraction spin column | Midi column | Omega Biotek | Cat No R6664-02 | |
| RNA purification spin column | Zymol RNA Clean and Concentrator kit | Zymo Research | Cat No R1016 | |
| Real time RT-PCR kit | AgPath kit One-Step RT-PCR Kit | Life Technologies | Cat No 4387391 | |
| Conventional RT-PCR kit | Qiagen one step RT-PCR kit | Qiagen kit | Cat No 210212 | |
| Gel extraction kit | Qiagen QIAquick gel extraction kit | Qiagen kit | Cat No 28704 or 28706 | |
| Coliphage MS2 | ATCC | Cat No 15597-B1 | ||
| RNA run-off transcripts | Bacteriophage MS2 (ATCC No. 15597-B1) can be cultivated using Escherichia coli (E.coli) Famp (ATCC No. 700891). | |||
| Realtime PCR platform | Applied Biosystems | Model ABI 7500 | GI and GII RNA run off transcripts were quantified spectrophotometrically at A260, diluted in diethyl pyrocarbonate-treated water to 1 × 106 copies/ μl, and stored at −80°C with 1.0 U /μl RNasin (Promega, Madison, WI). | |
| Optical 96-well reaction plate | Thermo Scientific | Cat No 4316813 | ||
| MicroAmp Clear Adhesive Film | Thermo Scientific | Cat No 4306311 |
- Isakbaeva, E. T., et al. Norovirus transmission on cruise ship. Emerg. Infect. Dis. 11, 154-158 (2005).
- Lopman, B. A., Gastañaduy, P., Park, G. W., Hall, A. J., Parashar, U. D., Vinjé, P. Environmental transmission of norovirus gastroenteritis. Curr. Opin. Virol. 2 (1), 1-7 (2011).
- Malek, M., et al. Outbreak of norovirus infection among river rafters associated with packaged delicatessen meat, Grand Canyon, 2005. Clin Infect Dis. 48 (1), 31-37 (2009).
- Atmar, R. L., et al. Norwalk virus shedding after experimental human infection. Emerg. Infect. Dis. 14 (10), 1553-1557 (2008).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N. Engl. J. Med. 361 (18), 1776-1785 (2009).
- Park, G. W., et al. Evaluation of a New Environmental Sampling Protocol for Detection of Human Norovirus on Inanimate Surfaces. Appl. Environ. Microbiol. 81 (17), 5987-5992 (2015).
- Barker, J., Jones, M. V. The potential spread of infection caused by aerosol contamination of surfaces after flushing a domestic toilet. J. Appl. Microbiol. 99, 339-347 (2005).
- Tung-Thompson, G., Libera, D. A., Koch, K. L., de Los Reyes, F. L., Jaykus, L. A. Aerosolization of a Human Norovirus Surrogate, Bacteriophage MS2, during Simulated Vomiting. PloS one. 10, 0134277 (2015).
- Atmar, R. L., et al. Determination of the 50% human infectious dose for Norwalk virus. J. Infect. Dis. 209 (7), 1016-1022 (2014).
- Petrignani, M., van Beek, J., Borsboom, G., Richardus, J. H., Koopmans, M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J. Hosp. Infect. 89 (3), 163-178 (2015).
- . Centers for Disease Control Prevention. Norovirus outbreak in an elementary school--District of Columbia, February 2007. MMWR. Morb. Mortal. Wkly. Rep. 56 (51-52), 1340-1343 (2008).
- Cheesbrough, J. S., Barkess-Jones, L., Brown, D. W. Possible prolonged environmental survival of small round structured viruses. J. Hosp. Infect. 35, 325-326 (1997).
- Julian, T. R., Tamayo, F. J., Leckie, J. O., Boehm, A. B. Comparison of surface sampling methods for virus recovery from fomites. Appl. Environ. Microbiol. 77, 6918-6925 (2011).
- Taku, A., et al. Concentration and detection of caliciviruses from food contact surfaces. J. Food. Prot. 65, 999-1004 (2002).
- Scherer, K., Ellerbroek, L., Schulenburg, J., Johne, R., Klein, G. Application of a swab sampling method for the detection of norovirus and rotavirus on artifically contaminated food and environmental surfaces. Food. Environ. Virol. 1 (42), 42-49 (2009).
- Herzog, A. B., et al. Evaluation of sample recovery efficiency for bacteriophage P22 on fomites. Appl. Environ. Microbiol. 78, 7915-7922 (2012).
- Vega, E., et al. CaliciNet: A Novel Surveillance Network for Norovirus Gastroenteritis Outbreaks in the United States. Emerging Infectious Diseases. 17 (8), 1389-1395 (2011).
- Rolfe, K. J., et al. An internally controlled, one-step, real-time RT-PCR assay for norovirus detection and genogrouping. J Clin Virol. 39 (4), 318-321 (2007).
- Kittigul, L., et al. Norovirus GII-4 2006b variant circulating in patients with acute Thailand during a 2006-2007 study. J. Med. Virol. 82 (5), 854-860 (2010).
- Teunis, P. F., et al. Norwalk virus: how infectious is it. J. Med. Virol. 80 (8), 1468-1476 (2008).
- Wollants, E., et al. Evaluation of a norovirus sampling method using sodium dodecyl sulfate/EDTA-pretreated chromatography paper strips. J. Virol. Methods. 122, 45-48 (2004).
- Weir, M. H., Shibata, T., Masago, Y., Cologgi, D., Rose, J. B. The Effect of Surface Sampling and Recovery of Viruses and Non-Spore Forming Bacteria on a QMRA Model for Fomites. Environ. Sci. Technol. 50 (11), 5945-5952 (2016).
- . Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR. International Organization for Standardization (ISO). , (2013).
- Huslage, K., Rutala, W. A., Sickbert-Bennett, E., Weber, D. J. A quantitative approach to defining "high-touch" surfaces in hospitals. Infect. Control. Hosp. Epidemiol. 31 (8), 850-853 (2010).
- Wu, H. M., et al. A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control. Hosp. Epidemiol. 26 (10), 802-810 (2005).
- Ikner, L. A., Gerba, C. P., Bright, K. R. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 4 (2), 41-67 (2012).
- Gallimore, C. I., et al. Environmental monitoring for gastroenteric viruses in a pediatric primary immunodeficiency unit. J. Clin. Microbiol. 44 (2), 395-399 (2006).
- Ganime, A. C., et al. Dissemination of human adenoviruses and rotavirus species A on fomites of hospital pediatric units. Am J Infect Control. , (2016).
- Verani, M., Bigazzi, R., Carducci, A. Viral contamination of aerosol and surfaces through toilet use in health care and other settings. Am J Infect Control. 42 (7), 758-762 (2014).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved