Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Immunology and Infection
Swab método de amostragem para a detecção do norovírus Humano em Surfaces
A macrofoam based sampling methodology was developed and evaluated for the detection and quantification of norovirus on environmental hard surfaces.
noroviruses humanos são uma das principais causas da epidemia e gastroenterite esporádica em todo o mundo. Porque a maioria das infecções são ou transmitida diretamente por via da pessoa-a-pessoa ou indirectamente através de superfícies ambientais ou alimentos, fômites contaminados e superfícies inanimadas são veículos importantes para a propagação do vírus durante surtos de norovírus.
Nós desenvolvido e avaliado um protocolo com cotonetes macro-espuma para a detecção e tipagem de norovírus humanos de superfícies duras. Comparado com cotonetes com ponta de fibra ou toalhetes anti-estáticos, compressas macro-espuma permitir a recuperação de vírus (intervalo 1,2-33,6%) das superfícies de assento de sanita de até 700 cm2. O protocolo inclui passos para a extracção do vírus a partir dos cotonetes e ao aumento da concentração do RNA viral utilizando colunas de centrifugação. No total, 127 (58,5%) das 217 amostras de esfregaço que tinham sido recolhidas a partir de superfícies em navios de cruzeiro e instalações de cuidados de longo prazo, onde norovirus gastroenterite tinham sidorelatado testou positivo para GII norovirus por RT-qPCR. Destes 29 (22,8%) poderia ser genotipados com sucesso. Em conclusão, a detecção de norovírus em superfícies ambientais utilizando o protocolo desenvolvido que pode ajudar a determinar o nível de contaminação do meio ambiente durante surtos, bem como a detecção de vírus quando as amostras não estão disponíveis clínicos; pode também facilitar o acompanhamento da eficácia de estratégias de remediação.
Noroviruses humanos são uma das principais causas da epidemia e gastroenterite aguda esporádica em todo o mundo 1, 2, 3. O vírus é extremamente contagiosa ea transmissão ocorre por meio de pessoa direta a interacção pessoa ou indirectamente, através de contacto com os alimentos contaminados, água ou superfícies ambientais. Norovírus pode ser derramado por longos períodos e prolongada sobrevivência do vírus em superfícies ambientais tem sido documentada 1, 2, 3. Durante derrama....
1. Swab Amostragem no campo
- Usar um par limpo de luvas.
- Medir o tamanho da área de amostragem, sem tocar na superfície utilizando uma fita de medição ou régua. Tente estimar a área com a maior precisão possível e preencher um formulário de relatório (Tabela Suplementar 1).
- Verifique o kit cotonete para possíveis fugas e amostras rótulo sacos de transporte e kits de esfregaço.
- Mover a haste de toda a área de amostragem, como segue: u.......
A Figura 1 apresenta um fluxograma do protocolo de amostragem cotonete. Este protocolo consiste em quatro etapas principais; 1) coleta de amostra, 2) o armazenamento de amostras e transporte, 3) purificação viral RNA e concentração e 4) ensaio de RT-qPCR e genotipagem.
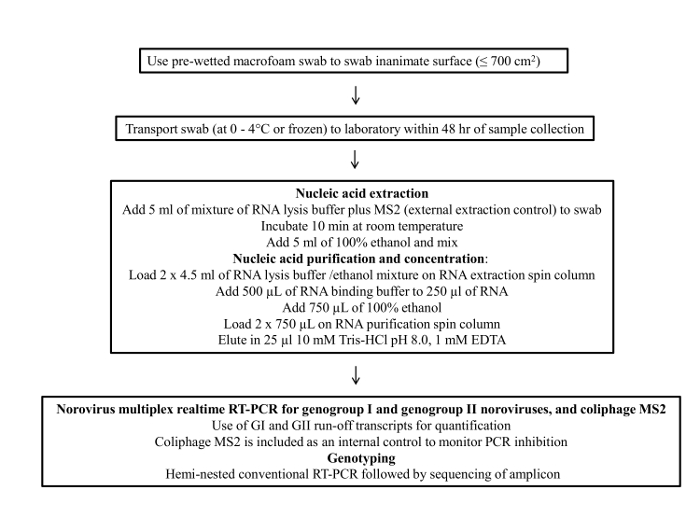
Figura 1: Fluxograma do protocolo final para amostragem de .......
Os norovírus têm uma dose infecciosa humana 50% entre 18 e 10 3 partículas de vírus 20. Portanto, mesmo a contaminação de baixo nível de superfícies podem representar um risco para a saúde pública. Vários aspectos do protocolo de amostragem swab foram avaliados, incluindo: 1) diferentes materiais de esfregaço, 2) cotonetes condição de armazenamento durante o transporte, 3) concentração de RNA viral, e 4) colifago MS2 como controle de extração interno.
| Name | Company | Catalog Number | Comments | |
| Generic name for kits | ||||
| Macrofoam swab | Premoistened EnviroMax Swab kit | Puritan | 2588060PFUW | |
| RNA Lysis buffer | CDC UNEX buffer | Microbiologics | Cat No MR0501 | |
| RNA extraction spin column | Midi column | Omega Biotek | Cat No R6664-02 | |
| RNA purification spin column | Zymol RNA Clean and Concentrator kit | Zymo Research | Cat No R1016 | |
| Real time RT-PCR kit | AgPath kit One-Step RT-PCR Kit | Life Technologies | Cat No 4387391 | |
| Conventional RT-PCR kit | Qiagen one step RT-PCR kit | Qiagen kit | Cat No 210212 | |
| Gel extraction kit | Qiagen QIAquick gel extraction kit | Qiagen kit | Cat No 28704 or 28706 | |
| Coliphage MS2 | ATCC | Cat No 15597-B1 | ||
| RNA run-off transcripts | Bacteriophage MS2 (ATCC No. 15597-B1) can be cultivated using Escherichia coli (E.coli) Famp (ATCC No. 700891). | |||
| Realtime PCR platform | Applied Biosystems | Model ABI 7500 | GI and GII RNA run off transcripts were quantified spectrophotometrically at A260, diluted in diethyl pyrocarbonate-treated water to 1 × 106 copies/ μl, and stored at −80°C with 1.0 U /μl RNasin (Promega, Madison, WI). | |
| Optical 96-well reaction plate | Thermo Scientific | Cat No 4316813 | ||
| MicroAmp Clear Adhesive Film | Thermo Scientific | Cat No 4306311 |
- Isakbaeva, E. T., et al. Norovirus transmission on cruise ship. Emerg. Infect. Dis. 11, 154-158 (2005).
- Lopman, B. A., Gastañaduy, P., Park, G. W., Hall, A. J., Parashar, U. D., Vinjé, P. Environmental transmission of norovirus gastroenteritis. Curr. Opin. Virol. 2 (1), 1-7 (2011).
- Malek, M., et al. Outbreak of norovirus infection among river rafters associated with packaged delicatessen meat, Grand Canyon, 2005. Clin Infect Dis. 48 (1), 31-37 (2009).
- Atmar, R. L., et al. Norwalk virus shedding after experimental human infection. Emerg. Infect. Dis. 14 (10), 1553-1557 (2008).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N. Engl. J. Med. 361 (18), 1776-1785 (2009).
- Park, G. W., et al. Evaluation of a New Environmental Sampling Protocol for Detection of Human Norovirus on Inanimate Surfaces. Appl. Environ. Microbiol. 81 (17), 5987-5992 (2015).
- Barker, J., Jones, M. V. The potential spread of infection caused by aerosol contamination of surfaces after flushing a domestic toilet. J. Appl. Microbiol. 99, 339-347 (2005).
- Tung-Thompson, G., Libera, D. A., Koch, K. L., de Los Reyes, F. L., Jaykus, L. A. Aerosolization of a Human Norovirus Surrogate, Bacteriophage MS2, during Simulated Vomiting. PloS one. 10, 0134277 (2015).
- Atmar, R. L., et al. Determination of the 50% human infectious dose for Norwalk virus. J. Infect. Dis. 209 (7), 1016-1022 (2014).
- Petrignani, M., van Beek, J., Borsboom, G., Richardus, J. H., Koopmans, M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J. Hosp. Infect. 89 (3), 163-178 (2015).
- . Centers for Disease Control Prevention. Norovirus outbreak in an elementary school--District of Columbia, February 2007. MMWR. Morb. Mortal. Wkly. Rep. 56 (51-52), 1340-1343 (2008).
- Cheesbrough, J. S., Barkess-Jones, L., Brown, D. W. Possible prolonged environmental survival of small round structured viruses. J. Hosp. Infect. 35, 325-326 (1997).
- Julian, T. R., Tamayo, F. J., Leckie, J. O., Boehm, A. B. Comparison of surface sampling methods for virus recovery from fomites. Appl. Environ. Microbiol. 77, 6918-6925 (2011).
- Taku, A., et al. Concentration and detection of caliciviruses from food contact surfaces. J. Food. Prot. 65, 999-1004 (2002).
- Scherer, K., Ellerbroek, L., Schulenburg, J., Johne, R., Klein, G. Application of a swab sampling method for the detection of norovirus and rotavirus on artifically contaminated food and environmental surfaces. Food. Environ. Virol. 1 (42), 42-49 (2009).
- Herzog, A. B., et al. Evaluation of sample recovery efficiency for bacteriophage P22 on fomites. Appl. Environ. Microbiol. 78, 7915-7922 (2012).
- Vega, E., et al. CaliciNet: A Novel Surveillance Network for Norovirus Gastroenteritis Outbreaks in the United States. Emerging Infectious Diseases. 17 (8), 1389-1395 (2011).
- Rolfe, K. J., et al. An internally controlled, one-step, real-time RT-PCR assay for norovirus detection and genogrouping. J Clin Virol. 39 (4), 318-321 (2007).
- Kittigul, L., et al. Norovirus GII-4 2006b variant circulating in patients with acute Thailand during a 2006-2007 study. J. Med. Virol. 82 (5), 854-860 (2010).
- Teunis, P. F., et al. Norwalk virus: how infectious is it. J. Med. Virol. 80 (8), 1468-1476 (2008).
- Wollants, E., et al. Evaluation of a norovirus sampling method using sodium dodecyl sulfate/EDTA-pretreated chromatography paper strips. J. Virol. Methods. 122, 45-48 (2004).
- Weir, M. H., Shibata, T., Masago, Y., Cologgi, D., Rose, J. B. The Effect of Surface Sampling and Recovery of Viruses and Non-Spore Forming Bacteria on a QMRA Model for Fomites. Environ. Sci. Technol. 50 (11), 5945-5952 (2016).
- . Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR. International Organization for Standardization (ISO). , (2013).
- Huslage, K., Rutala, W. A., Sickbert-Bennett, E., Weber, D. J. A quantitative approach to defining "high-touch" surfaces in hospitals. Infect. Control. Hosp. Epidemiol. 31 (8), 850-853 (2010).
- Wu, H. M., et al. A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control. Hosp. Epidemiol. 26 (10), 802-810 (2005).
- Ikner, L. A., Gerba, C. P., Bright, K. R. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 4 (2), 41-67 (2012).
- Gallimore, C. I., et al. Environmental monitoring for gastroenteric viruses in a pediatric primary immunodeficiency unit. J. Clin. Microbiol. 44 (2), 395-399 (2006).
- Ganime, A. C., et al. Dissemination of human adenoviruses and rotavirus species A on fomites of hospital pediatric units. Am J Infect Control. , (2016).
- Verani, M., Bigazzi, R., Carducci, A. Viral contamination of aerosol and surfaces through toilet use in health care and other settings. Am J Infect Control. 42 (7), 758-762 (2014).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved