Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Immunology and Infection
Pinnurvalsmetoden för påvisande av humana Norovirus på ytor
A macrofoam based sampling methodology was developed and evaluated for the detection and quantification of norovirus on environmental hard surfaces.
Mänskliga norovirus är en ledande orsak till epidemin och sporadisk gastroenterit hela världen. Eftersom de flesta infektioner är antingen sprids direkt via den person-till-person rutt eller indirekt genom miljö ytor eller mat, förorenade fomiter och livlösa ytor är viktiga fordon för spridning av viruset under norovirusutbrott.
Vi utvecklade och utvärderade ett protokoll med hjälp av makroskum svabbar för detektering och typning av humana norovirus från hårda ytor. Jämfört med fiber spets kompresser eller antistatiska våtservetter, makroskum kompresser tillåter virusutvinning (intervall 1,2-33,6%) från toalettsitsen ytor på upp till 700 cm 2. Protokollet inkluderar stegen för utvinning av viruset från bomullstopparna och ytterligare koncentration av det virala RNA med användning av centrifugeringskolonner. Totalt 127 (58,5%) av 217 pinnprover som samlats in från ytor i kryssningsfartyg och långvårdsanläggningar där norovirus gastroenterit hade varitrapporterade testat positivt för GII norovirus genom RT-qPCR. Av dessa 29 (22,8%) kunde framgångsrikt genotypas. Sammanfattningsvis, detektion av norovirus om miljö ytor använder protokollet vi utvecklat kan bidra till fastställandet av miljöföroreningar under utbrott samt detektion av virus när kliniska prover inte är tillgängliga; Det kan också underlätta övervakningen av effektiviteten i saneringsstrategier.
Mänskliga norovirus är en ledande orsak till epidemin och sporadisk akut gastroenterit i världen en, två, tre. Viruset är mycket smittsam och överföring sker genom direkt person till person interaktion eller indirekt genom kontakt med förorenat mat, vatten eller miljö ytor. Norovirus kan kasta under längre perioder och förlängd överlevnad av viruset på miljö ytor har dokumenterats en, två, tre. Under topp avlösning, är miljarder av viruspartiklar frigörs per gram avföring och ....
1. Swab Provtagning i fält
- Använd en ren par handskar.
- Mäta storleken på provytan utan att röra vid ytan med hjälp av ett måttband eller linjal. Försöka uppskatta det område som så exakt som möjligt och fyller i ett formulär (Supplementary Tabell 1).
- Kontrollera pinnen kit för eventuella läckage och etikett provtransportväskor och pinnsatser.
- Flytta pinnen tvärs över provtagningsområdet på följande sätt: en stroke i horisontell riktning, en .......
Figur 1 presenterar ett flödesschema över svabben provtagningsprotokoll. Detta protokoll består av fyra huvudsteg; 1) provsamling, 2) prov lagring och transport, 3) viralt RNA rening och koncentration och 4) RT-qPCR analys och genotypning.
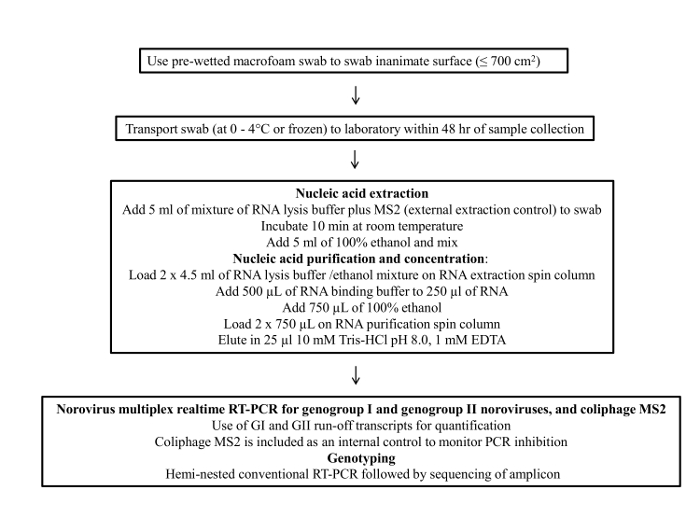
Figur 1: Flödesschema i slutprotokollet för miljö yta provtagning av norovirus .......
Norovirus har en 50% humant smitt dos mellan 18 och 10 tre viruspartiklar 20. Därför kan även smitta låg nivå av ytor utgör en risk för folkhälsan. Flera aspekter av pinnen provtagningsprotokoll utvärderades inklusive: 1) olika pinn material, 2) lagring skick kompresser under transport, 3) viralt RNA-koncentrationen, och 4) colifag MS2 som intern extraktion kontroll.
Tills nyligen hade endast resultatet av kompresser gjorda av bomull, polyester, ny.......
| Name | Company | Catalog Number | Comments | |
| Generic name for kits | ||||
| Macrofoam swab | Premoistened EnviroMax Swab kit | Puritan | 2588060PFUW | |
| RNA Lysis buffer | CDC UNEX buffer | Microbiologics | Cat No MR0501 | |
| RNA extraction spin column | Midi column | Omega Biotek | Cat No R6664-02 | |
| RNA purification spin column | Zymol RNA Clean and Concentrator kit | Zymo Research | Cat No R1016 | |
| Real time RT-PCR kit | AgPath kit One-Step RT-PCR Kit | Life Technologies | Cat No 4387391 | |
| Conventional RT-PCR kit | Qiagen one step RT-PCR kit | Qiagen kit | Cat No 210212 | |
| Gel extraction kit | Qiagen QIAquick gel extraction kit | Qiagen kit | Cat No 28704 or 28706 | |
| Coliphage MS2 | ATCC | Cat No 15597-B1 | ||
| RNA run-off transcripts | Bacteriophage MS2 (ATCC No. 15597-B1) can be cultivated using Escherichia coli (E.coli) Famp (ATCC No. 700891). | |||
| Realtime PCR platform | Applied Biosystems | Model ABI 7500 | GI and GII RNA run off transcripts were quantified spectrophotometrically at A260, diluted in diethyl pyrocarbonate-treated water to 1 × 106 copies/ μl, and stored at −80°C with 1.0 U /μl RNasin (Promega, Madison, WI). | |
| Optical 96-well reaction plate | Thermo Scientific | Cat No 4316813 | ||
| MicroAmp Clear Adhesive Film | Thermo Scientific | Cat No 4306311 |
- Isakbaeva, E. T., et al. Norovirus transmission on cruise ship. Emerg. Infect. Dis. 11, 154-158 (2005).
- Lopman, B. A., Gastañaduy, P., Park, G. W., Hall, A. J., Parashar, U. D., Vinjé, P. Environmental transmission of norovirus gastroenteritis. Curr. Opin. Virol. 2 (1), 1-7 (2011).
- Malek, M., et al. Outbreak of norovirus infection among river rafters associated with packaged delicatessen meat, Grand Canyon, 2005. Clin Infect Dis. 48 (1), 31-37 (2009).
- Atmar, R. L., et al. Norwalk virus shedding after experimental human infection. Emerg. Infect. Dis. 14 (10), 1553-1557 (2008).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N. Engl. J. Med. 361 (18), 1776-1785 (2009).
- Park, G. W., et al. Evaluation of a New Environmental Sampling Protocol for Detection of Human Norovirus on Inanimate Surfaces. Appl. Environ. Microbiol. 81 (17), 5987-5992 (2015).
- Barker, J., Jones, M. V. The potential spread of infection caused by aerosol contamination of surfaces after flushing a domestic toilet. J. Appl. Microbiol. 99, 339-347 (2005).
- Tung-Thompson, G., Libera, D. A., Koch, K. L., de Los Reyes, F. L., Jaykus, L. A. Aerosolization of a Human Norovirus Surrogate, Bacteriophage MS2, during Simulated Vomiting. PloS one. 10, 0134277 (2015).
- Atmar, R. L., et al. Determination of the 50% human infectious dose for Norwalk virus. J. Infect. Dis. 209 (7), 1016-1022 (2014).
- Petrignani, M., van Beek, J., Borsboom, G., Richardus, J. H., Koopmans, M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J. Hosp. Infect. 89 (3), 163-178 (2015).
- . Centers for Disease Control Prevention. Norovirus outbreak in an elementary school--District of Columbia, February 2007. MMWR. Morb. Mortal. Wkly. Rep. 56 (51-52), 1340-1343 (2008).
- Cheesbrough, J. S., Barkess-Jones, L., Brown, D. W. Possible prolonged environmental survival of small round structured viruses. J. Hosp. Infect. 35, 325-326 (1997).
- Julian, T. R., Tamayo, F. J., Leckie, J. O., Boehm, A. B. Comparison of surface sampling methods for virus recovery from fomites. Appl. Environ. Microbiol. 77, 6918-6925 (2011).
- Taku, A., et al. Concentration and detection of caliciviruses from food contact surfaces. J. Food. Prot. 65, 999-1004 (2002).
- Scherer, K., Ellerbroek, L., Schulenburg, J., Johne, R., Klein, G. Application of a swab sampling method for the detection of norovirus and rotavirus on artifically contaminated food and environmental surfaces. Food. Environ. Virol. 1 (42), 42-49 (2009).
- Herzog, A. B., et al. Evaluation of sample recovery efficiency for bacteriophage P22 on fomites. Appl. Environ. Microbiol. 78, 7915-7922 (2012).
- Vega, E., et al. CaliciNet: A Novel Surveillance Network for Norovirus Gastroenteritis Outbreaks in the United States. Emerging Infectious Diseases. 17 (8), 1389-1395 (2011).
- Rolfe, K. J., et al. An internally controlled, one-step, real-time RT-PCR assay for norovirus detection and genogrouping. J Clin Virol. 39 (4), 318-321 (2007).
- Kittigul, L., et al. Norovirus GII-4 2006b variant circulating in patients with acute Thailand during a 2006-2007 study. J. Med. Virol. 82 (5), 854-860 (2010).
- Teunis, P. F., et al. Norwalk virus: how infectious is it. J. Med. Virol. 80 (8), 1468-1476 (2008).
- Wollants, E., et al. Evaluation of a norovirus sampling method using sodium dodecyl sulfate/EDTA-pretreated chromatography paper strips. J. Virol. Methods. 122, 45-48 (2004).
- Weir, M. H., Shibata, T., Masago, Y., Cologgi, D., Rose, J. B. The Effect of Surface Sampling and Recovery of Viruses and Non-Spore Forming Bacteria on a QMRA Model for Fomites. Environ. Sci. Technol. 50 (11), 5945-5952 (2016).
- . Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR. International Organization for Standardization (ISO). , (2013).
- Huslage, K., Rutala, W. A., Sickbert-Bennett, E., Weber, D. J. A quantitative approach to defining "high-touch" surfaces in hospitals. Infect. Control. Hosp. Epidemiol. 31 (8), 850-853 (2010).
- Wu, H. M., et al. A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control. Hosp. Epidemiol. 26 (10), 802-810 (2005).
- Ikner, L. A., Gerba, C. P., Bright, K. R. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 4 (2), 41-67 (2012).
- Gallimore, C. I., et al. Environmental monitoring for gastroenteric viruses in a pediatric primary immunodeficiency unit. J. Clin. Microbiol. 44 (2), 395-399 (2006).
- Ganime, A. C., et al. Dissemination of human adenoviruses and rotavirus species A on fomites of hospital pediatric units. Am J Infect Control. , (2016).
- Verani, M., Bigazzi, R., Carducci, A. Viral contamination of aerosol and surfaces through toilet use in health care and other settings. Am J Infect Control. 42 (7), 758-762 (2014).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved