Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Immunology and Infection
Yüzeyler İnsan Norovirus Tespiti sürüntü Örnekleme Yöntemi
A macrofoam based sampling methodology was developed and evaluated for the detection and quantification of norovirus on environmental hard surfaces.
İnsan Noroviruses salgın ve dünya çapında dağınık gastroenteritin önde gelen nedenidir. En enfeksiyonlar ya çevresel yüzeylerde ya da gıda yoluyla dolaylı olarak kişiden kişiye yolla doğrudan yayılır ya, çünkü kirlenen fomitler ve cansız yüzeyler norovirus salgınları sırasında virüsün yayılması için önemli araçlardır.
Biz geliştirdik ve algılama ve sert yüzeylerde insan Noroviruses bir tiplemesi için macrofoam bezlerden kullanarak bir protokol değerlendirildi. Fiber uçlu bezlerden veya antistatik mendil ile karşılaştırıldığında, macrofoam bezlerden 700 cm2 klozet yüzeylerinden virüs kurtarma (aralık 1,2-33,6%) izin verir. Protokol spin sütunları kullanılarak viral RNA'nın bezlerden virüsün çıkarma ve bir daha konsantrasyon yapılması adımlarını içerir. norovirus gastroenterit olmuştu yolcu gemileri ve uzun süreli bakım tesislerinde yüzeylerinden toplanan olmuştu 217 sürüntü örneklerinin toplam olarak, 127 (% 58.5)RT-qPCR GII norovirusa için pozitif test bildirildi. Bu 29 (% 22.8) başarıyla genotip olabilir. Sonuç olarak, klinik örnekler mevcut olmadığında virüsün saptanması yanı sıra salgınlar sırasında çevresel kirlilik düzeyinin belirlenmesinde yardımcı olabilir geliştirilen protokolü kullanılarak çevresel yüzeylerde norovirusa tespiti; aynı zamanda iyileştirme stratejilerinin etkinliğinin izlenmesi kolaylaştırabilir.
İnsan Noroviruses salgın ve sporadik akut gastroenterit, dünya çapında 1, 2, 3 lider nedenidir. Virüs son derece bulaşıcıdır ve iletim kişi etkileşim ya da dolaylı kirlenmiş yiyecek, su ya da çevresel yüzeylerle temas yoluyla doğrudan kişi aracılığıyla gerçekleşir. Noroviruses uzun süre tutacak ve uzun süreli çevresel yüzeyler üzerinde virüs yaşam 1, 2, 3, belgelenmiştir edilebilir. Pik ağızlık açma işlemi esnasında, virüs partiküllerinin milyarlarca dışkıların gramı başına se....
Alanında 1. Swab Örnekleme
- eldiven temiz bir çifti giymek.
- bir ölçüm bandı veya cetvel kullanarak yüzeyine dokunmadan örnekleme alanının boyutunu ölçün. Mümkün olduğu kadar doğru bölgeyi tahmin ve bir rapor formu (Ek Tablo 1) doldurmak için deneyin.
- olası sızıntı ve etiket örneği taşıma çantaları ve çubukla kitleri için sürüntü kiti edin.
- şu şekilde numune alanı boyunca çubukla hareket Yatay yönde bir felç, dikey yönde bi.......
Şekil 1 sürüntü örnekleme protokolünün bir akış şemasını göstermektedir. Bu protokol dört ana aşamadan oluşmaktadır; 1) numune toplama, 2) örnek depolama ve nakliye, 3) viral RNA arıtma ve konsantrasyon ve 4) RT-qPCR tahlil ve genotiplendirme.
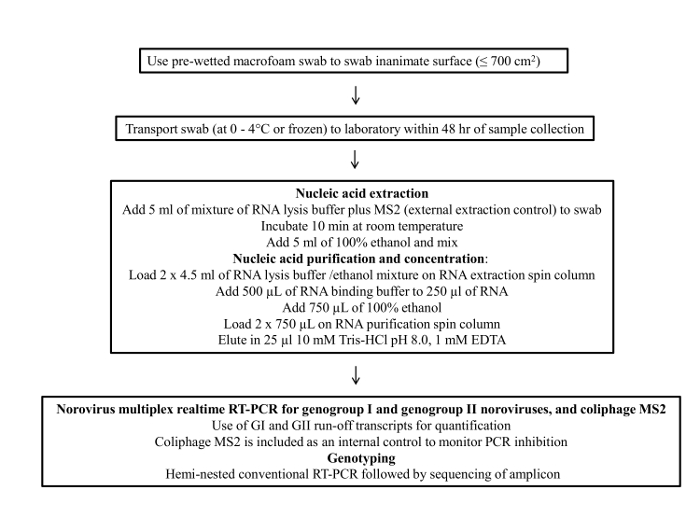
Şekil 1: norovirusa çevresel yüzey örnekleme için nihai protokol?.......
Noroviruses 18 ve 10 3 virüs parçacıkları 20 arasında% 50 insan bulaşıcı dozu var. Bu nedenle, yüzeylerin bile düşük seviyeli kirlenme bir halk sağlığı riski doğurabilir. iç çıkarma kontrolü olarak taşıma sırasında 1) farklı sürüntü malzemeleri, 2) depolama koşulu bezlerden, 3) viral RNA konsantrasyonu ve 4) kolifaj MS2: çubukla örnekleme protokolünün çeşitli yönleri de dahil olmak üzere değerlendirildi.
Yakın zamana .......
| Name | Company | Catalog Number | Comments | |
| Generic name for kits | ||||
| Macrofoam swab | Premoistened EnviroMax Swab kit | Puritan | 2588060PFUW | |
| RNA Lysis buffer | CDC UNEX buffer | Microbiologics | Cat No MR0501 | |
| RNA extraction spin column | Midi column | Omega Biotek | Cat No R6664-02 | |
| RNA purification spin column | Zymol RNA Clean and Concentrator kit | Zymo Research | Cat No R1016 | |
| Real time RT-PCR kit | AgPath kit One-Step RT-PCR Kit | Life Technologies | Cat No 4387391 | |
| Conventional RT-PCR kit | Qiagen one step RT-PCR kit | Qiagen kit | Cat No 210212 | |
| Gel extraction kit | Qiagen QIAquick gel extraction kit | Qiagen kit | Cat No 28704 or 28706 | |
| Coliphage MS2 | ATCC | Cat No 15597-B1 | ||
| RNA run-off transcripts | Bacteriophage MS2 (ATCC No. 15597-B1) can be cultivated using Escherichia coli (E.coli) Famp (ATCC No. 700891). | |||
| Realtime PCR platform | Applied Biosystems | Model ABI 7500 | GI and GII RNA run off transcripts were quantified spectrophotometrically at A260, diluted in diethyl pyrocarbonate-treated water to 1 × 106 copies/ μl, and stored at −80°C with 1.0 U /μl RNasin (Promega, Madison, WI). | |
| Optical 96-well reaction plate | Thermo Scientific | Cat No 4316813 | ||
| MicroAmp Clear Adhesive Film | Thermo Scientific | Cat No 4306311 |
- Isakbaeva, E. T., et al. Norovirus transmission on cruise ship. Emerg. Infect. Dis. 11, 154-158 (2005).
- Lopman, B. A., Gastañaduy, P., Park, G. W., Hall, A. J., Parashar, U. D., Vinjé, P. Environmental transmission of norovirus gastroenteritis. Curr. Opin. Virol. 2 (1), 1-7 (2011).
- Malek, M., et al. Outbreak of norovirus infection among river rafters associated with packaged delicatessen meat, Grand Canyon, 2005. Clin Infect Dis. 48 (1), 31-37 (2009).
- Atmar, R. L., et al. Norwalk virus shedding after experimental human infection. Emerg. Infect. Dis. 14 (10), 1553-1557 (2008).
- Glass, R. I., Parashar, U. D., Estes, M. K. Norovirus gastroenteritis. N. Engl. J. Med. 361 (18), 1776-1785 (2009).
- Park, G. W., et al. Evaluation of a New Environmental Sampling Protocol for Detection of Human Norovirus on Inanimate Surfaces. Appl. Environ. Microbiol. 81 (17), 5987-5992 (2015).
- Barker, J., Jones, M. V. The potential spread of infection caused by aerosol contamination of surfaces after flushing a domestic toilet. J. Appl. Microbiol. 99, 339-347 (2005).
- Tung-Thompson, G., Libera, D. A., Koch, K. L., de Los Reyes, F. L., Jaykus, L. A. Aerosolization of a Human Norovirus Surrogate, Bacteriophage MS2, during Simulated Vomiting. PloS one. 10, 0134277 (2015).
- Atmar, R. L., et al. Determination of the 50% human infectious dose for Norwalk virus. J. Infect. Dis. 209 (7), 1016-1022 (2014).
- Petrignani, M., van Beek, J., Borsboom, G., Richardus, J. H., Koopmans, M. Norovirus introduction routes into nursing homes and risk factors for spread: a systematic review and meta-analysis of observational studies. J. Hosp. Infect. 89 (3), 163-178 (2015).
- . Centers for Disease Control Prevention. Norovirus outbreak in an elementary school--District of Columbia, February 2007. MMWR. Morb. Mortal. Wkly. Rep. 56 (51-52), 1340-1343 (2008).
- Cheesbrough, J. S., Barkess-Jones, L., Brown, D. W. Possible prolonged environmental survival of small round structured viruses. J. Hosp. Infect. 35, 325-326 (1997).
- Julian, T. R., Tamayo, F. J., Leckie, J. O., Boehm, A. B. Comparison of surface sampling methods for virus recovery from fomites. Appl. Environ. Microbiol. 77, 6918-6925 (2011).
- Taku, A., et al. Concentration and detection of caliciviruses from food contact surfaces. J. Food. Prot. 65, 999-1004 (2002).
- Scherer, K., Ellerbroek, L., Schulenburg, J., Johne, R., Klein, G. Application of a swab sampling method for the detection of norovirus and rotavirus on artifically contaminated food and environmental surfaces. Food. Environ. Virol. 1 (42), 42-49 (2009).
- Herzog, A. B., et al. Evaluation of sample recovery efficiency for bacteriophage P22 on fomites. Appl. Environ. Microbiol. 78, 7915-7922 (2012).
- Vega, E., et al. CaliciNet: A Novel Surveillance Network for Norovirus Gastroenteritis Outbreaks in the United States. Emerging Infectious Diseases. 17 (8), 1389-1395 (2011).
- Rolfe, K. J., et al. An internally controlled, one-step, real-time RT-PCR assay for norovirus detection and genogrouping. J Clin Virol. 39 (4), 318-321 (2007).
- Kittigul, L., et al. Norovirus GII-4 2006b variant circulating in patients with acute Thailand during a 2006-2007 study. J. Med. Virol. 82 (5), 854-860 (2010).
- Teunis, P. F., et al. Norwalk virus: how infectious is it. J. Med. Virol. 80 (8), 1468-1476 (2008).
- Wollants, E., et al. Evaluation of a norovirus sampling method using sodium dodecyl sulfate/EDTA-pretreated chromatography paper strips. J. Virol. Methods. 122, 45-48 (2004).
- Weir, M. H., Shibata, T., Masago, Y., Cologgi, D., Rose, J. B. The Effect of Surface Sampling and Recovery of Viruses and Non-Spore Forming Bacteria on a QMRA Model for Fomites. Environ. Sci. Technol. 50 (11), 5945-5952 (2016).
- . Microbiology of food and animal feed-Horizontal method for determination of hepatitis A virus and norovirus in food using real-time RT-PCR. International Organization for Standardization (ISO). , (2013).
- Huslage, K., Rutala, W. A., Sickbert-Bennett, E., Weber, D. J. A quantitative approach to defining "high-touch" surfaces in hospitals. Infect. Control. Hosp. Epidemiol. 31 (8), 850-853 (2010).
- Wu, H. M., et al. A norovirus outbreak at a long-term-care facility: the role of environmental surface contamination. Infect. Control. Hosp. Epidemiol. 26 (10), 802-810 (2005).
- Ikner, L. A., Gerba, C. P., Bright, K. R. Concentration and recovery of viruses from water: a comprehensive review. Food Environ. Virol. 4 (2), 41-67 (2012).
- Gallimore, C. I., et al. Environmental monitoring for gastroenteric viruses in a pediatric primary immunodeficiency unit. J. Clin. Microbiol. 44 (2), 395-399 (2006).
- Ganime, A. C., et al. Dissemination of human adenoviruses and rotavirus species A on fomites of hospital pediatric units. Am J Infect Control. , (2016).
- Verani, M., Bigazzi, R., Carducci, A. Viral contamination of aerosol and surfaces through toilet use in health care and other settings. Am J Infect Control. 42 (7), 758-762 (2014).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved