Method Article
Quantificar a Microglia morfologia de fotomicrografias de imuno-histoquímica preparado tecido usando o ImageJ
Neste Artigo
Resumo
Microglia são células imunes do cérebro que pesquisa e reagem a fisiologia do cérebro alteradas através de alterações morfológicas que podem ser avaliadas quantitativamente. Este protocolo descreve um ImageJ com base em protocolo de análise para representar microglia morfologia como dados contínuos de acordo com métricas como ramificação de célula, complexidade e forma.
Resumo
Microglia são os fagócitos de cérebro que continuamente seu ambiente por doença, lesão e disfunção de vistoria e participarem na homeostase do cérebro. Como as socorristas, microglia têm funções importantes para atenuar a disfunção do neurônio e glia, e nesse processo, passam por uma ampla gama de alterações morfológicas. Microglia morfologias podem ser categorizadas de forma descritiva ou, alternativamente, podem ser quantificadas como uma variável contínua para parâmetros como ramificação de célula, complexidade e forma. Enquanto métodos para quantificar a microglia são aplicados a células únicas, algumas técnicas se aplicam a microglia múltiplos em uma Fotomicrografia inteira. A finalidade desse método é quantificar múltiplo e única células usando protocolos ImageJ prontamente disponíveis. Este protocolo é um resumo das etapas e plugins ImageJ recomendado para converter fotomicrografias de fluorescência e brilhante-campo em imagens binárias e esqueletizadas representante e analisá-los usando o software plugins AnalyzeSkeleton (2D/3D) e FracLac morfologia recolha de dados. As saídas desses plugins resumem morfologia celular em termos de pontos de extremidade do processo, junções e comprimento, bem como complexidade, forma da célula e descritores de tamanho. O protocolo de análise esqueleto aqui descrito é bem adequado para uma análise regional de micróglia múltiplos dentro de uma Fotomicrografia toda ou a região de interesse (ROI), Considerando que FracLac fornece uma análise complementar célula individual. Combinado, o protocolo fornece um objetivo, uma ferramenta de avaliação sensível e abrangente que pode ser usada para estratificar entre microglia diversas morfologias presentes no cérebro saudável e ferido.
Introdução
Microglia têm uma resposta morfológica imediata e diversa alterações no cérebro fisiologia1 ao longo de um continuum de possibilidades que variam de hiper-ramificação e altamente complexas morfologias a eliminação ramificadas e ameboides morfologias2 . Microglia também pode tornar-se polarizada e de forma cilíndrica3. Ramificação de célula microglia é comumente definida como uma forma complexa, tendo vários processos e muitas vezes é relatada como o número de pontos de extremidade por célula e a duração dos processos celulares. Desde microglia são finamente ajustados a função neuronal e glial através do celular contínua cross-talk e na vivo motilidade4,5, microglia morfologias podem servir como indicadores de célula diversas funções e disfunções no cérebro. Uma abordagem quantitativa é necessária para descrever adequadamente a diversidade dessas alterações morfológicas e de distinguir as diferenças entre células ramificadas que ocorrem com sutis perturbações fisiológicas (como epilepsia5,6 e concussão7) Além de prejuízo bruto (tais como acidente vascular cerebral8). Um aumento da utilização de morfologia quantificação7,8,9,10,11,12,13,14 revelará a completa diversidade de morfologias microglia durante saúde e doença. O presente estudo detalhes o uso gradual do ImageJ plugins necessários para resumir microglia morfologia de fotomicrografias fluorescentes ou não-fluorescente de micróglia adquirido em tecido de roedor fixo depois de imuno-histoquímica (IHC).
Central para as técnicas de análise descritas aqui são o ImageJ plugins AnalyzeSkeleton (2D/3D)15, desenvolvido em 2010 para quantificar a grandes estruturas mamárias e FracLac16, desenvolvido em 2014 para integrar a análise ImageJ e fractal para quantificar as formas individuais microglia. Esses plugins fornecem uma análise rápida da microglia ramificação dentro fotomicrografias inteiras ou microglia múltiplas de um ROI definido dentro uma Fotomicrografia. Esta análise pode ser usada sozinho ou em complemento com análise fractal. A análise fractal de célula única (FracLac) requer um investimento de tempo, mas fornece várias saídas de morfologia em relação a tamanho, forma e complexidade microglia. O uso de ambas as ferramentas não é redundante, como célula ramificação é complementar à complexidade da célula, e a combinação de vários parâmetros pode ser utilizada para distinguir microglia diversas morfologias dentro de conjuntos de dados12,17.
Protocolo
Todos os experimentos foram aprovados pela e executados em conformidade com as diretrizes estabelecidas pelo Comité de usar e cuidados de animais institucional da Universidade do Arizona e as diretrizes do NIH para o cuidado e o uso de animais de laboratório. Cuidado foi tomado para minimizar o desconforto e dor animal. Métodos de eutanásia são de acordo com um protocolo aprovado e consistem de decapitação cervical sob anestesia de isoflurano.
1. tecido preparação
Nota: Realizar análise de morfologia microglia em amostras de tecido cryoprotected fixo, para preservar a morfologia celular. O seguinte é um protocolo padrão para preparar e cortar diretamente tecido fixo por fluorescência IHC.
- Remova o cérebro de rato ou rato de um animal euthanized após a experiência desejada e de acordo com um protocolo padrão de laboratório. Colocar o cérebro em um frasco de 10 mL contendo 5 mL de uma solução de paraformaldeído 4% por 24 h a 4 ° C. Em seguida, enxágue e coloque em 5-10 mL de um fosfato de 30% de sacarose em buffer solução (PBS, 0,01 M) por 72 h a 4 ° C. Armazenar todo cérebro a-80 ° C até o corte de tecido com um criostato, ou a 4 ° C se corte com um micrótomo.
Nota: Este protocolo não ainda foi testado usando o tecido cortado de tecido parafina. - Secção do tecido cerebral para a espessura desejada e orientação usando um criostato ou micrótomo e loja seções flutuantes em uma solução de cryoprotection (50mm PBS, etileno glicol, glicerol) a-20 ° C.
Nota: Este protocolo tem sido realizaram com sucesso em secções de tecido coronal variando de 50 µm a 200 µm de espessura. Tecido seções menos do que 50 µm não pode capturar o intervalo completo de processos microglia, enquanto nas seções de tecido grosso, IHC coloração pode ser imperfeito devido à penetração do anticorpo nos tecidos. Tecido pode ser seccionada ou em um coronal ou sagital orientação e esta escolha dependerá o experimental objetivo e cérebro região (ões) a ser estudado.
2. imuno-histoquímica
Nota: Métodos de análise de esqueleto e fractal podem ser aplicados a fluorescência ou 3, 3 '-diaminobenzidine (DAB) IHC. O seguinte é um protocolo IHC fluorescência padrão e pode ser substituída conforme necessário. Fluorescência IHC produz superior visualização dos processos de célula quando comparado ao IHC DAB.
- Colocar as seções de tecido dentro de um frasco de vidro de 4 mL (até 15 rato cérebro seções/frasco) e incube com 1 mL de solução contendo acima de 10% de soro de cavalo, PBS (0,01 M), 0,5% Triton, 0,04% NaN3 à temperatura ambiente (23 ° C) por 1h.
- Lave por 5 min com PBS (0,01 M) três vezes à temperatura ambiente.
- Incube com o anticorpo primário (Iba1, 1:1, 000) em temperatura ambiente durante 72 h em 1 mL de solução contendo PBS (0,01 M), 0,5% Triton, 0,04% NaN3e coberto (para preservar a eficácia de3 NaN).
- Lave por 5 min com PBS (0,01 M) três vezes à temperatura ambiente.
- Incube com anticorpo secundário (anticoelho 488, 1: 250) coberto à temperatura ambiente durante 4 h em 1 mL de solução contendo PBS (0,01 M), 0,5% Triton, 0,04% NaN3
- Lave por 5 min com PBS (0,01 M) três vezes à temperatura ambiente.
- Montar as seções de tecido cerebral (número e orientação com base na preferência) para slides subbed, aplicar-se um meio de macio-conjunto de montagem para o slide e colocar a lamela sobre o tecido. Armazenar os slides a 4 ° C.
Nota: Uma espessura da lamela de 1,5 vidro é necessária para a imagem latente confocal. Macio-conjunto é um meio de montagem preferencial porque a alta viscosidade não comprimir o tecido e melhor mantém a morfologia quando comparado aos meios de montagem hard-set.
3. imagem latente
- Imagem Iba1 células positivas na seção de tecido cerebral, usando um microscópio de campo claro ou confocal que tem uma capacidade de aquisição de z-pilha usando um 20 X objetiva ou maior.
Nota: Parâmetros de instalação e software de imagem deve ser constante para toda aquisição de fotomicrografia de um experimento. Detalhe de excelente processo é obtido usando um 40 X ou objectivo de X 63. É possível aplicar o protocolo de análise esqueleto aqui descrito para uma Fotomicrografia inteira ou um ROI de várias célula dentro de uma Fotomicrografia maior.- Adquira imagens de 8 bits usando as configurações de software apropriado específicas para o software de microscópio.
Nota: A conversão de arquivos de 8 bits pós aquisição pode distorcer a coleta de dados. - Adquira pelo menos um 30 µm z-pilha com não mais do que um intervalo de 2 µm entre imagens usando as configurações de software adequado, específicas para o software de microscópio.
Nota: O microscópio e o software deverá permitir aquisição de imagem em um eixo X, Y e Z. Um z-pilha pode ser aumentada, e o intervalo pode ser diminuído para fornecer detalhes adicionais microglia. Em troca, imagem tempo aumentará. Use amostragem de Nyquist sempre que possível para microscopia de fluorescência.
- Adquira imagens de 8 bits usando as configurações de software apropriado específicas para o software de microscópio.
- Salve todos os arquivos como arquivos Tif, ou conforme exigido pelo software do microscópio.
- Abra os arquivos Tif no ImageJ e use a barra de ferramentas para dividir canais clicando imagem | Cor | Separação de canaise empilhar imagens clicando imagem | Pilhas | X projeto | Projeção de intensidade máxima eventualmente. Salve como arquivos. tif.
4. esqueleto análise
- Baixar FIJI ou ImageJ de < https://imagej.net/Fiji/Downloads>. Para os plugins individuais, baixar AnalyzeSkeleton(2D/3D) de < http://imagej.net/AnalyzeSkeleton>15 e baixar FracLac de < https://imagej.nih.gov/ij/plugins/fraclac/fraclac.html>16.
Nota: Todo o processo de conversão de uma fotomicrografia de uma imagem binária e esqueletizada leva menos de 1 min. - Se usando uma fotomicrografia de fluorescência, certifique-se que a imagem é de 8 bits e converter para escala de cinza para melhor Visualizar todos os coloração positiva. Use a barra de ferramentas e clique em imagem | Tabelas de pesquisa | Cinzas. Se usando uma fotografia de campo claro DAB, o primeiro uso da FFT bandpass filtrar plugin (usando a barra de ferramentas clicando processo | FFT | filtro passa-banda) e em seguida, converter em tons de cinza.
Nota: Para efeitos do presente protocolo, as configurações padrão do ImageJ para um filtro passa-banda de FFT são suficiente (filtro até 3 pixels, até 40, sem supressão de listra). Aplicar um filtro passa-banda FFT remove o ruído (pequenas características), preservando os aspectos de maiores total da imagem. Isto é especialmente útil em imagens de campo claro, onde se divide e rachaduras no tecido podem aparecer como plano de fundo e assim complicar a análise esqueleto18. - Ajuste o brilho e o contraste, se a imagem é muito fraca e não pode ser visualizado o processo microglia. Use a barra de ferramentas e clique em imagem | Ajustar | Brilho/contraste. Ajuste os controles deslizantes de máximos ou mínimos, conforme necessário, até as bordas do histograma, mas não mais.
Nota: No ImageJ, brilho e contraste são alteradas, atualizando a tabela de pesquisa da imagem (LUT), então os valores de pixel são inalterados. Controles deslizantes de Max e min controlam os limites superiores e inferiores da faixa de exibição, com valores de pixel acima 255 aparecendo branco e pixel abaixo 0 aparecendo preto18. No caso de fotomicrografias de fluorescência, o máximo controle deslizante deve ser usado, Considerando que o controle deslizante mínimo será usado para fotomicrografias de DAB manchado microglia. - Executar um filtro Unsharp Mask para aumentar ainda mais o contraste usando a barra de ferramentas clicando processo | Filtros | Unsharp Mask. Para efeitos do presente protocolo, as configurações padrão do ImageJ (raio de 3 pixels e peso de 0,6 de máscara) são utilizados.
Nota: Unsharp Mask aguça e aprimora os recursos de borda de uma imagem por subtraindo uma versão desfocada da imagem (o Unsharp Mask) do original e em seguida, mesclando a imagem resultante com uma versão de alto contraste da imagem original. Portanto, o filtro Unsharp Mask não cria detalhes, mas prefiro esclarece o detalhe existente em uma imagem. Será o raio definindo alterações como embaçado o Unsharp Mask (e assim quanto borrão será removido), e o peso da máscara definindo alterações do grau de contraste que será mesclado com o Unsharp Mask (e, portanto, ajusta o contraste da imagem final). - Execute uma etapa de despeckle para remover o sal e pimenta ruído gerado pelo Unsharp Mask. Use a barra de ferramentas e clique em processo | Ruído | Remoção de manchas.
Nota: Despeckle remove o ruído sal e pimenta, substituindo cada pixel com o valor mediano em sua vizinhança de 3 × 3. O efeito é que outliers no intensidade são substituídas pelo pixel mediano, sem afetar a nitidez das arestas18. - Converter a imagem para binário usando a barra de ferramentas clicando imagem | Ajustar | Limiar de.
Nota: Limiarização estratifica as imagens em tons de cinza para características de interesse contra o fundo e converte a imagem em binário18. - Aplicar o despeckle, perto-e remover funções de valores atípicos: na imagem binária resultante, pode haver ruído de fundo único pixel e as lacunas entre processos.
- Aplicar a função despeckle usando a barra de ferramentas clicando processo | Ruído | Remoção de manchas.
Nota: Aplicando despeckle para o binário imagem remove qualquer ruído de single-pixel restante. - Aplicar a função fechar usando a barra de ferramentas clicando processo | Binário | Perto.
Nota: Este plugin se conecta dois pixels escuros se eles são separados por até 2 pixels. - Aplicar a função de remover valores atípicos usando a barra de ferramentas clicando processo | Ruído | Remover Outliers.
Nota: Para efeitos do presente protocolo, brilhantes outliers são direcionados com raio de 2 pixels e um limite de 50. Este plugin substitui um pixel outlier clara ou escura pelos medianos pixels na área circundante, se ele se desvia em mais de um determinado valor (limiar)18.
- Aplicar a função despeckle usando a barra de ferramentas clicando processo | Ruído | Remoção de manchas.
- Salve a imagem como um arquivo separado para futura análise de utilização e/ou fractal e carnívoras a imagem usando a barra de ferramentas clicando processo | Binário | Esqueletizar.
- Selecione a imagem esqueletizada e executar o plugin AnalyzeSkeleton(2D/3D) usando a barra de ferramentas clicando Plugins | Esqueleto | Analisar o esqueletoe marcando a caixa de informações do ramo.
Nota: É provável que o processamento de imagem exigirá otimização com a adição ou exclusão das etapas sugeridas acima. Neste processo, imagens esqueletizadas são avaliadas pela precisão, criando uma sobreposição de esqueleto e a imagem original. Somas devem ser pontos de origem única com processos emanando do centro; circulares somas confundem os dados e devem ser evitadas através do ajuste do protocolo. Um exemplo de um ponto de origem único versus circulares somas é ilustrado na Figura 1.
Problemas comuns, resultando em não-representativo esqueletos e sugeriu soluções:
- Imagem fraca: converter para escala de cinzentos, ajuste os controles deslizantes de brilho/contraste, e/ou aplicar máscara de nitidez
- Muito fundo: ajuste os controles deslizantes de brilho/contraste, aplicar Despeckle, e/ou remover valores atípicos
- Circulares somas em imagem esqueletizada (particularmente para imagens de fluorescência): aplicar filtro FFT Bandpass, e/ou máscara de nitidez
- Rachaduras no tecido (particularmente para campo claro imagens): aplicar filtro FFT Bandpass, e/ou remoção de manchas
- Copiar todos os dados a partir dos resultados e informações do ramo saídas e colar os dados em uma planilha do Excel.
- No Excel, os dados para remover fragmentos de esqueleto que resultam de IHC e imagem aquisição da guarnição.
- Duplicar a pasta de trabalho do experimento com a saída de dados brutos de análise esqueleto e adicionar a guarnição para o nome do arquivo. Filtragem de dados subsequentes todos deve ocorrer na pasta duplicada para preservar os dados brutos para uso futuro e referência.
- Determine qual comprimento dos fragmentos será cortado do dataset abrindo a imagem esqueletizada no ImageJ e selecionando a ferramenta de linha. Medir vários fragmentos, tomando nota do comprimento médio e decidir sobre um valor de corte.
Nota: Para efeitos dos dados aqui apresentados, o comprimento de corte para fragmentos indesejados é 0,5. Esse valor deve ser consistente ao longo de um conjunto de dados. - Costume classificar a planilha do Excel por clicando em classificar & filtrar | Classificação personalizada. Ordenar por "ponto de extremidade voxels" do maior para o menor e, em um novo nível, por "Mx ramo pt" do maior para o menor.
- Remover todas as linhas que contém 2 pontos de extremidade com um comprimento máximo de ramificação de menor que o valor de corte (i. e., 0.5). Soma os dados na coluna de pontos de extremidade para calcular o número total de pontos de extremidade coletados a partir da imagem.
- Repetição de dados de informações de filiais: classificar por 'comprimento de ramo' do maior para o menor. Percorrer os dados e remover todas as linhas que tem um comprimento de ramo de menor que o valor de corte(i. e., 0.5). Soma os valores na coluna de comprimento de ramo para calcular o comprimento somado de todos os ramos coletados a partir da imagem.
- Repita etapas 4.11.3-4.11.5 para cada imagem/folha até que todos os dados foram aparados e resumidos.
- Divida os dados de cada imagem (somados o número de pontos de extremidade e resumiu o comprimento do ramo) pelo número de somas microglia na imagem correspondente. Introduza os dados finais (pontos de extremidade/celular & ramo comprimento/célula) no software estatístico.
Nota: Os dados de comprimento/células filial somados podem exigir conversão mícrons de comprimento em pixels.
5. análise fractal
Nota: FracLac é capaz de executar uma série de análises de forma diferente que não são abordados no presente protocolo. Para uma explicação mais detalhada de FracLac de várias funções, consulte o manual do FracLac em < https://imagej.nih.gov/ij/plugins/fraclac/FLHelp/Introduction.htm> e referências associado 2,16,19. Análise fractal utiliza as etapas do protocolo 4.1-4.7 descrito acima.
- Determine o tamanho do ROI que será usado para todas as análises de fractal. Use a ferramenta retângulo para desenhar o ROI. Certifique-se que a caixa é grande o suficiente para capturar toda a célula e pode permanecer consistente em todo o conjunto de dados.
Nota: Use o retângulo de seleção, em vez da seleção à mão livre para garantir que todos os ROIs são o mesmo tamanho retangular, e, portanto, as células têm a mesma escala. Isto não seria o caso se a seleção à mão livre foram usada porque ImageJ irá dimensionar automaticamente um ROI quadrado para caber janelas retangulares tamanhos diferentes, resultando em células com diferentes escalas. Enquanto as formas fractais são independentes da escala, o processo de análise fractal usando FracLac para ImageJ é dependente de escala16. Assim, há a necessidade de um ROI consistentemente tamanho em toda a coleção de dados. - Selecione aleatoriamente microglia para análise fractal em cada Fotomicrografia e imagem binária correspondente. Na janela Gerenciador de ROI, selecione atualização para mirar o ROI da posição da célula. Use Ctrl + Shift + D para duplicar a área dentro do ROI como uma nova janela e salve a célula recortada. Sobre a imagem binária correspondente (a partir da análise de esqueleto), duplica a área com a mesma célula usando o Gerenciador de ROI. Repita até que um número suficiente de células foram aleatoriamente selecionado para análise fractal e salvar todos os arquivos.
Nota: Um gerador de números aleatórios e uma grade numerada podem ser usados para selecionar aleatoriamente as células. - Abra a imagem binária com a célula individual. Clique duas vezes a ferramenta pincel, defina a cor para preto e ajustar a largura do pincel conforme necessário. Usando a correspondente Fotomicrografia como referência, use o pincel para remover processos de células adjacentes, conectar processos fragmentados e isolar a célula de interesse. Uma vez que a célula binária foi isolada, salve o arquivo binário.
Nota: Segurar 'alt' passará o pincel da cor do primeiro plano (preto) para a cor de fundo (branco). - Converter a célula binária para um contorno usando a barra de ferramentas através de processo de | Binário | Estrutura de tópicos.
Nota: FracLac para Image J pode ser usado em qualquer formas sólidas ou forma descreve, no entanto, Convenção atual é usar forma descreve16. - Na barra de ferramentas, abra FracLac usando a barra de ferramentas clicando Plugins | Análise fractal | FracLac e selecione BC (contagem de caixa). A Grade de Design , configura Num G para 4. Em opções de gráficos , marque a caixa de métricas para analisar o hull convexo e círculo delimitador da célula. Ao terminar, selecione Okey.
Nota: Num G é o número de caixa contando com orientações de grade usadas durante a verificação e o intervalo recomendado para Num G é de 4-12. A configuração Num G e o intervalo sugerido é minuciosamente revisado no manual FracLac16. Aumentando Num G pode diminuir significativamente o vezes cálculo. Configurações de FracLac só precisa ser definida uma vez por sessão. Uma vez que as configurações foram inseridas, o botão Scan ficará disponível. - Selecione o botão digitalizar para executar uma verificação de contagem de caixa sobre a imagem selecionada.
Nota: A verificação irá gerar três janelas com saídas de dados: casco e resultados de círculo, arquivo de Resumo de contagem de caixa e tipos de Scan. A janela digitalizar tipos contém um log das configurações usadas, desvios, bem como o padrão para determinadas medidas. Para efeitos do presente protocolo, a janela tipos de Scan não é usada e pode ser fechada ou salvos para referência futura. - Na janela do Casco e Resultados de círculo , copiar os dados todos desejados (i. e., densidade, relação de calibração e circularidade) resultados. Na janela de Resumo de contagem de caixa , copie os dados desejados (i. e., dimensão fractal e lacunarity) resultados. Transferi os dados copiados para um arquivo do Excel ou software estatístico.
Nota: Uma lista completa da FracLac saída de dados são fornecidos e explicados no FracLac para ImageJ manual16.
Resultados
Os protocolos de análise de morfologia microglia aqui descritos resumem passos útil no processamento de lâmpadas fluorescentes e DAB fotomicrografias para Análise morfométrica. Visualmente, estas etapas são resumidas na Figura 2 e Figura 3. O objetivo dessas etapas é criar uma imagem representativa de binária e esqueletizada que modela adequadamente a Fotomicrografia original, tal que os dados acumulados são válidos. Após a aplicação do protocolo, o plugin AnalyzeSkeleton resulta em uma imagem do esqueleto marcada do que o número de pontos de extremidade e filial (i. e., processos) lengthcan ser resumido de arquivos de saída resultante. Pontos de extremidade e processar dados de comprimento são usados para estimar a extensão da microglia ramificação na Fotomicrografia ou ROI. A Figura 4 resume os dados resultantes (comprimento/célula/célula de pontos de extremidade e processo) coletados com e sem a aplicação do protocolo. Embora existam tendências similares, os dados resumidos na Figura 4F são menos variável do que aqueles em Figura 4E. Além disso, esses dados ilustram o aumento da sensibilidade para detectar diferenças entre os grupos quando o protocolo é aplicado. Por último, deve ter cuidado sobre variabilidade inter usuário na aplicação do protocolo. Tais diferenças são resumidas pela Figura 5 , onde o mesmo conjunto de dados foi analisado por dois usuários independentes aplicando um protocolo idêntico como resumidos acima.
Morfologia adicionais dados são coletados de simples células isoladas a partir das imagens binárias criadas durante a aplicação do protocolo. As etapas do protocolo para analisar a morfologia microglia antes e usando o plugin FracLac estão resumidos na Figura 6. Podemos ilustrar esta análise em ambos ilesos (figura 6A) e ferido o tecido (Figura 6B). Imagens representativas de binário, esboçado, convexo de casco/encapsular círculo e exemplos de contagem de caixa para cada célula analisados com e sem o protocolo de aplicação são mostrados na Figura 6–F. Estas imagens ajudam a ilustrar as origens das diferenças nos dados de morfologia quais são resumidas na Figura 6.
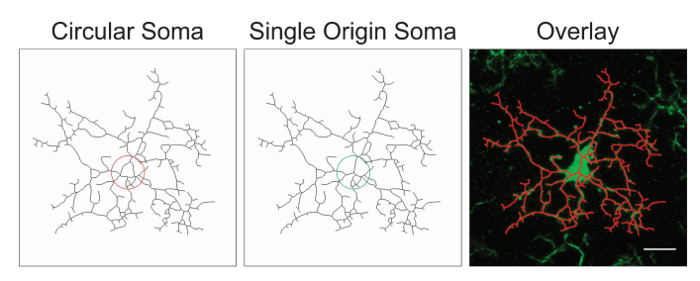
Figura 1. Ilustrações de esqueletizada microglia com uma soma circular (qualidade inferior) versus uma soma de origem única (ideal) e a correspondente sobreposição entre a célula esqueletizada e a original Fotomicrografia. Barra de escala = 10 µm. clique aqui para ver uma versão maior desta figura.
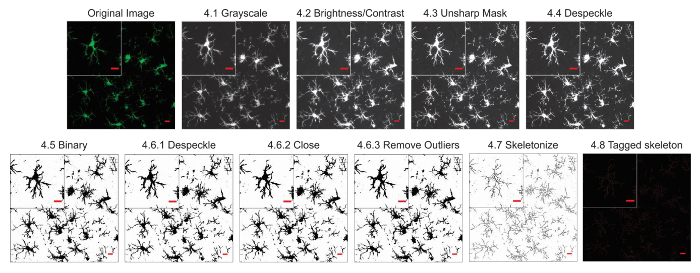
Figura 2. Protocolo de aplicativo para fluorescentes fotomicrografias. Ilustrações do protocolo esqueleto análise aplicada a uma Fotomicrografia fluorescente com uma única célula cortada para mostrar os detalhes. Barra de escala = 10 µm. clique aqui para ver uma versão maior desta figura.
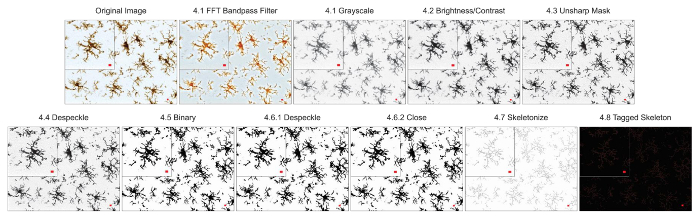
Figura 3. Aplicação de protocolo para campo claro DAB fotomicrografias. Ilustrações do esqueleto análise protocolo aplicado a uma Fotomicrografia DAB brilhante-campo com uma única célula cortada para mostrar os detalhes. Barra de escala = 10 µm. clique aqui para ver uma versão maior desta figura.
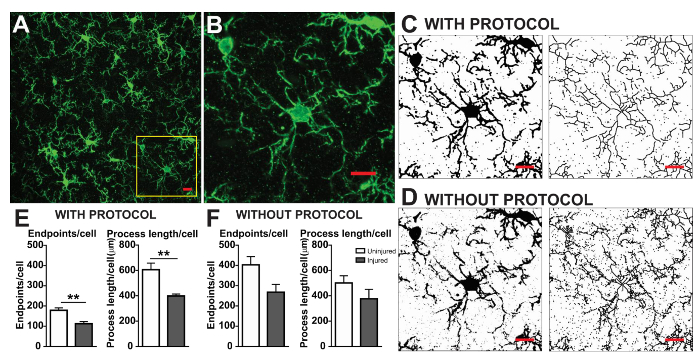
Figura 4. Análise de dados com e sem a aplicação do protocolo. (A) uma fotomicrografia de exemplo de IHC fluorescente e recortada célula que corresponde a caixa amarela em (B). Imagens de exemplo binárias e esqueletizadas com (C) e sem (D), o protocolo aplicado conforme descrito. Dados de Resumo de micróglia pontos de extremidade/célula e processo comprimento/célula em ileso (branco) e feridos (cinza) tecido cortical com (E) e sem (F), o protocolo aplicado. Análise estatística utilizando o teste t de student e n = 3, * * denota p < 0,01. Barra de escala = 10 µm. clique aqui para ver uma versão maior desta figura.
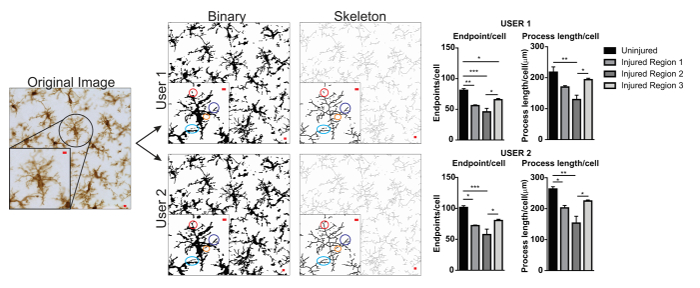
Figura 5. Diferenças do usuário com a aplicação do protocolo. Um exemplo de uma conversão de imagem e protocolo original para imagens binárias e esqueletos pelo usuário 1 e 2 do usuário. Diferenças entre as duas imagens são realçadas com correspondência de círculos coloridos. Gráficos de Resumo de dados de comprimento/célula/célula de pontos de extremidade e processo microglia em regiões do cérebro ileso e feridos pelo usuário 1 e 2 do usuário. Análise estatística com ANOVA e amostra tamanho é n = 3; p < 0.05, * *p < 0,01, * * *p < 0,001. Barra de escala = 10 µm. clique aqui para ver uma versão maior desta figura.
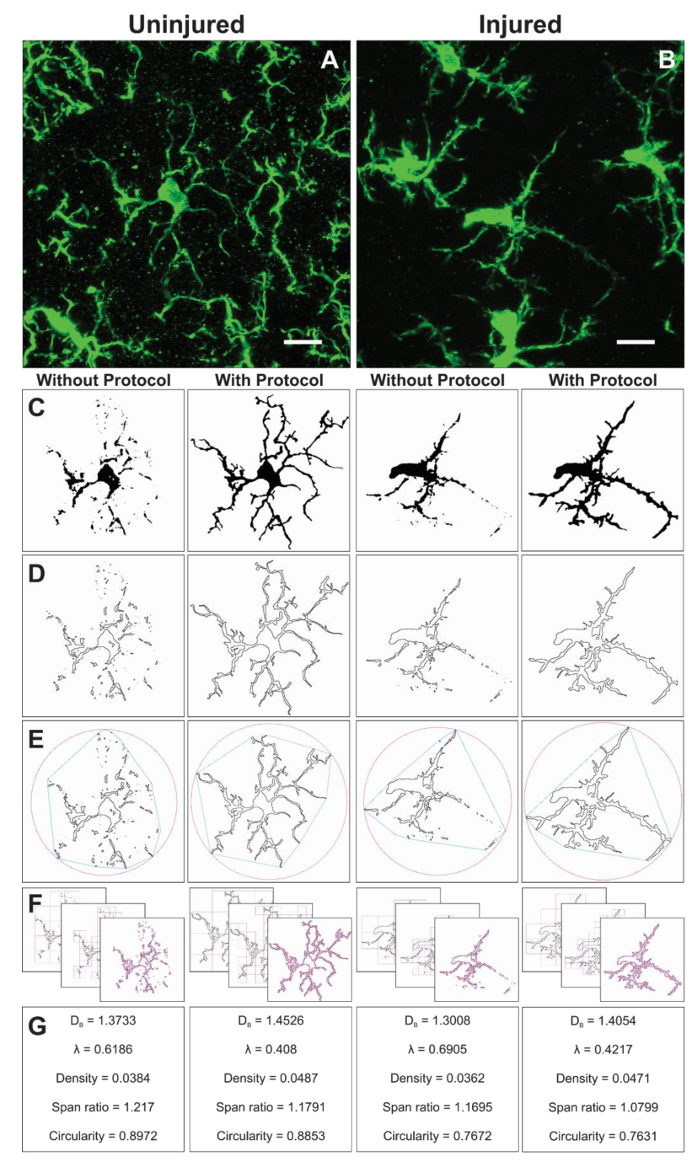
Figura 6. Análise fractal com e sem a aplicação do protocolo. Exemplo de fotomicrografias recortadas da microglia no ileso (A) e feridos (B) córtex com binário correspondente (C) e imagens de estrutura de tópicos (D) que resultam com e sem o protocolo aplicado. A superfície convexa associada (azul) e encerrando o círculo (rosa) para formas de contorno correspondente (E) são usados para calcular a densidade de forma, proporção e circularidade (G) de calibração. A caixa contando método é ilustrada em (F) e usada para cálculos de lacunarity (λ) (G) e a dimensão fractal (DB). Barra de escala = 10 µm. clique aqui para ver uma versão maior desta figura.
Discussão
As células da micróglia são finamente sintonizadas com a fisiologia e patologia dentro de seus domínios-micro e exibir uma gama diversificada de morfologias2 em sutil7,14 e prejuízo bruto8. O uso de protocolos ImageJ faz a quantificação de morfologia microglia acessível a todos os laboratórios como a plataforma e plugins são uma imagem de open source software de processamento. Enquanto o protocolo descrito é focado em processamento de imagem e análise usando este software, a consistência da coleta de dados, validade e confiabilidade começa com excelente IHC e microscopia. Este protocolo é usado para melhorar o binário, esqueleto e representações de contorno de toda fotomicrografias e células únicas, mas não pode tomar o lugar do pobre IHC coloração e microscopia que resulta em baixo contraste, borradas ou distorcidas imagens. Como uma consideração adicional, tenha cuidado para não achatar o tecido cerebral durante o armazenamento, antes do corte, o que altera irrevogavelmente microglia morfologia. Por último, dentro de cada experimento, microglia deve ser fotografada usando a mesma escala, bem como o mesmo microscópio. Instrumentação, objectivos e software variam entre microscópios que resultará em diferentes tamanhos fotomicrografias apesar de objectivos semelhantes e mudar os detalhes, bem como o número de células dentro de cada quadro. Por exemplo, aquisição de imagem usando um objectivo X 40 em uma Leica SPII resulta em duas vezes o número de células e menos detalhes do que usando um Zeiss 880 de aquisição. Isto é particularmente importante célula ramificação da recolha de dados de todo o quadro, ao invés de uma única célula, como isto se torna uma questão de amostragem de dados.
Em geral, análise de esqueleto que utiliza a Fotomicrografia toda precede a análise fractal única célula por dois motivos. Ramificação de célula determinante de todas as células em uma Fotomicrografia é rápida quando comparada à análise fractal de célula única e pode ser considerado como uma ferramenta de rastreio, se o tempo é um fator. Além disso, as imagens binárias derivadas durante a análise do esqueleto são utilizadas para análise fractal. Uma vez que a criação da imagem, há uma série de passos críticos que podem influenciar os resultados da análise de esqueleto e introduzir o usuário-influência. As etapas de protocolo que são a maioria das variáveis entre usuários estão etapa 4.2 (brilho crescente da imagem) em 4.5 (determinação do limiar). Sempre que possível, um número ideal para aumentar a luminosidade (max ou min controle deslizante entre 0-255) é determinado e mantido constante para todos os usuários e imagens. Onde a variabilidade de imagem é grande, o usuário pode escolher em vez de um brilho que pode variar entre imagens. Como alternativa, se as imagens são brilhantes e contraste é alta, então aumentar o brilho pode ser omitido e limiarização pode ser padronizada, usando um filtro de limiar de especialidade (ex., Huang) em vez do padrão mais variável. Uma vez otimizado, os parâmetros devem ser observados a fim de minimizar a influência-usuário adicional.
Um exemplo de variabilidade de usuário é apresentado na Figura 5. Valores de dados foram aumentados em usuário 1 contra 2 do usuário e, portanto, variabilidade seria aumentada se tanto usuário 1 e 2 do usuário contribuíram para a coleta de dados. Um exemplo das diferenças no usuário 1 e 2 do usuário binárias e esqueletizadas imagens são destacados por círculos coloridos (Figura 5). Neste caso, ambos os usuários foram brevemente treinados estudantes com experiência limitada no microglia. Supervisão regular e orientação por um microglia perito juntamente com protocolo maior formação2 podem reduzir a variabilidade inter-user. Embora não avaliados aqui, análise fractal é menos sujeito a variabilidade inter usuário porque células binárias são manualmente e individualmente isoladas uma Fotomicrografia ao invés de depender exclusivamente de limiarização para determinar formas de micróglia. No entanto, todos os métodos possuem uma variabilidade entre os usuários. Portanto, um único usuário (idealmente, treinado por alguma experiência nas células da microglia) deve concluir a coleta de dados para um dataset inteiro.
Modificações adicionais podem ser facilmente feitas ao presente protocolo e dependerão a qualidade da imagem e os esforços desenvolvidos para reduzir o ruído e garantir a ligação de processo. Por exemplo, se o contraste for adequada, máscara de nitidez não é necessária e pode ser omitida. É prudente otimizar e finalizar o protocolo para um conjunto específico de imagens, ambos os casos experimentais e controles, antes da coleta de dados de um conjunto inteiro. Por fim, plugins adicionais pode ser usado no lugar de outros para clarificar ou aguçar imagens que não foram descritas no presente protocolo como dilatar ou aguçar.
Vantagens do presente protocolo são sua disponibilidade universal e adaptabilidade. Além disso, avaliar a ramificação de célula usando AnalyzeSkeleton é rápida e aplicável a uma Fotomicrografia inteira. Uma vantagem da abordagem de análise de várias células é o foco de toda uma região, ao invés de células únicas. Portanto, é possível avaliar rapidamente a ramificação média (em termos de pontos de extremidade e comprimento de processo) de micróglia todos dentro da imagem. Análise de esqueleto fornece uma análise de várias células: uma amostragem de dados em termos de números de celular que não podem ser igualadas por análise fractal devido o investimento de tempo necessário para isolar células únicas de fotomicrografias. Uma instância que possa ser mais adequado seria no rastreio microglia morfologias nas proximidades de uma lesão focal. Uma limitação é o processamento de imagem de todo campo para criar modelos de esqueleto de fotomicrografias IHC é imperfeito quando comparado com a abordagem única célula mais demorada. Além disso, uma análise da região não é adequada às circunstâncias onde morfologias microglia são drasticamente diferentes dentro do mesmo campo. Por último, este método de análise é dependente da contagem de células, um parâmetro que pode ser diferente entre as condições experimentais.
Análise fractal é realizado em uma única célula e, portanto, complementa a saída de dados de ramificação de célula média resultante da análise de esqueleto. Embora muito mais demorada, este investimento produz uma ampla gama de dados morfométricos. Por exemplo, célula de densidade, relação de extensão, e dados de circularidade descrevem o tamanho, alongamento e forma de contorno da célula, respectivamente. Lacunarity e dimensão fractal resumem a célula complexidade e heterogeneidade de forma, respectivamente. É fornecido um resumo mais profundo de como cada parâmetro é calculado e como os dados podem ser interpretados no manual interativo16 e tal detalhe deve ser considerado em relação à questão específica de pesquisa. O protocolo descrito resulta em sensíveis ferramentas para quantificar pequenas mudanças em 2D microglia morfologias que podem ocorrer em condições fisiológicas e patológicas. Análise morfométrica adicionais como solidez, convexidade e fator de formulário16,20 pode ser possível se gerando formas 3D.
Adaptação e desenvolvimento de protocolo é contínuo e controlado pelo usuário. Isso foi estendido de fluorescência8 DAB/brilhante-campo imagens7 , mas ainda não tecido incorporado de parafina. -Além disso, pode ser usada em conjunto com software proprietário como hottie para análise adicional. Este protocolo pode ser aplicado a uma variedade de Fisiologia e não está limitado a microglia, mas pode ser aplicado a qualquer célula ou tecido com padrões particulares ou formas que podem ser identificadas usando métodos IHC. Por último, com tamanho de amostra suficiente, uma análise multivariada ou cluster pode ser aplicada para estratificar microglia de acordo com a morfologia de12,21; Isto é informações significativas como morfologia microglia é um indicador vital da microglia funções e respostas a seus arredors. O apreço pela diversidade morfológica microglial é importante para compreender inteiramente interações neurônio-glia-vascular durante a saúde e a doença e em expansão. Crescimento neste campo é reforçado por protocolos bem desenvolvidos, fácil de usar e pode ser reproduzidos para quantificar e resumir microglia morfologia usando múltiplas variáveis contínuas.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este estudo recebeu apoio financeiro da NINR (F32NR013611). Nós gostaríamos de reconhecer e agradecer os desenvolvedores de AnalyzeSkeleton(2D/3D) e FracLac (Arganda-Carreras et al e Karperien et al, respectivamente) sem que a análise aqui descrita não seria possível.
Materiais
| Name | Company | Catalog Number | Comments |
| primary antibody anti-IBA1 | Wako | 019-19741 | rabbit host |
| Vectashield soft mount | Vector Labs | H-1000 | |
| Secondary antibody | Jackson ImmunorResearch | 711-545-152 | donkey host |
| 4 mL glass vial | Wheaton | UX-08923-11 | |
| Triton X-100 | Fisher Scientific | BP151 | |
| Sodium Azide (NaN3) | Sigma | S-8032 | |
| glass coverslip | Fisher Scientific | 12-544-G |
Referências
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nat Neurosci. 8 (6), 752-758 (2005).
- Karperien, A., Ahammer, H., Jelinek, H. F. Quantitating the subtleties of microglial morphology with fractal analysis. Front Cell Neurosci. 7 (3), eCollection (2013).
- Taylor, S. E., Morganti-Kossmann, C., Lifshitz, J., Ziebell, J. M. Rod microglia: a morphological definition. PLoS One. 9 (5), e97096 (2014).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biol. 14 (6), e1002466 (2016).
- Wyatt-Johnson, S. K., Herr, S. A., Brewster, A. L. Status Epilepticus Triggers Time-Dependent Alterations in Microglia Abundance and Morphological Phenotypes in the Hippocampus. Front Neurol. 8 (700), eCollection (2017).
- Morrison, H., Young, K., Qureshi, M., Rowe, R. K., Lifshitz, J. Quantitative microglia analyses reveal diverse morphologic responses in the rat cortex after diffuse brain injury. Sci Rep. 7 (1), 13211 (2017).
- Morrison, H. W., Filosa, J. A. A quantitative spatiotemporal analysis of microglia morphology during ischemic stroke and reperfusion. J Neuroinflammation. 10 (4), (2013).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. J Biol Chem. 288 (21), 15291-15302 (2013).
- Xu, H., et al. Environmental Enrichment Potently Prevents Microglia-Mediated Neuroinflammation by Human Amyloid beta-Protein Oligomers. J Neurosci. 36 (35), 9041-9056 (2016).
- Rodriguez, J. J., Noristani, H. N., Verkhratsky, A. Microglial response to Alzheimer's disease is differentially modulated by voluntary wheel running and enriched environments. Brain Struct Funct. 220 (2), 941-953 (2015).
- Soltys, Z., et al. Quantitative morphological study of microglial cells in the ischemic rat brain using principal component analysis. J Neurosci Methods. 146 (1), 50-60 (2005).
- Orlowski, D., Soltys, Z., Janeczko, K. Morphological development of microglia in the postnatal rat brain. A quantitative study. Int J Dev Neurosci. 21 (8), 445-450 (2003).
- Morrison, H. W., Filosa, J. A. Sex differences in astrocyte and microglia responses immediately following middle cerebral artery occlusion in adult mice. Neuroscience. 339, (2016).
- Arganda-Carreras, I., Fernandez-Gonzalez, R., Munoz-Barrutia, A., Ortiz-De-Solorzano, C. 3D reconstruction of histological sections: Application to mammary gland tissue. Microsc Res Tech. 73 (11), 1019-1029 (2010).
- Davis, B. M., Salinas-Navarro, M., Cordeiro, M. F., Moons, L., De Groef, L. Characterizing microglia activation: a spatial statistics approach to maximize information extraction. Sci Rep. 7 (1), 1576 (2017).
- . ImageJ User Guide Available from: https://imagej.nih.gov/ij/docs/guide/ (2014)
- Karperien, A. L., Jelinek, H. F., , Fractal, Multifractal, and Lacunarity Analysis of Microglia in Tissue Engineering. Front Bioeng Biotechnol. 3 (51), eCollection (2015).
- Martyanova, E. K., Tishkina, A. O. 3D quantitative analysis of microglial morphology. available as conference preceedings SkoltechOn. , (2015).
- Fernandez-Arjona, M. D. M., Grondona, J. M., Granados-Duran, P., Fernandez-Llebrez, P., Lopez-Avalos, M. D. Microglia Morphological Categorization in a Rat Model of Neuroinflammation by Hierarchical Cluster and Principal Components Analysis. Front Cell Neurosci. 11 (235), eCollection (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados