Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Medicine
The Chick Chorioallantoic membran in vivo -modell for å vurdere Perineural invasjon i hode og nakke Cancer
Perineural invasjon er en aggressiv fenotype for hode-og nakke plateepitel celle kreftsvulster og andre svulster. Den dama chorioallantoic membran modellen har blitt brukt for å studere angiogenese, kreft invasjon, og metastasering. Her viser vi hvordan denne modellen kan benyttes for å vurdere Perineural invasjon i vivo.
Perineural invasjon er en fenotype der kreft omgir eller invaderer nervene. Det er forbundet med dårlig klinisk utfall for hode og nakke plateepitelkreft og andre kreftformer. Mekanistisk studier har vist at den molekylære crosstalk mellom nerver og tumorceller oppstår før fysisk interaksjon. Det er bare noen få in vivo-modeller for å studere Perineural invasjon, spesielt for å undersøke tidlig progresjon, før fysisk nerve-tumor interaksjoner oppstår. Den dama chorioallantoic membran modellen har blitt brukt til å studere kreft invasjon, fordi kjelleren membranen av det humant epitel etterligner den menneskelige epitel vev. Her repurposed vi den dama chorioallantoic membran modell for å undersøke Perineural invasjon, pode rotte rygg rot ganglia og menneskehode og nakke plateepitelkreft celler på den humant epitel. Vi har demonstrert hvordan denne modellen kan være nyttig for å evaluere evnen til kreftceller til å invadere nevrale vev in vivo.
Perineural invasjon (PNI) er en lite studert fenotype i kreft, som er forbundet med høy sykdom gjentakelse og dårlig overlevelse hos pasienter med hode og nakke plateepitelkreft (HNC)1. PNI er definert mikroskopisk som tumorceller innenfor eller rundt nervene2,3. Når PNI oppdages, pasienter er sannsynlig å få adjuvant behandling som valgfag nakke disseksjon og/eller strålebehandling4,5. Men disse behandlingene er aggressive, og ikke PNI-spesifikke. Faktisk er det ingen terapi for å blokkere PNI, først og fremst fordi mekanismene underliggende nerve-tumor interaksjoner er fortsatt dårlig forstått.
Ulike molekylære mekanismer har vært innblandet i nerve-tumor attraksjon; svulster og stromal celler løslate nevropeptider og vekstfaktorer for å fremme neuritogenesis6,7. Når kultivert sammen in vitro, HNC celler og rygg rot ganglia (DRG) begge har en robust respons; effekter på tumor celle invasjon og neuritogenesis kan sees etter noen dager i kultur6,8,9. Det er imidlertid en mangel på hensiktsmessig in vivo-modeller for å recapitulate tumor-nerve interaksjoner før invasjonen. Her presenterer vi en in vivo PNI modell for å studere tidlige interaksjoner mellom HNC celler og nerver6. Vi tilpasset Chick chorioallantoic membran (CAM) modell for å inkludere en neural komponent, pode en DRG i CAM, etterfulgt av en pode av kreftceller for å etterligne en innervated svulst mikromiljøet.
CAM-modellen har blitt brukt med hell for å vurdere invasjonen av celler gjennom kjeller membranen, etterligne tidlige invasive stadier av kreftsvulster og melanom10,11,12. The CAM består av øvre, humant epitel, mellomliggende mesenchyme, og lavere allantoic epitel. Den som er det samme epitel er strukturelt ligner menneskelige epitel10,13 i at kollagen-IV-rike kjeller membran simulerer kjeller membranen som skiller den muntlige epitel fra underliggende bindevev. Siden den første svulsten ble utført i cam i 191314, ble mange tilpasninger av metoden utviklet for å muliggjøre vurdering av angiogenese15,16,17, tumorprogresjon, og metastasering18. Viktigere, teknikken med pode svulster på CAM har endret seg svært lite, men søknadene er i stadig utvikling. Analyser av økende kompleksitet har blitt publisert, inkludert narkotika screening19, bein vev engineering20, og nanopartikkel-baserte anticancer narkotika21.
Vårt laboratorium bruker en CAM-DRG modell der en pattedyr DRG er isolert og podet på overflaten av den øvre CAM. Etter at DRG blir innlemmet i CAM, HNC cellene er podet nær DRG og lov til å samhandle med DRG før hele in vivo-systemet er høstet og analysert. Viktigere, systemet tillater ex-vivo visuell observasjon av både DRG og tumor ved fluorescens merking av DRG og tumorceller. Denne protokollen består av flere trinn med ulike nivåer av kompleksitet utført innen 17 dager, fra incubating egg til høsting av CAM (figur 1). Celler uttrykker ulike proteiner av interesse kan testes i denne modellen for å belyse den molekylære trasé ansvarlig for nerve invasjon i kreft, og også for screening narkotika å direkte målrette nevrale invasjon. Celler pre-behandlet med en kandidat stoffet kan være podet på CAM og forekomsten av PNI undersøkt i forhold til ubehandlede kontroller. Faktisk har CAM-modellen blitt brukt til narkotika screening som et mellom trinn mellom in vitro-studier og pre-Clinical in vivo-studier i gnagere19.
Den eksperimentelle designen vil variere med hypotesen. For eksempel, hvis du tester rollen som et bestemt protein på PNI, vil den eksperimentelle gruppen inkludere DRG-podet med tumorceller overexpressing proteinet, mens kontrollgruppen bør inkludere DRG med celler stabilt transfekterte med Tom vektor. Flere ulike eksperimentelle design kan brukes til å ta opp konkrete spørsmål.
Etikk erklæring: alle eksperimenter som bruker rotter i denne protokollen, gjøres i henhold til IACUC (institusjonelle Animal Care-og use Committee)-regler fra institusjonen vår. Eksperimenter med egg i denne studien er fritatt fra IACUC regulering.
1. egg Inkubasjons (estimert timing: 5 min, dag null)
- Få patogen-fri befruktet kommersielle Lohmann White Livorno egg, fortrinnsvis på den første dagen etter befruktning. Ruge seks egg per eksperimentell gruppe i et egg fukte inkubator på 38 ° c og 54% fuktighet i 8 dager med time rotasjon. Bruk vanlig rotasjon av eggene for å hindre embryo fra å stikke til egg membraner.
Merk: før inkubasjons, Oppbevar eggene i et kjøleskap på 18 ° c for å stanse utviklingen av embryo i maksimalt 1 uke.
2. Harvest og utarbeidelse av DRGs (estimert timing: 2 h, dag 8)
Merk: eksperimenter med mus og rotter krever godkjenning fra (IACUC). I noen land, bruk av kylling egg krever også godkjenning.
- Bli seks å syv uke-gamle Sprague Dawley rotter (~ 200 g inne vekt) å ekstra DRGs.
Merk: en rotte bør gi ~ 40 cervical og bryst DRGs. Mouse DRG integreres også i CAM, men forholdene for denne arten må optimaliseres uavhengig. - I en laminær Flow kabinett, høste DRGs fra livmorhals og bryst regioner etter protokollen for musen DRG utvinning publisert andre steder22. Følg figur 2 for orientering om hvordan å høste DRGs.
- Euthanize rotte ved CARDIAC punktering etter administrering av ketamin/Xylazine injisert intraperitonealt. Rengjør rotte huden med 70% etanol og fjern rotte ryggraden ved hjelp av en saks. Ikke Utfør cervical forvridning fordi dette ville skade cervical DRGs.
- Skill cervical, bryst og rygg områder med samme saks, etter skjematisk anatomisk representasjon og brutto bilder gitt i figuren 2a-D. Plasser ryggraden seksjoner i en 10 cm kultur parabolen med 1x PBS å holde vev våt.
- Med en delikat bein saks, åpne vertebrale bein i rygg og ventrale aspekter, skille ryggraden i to laterale halvdeler (figur 2e-F). Plasser vevs delene i en ren 10 cm rett med friskt 1x PBS.
- Bruke tang, forsiktig løsne ryggmargen fra vertebrale bein å visualisere DRGs (figur 2g).
- Med fine tang holdt under hver DRG, ta tak i den og trekke den ut fra beinet hulrom der det er fremlagt. Ikke Hold DRG direkte fordi dette vil forårsake vevsskade. Ikke trim axon bunter fra DRG (fig. 2h).
Merk: unngå å bruke korsrygg DRGs siden disse har redusert integrering i CAM. For DRG-regionen plassering, følger du skjematisk illustrasjon og brutto anatomiske bilder på figur 2a-D.
- Umiddelbart etter høsting, plassere hver DRG i DMEM kultur medium supplert med 2% penicillin/Streptomycin (pen/strep) og 10% varme-deaktivert fosterets storfe serum (FBS) for å hindre bakteriell forurensning av DRGs. gruppe alle DRGs i samme 6 cm kultur rett med 4 mL kultur medium.
- Etter høsting alle DRGs, overføre dem til en ny kultur parabol med DMEM kultur medium supplert med 2% pen/strep pluss 10% FBS og inneholder 1,25 μg/mL av rødt fluorescerende fargestoff. Ruge for 1 time i cellen kultur inkubator. I løpet av denne tiden, forberede eggene til å motta DRG som beskrevet nedenfor (trinn 3).
Merk: intervallet mellom høsting DRGs og fullføring av fluorescens merking bør være tilstrekkelig til å forberede eggene; DRGs kan oppbevares i noen timer i inkubator.
3. utarbeidelse av egg for DRG pode (estimert timing: 1 time for et dusin egg, dag 8)
- I et laminær strømnings kabinett, Demp lyset og transilluminate eggene for å se etter levedyktighet og embryonale fasen. Ekskluder egg med dårlig blodkar, ikke-befruktet egg, eller egg ikke i samsvar med dag 8 etter befruktning. Hold egget forsiktig med den naturlig forekommende luft sekken mot lyskilden (figur 3a).
- Med en blyant markerer du eggeskallet for å motta åpningene (figur 3a-B).
- Først identifisere vedlegget av utviklingsland embryo til CAM som et mørkt bevegelig fartøy festet til egg membranen og merke dette området for å unngå intervensjoner i denne regionen.
- For det andre, Velg operasjons vinduet området som et godt vascularized område minst 2 cm fra embryo vedlegget og tegne en 1,5 cm diameter sirkel. Ca 1 cm fra operasjons vinduet, tegne en 0,5 cm firkantet i et mindre vascularized område.
- Tredje, trekke luften SAC regionen for å utelukke det fra operasjonsområdet. Merk midten av luft SAC med et kors.
- Med et roterende verktøy og graverings boring, 3 mm i diameter, borer du eggeskallet på det markerte torget (figur 3c). Bruk stump tang for å fjerne egget skallet uten å fjerne den ytre egg skall membran (den hvite membranen rett under skallet) (figur 3D). Arbeid nøye for å unngå utilsiktet perforering av denne membranen.
- Ved hjelp av samme bore som i trinn 3,3, lage en finne perforering i merket korset i luften Sac området for å tillate luft strømme inn i egget (figur 3e). Vær forsiktig så du ikke bruke for mye press på egget, for å unngå å bryte eller skade den.
- Plasser 30 μL av HBSS i den firkantede åpningen, over den intakte ytre eggeskall membranen (figur 3e). Med en 30-G sprøyte nål, ta en finne perforering i den ytre membranen i dette området (figur 3F).
- Plasser egget i lyskilden for å visualisere luft SAC. Påfør press på en pipette gummi pære og legg den i den lille perforering gjort i luften Sac området (trinn 3,4). Slipp trykket i pæren til du ser separasjon av de to membraner i operasjons vinduet området (figur 3g); Gjenta dette trinnet så mange ganger som du trenger for å oppnå fullstendig separasjon av membraner i operasjons vinduet området.
- Gjenta trinn 3.1-3.6 for alle egg.
- Ved hjelp av samme drill som i trinn 3,3, bore sirkulær drifts vinduet være forsiktig med å sprekke den ytre eggeskall membran (figur 3h). Rengjør egg flaten ved å stikke en selvklebende tape for å fjerne alle løse partikler.
- Med stump tang, fjerne egget skallet fra boret området (figur 3I-J). Neste, med samme tang, fjerne den ytre eggeskall membran (figur 3k), være forsiktig med å innføre små skall partikler inne i egget for å minimere forurensning.
- Identifiser CAM omtrent på 1 cm dybde fra egg flaten. Dekk hver åpnet egg midlertidig med parafin voks membran for å unngå forurensning (figur 3l).
- Gjenta trinn 3.8-3.10 for alle eggene. Plasser eggene tilbake i egg inkubator uten rotasjon til DRGs er klar for pode.
4. pode DRG på CAM (estimert timing: 40 min, dag 8)
- Forbered en 6 cm kultur rett med HBSS medium, for å vaske DRGs før implantation. Bring forberedt egg til cellen kulturen laminær Flow kabinett. Fjern para fin membranen fra egget (figur 4a).
- Med fin steril tang, grip forsiktig en DRG fra innsiden av kulturen medium. Dypp den inn i HBSS medium for å fjerne overflødig medium som inneholder fluorescerende fargestoff. Hold DRG veldig forsiktig; ellers vil den holde seg til pinsett.
- Plasser DRG på ca-modulen, forsiktig så du ikke punktering av membranen (figur 4b-C). Om nødvendig, bruk et annet par tang for å hjelpe løsne DRG fra tuppen av Tang når du plasserer den på CAM.
Merk: holde DRG våt med HBSS medium vil også lette avløsning fra tang. - Dekk egget med en steril gjennomsiktig film dressing. Dekk alle vinduene og punktering laget i egget skallet for å unngå bakteriell forurensning (figur 4d).
- Etter å ha pode DRGs i alle egg, ruge eggene i en fukte inkubator ved 38 ° c og 54% fuktighet i 2 dager, uten rotasjon.
5. pode tumorceller på CAM (estimert timing: 1 t 30 min, dag 10)
- På 48 h før pode cellene, plate cellene som trengs i kultur plater. Beregn 0,5 til 1 x 106 celler per egg for UM-SCC-1-celler for å generere tredimensjonale SVULSTER i cam. Vær oppmerksom på at celle nummeret kan variere etter cellelinje.
- Aspirer medium og tilsett DMEM kultur medium supplert med 1% penn/strep pluss 10% FBS og 2,5 μg/mL av grønt fluorescerende fargestoff. Ruge for 1 t ved 37 ° c i cellekultur inkubator. Deretter kontrollerer fluorescens intensitet på mikroskopet, aspirer medium, vask én gang med 1x PBS, og tilsett 0,25% Trypsin i opptil 10 min. nøytralisere Trypsin med DMEM supplert medium.
- Sentrifuger på 250 x g for 4 min for å danne en celle pellet. Aspirer DMEM medium og re-suspendere i HBSS å vaske overflødig fluorescerende fargestoff. Telle celler ved hjelp av en hemocytometer.
- Bring eggene til cellen kultur laminær Flow kabinett. Med saks og tang, åpne den gjennomsiktige film dressing som dekker egget (figur 4e-F).
- Sentrifuger det beregnede antall celler igjen, aspirer HBSS medium og re-suspendere ved en endelig konsentrasjon på 0,5 til 1x106 celler per 5 μL av samme medium (figur 4G). Forbered beløpet som trengs for det totale antall egg (5 μL av celle suspensjon per egg).
- Plasser 5 μL av celle løsning på CAM, ca. 2 mm fra DRG (fig.4h). Hold uniform avstander mellom DRG og celler. Vær svært forsiktig med å forstyrre egget å minimere spredning av cellene.
Merk: Hvis du vil starte celle implantation, velger du egg der CAM-overflaten er visuelt tørr. Hvis overflaten er for våt, kan cellene spres og ikke danner vanlige svulster. - Dekk egget med en ny film dressing som i trinn 4,4. Pode cellene i alle eggene. Ruge eggene i en fukte inkubator ved 38 ° c og 54% fuktighet i 7 dager, uten rotasjon.
6. høsting av CAM (estimert timing: 1 time for dusin egg, dag 17)
- Forbered 6-brønn plater med 4% PFA (paraformaldehyde) pH 7.0, en brønn per egg, 2 mL per brønn.
- Bring eggene til en laboratoriebenk. Ved hjelp av en nål festet til en sprøyte for å perforere film dressing, slipp rundt 300 μL av PFA over CAM til litt stive CAM, og dermed tilrettelegge for høsting prosessen. Gjenta dette for alle eggene.
- Med en saks, fjerne den øvre halvdelen av egg skallet (der drifts vinduet er plassert) med CAM festet til det (figur 4I). Reduser størrelsen på denne halvdelen til ca 3 cm i diameter, holde den delen av CAM der DRG og tumorceller ble podet i sentrum (figur 4j). Ta tak i CAM-modulen med en fin tang og løsne den fra eggeskallet mens du plasserer den i PFA. Orientere DRG og kreftceller vendt oppover (figur 4k-L).
Merk: de 3 cm området bør inneholde både DRG og celler. Den DRG er lett sett på som en liten klump festet på CAM, men tumorceller er noen ganger vanskelig å identifisere på brutto eksamen. - Alternativt, med en saks, utvide drifts vinduet fjerne egget skallet fra toppen av egget mens du holder CAM på plass; Fjern ca 1 cm utover drifts vinduet (figur 4m) og Identifiser DRG og celler på cam (figur 4n-O). Med delikat fin tang, hold CAM på en av kantene og løft den forsiktig. Med skarp delikat saks, forsiktig klippe CAM å fjerne et sirkulært område, ca 3 cm i diameter (figur 4p), og plasser cam i PFA med DRG og kreftceller vendt oppover.
Merk: unngå å strekke eller holde CAM med tang på flere steder for å minimere vevsskade som kan generere mikroskopi artefakter. - Plasser hver CAM-membran i en brønn (figur 4L). Ta forsiktig tak i kantene av CAM for å spre vevet åpent i PFA eller rist platen forsiktig til CAM-modulen er utfoldet, for å unngå å brette gjenstander.
- Euthanize embryo (dag 17) ved rask halshogging. Fest høstes vev i PFA for 4 t ved romtemperatur. Etter fiksering, Erstatt PFA med 1x PBS og oppbevar vev i PBS ved 4 ° c til innebygging i parafin for snitting. Unngå over-fiksering som vil skade den delikate blodkar av CAM.
- Ved hjelp av en fluorescens stereomikroskopet, fotografere membraner innen 2 dager etter høsting for å unngå å miste fluorescerende signaler.
Når optimalisert, denne metoden har nær 100% DRG integrering i CAM. Representative resultater av DRG-integrering er vist i figur 5a-B. Integreringen av DRG i CAM er viktig siden det gir levedyktighet til DRG-vevet under eksperimentet. Mikroskopisk, DRG er sett i bindevev av CAM (H & E flekken). Blodårene er ofte sett inne i DRG vev, noe som tyder på at CAM blodtilførselen er pleie av podet vev. Implantert svulster er også identifisert på CAM av H & E; avhengig av hvor mye invasjon er til stede, svulster kan presentere med ingen til mange tumor øyer invadere bindevev (figur 5c-D). Den representative figur 5e-F viser høstet cam on brightfield Imaging og fusjonerte fluorescens. UM-SCC-1 celler overexpressing Galanin reseptor 2 presentert økt invasjon av DRG i forhold til kontroll celler (figur 5G-H). Kreft-DRG interaksjon er observert som kreftceller presenterer retningsbestemt invasjon mot DRG (figur 5h).
Data analyse utføres på forskjellige måter. Den retningsbestemt invasjonen av kreftceller mot DRG er observert som en dikotome variabel og antall egg presentere dette mønsteret av invasjonen telles i hver gruppe. Statistiske forskjeller mellom grupper beregnes ved hjelp av en binomiske test av proporsjoner. Nærheten mellom kreftceller og DRG, og tumor området måles ved hjelp ImageJ6 og forskjeller mellom grupper er vurdert ved hjelp av student t test. For å sikre nøyaktigheten med ImageJ-analyse, bør alle bildene fra det samme eksperimentet tas på like lys og eksponeringsinnstillinger. Etter justering bilde terskelen og lysstyrken på alle bilder ved hjelp av samme kriterier, analysere partikler verktøyet brukes til å måle tumor området og den lineære måleverktøyet måler tumor-DRG avstander. Det er viktig å bruke konstant oppsett av størrelsen på partiklene analysert for alle bilder på tvers av ulike grupper. I noen tilfeller, svulster vokse tykkere og kan måles manuelt med en digital tykkelse, slik at for et volummåling.
Ved hjelp av deler av parafin-embedded CAM vev, H & E beis eller immunhistokjemi for epitelceller (anti-cytokeratin antistoff reaktiv for menneskelige arter) kan utføres, noe som åpner for vurdering av invasjonen i bindevev. Invasjonen er kvantifisert idet antallet av svulst øy inne det binde tissue per egg. Immunofluorescence for kollagen IV kan brukes til å markere kjelleren membran. Også, hvis du bruker GFP-merket kreftceller, identifisering av disse cellene i vevet delene er tilrettelagt uten en immunhistokjemi for cytokeratin. Metastasering og angiogenese analyse i cam eksperimenter diskuteres andre steder10,17.
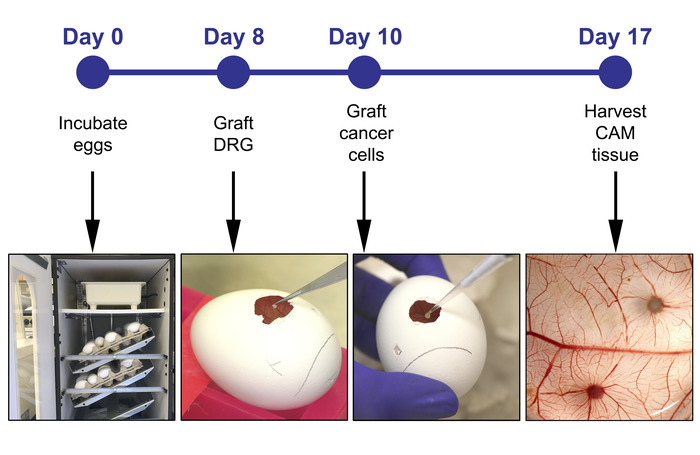
Figur 1: tidslinjen for eksperimentet, inkludert de viktigste trinnene på dag 0, 8, 10 og 17. Vennligst klikk her for å se en større versjon av dette tallet.
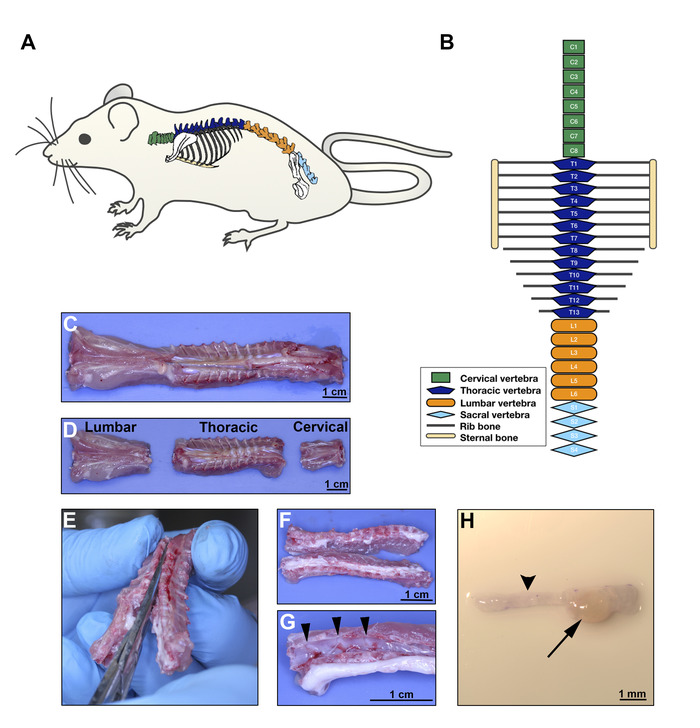
Figur 2: DRG-ekstraksjon på dag 8 . A. Rat skjematisk illustrerer den anatomiske plasseringen av ryggraden. B. diagram av rotte virvler konfigurasjonen viser ulike kroppens regioner; grønn for livmorhals, mørk blå for bryst, oransje for korsrygg og lys blå for sakral ryggrad. C-D. Ventrale aspekt av rotte ryggraden etter kirurgisk forbrukeravgift; separasjon av regionene som illustrert i B. E. disseksjon i ryggsøylen for å åpne kanalen for ryggmargen, som skiller vertebrale kropper i to laterale seksjoner som inneholder DRGs. seksjon skal skjære gjennom rygg og ventrale aspekt av hver vertebrale bein på midtlinjen. F. brutto aspekt av åpnede bryst ryggraden. G. etter at ryggmargen er forskjøvet, DRGs er lett synlige i vertebrale kanaler (pilhodene peker 3 DRGs). H. Stereomicroscopic bilde av en DRG (pil) med tilsvarende axon bunter (pil hode). Skala stolper: C, D, Fog G, 1 cm; H, 1 mm. Vennligst klikk her for å se en større versjon av dette tallet.
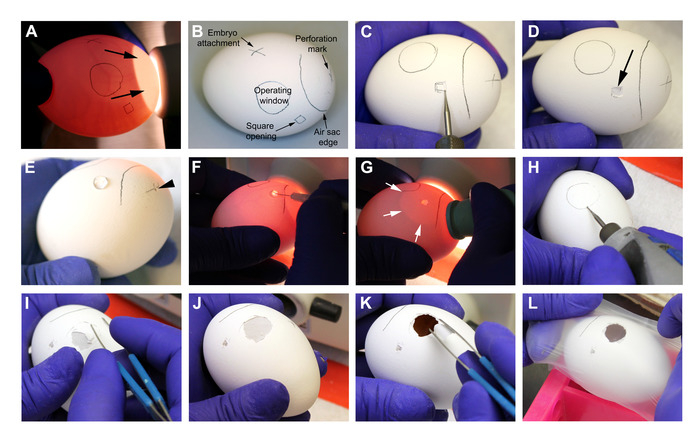
Figur 3: utarbeidelse av eggene på dag 8. A-B. Identifisering av egg blodkar og markeringer før inngrepet. Piler på et punkt til den naturlig forekommende luft SAC. C-D. Boring og åpning av eggeskallet på det firkantede åpnings merket. Pil på D peker til intakt ytre egg skall membran etter fjerning av skallet ved hjelp av stump tang. E. den markerte korset på luften SAC er perforert med boret for å tillate luftstrømmen inn i egget (pil hodet). 30 μL av HBSS medium er plassert på den ytre eggeskall membranen på den firkantede åpningen. F. med en fin sprøyte nål, den ytre eggeskall membranen er PERFORERT der HBSS var tidligere plassert. G. Pressure påføres en gummi pipette pære mens feste den til perforering boret på luften SAC. Når finger trykket slippes, luft er støvsuges, genererer en kunstig luft sac (hvite piler) som skal utvide til drifts vinduet. H. kantene av drifts vinduet er boret i en nesten parallell posisjon til eggeskallet, for å unngå utilsiktet perforering. I-J. Fjerning av eggeskall med stump tang. K. Fjern den ytre eggeskall membranen med stump tang, vær forsiktig så du ikke innfører partikler på CAM-modulen (observert ved ̴1 cm under overflaten). L. egg dekkes midlertidig med en parafinvoks membran og settes tilbake i inkubator. Vennligst klikk her for å se en større versjon av dette tallet.
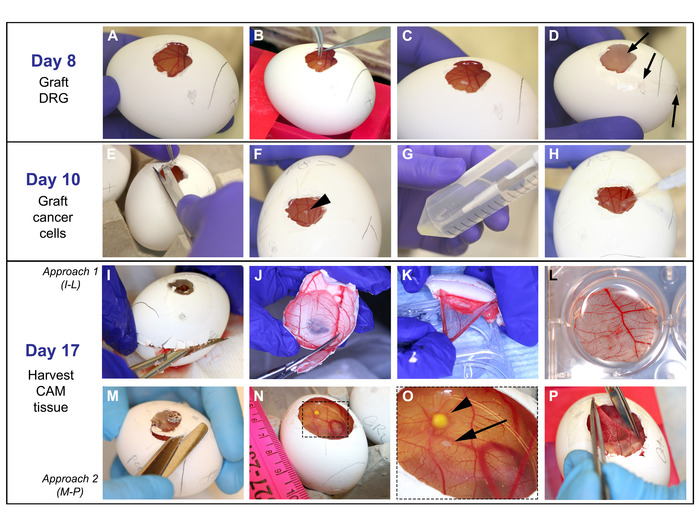
Figur 4: pode av DRG, celler, og høsting av cam: på dag 8: A. CAM lett observert etter parafin voks membran fjerning. B-C. Med fin tang, er DRG plassert på CAM. D. egg er dekket med film dressing og satt i inkubator; pilene peker på åpningene som er dekket. På dag 10: E-F. Film dressing er fjernet og DRG er plassert (pil hodet på F). G-H. 5 μL av celle løsning slippes på CAM på en ~ 2 mm avstand fra DRG. På dag 17: i-L og M-P demonstrere to ulike tilnærminger brukes til å høste cam. I. egg Shell åpnes med en fin saks som starter på luften SAC boret perforering til den øvre halvdelen av egget er fjernet. J. egg Shell som inneholder cam er redusert i størrelse til ca 3 cm. K-L. Med fin tang, er CAM løsrevet fra egget skallet og plassert i PFA. M-O. Utvidelse av drifts vinduet er utført for å visualisere DRG og kreftceller på CAM. Pilspissen peker på tumor og pilen peker til DRG. P. The cam er forstått med fine tang, skåret ut med en skarp saks, og PLASSERT i PFA som vist i L. Vennligst klikk her for å se en større versjon av dette tallet.
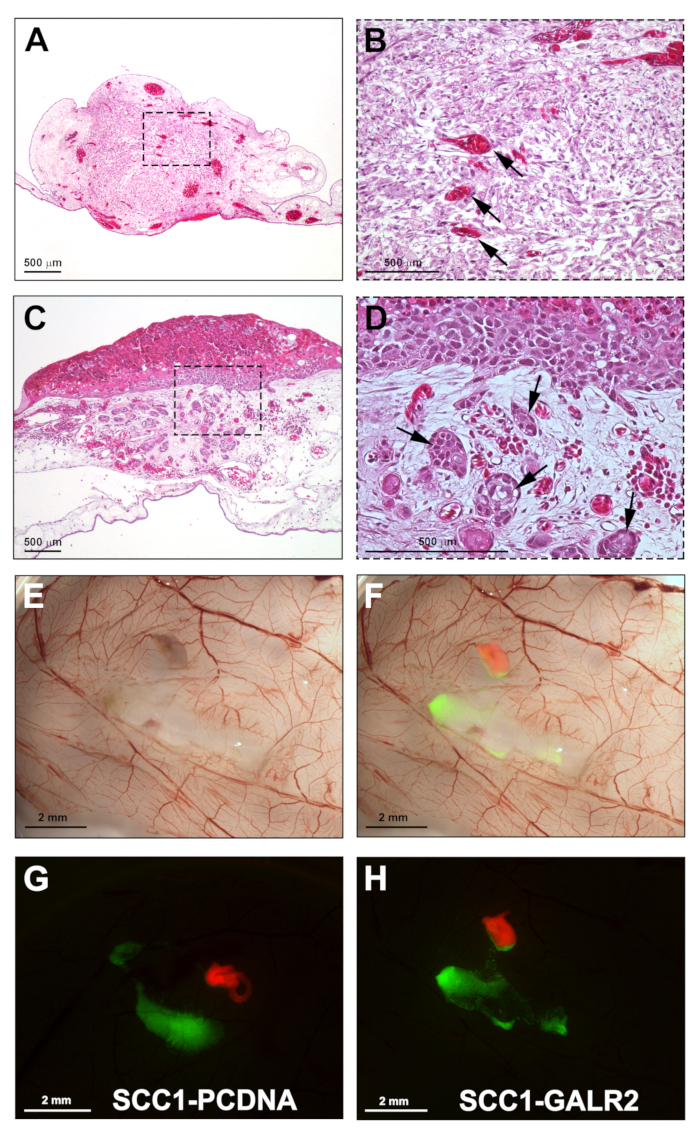
Figur 5: representative resultater. A. H &Amp; E delen viser integrering av DRG i cam. B. høyere forstørrelse av A; piler viser CAM blodkar i DRG. C. UM-SCC-1 celler PODET på cam og høstet fire dager etter pode (H & E flekken). D. høyere forstørrelse av C viser INVASIVE tumor øyer i cam bindevevet (piler). E. Gross stereomicroscopic bilde av cam-PODET med UM-SCC-1-GALR2 celler og rotte DRG, høstet på dag 17. F. fusjonerte fluorescens og brightfield bilder fremheve DRG merket i rødt og kreftceller merket i grønt. G-H. Fluorescens omikroskopi av CAM podet med DRG og UM-SCC-1-GALR2 versus kontroll celler, som illustrerer retningsbestemt invasjon av UM-SCC-1-GALR2 celler til DRG (H). Vektstenger: A-D, 500 μm; E-H, 2 mm. Vennligst klikk her for å se en større versjon av dette tallet.
| Trinn | Problem | Grunn | Løsning | ||||||
| 3.2.1 | Kan ikke identifisere embryo-vedlegget. | Vedlegg posisjon er vanskelig å se mens egget er fortsatt. | Roter egget raskt sidelengs for å kunne se et langt fartøy festet til egg membranen. | ||||||
| 3,3 & 3,8 | Perforering av den ytre eggeskall membranen under boring. | Feil posisjonering av boret. | Plasser boret nesten parallelt med eggeskallet mens du borer. Hvis membranen er perforert i trinn 3,3, er det ikke nødvendig å utføre ytterligere perforering med nålen som angitt i trinn 3,5. Hvis blødningen skjer, kast egget. | ||||||
| 4,3 for alle | DRG holder seg til tang. | DRG er tørr. | Våt DRG igjen i HBSS og/eller bruke en fin nål for å hjelpe løsne DRG fra pinsett. | ||||||
| 5,2 for alle | Celler er ikke perfekt merket med fluorescerende fargestoff. | Inkubasjonstid. Noen celler krever mer tid til å merke. | Hold celler for en ekstra time i Media med fluorescerende fargestoff. | ||||||
| 5,6 for alle | Luftboble på celle drop. | Bruk all væsken i pipette spissen. | Legg 1μL mer enn ønsket volum og ikke bruk siste μL av pipette når implanting celler. Dette vil unngå luftbobler i cellene mix. | ||||||
| 6,3 for alle | Kan ikke identifisere DRG eller celler ved høsting av ca-modulen. | Liten DRG, DRG fikk fordrevet, kreftceller spredt. | Hvis DRG ikke er sett, høste et større område av CAM og plassere i en større beholder for fiksering. Kontroller DRG og celle posisjon under fluorescens i et stereo mikroskop, og skjær deretter CAM-modulen til en mindre størrelse for para fin innebygging. | ||||||
Tabell 1: feilsøkings tabell
Den CAM-DRG in vivo-modellen som presenteres her løser underskudd av tidligere modeller ved å demonstrere nerve-tumor interaksjon før fysisk invasjon av nerve av tumorceller. De fleste in vivo studier av PNI fokus på tumor spredning og hemming av motorisk funksjon, og er avhengig av direkte injeksjon av tumorceller i ischias nerver23,24,25. Den ischias nerven injeksjon er en in vivo modell av PNI der kreftceller injiseres i en mus eller rotte ischias nerven der svulsten senere vokser. Injeksjon modeller er nyttig å vise destruktive tumorprogresjon og smerte som følge av tumorceller i nerver. Den ischias nerven modellen er også egnet for studiet av faktorer som gjør at kreftceller til å trives i nerve, men mangler evnen til å evaluere den tidlige fasen av PNI, fordi den introduserer celler direkte inn i nerve, omgåelsen nerve hylser. I en annen tilnærming, kirurgisk implantert orthotopic tumor er blitt brukt til å karakterisere betydningen av adrenerge og kolinerge nervefibre for å fremme prostatakreft Progresjon, og dermed antyder en fremtredende rolle nerver i tumorprogresjon 26. denne modellen besto av kjemiske ablasjon av murine sympatiske og parasympatiske nerver. Den parasympatiske fibrene infiltrere tumor vev, en prosess knyttet til PNI, men modellen ble ikke spesielt brukt til å vurdere fysisk interaksjon mellom nerve og tumor. CAM-DRG-modellen gjør det mulig å undersøke samspillet mellom nerven og kreften under PNI. Videre er murine modeller dyre og tidkrevende sammenlignet med CAM-modellen. Vi foreslår at du bruker CAM-DRG-modellen for mekanistisk studier av PNI.
Noen fordeler til CAM-DRG tilnærming inkluderer vurdering av PNI og andre fenotyper, slik som tumor vekst, metastasering, og angiogenese. Identifisering av menneskelig DNA på nedre CAM og/eller i leveren kan brukes til påvisning av metastasering av menneskelig kreftcelle linjer10, en mer følsom eksperimentell tilnærming i forhold til vev snitting og farging, som kanskje ikke avslører små metastaser.
CAM-DRG-metoden har noen begrensninger, inkludert den korte observasjons tidsrammen. Immunforsvaret av embryo er fysiologisk aktiv ved dag 1827, når avvisning og en inflammatorisk prosess kan finne sted, begrenser eksperimentell tid. Det er også viktig å vurdere avstanden når pode tumorceller nær DRG; større DRG-kreft avstander kan svekke den molekylære interaksjoner mellom tumorceller og nerve, eller kan forsinke den fysiske kontakten mellom begge komponentene i modellen. Også, hvis embryo er eldre enn fastsatt i denne protokollen, embryo bevegelser kan fortrenge tumorceller. Derfor er det viktig å bruke egg i samsvar med dag 10 post-befruktning for celle pode.
Siden immunsystemet er ikke fullt utviklet før dag 1827, tumor MIKROMILJØET i cam er lik som i aper murine modeller ofte brukt for kreft studier. Derfor er denne modellen ikke er nyttig å vurdere rollen til immunceller i tumorprogresjon. En annen begrensning er begrenset tilgjengelighet av reagenser for kylling arter, slik som antistoffer, cytokiner og primere.
Nøyaktig utføring av denne protokollen krever praksis; men det kan gjøres av et laboratorium medlem uten behov for en spesialisert kjerne anlegget. Boring av eggeskall krever trening. Øve på dagligvarer (ikke-befruktet) egg anbefales før du prøver denne modellen for første gang. Høy embryonale overlevelse og suksess av modellen kan oppnås hvis noen kritiske skritt for å unngå smitte følges: hensiktsmessig antibiotika forebygging av DRGs i 2% penn/strep, arbeider i en laminær Flow kabinett, og unngå spredning av egg Shell partikler på CAM-modulen. Det er også avgjørende å holde stabil fuktighet under den totale egg inkubasjonstiden. Vi anbefaler å øke antall egg per gruppe til teknikken er mestret. De hyppigste problemene for uerfarne laboratoriepersonell er egg forurensning og unøyaktig teknikk for celle pode.
DRG høsting krever også opplæring; praksis i høsting DRGs for in vitro eksperimenter8 før du prøver in vivo-modellen anbefales. Den in vitro DRG kulturen er en mulighet til å optimalisere forholdene og bedre teknikk for å forkorte varigheten av DRG utvinning. Spesiell oppmerksomhet til høsting teknikken er nødvendig når fatte den DRG med tang. DRG skal ikke holdes direkte; Trykk skal påføres under den. Vi anbefaler bruk av forstørrelsesglass for å bedre visualisere DRG under ekstraksjon.
Viktigere, når du utfører denne modellen for første gang, bør alle forhold optimaliseres for ønsket cellelinje. Denne modellen ble optimalisert for rotte DRG og HNC cellelinje UM-SCC-1. Bruk av musen DRG og andre kreftcelle typer kan kreve optimalisering. Med en høyere konsentrasjon av podet celler, svulster tendens til å vokse tykkere og stivere, noe som forenkler tumor målinger. Tatt i betraktning flere egg for hver gruppe og en passende konsentrasjon av celler for hvert egg, flere millioner celler kan være nødvendig for hvert eksperiment. For å lette planleggingen, bør kunnskap om dobling tid av cellene tas i betraktning. For noen kritiske trinn i denne protokollen finnes det en feilsøkings tabell (tabell 1).
Forfatterne erklærer ingen konkurrerende interesser.
Dette arbeidet ble støttet av NIH/NIDCR tilskudd DE027551 og DE022567 (NJD).
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin-EDTA (1x) | Gibco | # 25200-056 | |
| ACE light source | SCHOTT North America, Inc. | Used to transilluminate the eggs | |
| CellTracker Green CMFDA fluorescent dye | Life Technologies | # C7025 | Reconstitute 50µg in 20µL of DMSO and stock at -20oC. Use 1µL of stock solution/mL of culture medium. |
| CellTracker Red CMTPX fluorescent dye | Life Technologies | # C34552 | Reconstitute 50µg in 40µL of DMSO and stock at -20oC. Use 1µL of stock solution/mL of culture medium |
| Cordless rotary tool | DREMEL | # 866 | Used to drill the egg shell |
| DMEM (1x) | Gibco | # 11965-092 | Dulbeecco`s Modified Eagle Medium |
| DMSO | Fisher Bioreagents | # BP231-100 | Dimethyl Sulfoxide |
| Dumont # 5 fine forceps | Fine Science Tools (FST) | # 11254-20 | Used to harvest DRG |
| Egg incubator | GQF Digital Sportsman | # 1502 | Egg incubator equipped with automatic rotator, digital thermostat, temperature and humidity controls |
| Engraving cutter | DREMEL | # 108 | Used to drill the egg shell |
| Extra fine Graefe forceps, curved | Fine Science Tools (FST) | # 11151-10 | Used to graft DRG onto the CAM on day 8 and to harvest CAM tissue on day 17 |
| Extra fine Graefe forceps, straight | Fine Science Tools (FST) | # 11150-10 | Used to graft DRG onto the CAM on day 8 and to harvest CAM tissue on day 17 |
| Fertilized Lohmann White Leghorn eggs | Fertilized eggs at early fertilization days, preferably on first day post-fertilization. Eggs used in this protocol are from Michigan State University Poultry Farm. | ||
| Filter Forceps | EMD Millipore | # XX6200006P | Blunt forceps used to remove the egg shell |
| Fine surgical straight sharp scissor | Fine Science Tools (FST) | #14060-09 | Used to harvest the CAM tissue on day 17 |
| HBSS (1x) | Gibco | # 14025-092 | Hank`s Balanced Salt Solution |
| HI FBS | Gibco | # 10082-147 | Heat-inactivated Fetal Bovine Serum |
| Paraffin wax membrane | Parafilm laboratory film | # PM-996 | Used to temporarily cover the egg openings until DRG grafting on day 8 |
| PBS (1x) pH 7.4 | Gibco | # 10010-023 | Phosphate Buffered Saline |
| Pen/Strep | Gibco | # 15140-122 | 10,000 Units/mL Penicilin, 10,000 µg/mL Streptomycin |
| PFA (paraformaldehyde solution) | Sigma-Aldrich | # P6148-1KG | Dilute in water to make a 4% PFA solution |
| Sprague Dawley rats (females) | Charles River laboratories | Strain code: 001 | 6-7 weeks old (190-210g in weight) |
| Tegaderm Transparent Film Dressing | 3M | # 9505W | Sterile, 6x7cm, used to cover the egg openings during incubation |
- Schmitd, L. B., Scanlon, C. S., D'Silva, N. J. Perineural Invasion in Head and Neck Cancer. Journal of dental research. 97 (7), 742-750 (2018).
- Liebig, C., Ayala, G., Wilks, J. A., Berger, D. H., Albo, D. Perineural invasion in cancer: a review of the literature. Cancer. 115 (15), 3379-3391 (2009).
- Schmitd, L. B., et al. Redefining Perineural Invasion: Integration of Biology With Clinical Outcome. Neoplasia (New York, N.Y). 20 (7), 657-667 (2018).
- Chinn, S. B., et al. Impact of perineural invasion in the pathologically N0 neck in oral cavity squamous cell carcinoma. Otolaryngology--head and neck surgery : official journal of American Academy of Otolaryngology-Head and Neck Surgery. 149 (6), 893-899 (2013).
- Tai, S. K., Li, W. Y., Yang, M. H., Chu, P. Y., Wang, Y. F. Perineural invasion in T1 oral squamous cell carcinoma indicates the need for aggressive elective neck dissection. The American journal of surgical pathology. 37 (8), 1164-1172 (2013).
- Scanlon, C. S., et al. Galanin modulates the neural niche to favour perineural invasion in head and neck cancer. Nature communications. 6, 6885 (2015).
- Amit, M., et al. Upregulation of RET induces perineurial invasion of pancreatic adenocarcinoma. Oncogene. 36 (23), 3232-3239 (2017).
- Huyett, P., Gilbert, M., Liu, L., Ferris, R. L., Kim, S. A Model for Perineural Invasion in Head and Neck Squamous Cell Carcinoma. Journal of visualized experiments : JoVE. (119), (2017).
- Ayala, G. E., et al. In vitro dorsal root ganglia and human prostate cell line interaction: redefining perineural invasion in prostate cancer. The Prostate. 49 (3), 213-223 (2001).
- Liu, M., et al. The Histone Methyltransferase EZH2 Mediates Tumor Progression on the Chick Chorioallantoic Membrane Assay, a Novel Model of Head and Neck Squamous Cell Carcinoma. Translational oncology. 6 (3), 273-281 (2013).
- Busch, C., Krochmann, J., Drews, U. The chick embryo as an experimental system for melanoma cell invasion. PloS one. 8 (1), e53970 (2013).
- Li, M., et al. The In Ovo Chick Chorioallantoic Membrane (CAM) Assay as an Efficient Xenograft Model of Hepatocellular Carcinoma. Journal of visualized experiments : JoVE. (104), (2015).
- Ota, I., Li, X. Y., Hu, Y., Weiss, S. J. Induction of a MT1-MMP and MT2-MMP-dependent basement membrane transmigration program in cancer cells by Snail1. Proceedings of the National Academy of Sciences of the United States of America. 106 (48), 20318-20323 (2009).
- Murphy, J. B. TRANSPLANTABILITY OF TISSUES TO THE EMBRYO OF FOREIGN SPECIES : ITS BEARING ON QUESTIONS OF TISSUE SPECIFICITY AND TUMOR IMMUNITY. The Journal of experimental medicine. 17 (4), 482-493 (1913).
- Ribatti, D., Nico, B., Vacca, A., Presta, M. The gelatin sponge-chorioallantoic membrane assay. Nature. 1 (1), 85-91 (2006).
- Auerbach, R., Arensman, R., Kubai, L., Folkman, J. Tumor-induced angiogenesis: lack of inhibition by irradiation. International journal of cancer. 15 (2), 241-245 (1975).
- Banerjee, R., et al. The G protein-coupled receptor GALR2 promotes angiogenesis in head and neck cancer. Molecular cancer therapeutics. 13 (5), 1323-1333 (2014).
- Ossowski, L., Reich, E. Experimental model for quantitative study of metastasis. Cancer research. 40 (7), 2300-2309 (1980).
- Nowak-Sliwinska, P., Segura, T., Iruela-Arispe, M. L. The chicken chorioallantoic membrane model in biology, medicine and bioengineering. Angiogenesis. 17 (4), 779-804 (2014).
- Moreno-Jimenez, I., et al. The chorioallantoic membrane (CAM) assay for the study of human bone regeneration: a refinement animal model for tissue engineering. Scientific reports. 6, 32168 (2016).
- Vu, B. T., et al. Chick chorioallantoic membrane assay as an in vivo model to study the effect of nanoparticle-based anticancer drugs in ovarian cancer. Scientific reports. 8 (1), 8524 (2018).
- Sleigh, J. N., Weir, G. A., Schiavo, G. A simple, step-by-step dissection protocol for the rapid isolation of mouse dorsal root ganglia. BMC research notes. 9, 82 (2016).
- Cavel, O., et al. Endoneurial macrophages induce perineural invasion of pancreatic cancer cells by secretion of GDNF and activation of RET tyrosine kinase receptor. Cancer research. 72 (22), 5733-5743 (2012).
- Guo, K., et al. Interaction of the sympathetic nerve with pancreatic cancer cells promotes perineural invasion through the activation of STAT3 signaling. Molecular cancer therapeutics. 12 (3), 264-273 (2013).
- Deborde, S., et al. An In Vivo Murine Sciatic Nerve Model of Perineural Invasion. Journal of visualized experiments : JoVE. (134), (2018).
- Magnon, C., et al. . Autonomic nerve development contributes to prostate cancer progression. 341 (6142), 1236361 (2013).
- Ribatti, D. Chick embryo chorioallantoic membrane as a useful tool to study angiogenesis. International review of cell and molecular biology. 270, 181-224 (2008).
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved