Преобразование, редактирование генома и фенотипирование азота фиксации тропических каннабацеи Дерево Параспония andersonii
В этой статье
Резюме
Parasponia andersonii является быстрорастущим тропическим деревом, которое принадлежит к семейств каннабиса (Cannabaceae) и может образовывать азотфиксирующие корневые узлы в связи с корневиком. Здесь мы описываем подробный протокол для обратного генетического анализа в P. andersonii на основе Agrobacteriumtumefaciens-опосредованной стабильной трансформации и редактирования генома на основе CRISPR/Cas9.
Аннотация
Parasponia andersonii - это быстрорастущее тропическое дерево, принадлежащее семейстку каннабиса (Cannabaceae). Вместе с 4 дополнительными видами, он образует единственный известный не-бобовой линии способны установить азот-фиксации конкреции симбиоз с корневища. Сравнительные исследования между бобовинами и P. andersonii могли бы дать ценную информацию о генетических сетях, лежащих в основе образования корневых конкреций. Чтобы облегчить сравнительные исследования, мы недавно секвенировали геном P. andersonii и установили Agrobacteriumtumefaciens-опосредованные стабильные преобразования и CRISPR/Cas9 основе редактирования генома. Здесь мы предоставляем подробное описание процедур преобразования и редактирования генома, разработанных для P. andersonii. Кроме того, мы описываем процедуры прорастания семян и характеристики симбиотических фенотипов. Используя этот протокол, стабильные трансгенные линии мутантов могут быть созданы в течение 2-3 месяцев. Вегетативное распространение трансгенных линий T0 позволяет проводить эксперименты по фенотипированию через 4 месяца после совместного культивирования A. tumefaciens. Таким образом, этот протокол занимает лишь незначительно больше времени, чем переходный Agrobacterium rhizogenesоснове метод преобразования корня доступны для P. andersonii, хотя и предлагает несколько явных преимуществ. В совокупности описанные здесь процедуры позволяют использовать P. andersonii в качестве исследовательской модели для исследований, направленных на понимание симбиотических ассоциаций, а также потенциально других аспектов биологии этого тропического дерева.
Введение
Parasponia andersonii - тропическое дерево, принадлежащее семейстку каннабиса (Cannabaceae) и произрастает в Папуа-Новой Гвинее и нескольких тихоокеанских островах1,2,3. Вместе с 4 дополнительными видами Parasponia, он представляет собой единственную нелегумную линию, которая может установить азотфикирующий конкреционный симбиоз с корневищами. Этот симбиоз хорошо изучен в бобовых (Fabaceae) модели Medicago truncatula и Lotus japonicus, что привело к приобретению подробных знаний о молекулярно-генетической природе образования конкреций и функционирования4. Кроме того, было продемонстрировано, что корень узел симбиоз в бобовых основан на гораздо старше, и широко ебрмодульный микоризальный симбиоз5. Филогеномные сравнения показывают, что азотфиксирующие конкреционные симбиозы бобовых, Parasponia, а также, так называемые актинорхизальные виды растений, принимающих диазотрофные бактерии Frankia, имеют общее эволюционное происхождение 6,7,8. Чтобы определить, являются ли гены, идентифицированные для участия в образовании конкреций бобовых, частью сохраненной генетической основы, исследования небобовых видов имеют важное значение. С этой целью мы предлагаем использовать P. andersonii в качестве сравнительной исследовательской модели, наряду с бобовых, для определения основных генетических сетей, лежащих в основе формирования и функционирования корневых конкреций.
P. andersonii является пионером, который можно найти на склонах вулканических холмов. Он может удовлетворить скорость роста 45 см в месяц и достигать длины до 10 метров9. P. andersonii деревья опыляются ветром, чему способствует формирование отдельныхмужских и женских цветов 3,10. Недавно мы секвенировали и аннотировали диплоидный геном (2n no 20; 560 Mb/1C) P. andersonii,и собрали проект последовательности генома еще 2 видов Parasponia; P. rigida и P. rugosa6. Это показало, 35000 P. andersonii генных моделей, которые могут быть сгруппированы в йgt;20,000 ортогрупп вместе с генами из M. truncatula, соевый bean (Глицин макс), Arabidopsis thaliana, лесной клубники ( Fragaria vesca), Trema orientalis, черный хлопковый тополь (Populustrichocarpa)и эвкалипт (Eucalyptusgrandis)6. Кроме того, транскриптом сравнения между M. truncatula и P. andersonii определены набор из 290 предполагается ортогологи, которые отображают узел расширенной картины выражения в обоих видов6. Это обеспечивает отличный ресурс для сравнительных исследований.
Для изучения функции гена в корнях и конкрециях P. andersonii, протокол для Agrobacteriumrhizogenes-опосредованного преобразования корня был установлен11. Используя этот протокол, сложные растения, несущие трансгенные корни, могут быть созданы в относительно короткие сроки. Этот метод, также, широко применяется в бобовых симбиоз исследований12,13,14. Однако недостатком этого метода является то, что преобразуются только корни и что каждый трансгенный корень представляет собой независимое событие трансформации, что приводит к существенным изменениям. Кроме того, трансформация является переходной и трансгенные линии не могут быть сохранены. Это делает преобразование корневища на основе А. ризогеновменее подходит для редактирования генома CRISPR/Cas9. Кроме того, A. rhizogenes передает свои корневые индуцирующих локус (rol) гены в геном растения, который когда-то выразил вмешиваться с гормоном гомеостаза15. Это делает изучение роли растительных гормонов в A. rhizogenes-преобразованныхкорней сложной задачей. Чтобы преодолеть эти ограничения, мы недавно разработали протокол для Agrobacterium tumefaciensоснове трансформации и CRISPR / Cas9-опосредованный мутагенез P. andersonii10.
Здесь мы предоставляем подробное описание процедуры трансформации на основе A. tumefaciensи обратного генетического конвейера, разработанного для P. andersonii. Кроме того, мы предоставляем протоколы для обработки трансгенных растений, в ключая анализы для изучения симбиотических взаимодействий. Используя описанный здесь протокол, несколько трансгенных линий могут быть созданы в течение 2-3 месяцев. В сочетании с crispR/Cas9-опосредованный мутагенез, это позволяет эффективное производство линий мутации нокаут. Эти линии мутантов могут быть вегетативно размножаться в пробирке10,16,17, что позволяет достаточно материала, который будет генерироваться, чтобы начать фенотипической характеристики в 4 месяца после процедуры преобразования имеет было начато10. Вместе, этот набор процедур должен позволить любой лаборатории принять P. andersonii в качестве исследовательской модели для исследований, направленных на понимание rhizobial и микоризных ассоциаций, а также потенциально другие аспекты биологии этого тропического дерева.
протокол
1. Выращивайте деревья P. andersonii в теплице
-
Germinate P. andersonii WU1 семена18.
- Используйте свежие ягоды Параспонии или замочите сушеные ягоды в воде в течение 2 ч для регидратации. Сквош ягоды на листе бумаги ткани или руб против внутренней части сито чая, чтобы удалить семена.
- Дезинфицировать семена с помощью коммерческого отбеливателя (4% гипохлорит) в течение 15-20 мин, а затем мыть семена 6 раз с помощью стерилизованной воды.
- Перенесите семена в стерильные 200 ПЦР-трубки. Заполните трубки стерилизоватой водой, чтобы семена были полностью погружены в воду. Инкубировать трубки в течение 10 дней в термоцикле работает следующая программа: 30 циклов (7 градусов по Цельсию за 4 ч, 28 градусов по Цельсию за 4 ч). Не используйте нагретую крышку, так как это может убить семена.
- Подготовка SH-0 пластин (см. Таблица 1). Перенесите семена на тарелки SH-0 и инкубировать при 28 градусах По Цельсия, 16 ч.8 ч день:ночь. Закройте пластины с 2 слоями эластичной герметичной фольги, чтобы предотвратить сушки во время инкубации при 28 градусах Цельсия.
- После того, как саженцы разработали свой первый набор истинных листьев (3-4 недели после инкубации при 28 градусах Цельсия), перенесите саженцы в горшки, заполненные коммерческой почвой для заливки, и покройте саженцы полупрозрачной пластиковой чашкой, чтобы предотвратить высыхание. Поместите горшки в климатической комнате 28 градусов по Цельсию или в теплице, 85% RH, под 16 ч:8 ч день: ночной режим.
- Через 1 неделю снимите полупрозрачный пластиковый стаканчик. Вода горшки регулярно и когда деревья растут больше дополнения с удобрениями для поддержания роста.
2. Клонирование конструкций для CRISPR/Cas9-опосредованного мутагенеза П. Андерсони
ПРИМЕЧАНИЕ: Стандартные векторы бинарных преобразований могут быть использованы для стабильной трансформации P. andersonii. Вот, например, процедура создания конструкций для CRISPR/Cas9-опосредованного мутагенеза с использованием модульного клонирования (например, Золотые ворота)19.
- Определите направляющие последовательности рнковых целей для гена (ы) интереса, используя программное обеспечение биоинформатики с встроенным инструментом проектирования CRISPR. Выберите направляющие последовательности РНК, расположенные на 5'конце последовательности кодирования гена-мишени, чтобы увеличить вероятность получения полного нокаута. Убедитесь в том, чтобы проверить для вне цели эффекты путем поиска против генома P. andersonii 6.
ПРИМЕЧАНИЕ: Используйте 2 sgRNA на ген цели, предпочтительно 200-300 bp друг от друга. Это может генерировать удаления, которые могут быть определены ПЦР, а затем агарозный гель электрофорес. - Создайте конструкции 1-го уровня Golden Gate, содержащие последовательности sgRNA.
- Дизайн грунтовки для усиления каждого отдельного sgRNA путем вставки 20 bp руководство последовательность в положении N(20) в следующей последовательности грунтовки: 5'-TGTGGTCTCAATTGN(20) GTTTTAGAGCTAGAAATAGCAAG-3.'
ПРИМЕЧАНИЕ: Если направляющая последовательность равна GN(19), удалите G в конце 5', прежде чем вставить в последовательность грунтовки. - PCR усиливают sgRNAs от pICH86966::AtU6p::sgRNA-PDS20 с помощью передних грунтовок, разработанных на шаг 2.2.1 и универсальной реверсивной грунтовки: 5'-TGTGGTCAAGCGTAATGCCAACTTTGTAC-3'. Используйте высокой точностью теплостабильную ПОЛимеразу ДНК и следующие условия ПЦР: 98 градусов по Цельсию на 30 с; 30 циклов (98 градусов по Цельсию на 10 с; 53 градуса по Цельсию на 20 с; 72 градуса по Цельсию на 10 с); 72 КК в течение 7 мин. Успешные реакции ПЦР дают 165 bp ампликон.
- Колонна очищает amplicon PCR с помощью коммерческого комплекта очистки ПЦР. Впоследствии, создать Золотые ворота реакции клона sgRNAs за Arabidopsis thaliana AtU6p небольшой промоутер РНК: 10 нг sgRNA PCR ампликон, 150 нг pICSL01009::AtU6p20, 60 нг соответствующего уровня 1 приемование вектор, 2 л T4 буфер лигазы, 2 л 0,1% бычьего сывороточки альбумина (BSA), 0,5 л BsaI, 0,5 л Лигазы T4, заполняйте до 20 л ультра-чистой водой. Убедитесь, что все sgRNAs клонируются в той же ориентации, чтобы предотвратить образование шпильки.
- Инкубировать реакции в термоцикле, выполняемщем следующую программу: 37 градусов по Цельсию на 20 с; 26 циклов (37 градусов по Цельсию на 3 мин; 16 градусов по Цельсию в течение 4 мин); 50 кв. м в течение 5 мин; 80 градусов по Цельсию в течение 5 мин. Преобразуйте реакции Золотые ворота на кишечную палочку и пластину на lb-среде21, содержащую ампициллин (50 мг/л), X-Gal (200 мг/л) и IPTG (1 мМ).
ПРИМЕЧАНИЕ: Подготовьте стоковые растворы IPTG и X-Gal в ультра-чистой воде и диметилформамидии, соответственно. Фильтр стерилизовать ампициллин и IPTG фондовых решений и хранить все запасы на -20 градусов по Цельсию. Носите перчатки при обращении с диметилформамидом. - Выберите белые колонии и изолировать плазмиды с помощью коммерческого комплекта плазмидизоляции. Последовательность проверить изолированные плазмиды, прежде чем продолжить с Золотыми воротами уровня 2 сборки.
- Дизайн грунтовки для усиления каждого отдельного sgRNA путем вставки 20 bp руководство последовательность в положении N(20) в следующей последовательности грунтовки: 5'-TGTGGTCTCAATTGN(20) GTTTTAGAGCTAGAAATAGCAAG-3.'
- Соберите 2-й уровень Золотые ворота конструкций для стабильной трансформации.
- Выполните реакцию Золотые Ворота, используя уровень 1 AtU6p::sgRNA конструкций (порожденных в соответствии с разделом 2.2), а такжеpICH47802::NPTII, pICH4742::35S pro::: ЗНЛС-aCas9::35Sтер, уровень 2 приемник pICSL4723 и соответствующие конечный линкер (см. Энглер и др.22). Выполните реакции следующим образом: используйте 100 моль каждого донорского вектора и 20 моль переносчика принимает и добавляйте 2 л буфера Лигазе T4, 2 Зл 0,1% BSA, 0,5 л БпиИ, 0,5 л лигиза T4, заполняйте до 20 л с ультра-чистой водой.
ПРИМЕЧАНИЕ: Уровень 1 плазмиды pICH47802::NPTII, pICH47742::35Spro:ЗННЯ-aCas9::35Sтер должны быть клонированы первым (см. Дополнительный файл 1), как описано для sgRNAs в разделе 2.220,22 ,23. - Инкубировать реакции, как под шагом 2.2.4 и трансформироваться в кишечной палочки. Плита на среде LB, содержащей канамицин. На следующий день выберите белые колонии и изолировать плазмиды. Определите правильную плазмидную сборку с помощью анализа ограничения-пищеварения.
- Выполните реакцию Золотые Ворота, используя уровень 1 AtU6p::sgRNA конструкций (порожденных в соответствии с разделом 2.2), а такжеpICH47802::NPTII, pICH4742::35S pro::: ЗНЛС-aCas9::35Sтер, уровень 2 приемник pICSL4723 и соответствующие конечный линкер (см. Энглер и др.22). Выполните реакции следующим образом: используйте 100 моль каждого донорского вектора и 20 моль переносчика принимает и добавляйте 2 л буфера Лигазе T4, 2 Зл 0,1% BSA, 0,5 л БпиИ, 0,5 л лигиза T4, заполняйте до 20 л с ультра-чистой водой.
- Преобразование уровня 2 конструкций для Agrobacterium tumefaciens штамм AGL124.
3. Стабильная трансформация П. Андерсони
- Прививать 2 пластины LB, содержащие соответствующие антибиотики с штаммом A. tumefaciens AGL1, преобразованный с конструкцией интереса. Инкубировать тарелки при 28 градусах По Цельсию в течение 2 дней.
- Урожай молодых ветвей из тепличных деревьев. Используйте около 5 ветвей длиной 5-8 см для каждой трансформации. Убедитесь в использовании только здоровых неинфицированных ветвей. Удалите листья, разрезая их таким образом, что 1 см2 листа ткани остается в конце каждого петиола. Отбросьте листья.
- Дезинфекционная ткань в течение 15 мин с использованием 1:1-разбавленного коммерческого отбеливателя (2% гипохлорит после разбавления), содержащего несколько капель полисорбата 20. Затем промыть ткань 6 раз с автоклавированной водой.
ПРИМЕЧАНИЕ: Этот шаг, а также, следующие шаги должны быть проведены внутри ламинар вниз потока шкаф держать ткани стерильными. - Повторно приостановить A. tumefaciens клеток из 1-2 пластин в 25 мл инфильтрации среды (см. Таблица 1), содержащий ацетосирирингон (20 мг / л) и не-ионический сурфактант (0,001% v/v) для достижения оптической плотности (OD600) 5.
ПРИМЕЧАНИЕ: Подготовьте раствор запасов ацетосирингона в 70% этанола и храните при -20 градусов по Цельсию. Неионический сурфактант должен быть стерилизован фильтром перед добавлением в инфильтрационную среду. - Вырезать как стволовые и мелкой ткани в куски 1 см в длину внутри A. tumefaciens подвески, тем самым создавая свежие раны с обеих сторон. Оставьте части ткани в подвеске A. tumefaciens в течение 10-30 мин.
- Подготовьте укоренение (см. таблицу1) и добавьте ацетосирингон (20 мг/л) после автоклавирования. Сухие кусочки ткани на стерильный кусок фильтровальной бумаги и поместите его на среду (No 10 explants/plate). Инкубировать тарелки в темное время суток при 21 градусах по Цельсию в течение 2 дней.
ПРИМЕЧАНИЕ: Разрешить среде остыть до 60 градусов до добавления ацетосирингона. - После 2 дней, проверить пластины для грибковых или очевидных бактериальных загрязнений (бактерий, кроме A. tumefaciens). Загрязненные пластины должны быть отброшены.
- Подготовка жидкости SH-10 среды (см. Таблица 1). После автоклавирования добавьте полисорбат 20 (0.01%, v/v). Перенос тканей на 10 мл SH-10, содержащий полисорбат 20. В течение не менее 10 мин, осторожно агитировать каждые 2-3 мин, чтобы вымыть ткани.
- Вымойте еще два раза со свежим SH-10, содержащим полисорбат 20. В эти времена, 2-3 мин инкубации времени на стиральную ступень достаточно.
- Подготовьте укоренение (см. таблицу1). После автоклавирования добавьте цефотаксим (300 мг/л) и канамицин (50 мг/л) и залить тарелками. Для вторичных преобразований (преобразований трансгенных канамицин-устойчивых линий) нанесите гигромицин (15 мг/л).
- Сухие кусочки ткани на стерильных кусочках фильтровальной бумаги. После этого перенесите кусочки ткани на пластины, приготовленные в шаге 3.9.
- Инкубировать тарелки в течение 7 дней при 28 градусах по Цельсию, 16 ч:8 ч день:ночь. Каждые 2 дня проверяйте пластины на грибковые или бактериальные загрязнения и чрезмерный рост A. tumefaciens. В случае заражения перенесите неинфицированные кусочки на свежую тарелку.
- Через 7 дней перенесите кусочки тканей в среду распространения (см. таблицу1), содержащую цефотаксим (300 мг/л) и канамицин (50 мг/л). Инкубировать пластины при 28 градусах По кв.м., 16 ч.8 ч день:ночь. Освежайте пластины один раз в неделю, пока трансгенные побеги не разовьются. Убедитесь, что только передать неинфицированных частей ткани на свежие пластины. Отбросьте кусочки, которые заросли A. tumefaciens.
- После того, как предположительно-трансгенных побегов 1 см в длину, вырезать побеги и культуры их самостоятельно в среде распространения, содержащей цефотаксим (300 мг/ л) и канамицин (50 мг/ л). Для обеспечения того, чтобы побеги представляли независимые трансформаторы, возьмите только одну съемку с каждой стороны экспланта.
- Вегетативно размножаться по-препозно-трансгенных побегов, как описано в соответствии с шагом 5.2.
4. Генотипирование путитивно-трансгенных побегов
- Дизайн праймеров, охватывающих sgRNA признание сайта (ы). Для обеспечения секвенирования amplicon PCR, выберите грунтовки 150-250 bp от сайта распознавания sgRNA (ы).
- Вырежьте наконечник листа (5 мм) от каждой трансгенной съемки, чтобы быть генотипированным. Кроме того, урожай дикого типа контрольного образца.
- Выполните 50 ПЦР-реакций с использованием грунтовок, разработанных на этапе 4.1, и коммерческого комплекта для непосредственного усиления ДНК из образцов растений. Кроме того, ПЦР реакции могут быть выполнены на очищенной ДНК с использованием полимеразы высокой точности.
- Отдельные ампулы ПЦР на 1,5-2% агарозного геля.
- Проанализируйте результаты геля электрофорез. Проверьте наличие образцов, производящих несколько диапазонов (более 1 аллелей) и ампликонов ПЦР с размерами, отличащимися от дикого типа, что указывает на наличие средних indels.
- Последовательность ампулконов ПЦР для определения точных мутаций. Для образцов, производящих один ампликон ПЦР, продукты ПЦР могут быть секвенированы непосредственно. Образцы, которые производят более 1 полосы после геля электрофорез или которые, как представляется, гетерозиготный после прямого секвенирования ампликона ПЦР, должны быть клонированы в тупой конец клонирования вектор в первую очередь. Впоследствии, последовательность нескольких клонов для каждого образца, чтобы определить все возможные аллели, присутствующие в образце.
- Выровняйте результаты секвенирования с геном интереса и проинспектировать выравнивание для проверки на наличие мутаций вблизи целевого участка sgRNA (ы). Впоследствии проверьте, создают ли эти мутации кадры. Отбросьте линии с 2 аллелями, и линии, содержащие в кадре мутации.
- Выберите несколько строк для дальнейшего анализа.
- Распространение выбранных строк, описанных в шаге 5.2.
- Когда линии разработали несколько новых побегов, возьмите новые образцы из советов листа No3 и повторите шаги 4.3-4.7. Определите, идентичны ли мутации в каждом из образцов, происходящих из одной и той же линии, а также исходного образца ПЦР. Линии, которые дают одинаковые мутации во всех образцах, однородны и могут быть использованы для дальнейших экспериментов. Отбрасывайте линии, которые не дают тех же результатов, что и эти линии, химерные.
5. Подготовка Корневых П. Андерсони Плантлетов для экспериментов
-
Инициировать новую линию культуры ткани P. andersonii.
- Урожай подмышечные почки, молодые авантюрные побеги или лист ткани из здоровых деревьев. Кроме того, саженцы могут быть использованы в качестве исходного материала.
- Дезинфекционная ткань с использованием 1:1-разбавленного коммерческого отбеливателя (2% гипохлорит после разбавления), содержащего несколько капель полисорбата 20 на 15 мин. После этого промыть ткань 6 раз с помощью автоклавированной воды.
ПРИМЕЧАНИЕ: Этот шаг, а также, следующие шаги должны быть проведены внутри ламинарного downflow или ламинарный перекрестный шкаф, чтобы сохранить ткани стерильными. - Передача ткани в среду распространения (см. таблицу1). Закройте пластины с 2 слоями эластичной уплотнительной фольги и инкубируйте пластины при 28 градусах По кв.м,16 ч.8 ч день:ночь.
- Осмотрите пластины каждые несколько дней в течение первых 2 недель, чтобы убедиться, что ткань свободна от грибковых или бактериальных загрязнений.
- Пропируйте ткань, разместив 10 побегов на свежей пластине среды распространения и закройте пластину 2 слоями эластичной уплотнительной фольги. Инкубировать пластины при 28 градусах По кв.м., 16 ч.8 ч день:ночь. Повторите этот шаг каждые 4 недели.
- Когда побеги являются йgt;1 см в длину, вырезать побеги на их базе и поместить их на укоренение среды (см. Таблица 1). Около 10 побегов можно поместить на одну укоренетельную пластину. Позиция стреляет вертикально, вставив базальный кончик побега в среду. Корни появляются в 10-14 дней после инкубации пластин при 28 градусах По кв.м., 16 ч.8 ч день:ночь.
ПРИМЕЧАНИЕ: Не корень всех побегов, но сохранить часть для распространения культуры тканей (см. шаг 5.2).
6. Нодуляция P. andersonii Plantlets в горшках
-
Подготовка rhizobium инокулум.
- Прививать 10 мл жидкой среды YEM (см. таблицу2) из одной колонии мезорхизобия плюрифария BOR26 и инкубировать при 28 градусах Цельсия в течение 2 дней.
ПРИМЕЧАНИЕ: M. plurifarium BOR2 является предпочтительным, поскольку он эффективно конулирует P. andersonii. Тем не менее, другие штаммы rhizobium также могут быть использованы для nodulation P. andersonii (например, Bradyrhizobium elkanii WUR325, Rhizobium tropici CIAT89926,27 или Bradyrhizobium sp. Kelud2A4). - Используйте культуру 10 мл, чтобы привить больший объем жидкой среды YEM. Объем этой культуры зависит от количества горшков, которые должны быть привиты.
- Подготовка жидкой среды EKM (см. Таблицы 3, Таблица4). Центрифуги бактериальной культуры в течение 10 мин на 3500 х г для сбора клеток. Впоследствии повторно приостановить бактериальные гранулы в жидком ЭКМ (использовать примерно такой же объем, как оригинальная культура YEM) и определить оптическую плотность (OD600).
- Прививать 10 мл жидкой среды YEM (см. таблицу2) из одной колонии мезорхизобия плюрифария BOR26 и инкубировать при 28 градусах Цельсия в течение 2 дней.
- Для 20 горшков, подготовить 3 л жидкой eKM среды и прививать с корневильной подвески подготовлены на шаг 6.1.3. для достижения OD600 и 0.025.
- Смешайте 3 L EKM, содержащий ризобию с 1250 г перлита. Затем добавьте 210 г этой смеси в стерильные полупрозрачные полипропиленовые горшки. Кроме того, вместо перлита, использовать песок в качестве субстрата для кидуляции анализов.
- Завод 1-3 P. andersonii plantlets в каждом горшке. Кроме того, подготовить несколько горшков, содержащих P. andersonii растений преобразованы с CRISPR-контроль конструкции (см. Дополнительная таблица 1). Взвесьте несколько горшков, чтобы быть в состоянии определить потерю воды во время эксперимента. Обложка нижней части каждого горшка, чтобы оградить корни от воздействия света.
- Инкубировать горшки в климатизированной комнате роста (28 кв.м., 16 ч.8 ч день:ночь) в течение 4-6 недель. Раз в неделю, весят несколько горшков, чтобы определить потерю воды. Если потеря воды превышает 10 мл, дополнить ультра-чистой водой, чтобы компенсировать потерю.
- После 4-6 недель, очистить корни от перлита и определить конкреции номера с помощью бинокля для изучения эффективности нодиляции.
7. Нодуляция P. andersonii Plantlets на плитах
-
Подготовка целлофановых мембран 28.
- Вырезать целлофановой мембраны, чтобы поместиться в квадрат 12 см х 12 см Петри блюдо. Вырезать мембраны немного короче в верхней части, чтобы пространство для побегов расти.
- Чтобы увеличить проницаемость целлофановых мембран, вскипятите мембраны в растворе ЭДТА (1 г/л) в течение 20 мин. После этого промыть не менее 6 x деминерализованной водой, чтобы удалить ЭДТА.
ПРИМЕЧАНИЕ: Как сухая мембрана, как правило, морщин при контакте с водой, погрузить сухие мембраны один за другим в раствор. - Расположите мембраны горизонтально тонким слоем воды в круглой стеклянной пластине. Стерилизовать мембраны путем автоматического автоматического вуза в два раза.
- Поместите 1 автокловную целлофановой мембрану на квадратную 12 х 12 см чашку Петри, содержащую агар-затвердевшая ЭКМ-среду (см. Таблица 3, Таблица 4). Поместите два 3-недельных старых лежачем P. andersonii растения (см. раздел 5) или 4-недельные старые саженцы (см. раздел 1.1) на верхней части мембраны. Убедитесь, что только выбрать растения или саженцы с корнями, которые имеют белые кончики корня, указывая, что эти корни все еще растут.
- Аккуратно накройте корни второй целлофановой мембраной, создавая сэндвич-слой. Запечатайте тарелку 3 слоями эластичной уплотнительной фольги. Оберните нижнюю половину пластин алюминиевой фольгой, чтобы покрыть корни от воздействия света.
- Инкубировать пластины в климатизированной комнате роста (28 кв.м., 16 ч.8 ч день:ночь) в течение 3-4 недель. Отметьте положение корневых советов, чтобы следить за ростом корня с течением времени.
- Если пластины ЭКМ начинают высыхать из-за длительной инкубации, перенесите растения на свежие пластины ЭКМ за несколько дней до бактериальной прививки.
- Подготовьте бактериальный инокулум, как описано на шаг6.1.
- Удалить верхнюю клеточную мембрану и применить 1 мл культуры rhizobium (OD600 и 0,025) к корням. Впоследствии поместите новую целлофановую мембрану на привитые корни. Оберните внешнюю часть пластины с помощью алюминиевой фольги, чтобы покрыть корни от воздействия света.
- После 4 недель, изучить конкреции номера с помощью бинокля, чтобы определить эффективность нодиляции.
8. Нодуляция П. Андерсони Саженцы в мешки
- Семена germinate P. andersonii, описанные в разделе 1.1. После того, как котиледоны полностью появились (12 дней на тарелках SH-0 при 28 градусах Цельсия), перенесите саженцы в мешки.
- Для подготовки мешки, разорвать сложенный раздел бумаги фитиль и добавить 7 мл модифицированной среды EKM (см. Таблица 3, таблица 4).
- Вставьте 1 или 2 саженцы, поместив корни между обоими листами бумаги, которые образуют бумажный фитиль и передний пластиковый лист сумки.
- Защитите корни от воздействия света, складывая алюминиевую фольгу вокруг мешка. Приостановите мешки в пластиковой коробке, покрытой полупрозрачной крышкой для поддержания высокой влажности. Поместите коробку в климатизированную комнату роста (28 кв.к., 16 ч.8 ч день:ночь).
- Компенсировать испарение воды путем добавления стерильной ультра-чистой воды, как таковой, что бумажный фитиль остается влажным (избегайте стоячей воды на дне мешка). После первой недели, это обычно требует добавления 2-3 мл каждые 4 дня.
- Подготовьте бактериальный инокулум, как описано на шаг6.1.
- После того, как саженцы выращиваются в течение 10-12 дней в мешках, привить корневую систему с 500 зл культуры rhizobium (OD600 и 0,025).
- Следуйте образование конкреций во времени. Четыре недели после прививки, конкреции могут быть подсчитаны и собраны для определения эффективности нодула.
9. Анализ китоархитектуры кондука
- Соберите 10-15 уздей в трубке 2 мл, содержащей фиксатор (5% глютаральдегида в буфере фосфатов 0,1 м, рН 7,2). Нанесите вакуум на 1/2-1 ч и инкубировать на ночь при 4 градусах Цельсия. В течение этого периода образцы опускаются на дно трубки.
ПРИМЕЧАНИЕ: Фиксаторное решение может храниться при 4 градусах Цельсия в течение 2-4 недель до использования. Убедитесь в том, чтобы носить перчатки при работе с тканью фиксатор. - Вымойте узелки 2x с 0,1 М фосфат буфера, рН 7,2. Нанесите 10 минут интервалов между каждым шагом стирки.
- Обезвоживать образцы путем последующего инкубации в 30%, 50%, 70% и 100% этанола. Чтобы убедиться, что вся вода удаляется из образцов, повторите 100% этанола шаг 3x. Нанесите 10 минут интервалов между каждым шагом обезвоживания.
- Подготовка полимеризации смеси I (PM-I) путем добавления 1 пакет Хардера I до 2,5 мл PEG400 смешивается с 100 мл HEMA (2-гидроксиэтил метакрилат) на основе раствора из мисы. Перемешать раствор в течение 15 мин, чтобы полностью растворить Hardener I. Впоследствии, хранить PM-I при -20 градусах По Цельсию.
- Удалите этанол со ступени 9.3. и проникают в образцы в следующем порядке: ПМ-I:100% этанол (1:3, v/v), PM-I:100% этанол (1:1, v/v) и PM-I:100% этанол (3:1, v/v). Инкубировать образцы в каждом растворе на RT в течение 1/2-1 ч или до тех пор, пока образцы опустятся на дно.
- Инкубировать образцы на ночь при 4 градусах Цельсия в 100% РАСТВОРе PM-I.
- Подготовка полимеризации смеси II путем смешивания PM-I и Hardener II в соотношении 15:1 (v/v). Заполните пластиковую форму раствором полимеризации, ориентируйте образцы горизонтально в нижней части формы и накройте куском эластичной уплотнительной фольги. Избегайте образования пузырьков воздуха.
ПРИМЕЧАНИЕ: Как раствор начинает полимеризации при воздействии на RT, постарайтесь сориентировать образцы как можно быстрее в пластиковый держатель. Полимеризация завершается после ночной инкубации на РТ, или 1 ч при 37 градусах Цельсия. - Снимите упругаемую крышку фольги со ступени 9.7 и поместите держатель к полимеризированным образцам. Чтобы установить держатель к образцам, растворите 10 мл порошка мелины на основе метил-метакрилата в 5 мл раствора мелины на основе метил-метакрилата. Быстро добавьте раствор в отверстие в верхней части держателя.
ПРИМЕЧАНИЕ: Выполните шаг полимеризации в капоте дыма (30 мин на RT). - Образцы секции микротома толщиной 4-5 мкм. Поместите микроскоп на горячую пластину 58 градусов по Цельсию и добавьте большую каплю воды к каждой горке. Поместите секции в верхней части воды. Как только вода испарится, секции будут прилипать к горке.
- Пятно слайды, погружая в 0,05 % (w/v) толуидин синий в течение 2 мин. Впоследствии, промыть слайды 3x с ультра-чистой водой. Слайды можно наблюдать с помощью ярко-поляного микроскопа.
10. Микорризация П. Андерсони Плантлетс
-
Подготовка Rhizophagus irregularis споры 'инокулум
- Подготовьте стопку полиэстеровых фильтров со следующими размерами (сверху вниз): 210 мкм, 120 мкм и 36 мкм размера сетки.
- Pipette необходимое количество коммерческой подвески spore на стек полиэфирных фильтров. Промыть фильтры 3x с 100 мл автоматической деминерализованной воды. Споры сохраняются на поверхности фильтра 36 мкм.
ПРИМЕЧАНИЕ: Подготовьте подвеску spore в шкафе перекрестного потока laminar для того чтобы предотвратить загрязнение. - Разобрать полиэстер стек и сохранить 36 мкм фильтр только. Повторите шаг стирки с автоклавированной деминерализованной водой, по крайней мере 6x.
- Поместите фильтр на чашку Петри и повторно приостановить споры в автоклавированной деминерализованной воды. Используйте объем воды, равный объему подвески, используемой в шаге 10.1.2. Перенесите подвеску на стерильную трубку путем пипетки.
- Поместите 5 капель по 20 л суспензии на стеклянную горку и подсчитайте количество спор с помощью ярко-поляного микроскопа. Преобразование спор рассчитывает в соотношении спор / мл и разбавить споры подвески, пока не достигнет 250 спор / мл. Храните подвеску со поры при 4 градусах Цельсия.
- Выполните асссс ымикоризации. С этой целью добавьте 800 г аутоклавизированного песка, дополненного 70 мл среднего и стерильного полупрозрачного полипропилена (см. Таблицы 5-6). Смешайте песок и средний непосредственно в кастрюлю, встряхивая энергично.
- Поместите один завод P. andersonii в каждый горшок, и пипетка 1 мл суспензии прямо на корень растения P. andersonii. Убедитесь в том, чтобы включить несколько горшков, содержащих P. andersonii plantlets преобразованы с CRISPR-контроль конструкции (см. Дополнительная таблица 1).
- Инкубировать горшки в климатизированной комнате роста (28 кв.м., 16 ч.8 ч день:ночь) в течение 6 недель.
- Выньте растения из горшков и мыть корни с проточной водой, чтобы удалить как можно больше песка, как это возможно.
- Нарежьте корни на 1 см длинными кусочками и варите кусочки корня в 10% KOH (w/v) в течение 20 мин при температуре 90 градусов по Цельсию. Впоследствии поместите отварные корни на клеточный ситечко с размером сетки 100 мкм и промыть 3x 50 мл воды.
- Корни пятен с 0,05% (w/v) трипан синий в лактоглицерола (300 мл молочной кислоты; 300 мл глицерола; и 400 мл деминерализованной воды) в течение 5 мин при 90 градусах Поцельсив в водяной бане или нагревательном блоке. Впоследствии, передача корней на 30% глицерола. Образцы корней могут храниться на RT.
- Поместите 15-25 фрагментов корней на один слайд микроскопа. Добавить 30% глицерола и накрыть крышкой стекла и нажмите, пока корневые части не станут плоскими. Наблюдайте за фрагментами корней с помощью ярко-поляного микроскопа и оценка микоризальной колонизации.
ПРИМЕЧАНИЕ: Метод оценки микоризации описывается в соответствии с Trouvelot и др.29. Этот метод использует несколько классов (%F, %M и %A), что позволяет быстро оценить уровень микоризальной колонизации каждого корневого фрагмента и обилие арбускула.
Результаты
P. andersonii trees можно выращивать в кондиционированной теплице при 28 градусах Цельсия и 85% относительной влажности (рисунок1A). В этих условиях деревья начинают цвететь через 6-9 месяцев после посадки. Самка Цветов P. andersonii производит ягоды, каждая из которых содержит одно семя. Во время созревания ягоды меняют цвет; сначала от зеленого до белого, а затем от белого до коричневого(рисунок 1B). Семена, извлеченные из созреваемых коричневых ягод, хорошо прорастают после 10-дневного цикла температуры и 7-дневной инкубации на sh-0 пластинах(рисунок 1C). Проросшие семена продолжают развиваться в молодых саженцев, которые могут быть использованы для экспериментов после 4 недель(рисунок 1D).
Ранее мы показали, что черешки и сегменты молодых стеблей P. andersonii могут быть эффективно преобразованы с помощью штамма A. tumefaciens AGL110. В начале процедуры преобразования, ткани explants совместно культивируются с A. tumefaciens в течение 2 дней при 21 КС (рисунок2A). Длительное совместное культивирование приводит к чрезмерной колонизации тканей explants A. tumefaciens и, следовательно, должны быть предотвращены(Рисунок 2B). После периода совместного культивирования, ткани explants передаются в селективные средства массовой информации, что способствует росту преобразованной ткани. Две-три недели спустя, небольшие зеленые микро-калли, как правило, наблюдаются вдоль исходной поверхности раны(рисунок 2C). Эти калли должны продолжать расти и развиваться 1 или более преподобным преобразованы побеги на 6-8 недель после процедуры преобразования была начата(рисунок 2D). На данном этапе эффективность трансформации обычно колеблется от 10-30% для преобразований, инициированных с помощью тканевых экстенстов, взятых из зрелых и частично древесных ветвей(Таблица 7). Если трансформации инициируются с explants взяты из молодых и быстро растущих кончиков ветвей, которые еще не несут цветы, преобразования эффективности 65-75% может быть достигнуто (Таблица 7). Иногда, беловатый калли образуются на стороне explant, который не находится в контакте со средой и, следовательно, не испытывают канамицин выбор. Эти калли часто не трансгенные и любые побеги, образованные из этих calli, как правило, отбеливатель и умирают после прямого контакта с канамицин-содержащих среды (Рисунок 2E). В случае, если скорость преобразования низка и / или исходный материал был неоптимальным, ткани части могут стать коричневыми(рисунок 2F) и страдают от чрезмерного распространения A. tumefaciens (Рисунок2G). Для предотвращения A. tumefaciens от распространения и перерастая близлежащих explants, регулярное освежение среды необходимо, и сильно инфицированных explants должны быть удалены. После того, как отдельные трансгенные побеги помещаются в среду распространения, чрезмерное распространение A. tumefaciens, как правило, больше не происходит (рисунок2H). Трансгенные побеги могут размножаться путем распространения in vitro, что приведет к десяткам побегов в течение одного месяца(рисунок 3A-B). Эти побеги могут быть размещены на укоренение среды, которая должна вызвать образование корней после 2 недель(рисунок 3C-D). Корневые растения могут впоследствии использоваться для экспериментов.
Для создания линий мутаций нокаутом мы используем мутагенез, опосредованный CRISPR/Cas9. С этой целью мы используем бинарный вектор, содержащий ген сопротивления канамицином NPTII, последовательность кодирования Cas9, управляемая промоутером CaMV35S и 2 sgRNA на целевой ген, которые выражены из малого РНК-промоутера AtU6p20. Графическое представление конструкции, используемой для CRISPR/Cas9-опосредованного мутагенеза P. andersonii, представлено на рисунке 4A. Используя этот метод, редактирование генома наблюдается в 40% преображенно преобразованных побегов10. Для выявления линий мутантов, по-верном преобразовании побегов генотипируются для мутаций на целевом участке sgRNA (ы) с использованием грунтовок, охватывающих целевой регион. Пример ожидаемых результатов приведен на рисунке 4. Как видно из фотографии, сделанной после геля электрофорез, несколько образцов производят ампликон ПЦР с аналогичным размером с диким типом(рисунок 4B). Эти растения могут содержать небольшие индельи, которые не могут быть визуализированы электрофорексом геля агарозы или остаются неотредактированными ферментом Cas9. Кроме того, несколько образцов дают полосы, отличающиеся по размеру от дикого типа (например, линии 2, 4, 7 и 8 на рисунке 4B). В этих строках 1 (линии 4, 7 и 8) или оба (линия 2) аллели содержат большие indels, которые могут быть легко визуализированы. Точная природа мутаций на целевом участке (ы) раскрывается после секвенирования amplicon PCR. Как видно из рисунка 4C, как небольшие indels 1-4 bp, а также, большие удаления могут быть получены после CRISPR/Cas9 мутагенеза. На рисунке 4Cпоследовательность строки 1 идентична той, что иная для дикого типа, что указывает на то, что эта строка избежала редактирования и, следовательно, должна быть отброшена. Среди линий, которые содержат мутации, гетерозиготные, гомозиговые и двуэлелицамутные мутанты могут быть определены(рисунок 4C). Тем не менее, гетерозиготные мутанты, как правило, редкие10. Гомозиготные или двухаллийские мутации нокаута могут размножаться вегетативно, чтобы получить достаточно материала для фенотипического анализа. Поскольку фенотипический анализ выполняется в поколении T 0, важно проверить, могут ли линии мутантов быть химерными. С этой целью генотипирование необходимо повторять по крайней мере на 3 различных образцах, взятых из каждой линии мутантов. Если результаты генотипирования идентичны друг другу и оригинальный образец генотипирования (например, строка 8 на рисунке 4D),линия однородно мутирует и может быть использована для дальнейшего анализа. Однако, если результаты генотипирования отличаются между независимыми образцами (например, строка 4 на рисунке 4D),линия мутантов химерная и должна быть отброшена.
Прививка P. andersonii с M. plurifarium BOR2 приводит к образованию корневых конкреций (рисунок5). Как видно на рисунке 5A,эти узлы распределены по корневой системе. Козлы P. andersonii светло-коричневого цвета, но могут быть легко дискриминированы из корневой ткани на основе их формы (рисунок5B). Эксперименты с прививками в горшках и последующий рост в течение 4-6 недель обычно приводят к образованию конкреций no10-30(рисунок 6A). Аналогичное количество узелков образуется после прививки eKM пластины выращенных P. andersonii растений на 4 недели после прививки (рисунок6A). В мешках, P. andersonii саженцы обычно образуют 5-15 узелков на 5 недель после прививки (Рисунок5C-D, 6A). Для анализа цитоархитектуры конкреций, конкреции могут быть разделены и наблюдались с помощью ярко-поляной микроскопии. На рисунке 6B показан пример продольного раздела через середину конкреции P. andersonii. В этом разделе показан центральный сосудистый пучок конкреции P. andersonii, который окружен конкреционными долей, содержащими инфицированные клетки (рисунок6B).
P. andersonii plantlets также могут быть микоризации. После 6 недель прививки с R. irregularis, микоризальная частота колонизации обычно достигает йgt; 80% (рисунок6C). В этот момент времени, как правило, 30% клеток содержат арбускулы(рисунок 6C). Репрезентативное изображение корневого сегмента P. andersonii, содержащего абускулы, показано на рисунке 6D.

Рисунок 1: Репрезентативные изображения P. andersonii дерево, семена и саженцы. (A) Шестимесячное дерево P. andersonii, выращенное в заливке почвы в теплице, приодненной при 28 градусах Цельсия. (B) Представитель изображение с изображением P. andersonii ягоды на различных стадиях созревания. Молодые P. andersonii ягоды (незрелые) изменит цвет от зеленого до белого и, наконец, коричневый (зрелый) при созревании. (C) P. andersonii семена инкубируются на SH-0 среде в течение 1 недели. Черный круг указывает на проросшие рассаду. (D) Четырехнедельный P. andersonii саженцы, выращенные в SH-0 среде. Шкала баров равна 25 см в (A) и 1 см в (B-D). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
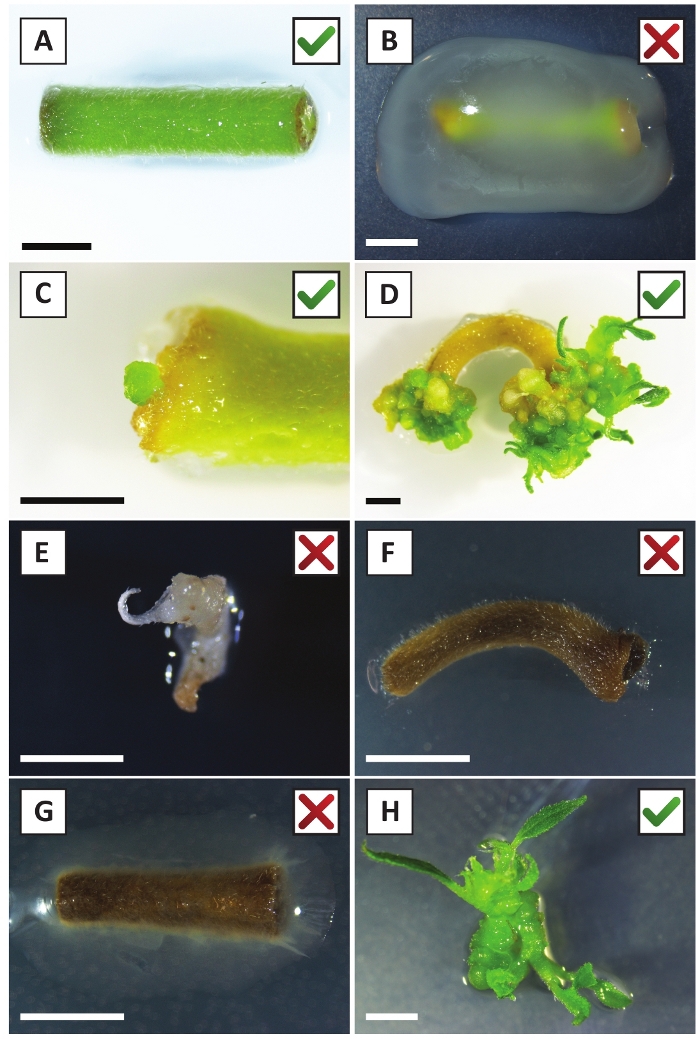
Рисунок 2: Репрезентативные изображения экспланаторов на разных стадиях процедуры стабильной трансформации. (A) Explant совместно культивируемых с A. tumefaciens. (B) Explant заросшие A. tumefaciens в течение первых 2 недель после трансформации. (C) Трансгенный микро-каллус формируется вблизи места раны explant на 2,5 недели после совместного выращивания. (D) Представитель изображение explant на 6 недель после совместного выращивания показаны появление побегов из (трансгенных) калли. (E) Представитель изображение стрелять, который становится беловатый и в конечном итоге умирает при прямом контакте с канамицин-содержащих среды. Эта съемка, скорее всего, нетрансгенных и избежал канамицина выбор при прикреплении к explant. (F) Представитель изображение неудачно преобразованного explant. (G) Представитель изображение неудачно преобразованы explant заросшие A. tumefaciens. (H) Одиночный трансгенный побег, выращенный на среде распространения на 8 недель после совместного культивирования с A. tumefaciens. Шкала баров равна 2,5 мм. Коробки, содержащие зеленые контрольные знаки или красные кресты, указывают на успешное или неудачное преобразование эксплантаторов, соответственно. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Репрезентативные изображения in vitro распространения. (A) Побеги, выращенные на среде распространения. Изображение было принято через неделю после того, как пластины были обновлены. (B) Побеги, выращенные на среде распространения. Изображение было принято через 4 недели после того, как пластины были обновлены. (C) Свежесрезаны побеги, размещенные на укоренение среды. (D) Побеги инкубируются на укоренение среды в течение 2 недель. Обратите внимание на наличие корней. Шкала баров равна 2,5 см. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой фигуры.
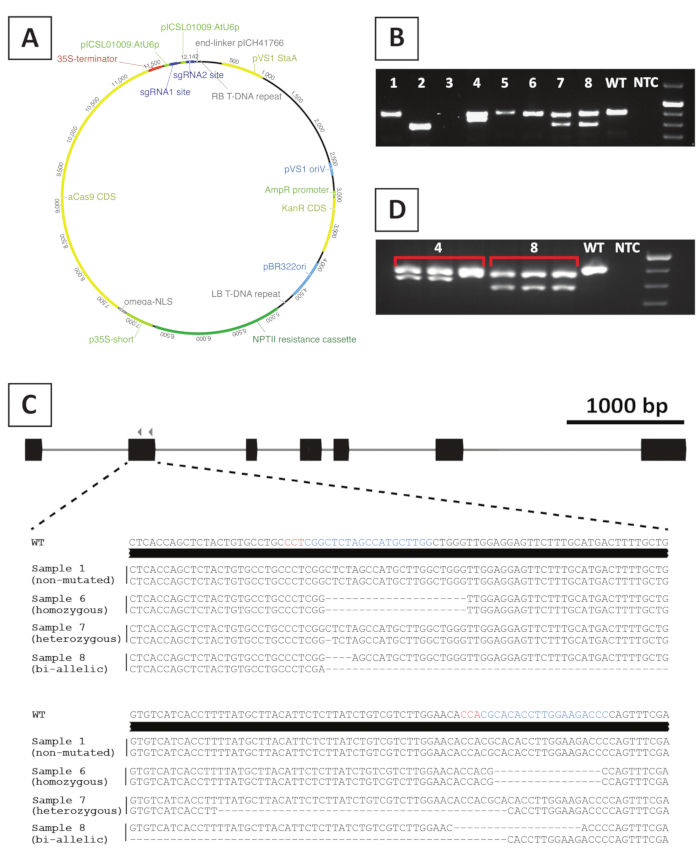
Рисунок 4: Представитель результаты после генотипирования P. andersonii T0 трансгенных CRISPR/ Cas9 мутантных линий. (A) Представитель карта бинарного вектора, используемого для CRISPR/Cas9-опосредованного мутагенеза P. andersonii. (B) Представитель результат после ПЦР основе генотипирования потенциальных CRISPR / Cas9 мутант линий с использованием грунтовки, охватывающих sgRNA целевой сайт (ы). Показано изображение после агарозного геля электрофореза амплитонов. Образцы, взятые из отдельных трансгенных линий, указаны цифрами. Дикий тип (WT) и отсутствие шаблонного контроля (NTC) указывают полосы, содержащие положительный и отрицательный контроль, соответственно. (C) Схематическое представление аллелей мутантов, полученных после редактирования генов CRISPR/Cas9. Выделенными в синих и красных цветах являются целевые сайты sgRNA и последовательности PAM, соответственно. (D) Представитель результат после ПЦР основе скрининга для потенциальных линий химерных мутантов. Показано изображение после агарозного геля электрофорус 3 отдельных образцов, взятых из мутантных линий 4 и 8. Обратите внимание, что трансгенная линия мутантов 4 является химерной. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
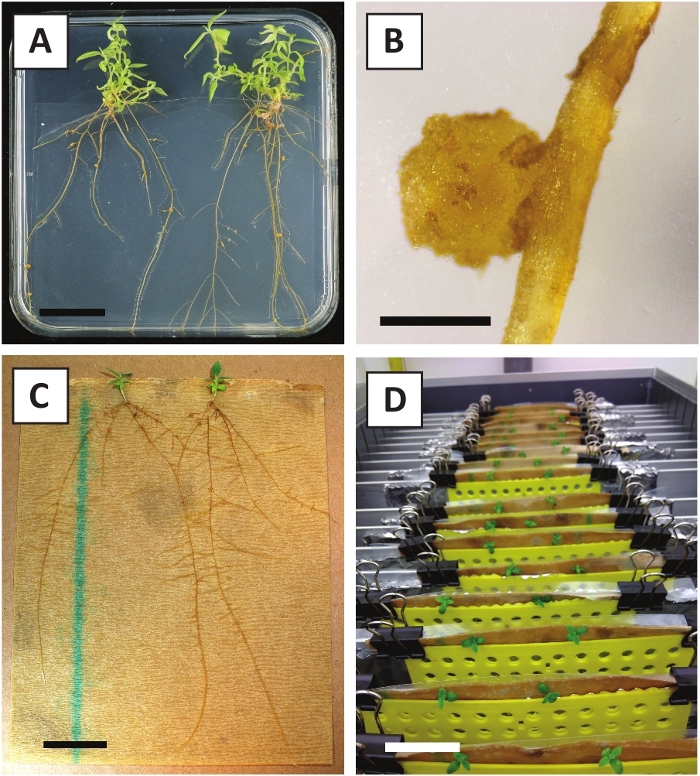
Рисунок 5: Репрезентативные изображения анализов кивки в тарелках и мешках. (A) Нодуляция на пластинах, содержащих агар-затвердевной среде ЭКМ и привитых с M. plurifarium BOR2 в течение 4 недель. (B) Представитель изображение p. andersonii корневой узел. Изображение было принято в 4 недели после прививки с M. plurifarium BOR2. (C) Нодуляция в мешках, содержащих жидкую среду ЭКМ. Рассада была привитана с bradyrhizobium sp. Kelud2A4 в течение 5 недель. (D) Представитель изображение полной установки, используемой для нодиляции в мешках. Шкала баров равна 2,5 см в (A, C), 1 мм в (B), и 5 см в (D). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
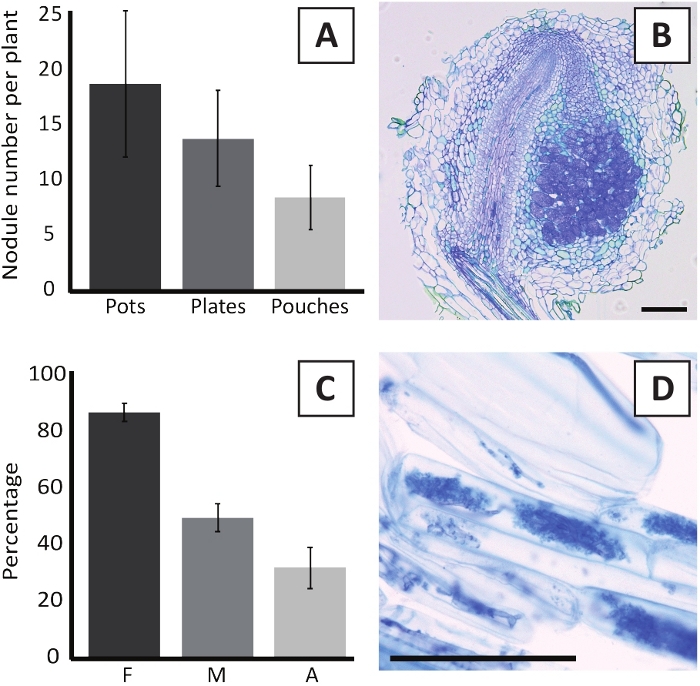
Рисунок 6: Репрезентативные результаты анализов нодрики и микоризации. (A) Представитель бар график, показывающий количество конкреций, образуюдюдинированных на растение в 4 недели после прививки с M. plurifarium BOR2 в горшках или на пластинах и на 5 недель после прививки с Bradyrhizobium sp. Kelud2A4 в сучках. Данные представляют собой среднее sD (n No 10). (B) Представитель изображение продольной секции через конкрецию формируется на 4 недели после прививки с M. плюрифарий BOR2. Секция окрашена толуидином синего цвета. (C) Представитель бар график, показывающий количественную оценку микоризации. Переменные количественно в соответствии с Trouvelot et al.29 f, частота анализируемых корневых фрагментов, которые микоризации; М, интенсивность инфекции; A, обилие зрелых арбускула в общей корневой системе. Микорризация была количественно на 6 недель после прививки с R. irregularis (напряжение DAOM197198). Данные представляют собой среднее sD (n No 10). (D) Представитель изображение зрелых арбускулы, присутствующие в P. andersonii корневых корковых клеток на 6 недель после прививки с R. irregularis. Шкала баров равна 75 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
| Составной | Ш-0 | SH-10 | Среда распространения | Укоренение среды | Инфильтрационная среда |
| SH-базальная соляная среда | 3,2 г | 3,2 г | 3,2 г | 3,2 г | 3,2 г |
| SH-витаминная смесь | 1 г | 1 г | 1 г | 1 г | 1 г |
| Сахароза | - | 10 г | 20 г | 10 г | 10 г |
| BAP (1 мг/мл) | - | - | 1 мл (4,44 мкм) | - | - |
| IBA (1 мг/мл) | - | - | 100 л (0,49 мкм) | 1 мл (4,92 мкм) | - |
| NAA (1 мг/мл) | - | - | - | 100 л (0,54 мкм) | - |
| 1 М МЧС рН-5,8 | 3 мл | 3 мл | 3 мл | 3 мл | 3 мл |
| 1 M KOH | Отрегулируйте рН до 5.8 | Отрегулируйте рН до 5.8 | Отрегулируйте рН до 5.8 | Отрегулируйте рН до 5.8 | Отрегулируйте рН до 5.8 |
| Дайшин ский | 8 г | - | 8 г | 8 г | - |
Таблица 1: Состав30 средств массовой информации, используемых для выращивания саженцев P. andersonii, стабильной трансформации и распространения в пробирке. Растворите твердые соединения в 750 мл сверхчистой воды перед добавлением жидких запасов. После этого заполните полную среду до 1 л. Подготовьте запасы BAP, IBA, NAA в 0,1 млн кН и храните при -20 oC.
| Перед автоклавированием: | ||
| Составной | Сумма за литр | Окончательная концентрация |
| Маннитол | 5 г | 27,45 мМ |
| На-Глюконат | 5 г | 22,92 мМ |
| Дрожжевой экстракт | 0,5 г | - |
| MgSO4No7H2O | 0,2 г | 0,81 мМ |
| Nacl | 0,1 г | 1,71 мМ |
| K2HPO4 | 0,5 г | 2,87 мМ |
| После автоклавирования: | ||
| Составной | Сумма за литр | Окончательная концентрация |
| 1.5 M CaCl2 | 1 мл | 1,5 мМ |
Таблица 2: Состав дрожж-маннитол (YEM) среды, используемой для выращивания корневища. Отрегулируйте рН до 7,0 и залейте ультрачистой водой до 1 л. Для приготовления агар-затвердевной среды YEM, добавьте 15 г микроагара перед автоклавированием.
| Перед автоклавированием: | |||
| Составной | Концентрация запасов | Сумма за литр среды | Окончательная концентрация |
| KH2PO4 | 0,44 м | Добавить 2 мл | 0,88 мМ |
| K2HPO4 | 1.03 M | Добавить 2 мл | 2,07 мм |
| 500x решение для акций микроэлементов | - | Добавить 2 мл | - |
| МЧС рН6,6 | 1 M | Добавить 3 мл | 3 мМ |
| Hcl | 1 M | Отрегулируйте рН до 6.6 | - |
| Ультра-чистая вода | - | Заполните до 990 мл | - |
| После автоклавирования: | |||
| Составной | Концентрация запасов | Сумма за литр среды | Окончательная концентрация |
| MgSO4No7H2O | 1.04 M | 2 мл | 2,08 мм |
| Na2SO4 | 0,35 м | 2 мл | 0,70 мМ |
| NH4NO3 | 0,18 м | 2 мл | 0,36 мМ |
| CaCl2No2H2O | 0,75 м | 2 мл | 1,5 мМ |
| Fe (III)-цитрать | 27 мМ | 2 мл | 54 км |
Таблица 3: Композиция 1 L модифицированный EKM средний31 используется для P. andersonii нодуляции ассе. Состав 500-x решения для акций микроэлементов указан в таблице 4. Для приготовления 2% агар-затвердевной среды ЭКМ, добавьте 20 г дайшинского агара перед автоклавированием. Автоклав MgSO4No7H2O, Na2SO4, CaCl2Х2H2O, и Fe (III) цитрат запасов для стерилизации. Фильтр стерилизовать NH4NO3 фондовый раствор для стерилизации.
| Составной | Сумма за литр | Концентрация запасов |
| MnSO4 | 500 мг | 3,31 мМ |
| NSO4No7H2O | 125 мг | 0,43 мМ |
| CuSO4No5H2O | 125 мг | 0,83 мМ |
| H3BO3 | 125 мг | 2,02 мм |
| Na2MoO4No2H2O | 50 мг | 0,21 мм |
Таблица 4: Состав 500-x микроэлементов, используемых для подготовки модифицированной среды ЭКМ. Храните раствор запаса микроэлементов при 4 градусах Цельсия.
| Соединений | Концентрация запасов | Сумма за литр среды | Окончательная концентрация |
| K2HPO4 | 20 мМ | 1 мл | 0,2 мМ |
| NH4NO3 | 0,28 м | 10 мл | 2,8 мМ |
| MgSO4 | 40 мМ | 10 мл | 0,4 мМ |
| K2SO4 | 40 мМ | 10 мл | 0,4 мМ |
| Fe (II)-EDTA | 9 мМ | 10 мл | 0,9 мм |
| CaCl2 | 80 мМ | 10 мл | 0,8 мм |
| 50x решение для акций микроэлементов | - | 10 мл | - |
Таблица 5: Состав 1/2-Hoagland32 среды, используемой для анализов микоризации. Состав 50-х микроэлементов стокового раствора указан в таблице 6. Подготовьте решение Fe(II)-EDTA, объединив FeSO4Х7H2O (9 мМ) и Na2 EDTA (9 мМ) в 1 биржевом растворе и хранить при 4 градусах Цельсия. Отрегулируйте рН среды до 6,1 с помощью 1 М кОнг и заполните ультра-чистой водой до 1 л.
| Соединений | Сумма за литр | Концентрация запасов |
| H3BO3 | 71,1 мг | 1,15 мМ |
| MnCl2No 4H2O | 44,5 мг | 0,22 мМ |
| CuSO4No5H2O | 3,7 мг | 23.18 км |
| NCl2 | 10,2 мг | 74,84 км |
| Na2MoO4No2H2O | 1,2 мг | 4.96 км |
Таблица 6: Состав 50-х микроэлементов, используемых для подготовки 1/2-Hoagland среды.
| Возраст эксламов | Эффективность трансформации |
| Молодые | 69,4 и 6,2% (п No 2) |
| Зрелые | 18,3 и 10,2% (n No 15) |
Таблица 7: Эффективность преобразования P. andersonii. Здесь эффективность преобразования определяется как процент экспланаторов, которые образуют по крайней мере 1 трансгенный каллус или стрелять. Эффективность преобразования была забита на 6 недель после преобразования и изображается как средняя SD. n указывает количество экспериментов преобразования, из которых была определена эффективность преобразования.
Дополнительный файл 1: Обзор конструкций уровня 1 и уровня 2, используемых для мутагенеза CRISPR/Cas9. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
Legumes и отдаленно связанных Cannabaceae рода Parasponia представляют собой только две клады видов растений, способных установить эндосимбиотические отношения с азот-фиксирующих ризобии и форме корнеплодов. Сравнительные исследования между видами обеих кладок имеют большое значение для получения информации о основных генетических сетях, позволяющих этот симбиоз. В настоящее время генетические исследования проводятся в основном в бобовых; особенно двух видов моделей M. truncatula и L. japonicus. Для обеспечения дополнительной экспериментальной платформы и облегчения сравнительных исследований с узловавающим не-легум, мы описываем здесь подробный протокол для стабильной трансформации и обратного генетического анализа в P. andersonii. Представленный протокол использует в пробирке распространение T0 трансгенных линий P. andersonii, что позволяет фенотипического анализа, который будет начат в течение 4 месяцев после A. tumefaciens совместного культивирования. Это значительно быстрее, чем текущие протоколы, которые были созданы для стабильной трансформации бобовых33. Это делает P. andersonii привлекательной исследовательской моделью.
Описанный здесь протокол содержит несколько критических шагов. Первый из которых касается прорастания семян. Чтобы подготовить семена P. andersonii для прорастания, семена должны быть изолированы от ягод. Это делается путем трения ягод на листе бумаги или против внутренней части сито чая. Эта процедура должна быть выполнена мягко, чтобы предотвратить повреждение семенного слоя. Если семенной слой получает повреждения, отбеливатель может войти в семя во время стерилизации, что снижает жизнеспособность семян. Чтобы сломать спячку семян, семена подвергаются 10-дневному температурному циклу. Однако, несмотря на это лечение, прорастание не полностью синхронизировано. Как правило, первые семена показывают появление радикля после 7 дней, но другие могут занять несколько дней дольше, чтобы прорасти.
Критические пункты в процедуре преобразования относятся выбор начиная материала и продолжительность шага co-культивирования. Для достижения эффективной трансформации, лучше всего использовать здоровые и молодые стебли или черешки нестерильных тепличных растений в качестве исходного материала. Для того, чтобы стимулировать рост молодых ветвей, желательно обрезать деревья Parasponia каждые 2-3 месяца и освежить деревья один раз в год. Кроме того, шаг совместного культивирования должен быть выполнен только в течение 2 дней. Длительное совместное культивирование способствует чрезмерной колонизации тканевых эксцестов A. tumefaciens и в целом снижает эффективность преобразования. Для предотвращения чрезмерной колонизации A. tumefaciens также важно регулярно обновлять пластины, на которых выращиваются экспланты. В случае чрезмерной колонизации происходит, ткани explants могут быть вымыты (см. раздел 3.8), чтобы удалить A. tumefaciens клеток. Мы советуем добавить отбеливатель в раствор SH-10, используемый для мытья (окончательная концентрация: 2% гипохлорит). Важно отметить, что этот дополнительный шаг стирки может не работать на сильно инфицированных эксплансов(рисунок 2B). В случае, если преобразование с конструкцией CRISPR/Cas9 дает только ограниченное число предполагаемых преобразованных побегов или если мутагенез конкретного гена, как ожидается, вызовет проблемы в регенерации, желательно включить пустую конструкцию управления переносчиком как положительный контроль. Наконец, важно обеспечить, чтобы все трансгенные линии, которые были отобраны, были получены в результате независимых событий интеграции Т-ДНК. Поэтому мы поручаем принимать только одну приблизительно-трансгенную съемку с каждой стороны экспланта. Тем не менее, мы понимаем, что это уменьшает потенциальное количество независимых линий. Если требуется много линий, исследователи могут принять решение отделить предполагаемо преобразованы calli от исходных explants, когда эти калли являются 2 мм в размере и культуры этих calli самостоятельно. Таким образом, несколько линий могут быть изолированы от каждого экспланта, что повышает количество потенциальных трансгенных линий.
В текущем протоколе трансгенные линии P. andersonii распространяются вегетативно через распространение in vitro. Преимущество этого заключается в том, что многие трансгенные растения могут быть созданы в относительно короткий период времени. Тем не менее, этот метод также имеет ряд ограничений. Во-первых, поддержание T0 трансгенных линий через распространение in vitro является трудоемким и может привести к нежелательным генетическим или эпигенетическим изменениям34,35. Во-вторых, линии T0 по-прежнему содержат копию Т-ДНК, включая кассету устойчивости к антибиотикам. Это ограничивает количество возможных перепреобразований, так как для каждой повторной трансформации требуются различные маркеры выбора. В настоящее время мы тестировали трансформацию только с помощью выбора канамицина или гигромицина (данные не показаны). Кроме того, наличие последовательности кодирования Cas9 и sgRNA в трансгенных линиях Т0 усложняет исследования дополнения. Дополнительные анализы возможны, но требуют, чтобы целевой участок sgRNA (ы) мутировал как таковой, что редактирование генов конструкции дополнения предотвращается. В-третьих, недостатком работы с линиями T0 является то, что мутанты CRISPR/Cas9 могут быть химерными. Для предотвращения фенотипического анализа линий химерных мутантов, мы рекомендуем повторить анализ генотипирования после распространения in vitro по крайней мере на 3 различных побегах. Хотя количество химерных мутантов, полученных с помощью описанного здесь протокола, ограничено, их иногда наблюдается10. Чтобы преодолеть ограничения работы с линиями T 0, линии мутантов P. andersonii могут распространяться генеративно. P. andersonii деревья dioecious и ветра опыляется2. Это означает, что каждая трансгенная линия должна быть обработана как таковая, что мужские и женские цветы производятся на одного человека, а затем выращиваются как таковые, что перекрестное опыление не происходит. Поскольку P. andersonii является быстрорастущим деревом, оно требует значительного количества места в тропической теплице (28 градусов по Цельсию, относительная влажность 85% ). Поэтому, хотя это технически возможно, генеративное распространение трансгенных линий P. andersonii является логистической сложной задачей.
В разделе протокола мы описали 3 метода для нодиляции P. andersonii. Преимущество пластины и мешок систем является то, что корни легко доступны, что может позволить пятно-прививки бактерий и после образования конкреций с течением времени. Тем не менее, система пластин является довольно трудоемким, что делает его менее пригодным для крупномасштабных экспериментов по обножению. Недостатком системы сусликов является то, что трудно предотвратить грибковое загрязнение. Мешки не стерильны, и поэтому грибковый рост часто наблюдается на верхней половине сумки. Однако, это не влияет на рост P. andersonii, и поэтому не мешает анализу кивки. Кроме того, система суса подходит только для рассады. Несмотря на несколько попыток, мы не смогли выращивать растения, полученные в результате распространения в пробирке в мешках.
P. andersonii обратный генетический трубопровод описан здесь предлагает существенное улучшение по сравнению с существующими A. rhizogenesоснове метод преобразования корня11. Используя описанные процедуры, стабильные трансгенные линии могут быть созданы эффективно и могут поддерживаться с помощью распространения in vitro. В отличие от этого, преобразование А. rhizogenes является переходным и приводит только к образованию трансгенных корней. Поскольку каждый трансгенный корень является результатом независимой трансформации, анализы на основе трансформации A. rhizogenes страдают от существенных фенотипических вариаций. Этот вариант гораздо меньше в случае стабильных линий, хотя распространение in vitro также создает некоторый уровень вариации. Из-за этого уменьшенного изменения и факта что множественные plantlets смогли быть phenotyped для каждой стабилизированной линии, стабилизированные линии больше приспособлены для количественных анализов сравненных к A. rhizogenes-преобразованныекорни. Кроме того, стабильная трансформация не зависит от введения корня A. rhizogenes, вызывающего локус (rol), который влияет на эндогенный гормональный баланс15. Таким образом, стабильные линии лучше подходят для обратного генетического анализа генов, участвующих в гормонго гомеостаза по сравнению с А. rhizogenes-преобразованныхкорней. Более общим преимуществом P. andersonii в качестве исследовательской модели является то, что она не испытывала недавнего полного дублирования генома (РГД). Бобовые Papilionoideae подсемейство, которое включает в себя модель бобов M. truncatula и L. japonicus, а также Salicaceae (заказ Malpighiales), который включает в себя модель дерева Populus trichocarpa опытных WGDs миллионов лет назад36,37. Многие паралогические копии генов в результате этих РГД сохраняются в геномах M. truncatula, L. japonicus и P. trichocarpa37,38,39, который создает избыточность, которая может осложнить обратный генетический анализ. Поскольку P. andersonii не испытывал ажиотажа в последнее время РГД, обратный генетический анализ P. andersonii может быть менее затронут избыточной функционирования паралогических копий генов.
В совокупности мы предоставляем подробный протокол для обратного генетического анализа в P. andersonii. Используя этот протокол, одиночные линии мутантов могут быть эффективно сгенерированы в течение 2-3 месяцев10. Этот протокол может быть расширен для создания мутантов более высокого порядка путем мультиплексирования sgRNAs ориентации различных генов одновременно, как показано на других видов растений40,41,42. Кроме того, описанная здесь процедура стабильной трансформации не ограничивается генной таргетингом CRISPR/Cas9, но может также использоваться для внедрения других типов конструкций (например, для анализов промоутер-репортеров, эктопического выражения или транс- дополняют друг друга). Мы создали P. andersonii в качестве сравнительной исследовательской модели для изучения взаимосвязанных симбиозов с азотфикацией ризобии или эндомикоррхизальных грибов. Тем не менее, протоколы, описанные здесь также предоставить инструменты для изучения других аспектов биологии этого тропического дерева, таких как образование древесины, развитие би-сексуальных цветов или биосинтез анабанацеи конкретных вторичных метаболитов.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы признать Марк Youles, Софин Камун и Сильвестр Marillonnet для принятия Золотые ворота клонирования частей доступны через базу данных Addgene. Кроме того, мы хотели бы поблагодарить Э. Джеймса,. Хадоласа и Т. Дж. Хиггенса за семена P. andersonii. Эта работа была поддержана Нидерландской организацией научных исследований (грант NWO-VICI 865.13.001; NWO-Открытый конкурс грант 819.01.007) и Министерство исследований, технологий и высшего образования Республики Индонезия (RISET-PRO грант 8245-ID).
Материалы
| Name | Company | Catalog Number | Comments |
| Sigma-Aldrich | N0640 | NAA | |
| Duchefa Biochemie | M1503.0250 | MES | |
| Sigma-Aldrich | D134406 | Acetosyringone | |
| Duchefa Biochemie | X1402.1000 | X-Gal | |
| Merck | 101236 | For nucleic acid electrophoresis gel | |
| - | - | Pouches box material, hangers | |
| Merck | 101188 | NH4NO3 | |
| Sigma-Aldrich | B3408-1G | BAP | |
| Merck | 100156 | H3BO3 | |
| Thermo-Fisher | ER1011 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Thermo-Fisher | 15561020 | Used in Golden Gate cloning assembly | |
| Merck | 137101 | CaCl2·2H2O | |
| Duchefa Biochemie | C0111.0025 | C16H16N5O7S2Na | |
| Thermo-Fisher | K1231 | Used for cloning the blunt-ended PCR amplicons in genotyping procedure | |
| Agronutrition | AP2011 | Containing Rhizophagus irregularis DAOM 197198 (1,000 spores/mL), used for mychorrization assay | |
| Merck | 102790 | CuSO4·5H2O | |
| Duchefa Biochemie | D1004.1000 | Used for plant tissue culture agar-based medium | |
| Merck | 105101 | K2HPO4 | |
| VWR Chemicals | 20302.293 | Na2·EDTA | |
| Duchefa Biochemie | M0803.1000 | C6H14O6 | |
| Thermo-Fisher | ER0291 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Merck | 100983 | C2H5OH | |
| VWR Chemicals | BDH9232-500G | EDTA | |
| Sigma-Aldrich | Z377600-1PAK | Cellophane membrane | |
| Biomatters, Ltd. | R9 or higher | Bioinformatics software for in silico cloning and designing of sgRNAs | |
| Mega International | - | Technical information at https://mega-international.com/tech-info/ | |
| Sigma-Aldrich | 65882 | Used for fixating nodule tissues | |
| VWR Chemicals | 24385.295 | - | |
| Vink | 219341 | Pouches box material, bottom part | |
| Leica Biosystems | 14702218311 | Used as a template for plastic embedding | |
| Merck | 100317 | HCl | |
| Sigma-Aldrich | I5386-1G | IBA | |
| Merck | 103862 | C6H5FeO7 | |
| Merck | 103965 | FeSO4O·7H2O | |
| Duchefa Biochemie | I1401.0005 | IPTG | |
| Duchefa Biochemie | K0126.0010 | ||
| Sigma-Aldrich | L2000 | ||
| Merck | 105886 | MgSO4O·7H2O | |
| Merck | 105934 | MnCl2·4H2O | |
| Merck | 102786 | MnSO4O | |
| Duchefa Biochemie | M1002.1000 | Used for bacterial culture agar-based medium | |
| Manutan | 92007687 | Pouches material | |
| Paraxisdienst | 130774 | Elastic sealing foil | |
| Pull Rhenen | Agra-Perlite No.3 | Used as growing substrate in pots for nodulation assay | |
| VWR Chemicals | 391-0581 | Used as container for cellophane membranes | |
| Thermo-Fisher | F130WH | For genotyping transgenic lines | |
| Addgene | 50337 | Level 0 terminator, 3'UTR, 35s (Cauliflower Mosaic Virus) | |
| Addgene | 48017 | End-link 2 for assembling 2 level one part into a level 2 acceptor | |
| Addgene | 48018 | End-link 3 for assembling 3 level one part into a level 2 acceptor | |
| Addgene | 48001 | Level 1 acceptor. Position 5. Forward orientation | |
| Addgene | 48007 | Level 1 Acceptor. Position 1. Reverse orientation | |
| Addgene | 50268 | Level 0 promoter (0.4 kb), 35s (Cauliflower Mosaic Virus) + 5'UTR, Ω (Tobacco Mosaic Virus) | |
| Addgene | 46966 | Used for designing CRISPR/Cas9 module | |
| Addgene | 46968 | Used for designing CRISPR/Cas9 module | |
| Addgene | 50334 | Level 0 Kanamycin/Neomycin/Paromomycin resistance cassette | |
| Topzeven | - | Used as filters for washing spore suspension | |
| Sigma-Aldrich | 8.17003 | PEG400 | |
| Duchefa Biochemie | E1674.0001 | Pots to grow Parasponia plantlets/seedlings | |
| Merck | 104871 | KH2PO4 | |
| Merck | 105033 | KOH | |
| Merck | 105153 | K2SO4O | |
| Van Leusden b.v. | - | Used as growing substrate for mychorrhization assay | |
| Duchefa Biochemie | S0225.0050 | SH-basal salt medium | |
| Duchefa Biochemie | S0411.0250 | SH-vitamin mixture | |
| Lehle Seeds | VIS-02 | Used as non-ionic surfactant in the washing step of stable transformation | |
| Merck | 137017 | NaCl | |
| VWR Chemicals | 89230-072 | C6H11NaO7 | |
| Merck | 106521 | Na2MoO4·2H2O | |
| Merck | 106574 | Na2HPO4·7H2O | |
| Merck | 567549 | NaH2PO4·H2O | |
| Sigma-Aldrich | 239313 | Na2SO4O | |
| Duchefa Biochemie | S0809.5000 | C12H22O11 | |
| Thermo-Fisher | B69 | Used in Golden Gate cloning assembly | |
| Thermo-Fisher | EL0013 | Used in Golden Gate cloning assembly | |
| Kulzer-Mitsui Chemicals Group | 64708806 | Methyl methacrylate-based resin powder | |
| Kulzer-Mitsui Chemicals Group | 64709003 | HEMA (2-hydroxyethyl methacrylate)-based resin solution | |
| Kulzer-Mitsui Chemicals Group | 66022678 | Methyl methacrylate-based resin solution | |
| Merck | 1159300025 | ||
| Acros | 189350250 | ||
| VWR Chemicals | 663684B | Polysorbate 20 | |
| Stout Perspex | - | pouches box material, lid | |
| Duchefa Biochemie | Y1333.1000 | ||
| Merck | 108816 | ZnCl2 | |
| Alfa Aesar | 33399 | ZnSO4O·7H2O |
Ссылки
- Clason, E. W. THE VEGETATION OF THE UPPER-BADAK REGION OF MOUNT KELUT (EAST JAVA). Bulletin du Jardin Botanique de Buitenzorg. Serie III, 509-518 (1936).
- Soepadmo, E. Ulmaceae. Flora Malesiana-Series 1, Spermatophyta. 8, 31-76 (1974).
- Becking, J. H. The Rhizobium symbiosis of the nonlegume Parasponia. Biological Nitrogen Fixation. , 497-559 (1992).
- Oldroyd, G. E. D. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 11, 252-263 (2013).
- Gutjahr, C., Parniske, M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annual Review of Cell and Developmental Biology. 29, 593-617 (2013).
- van Velzen, R., et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses. Proceedings of the National Academy of Sciences of the United States of America. 115, E4700-E4709 (2018).
- van Velzen, R., Doyle, J. J., Geurts, R. A Resurrected Scenario: Single Gain and Massive Loss of Nitrogen-Fixing Nodulation. Trends in Plant Science. 24, 49-57 (2019).
- Griesmann, M., et al. Phylogenomics reveals multiple losses of the nitrogen-fixing root nodule symbiosis. Science. 1743, eaat1743 (2018).
- Becking, J. H. Root-Nodule Symbiosis Between Rhizobium And Parasponia (Ulmaceae). Plant and Soil. 51, 289-296 (1979).
- van Zeijl, A., et al. CRISPR/Cas9-Mediated Mutagenesis of Four Putative Symbiosis Genes of the Tropical Tree Parasponia andersonii Reveals Novel Phenotypes. Frontiers in Plant Science. 9, 284 (2018).
- Cao, Q., et al. Efficiency of Agrobacterium rhizogenes–mediated root transformation of Parasponia and Trema is temperature dependent. Plant Growth Regulation. 68, 459-465 (2012).
- Limpens, E., et al. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55, 983-992 (2004).
- Boisson-Dernier, A., et al. Agrobacterium rhizogenes-Transformed Roots of Medicago truncatula for the Study of Nitrogen-Fixing and Endomycorrhizal Symbiotic Associations. Molecular Plant-Microbe Interactions. 14, 695-700 (2001).
- Kumagai, H., Kouchi, H. Gene Silencing by Expression of Hairpin RNA in Lotus japonicus Roots and Root Nodules. Molecular Plant-Microbe Interactions. 16, 663-668 (2003).
- Nilsson, O., Olsson, O. Getting to the root: The role of the Agrobacterium rhizogenes rol genes in the formation of hairy roots. Physiologia Plantarum. 100, 463-473 (1997).
- Davey, M. R., et al. Effective Nodulation of Micro-Propagated Shoots of the Non-Legume Parasponia andersonii by Bradyrhizobium. Journal of Experimental Botany. 44, 863-867 (1993).
- Webster, G., Poulton, P. R., Cocking, E. C., Davey, M. R. The nodulation of micro-propagated plants of Parasponia andersonii by tropical legume rhizobia. Journal of Experimental Botany. 46, 1131-1137 (1995).
- Op den Camp, R., et al. LysM-type mycorrhizal receptor recruited for rhizobium symbiosis in nonlegume Parasponia. Science. 331, 909-912 (2011).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A Modular Cloning System for Standardized Assembly of Multigene Constructs. PLOS ONE. 6, e16765 (2011).
- Nekrasov, V., Staskawicz, B. J., Weigel, D., Jones, J. D. G., Kamoun, S. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9 RNA-guided endonuclease. Nature Biotechnology. 31, 691-693 (2013).
- Bertani, G. Studies On Lysogenesis. I. The Mode Of Phage Liberation By Lysogenic Escherichia Coli. Journal of Bacteriology. 62, 293-300 (1951).
- Engler, C., et al. A Golden Gate modular cloning toolbox for plants. ACS Synthetic Biology. 3, 839-843 (2014).
- Fauser, F., Schiml, S., Puchta, H. Both CRISPR/Cas-based nucleases and nickases can be used efficiently for genome engineering in Arabidopsis thaliana. The Plant Journal. 79, 348-359 (2014).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA Transformation-Competent Arabidopsis Genomic Library in Agrobacterium. Biotechnology. 9, 963-967 (1991).
- Op den Camp, R. H. M., et al. N Nonlegume Parasponia andersonii Deploys A Broad Rhizobium Host Range Strategy Resulting in Largely Variable Symbiotic Effectivenes. Molecular Plant-Microbe Interactions. 25, 954-963 (2012).
- Graham, P. H., Viteri, S. E., Mackie, F., Vargas, A. T., Palacios, A. Variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Research. 5, 121-128 (1982).
- Martinez-Romero, E., et al. Rhizobium tropici, A Novel Species Nodulating Phaseolus vulgaris L. Beans and Leucaena sp. Trees. International Journal of Systematic and Evolutionary Microbiology. 41, 417-421 (1991).
- Felten, J., et al. The Ectomycorrhizal Fungus Laccaria bicolor Stimulates Lateral Root Formation in Poplar and Arabidopsis through Auxin Transport and Signaling. Plant Physiology. 151, 1991-2005 (1991).
- Trouvelot, A., Kough, J. L., Gianinazzi-Pearson, V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. Aspects Physiologiques et Genetiques des Mycorhizes. , 217-221 (1986).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany. 50, 199-204 (1972).
- Becking, J. H. The Parasponia parviflora - Rhizobium symbiosis. Host specificity, growth and nitrogen fixation under various conditions. Plant and Soil. 75, 309-342 (1983).
- Hoagland, D. R., Arnon Revised, D. I., Arnon, D. I. The Water-Culture Method for Growing Plants without Soil. Circular California Agricultural Experiment Station. 347, 1-32 (1950).
- Wang, K. . Methods in Molecular Biology: Agrobacterium Protocols. 1, (2015).
- Smulders, M. J. M., de Klerk, G. J. Epigenetics in plant tissue culture. Plant Growth Regulation. 63, 137-146 (2011).
- Larkin, P. J., Scowcroft, W. R. Somaclonal variation — a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics. 60, 197-214 (1981).
- Cannon, S. B., et al. Legume genome evolution viewed through the Medicago truncatula and Lotus japonicus genomes. Proceedings of the National Academy of Sciences of the United States of America. 103, 14959-14964 (2006).
- Tuskan, G. A., et al. The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray). Science. 313, 1596-1604 (2006).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520 (2011).
- Sato, S., et al. Genome Structure of the Legume, Lotus japonicus. DNA Research. 15, 227-239 (2008).
- Xing, H. L., et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants. BMC Plant Biology. 14, 327 (2014).
- Lowder, L. G., et al. A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation. Plant Physiology. 169, 971 (2015).
- van Zeijl, A. . Dissecting Hormonal Pathways in Nitrogen-Fixing Rhizobium Symbioses. , (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены