Luminescence Lifetime Imaging of O2 con un sistema de cámara basado en dominio de frecuencia
* Estos autores han contribuido por igual
En este artículo
Resumen
Describimos el uso de una novedosa cámara de duración de luminiscencia de dominio de frecuencia para mapear distribuciones 2D O2 con láminas de sensor óptico. El sistema de cámaras y los procedimientos de análisis de imágenes se describen junto con la preparación, calibración y aplicación de láminas de sensores para visualizar el microambiente O2 en la rizoesfera de plantas acuáticas.
Resumen
Describimos un método para la imagen de oxígeno disuelto (O2), en 2D a alta resolución espacial (< 50-100 m) y temporal (< 10 s). El método emplea láminas de sensor luminiscentes sensibles O2 (optodos planos) en combinación con un sistema de cámara especializado para la vida útil de la luminiscencia de imágenes en el dominio de frecuencia. Los optodos planos se preparan disolviendo el tinte indicador sensible O2en un polímero y extendiendo la mezcla sobre un soporte sólido en un espesor definido a través del recubrimiento de cuchillo. Después de la evaporación del disolvente, el optode plano se pone en estrecho contacto con la muestra de interés - aquí demostrado con las raíces de la planta acuática Littorella uniflora. El cambio dependiente de la concentración O2 en la vida útil de la luminiscencia del tinte indicador dentro del optode plano se toma una imagen a través de la parte posterior de la lámina portadora transparente y la pared del acuario utilizando una cámara especial. Esta cámara mide la vida útil de la luminiscencia a través de un cambio en el ángulo de fase entre una señal de excitación modulada y la señal de emisión. Este método es superior a los métodos de imagen de intensidad de luminiscencia, ya que la señal es independiente de la concentración o intensidad del tinte de la fuente de excitación, y se basa únicamente en el tiempo de decaimiento de la luminiscencia, que es un parámetro referenciado intrínsecamente. Por consiguiente, no se necesita un tinte de referencia adicional u otros medios de referencia. Demostramos el uso del sistema para la toma de imágenes macroscópicas O2 de rizoesferas vegetales, pero el sistema de cámara también se puede acoplar fácilmente a un microscopio.
Introducción
La distribución y dinámica de gases e iones disueltos en sedimentos y suelos proporcionan información clave sobre procesos biogeoquímicos como la respiración microbiana1,2, o la pérdida radial de oxígeno de las raíces de las plantas3,4,5, y el microambiente químico de microbios6,7, rizosferas vegetales5,8,9 y madrigueras animales10, 11,12. La actividad biológica y química en estos entornos limitados por difusión puede crear pendientes pronunciadas de sustratos químicos o productos de procesos biogeoquímicos. En particular, la disponibilidad de O2 tiene un gran impacto en los procesos biogeoquímicos y, por lo tanto, en la biología y ecología de un sistema13. Por lo tanto, el análisis de las concentraciones de O2 a alta resolución espacial y temporal es de suma importancia en las ciencias acuáticas y terrestres. En primer lugar, se desarrollaron microsensores electroquímicos y ópticos14,15 para medir este importante analito. Más tarde, se introdujeron imágenes en 2 dimensiones (2D) de O2 con optodes planos12,16,17,18,19, lo que permitió la visualización y cuantificación de la distribución heterogénea De2 en suelos y sedimentos.
Los optodos Planar O2 consisten en un indicador deo2sensible dye20,que se disuelve en un polímero adecuado21. El tinte indicador se excita en longitudes de onda ópticas específicas y emite luz de desplazamiento rojo tras la relajación en forma de luminiscencia. En presencia de O2,el tinte indicador excitado puede transferir su energía a la molécula O2 tras la colisión, que se conoce como enfriamiento de luminiscencia basado en colisión22. Por lo tanto, la intensidad de la luminiscencia, así como la vida útil de la luminiscencia se reducen con el aumento de la concentración de O2 2 23. En un caso ideal, el cambio de intensidad y de vida útil sigue la ecuación Stern-Volmer (ecuación 1) utilizando la intensidad de luminiscencia o la vida útil en ausencia (I0;0) o la presencia (I, ) de O2 a una concentración dada [Q]. La constante Stern-Volmer (Ksv) es una medida para la sensibilidad del optode hacia O2; KSV depende de variables ambientales como la temperatura y la presión.
(1)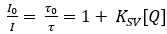
La grabación de estos cambios en la luminiscencia sobre una lámina plana del sensor con un sistema de cámara se puede utilizar para visualizar los cambios correspondientes en la distribución de O2. Inicialmente, se utilizaron imágenes O2 simples basadas en la intensidad de luminiscencia18. Sin embargo, esta metodología es muy sensible a las interferencias externas, que comprometen la fiabilidad de los resultados debido a la iluminación heterogénea, las fluctuaciones en la fuente de excitación o la cámara, así como la distribución desigual del tinte indicador dentro del optodo plano.
Algunas de estas limitaciones se pueden aliviar mediante el uso de optodos planos para la imagen ratiométrica17,24, donde el tinte indicador sensible O2se inmoviliza en la capa de polímero del optodo plano con un tinte de referencia insensible que emite en un rango espectral diferente al indicador O2. Basándose en imágenes de emisión adquiridas en dos ventanas espectrales, la señal de emisión sensible O2se divide por la señal de referencia, generando una imagen de relación menos propensa a las interferencias mencionadas anteriormente5,17. El método requiere el uso de un segundo tinte, que idealmente puede ser excitado por la misma fuente de excitación, pero emite a una longitud de onda diferente (sin superposición espectral significativa), en otra ventana espectral de la cámara (por ejemplo, en otro canal de color de una cámara RGB).
Alternativamente, la imagen O2 puede basarse en la cuantificación del cambio dependiente de O2en la vida útil de la luminiscencia del tinte indicador, que no se ve afectado por la iluminación desigual o las heterogeneidades en la concentración del indicador25. Los primeros sistemas de imágenes O2 basados en la duración de la luminiscencia se basaron en mediciones de dominio del tiempo con un sistema de cámara de dispositivo acoplado cargado (CCD)26,donde se utiliza una fuente de excitación pulsada y las imágenes de luminiscencia se toman sobre intervalos de tiempo definidos dentro de la excitación o emisión del indicador8,23,27. A partir de estas imágenes, la vida útil de la luminiscencia se puede determinar y correlacionar con la concentración correspondiente de O2 en una calibración. Posteriormente, las imágenes de vida útil de la luminiscencia de una muestra determinada presionada contra el optode plano se pueden convertir en imágenes de la distribución 2D correspondiente de la concentración de O2. Este sistema se ha utilizado en muchas aplicaciones tanto en el laboratorio como in situ16,28,pero la cámara CCD esencial capaz de compuerta ya no está disponible comercialmente.
Recientemente, se lanzó un sistema de cámara de vida de iluminación luminiscencia diferente, que adquiere imágenes en el dominio de frecuencia8. El sistema se basa en una fuente de luz modulada continuamente para la excitación. Esto puede ser una onda sinusoidal o cuadrada en lugar de una excitación pulsada, que se utiliza para la adquisición de imágenes en el dominio del tiempo. Esta modulación da como resultado una emisión de luminiscencia modulada del tinte indicador O2, que se desplaza por fases por un ángulo, , que depende de la vida útil de la luminiscencia del tinte indicador (véase la ecuación 2).
(2)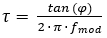
El cambio entre la excitación y la amplitud de emisión (es decir, el denominado índice o profundidad de modulación (amplitud dividida por la parte de luminiscencia constante)) también depende de la vida útil de la luminiscencia. Por lo tanto, mediante el establecimiento de una frecuencia de modulación conocida, el sensor de imagen CMOS especial dentro de la cámara es capaz de medir la vida útil de la luminiscencia en el rango ns a s como se describe en detalle en otros lugares 8,29,30. Se puede encontrar una guía general sobre el principio de funcionamiento (utilizando el siguiente enlace https://www.youtube.com/watch?v=xPAB_eVWOr8).
En el siguiente protocolo, demostramos el uso del novedoso sistema de cámaras para la toma de imágenes de la distribución de la concentración de O2 alrededor de las raíces de la planta de agua dulce acuática Littorella uniflora en 2D9,31. Nos gustaría hacer hincapié en que este método no se limita de ninguna manera a esta aplicación. Los optodos sensibles al oxígeno o las partículas desensores 27 en combinación con diversos métodos de imagen se han utilizado en la investigación médica32,en la bioimpresión33,para pinturas sensibles a la presión34,35,o para estudiar sistemas fotosintéticos2,36,37, sólo para nombrar algunos otros campos de aplicación.
Protocolo
1. Fabricación de optode planar O2
- Disolver 1,5 mg del indicador luminiscente O2 colorante platino(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porphyrin (PtTFPP) y 100 mg de poliestireno (PS) en 1 g de cloroformo para obtener el llamado 'cóctel'.
NOTA: El cóctel se puede guardar en un vial de vidrio cerrado y hermético durante unas horas en la nevera y la oscuridad hasta su uso posterior. - Fijar una lámina de tereftalato de polietileno (PET) limpia y libre de polvo (tamaño dependiendo de la aplicación) en una placa de vidrio limpia con la ayuda de un agua o etanol (70%) película(Figura 1A).
- Coloque el dispositivo de recubrimiento de cuchillo limpio (120 m) en la lámina y aplique una línea del cóctel del sensor delante del dispositivo utilizando una pipeta de vidrio(Figura 1B). A continuación, arrastre el dispositivo de recubrimiento de cuchillo lentay uniformemente sobre la lámina PET para extender el cóctel uniformemente.
NOTA: Todos los materiales y herramientas deben limpiarse a fondo y la fabricación debe realizarse en un entorno libre de polvo, como una campana de humos, un banco de flujo o debajo de un dispositivo de aspiración de puntos. Para evitar heterogeneidades en la lámina final del sensor, los pasos que siguen a la aplicación del cóctel sensor sobre la lámina deben realizarse rápidamente, ya que el cloroformo se evapora rápidamente. - Secar el optode plano terminado O2-sensible en el aire ambiente durante 1 h y luego durante la noche en un armario de calefacción a 50-60 oC, lo que resulta en un espesor de capa final después de la evaporación del disolvente de 12 m. Almacene los optodos producidos en la oscuridad (por ejemplo, en un sobre de papel) hasta su uso posterior(Figura 1C).
NOTA: Los optodos Planar O2 se pueden almacenar secos y en la oscuridad durante varios meses a años antes de su uso. Un espesor de capa final que va de 1-20 m ha demostrado ofrecer buenos resultados, con suficiente señal de luminiscencia y tiempos de respuesta adecuados.
2. Cámara rhizo-sandwich
- Limpie dos placas de vidrio (24,5 x 14 cm2,espesor: 4 mm) con 96% de etanol.
- Utilice adhesivo instantáneo a base de acrílico curable a la luz (ver Tabla de Materiales)para pegar diapositivas de microscopio (76 x 26 mm2, espesor: 1 mm) a lo largo de los bordes de la primera placa de vidrio (es decir, el lado de la cámara trasera), dejando un borde largo abierto. Utilice un cortador de vidrio para acortar las diapositivas del microscopio según sea necesario.
ADVERTENCIA: Cortar vidrio puede causar bordes afilados y debe ser manejado con cuidado.
NOTA: Las diapositivas del microscopio funcionan como espaciadores entre la parte delantera y trasera, y dependiendo del grosor de las raíces y el tamaño de la planta, se pueden pegar varias capas de diapositivas de microscopio una encima de la otra. - Corte el optode plano en la forma y el tamaño requeridos para caber en el espacio entre las diapositivas del microscopio pegado. Colóquelo en el interior de la placa de vidrio frontal con el lado recubierto hacia arriba, para permitir el contacto con la muestra de interés cuando se presiona contra ella.
- Pegue un borde de la lámina de optode a la placa de vidrio y agregue unas gotas de agua del grifo entre la placa de vidrio y la lámina de optode(Figura 2A). Baje lentamente la lámina de estas gotas de agua, lo que le permite enderezarse en la superficie de vidrio.
- Retire cuidadosamente las burbujas de aire atrapadas entre el optode plano y la placa de vidrio utilizando un tejido blando, evitando el rayado del recubrimiento del sensor. Limpie la placa de vidrio en seco y pegue los bordes restantes de la lámina de optode a la placa de vidrio(Figura 2B).
NOTA: Se debe elegir una cinta con una adherencia adecuada bajo el agua. - Tamizar el sedimento usando un tamaño de malla de 0,5 mm. Coloque una cuchara de sedimento húmedo en la primera placa de vidrio(Figura 2C).
NOTA: El tamaño de la malla no debe ser mayor que la mitad del grosor del espaciador. - Distribuya el sedimento uniformemente y ajústelo al mismo grosor que los espaciadores deslizantes del microscopio utilizando una placa de vidrio plana. Limpie cuidadosamente la superficie superior de las guías del microscopio para asegurarse de que la segunda placa de vidrio selle la cámara correctamente.
- Aplique grasa de silicio a la superficie deslizante del microscopio. Cubra el sedimento con una película de agua fina, evitando cuidadosamente la formación de burbujas de aire.
- Lavar cuidadosamente un solo brote de Littorella uniflora y colocarlo en el sedimento, con las hojas de la planta sobresaliendo desde el lado abierto superior(Figura 2D).
- Colocar la segunda placa de vidrio, con el optode unido a ella, sobre el sedimento y aplicar una presión suave para poner el optode en estrecho contacto con las raíces de la planta y el sedimento circundante.
NOTA: Las burbujas de aire atrapadas en el sedimento se pueden eliminar inclinando las placas de vidrio mientras las une. - Fije las placas de vidrio usando abrazaderas(Figura 2E). Seque los bordes exteriores con papel tisú. Mantener las hojas hidratadas durante todo el conjunto del rizo-sandwich (por ejemplo, por la adición frecuente de unas gotas de agua).
- Apriete la cámara de rizo-sandwich con cinta eléctrica de vinilo. Sellar los bordes con arcilla de modelado y además grabarlos con cinta eléctrica de vinilo(Figura 2F).
NOTA: Si hay muchas burbujas de aire en el sedimento, o granos de sedimento entre los portaobjetos del microscopio espaciador y la segunda placa de vidrio, la cámara debe volver a montarse ya que el agua de los poros puede escaparse (repetir los pasos 2.4 - 2.8). - Use un plástico opaco para cubrir el rizo-sandwich, pero deje una hendidura en el papel de aluminio para que las hojas de la planta sobresalgan. Cortar una ventana en la lámina de plástico, por lo que se puede abrir para los experimentos por desdoblamiento. Cierre la ventana durante los tiempos de aclimatación utilizando bandas de goma(Figura 2G)para proteger el optode del blanqueamiento fotográfico mientras la planta está incubada.
NOTA: Como el crecimiento de algas podría interferir potencialmente con las concentraciones de O2 medidas, recomendamos tratar de minimizarlo, mediante el uso de agua filtrada, equipos experimentales prelimpiados y la eliminación de algas en el momento de la formación.
3. Incubación de cámara de rizo-sandwich
- Coloque la cámara rizo-sandwich en un tanque de agua (32 x 7 x 28 cm3) en una posición ligeramente inclinada para fomentar el crecimiento de la raíz contra el optode plano.
- Llene el tanque de agua con suficiente agua para sumergir completamente las hojas de la planta.
- Establecer un ciclo oscuro de 14 h de luz y 10 h para la aclimatación de la planta utilizando una lámpara de control de tiempo. Coloque una bomba de aire o de agua en el tanque para asegurar la aireación y la mezcla del agua(Figura 2H).
4. Imágenes
- Configuración de imágenes
- Retire la lámina de plástico que cubre el optodo plano en la cámara de rizo-sandwich. Coloque la cámara con la pared de cristal con el optode en posición vertical contra la pared del acuario. Usa un espaciador para presionar la cámara de rizo-sandwich contra la pared del acuario.
NOTA: El espesor total de la pared del acuario más la pared de la cámara rizo-sandwich no debe ser demasiado grueso, sin embargo, los espesores de vidrio para las paredes de acuario para la iluminación se recomiendan con > 1 cm, con el fin de reducir la cruz espacial mediante el aumento de la atenuación de la luz dispersa. Es importante, utilizar el mismo material para ambas paredes de vidrio (mismo índice refractario), con el fin de minimizar la dispersión de la luz en la interfaz del material; ya que esto llevaría a una imagen borrosa, así12. - Coloque la cámara de vida de intensidad luminiscencia basada en dominio de frecuencia equipada con un objetivo (ver Tabla de Materiales)delante del acuario y el área de interés (raíces de la planta acuática Littorella uniflora, que están en contacto directo con el optode plano) (Figura 3).
NOTA: La cámara se puede colocar en un soporte de laboratorio para permitir un ajuste sencillo de la altura de la cámara. La posición del soporte de laboratorio debe marcarse y mantenerse fija. Además, la cámara se puede pegar en el soporte de laboratorio para evitar el movimiento accidental de la cámara durante el experimento. - Atornille un filtro de emisión adecuado para la toma de imágenes PtTFPP como tinte indicador (ver Tabla de materiales)en el objetivo de la cámara, para eliminar las inferencias de la fuente de excitación.
NOTA: Los filtros atornillados son ideales, pero los filtros cuadrados también se pueden utilizar con un adaptador adecuado, o pegándolos cuidadosamente al objetivo. - Conecte una fuente de excitación LED (consulte Tabla de materiales)a la modulación y salida de compuerta oscura de la cámara.
NOTA: El primero proporciona la señal de modulación para la fuente de luz, mientras que el segundo apaga la luz durante la lectura de la imagen del sensor de imagen. Conecte la fuente de excitación LED y la cámara a un ordenador. La luz de fondo debe minimizarse durante la lectura de la imagen, ya sea oscureciendo toda la habitación o poniendo un paño denso y negro sobre toda la configuración. En este último caso, es importante garantizar una ventilación suficiente para evitar el calentamiento de la cámara. - Fije la guía de luz en la fuente de excitación LED y colóquela para iluminar uniformemente la lámina de optode plana que cubre el área de interés.
NOTA: En la fuente de excitación LED utilizada es posible cambiar entre 3 LEDs diferentes (460 nm, 528 nm, 625 nm), cuyo intensidad se puede ajustar a través del software de control.
- Retire la lámina de plástico que cubre el optodo plano en la cámara de rizo-sandwich. Coloque la cámara con la pared de cristal con el optode en posición vertical contra la pared del acuario. Usa un espaciador para presionar la cámara de rizo-sandwich contra la pared del acuario.
- Ajustes y funcionamiento de la cámara
NOTA: Para los experimentos descritos, utilizamos una cámara de por vida basada en dominio de frecuencia en combinación con un módulo dedicado para imágenes de por vida en un paquete de software disponible comercialmente (consulte Tabla de materiales).- Seleccione la cámara en el software elegido antes de usarlo.
NOTA: Los controladores de software y cámara deben instalarse antes de la toma de imágenes siguiendo las directrices del fabricante. - Abra el software de control LED (de nuevo instalado antes de iniciar el experimento) y elija el LED adecuado (aquí: 528 nm) marcando el modo de espera. Ajuste la intensidad del LED según sea necesario (aquí al 30%). Asegúrese de que el LED sea activado por el TTL externo; esto se hace marcando analógico y sincronizando para el LED.
NOTA: La intensidad del LED debe ajustarse individualmente, ya que una potencia láser demasiado alta puede conducir a un blanqueo fotográfico acelerado del indicador o del tinte de referencia. - Enfoque la cámara y ajuste la apertura del objetivo manualmente (en el presente estudio utilice f s 2.8).
NOTA: Es importante enfocar la cámara en el optode plano y no en el cristal del acuario; esto se puede asegurar tomando una imagen con una regla para la escala, y centrándose en la sombra de la regla en el optode, en lugar de en la regla real. - Establezca los siguientes parámetros en el panel de control de la cámara del software: fuente de modulación interna; onda sinusoidal para la forma de onda de salida; muestreo de fase adicional (Sí); 8 muestras de fase, orden de fase opuesta, lectura de toque A + B; Frecuencia de modulación de 5 kHz.
NOTA: Estos parámetros afectan a la calidad de la imagen y se pueden cambiar si es necesario. El fabricante de la cámara proporciona pautas sobre los parámetros individuales (El fabricante de la cámara está lanzando directrices y actualizaciones cada vez que el software se actualiza). - Tome una imagen de referencia antes de los experimentos.
NOTA: Esto se puede hacer mediante imágenes de un estándar de calibración (un tinte luminiscente con una vida útil conocida (ns o s)), o utilizando la luz reflejada del LED. En este último caso, el filtro de paso largo de emisión debe eliminarse del objetivo y la vida útil conocida se puede establecer en 1 ns. - Ajuste el tiempo de exposición en la sección de calibración del software de imágenes dedicado hasta que la lectura de ROI Statistics (en la parte inferior de este panel) para la imagen de intensidad de luminiscencia normalizada esté en el rango de 0.68 - 0.72.
NOTA: Ahora la duración de la referencia (por ejemplo, 1 ns) se da como entrada para el software. - Pulse Capturar referencia para iniciar la adquisición de una serie de medición de referencia.
NOTA: Cuando haya terminado, los datos de referencia se almacenan y se pueden realizar mediciones de un solo lapso de tiempo en muestras.
- Seleccione la cámara en el software elegido antes de usarlo.
- Calibración del optode O2
- Coloque un pedazo de un optode sensible o2plano en un acuario de vidrio (pequeño). Fije el optode plano en la pared de vidrio de la cámara de calibración como se describió anteriormente (ver sección 2.3). Coloque el acuario de calibración delante de la cámara. Garantice una iluminación uniforme por el LED, así como que el optode llene todo el campo de visión.
NOTA: El optode plano debe ser de la misma pieza de papel de aluminio o hecho del mismo cóctel sensor que la lámina utilizada en el experimento real. - Llene el acuario con el mismo medio líquido que se utiliza en los experimentos.
NOTA: El uso de diferentes medios para calibraciones y experimentos puede influir en la medición (por ejemplo, cambiando la respuesta del sensor y/o la solubilidad de O2). Por lo tanto, la calibración debe hacerse en el mismo medio, y a la misma temperatura que el experimento real. Las fluctuaciones de temperatura afectarán a la señal de luminiscencia y deben evitarse. Sin embargo, si la temperatura no se puede mantener estable, la compensación de la temperatura debe hacerse calibrando el optodo sensible O2(múltiples puntos) a diferentes temperaturas (relevantes) y el posterior recálculo de los valores. - Ajuste la concentración de O2 dentro del acuario de calibración descargando el agua con una mezcla de gas de aire/N2 de concentración conocida de O2, utilizando un dispositivo de mezcla de gas. Asegúrese de que el agua esté bien equilibrada con la mezcla de gas usada aireando durante un tiempo suficiente (depende del caudal y el tamaño del acuario).
NOTA: Recomendamos monitorear el nivel De2 en el acuario de calibración con un sensor O2 externo calibrado con compensación de temperatura (por ejemplo, utilizando un sensor de fibra óptica o electroquímico O2). - Tome una serie de imágenes en diferentes concentraciones de O2 en la cámara de calibración.
NOTA: Se deben medir al menos cinco concentraciones diferentes de O2 para permitir un ajuste adecuado de la curva a los datos de calibración adquiridos. Es importante medir a 0 hPa (condiciones anóxicos) y luego distribuir los otros valores en el rango dinámico de su tinte indicador específico. Aquí usamos PtTFPP como el tinte indicador sensible O2inmovilizado en una matriz de poliestireno. Las imágenes fueron tomadas a 0, 48, 102, 156 y 207 hPa; 207 hPa corresponde al 100% de saturación de aire en la salinidad y presión dada.
- Coloque un pedazo de un optode sensible o2plano en un acuario de vidrio (pequeño). Fije el optode plano en la pared de vidrio de la cámara de calibración como se describió anteriormente (ver sección 2.3). Coloque el acuario de calibración delante de la cámara. Garantice una iluminación uniforme por el LED, así como que el optode llene todo el campo de visión.
- Imagen de la muestra
- Coloque la muestra delante de la cámara y garantice una iluminación uniforme.
- Apague la luz que suministra irradiación a la planta (y a todas las demás fuentes de luz) justo antes de adquirir la imagen de vida útil de la luminiscencia de la planta. Ajuste el tiempo de adquisición en función de la imagen de intensidad, asegurándose de que la señal no esté sobresaturada ni demasiado débil para una buena relación señal/ruido (S/N) en la determinación de la vida útil.
- Exponer la planta a diferentes condiciones de luz (por ejemplo, luz/oscuridad) y adquirir un conjunto de imágenes.
- Encienda la luz de la habitación para adquirir una imagen estructural.
NOTA: Cuando la luz de fondo está encendida, la cámara no medirá una imagen realista de por vida. Sin embargo, la imagen de intensidad ahora muestra todo el campo de visión como se ve a través del optode semitransparente. - Tome una imagen con una regla o similar en el campo de visión para habilitar el escalado posterior de las imágenes adquiridas.
5. Análisis de datos
- Exporte las imágenes de duración de fase e intensidad directamente desde el software de imágenes dedicado, utilizando la macro proporcionada por el fabricante de la cámara.
- Realice más análisis de imágenes utilizando un software de análisis de imágenes de libre acceso (consulte Tabla de materiales).
- Abra las imágenes de duración de fase de la calibración en el software de análisis de imágenes y determine la media de toda la imagen utilizando la función de medición. Trazar las vidas útiles medidas con respecto a las concentraciones o2 conocidas para determinar la función de calibración(Figura 4A).
- Calcular a partir de todos los datos (0 es la duración de la fase medida en ausencia de O2). Trazar estos valores frente a las concentraciones O2 conocidas(Figura 4B).
- Determine los parámetros Ksv y f de la gráfica de calibración, utilizando el modelo simplificado de dos sitios para el enfriamiento dinámico de colisiones (ecuación 3)38,39 donde [Q] es la concentración de O2. Defina la función de ajuste en el software de análisis de datos, que luego determina Ksv y f.
(3)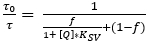
- Abra las imágenes de muestra adquiridas en el software de análisis de imágenes para convertir las vidas útiles de las imágenes en concentraciones de O2, utilizando los parámetros determinados Ksv, f y 0.
NOTA: Como enfoque alternativo, también se pueden utilizar directamente los valores de duración de la fase de calibración adquirida(figura 4A). En este caso, se utiliza un ajuste exponencial mediante la función de ajuste de curva para la calibración. - Abra la imagen con la regla siguiente en el software de análisis de imágenes y mida una distancia conocida utilizando la herramienta de medición. Establezca esta medida como escala global en Establecer escala.
Resultados
Como ejemplo de aplicación para el nuevo sistema de imágenes, mostramos imágenes 2D O2 de una muestra biológica compleja (es decir, la rizoesfera de la planta acuática Littorella uniflora).
En primer lugar, el método describe la fabricación de una película de sensor plano, un llamado optode plano. Como se ve en la Figura 1,tal optode está hecho de una capa delgada de un indicador óptico en una matriz de polímero que se extiende sobre un soporte transparente. Siguiendo el protocolo descrito, se obtiene una película de sensor homogénea con un espesor uniforme, tal como se define por la separación del dispositivo de recubrimiento de cuchillo. Si el optode producido tiene una distribución irregular del material del sensor (por ejemplo, agujeros en el recubrimiento, muestra rayas o agregados de tinte (esto se puede evaluar visualmente y visualmente con la ayuda de una lámpara UV) ), el protocolo debe repetirse y todos los materiales deben limpiarse a fondo con acetona.
Una vez preparado el optode plano, la muestra se puede poner en contacto con la capa de sensación del optode plano, como se muestra aquí con el optode plano integrado en una cámara de rhizo-sandwich, donde las raíces de una planta dentro de una matriz sedimentaria circundante se pueden colocar en estrecho contacto con el optode plano(Figura 2). Si se prepara correctamente, la cámara de rizo-sandwich debe ser fácilmente movible de un acuario (incubación) al otro (medida). Si no se construye correctamente, la cámara de rizo-sandwich puede ser inestable, perder sedimentos o contener burbujas de aire. Por lo tanto, se recomienda el examen visual de la cámara rizo-sandwich directamente después del montaje.
El protocolo dado permite la toma de imágenes de duración de la luminiscencia basada en dominio de frecuencia de la muestra en contacto con el optode plano mediante la cámara de vida útil de luminiscencia basada en dominio de frecuencia. En las publicaciones recientes8,29se ofrecen más detalles sobre este sistema de cámaras, como el modo de adquisición de imágenes y las características científicas complementarias de la cámara de óxido metálico(SCMOS).
La configuración en sí es bastante simple y sólo incluye la cámara que controla una fuente de luz (en este caso, una fuente de excitación LED) y la muestra con el optode(Figura 3). Asegúrese de que todas las piezas estén correctamente conectadas y de que la muestra esté iluminada de forma homogénea. Es necesario evitar la luz de fondo mientras se preforman las mediciones.
Antes de tomar imágenes de la muestra, el optode debe calibrarse. Como se ve en la Figura 4A, la vida útil de la luminiscencia medida disminuye con el aumento de la concentración de O2 después de una decadencia casi exponencial. Esta relación también se puede describir mediante el modelo simplificado de dos sitios(Figura 4B y ecuación 3). En el ejemplo dado, los parámetros necesarios para calcular posteriormente la concentración de O2 fueron los siguientes; á0 a 56,26 s, Ksv a 0,032 hPa-1 y f a 0,86.
Realizar una calibración también es una manera ideal de probar que el sistema funciona correctamente. Si todos los componentes se instalan como se describe aquí (o dentro de las directrices de los fabricantes), la vida útil medida debe mostrar la misma dependencia de O2 como se ve en la Figura 4. Además, para la misma combinación de materiales de sensor O2 (polímero y tinte), el medida0 debe estar en el mismo rango (a unos pocos s) que se mide aquí (principalmente influenciado por la temperatura experimental). Si no puede obtener una curva de calibración similar, asegúrese de que todos los pasos se han seguido correctamente. A veces el optode se fija accidentalmente con el lado sensible frente a la pared de vidrio en lugar de la muestra, o las imágenes adquiridas están sobreexpuestas o subexpuestas.
Con los parámetros de calibración, es posible determinar la concentración de O2 mediante la toma de imágenes de la vida útil de la luminiscencia. Esto se demuestra en la Figura 5A,B, donde la distribución de la concentración de O2 en la rizoesfera de Littorella uniflora se imaginó en la oscuridad y después de la exposición a la luz a 500 fotones de molm m-2 s-1 para 12 h, respectivamente. Debido a la actividad fotosintética de la planta, la concentración de O2 en la rizoesfera aumentó después de la exposición a la luz. Además de las imágenes de por vida, también se pueden obtener imágenes "estructurales" bajo iluminación externa, manteniendo la geometría de imagen fija. De este modo, las imágenes de O2 se pueden correlacionar con precisión con la imagen estructural(Figura 5C),secciones transversales o regiones de interés. Por ejemplo, los perfiles de concentración de O2 a través de una sola raíz se extrajeron de la imagen adquirida en oscuridad y luz, respectivamente(Figura 5D).

Figura 1: Fabricación de un optodo plano O2. (A) Se fija una lámina PET en una placa de vidrio y el dispositivo de recubrimiento de cuchillo se coloca en la lámina. (B) El cóctel del sensor preparado se extiende sobre la lámina PET como una línea delgada delante del dispositivo de recubrimiento de cuchillo. (C) El dispositivo de recubrimiento de cuchillo se mueve hacia abajo para extender el cóctel del sensor como una película delgada en la lámina PET, que después de la evaporación del disolvente resulta en un optode plano listo para usar. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Montaje de cámara Rhizo-sandwich con integración de un optode O2 plano. (A) El optode se fija en una de las placas de vidrio utilizando una película de agua. (B) El optode se pega a la placa con cinta eléctrica. (C) El sedimento se rellena en la placa opuesta con los espaciadores conectados (es decir, portaobjetos de microscopio). (D) Las raíces de las plantas se colocan en el sedimento uniformemente extendido. (E) La cámara de rizo-sandwich está cerrada y fijada temporalmente con abrazaderas. (F) Cámara de rizo-sandwich totalmente cerrada y montada. (G) Para proteger el optode de la exposición a la luz por la lámpara de incubación y para evitar el crecimiento de algas se coloca una cubierta de plástico sobre la cámara de rizo-sandwich montada. (H) La cámara rizo-sandwich incubada en un acuario. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Configuración de imágenes que contiene la cámara de vida de la luminiscencia basada en el dominio de frecuencia, con el objetivo centrado en la muestra con el optode desde atrás a través del acuario transparente y las paredes de la cámara de rizo-sandwich. La guía de luz de la fuente de excitación LED se coloca para iluminar la muestra uniformemente. Haga clic aquí para ver una versión más grande de esta figura.
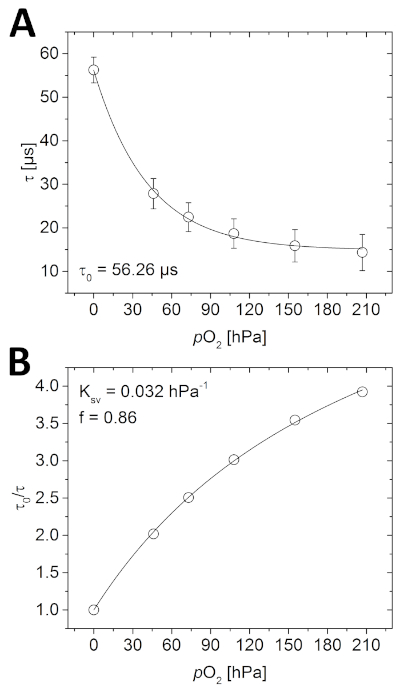
Figura 4: Curvas de calibración para optode planar O2. (A) Diferentes vidas de fosforescencia medidas en las respectivas concentraciones de O2 en la cámara de calibración llena de agua. (B) Gráfica Stern-Volmer de los datos de calibración ajustados utilizando el modelo simplificado de dos sitios para el enfriamiento dinámico de colisiones (ecuación 3). Haga clic aquí para ver una versión más grande de esta figura.
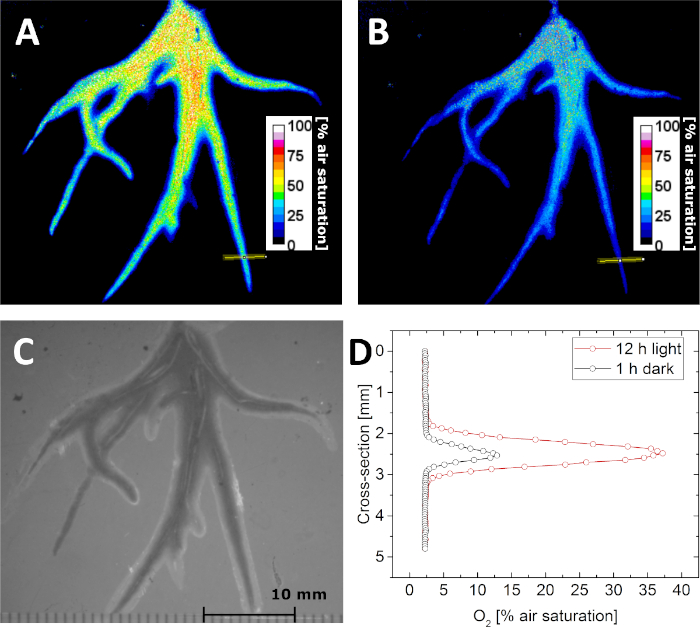
Figura 5: Imagen de por vida de la distribución O2 en la rizoesfera de la planta acuática Littorella uniflora. (A) O2 distribución después de mantener la planta bajo luz durante 12 h a aproximadamente 500 mmol fotones m-2 s-1. (B) O2 distribución después de mantener la planta en tinieblas durante 1 h. (C) Imagen estructural de las raíces de la planta como se ve a través del optode plano. (D) Perfil de concentración O2 transversal (la ubicación se indica mediante la línea amarilla en el panel A y B) después de 12 h de luz (rojo) y 1 h en oscuridad (negro). Adaptado con el permiso de (Koren, K., Mo-hammer, M., Scholz, V. V., Borisov, S.M., Holst, G., K-hl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Química Analítica. 91 (5), 3233-3238, doi: 10.1021/acs.analchem.8b05869 (2019)). Copyright (2019) American Chemical Society. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
En este protocolo, se cubre todo el flujo de trabajo desde la preparación del optode hasta el análisis de imágenes O2. Siguiendo este protocolo, se pueden obtener imágenes químicas utilizando la nueva cámara de duración de la luminiscencia basada en el dominio de frecuencia. Dependiendo de la aplicación, los optodos planos se pueden fabricar en varios tamaños y espesores de capa de la capa del sensor que van desde pesados optodos planos de 50-100 m de espesor de varias décimas de centímetro cuadrado hasta resbalones de cubierta del microscopio con capas de sensor de <1 m de espesor6,40. El potencial de este método se demostró con una aplicación particular, pero no sólo se limita a la toma deimágenes O 2 en rizoesferas vegetales12,28.
Este método tiene varios beneficios en comparación con los métodos de imagen química basados en intensidad de luminiscencia pura. Las imágenes de por vida luminosa no se ven afectadas, o al menos mucho menos, por la iluminación desigual, el grosor desigual del piso de los pliegues y el blanqueo fotográfico25. Además, este método evita el uso de un tinte de referencia adicional común en la imagen ratiométrica17,37. En comparación con otros sistemas de cámaras basados en la vida útil, como las cámaras de dominio del tiempo cerradas de uso común8,26, el nuevo sistema de cámara y el protocolo presentado aquí pueden ofrecer resultados comparables. En una publicación reciente, se compararon las características analíticas de esos dos sistemas y se encontró que el sistema de cámaras de vida útil de luminiscencia basado en dominios de frecuencia es al menos comparable al predecesor de sintibronse basado en el dominio del tiempo8.
Hemos presentado el optode O2 más simple que consiste únicamente en un indicador en una matriz de polímeros. Además de múltiples otros posiblesindicadores O2 que podrían ser utilizados aditivos pueden incluirse, es decir, agentes de dispersión como TiO2 o polvo de diamante2 para aumentar la señal del sensor mientras se reduce la transparencia del optode. También se pueden utilizar destidados adicionales para mejorar la intensidad de la señal a través de la transferencia de energía41.
Para la fabricación de optode plano, se recomienda utilizar un hueco en el dispositivo de recubrimiento de cuchillas de 75 - 120 m para producir un espesor final de la capa del sensor de alrededor de 7,5 a 12 m después de la evaporación del disolvente (alrededor del 10% de la brecha utilizada), cuando se utiliza la composición de cóctel del sensor descrita. Este es un buen compromiso entre la intensidad de la señal, que se puede modificar mediante una mayor carga de tinte, o mediante la elección de tintes de indicador y referencia de mayor brillo, y el tiempo de respuesta. Un aumento en el espesor de la capa se traduce en un aumento en el tiempo de respuesta, ya que el intervalo de tiempo necesario para que el analito alcance un equilibrio termodinámico en la capa de sensibilidad con el medio circundante aumenta12.
Los optodes, como se describe aquí, reaccionan a los cambios en la concentración de O2 en pocos segundos17 mientras siguen teniendo una señal de luminiscencia suficientemente fuerte. Los recubrimientos de sensores ultradelgados con tiempos de respuesta de menos de un segundo se pueden realizar con recubrimiento de espín6. Si el soporte o el dispositivo de recubrimiento de cuchillo sin limpiar bien, podría dar lugar a capas de sensores no homogéneas. Además, cuando el cóctel no es completamente homogéneo o se aplica demasiado rápido después de extenderse delante del dispositivo de recubrimiento tal resultado no deseado se puede observar. Por lo tanto, es posible que necesite algo de práctica para preparar optodes óptimos.
El método se puede utilizar para tomar imágenes de muestras que se pueden poner en contacto con el optode, como ciertos animales marinos42, biopelículas6 y suelos31 sólo para nombrar unos pocos. Presentamos una configuración independiente utilizando un objetivo, sin embargo, la cámara se puede acoplar fácilmente a un microscopio para imágenes químicas de mayor resolución43.
Mientras que la imagen de vida útil de luminiscencia basada en dominio de tiempo permitió la supresión de la fluorescencia en segundo plano26,esto es un problema cuando se utiliza el nuevo sistema de cámara basado en dominio de frecuencia8. Debido a la adquisición continua de imágenes, esta cámara grabará cualquier fluorescencia de fondo de la muestra que pueda ser excitada por el LED seleccionado y emita en la ventana espectral seleccionada según lo definido por el filtro de emisión en el objetivo de la cámara. Esto resultará en una vida aparentemente más baja y, por lo tanto, en lecturas falsas. En caso de trabajar con muestras con una fluorescencia intrínseca significativa superpuesta con la excitación y emisión del sensor O2, es esencial aplicar un aislamiento óptico adicional en la parte superior del optode, recubriendo una capa adicional que contenga negro de carbono2,17. Por lo tanto, sólo la luminiscencia emitida por el optode plano llegará a la cámara. Con el fin de comprobar la luminiscencia de fondo, se puede tomar una imagen sin el optode, que luego mostraría exclusivamente luminiscencia intrínseca de la muestra. También es posible añadir agentes de dispersión como TiO2 o polvo de diamante2,44, al cóctel sensor, para aumentar la intensidad de la luminiscencia del tinte indicador. Sin embargo, esto también puede conducir a un blanqueo fotográfico más rápido y TiO2 es un fotocatalizador conocido, que puede afectar a la fotoestabilidad de un tinte41. Otro aspecto a tener en cuenta es la luz de fondo. Cuando la duración de la luminiscencia de la imagen, la luz de fondo debe evitarse de la manera más eficiente posible. Por lo tanto, este método de imagen requiere que la configuración se coloque en un entorno oscuro y cualquier fuente de luz externa debe desactivarse temporalmente durante la adquisición de la imagen.
En resumen, la imagen de por vida de luminiscencia es un método de imagen química robusto que se puede adaptar a muchas aplicaciones diferentes. Este protocolo (ver sección 1 - 5) cubre todos los pasos esenciales para generar una imagen O2 y utiliza el sistema de imágenes de vida útil de luminiscencia de dominio de frecuencia más flexible actualmente, que puede reemplazar la cámara de dominio del tiempo cerrada descontinuada para imágenes 2D O2 con optodos planos.
Divulgaciones
El autor Gerhard Holst es un empleado de PCO AG que fabrica el sistema de cámara utilizado en este artículo. PCO AG contribuyó financieramente a los costos de publicación y acceso abierto de este artículo.
Agradecimientos
Agradecemos a Sofie Lindegaard Jakobsen (Universidad de Copenhague) y Lars Borregaard Pedersen (Universidad de Aarhus) por la asistencia técnica. La financiación de este estudio se obtuvo de una subvención Sapere-Aude Advanced del Fondo Independiente de Investigación de Dinamarca (DFF-1323-00065B; MK), subvenciones de proyectos del Fondo Independiente de Investigación de Dinamarca Ciencias Naturales (DFF-8021-00308B; MK) y Ciencias Técnicas y de Producción (DFF-8022-00301B y DFF-4184-00515B; MK), la Fundación Nacional danesa de Investigación (DNRF136) y la Fundación Poul Due Jensen (KK).
Materiales
| Name | Company | Catalog Number | Comments |
| Air pump with air stone and water pump | Local aquarium store | ||
| Chloroform | Sigma Aldrich | 67-66-3 | |
| DC4 silicone compound | Dow Corning GmbH | 2793695 | |
| Gas mixer | Vögtlin Instruments GmbH | red-y compact meter GCM | This is just one possible instrument. Several companies offer gas mixing devices |
| Glass plates and aquaria | Local aquarium or hardware store | ||
| ImageJ Software | ImageJ | Freely available imaging software (imagej.nih.gov/ij/index.html) | |
| Knife-coating device | BYK-GARDNER GMBH byk.com | 2021 | This is a four sided film applicator enabling easy variation of the film thickness. Other versions are also available. We recommend a thickness of the applied film between 75-120 µm, which yields a final sensor layer thickness of ~10% of the applied thickness before solvent evaporation. |
| LED lamp, Reflector PAR38 | Megaman | MM17572 | |
| LED LEDHUB | Omicon Laserage, Germany | Can be configured with a variety of LEDs. For the presented example, the green LED (528 nm) is essential | |
| LOCTITE AA 3494 | Henkel AG & Co. KGaA | NA | Acrylic-based instant adhesive |
| NIS Elements AR Software | Nikon Inc | Software package used for image acquisition | |
| pco.flim | PCO AG, Germany | Frequency domain based luminescence lifetime camera | |
| platinum(II)-5,10,15,20-tetrakis-(2,3,4,5,6-pentafluorphenyl)-porphyrin (PtTFPP) | Frontier Scientific | PtT975 | O2 indicator |
| polyethylene terephthalate (PET) foil | Goodfellow | 320-992-72 | Such foils might also be found from other providers and serve as solid support |
| Polystyrene (PS) | Sigma Aldrich | 9003-53-6 | Polymer matrix |
| Schott RG610 filter | www.uviroptics.com | Here 52mm screw on Filters can obtained. Other sources offer square glass filters from Schott glass that can be fixed in front of the objective | |
| Vinyl electrical tape | Scotch, Super 33+ | NA | |
| Zeiss Makro Planar 2/100 with Hama C for Nikon adaptor | delivered with the camera | Here any other objective might also be used in combination with an adaptor if the objective does not have a C-mount |
Referencias
- Glud, R. N., Kühl, M., Kohls, O., Ramsing, N. B. Heterogeneity of oxygen production and consumption in a photosynthetic microbial mat as studied by planar optodes. Journal of Phycology. 35 (2), 270-279 (1999).
- Moßhammer, M., Strobl, M., Kühl, M., Klimant, I., Borisov, S. M., Koren, K. Design and Application of an Optical Sensor for Simultaneous Imaging of pH and Dissolved O2 with Low Cross-Talk. ACS Sensors. 1 (6), 681-687 (2016).
- Jensen, S. I., Kühl, M., Glud, R. N., Jørgensen, L. B., Priemé, A. Oxic microzones and radial oxygen loss from roots of Zostera marina. Marine Ecology Progress Series. , 49-58 (2005).
- Larsen, M., Santner, J., Oburger, E., Wenzel, W. W., Glud, R. N. O2 dynamics in the rhizosphere of young rice plants (Oryza sativa L.) as studied by planar optodes. Plant and Soil. 390 (1-2), 279-292 (2015).
- Brodersen, K. E., Koren, K., Moßhammer, M., Ralph, P. J., Kühl, M., Santner, J. Seagrass-Mediated Phosphorus and Iron Solubilization in Tropical Sediments. Environmental Science and Technology. 51, 14155-14163 (2017).
- Kühl, M., Rickelt, L. F., Thar, R. Combined imaging of bacteria and oxygen in biofilms. Applied and Environmental Microbiology. 73 (19), 6289-6295 (2007).
- Sønderholm, M., et al. Tools for studying growth patterns and chemical dynamics of aggregated Pseudomonas aeruginosa exposed to different electron acceptors in an alginate bead model. npj Biofilms and Microbiomes. 3, 1-11 (2018).
- Koren, K., Moßhammer, M., Scholz, V. V., Borisov, S. M., Holst, G., Kühl, M. Luminescence Lifetime Imaging of Chemical Sensors - A Comparison between Time-Domain and Frequency-Domain Based Camera Systems. Analytical Chemistry. 91 (5), 3233-3238 (2019).
- Brodersen, K. E., Koren, K., Lichtenberg, M., Kühl, M. Nanoparticle-based measurements of pH and O2 dynamics in the rhizosphere of Zostera marina L.: effects of temperature elevation and light-dark transitions. Plant, Cell & Environment. 39 (7), 1619-1630 (2016).
- Zhu, Q., Aller, R. C., Fan, Y. High-Performance Planar pH Fluorosensor for Two-Dimensional pH Measurements. in Marine Sediment and Water. Environmental Science & Technology. 39, 8906-8911 (2005).
- Murniati, E., Gross, D., Herlina, H., Hancke, K., Glud, R. N., Lorke, A. Oxygen imaging at the sediment-water interface using lifetime-based laser induced fluorescence (τLIF) of nano-sized particles. Limnology and Oceanography: Methods. 14 (8), 506-517 (2016).
- Santner, J., Larsen, M., Kreuzeder, A., Glud, R. N. Two decades of chemical imaging of solutes in sediments and soils - a review. Analytica Chimica Acta. , 9-42 (2015).
- Glud, R. N. Oxygen dynamics of marine sediments. Marine Biology Research. 4 (4), 243-289 (2008).
- Revsbech, N. P., Jorgensen, B. B., Blackburn, T. H. Oxygen in the Sea Bottom Measured with a Microelectrode. Science. 207 (4437), 1355-1356 (1980).
- Klimant, I., Meyer, V., Kuhl, M. Fiberoptic oxygen microsensors, a new tool in aquatic biology. Limnology and Oceanography. 40 (6), 1159-1165 (1995).
- Glud, R. N., Tengberg, A., Kühl, M., Hall, P. O. J., Klimant, I., Holst, G. An in situ instrument for planar O2 optode measurements at benthic interfaces. Limnology and Oceanography. 46 (8), 2073-2080 (2001).
- Larsen, M., Borisov, S. M., Grunwald, B., Klimant, I., Glud, R. N. A simple and inexpensive high resolution color ratiometric planar optode imaging approach: application to oxygen and pH sensing. Limnology and Oceanography: Methods. 9, 348-360 (2011).
- Glud, R., Ramsing, N., Gundersen, J., Klimant, I. Planar optrodes:a new tool for fine scale measurements of two-dimensional O2 distribution in benthic communities. Marine Ecology Progress Series. 140, 217-226 (1996).
- Frederiksen, M. S., Glud, R. N. Oxygen dynamics in the rhizosphere of Zostera marina: A two-dimensional planar optode study. Limnology and Oceanography. 51 (2), 1072-1083 (2006).
- Quaranta, M., Borisov, S. M., Klimant, I. Indicators for optical oxygen sensors. Bioanalytical Reviews. 4, 115-157 (2012).
- Koren, K., Hutter, L., Enko, B., Pein, A., Borisov, S. M., Klimant, I. Tuning the dynamic range and sensitivity of optical oxygen-sensors by employing differently substituted polystyrene-derivatives. Sensors and Actuators B: Chemical. 176 (100), 344-350 (2013).
- Borisov, S. M. Fundamentals of Quenched Phosphorescence O2 Sensing and Rational Design of Sensor Materials. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. , 1-18 (2018).
- Wang, X., Wolfbeis, O. S. Optical methods for sensing and imaging oxygen: materials, spectroscopies and applications. Chemical Society Reviews. 43, 3666-3761 (2014).
- Ehgartner, J., Wiltsche, H., Borisov, S. M., Mayr, T. Low cost referenced luminescent imaging of oxygen and pH with a 2-CCD colour near infrared camera. The Analyst. 139 (19), 4924 (2014).
- Meier, R. J., Fischer, L. H., Wolfbeis, O. S., Schäferling, M. Referenced luminescent sensing and imaging with digital color cameras: A comparative study. Sensors and Actuators B: Chemical. 177, 500-506 (2013).
- Holst, G., Kohls, O., Klimant, I., König, B., Kühl, M., Richter, T. A modular luminescence lifetime imaging system for mapping oxygen distribution in biological samples. Sensors and Actuators B. 51, 163-170 (1998).
- Moßhammer, M., Brodersen, K. E., Kühl, M., Koren, K. Nanoparticle- and microparticle-based luminescence imaging of chemical species and temperature in aquatic systems: a review. Microchimical Acta. , 1-28 (2019).
- Koren, K., Kühl, M. CHAPTER 7. Optical O2 Sensing in Aquatic Systems and Organisms. Quenched-phosphorescence Detection of Molecular Oxygen: Applications in Life Sciences. 1, 145-174 (2018).
- Chen, H., Holst, G., Gratton, E. Modulated CMOS camera for fluorescence lifetime microscopy. Microscopy Research and Technique. 78, 1075-1081 (2015).
- Franke, R., Holst, G. A. Frequency-domain fluorescence lifetime imaging system (pco.flim) based on a in-pixel dual tap control CMOS image sensor. Proceedings of SPIE 93281, Imaging, Manipulation, and Analysis of Biomolecules, Cells, and Tissues XIII. , 1-19 (2015).
- Williams, P. N., et al. Localized flux maxima of arsenic, lead, and iron around root apices in flooded lowland rice. Environmental Science and Technology. 48 (15), 8498-8506 (2014).
- Schreml, S., et al. 2D luminescence imaging of physiological wound oxygenation. Experimental dermatology. 20 (7), 550-554 (2011).
- Trampe, E., et al. Functionalized Bioink with Optical Sensor Nanoparticles for O2 Imaging in 3D-Bioprinted Constructs. Advanced Functional Materials. 1804411, 1804411 (2018).
- Gouterman, M. Oxygen Quenching of Luminescence of Pressure Sensitive Paint for Wind Tunnel Research. Journal of Chemical Education. 74 (6), 697 (1997).
- Fischer, L. H., et al. Referenced dual pressure- and temperature-sensitive paint for digital color camera read out. Chemistry. 18 (49), 15706-15713 (2012).
- Fabricius-Dyg, J., Mistlberger, G., Staal, M., Borisov, S. M., Klimant, I., Kühl, M. Imaging of surface O2 dynamics in corals with magnetic micro optode particles. Marine Biology. 159 (7), 1621-1631 (2012).
- Koren, K., Jakobsen, S. L., Kühl, M. In-vivo imaging of O2 dynamics on coral surfaces spray-painted with sensor nanoparticles. Sensors and Actuators B: Chemical. 237, 1095-1101 (2016).
- Carraway, E. R., Demas, J. N., DeGraff, B. A., Bacon, J. R. Photophysics and Photochemistry of Oxygen Sensors Based on Luminescent Transition-Metal Complexes. Analytical Chemistry. 63 (4), 337-342 (1991).
- Klimant, I., Ruckruh, F., Liebsch, G., Stangelmayer, A., Wolfbeis, O. S. Fast response oxygen micro-optodes based on novel soluble ormosil glasses. Mikrochimica Acta. 131, 35-46 (1999).
- Askaer, L., Elberling, B., Glud, R. N., Kühl, M., Lauritsen, F. R., Joensen, H. P. Soil heterogeneity effects on O2 distribution and CH4 emissions from wetlands: In situ and mesocosm studies with planar O2 optodes and membrane inlet mass spectrometry. Soil Biology and Biochemistry. 42 (12), 2254-2265 (2010).
- Mayr, T., Borisov, S. M., Abel, T., Enko, B., Waich, K. Light Harvesting as a Simple and Versatile Way to Enhance Brightness of Luminescent Sensors. Analytical Chemistry. 81, 6541-6545 (2009).
- Kühl, M., et al. Microenvironmental Ecology of the Chlorophyll b-Containing Symbiotic Cyanobacterium Prochloron in the Didemnid Ascidian Lissoclinum patella. Frontiers in microbiology. 3, 1-18 (2012).
- Dalfen, I., Dmitriev, R. I., Holst, G., Klimant, I., Borisov, S. M. Background-Free Fluorescence-Decay-Time Sensing and Imaging of pH with Highly Photostable Diazaoxotriangulenium Dyes. Analytical Chemistry. 91 (1), 808-816 (2019).
- Chatni, M. R., Maier, D. E., Porterfield, D. M. Evaluation of microparticle materials for enhancing the performance of fluorescence lifetime based optrodes. Sensors and Actuators B: Chemical. 141, 471-477 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados