Summary
Abstract
Introduction
Protocol
Representative Results
Discussion
Acknowledgements
Materials
References
Medicine
ملامح التصوير للتصلب الجهازي المرتبط بمرض الرئة الخلالي
هنا، نقدم توصيات عملية لأداء التصوير المقطعي عالي الدقة الصدري لتشخيص وتقييم أمراض الرئة الخلالي المرتبطة بالتصلب الجهازي.
التشخيص المبكر لمرض الرئة الخلالي المتصل بالتصلب الجهازي (SSc-ILD) مهم لتمكين العلاج الذي يتم تناوله بأقل تأخير. ومع ذلك، تشخيص SSc-ILD هو التحدي لأن الأعراض الرئيسية هي غير محددة. يتم التعرف على التصوير المقطعي عالي الدقة (HRCT) للصدر كأسلوب تصوير حساس لتشخيص وتقييم SSc-ILD. ويمكن اعتبار تعرض المرضى للإشعاع المؤين قيداً، على الرغم من أنه يمكن اتخاذ خطوات منهجية لتخفيف هذا. نقدم توصيات عملية لإجراء عمليات المسح الضوئي HRCT وتفسير النتائج. وتشمل الملامح الرئيسية لSSc-ILD على HRCT نمط الالتهاب الرئوي الخلالي غير محددة (NSIP) مع التعتيم سطح الأرض الزجاج المحيطي والجر واسعة القصبات. على الرغم من أوجه التشابه بين SSC-ILD والتليف الرئوي مجهول السبب (IPF)، يمكن استخدام HRCT للتمييز بين هذه الحالات: في SSc-ILD مقارنة مع IPF، هناك نسبة أكبر من التعتيم الزجاج الأرض والتليف أقل الخشنة. وهناك متوسعة، والمريء مملوءة بالهواء مع القطر > 10 ملم، موحية من dysmotility المريء وينظر عادة في SSc-ILD. يشير حجم الشريان الرئوي الأكبر من الشريان الأورطي الصاعد المجاور إلى ارتفاع ضغط الدم الرئوي المتعايش. يجب مراقبة العقيدات بسبب زيادة خطر الإصابة بسرطان الرئة. مدى كبير من المرض على HRCT (≥20٪) أو درجة عالية من التليف تشير إلى زيادة خطر الوفيات. يعتبر HRCT أساسيًا لتشخيص SSc-ILD، ويمكن أن تكون التقييمات التسلسلية مفيدة في مراقبة تطور المرض أو الاستجابة للعلاج.
التصلب الجهازي (SSc) هو مرض معقد وغير متجانس المناعة الذاتية. قد يتجلى كاعتلال الأوعية الدموية، ظاهرة رينود والتليف من الجلد والأعضاء الداخلية1. SSc تصنف في أنواع فرعية على النحو التالي: محدودة جلدية, منتشر جلدية, sine scleroderma (دون تدخل الجلد), ومتلازمة تداخل SSc1.
SSc ليست موروثة في الأزياء مندليان، ولكن يبدو أن العوامل الوراثية تؤثر على قابلية لهذا المرض. تختلف معدلات الإصابة بين المجموعات العرقية وتزداد بين الأفراد الذين لديهم تاريخ عائلي من المرض2,3. كما يبدو أن عوامل الخطر البيئية موجودة، مع تعرض عالية للسيليكا أو المذيبات العضوية التي يبدو أنها تزيد من حدوث SSc4. انتشار SSC في العالم حوالي 1 في 10،0001. أكثر من الذكور تتأثر الإناث SSc، مع ذكر نسب الإناث:الذكور تتراوح بين 3:1 و 8:1، والفئة العمرية مع أعلى معدل الإصابة بالمرض هو 45-54 سنة5.
الرئة هي ثاني أكثر الأعضاء الحشوية تأثراً في المرضى الذين يعانون من SSc6. هناك نوعان من مظاهر الرئة الرئيسية من SSc: مرض الرئة الخلالي (ILD), وارتفاع ضغط الدم الرئوي7. عادة ما يكون ILD ليفيًا؛ يحدث في ما يقرب من 80٪ من المرضى الذين يعانون من SSc وأكثر شيوعا في تصلب الجلد الجلدي منتشر مما كانت عليه في شكل محدود من المرض1,8. قد يظهر ارتفاع ضغط الدم الرئوي كضغوط الدم الشرياني الرئوي المعزول (PAH، الذي لديه انتشار 13-35٪ في SSc) أو ارتفاع ضغط الدم الرئوي الناتج عن تورط البطين الأيسر / الخلل الانبساطي أو ILD / نقص الأكسجة7. وتختلف ملامح الأجسام المضادة بين المرضى الذين يعانون من SSc-ILD وأولئك الذين يعانون من SSc-PAH. على سبيل المثال، يرتبط وجود الأجسام المضادة Scl-70 المضادة مع SSc-ILD8، في حين أن الأجسام المضادة anticentromere هي أكثر شيوعا في مرضى SSc مع PAH مما كانت عليه في تلك التي لا PAH9.
وتشمل أعراض SSc-ILD ضيق التنفس والسعال وآلام في الصدر، والحد من ممارسة الرياضة. ILD هو مساهم رئيسي في المراضة في SSc10،11،12. ونتيجة لذلك، تم الإبلاغ عن تكاليف الرعاية الصحية السنوية لجميع الأسباب لتكون أعلى في المرضى الذين يعانون من SSC-ILD مما كانت عليه في تلك التي تحتوي على SSC ولا ILD: $31,285-55,446 مقابل $18,513-23,268, على التوالي13.
SSc-ILD هو السبب الرئيسي للوفيات في المرضى الذين يعانون من مرضى SSC، وهو ما يمثل 30-35٪ من الوفيات في هذه المجموعة10،14. متوسط البقاء على قيد الحياة بين المرضى الذين يعانون من مرضى SSc-ILD وقد أفيد أن تكون 5-8 سنوات10,15; وعلى سبيل المقارنة، ما يقرب من 76٪ من مجموع السكان مع SSc البقاء على قيد الحياة لأكثر من 10 عاما من ظهور المرض16. وتشمل التنبؤات الهامة للوفيات في SSc-ILD العمر، والقدرة الحيوية القسرية (FVC)، والقدرة على نشر خط الأساس للرئة لأول أكسيد الكربون (DLCO)، ومدى المرض على التصوير المقطعي عالي الدقة (HRCT)، وجود ارتفاع ضغط الدم الرئوي ومستويات كيربس فون دن لونغرين 6 (KL-6) مستضد17،18.
التشخيص المبكر مهم لتمكين العلاج الذي يمكن أن تدار مع الحد الأدنى من التأخير، وفي المرضى الذين يعانون من النمط الظاهري التدريجي، قد يكون من المحتمل أن يتباطأ تطور المرض. ومع ذلك، تشخيص SSc-ILD هو التحدي لأن الأعراض غير محددة من السعال، وضيق التنفس، والتعب يمكن أن يكون مخطئا لجوانب أخرى من SSc، مثل مرض القلب والمشاركة العضلية الهيكلية. وتشمل تقييمات لتشخيص ILDs: العرض السريري، والتاريخ، وحالة التدخين، وظيفة الرئة، والتصوير، وفي بعض الحالات، خزعة الرئة. تأكيد تشخيص SSc-ILD يتطلب العديد من التحقيقات، والتي غالبا ما تستخدم في الجمعبين 19. وتشمل التقييمات الأكثر استخداماً اختبارات وظائف الرئة و HRCT20،21،22،23. أساليب التصوير الأخرى، مثل التصوير الشعاعي للصدر والتصوير الإشعاعي (على سبيل المثال، التصوير بالرنين المغناطيسي ،التصوير بالرنين المغناطيسي، الموجات فوق الصوتية في الرئة) قد تستخدم أيضا22. تُستخدم اختبارات وظائف الرئة لتقييم شدة ILD ومراقبة مساره. ومع ذلك، فإن استخدام اختبارات وظيفة الرئة وحدها ذات استخدام محدود لتشخيص SSc-ILD24,25. يُنظر إلى HRCT للصدر على أنه أكثر الوسائل حساسية غير الغازية لتسهيل التشخيص التفريقي لـ SSc-ILD19. يمكن استخدام نتائج HRCT الأساسية ، وكذلك التغيرات مع مرور الوقت ، للتنبؤ بالمجري المستقبلي لأمراض الرئة والاستجابة المحتملة للعلاج26.
ويعتبر التعرض للإشعاع مع HRCT في بعض الأحيان كعامل يحد من الفحص المنتظم27,28; الحد من عدد شرائح هو وسيلة محتملة للحد من خطر الإشعاع، ويمكن أيضا أن تخفض الجرعة عن طريق خفض إما الجهد أو الحالي29,,30,,31. ويمكن بدلاً من ذلك النظر في طرق تقييم مختلفة. على سبيل المثال، يبدو أن التصوير بالرنين المغناطيسي لديه بعض الإمكانات لتقييم ومتابعة مرضى ILD22. في إحدى الدراسات التي استخدمت صور التصوير بالرنين المغناطيسي المرجحة T2 مع تزامن التنفس، تم إجراء HRCT بالتوازي كتقييم "معيار الذهب"؛ تم الإبلاغ عن حساسية 100٪ و 60٪ خصوصية مع التصوير بالرنين المغناطيسي لتحديد وجود ILD32. وقد تم الإبلاغ عن اتفاق مماثل بين التصوير بالرنين المغناطيسي و HRCT في الكشف عن التصنيف ILD وتصنيفه في دراسة أخرى33. على الرغم من النتائج الواعدة، التصوير بالرنين المغناطيسي هو حاليا منهجية البحث وأنها ليست مستعدة بعد للاستخدام السريري معممة.
هنا، نقدم لمحة عملية عن تفسير نتائج التصوير، مع التركيز على HRCT، لتشخيص تورط الرئة في SSc، وتحديد التشخيص، وكذلك استكشاف التطورات المستقبلية التي قد تحسن طرق التصوير وتفسير النتائج. وترد في الورقة صور من هذه اللجنة من الحالات التمثيلية.
1- المسح الضوئي لـ HRCT
- تنفيذ عملية استحواذ حجمية على HRCT للصدر36. لا يلزم وكلاء التباين36,37.
- الحصول على المقتنيات التالية مع المعلمات المبينة في الجدول 136،37.
- الحصول على مسح مستوحى supine (الحجمي) من apices الرئة إلى قاعدة الرئة.
- الحصول على مسح منتهي supine (متسلسلة مع 10-20 ملم الثغرات) من 2 سم تحت الرئة إلى قاعدة الرئة.
- احصل على اختياري ملهم (متسلسل مع فجوات 10-20 مم) من carina إلى قاعدة الرئة.
- إعطاء تعليمات التنفس للمريض قبل كل اقتناء36,37. لمسح ملهم ، ويقول "خذ في نفسا عميقا....والسماح لها بها. تأخذ في نفسا عميقا آخر....والسماح لها بها. خذ نفساً عميقاً آخر، وحبس أنفاسك. الحفاظ على عقد أنفاسك"37.
- الحصول على المسح الملهم في الإلهام الكامل35,36.
- استخدام أنحف collimation ، أقصر وقت التناوب وأعلى درجة لضمان الحصول على الصور الخالية من الحركة36. يتم تفصيل معلمات المسح المقترحة في الجدول 137.
- للحصول على الجودة المثلى للمسح الحجمي، احصل على صور رقيقة من القسم (<2 مم) مع إعادة بناء عالية الدقة المكانية35،36.
- استعراض بمسح مباشرة بعد اكتساب وتكرار إذا كان أي حركة التحف موجود أو إلهام غير كافية قد حدث37.
2- الإبلاغ
- إعداد تقرير تفسيري.
- شارك التقرير وصور HRCT مع فريق رعاية المريض وإضافتها إلى السجلات الطبية للمريض.
التشخيص
وتشمل السمات الرئيسية لSSc-ILD على HRCT عادة نمط الالتهاب الرئوي الخلالي غير محددة (NSIP) مع التعتيم الأرض الزجاجي المحيطية والاجهاد الجر واسعة(الشكل 1 والشكل 2). عتامة الزجاج الأرضي لها مسببات واسعة وغالبا ما تكون غير محددة40،41،42. هيمنة مركزية أو توزيع محيطيّة مع [سوبوورّلوري] يموّل جدّا من [نسيب](شكل 3).
عادة، أنماط ILD في الصور HRCT تشمل التشوهات مع التشوه المعماري مما أدى إلى الجر القصبات / bronchiolectasis (بما يتفق مع شكل ليفي من NSIP). في الواقع الجر القصباتية والجر القصباتية وغالبا ما تكون السمات السائدة من SSc-ILD (الشكل 4)43. قد تشمل النتائج الإضافية العسل (الشكل 5؛ أكثر شيوعًا في أشكال محدودة من SSc) ، وسماكة الحاجز بين الفتى والخطوط داخل العين ، وmicronodules40،44. العسل يشير إلى المجالات الجوية الكيسية متفاوتة المسافات من قطر ثابت عادة (~ 3-10 ملم) مع سميكة، والجدران31محددة جيدا. العسل والجر القصبات هي السمات الرئيسية للالتهاب الرئوي الخلالي المعتاد (UIP) على HRCT. على الرغم من أن هذا النمط هو الأكثر شيوعاً المرتبطة التليف الرئوي مجهول السبب (IPF)، النموذج الأولي الليفي ILD مع النمط الظاهري التدريجي، فإنه يمكن أن ينظر إليه في بعض الأحيان في المرضى الذين يعانون من SSc-ILD10. في الآونة الأخيرة، وقد تم تحديد العديد من العلامات في المرضى الذين يعانون من مرض الضام ذات الصلة ILD (بما في ذلك SSc-ILD) ونمط UIP على HRCT، ولكن ليس في تلك التي لديها IPF. هذه هي علامة الحافة المستقيمة (أي عزل التليف إلى قواعد الرئة مع ترسيم حاد في مستوى القحف دون تمديد كبير على طول الهوامش الجانبية للرئتين على الصور الإكللية) ، علامة العسل السائدة (أو المندفعة) (> 70٪ من الأجزاء الليفية من الرئة) ، وعلامة الفص العلوي الأمامي (أي ، تركيز التليف داخل الجانب الأمامي من الفصوص العليا، مع تجنيب النسبية من الجوانب الأخرى من الفصوص العليا، وما يصاحب ذلك مشاركة الفص السفلي)45. كما ارتبطت علامة الحافة المستقيمة مع مرض NSIP46، وهو نمط CT الرئيسي في SSc-ILD10.
وكثيرا ما لوحظ المُلَوَع المُسَمَّر في المريء المُزَمَّل في المرضى الذين يعانون من SSc (الشكل 6)47،48،49 وفي المرضى الذين يعانون من SSc-ILD47،48. في حين لا يوجد حد أعلى للعمر المقبول حيث المريء المتوسع قد لا يساعد بعد الآن على التفريق بين SSC-ILD و IPF، قد يكون من الصعب تفسير المريء المتوسع في المرضى الذين تزيد أعمارهم عن 65 بسبب زيادة حدوث اضطرابات حركية المريء. علم الغدد الليمفاوية Mediastinal (عادة رد الفعل), الذي محور قصيرة من العقدة الليمفاوية يتجاوز 10 مم, كما لوحظ في كثير من الأحيان في المرضى الذين يعانون من SSc-ILD47,50. يشير حجم الشريان الرئوي أكبر من الشريان الأورطي الصاعد المجاور إلى ارتفاع ضغط الدم الرئوي المتعايش (الشكل 6) ، حتى في المرضى الذين لا يعانون من أمراض الرئة الليفية51،52،53. تشير مناطق الدمج إلى العدوى المتراكبة أو الطموح أو تنظيم الالتهاب الرئوي أو النزيف أو الورم الخبيث. يجب رصد العقيدات بسبب زيادة خطر الإصابة بسرطان الرئة في SSc-ILD7؛ السرطان الابتدائي الأكثر شيوعا التي تنشأ في المرضى الذين يعانون من مرضى SSc-ILD هو غدي7,54.
SSc-ILD سهم عدد من التشابهات السريرية، ميكانيكية، والمرضية مع IPF15،55. ومع ذلك، تسمح بعض الميزات الإشعاعية بالتمايز بين هذين ILDs15،45. في SSc-ILD، بالمقارنة مع IPF، هناك نسبة أكبر من التعتيم الزجاج الأرض والتليف هو أقل الخشنة. في حالات UIP في SSc ، يمكن ملاحظة العسل في أكثر من 70 ٪ من الأنسجة الليفية الرئوية - علامة العسل المندفع56،57. وبالإضافة إلى ذلك، فإن علامة الزوايا الأربع (المعروفة أيضاً باسم علامة الفص العلوي الأمامي) أكثر شيوعاً في SSc-ILD من إشارة IPF؛ هذا هو نمط من الالتهاب و / أو التليف بشكل محوري أو بشكل غير متناسب التي تنطوي على فصوص العلوية الثنائية و وبوستروسوبيوريور السفلى58.
قد يكشف التصوير الإشعاعي للصدر في البداية ILD; ومع ذلك، فإنها لا توفر دقة التباين كافية لتشخيص موثوق. في التصويرات الإشعاعية الصدر من المرضى الذين يعانون من SSc-ILD، النمط الأكثر شيوعا هو القاعدية السائدة59. قد تشمل ميزات أخرى القصبات مرئية، وفقدان حجم والعسل. كما هو الحال مع HRCT، قد يكون وجود المريء المتوسع المليئة بالهواء مفيدًا في دعم تشخيص SSc-ILD47.
التشخيص
وقد تبين أن العديد من نتائج التصوير المختلفة ترتبط بالتكهن في SSc-ILD. وقد أفيد أن خطر الوفيات أعلى في المرضى الذين يعانون من مدى المرض لا يقل عن 20٪ على HRCT (10 سنوات البقاء على قيد الحياة كان 43٪ مقابل 67٪، على التوالي، في المرضى الذين يعانون من مدى المرض أعلاه مقابل أقل من عتبة 20٪)60. وبالمثل، فإن درجة التليف العالي على HRCT (استنادا إلى مدى التشنج والعسل) قد ارتبطت بزيادة معدل الوفيات61. ترتبط أقطار المريء الكبيرة بزيادة شدة ILD وانخفاض DLCO48. قد يحتمل أن تستخدم كثافة الرئة وقطر الشريان الرئوي للتنبؤ بخطر ارتفاع ضغط الدم الرئوي62. كما يمكن تسخير بارامترات التصوير المقطعي المحوسبة الكمية لتحديد خطر المرضى في انخفاض وظائف الرئة أو الوفيات. واقترحت إحدى الدراسات أن مدى ILD، الذي تم قياسه كمياً من HRCT، يمكن استخدامه للتنبؤ بانخفاض FVC على مدى 12شهراً 63. في دراسة أخرى، قدمت المعلمات الكمية CT الصدر نتائج مخاطر الوفيات التي كانت متسقة مع نماذج التنبؤ السريري64. على الرغم من إمكاناتها الظاهرة ، يتم النظر في المؤشرات الحيوية القائمة على التصوير حاليًا على أفضل مستوى سكاني حيث لم يتم تحديد فائدتها السريرية في المرضى الفرديين.
استجابة العلاج
Cyclophosphamide و mycophenolate mofetil تقديم فائدة متواضعة في المرضى الذين يعانون من SSc-ILD. في دراسة الرئة Scleroderma التاريخية I, أدى العلاج السيكلوفوسفامي إلى تباطؤ تطور التليف مقارنة مع الغفل65. في الآونة الأخيرة, ذكرت دراسة الرئة Scleroderma II فعالية مماثلة وتحسين التحمل مع الميكوسفينولات mofetil بالمقارنة مع cyclophosphamide66. ومع ذلك، لا تزال هناك حاجة إلى خيارات علاجية محسنة للمرضى الذين يعانون من مرض SSc-ILD. وتشمل العلاجات التي يجري التحقيق حاليا الأجسام المضادة أحادية النسيلة (مثل rituximab، abituzumab)، وكلاء مضادة للاختلاف (على سبيل المثال، nintedanib، pirfenidone)، ومثبط ثرومبلين المباشر dabigatran، ومثبط proteasome bortezomib، وزرع الخلايا الجذعية الدموية19،67.
المسلسل HRCT بمسح تظهر تطور المرض في مريض مع SSc-ILD
ويمكن استخدام تقييمات مركز حقوق الإنسان في الممارسات التي تجري في نقاط زمنية مختلفة في استقصاء تطور المرض. يظهر الشكل 7 مجموعتين من الصور HRCT الصدرية المحورية والإكليلية التي اتخذت 10 سنوات على حدة في المريض مع SSc-ILD. الصور المحورية والإكليلية الأولية(الشكل 7A, B) من الصدر HRCT تظهر باسيلار العتامة الأرضية السائدة والزجاج الشبيكة مع القصبات الجر خفيفة وجنبي تجنيب متسقة مع NSIP في هذا المريض مع SSc. المجموعة الأخيرة من الصور(الشكل 7C, D)التي اتخذت بعد 10 سنوات, تظهر زيادة الشتيك والجر القصباتية في قواعد الرئة مع انخفاض في التعتيم الزجاج الأرض على محوري والإكليال(الشكل 7C, D)صور من الصدر CT تتفق مع تفاقم طفيف من التليف الرئوي. ويمكن أيضا أن تستخدم الأشعة HRCT المسلسل لرصد استجابة العلاج68,69,70; وقد تجلى ذلك في دراسة الرئة Scleroderma II، التي استخدمت نتائج التشخيص بمساعدة الكمبيوتر على أساس التفحص HRCT لمقارنة فعالية السيكلوفوسفامي مع الميكوفينوفات mofetil في المرضى الذين يعانون من SSc-ILD68.
| المرحله | كاشف تجميع | الجهد (كيلو فولت) | الحالي (mAs) | المسح الضوئي الفاصل الزمني | الملعب | التناوب | التيار الأنبوبي تعديل |
| سوبين الملهم | الهليلة 1.2 مم | 120 (يمكن تخفيض) | 230 (يمكن تخفيض) | غير مُنَدِيًا | حوالي 1.0 | 0.5 ثانية أو أسرع | في |
| Supine انتهاء | محوري 2 × 1.0 مم | 120 | 150 | 20 ملم | غير مُنَدِيًا | 1.0 ثانية | في |
| ملهمة عرضة | محوري 2 × 1.0 مم | 120 | 150 | 20 ملم | غير مُنَدِيًا | 1.0 ثانية | في |
الجدول 1: بارامترات اقتناء التصوير المقطعي المحسوب37. غير قابل للتطبيق.
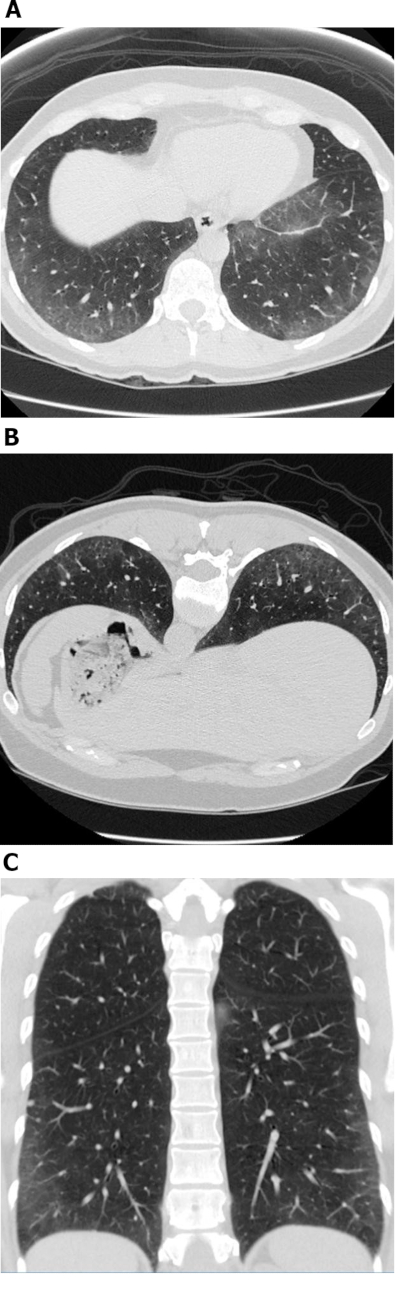
الشكل 1: التصلب الجهازي مع نمط NSIP الخلوية من المرض. Axial (A) ، المعرضة (B) والإكليلية(C)عالية الدقة الصور المقطعية المحوسبة تظهر جميعها عتامة واسعة النطاق المحيطية والبطاسية الأرضية الزجاجية السائدة ؛ هذه هي الملاحظات النموذجية مع NSIP. عدم وجود الجر القصباتية هو موحية من نمط NSIP الخلوية للمرض. NSIP = الالتهاب الرئوي الخلالي غير المحدد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 2: التصلب الجهازي مع نمط الالتهاب الرئوي الخلالي غير الليفية المحددة من المرض. تُظهر صورة التصوير المقطعي المحوري واسعة النطاق، وعتامة الزجاج الأرضي السائدة باكال مع القصبات الهوائية المرتبطة بالجر. لا سيما, المريء يظهر تمدد ملحوظ; هذا هو نموذجي من تصلب الجلد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 3: التصلب الجهازي مع نمط NSIP ليفي. صور التصوير المقطعي المحورى عالية الدقة (A و B) تظهر عتامة واسعة من الزجاج الأرضي ، والتشويه المعماري ، والجر القصبي. وتجدر الإشارة إلى أن الايخاذ الجنبي واضح؛ هذا هو نموذجي من NSIP وينظر في حوالي 50٪ من جميع الحالات. NSIP = الالتهاب الرئوي الخلالي غير المحدد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
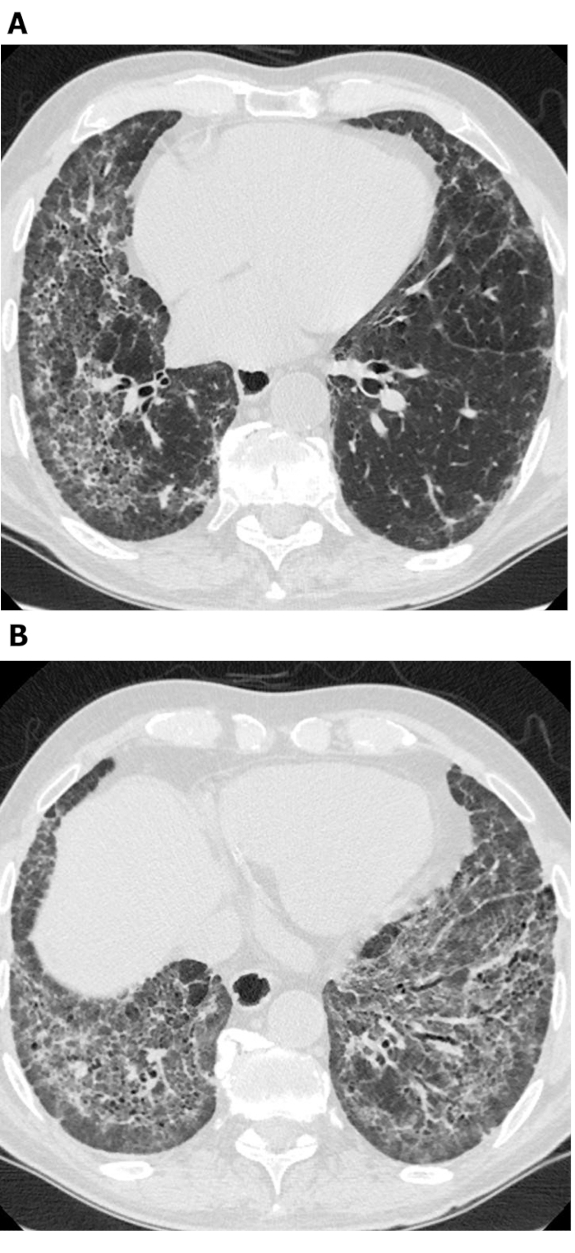
الشكل 4: التصلب الجهازي مع الجرمندفعا القصبات. Axial (A) والإكليلية(B) عالية الدقة التصوير المقطعي الصور تظهر واسعة الوسطى والسفلى في منطقة الرئة الجر العصبي السائدة. في حين أن هذا قد يكون مخطئا لالعسل, المناطق الكيسي الاتصال مع بعضها البعض وتجنيب الرئة الجنبية الفورية; هذا هو نموذجي من القصبات. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
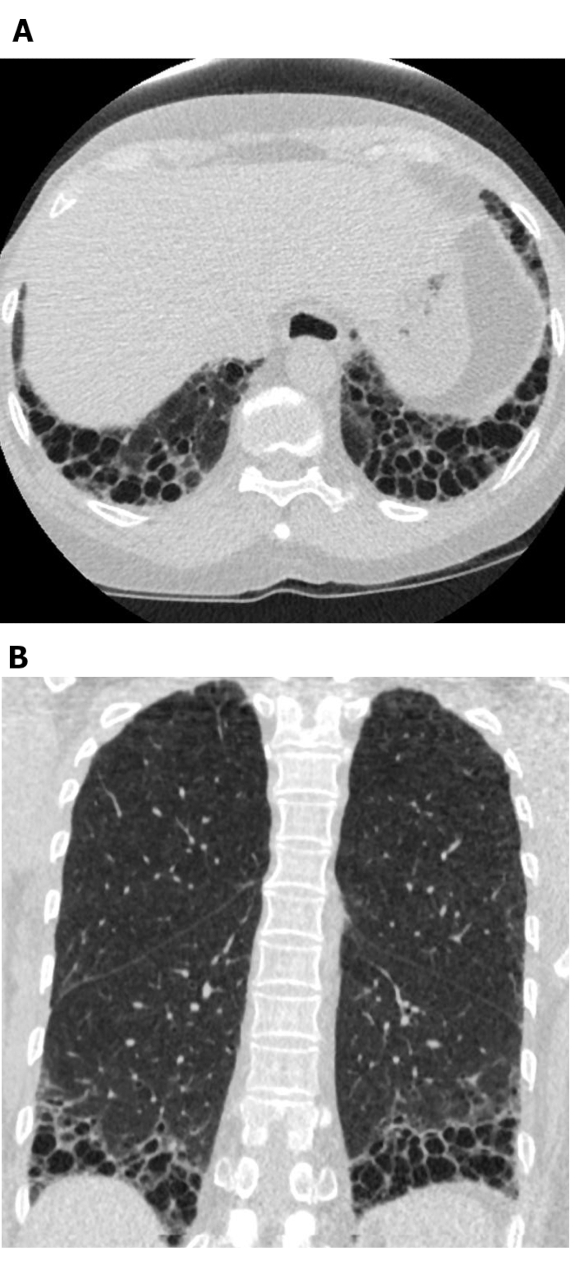
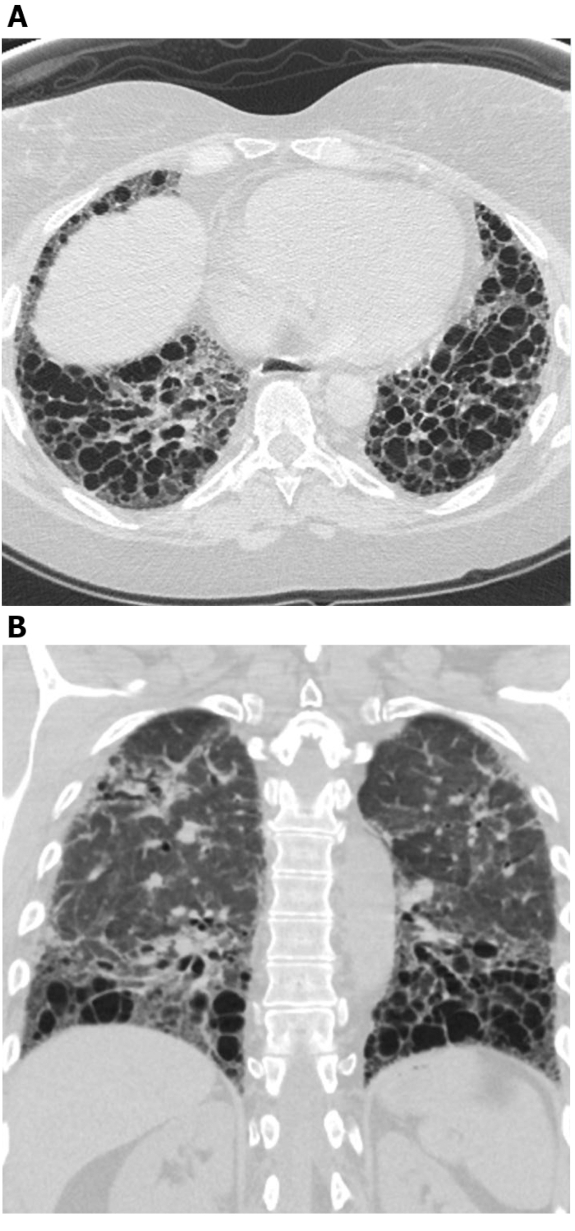
الشكل 5: التصلب الجهازي مع نمط UIP من تليف الرئة. Axial (A) والإكليلية (B) الصور المقطعية المحوسبة تظهر محيطية ولباسية المهيمنة العسل والجر القصبات تمشيا مع نمط UIP نموذجي من تليف الرئة. لاحظ المريء المتوسع (الذي يعزى إلى تصلب الجلد) والعسل "المندفع" (موحي من ILD المتعلقة بمرض الأنسجة الضامة بدلاً من التليف الرئوي مجهول السبب). UIP = الالتهاب الرئوي الخلالي المعتاد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
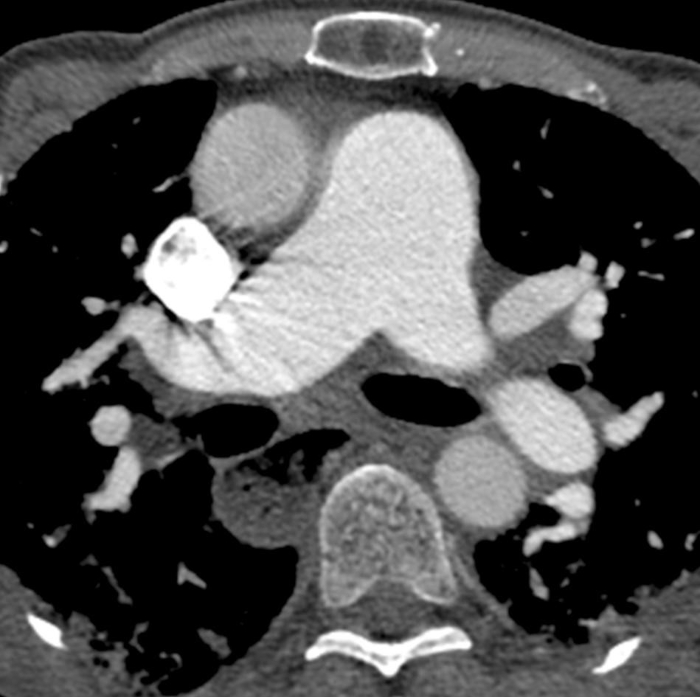
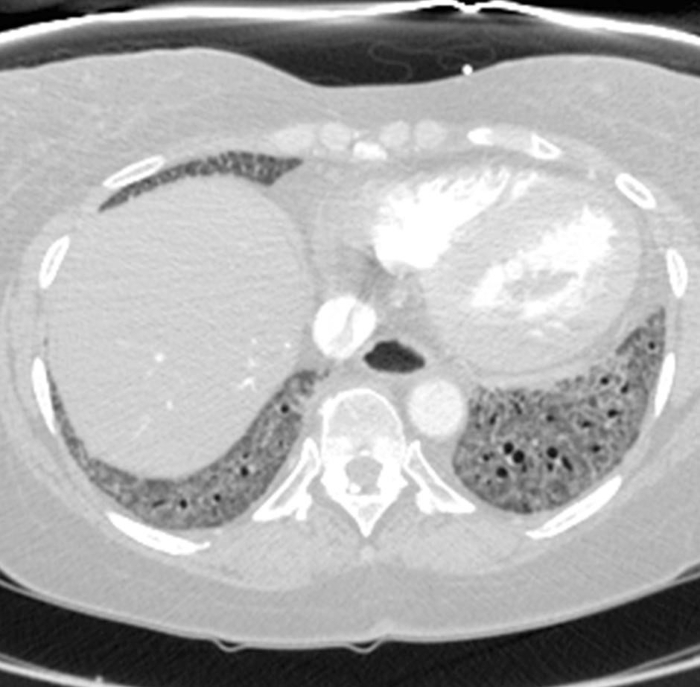
الشكل 6: التصلب الجهازي مع ارتفاع ضغط الدم الرئوي والمريء المتوسع. يظهر التصوير المقطعي المقنن للصدر المعزز على النقيض من ذلك توسعًا ملحوظًا في الجذع الرئوي، مع قياس أكبر من الشريان الأورطي الصاعد المجاور الذي يشير إلى ارتفاع ضغط الدم الرئوي الكامن. يتم توسيع المريء بشكل ملحوظ; وهذا يعزى إلى تصلب الجلد. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
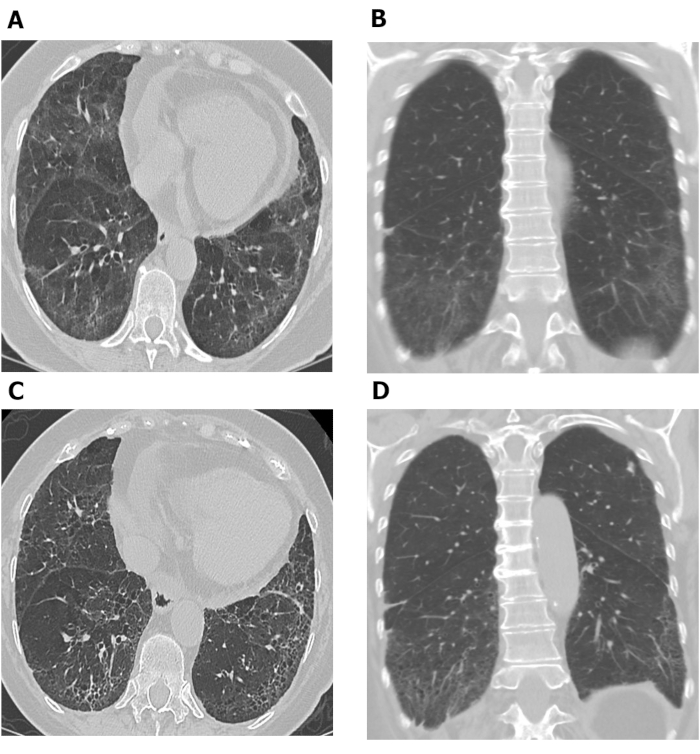
الشكل 7: صور HRCT الصدرية المسلسل تظهر تطور التليف الرئوي في المريض مع SSc-ILD. محورية (A) والاكليلية (B) تظهر الصور من الصدر HRCT basilar الغالبة عتامة الزجاج الأرضي والتشكيل مع القصبات الجر خفيفة و مابال تحت جنبي متداخلة مع الالتهاب الرئوي الخلالي غير محددة في هذا المريض مع SSc. بعد 10 سنوات، ويلاحظ زيادة الشتيكل والجر القصبات في قواعد الرئة مع انخفاض في التعتيم الزجاج الأرض على محوري (C) والإنليل(D) الصدر HRCT الصور، بما يتفق مع تفاقم طفيف من التليف الرئوي. HRCT = التصوير المقطعي عالي الدقة؛ SSc-ILD = مرض الرئة الخلالي المرتبط بالتصلب الداخلي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
في حين أن HRCT هو حاليا طريقة التصوير النهائي لتشخيص وتقييم SSc-ILD، فإنه يستخدم الإشعاع المؤين ومكلفة نسبيا. ويمكن إجراء التصويرات الإشعاعية الصدرية بدلا من ذلك، على الرغم من أن هذه لا تسهل التشخيص التفريقي إلى نفس الحد الذي يقوم به الفريق، ولا يزيل التصوير الإشعاعي للصدر العادي إمكانية وجود ILD. ولعل أفضل استخدام للفحصات الإشعاعية في الصدر هو رصد المرض التدريجي بين الفحوصات HRCT واستبعاد تعقيد المرض، مثل الالتهاب الرئوي المعدي، في وضع تفاقم حاد من الأعراض.
ومن القيود المتصورة التي تحد من هذا الـ HRCT التعرض للإشعاع. وكما هو موضح سابقاً، قد تمكن الطرق الجديدة لإجراء الأشعة المقطعية من تقليل التعرض للإشعاع31، وعلاوة على ذلك ، توفر الماسحات الضوئية المقطعية الحالية مجموعة من التقنيات المتقدمة التي توفر إمكانية في المستقبل لخفض التعرض للإشعاع لمستويات الأشعة في الصدر تقريبًا. بدلا من ذلك، يمكن استخدام طرق التصوير مثل التصوير بالرنين المغناطيسي أو الموجات فوق الصوتية الرئة لتجنب تعريض المريض للإشعاع في المستقبل32،71،72،73. ونحن نعتقد أنه في حين أن هناك اعتبارات المخاطر والفوائد المرتبطة باستخدام التصوير، فإن مزايا التصوير المقطعي في التشخيص وإدارة المرضى تفوق بكثير المخاطر المحتملة.
بيانات التصوير، وخاصة HRCT، توفر المعلومات الأكثر أهمية لتمكين تشخيص SSc-ILD. النظر في أنماط وخصائص التفحص HRCT عادة ما يكفي لتمييز SSc-ILD من أمراض الرئة الأخرى، مع الاستفادة من تجنب الحاجة لإجراء خزعة الغازية.
يقدم التقييم البصري لمسحات HRCT درجة من الذاتية وإمكانية التباين بين المراقبين. وقد تم التحقيق في الأساليب المستندة إلى الكمبيوتر من الترجمة الضوئية HRCT باعتبارها نهجا ممكنا لتحسين دقة63،74. على سبيل المثال، يمكن استخدام الأساليب الكمية لتقييم تليف الرئة أو مدى المرض لتقييم استجابة العلاج68،70،75. ومع ذلك، لا تستخدم هذه الأساليب على نطاق واسع في الممارسة السريرية اليومية في هذا الوقت.
نأمل أن تكون المعلومات الواردة في هذه المخطوطة بمثابة دليل عملي لمساعدة الأطباء في استخدام فحوصات HRCT لتشخيص SSc-ILD وتحديد التشخيص. إن الطرق المحسنة للحصول على الصور وتفسير عمليات المسح الضوئي لديها القدرة على تقليل تعرض المرضى للإشعاع وتحسين الدقة التشخيصية/التنبؤية.
يعلن جوناثان تشونغ أي تضارب محتمل في المصالح فيما يتعلق بالأبحاث الموصوفة، و/أو التأليف، و/أو نشر هذه المقالة؛ كريستوفر ووكر يعلن استلام الإتاوات من أميرس (إلسفير)؛ و ستيفن هوبز يعلن استلام الإتاوات من إلسفير و Wolters كلوير الصحة. نشر الوصول المفتوح من هذه المادة برعاية بوهرنجر إنغلهايم للمستحضرات الصيدلانية ، وشركة
يفي المؤلف (المؤلفون) بمعايير التأليف كما أوصت بذلك اللجنة الدولية لمحرري المجلات الطبية (ICMJE). ولم يتلق المؤلفان أي تعويض مباشر فيما يتعلق بتطوير الفيديو. تم تقديم الدعم للكتابة الطبية لسيناريو الفيديو من قبل ليون نيومان، دكتوراه، من GeoMed، وهي شركة أشفيلد، التي تم التعاقد معها وتمويلها من قبل شركة بوهرنجر إنغلهايم للأدوية، وشركة (BIPI). وأُعطيت المبادرة فرصة استعراض الفيديو النهائي للتأكد من دقته طبياً وعلمياً فضلاً عن اعتبارات الملكية الفكرية.
يستوفي المؤلفون معايير التأليف على النحو الذي أوصت به اللجنة الدولية لمحرري المجلات الطبية (ICMJE). ولم يتلق المؤلفان أي تعويض مباشر فيما يتعلق بوضع المخطوطة. تم تقديم المساعدة في الكتابة من قبل كين سوتور، BSC، من GeoMed، وهي شركة Ashfield، وهي جزء من UDG Healthcare plc، والتي تم التعاقد معها وتمويلها من قبل شركة بوهرنجر إنغلهايم للأدوية، وشركة (BIPI). وأتيحت الفرصة لل BIPI لمراجعة المخطوطة للتأكد من دقتها الطبية والعلمية فضلاً عن اعتبارات الملكية الفكرية.
| Name | Company | Catalog Number | Comments |
| CT scanners | Philips | NA | Multiple |
- Denton, C. P., Khanna, D. Systemic sclerosis. Lancet. 390 (10103), 1685-1699 (2017).
- Arnett, F. C., et al. Familial occurrence frequencies and relative risks for systemic sclerosis (scleroderma) in three United States cohorts. Arthritis & Rheumatism. 44 (6), 1359-1362 (2001).
- Barnes, J., Mayes, M. D. Epidemiology of systemic sclerosis: incidence, prevalence, survival, risk factors, malignancy, and environmental triggers. Current Opinion in Rheumatology. 24 (2), 165-170 (2012).
- Marie, I., Gehanno, J. F. Environmental risk factors of systemic sclerosis. Seminars in Immunopathology. 37 (5), 463-473 (2015).
- Silman, A. J. Epidemiology of scleroderma. Annals of the Rheumatic Diseases. 50, 846-853 (1991).
- Scholand, M. B., et al. Interstitial lung disease in systemic sclerosis: diagnosis and management. Rheumatology. 1, 008 (2012).
- Solomon, J. J., et al. Scleroderma lung disease. European Respiratory Review. 22 (127), 6-19 (2013).
- Walker, U. A., et al. Clinical risk assessment of organ manifestations in systemic sclerosis: a report from the EULAR Scleroderma Trials And Research group database. Annals of the Rheumatic Diseases. 66 (6), 754-763 (2007).
- Hinchcliff, M., Fischer, A., Schiopu, E., Steen, V. D., Investigators, P. Pulmonary hypertension assessment and recognition of outcomes in scleroderma (PHAROS): baseline characteristics and description of study population. The Journal of Rheumatology. 38 (10), 2172-2179 (2011).
- Giacomelli, R., et al. Interstitial lung disease in systemic sclerosis: current and future treatment. Rheumatology International. 37 (6), 853-863 (2017).
- Sanchez-Cano, D., et al. Interstitial lung disease in systemic sclerosis: data from the spanish scleroderma study group. Rheumatology International. 38 (3), 363-374 (2018).
- Silver, K. C., Silver, R. M. Management of systemic-sclerosis-associated interstitial lung disease. Rheumatic Diseases Clinics of North America. 41 (3), 439-457 (2015).
- Fischer, A., Kong, A. M., Swigris, J. J., Cole, A. L., Raimundo, K. All-cause healthcare costs and mortality in patients with systemic sclerosis with lung involvement. The Journal of Rheumatology. 45 (2), 235-241 (2018).
- Tyndall, A. J., et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Annals of the Rheumatic Diseases. 69 (10), 1809-1815 (2010).
- Herzog, E. L., et al. Review: interstitial lung disease associated with systemic sclerosis and idiopathic pulmonary fibrosis: how similar and distinct. Arthritis & Rheumatology. 66 (8), 1967-1978 (2014).
- Rubio-Rivas, M., Royo, C., Simeon, C. P., Corbella, X., Fonollosa, V. Mortality and survival in systemic sclerosis: systematic review and meta-analysis. Seminars in Arthritis and Rheumatism. 44 (2), 208-219 (2014).
- Stock, C., et al. Serum KL-6 as a marker of disease progression in SSc-ILD. European Respiratory Journal. 52, (2018).
- Winstone, T. A., et al. Predictors of mortality and progression in scleroderma-associated interstitial lung disease: a systematic review. Chest. 146 (2), 422-436 (2014).
- Khanna, D., et al. Ongoing clinical trials and treatment options for patients with systemic sclerosis-associated interstitial lung disease. Rheumatology (Oxford). 58 (4), 567-579 (2019).
- Behr, J., Furst, D. E. Pulmonary function tests. Rheumatology (Oxford). 47, 65-67 (2008).
- Hax, V., et al. Clinical algorithms for the diagnosis and prognosis of interstitial lung disease in systemic sclerosis. Seminars in Arthritis and Rheumatism. 47 (2), 228-234 (2017).
- Molberg, O., Hoffmann-Vold, A. M. Interstitial lung disease in systemic sclerosis: progress in screening and early diagnosis. Current Opinion in Rheumatology. 28 (6), 613-618 (2016).
- Raghu, G., Goldman, L., Schafer, A. I. Interstital lung disease. Goldman-Cecil Medicine. , 575-588 (2016).
- Showalter, K., et al. Performance of forced vital capacity and lung diffusion cutpoints for associated radiographic interstitial lung disease in systemic sclerosis. The Journal of Rheumatology. 45 (11), 1572-1576 (2018).
- Suliman, Y. A., et al. Brief report: pulmonary function tests: high rate of false-negative results in the early detection and screening of scleroderma-related interstitial lung disease. Arthritis & Rheumatology. 67 (12), 3256-3261 (2015).
- Roth, M. D., et al. Predicting treatment outcomes and responder subsets in scleroderma-related interstitial lung disease. Arthritis & Rheumatology. 63 (9), 2797-2808 (2011).
- Kalra, M. K., Maher, M. M., Rizzo, S., Kanarek, D., Shepard, J. A. Radiation exposure from chest CT: issues and strategies. Journal of Korean Medical Science. 19 (2), 159-166 (2004).
- Siegel, J. A., Pennington, C. W., Sacks, B., Welsh, J. S. The birth of the illegitimate linear no-threshold model: an invalid paradigm for estimating risk following low-dose radiation exposure. American Journal of Clinical Oncology. 41 (2), 173-177 (2018).
- Frauenfelder, T., et al. Screening for interstitial lung disease in systemic sclerosis: performance of high-resolution CT with limited number of slices: a prospective study. Annals of the Rheumatic Diseases. 73 (12), 2069-2073 (2014).
- Kubo, T., et al. Radiation dose reduction in chest CT: a review. American Journal of Roentgenology. 190 (2), 335-343 (2008).
- Nguyen-Kim, T. D. L., et al. The impact of slice-reduced computed tomography on histogram-based densitometry assessment of lung fibrosis in patients with systemic sclerosis. Journal of Thoracic Disease. 10 (4), 2142-2152 (2018).
- Muller, C. S., Warszawiak, D., Paiva, E. D. S., Escuissato, D. L. Pulmonary magnetic resonance imaging is similar to chest tomography in detecting inflammation in patients with systemic sclerosis. Revista Brasileira de Reumatologia English Edition. 57 (5), 419-424 (2017).
- Pinal-Fernandez, I., et al. Fast 1.5 T chest MRI for the assessment of interstitial lung disease extent secondary to systemic sclerosis. Clinical Rheumatology. 35 (9), 2339-2345 (2016).
- Sverzellati, N. Highlights of HRCT imaging in IPF. Respiratory Research. 14, 3 (2013).
- Lynch, D. A., et al. Diagnostic criteria for idiopathic pulmonary fibrosis: a Fleischner Society White Paper. The Lancet Respiratory Medicine. 6 (2), 138-153 (2018).
- Raghu, G., et al. Diagnosis of idiopathic pulmonary fibrosis. An official ATS/ERS/JRS/ALAT clinical practice guideline. American Journal of Respiratory and Critical Care Medicine. 198 (5), 44-68 (2018).
- . Exam: CT thorax for interstitial lung disease Available from: https://www.pulmonaryfibrosis.org/docs/default-source/medical-community-documents/ct-chest-for-ild-protocol.pdf?sfvrsn=0 (2019)
- Doyle, T. J., Hunninghake, G. M., Rosas, I. O. Subclinical interstitial lung disease: why you should care. American Journal of Respiratory and Critical Care Medicine. 185 (11), 1147-1153 (2012).
- Peroni, D. G., Boner, A. L. Atelectasis: mechanisms, diagnosis and management. Paediatric Respiratory Reviews. 1 (3), 274-278 (2000).
- Branley, H. M. Pulmonary fibrosis in systemic sclerosis: diagnosis and management. Respiratory Medicine CME. 3, 10-14 (2010).
- Engeler, C. E., Tashjian, J. H., Trenkner, S. W., Walsh, J. W. Ground-glass opacity of the lung parenchyma: a guide to analysis with high-resolution CT. American Journal of Roentgenology. 160 (2), 249-251 (1993).
- Goldin, J. G., et al. High-resolution CT scan findings in patients with symptomatic scleroderma-related interstitial lung disease. Chest. 134 (2), 358-367 (2008).
- Strollo, D., Goldin, J. Imaging lung disease in systemic sclerosis. Current Rheumatology Reports. 12 (2), 156-161 (2010).
- Pandey, A. K., et al. Significance of various pulmonary and extrapulmonary abnormalities on HRCT of the chest in scleroderma lung. Indian Journal of Radiology and Imaging. 23 (4), 304-307 (2013).
- Chung, J. H., et al. CT Features of the usual interstitial pneumonia pattern: differentiating connective tissue disease-associated interstitial lung disease from idiopathic pulmonary fibrosis. American Journal of Roentgenology. 210 (2), 307-313 (2018).
- Zhan, X., et al. Differentiating usual interstitial pneumonia from nonspecific interstitial pneumonia using high-resolution computed tomography: the "Straight-edge Sign". Journal of Thoracic Imaging. 33 (4), 266-270 (2018).
- Farrokh, D., Abbasi, B., Fallah-Rastegar, Y., Mirfeizi, Z. The extrapulmonary manifestations of systemic sclerosis on chest high resolution computed tomography. Tanaffos. 14 (3), 193-200 (2015).
- Salaffi, F., et al. Relationship between interstitial lung disease and oesophageal dilatation on chest high-resolution computed tomography in patients with systemic sclerosis: a cross-sectional study. La Radiologia Medica. 123 (9), 655-663 (2018).
- Vonk, M. C., et al. Oesophageal dilatation on high-resolution computed tomography scan of the lungs as a sign of scleroderma. Annals of the Rheumatic Diseases. 67 (9), 1317-1321 (2008).
- Chowaniec, M., Skoczynska, M., Sokolik, R., Wiland, P. Interstitial lung disease in systemic sclerosis: challenges in early diagnosis and management. Reumatologia. 56 (4), 249-254 (2018).
- McCall, R. K., Ravenel, J. G., Nietert, P. J., Granath, A., Silver, R. M. Relationship of main pulmonary artery diameter to pulmonary arterial pressure in scleroderma patients with and without interstitial fibrosis. Journal of Computer Assisted Tomography. 38 (2), 163-168 (2014).
- Pandey, A. K., et al. Predictors of pulmonary hypertension on high-resolution computed tomography of the chest in systemic sclerosis: a retrospective analysis. Canadian Association of Radiologists Journal. 61 (5), 291-296 (2010).
- Raymond, T. E., Khabbaza, J. E., Yadav, R., Tonelli, A. R. Significance of main pulmonary artery dilation on imaging studies. Annals of the American Thoracic Society. 11 (10), 1623-1632 (2014).
- Colaci, M., et al. Lung cancer in scleroderma: results from an Italian rheumatologic center and review of the literature. Autoimmunity Reviews. 12 (3), 374-379 (2013).
- Distler, O., et al. Design of a randomised, placebo-controlled clinical trial of nintedanib in patients with systemic sclerosis-associated interstitial lung disease (SENSCIS). Clinical and Experimental Rheumatology. 35 (4), 75-81 (2017).
- Desai, S. R., et al. CT features of lung disease in patients with systemic sclerosis: comparison with idiopathic pulmonary fibrosis and nonspecific interstitial pneumonia. Radiology. 232 (2), 560-567 (2004).
- Mira-Avendano, I., et al. Interstitial lung disease and other pulmonary manifestations in connective tissue diseases. Mayo Clinic Proceedings. 94 (2), 309-325 (2019).
- Walkoff, L., White, D. B., Chung, J. H., Asante, D., Cox, C. W. The four corners sign: a specific imaging feature in differentiating systemic sclerosis-related interstitial lung disease from idiopathic pulmonary fibrosis. Journal of Thoracic Imaging. 33 (3), 197-203 (2018).
- Kotnur, M. R., Suresh, P., Reddy, V. S., Sharma, T., Salim, N. A. Systemic sclerosis with multiple pulmonary manifestations. Journal of Clinical & Diagnostic Research. 10 (6), 16-17 (2016).
- Goh, N. S., et al. Interstitial lung disease in systemic sclerosis: a simple staging system. American Journal of Respiratory and Critical Care Medicine. 177 (11), 1248-1254 (2008).
- Takei, R., et al. Radiographic fibrosis score predicts survival in systemic sclerosis-associated interstitial lung disease. Respirology. 23 (4), 385-391 (2018).
- Bakker, M. E., et al. Lung density and pulmonary artery diameter are predictors of pulmonary hypertension in systemic sclerosis. Journal of Thoracic Imaging. 32 (6), 391-397 (2017).
- Khanna, D., et al. Predictors of lung function decline in scleroderma-related interstitial lung disease based on high-resolution computed tomography: implications for cohort enrichment in systemic sclerosis-associated interstitial lung disease trials. Arthritis Research & Therapy. 17, 372 (2015).
- Ariani, A., et al. Quantitative chest computed tomography is associated with two prediction models of mortality in interstitial lung disease related to systemic sclerosis. Rheumatology (Oxford). 56 (6), 922-927 (2017).
- Goldin, J., et al. Treatment of scleroderma-interstitial lung disease with cyclophosphamide is associated with less progressive fibrosis on serial thoracic high-resolution CT scan than placebo: findings from the scleroderma lung study. Chest. 136 (5), 1333-1340 (2009).
- Tashkin, D. P., et al. Mycophenolate mofetil versus oral cyclophosphamide in scleroderma-related interstitial lung disease (SLS II): a randomised controlled, double-blind, parallel group trial. The Lancet Respiratory Medicine. 4 (9), 708-719 (2016).
- Distler, O., et al. Nintedanib for Systemic Sclerosis-Associated Interstitial Lung Disease. New England Journal of Medicine. 380, 2518-2528 (2019).
- Cappelli, S., et al. Interstitial lung disease in systemic sclerosis: where do we stand. European Respiratory Review. 24 (137), 411-419 (2015).
- Goldin, J. G., et al. Longitudinal changes in quantitative interstitial lung disease on CT after immunosuppression in the Scleroderma Lung Study II. Annals of the American Thoracic Society. 5 (11), 1286-1295 (2018).
- Wangkaew, S., Euathrongchit, J., Wattanawittawas, P., Kasitanon, N. Correlation of delta high-resolution computed tomography (HRCT) score with delta clinical variables in early systemic sclerosis (SSc) patients. Quantitative Imaging in Medicine and Surgery. 6 (4), 381-390 (2016).
- Kim, H. J., et al. Transitions to different patterns of interstitial lung disease in scleroderma with and without treatment. Annals of the Rheumatic Diseases. 75 (7), 1367-1371 (2016).
- Tardella, M., et al. Ultrasound B-lines in the evaluation of interstitial lung disease in patients with systemic sclerosis: cut-off point definition for the presence of significant pulmonary fibrosis. Medicine (Baltimore). 97 (18), 0566 (2018).
- Hassan, R. I., et al. Lung ultrasound as a screening method for interstitial lung disease in patients with systemic sclerosis. Journal of Clinical Rheumatology. , (2018).
- Wang, Y., Gargani, L., Barskova, T., Furst, D. E., Cerinic, M. M. Usefulness of lung ultrasound B-lines in connective tissue disease-associated interstitial lung disease: a literature review. Arthritis Research & Therapy. 19 (1), 206 (2017).
- Ariani, A., et al. Quantitative CT indexes are significantly associated with exercise oxygen desaturation in interstitial lung disease related to systemic sclerosis. The Clinical Respiratory Journal. 11 (6), 983-989 (2017).
- Kim, H. J., et al. Quantitative texture-based assessment of one-year changes in fibrotic reticular patterns on HRCT in scleroderma lung disease treated with oral cyclophosphamide. European Radiology. 21 (12), 2455-2465 (2011).
Tags
ABOUT JoVE
Copyright © 2024 MyJoVE Corporation. All rights reserved